Раздел недели: Скоропись физического, математического, химического и, в целом, научного текста, математические обозначения. Математический, Физический алфавит, Научный алфавит. | |||||||
| Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Физический справочник / / Растворимость. Поделиться:
| ||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.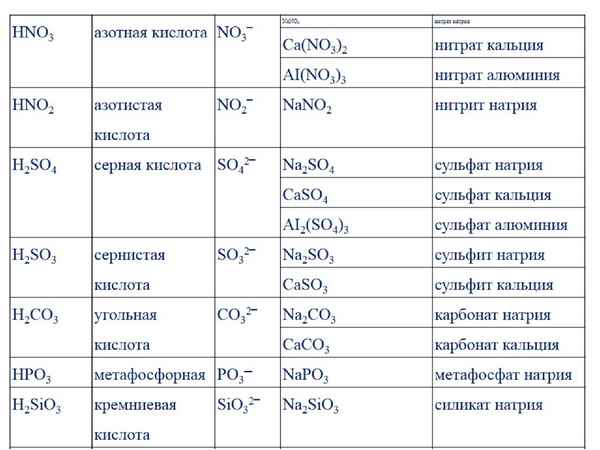 Free xml sitemap generator Free xml sitemap generator | ||||||
— Как рассчитать молярность раствора Na2CO3?
спросил
Изменено 3 года, 1 месяц назад
Просмотрено 105 тысяч раз
$\begingroup$
Мой учитель не очень хорошо помогает мне решить эту задачу. Я продолжаю получать ответ, но я не знаю, почему я получаю его. Не могли бы вы помочь мне понять эту проблему и почему вы должны сделать этот конкретный шаг?
Образец $\pu{1,00 г}$ $\ce{Na2CO3.10h3O}$ растворяли в $\pu{20,0 мл}$ дистиллированной воды. Добавляли дополнительную воду, чтобы получить $\pu{250 мл}$ раствора. Какова молярная концентрация $\ce{Na2CO3}$?
Вот что я сделал, получил ответ и не понимаю, зачем мне это нужно:
\begin{align}
\frac{\pu{1 г}~\ce{Na2CO3.
$\pu{0.013986 M}$ — правильный ответ, но я не знаю почему и не понимаю вопроса. Если бы вам нужно было решить задачу, не могли бы вы объяснить, почему вы сделали то, что сделали, чтобы получить ответ.
- стехиометрия
- концентрация
$\endgroup$
3
$\begingroup$
Вопрос заключается в молярной концентрации данного вещества после разбавления с помощью приведенных значений. Первым шагом ответа является перевод заданного веса $\ce{Na2CO3.10h3O}$ в количество вещества. Для этого у нас есть формула как
\начать{выравнивать}
\text{количество вещества} &= \frac{\text{масса вещества}}{\text{молекулярная масса вещества}}\\
\text{количество вещества} &= \frac{
\pu{1 г}~\ce{Na2CO3.
Вторым шагом является преобразование количества вещества в молярность. Как, \начать{выравнивать} \text{молярность} &= \frac{\text{количество вещества}}{\text{объем в л}}\\ \text{молярность} &= \frac{\pu{0,003447 моль}}{\pu{0,020 л}} = \pu{0,174825 M}\\ \end{align}
Второй шаг делается для того, чтобы узнать молярную концентрацию вещества, так как в вопросе нас просили дать ответ в молярности после разбавления.
После этого данный раствор разбавляют до $\pu{250 мл}$, поэтому приходится использовать формулу разбавления
$$\begin{многострочный}
\text{начальная концентрация}\times \text{начальный объем раствора} =\\
\text{конечная концентрация}\times \text{конечный объем раствора}.
\end{многострочный}$$
Итак, мы предполагаем, что конечная концентрация раствора равна $x$, и у нас есть значения для других сущностей. \начать{выравнивать}
(\ pu {0,174825 M}) (\ pu {0,020 л}) &= (\ pu {0,250 л}) (x) \\
х &= \pu{0,013986 М}\\
\end{выравнивание}
Этот последний шаг выполняется потому, что после разбавления меняется молярность раствора, а не количество вещества, как я говорил ранее. Таким образом, мы приравниваем уравнение как $$\text{начальное количество вещества} = \text{конечное количество вещества}.$$
И окончательный ответ: $\pu{0,013986 M}$.
\начать{выравнивать}
(\ pu {0,174825 M}) (\ pu {0,020 л}) &= (\ pu {0,250 л}) (x) \\
х &= \pu{0,013986 М}\\
\end{выравнивание}
Этот последний шаг выполняется потому, что после разбавления меняется молярность раствора, а не количество вещества, как я говорил ранее. Таким образом, мы приравниваем уравнение как $$\text{начальное количество вещества} = \text{конечное количество вещества}.$$
И окончательный ответ: $\pu{0,013986 M}$.
$\endgroup$
4
$\begingroup$
В первой части логичнее писать кроты явно. Первым шагом является определение количества молей карбоната натрия в исходной пробе стоимостью 1,00\\mathrm g$:
$$\frac{1.00\ \mathrm{g}}{286\ \mathrm{g/mol}} = 0.003447\ \mathrm{mol}$$
Второй шаг — определение концентрации первых $20.0\ \mathrm{мл}$ раствор, т.е. какая концентрация получается при растворении $0,00345\ \mathrm{моль}$ карбоната натрия, рассчитанного выше. $$\frac{0,003447\\mathrm{mol}}{0,0200\\mathrm{L}} = 0,174825\\mathrm{M}$$
$$\frac{0,003447\\mathrm{mol}}{0,0200\\mathrm{L}} = 0,174825\\mathrm{M}$$
Третья часть — это просто разведение — какая концентрация получается, когда мы разбавляем первую Решение $20.0\ \mathrm{mL}$ для $250\ \mathrm{mL}$: $$c_2 = \frac{c_1V_1}{V_2}$$ $$c_2 = \frac{(0,174825\\mathrm{M})(0,020\\mathrm{L})}{(0,250\ \mathrm{L})} = 0,0140\\mathrm{M}$$
$\endgroup$
3
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Как рассчитать молярную массу Na2Co3
Помощь в домашнем задании: Как рассчитать молярную массу Na2Co3
У Мэри был маленький ягненок
Его шерсть была грязно-серой.
Мэри пришлось вычистить его дочиста.
На носок на день рождения мамы.
Она отнесла его к автомату.
А вот задумался что добавить.
Карбонат натрия поможет.
Но добавлять слишком много было плохо.
Итак, Мэри должна была вычислить
Сколько атомных граммов использовать.
Для этого она вычислила свою молярную массу
И начала глубоко размышлять.
Прежде чем мы начнем или если вам понадобится дополнительная помощь, зайдите на Studygate, чтобы нанять онлайн-репетитора по химии. Давайте научимся здесь находить молярную массу , особенно на примере молярной массы Na2Co3. Молярная масса определяется как «грамм-формула-масса». Другими словами, молярная масса — это то, сколько весит один моль вещества в пересчете на «атомную массу». Моль — это число: 6,02×10 23 . Точно так же, как дюжина равна 12, один моль равен 6020000000000000000000000. Ученые используют моли в качестве основного числа, чтобы сравнивать группы атомов. Точно так же, как вы можете сравнить один атом углерода с одним атомом гелия, вы можете сравнить один моль углерода с одним молем гелия. Это интересно, потому что химия влияет на то, кем мы являемся как люди, и даже влияет на состав продуктов, которые мы едим.
Молярная масса определяется как «грамм-формула-масса». Другими словами, молярная масса — это то, сколько весит один моль вещества в пересчете на «атомную массу». Моль — это число: 6,02×10 23 . Точно так же, как дюжина равна 12, один моль равен 6020000000000000000000000. Ученые используют моли в качестве основного числа, чтобы сравнивать группы атомов. Точно так же, как вы можете сравнить один атом углерода с одним атомом гелия, вы можете сравнить один моль углерода с одним молем гелия. Это интересно, потому что химия влияет на то, кем мы являемся как люди, и даже влияет на состав продуктов, которые мы едим.
*для сокращения слова «моль» просто сократите его до «моль».
Чем больше атом, тем тяжелее он весит. Это имеет смысл, верно? Ну, периодическая таблица организована от меньшего к большему, в которой количество протонов и нейтронов в значительной степени определяет вес (у атомов есть электроны, но они настолько малы, что «ничего не весят»).
Например, в верхнем левом углу у Водорода один протон, один электрон и нет нейтронов. Так что его атомный номер Один (на один протон) и его атомный вес равен Один (на один протон и один нейтрон)
Один моль атомов водорода будет его атомным весом. Один моль атомов водорода весит Один грамм/моль.
Следующим является гелий, который имеет два протона и два нейтрона. Это означает, что атомный номер равен Два (для два протона), но атомный вес атома равен 9.0128 ЧЕТЫРЕ ( два протона и два нейтрона).
Один моль атомов гелия весит Четыре грамм/моль.
**Вот небольшой совет: в наиболее распространенных элементах в верхней части таблицы протоны и нейтроны атома «в идеале» одинаковы.

 Растворимость газов и твердых веществ / / Растворимость как концентрация насыщенного раствора (молярная) солей Na2SO4, Na2CO3, KCl, NaCl, (Nh5)2SO4, K2CO3, NaNO3, KNO3 и щелочи KOH в зависимости от температуры 0-150°C — диаграмма
Растворимость газов и твердых веществ / / Растворимость как концентрация насыщенного раствора (молярная) солей Na2SO4, Na2CO3, KCl, NaCl, (Nh5)2SO4, K2CO3, NaNO3, KNO3 и щелочи KOH в зависимости от температуры 0-150°C — диаграмма Введите свой запрос:
Введите свой запрос: