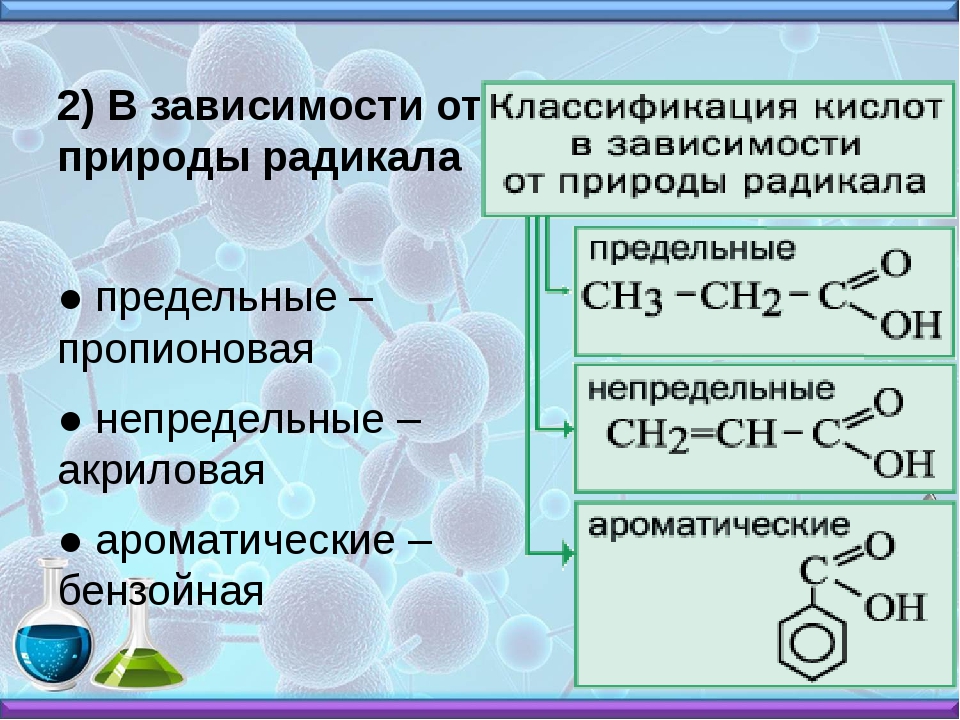
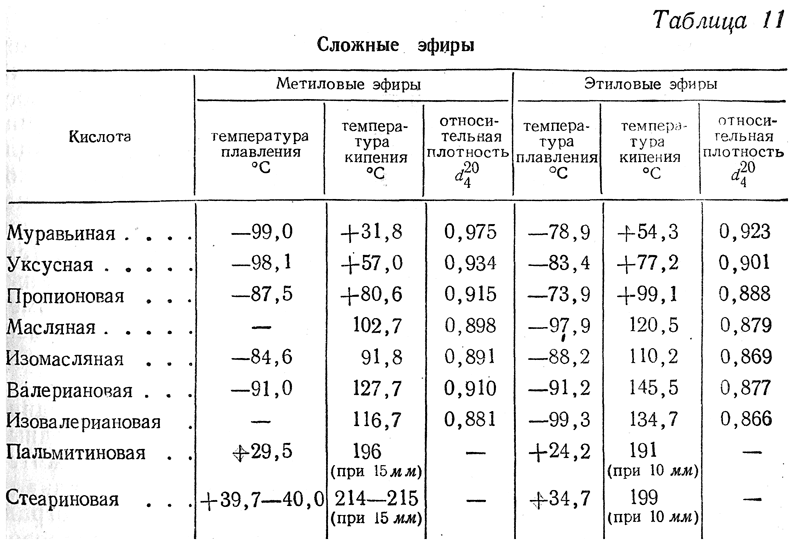
Пропионовая кислота, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ICSC 0558 — ПРОПИОНОВЫЙ АНГИДРИД
ICSC 0558 — ПРОПИОНОВЫЙ АНГИДРИД« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ПРОПИОНОВЫЙ АНГИДРИД | ICSC: 0558 (Март 1996) |
| CAS #: 123-62-6 |
| UN #: 2496 |
| EINECS #: 204-638-2 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. При температуре превышающей 63°C могут образовываться взрывоопасные смеси паров с воздухом. При температуре превышающей 63°C могут образовываться взрывоопасные смеси паров с воздухом. |
НЕ использовать открытый огонь. При температуре свыше 63°C применять замкнутую систему и вентиляцию. | Использовать распыленную воду, порошок, спиртоустойчивую пену, двуокись углерода. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЯ ТУМАНА! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Кашель. Ощущения жжения. Сбивчивое дыхание. Симптомы могут проявляться позже. См. примечания. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Может потребоваться искусственное дыхание. Обратиться за медицинской помощью. |
| Кожа | Боль. Ожоги кожи. Ожоги кожи. |
Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. Сильные ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. Боль в горле. Боль в животе. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Дать выпить один или два стакана воды. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: костюм химической защиты и защитная маска. Собрать подтекающую жидкость в герметичные контейнеры. Удалить оставшуюся жидкость при помощи сухого песка или инертного абсорбента. Затем хранить и утилизировать в соответствии с местными правилами. Собрать подтекающую жидкость в герметичные контейнеры. Удалить оставшуюся жидкость при помощи сухого песка или инертного абсорбента. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Хранить сухим. Вентиляция вдоль пола. Отдельно от оснований, окислителей и пищевых продуктов и кормов. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
| ПРОПИОНОВЫЙ АНГИДРИД | ICSC: 0558 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C6H10O3 / (CH3CH2CO)2O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: C; R: 34; S: (1/2)-26-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
3-(2-гидроксифенил)пропионовая кислота | ≥99% (ВЭЖХ) | Селлек
Выберите страну или регион
- Соединенные Штаты
- Германия
- Китай
- Япония
- Соединенное Королевство
- Франция
- Корея
- Нидерланды
- Канада
- Италия
- Австралия
- Австрия
- Бельгия
- Канада
- Китай
- Чешская Республика
- Дания
- Финляндия
- Франция
- Германия
- Греция
- Гонконг
- Венгрия
- Исландия
- Индия
- Ирландия
- Израиль
- Италия
- Япония
- Корея
- Люксембург
- Малайзия
- Нидерланды
- Новая Зеландия
- Норвегия
- Польша
- Катар
- Румыния
- Саудовская Аравия
- Сингапур
- Испания
- Швеция
- Швейцария
- Тайвань
- Турция
- Соединенное Королевство
- Соединенные Штаты
- Другие страны
Дом Другие Другое химическое 3-(2-Гидроксифенил)пропионовая кислота
Каталожный номер S3339 Синонимы : мелилотовая кислота, мелилотат, 2-гидроксибензолпропановая кислота.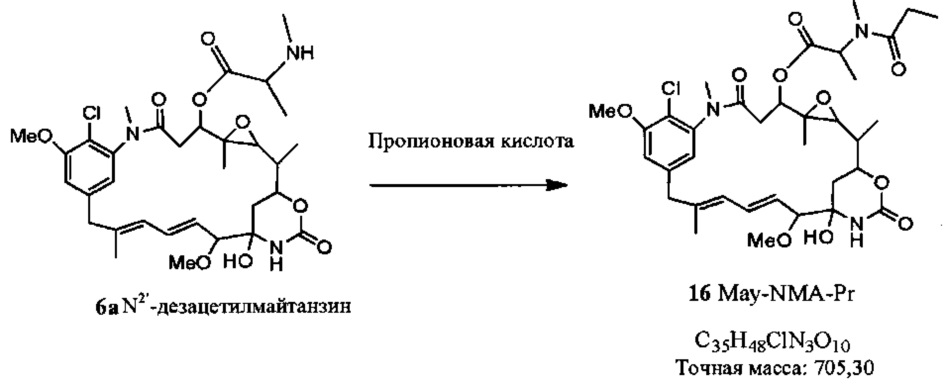
Только для исследовательских целей.
3-(2-гидроксифенил)пропановая кислота (мелилотовая кислота, мелилотат, 2-гидроксибензолпропановая кислота) является эндогенным метаболитом.
CAS № 495-78-3
Чистота и контроль качества
Библиотеки родственных соединений
Прочие родственные продукты
Биологическая активность
| Описание | 3-(2-гидроксифенил)пропановая кислота (мелилотовая кислота, мелилотат, 2-гидроксибензолпропановая кислота) является эндогенным метаболитом. |
|---|
Протокол (из ссылки)
Растворимость (25°C)
In vitro | ||
Химическая информация
| Молекулярный вес | 166,17 | ||
|---|---|---|---|
| Формула | С 9 Н 10 О 3 | ||
| Номер CAS | 495-78-3 | ||
| Хранение | 3 года | -20°С | порошок |
| 2 года | -80°С | в растворителе | |
Калькулятор составов in vivo (прозрачный раствор)
Шаг 1: Введите информацию ниже (Рекомендуется: дополнительное животное с поправкой на потерю во время эксперимента)
Дозировка: мг/кг Средний вес животных: грамм Объем дозирования на животное: мкл Количество животных:
Шаг 2: Введите рецептуру in vivo (Это только калькулятор, а не рецептура. Пожалуйста, сначала свяжитесь с нами, если в разделе растворимости нет состава in vivo.)
Пожалуйста, сначала свяжитесь с нами, если в разделе растворимости нет состава in vivo.)
% ДМСО + % ПЭГ300Кукурузное масло+ % Твин 80 + % ddH 2 O
%ДМСО+ % Кукурузное маслоPEG300
Результаты расчета:
Рабочая концентрация: мг/мл;
Метод приготовления эталонной жидкости с ДМСО: мг препарата, предварительно растворенного в мкл ДМСО (Концентрация эталонной жидкости, мг/мл. Пожалуйста, сначала свяжитесь с нами, если концентрация превышает растворимость в ДМСО для партии лекарственного средства.)
Метод приготовления состава in vivo: Возьмите мкл эталонной жидкости ДМСО, затем добавьте мкл ПЭГ300, перемешайте и осветлите, затем добавьте мкл Tween 80, перемешайте и осветлите, затем добавьте мкл ddH 2 O, перемешайте и осветлите.
Метод приготовления состава in vivo: возьмите мкл эталонной жидкости ДМСО, затем добавьте мкл кукурузного масла, перемешайте и осветлите.
Примечание: 1. Перед добавлением следующего растворителя убедитесь, что жидкость прозрачная.
2. Добавляйте растворители по порядку. Вы должны убедиться, что раствор, полученный при предыдущем добавлении, является прозрачным раствором, прежде чем приступать к добавлению следующего растворителя. Физические методы такие
в виде вортекса, ультразвука или горячей водяной бани можно использовать для облегчения растворения.
Калькулятор молярности
| Масса | Концентрация | Том | Молекулярный вес |
|---|---|---|---|
| пгнгмкгмггкг= | фМпМнМмМмММ× | нЛмкЛмЛЛ× |
Калькулятор разбавления Калькулятор молекулярной массы
Техническая поддержка
Ответы на вопросы, которые могут у вас возникнуть, можно найти в инструкциях по обращению с ингибитором. Темы включают в себя приготовление маточных растворов, хранение ингибиторов и вопросы, требующие особого внимания при проведении клеточных анализов и экспериментов на животных.
Инструкции по обращению
Тел. : +1-832-582-8158 Добавочный: 3
: +1-832-582-8158 Добавочный: 3
Если у вас есть другие вопросы, пожалуйста, оставьте сообщение.
* Указывает обязательное поле
* Имя Пожалуйста, введите ваше имя.
* Электронная почта Пожалуйста, введите адрес электронной почты. Пожалуйста, введите действительный адрес электронной почты.
Телефон
* Комментарии: Пожалуйста, напишите нам что-нибудь.
Теги: купить 3-(2-Гидроксифенил)пропионовая кислота | поставщик 3-(2-гидроксифенил)пропионовой кислоты | купить 3-(2-гидроксифенил)пропионовая кислота | Стоимость 3-(2-гидроксифенил)пропионовой кислоты | производитель 3-(2-гидроксифенил)пропионовой кислоты | заказать 3-(2-Гидроксифенил)пропионовая кислота | Распределитель 3-(2-гидроксифенил)пропионовой кислоты


 3-9.5
3-9.5
 д.
д. В течение следующих нескольких лет другие химики производили пропионовую кислоту различными способами, но никто из них не осознавал, что они производят то же самое вещество. В 1847 году французский химик Жан-Батист Дюма установил, что все кислоты представляют собой одно и то же соединение, которое он назвал пропионовой кислотой, от греческих слов protos = «первый» и pion = «жир», потому что это было наименьший H(CH 2 ) n СООН-кислота, которая проявляет свойства других жирных кислот, например образует маслянистый слой при высаливании из воды и имеет мыльную калиевую соль.
В течение следующих нескольких лет другие химики производили пропионовую кислоту различными способами, но никто из них не осознавал, что они производят то же самое вещество. В 1847 году французский химик Жан-Батист Дюма установил, что все кислоты представляют собой одно и то же соединение, которое он назвал пропионовой кислотой, от греческих слов protos = «первый» и pion = «жир», потому что это было наименьший H(CH 2 ) n СООН-кислота, которая проявляет свойства других жирных кислот, например образует маслянистый слой при высаливании из воды и имеет мыльную калиевую соль. Он также подвергается этому соединению в жидком состоянии.
Он также подвергается этому соединению в жидком состоянии. В настоящее время крупнейшим производителем в мире является BASF с производственной мощностью около 80 тыс. тонн в год.
В настоящее время крупнейшим производителем в мире является BASF с производственной мощностью около 80 тыс. тонн в год. В качестве корма для животных он используется либо непосредственно, либо в виде аммонийной соли. В пищевых продуктах человека, особенно в хлебе и другой выпечке, он используется в виде натриевой или кальциевой соли. Аналогичное использование встречается в некоторых старых противогрибковых присыпках для ног.
В качестве корма для животных он используется либо непосредственно, либо в виде аммонийной соли. В пищевых продуктах человека, особенно в хлебе и другой выпечке, он используется в виде натриевой или кальциевой соли. Аналогичное использование встречается в некоторых старых противогрибковых присыпках для ног. Никаких токсических, мутагенных, канцерогенных или репродуктивных эффектов никогда не наблюдалось. В организме пропионовая кислота легко метаболизируется, поэтому не подвергается биоаккумуляции.
Никаких токсических, мутагенных, канцерогенных или репродуктивных эффектов никогда не наблюдалось. В организме пропионовая кислота легко метаболизируется, поэтому не подвергается биоаккумуляции.