Государственное бюджетное общеобразовательное учреждение Ненецкого автономного округа «Средняя школа № 1 г. Нарьян-Мара с углубленным изучением отдельных предметов».
Министерство просвещения Российской Федерации | Департамент образования, культуры и спорта Ненецкого автономного округа | Ненецкий автономный округ, г. Нарьян-Мар
Календарный учебный график образовательного процесса на 2021-2022 учебный год
Информационная памятка для обучающихся для размещения на официальных интернет-ресурсах
Памятка для родителей об информационной безопасности детей
Приём в 1 класс
Социально-психологическое тестирование
Консультационный центр НАО «Современная школа»
Расписание
Образцы бланков
Мы рады приветствовать вас на официальном сайте школы № 1 города Нарьян-Мара.
Наш сайт – одно из связующих звеньев с учениками, родителями, выпускниками и, конечно, с коллегами из Ненецкого округа и других регионов страны.
История первой школы – это славное прошлое, интересное настоящее и перспективное будущее.
Это богатейший опыт педагогической, воспитательной работы, талантливые педагоги и успешные выпускники, которые сегодня работают во всех уголках нашей необъятной страны и за рубежом.
Первая школа – это атмосфера творчества, доброты и сотрудничества педагогов, родителей и учеников.
Мы стараемся видеть ЛИЧНОСТЬ в каждом школьнике и максимально раскрывать его способности.
Мы всегда готовы делиться с коллегами своим опытом и педагогическими находками.
Надеюсь, Вы сможете найти на сайте полезную информацию, узнать как можно больше о школе и стать нашими постоянными гостями и собеседниками.
С уважением,
Юрий Викторович Канев,
директор школы
Детский телефон доверия
ДЕТСКИЙ ТЕЛЕФОН ДОВЕРИЯ 8-800-2000-122 СОЗДАН ДЛЯ ОКАЗАНИЯ ПСИХОЛОГИЧЕСКОЙ ПОМОЩИ ДЕТЯМ, ПОДРОСТКАМ И ИХ РОДИТЕЛЯМ В ТРУДНЫХ ЖИЗНЕННЫХ СИТУАЦИЯХ. ЗВОНОК БЕСПЛАТНЫЙ И АНОНИМНЫЙ.
ЗВОНОК БЕСПЛАТНЫЙ И АНОНИМНЫЙ.
Порой дети и подростки, находясь в трудной жизненной ситуации, не знают к кому обраться за реальной помощью, или к тому, кто готов их выслушать. По инициативе Фонда поддержки детей 1 сентября 2010 года заработал телефон службы экстренной психологической помощи для детей и подростков: 8-800-2000-122. Звонок бесплатный.
Подробнее о принципах работы единого федерального номера телефона доверия можно узнать на официальном сайте https://telefon-doveria.ru/.
НЕ СТОИТ ЗАБЫВАТЬ! Телефон доверия работает ради того, чтобы дети, их родители да и просто люди, неравнодушные к беде живущего рядом ребенка, могли вовремя получить помощь профессионального психолога и понять, что они не одни.
Уважаемые участники образовательного процесса нашей школы, а также наши выпускники! Вы можете принять участие в независимой оценке качества оказываемых школой услуг. Для этого КЛИКНИТЕ по баннеру выше или по данной ссылке https://bus.gov. ru/info-card/455746, зайдите, оставьте свой отзыв или пожелание! Будем рады ВАШЕЙ АКТИВНОСТИ!
ru/info-card/455746, зайдите, оставьте свой отзыв или пожелание! Будем рады ВАШЕЙ АКТИВНОСТИ!
Мониторинг проводится по инициативе Министерства просвещения России.
Более подробно о независимой оценке качества оказываемых школой услуг можно узнать в разделе сайта «НЕЗАВИСИМАЯ ОЦЕНКА КАЧЕСТВА ОКАЗАНИЯ УСЛУГ».
Последние документы
Осуществляется загрузка…
Документ
Проект «Билет в будущее» открывает новый учебный год
Вот уже четвёртый год ведущий в России профориентационный проект «Билет в будущее» помогает школьникам выбрать путь в жизни, найти профессию. Приоритеты профориентации в России сегодня закреплены Президентом РФ на государственном уровне. Федеральным оператором проекта является Фонд Гуманитарных Проектов.
Подробнее…
Общероссийское исследование качества получения государственных и социальных услуг
Просим учителей, педагогов и воспитателей принять участие в опросе:
Подробнее.

Форум «Патриотическое воспитание»
Наш учитель истории, Калмыкова Наталья Сергеевна, приглашена к участию на форум «Патриотическое воспитание». Вот, о чём она рассказала:
Подробнее…
Отличники учебного труда
Михаил Пластинин, ученик 9 «Б» класса, Чупрова Анастасия, ученица 10 «А» класса, стали лауреатами ежегодной именной премии ООО «ЛУКОЙЛ-Коми».
Сегодня в зале официальных мероприятий ДК «Арктика» им вручены дипломы и сертификаты.
Подробнее…
Об организации питания учащихся на 2022-2023 учебный год
В связи с внесением изменений в закон Ненецкого автономного округа от 16 апреля 2014 года № 12-оз «Об образовании в Ненецком автономном округе (в редакции закона округа от 31 октября 2016 года № 258-оз) законом округа от 06 декабря 2016 года №279-оз, и внесением изменений в Положение об организации питания в государственных организациях Ненецкого автономного округа, осуществляющих образовательную деятельность от 09.
04.2019 года:
Подробнее…
Объявление
Уважаемые родители будущих первоклассников!
Мы знаем, как волнуетесь вы перед длительным путешествием по стране знаний! Мы поможем вам настроиться на позитивную встречу со школой!
Приглашаем вас на родительское собрание, которое состоится 29 августа. в 18.00, в актовом зале школы.
Достойная награда
Герои уходящей недели нашей школы — выпускники, награждённые медалью «За особые успехи в учении» Сомов Артём и Калугина Лена. Это целеустремлённые, трудолюбивые представители современной молодёжи. Спасибо ребятам за труд!
Подробнее…
Безопасное лето в НАО (видео)
#БезопасноелетовНАО
Подробнее.
 ..
..
С ДНЁМ ПОБЕДЫ!
С днём ПОБЕДЫ в Великой Отечественной войне, дорогие друзья! Наши прадеды и деды совершили беспримерный подвиг, защитив мир от фашизма 77 лет назад!
Подробнее…
ЧИТАЕМ СТИХИ
Литературная гостиная собрала тех, кто любит стихи. Ребята читали о суровых годах Великой Отечественной войне, детях войны, о ПОБЕДЕ.
Подробнее…
ПАРТА ГЕРОЯ
Наша школа — участник общероссийского проекта партии Единая Россия «Парта ГЕРОЯ». 6 мая состоялось открытие. Участниками стали ребята, педагоги-ветераны, учителя.
Подробнее…
Будем помнить – будем жить!
Эти слова прозвучали на всех мероприятиях, посвящённых 77 годовщине Победы в Великой Отечественной войне.
 6 мая вся школа вышла по особому графику на торжественные линейки к Обелиску ПОБЕДЫ и к памятнику экипажу буксирного катера «Комсомолец».
6 мая вся школа вышла по особому графику на торжественные линейки к Обелиску ПОБЕДЫ и к памятнику экипажу буксирного катера «Комсомолец».Подробнее…
Нас собрал юбилей!
2022 год – год 90-летия в школе. Все мероприятия, которые проходят в этом году, посвящены этой дате. 22 апреля состоялось юбилейное торжество «Нас собрал юбилей». Это была не просто встреча, а удивительный полёт на рейсе 2022 90/ 1 авиакомпании «Юбилейные авиалинии».
Подробнее…
Юбилей школы 90-лет
Подробнее…
Приглашаем
Дорогие друзья! 2022 год – год юбилея школы № 1 города Нарьян-Мара!
22 апреля выпускников школы приглашаем на юбилейное торжество. Наша встреча будет проходить во Дворце культуры «Арктика».
Подробнее… Ждём! Регистрация – 16.30-16.50. Начало вечера в 17.00
Ждём! Регистрация – 16.30-16.50. Начало вечера в 17.00Классные встречи РДШ
#рдшнао #российскоедвижениешкольников
Российское движение школьников реализует проект «Классные встречи». Классные встречи проходят в эту неделю с нашими активистами РДШ.
Подробнее…
Инноватариум
Благодарим ребят, которые продолжают заниматься техническим творчеством. Инноватариум вызывает интерес у тех, кому интересно повозиться с конструкторами, попробовать силы в программировании, запустить свои «машины».
Подробнее…
Профилактика экстремизма
Сотрудники УМВД по НАО Исаков Денис Петрович и Бондур Алексей Петрович пообщались с учениками 11-х классов на тему экстремизма в молодёжной среде.

Подробнее…
Юбилейный басктбол
16 апреля в спортивном зале школы прошли товарищеские матчи по баскетболу между командами баскетболистов «Ученик – 2022» и «Выпускник».
Подробнее…
День космонавтики
#рдшнао #российскоедвижениешкольников
12 апреля 1961 года Юрий Гагарин стал первым человеком в мировой истории, совершившим полёт в космическое пространство. День полёта Юрия Гагарина в космос объявлен праздником — Днём космонавтики.
Подробнее…
© 2022. ГБОУ НАО «СШ № 1 ИМЕНИ П.М. СПИРИХИНА».
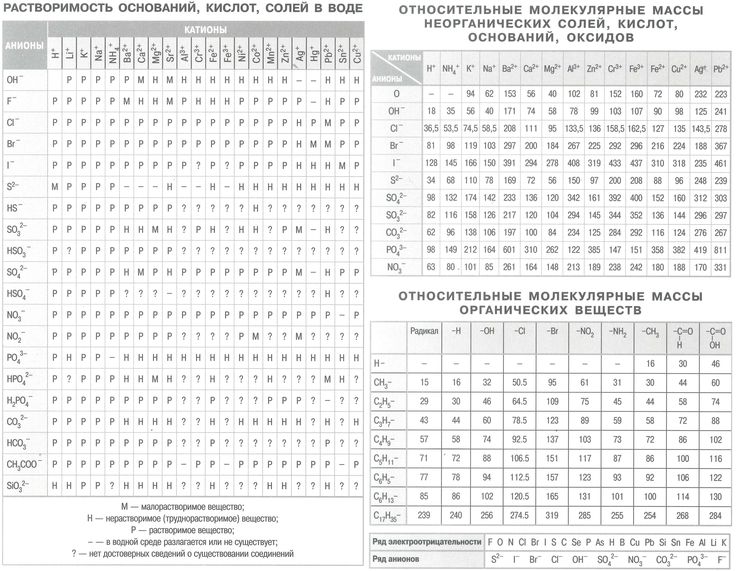
Задачи на растворимость | CHEMEGE.RU
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса (или объем для газов) растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. »
»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.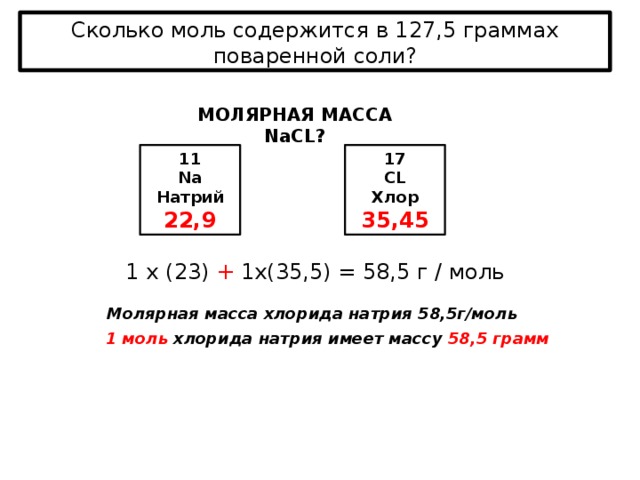 в. = mр.в./(mр.в. + mр-ра)
в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т. д.
д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.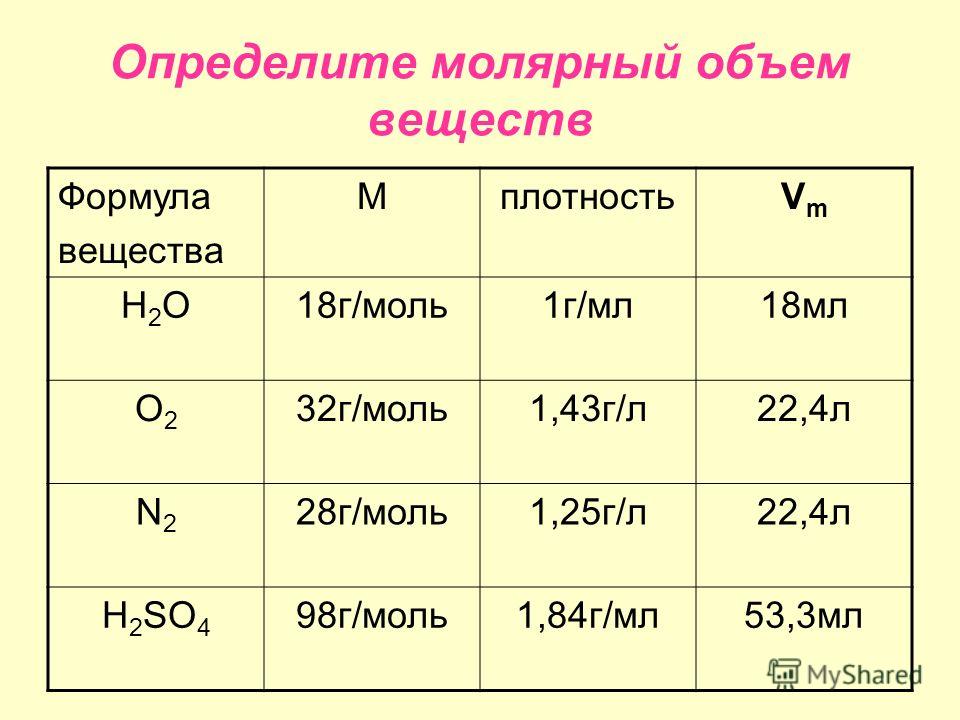
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
Решение и ответ
Свернуть
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
17. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор карбоната натрия массой 395,4 г разделили на две части. К первой части прилили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
18. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
19. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
21. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
22. Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
23. Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
24. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
25. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
26. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита натрия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 300 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался равен объёму газа, выделившемуся из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.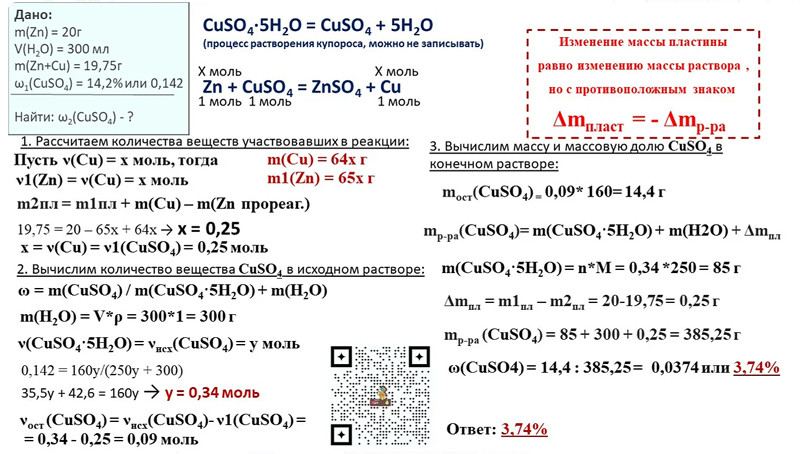
27. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили 250,4 г насыщенного раствора сульфита натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата алюминия. К раствору во второй колбе добавили 200 г разбавленного раствора серной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе. (Учитывать образование только средних солей).
Понравилось это:
Нравится Загрузка…
Нитрат бария — Barium nitrate
Нитрат бария это неорганическое соединение с химическая формула Ba (НЕТ3 )2. Он, как и большинство солей бария, бесцветен, токсичен и водорастворим. Он горит зеленым пламенем и является окислителем; соединение обычно используется в пиротехника.[3]
Он горит зеленым пламенем и является окислителем; соединение обычно используется в пиротехника.[3]
Содержание
- 1 Производство, возникновение и реакции
- 2 Приложения
- 2.1 Военный
- 3 Безопасность
- 4 Рекомендации
Производство, возникновение и реакции
Нитрат бария производится с помощью двух процессов, которые начинаются с основного исходного материала для бария — карбоната. Первый предполагает растворение карбонат бария в азотная кислота, позволяя осаждаться любым примесям железа, затем фильтровать, упаривать и кристаллизовать. Второй требует совмещения сульфид бария с азотной кислотой.[3]
Встречается в природе как очень редкий минерал. нитробарит.[4][5]
При повышенных температурах нитрат бария разлагается до оксид бария:
- 2Ba (НЕТ3)2 → 2BaO + 4NO2 + O2
Приложения
Нитрат бария используется в производстве материалов, содержащих ВаО.
Военный
Хотя больше не производится, Баратол взрывчатое вещество, состоящее из нитрата бария, TNT и связующее; высокая плотность нитрата бария также приводит к тому, что баратол довольно плотный. Нитрат бария смешанный с алюминиевый порошок, формула для флэш-порошок, очень взрывоопасен. Он смешан с термит формировать Thermate-Th4, используемый в военных термитных гранатах. Нитрат бария также был основным ингредиентом «SR 365». зажигательный заряд используется британцами в Де Вильд зажигательные боеприпасы которыми они вооружили свои истребители-перехватчики, такой как Hawker Hurricane и Супермарин Спитфайр, вовремя Битва за Британию.[6] Он также используется в процессе производства оксид бария, то вакуумная труба промышленность и зеленый огонь в пиротехника.
Безопасность
Как и все растворимые соединения бария, нитрат бария токсичный при проглатывании или вдыхании.[7]
Решения сульфат соли, такие как Английская соль или же сульфат натрия могут быть оказаны в качестве первой помощи при отравлении барием, поскольку они осаждают барий как нерастворимый (и нетоксичный) сульфат бария. CDC — Карманный справочник NIOSH по химической опасности
CDC — Карманный справочник NIOSH по химической опасности
Соли и ковалентные производные нитрат ион
| HNO3 | Он | ||||||||||||||||
| LiNO3 | Быть (НЕТ3)2 | B (НЕТ 3)− 4 | РОНО2 | НЕТ− 3 NH4НЕТ3 | HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg (НЕТ3)2 | Al (НЕТ3)3 | Si | п | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca (НЕТ3)2 | Sc (НЕТ3)3 | Ti (НЕТ3)4 | VO (НЕТ3)3 | Cr (НЕТ3)3 | Mn (НЕТ3)2 | Fe (НЕТ3)2 Fe (НЕТ3)3 | Co (НЕТ3)2 Co (НЕТ3)3 | Ni (NO3)2 | CuNO3 Cu (NO3)2 | Zn (НЕТ3)2 | Ga (НЕТ3)3 | Ge | В качестве | Se | Br | Kr |
| RbNO3 | Sr (НЕТ3)2 | Д (НЕТ3)3 | Zr (НЕТ3)4 | Nb | Пн | Tc | Ru (NO3)3 | Rh (НЕТ3)3 | Pd (НЕТ3)2 Pd (НЕТ3)4 | AgNO3 Ag (НЕТ3)2 | CD (НЕТ3)2 | В (NO3)3 | Sn | Sb (НЕТ3)3 | Te | Я НЕ3 | Xe (НЕТ3)2 |
| CsNO3 | Ba (НЕТ3)2 | Hf (НЕТ3)4 | Та | W | Re | Операционные системы | Ir | Pt (НЕТ3)2 Pt (НЕТ3)4 | Au (НЕТ3)3 | Hg2(НЕТ3)2 Hg (НЕТ3)2 | TlNO3 Tl (НЕТ3)3 | Pb (НЕТ3)2 | Би (НЕТ3)3 BiO (НЕТ3) | По (НЕТ3)4 | В | Rn | |
| FrNO3 | Ра (НЕТ3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла (НЕТ3)3 | Ce (НЕТ3)3 Ce (НЕТ3)4 | Pr (НЕТ3)3 | Nd (НЕТ3)3 | PM (НЕТ3)3 | Sm (НЕТ3)3 | Eu (NO3)3 | Gd (НЕТ3)3 | Tb (НЕТ3)3 | Dy (НЕТ3)3 | Хо (НЕТ3)3 | Er (НЕТ3)3 | Тм (НЕТ3)3 | Yb (НЕТ3)3 | Лу (НЕТ3)3 | |||
| Ac (НЕТ3)3 | Чт (НЕТ3)4 | PaO2(НЕТ3)3 | UO2(НЕТ3)2 | Np (НЕТ3)4 | Pu (НЕТ3)4 | Am (НЕТ3)3 | См (НЕТ3)3 | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||
1.
 2.1 Свойства нитратов бария и стронция. Растворимость щелочноземельных продуктов деления в кислых растворах уранилнитрата
2.1 Свойства нитратов бария и стронция. Растворимость щелочноземельных продуктов деления в кислых растворах уранилнитратаРастворимость щелочноземельных продуктов деления в кислых растворах уранилнитрата
дипломная работа
Нитрат бария Ba(NO3)2 представляет собой бесцветные кристаллы с кубической решеткой. Встречается в природе в виде минерала нитробаритa. Он представляет собой бесцветные кристаллы с кубической решеткой.
Нитрат стронция Sr(NO3)2 представляет собой бесцветные кристаллы с кубической решеткой. Нитрат стронция мало токсичен. Смеси нитрата стронция с порошками металлов склонны к спонтанному нагреву и могут самовоспламеняться, особенно в присутствии влаги
Таблица 2 — Свойства наиболее распространенных солей бария и стронция
Химическая формула | Ba(NO3)2 | BaC2O4 | BaCl2 | ВаF2 | BaSO4 | ВаСО3 | Sr(NO3)2 | SrSO4 | SrF2 | SrСО3 | SrCl2 | |
Молярная масса, г/моль | 261,4 | 225,3 | 208,2 | 175,3 | 233,4 | 197,4 | 211,63 | 184 | 126 | 148 | 159 | |
Плотность, г/смі | 3,24 | 2,66 | 3,2 | 4,83 | 4,5 | 4,43 | 3,0 | 3,96 | 4,18 | 3,79 | 3,09 | |
Температура плавления, °C | 595 | 400 | 962 | 1280 | 1580 | 1555 | 645 | 2606 | 1473 | 1494 | 874 | |
Теплоёмкость Дж/(моль·К) | 151,6 | 73,2 | 49,4 | 71,21 | 102,1 | 85,35 | 149,91 | — | — | 82 | 75,6 | |
Растворимость в воде, г/100 мл 20 оС 100 оС | 9,2 34,2 | малорастворимый | 36,2 | малорастворимый | практически не растворим | практически не растворим | 70,7 100 | практически не растворим | практически не растворим | практически не растворим | малорастворимый | |
Делись добром 😉
Анализ проб питьевой воды, подаваемой из скважины г. Нижнего Новгорода, автозаводского района, пос. Малышево
Нижнего Новгорода, автозаводского района, пос. Малышево
5.2 Потенциометрическое определение концентрации нитратов, фторидов, хлоридов
Определение концентрации нитратов. Для измерения активности ионов NO3 в водных растворах используют в качестве индикаторного электрода мембранный нитратселективный электрод марки ЭМ — NO3 — 01 в паре с любым вспомогательным электродом…
Гравиметрический анализ
2.2 Определение кристаллизационной воды в кристаллическом хлориде бария
Кристаллизационной водой называется вода, входящая в структуру кристаллов некоторых веществ, называемых кристаллогидратами. Содержание кристаллизационной воды определяют высушиванием кристаллогидрата до постоянной массы. Температура…
Люминесцентные свойства нанопорошков состава EuxAlyOz, синтезированных золь-гель методом
1. Люминесцентные свойства европия в сложных соединениях. Влияние алюминия на люминесцентные свойства редкоземельных металлов
…
Новые разработки и предложения вискозного волокна
2.
 2 Свойства
2 СвойстваТермопластичные смолы — хрупкие низкомолекулярные вещества от желтого до красно-коричневого цвета; температура размягчения от 72 до 85 °С; хорошо растворяются в смеси спирта с бензолом…
Новые разработки и предложения вискозного волокна
5.2 Свойства
Меламино-формальдегидные смолы — это олигомерные продукты поликонденсации меламина с формальдегидом, способные превращаться в пространственные (сшитые) полимеры. Эти смолы аморфные продукты белого цвета…
Определение содержания металлов в воде
2.2 Определение алюминия, бария, бериллия, молибдена, ванадия с использованием пламени: ацетилен — оксид азота
Для определения такого типа в приборе должен быть специальный кран, поворотом которого можно быстро вводить в горелку попеременно то воздух, то оксид азота. Сначала получают ярко — желтое воздушно — ацетиленовое пламя…
Отбор и изучение методик определения ионов Ва2+, SO42 — экспериментальное определение ионов Ва2+, SO42-
3.
 1 Определение содержания ионов бария в растворе
1 Определение содержания ионов бария в раствореЦель работы: изучение турбидиметрического метода анализа и его применение для определения веществ. Задание. Определить содержание ионов бария в растворе. Провести статистическую обработку и обсуждение результатов…
Растворимость щелочноземельных продуктов деления в кислых растворах уранилнитрата
1.2 Свойства солей бария и стронция
Из обычно применяемых солей бария хорошо растворимы хлорид бария ВаCl2 и другие галогениды, нитрат Ba(NO3)2, сульфид BaS, хлорат Ва(ClО3)2, трудно растворимы — сульфат бария BaSO4…
Свойства катионов бария, кальция. Групповой реактив. Его действие. Реактивы. Значение соединений катионов III группы в медицине
2. Свойства катионов бария и кальция
Свойства катионов бария. Барий — белый серебристый металл с объемно-центрированной кубической решеткой (модификация ?-Ва устойчива ниже 375°, модификация ?-Ва — от 375 до 710°). Плотность бария 3,74 г1см 3 , твердость 3 по шкале Мооса (тверже свинца).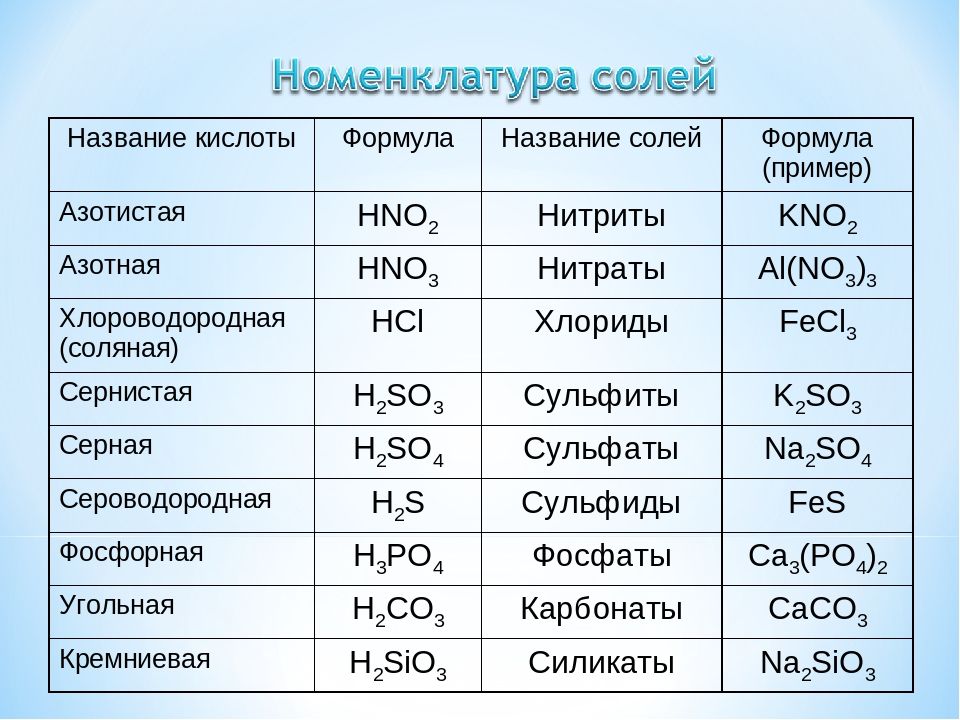 ..
..
Свойства катионов бария, кальция. Групповой реактив. Его действие. Реактивы. Значение соединений катионов III группы в медицине
4. Реакции катионов бария и кальция
Действие окислителей и восстановителей. Катионы бария, стронция, кальция, магния, алюминия устойчивы по отношению к окислителям и восстановителям. Ионы марганца, хрома (III)…
Синтез бихромата аммония
2.2.3.1 Свойства
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % h3SO4. Растворимость (в г/100 г или характеристика): вода: смешивается этанол: реагирует 1,005 (0.986%, 20°C…
Синтез бихромата аммония
2.5.1 Свойства
Брутто-формула (система Хилла): HKO4S Формула в виде текста: KHSO4 Молекулярная масса (в а. е. м.): 136,16 Температура плавления (в°C): 210 Температура разложения (в°C): 300 Плотность: 2,5 (20°C…
Синтез и свойства амилнитрита
Проблема нитратов и нитритов
Проблема нитратов активно обсуждается общественностью нашей страны. Попробуем разобраться в этом вопросе и мы. Нитраты — соли азотной кислоты, например NaNO3, KNO3, Nh5 NO3, Mg(NO3)2…
Попробуем разобраться в этом вопросе и мы. Нитраты — соли азотной кислоты, например NaNO3, KNO3, Nh5 NO3, Mg(NO3)2…
Синтез карбоната гидроксомеди (II)
1.2 Разложение нитратов
Нитраты разлагаются в зависимости от катиона соли. Первую группу составляют нитраты щелочных металлов…
Синтетические ювелирные камни
3.5. Титанат стронция (фабулит)
По сравнению с рутилом этот синтетический камень более подходит для замены алмаза в ювелирных изделиях. Он совершенно бесцветен, оптически изотропен, и его показатель преломления (2,41) аналогичен алмазу. Дисперсия у фабулита (0,1 — 0…
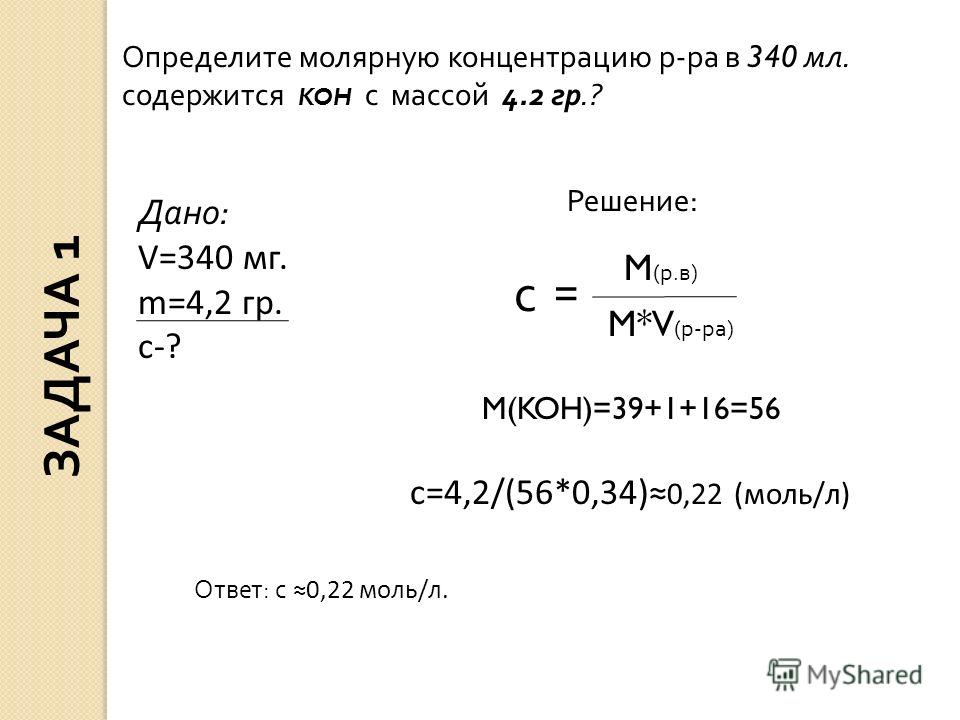
Пример 3. Какое количество вещества оксида меди (II) содержится в 120 г его массы? — Мегаобучалка
Решение. Используем формулу ,
где n- количество вещества;
m- масса вещества;
М – молярная масса вещества, численно равна
относительной молекулярной массе
1. Относительная молекулярная масса Мr(СuО)=64+16=80, следовательно, молярная масса М (СuО)=80г/моль.
2. Пользуясь соотношением
находим количество вещества: n(СuО)=
Пример 4. Определите массу гидроксида натрия количеством вещества 2 моль.
Решение. Используем формулу ,
1. Молярная масса М(NаOH)= 23+16+1=40г/моль.
2. m=nM
3. m(NаOH)= 2 40г/моль=80г.
Пример 5. Какой объем занимает 4 моль углекислого газа СО2.
Решение. Используем формулу ,
где Vm=22,4 л/моль
1. V(СО2)=n(CO2) Vm= 4 22,4л/моль= 89,6л.
Пример 6. Вычислите массу осадка, полученного действием раствора, содержащего 8г гидроксида натрия с раствором сульфата меди(II).
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(NаOH)=8г Найти: m(Cu(OH)2)-? |
2. Составьте уравнение химической реакции Составьте уравнение химической реакции
| Решение: CuSO4+2 NаOH→ Cu(OH)2+Na2SO4 |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | CuSO4+2 NаOH→ Cu(OH)2+Na2SO4 |
| 4. Под подчеркнутыми формулами подписать по коэффициентам «моли» | CuSO4+2 NаOH→ Cu(OH)2+Na2SO4 2 моль 1 моль |
| 5. Вычислите количество вещества n, которое записано в «Дано» | n(NаOH) = |
| 6. Подпишите найденное n под формулой этого вещества | CuSO4+2 NаOH→ Cu(OH)2+Na2SO4 2 моль 1 моль0,2 моль |
7. Под формулой вещества, массу которого надо найти, поставим х моль Под формулой вещества, массу которого надо найти, поставим х моль
| CuSO4+2 NаOH→ Cu(OH)2+Na2SO4 2 моль 1 моль0,2 моль х моль |
| 8. Из полученной пропорции выразить х | 2 моль 1 моль 0,2 моль х моль х = – это количество вещества n( Cu(OH)2) |
| 9. Зная n( Cu(OH)2) найдите массу Cu(OH)2 | m=nM m(Cu(OH)2)= n Cu(OH)2 M Cu(OH)2 M Cu(OH)2 =64+(16+1) 2=98г/моль m(Cu(OH)2)=0,1 98г/моль=9,8г |
| 10. Запишите ответ | Ответ: m(Cu(OH)2)=9,8г |
Контрольные задания
Подготовьте сообщения
1. Аллотропные модификации углерода (алмаз, графит), кислорода (кислород, озон), олова (серое и белое олово). (Указание: в сообщении написать о физических свойствах указанных модификаций и применении, можно оформить в виде таблицы).
Аллотропные модификации углерода (алмаз, графит), кислорода (кислород, озон), олова (серое и белое олово). (Указание: в сообщении написать о физических свойствах указанных модификаций и применении, можно оформить в виде таблицы).
2. Понятие о химической технологии, биотехнологии и нанотехнологии. (Указание: в сообщении отразить их определение и привести конкретные примеры применения.)
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1. Вычислите относительную молекулярную массу.
1. Азотной кислоты
2. Оксида алюминия
3. Гидроксида железа (III)
4. Сульфата бария
5. Гидроксида алюминия
6. Угольной кислоты
7. Соляной кислоты
8. Карбоната натрия
9. Оксида калия
10. Хлорида железа (II)
11. Фосфорной кислоты
12. Сульфата натрия
13. Оксида серы (IV)
14. Нитрата бария
15. Сульфата меди (II)
16. Аммиака
17. Карбоната кальция Сульфата меди (II)
16. Аммиака
17. Карбоната кальция
| 18. Оксида фосфора (V) 19. Гидроксида кальция 20. Оксида серебра 21. Нитрата магния 22. Гидроксида магния 23. Карбоната бария 24. Сульфата калия 25. Оксида меди (II) 26. Нитрата натрия 27. Хлорида цинка 28. Нитрата серебра 29. Оксида магния 30. Фосфата алюминия 31. Сульфида натрия 32. Гидроксида цинка 33. Хлорида железа (III) 34. Хлорида бария |
Чему равна молярная масса вещества из вашего варианта?
Задача 2.Расчитайте массовую долю (%) для первого элемента в веществе ….
1. СО2
2. Н2S
3. NH3
4. Н3РО4
5. СН4
6. Н2О
7. Na2SO4
8. Na2S
9. HNO3
10. HBr
11. С2Н4
12. СаF2
13. К2СО3
14. SO2
15. Ag2O
16. NO2
17. C2H6 HBr
11. С2Н4
12. СаF2
13. К2СО3
14. SO2
15. Ag2O
16. NO2
17. C2H6
| 18. HF 19. Nа3РО4 20. Н2СО3 21. CuO 22. Ag2O 23. Ва(ОН)2 24. СаО 25. N2O5 26. ZnO 27. K2SO3 28. CO 29. Fe2O3 30. HCl 31. Al2O3 32. H2SiO3 33. K2О 34. KOH |
Задача 3.
1. Рассчитайте, какое количество(n) углекислого газа получится при сгорании 6г угля С.
2. Юный радиотехник при травлении омедненной платы опустил ее в раствор хлорида железа (III).Какая масса меди перейдет в раствор, если в результате реакции, идущей согласно уравнению 2FeCl3 + Сu = 2FeCl2 + СuСl2, выделилось 1,35г хлорида меди(II).
3. Какова масса нитрата меди, образующегося при взаимодействии оксида меди(II) массой 4г с азотной кислотой?
4. Какое количество вещества (n) воды можно получить, если сжечь 3 моль газа водорода.
5. Какой объем кислорода (н.у.) потребуется для сжигания 2,4г магния?
6. Сколько литров водорода (н.у.)можно получить при действии избытка разбавленной серной кислоты на цинк массой 24г?
7. Сколько граммов гидроксида калия потребуется для взаимодействия с 70г серной кислоты?
8. Сколько граммов водорода можно получить при взаимодействии алюминия массой 54г с соляной кислотой?
9. 4,6г натрия растворили в воде с образованием щелочи и газа. Вычислите объем газа (н.у).
10. Какова масса соли, получившейся при взаимодействии оксида кальция массой 28 г с соляной кислотой?
11. Сколько литров оксида углерода (IV) (н.у.) можно получить при прокаливании известняка СаСО3, массой 200г?
12. Какая масса алюминия подверглась окислению кислородом, если образовалось 10,2г оксида алюминия.
13. При растворении цинка в соляной кислоте выделился газ объемом 6,72л. Вычислите массу растворившегося цинка.
14. Сколько литров водорода (н.у.) выделится при разложении электрическим током воды массой 72 г?
15. Сколько граммов серной кислоты прореагирует с цинком, если получается 4 моль сульфата цинка?
16. Сколько литров водорода (н.у.) сгорело, если образовалось 72 г воды?
17. Какое количество вещества водорода выделится при взаимодействии магния с соляной кислотой массой 146 г?
18. Сколько граммов сульфата цинка можно получить, имея 0,5 моль серной кислоты взаимодействующей с цинком?
19. Какой объем водорода в литрах выделится (н.у.) если с соляной кислотой прореагировало 3 моль магния?
20. Получают 3г ртути путем разложения оксида ртути НgО. Сколько граммов исходного вещества потребуется для этого?
21. Сколько потребуется карбоната кальция (мрамора) при взаимодействии с соляной кислотой для получения 5,6 л углекислого газа (н. у.)
у.)
22. Сколько молей кислорода необходимо для полного окисления 0,4 моль магния?
23. Сколько грамм гидроксида натрия потребуется для взаимодействия с 9,8г серной кислоты.
24. Хлорид магния реагирует с 10,6г карбоната натрия. Найти массу образовавшегося осадка.
25. Какой объем кислорода (н.у.) нужен для сжигания серы массой 6,4 г до SО2.
26. Какая масса гидроксида натрия потребуется для превращения сульфата меди (II) массой 16 г в гидроксид меди (II)?
27. Гидроксид алюминия массой 7,8 г растворили в соляной кислоте. Какая масса соли при этом образовалась?
28. Сколько грамм воды образуется при нейтрализации 8 г гидроксида натрия азотной кислотой?
29. Вычислите массу осадка, полученного действием раствора, содержащего 9,8г серной кислоты с раствором хлорида бария.
30. Определите объем водорода, вступающего в реакцию с 44,8 л кислорода для образования воды. Объемы газов измерены при н.у.
31. Хлорид натрия реагирует с 17 г нитрата серебра. Найти массу образовавшегося осадка.
Найти массу образовавшегося осадка.
32. Для получения меди из оксида меди (II) израсходован водород объемом 1,12 л (н.у.).Сколько меди в граммах при этом выделилось?
33. Какой объем кислорода (н.у.) израсходуется на сжигание 12 г магния?
34. Для нейтрализации серной кислоты потребовалось 5,6 г гидроксида калия. Вычислите массу образовавшейся при этом соли.
[Решено] ПОЖАЛУЙСТА, ПОМОГИТЕ МНЕ ОТВЕТИТЬ НА ЭТИ ВОПРОСЫ С НЕСКОЛЬКИМИ ВАРИАНТАМИ СПАСИБО Рассчитайте массу формулы нитрата бария, Ba(NO 3 ) 2???????? 199 а.е.м. 16…
Получите больше от подписки*
- Доступ к более чем 100 миллионам учебных ресурсов по конкретным курсам
- Круглосуточная помощь опытных наставников по более чем 140 предметам
- Полный доступ к более чем 1 миллиону решений для учебников
*Вы можете изменить, приостановить или отменить в любое время
Рассчитайте формулу массы нитрата бария, Ba(NO 3 ) 2????????
- 199 а.
 е.м.
е.м. - 167 а.е.м.
- 261 а.е.м.
- 253 а.е.м.
Рассчитайте формулу массы KHCO 3. ????
- 92,1 а.е.м.
- 100 а.е.м.
- 68,1 а.е.м.
- 204 а.е.м.
Что из следующего действует как коэффициент преобразования для преобразования между числом молекул в образце и числом молей в образце?
- Количество электронов в образце
- Число Авогадро
- Количество нейтронов в образце
- Атомная масса
Рассмотрим образец C2h3 массой 4,06 г. Сколько атомов C будет в этом образце? Запишите свой ответ с тремя значащими цифрами и в экспоненциальном представлении. Используйте * для символа умножения.
_______________??????
Рассмотрим образец C3H6 массой 1,35 г. Сколько молекул в этом образце? Запишите свой ответ с тремя значащими цифрами и в экспоненциальном представлении. Используйте * для символа умножения.?????
________________????
Каков процентный состав C в C9h26? Запишите свой ответ до 2 знаков после запятой. ????
????
_______________?????
Образец соединения содержит 40,0% углерода, 6,7% водорода и 53,3% кислорода. Какова эмпирическая формула этого соединения?
________________
Соединение с эмпирической формулой NO 2 имеет формульную массу 92,02 г/моль. Какова его молекулярная формула?
_______________
Роберт заказывает сладкий чай на ужин, но в ресторане есть только несладкий. Когда его чай подается на стол, Роберт добавляет в несладкий чай два пакетика сахара. В этом сценарии несладкий чай – это _________ , а сахар – ______________ ???????????? .
- растворитель, растворитель
- растворитель, растворенное вещество
- растворенное вещество, растворитель
- растворенное вещество, растворенное вещество
Сколько молей NaOH содержится в 463 мл 0,5 М раствора? Дайте ответ с точностью до двух знаков после запятой.
_____________????
Сколько мл 6,6 М раствора HCl потребуется для приготовления 250 мл 2,5 М раствора? Дайте ответ с точностью до 1 знака после запятой.
___________________?????
Сколько мл 0,0830 М карбоната лития нужно разбавить водой, чтобы получить 20,7 мл 0,260 М раствора?
- 0,0154 мл
- 64,8 мл
- 6,61 мл
- 0,447 мл
Концентрация раствора, образованного при растворении жидкого растворенного вещества в жидком растворителе, выражается как??????
- Проценты по объему
- Проценты по массе
- Проценты по массе и объему
При выражении очень низких концентраций растворенных веществ с использованием частей на миллион, что из следующего необходимо использовать для правильного преобразования в части на миллион?
- *10 6
- *10 9
- *10 3
- *10 12
Рассчитайте процент массы из SUCROSE Suctorse, который создан на основе Sucrams 9.74
. воды до массы раствора 25,2 грамма. Дайте ответ в виде целого числа.
___________?
Раствор гидроксида натрия, содержащий 46,2 г NaOH на 1 л раствора, имеет плотность 1,06 г/мл. Рассчитайте моляльность NaOH в этом растворе. Запишите свой ответ с точностью до 2 знаков после запятой.
Рассчитайте моляльность NaOH в этом растворе. Запишите свой ответ с точностью до 2 знаков после запятой.
_____________
Какова концентрация бромида в частях на миллион, если 132,72 г MgBr2 растворено в 9,11 л воды. Запишите ответ в экспоненциальном представлении до 3-х значащих цифр.
__________???
Рассчитайте формулу массы (NH 4 ) 2 SO 4????????
- 132 а.е.м.
- 63,1 а.е.м.
- 114 а.е.м.
- 252 а.е.м.
- .602×10 23
- 6.02
- 2,06×10 23
- 6.02×10 23
, сколько молекул C9H26 у вас будет, если у вас будет 7.7114
, сколько молекул C9H26 у вас будет 7.71 моль? Запишите свой ответ с тремя значащими цифрами и в экспоненциальном представлении. Используйте * для символа умножения.
__________???
Каков процентный состав H в C4H8?
- 16,82
- 0,16
- 0,14
- 15,51
- 14,4
Анализ показал, что образец неизвестного соединения содержит 88,8% Cu и 11,2% O.
 Какова эмпирическая формула этого соединения?
Какова эмпирическая формула этого соединения?____________
Соединение с эмпирической формулой NH 2 имеет формульную массу 32,05 г/моль. Какова его молекулярная формула?
___________
В лаборатории необходимо приготовить 500 мл 0,5 М раствора NaOH. Сколько граммов NaOH нужно отмерить для приготовления раствора? Округлите ответ до ближайшего целого числа.
_____________
Какова молярность раствора, полученного путем разбавления 35,3 мл 0,260 М хлорида калия до 154 мл?
- 1,13 M
- 16,8 M
- 0,0596 M
- 1,410 M
Что из следующего определяется как отношение массы компонента к массе раствора, выраженное в процентах?
- Массовая доля
- Объемная доля
- Массово-объемная доля
Какова концентрация бромида магния в частях на миллион, если 82,84 г MgBr2 растворено в 5,96 л воды. Запишите ответ в экспоненциальном представлении до 3-х значащих цифр.

____________????
Рассчитайте формулу массы NaH 2 PO 4??????
- 71,0 а.е.м.
- 120 а.е.м.
- 90,0 а.е.м.
- 284 а.е.м.
- на моль
- килограммов
- а.е.м.
- фунтов
Каково процентное содержание H в C4H6? Запишите свой ответ с точностью до 2 знаков после запятой.
________________
Соединение с эмпирической формулой Ch3O имеет формульную массу 120,1 г/моль. Какова его молекулярная формула?
_______________
Джон смешивает два водных раствора в химической лаборатории. В первый раствор он добавил 7,90 г NaCl, а во второй добавил 15,0 г NaCl. Джон делает вывод, что первое решение более __________ больше, чем второе.
- концентрированный
- разбавленный
Сколько граммов сахарозы (молярная масса 342,30 г/моль) содержится в 981 мл 2,4 М раствора? Дайте ответ в виде целого числа.
_______________
Сколько мл 1,65 М хлорида кальция нужно разбавить водой, чтобы получить 355 мл 0,00290 М раствора?
- 202 000 мл
- 1,60 мл
- 1,70 мл
- 0,624 мл
При выражении очень низких концентраций растворенных веществ в частях на миллиард, какое из следующих утверждений следует использовать для правильного преобразования в части на миллиард?
- *10 12
- *10 9
- *10 6
- *10 3
Рассчитайте концентрацию в PPM из раствора 82,04 мг PB PB PB PB PB PB PB PB PB.
 Запишите свой ответ с точностью до ближайшего целого числа.
Запишите свой ответ с точностью до ближайшего целого числа.______________
Наука Химия
Ответ и объяснение
Решено проверенным экспертом
Последствие молочницы, ultrices
ia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsumicitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui l
icitur laoreet. Nam risus ante, da
Разблокируйте полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы посмотреть ответ
Пошаговое объяснение
7 вложений
jpg
jpg
jpg
jpg
jpg
jpg
jpg
Формула нитрата ртути II – структура, свойства, использование, примеры вопросов
Ртуть также известна как ртуть.
 Это естественный элемент, обнаруженный в горных породах и угольных месторождениях. Слово ртуть происходит от греческого слова Hydrargyrum, означающего воду и серебро. Ртуть имеет символ Hg и атомный номер 80. Это жидкий металл, принадлежащий к 12 группе периодической таблицы. Его атомная масса 200,59.u и температура плавления -38,83˚C.
Это естественный элемент, обнаруженный в горных породах и угольных месторождениях. Слово ртуть происходит от греческого слова Hydrargyrum, означающего воду и серебро. Ртуть имеет символ Hg и атомный номер 80. Это жидкий металл, принадлежащий к 12 группе периодической таблицы. Его атомная масса 200,59.u и температура плавления -38,83˚C.
Азот необходим всем живым организмам. Когда азот соединяется с кислородом, он естественным образом образует нитратное соединение. Большинство неорганических нитратов могут быть растворимы в воде. Он имеет молярную массу 62,0049 г/моль. Это многоатомный ион с химической формулой NO 3 – . Он используется в удобрениях и фармацевтических препаратах.Ртуть II Нитрат
Ртуть II Нитрат является токсичным химическим соединением, хотя иногда он используется в качестве реагента. Он имеет вид белого кристаллического твердого вещества и растворим в воде. Плотность нитрата ртути II 4,3 г/см 3 . Его также называют нитратом ртути, динитратом ртути.
 Он может вызвать взрыв, когда подвергается воздействию более высоких температур в течение длительного времени, и выделяет токсичные оксиды азота при разложении при нагревании. При работе с этим составом следует соблюдать соответствующие меры безопасности. Из-за высокой токсичности и опасности он запрещен во многих странах.
Он может вызвать взрыв, когда подвергается воздействию более высоких температур в течение длительного времени, и выделяет токсичные оксиды азота при разложении при нагревании. При работе с этим составом следует соблюдать соответствующие меры безопасности. Из-за высокой токсичности и опасности он запрещен во многих странах.Формула нитрата ртути II
Hg (NO 3 ) 2 — химическая формула нитрата ртути II. Символ Hg представляет собой ртуть, а символ NO представляет нитрат. Он имеет молярную массу 324,7 г/моль.
Структура нитрата ртути II
Физические свойства нитрата ртути II
- Температура плавления 79°C.
- Растворим в воде.
- Плотность 4,3 г/см 3 .
- Нитрат ртути II нерастворим в спирте, но растворим в азотной кислоте, ацетоне и аммиаке.
- Разъедает большинство металлов.
- Молекулярная масса 324,7 г/моль.

- негорючий
Chemical Properties of Mercury II Nitrate
- Mercury (II) nitrate can easily hydrolyze to mercury(II) oxide by dilution or addition of alkali,
Hg(NO 3 ) 3 + H 3 O ⇢ HgO + 2HNO 3
- Для получения металлической ртути из нитрата необходимо нагревание Hg(NO 3 ) в дистилляционном аппарате. При температуре выше 400°C легко разлагается,
HG (NO 3 ) 3 ⇢ HG + 2NO 3 + O 3
Использование Mercury II -нитрат
IT INTRATATIANTATION 2 IT INTRATATATION 2 IT INTIPARATATION 2 IT INTIPARATATION.
- Используется в реакциях образования ртути.
- Он также используется в качестве аналитических реагентов и нитрификаторов в лабораториях.

- Нитрат ртути раньше использовался для изготовления шляпного войлока.
- Нитрат ртути содержится в некоторых мазях.
- Следование за вдохом – Убедитесь, что имеется достаточное количество естественного воздуха. Ищите клиническое руководство, предполагая, что вы чувствуете некоторую неуверенность, или, с другой стороны, если ваши побочные эффекты не исчезнут.

- После контакта с кожей – При попадании на кожу немедленно смойте большим количеством воды. В любом случае проконсультируйтесь со специалистом.
- После визуального подключения – Промойте водой в течение нескольких минут, следя за тем, чтобы не переборщить. В случае, если вы испытываете некоторые сомнения или, наоборот, в случае, если ваши побочные эффекты не исчезают, обратитесь к специалисту для клинического направления
- После поступления – Промойте рот водой (при условии, что человек сознательный). Организуйте встречу с врачом.
- Она используется в люминесцентных лампах, термометрах, поплавковых клапанах и стоматологических амальгамах.
- Используется в медицине.
- Гремучая ртуть II — это взрывчатое вещество, используемое в качестве капсюля в огнестрельном оружии.
- Также используется для производства других химических веществ и
- Также используется для изготовления жидких зеркал.

- Дезинфицирующее ртутное соединение – тимеросал представляет собой ртутьорганическое соединение, которое содержится в вакцинах, чернилах для татуировок, растворах для контактных линз и косметике.
Меры безопасности
Нитрат ртути II является высокотоксичным соединением. Он вызывает психологическое заболевание, когда в значительной степени подвергается его воздействию. Даже когда нитрат ртути II подвергается большему воздействию тепла, это может привести к взрыву. При работе с этим соединением необходимо принимать надлежащие меры безопасности и избегать прямого контакта. Необходимо использовать соответствующую защитную одежду.
Примеры вопросов
Вопрос 1: Какие виды неотложной помощи должны быть даны человеку в случае его взаимодействия с нитратом ртути II?
Ответ:
Методы неотложной помощи:
Вопрос 2: Какие вещи следует держать в надлежащих пределах при хранении нитрата ртути II?
Ответ:
Следует избегать продуктов питания и кормов, горючих веществ, уменьшающих количество специалистов и легковоспламеняющихся веществ. Держитесь в тени. Хранить там, где нет доступа к каналу или канализации.
 Мероприятия по сдерживанию тушения пожаров. Заткнись в нерешительности. Просто держите первый держатель. Температура емкости должна быть низкой, так как чрезмерная интенсивность может привести к ее срабатыванию, вызывающему взрыв.
Мероприятия по сдерживанию тушения пожаров. Заткнись в нерешительности. Просто держите первый держатель. Температура емкости должна быть низкой, так как чрезмерная интенсивность может привести к ее срабатыванию, вызывающему взрыв.Вопрос 3: Двуокись азота – это газ, образующийся при термическом разложении нитрата ртути II. Опасен ли газ для людей?
Ответ:
Поскольку двуокись азота является ядовитым газом, известно, что более высокие дозы губительны для людей. Это может нанести вред дыхательной системе, особенно легким, а также повысить риск респираторных заболеваний и астмы. Дальний выброс диоксида азота также может вызвать заболевания легких.
Вопрос 4: Что такое оксид ртути II?
Ответ:
Оксид ртути II или оксид ртути представляет собой твердое вещество красного или оранжевого цвета. Это неорганическое соединение, которое при нагревании разлагается на металлическую ртуть и газообразный кислород.
 HgO – это формула оксида ртути. Он имеет молярную массу 216,59 г/моль и температуру плавления 500°С. он реагирует с кислотами и нерастворим в спиртах. Это высокотоксичное вещество, которое может оказывать воздействие на почки, раздражая глаза, кожу и дыхательные пути. Он используется в морских и фарфоровых красках, сухих батареях и химических реагентах. Он играет важную роль в производстве ртути.
HgO – это формула оксида ртути. Он имеет молярную массу 216,59 г/моль и температуру плавления 500°С. он реагирует с кислотами и нерастворим в спиртах. Это высокотоксичное вещество, которое может оказывать воздействие на почки, раздражая глаза, кожу и дыхательные пути. Он используется в морских и фарфоровых красках, сухих батареях и химических реагентах. Он играет важную роль в производстве ртути.Вопрос 5: Для чего используется ртуть?
Ответ:
Ртуть — самый редкий элемент в земной коре. Некоторые из применений ртути:
Вопрос 6: Вредны ли нитраты для человека?
Ответ:
Нитраты несколько бесполезны, а это означает, что они стабильны, маловероятны и вредны. Микробы во рту или ферменты в организме могут превратиться в нитриты, и это может быть вредно. Таким образом, нитриты могут трансформироваться либо в: окись азота, что полезно для организма.
Чрезмерное потребление нитратов может быть разрушительным, особенно для детей. Потребление чрезмерного количества нитратов может повлиять на то, как кровь переносит кислород, и может вызвать метгемоглобинемию (иначе называемую синдромом синего ребенка). Дети до полугода, находящиеся на искусственном вскармливании, подвергаются наибольшему риску заболеть метгемоглобинемией.

Какова молярная масса 7 кг гидроксида бария
Какова молярная масса bacl2?
208,23 г/моль
Бария хлорид/Молярная масса
Какова молярная масса октагидрата гидроксида бария?
315.46
Basic Information
Product Name Barium Hydroxide Octahydrate Chemical Formula Ba(OH) 2 ・8H 2 O Molecular Weight (Formula Weight) 315,46 TSCA Зарегистрировано (как ангидрид) EINECS 241-234-5 (в виде ангидрида) Какова молярная масса baso4?
233,38 г/моль
Сульфат бария/Молярная масса
Какова молярная масса Ba oh 3?
171.34 g/mol
Barium hydroxide
Identifiers Molar mass 171.  34 g/mol (anhydrous) 189.355 g/mol (monohydrate) 315.46 g/mol (octahydrate)
34 g/mol (anhydrous) 189.355 g/mol (monohydrate) 315.46 g/mol (octahydrate) Appearance white solid Density 3.743 g/cm 3 (monohydrate) 2.18 g/cm 3 (octahydrate, 16 °C) Melting point 78 °C (172 °F; 351 K) (октагидрат) 300 °C (моногидрат) 407 °C (безводный) Как найти молярную массу гидроксида бария?
171,34 г/моль
Бария гидроксид/Молярная масса
Какова молярная масса NaOH?
39,997 г/моль
Гидроксид натрия/Молярная масса
Чтобы рассчитать молекулярную массу NaOH, добавьте молярные массы каждого элемента. При добавлении оно составляет 39,997 г/моль . При округлении молекулярная масса NaOH равна 40 г/моль.
Какова молярная масса BA OH 2 8h3O?
БАРИЯ ГИДРОКСИД 8h3O – Физико-химические свойства
Молекулярная формула Ba(OH)2·8h3O Molar Mass 315.  467 g/mol
467 g/mol Melting Point 78℃ Solubility 56 g/L (15℃) What is the mass of BA no3 2?
261,337 г/моль
Нитрат бария/Молярная масса
Какова молярная масса na2co3?
105,9888 г/моль
Карбонат натрия/Молярная масса
Какова молярная масса 8 ч3о?
Какова молярная масса Коха?
56,1056 г/моль
Гидроксид калия/Молярная масса
Какова молярная масса воды?
18,01528 г/моль
Вода/Молярная масса
Какова молярная масса ch5?
16,04 г/моль
Метан/Молярная масса
Как найти молярную массу?
Молярная масса – это масса данного химического элемента или химического соединения (г), деленная на количество вещества (моль). Молярную массу соединения можно рассчитать по формуле 9039.1 добавление стандартных атомных масс (в г/моль) составляющих атомов .

Какова молярная масса cuso4?
159,609 г/моль
Сульфат меди(II)/Молярная масса
Сколько молей у Ch5?
(молярная масса Ch5 = 16,0 г/моль] G: 1,58 моль Ch5 D: ?
Что такое Ch5 в химии? некоторые виды деятельности человека. Метан является простейшим представителем парафинового ряда углеводородов и одним из самых сильнодействующих парниковых газов. Его химическая формула — CH
4 .Какова молярная масса n2?
28,0134 г/моль
Диназот/Молярная масса
Сколько молей составляют 17,6 грамма NaOH?
17,6 г гидроксида натрия равны 0,440 моль гидроксида натрия.
Сколько граммов ch5 содержится в 12 молях ch5?
Сколько молей ch5 содержится в 16 г ch5?
Отсюда можно сделать вывод, что n (число молей) в 16 г метана составляет 1 моль .
Сколько молей NaOH?
Молярная масса соединения NaOH составляет 40 г/моль .

Какова молярная масса bacl2?
208,23 г/моль
Бария хлорид/Молярная масса
Какова молярная масса октагидрата гидроксида бария?
315.46
Basic Information
Product Name Barium Hydroxide Octahydrate Chemical Formula Ba(OH) 2 ・8H 2 O Molecular Weight (Formula Weight) 315.46 TSCA Registered (as Anhydride) EINECS 241-234-5 (as Anhydride) What is the молярная масса baso4?
233,38 г/моль
Сульфат бария/Молярная масса
Какова молярная масса Ba oh 3?
171,34 г/моль
Бария гидроксид
Идентификаторы Molar mass 171.34 g/mol (anhydrous) 189.  355 g/mol (monohydrate) 315.46 g/mol (octahydrate)
355 g/mol (monohydrate) 315.46 g/mol (octahydrate) Appearance white solid Density 3,743 г/см 3 (моногидрат) 2,18 г/см 3 (октагидрат, 16 °C) (моногидрат) 407 °C (безводный) Как найти молярную массу гидроксида бария?
171,34 г/моль
Бария гидроксид/Молярная масса
Какова молярная масса NaOH?
39,997 г/моль
Гидроксид натрия/Молярная масса
Чтобы рассчитать молекулярную массу NaOH, добавьте молярные массы каждого элемента. При добавлении оно составляет 39,997 г/моль . При округлении молекулярная масса NaOH равна 40 г/моль.
Какова молярная масса BA OH 2 8h3O?
BARIUM HYDROXIDE 8h3O – Physico-chemical Properties
Molecular Formula Ba(OH)2·8h3O Molar Mass 315.  467 g/mol
467 g/mol Melting Point 78℃ Растворимость 56 г/л (15℃) Какова масса БА №3 2?
261,337 г/моль
Нитрат бария/Молярная масса
Какова молярная масса na2co3?
105,9888 г/моль
Карбонат натрия/Молярная масса
Какова молярная масса 8 ч3о?
Какова молярная масса Коха?
56,1056 г/моль
Гидроксид калия/Молярная масса
Какова молярная масса воды?
18,01528 г/моль
Вода/Молярная масса
Какова молярная масса ch5?
16,04 г/моль
Метан/Молярная масса
Как найти молярную массу?
Молярная масса – это масса данного химического элемента или химического соединения (г), деленная на количество вещества (моль). Молярную массу соединения можно рассчитать по формуле добавление стандартных атомных масс (в г/моль) составляющих атомов .




 ..
..
 6 мая вся школа вышла по особому графику на торжественные линейки к Обелиску ПОБЕДЫ и к памятнику экипажу буксирного катера «Комсомолец».
6 мая вся школа вышла по особому графику на торжественные линейки к Обелиску ПОБЕДЫ и к памятнику экипажу буксирного катера «Комсомолец». Ждём! Регистрация – 16.30-16.50. Начало вечера в 17.00
Ждём! Регистрация – 16.30-16.50. Начало вечера в 17.00
 е.м.
е.м. Какова эмпирическая формула этого соединения?
Какова эмпирическая формула этого соединения?
 Запишите свой ответ с точностью до ближайшего целого числа.
Запишите свой ответ с точностью до ближайшего целого числа. Это естественный элемент, обнаруженный в горных породах и угольных месторождениях. Слово ртуть происходит от греческого слова Hydrargyrum, означающего воду и серебро. Ртуть имеет символ Hg и атомный номер 80. Это жидкий металл, принадлежащий к 12 группе периодической таблицы. Его атомная масса 200,59.u и температура плавления -38,83˚C.
Это естественный элемент, обнаруженный в горных породах и угольных месторождениях. Слово ртуть происходит от греческого слова Hydrargyrum, означающего воду и серебро. Ртуть имеет символ Hg и атомный номер 80. Это жидкий металл, принадлежащий к 12 группе периодической таблицы. Его атомная масса 200,59.u и температура плавления -38,83˚C.  Он может вызвать взрыв, когда подвергается воздействию более высоких температур в течение длительного времени, и выделяет токсичные оксиды азота при разложении при нагревании. При работе с этим составом следует соблюдать соответствующие меры безопасности. Из-за высокой токсичности и опасности он запрещен во многих странах.
Он может вызвать взрыв, когда подвергается воздействию более высоких температур в течение длительного времени, и выделяет токсичные оксиды азота при разложении при нагревании. При работе с этим составом следует соблюдать соответствующие меры безопасности. Из-за высокой токсичности и опасности он запрещен во многих странах.


 Мероприятия по сдерживанию тушения пожаров. Заткнись в нерешительности. Просто держите первый держатель. Температура емкости должна быть низкой, так как чрезмерная интенсивность может привести к ее срабатыванию, вызывающему взрыв.
Мероприятия по сдерживанию тушения пожаров. Заткнись в нерешительности. Просто держите первый держатель. Температура емкости должна быть низкой, так как чрезмерная интенсивность может привести к ее срабатыванию, вызывающему взрыв. HgO – это формула оксида ртути. Он имеет молярную массу 216,59 г/моль и температуру плавления 500°С. он реагирует с кислотами и нерастворим в спиртах. Это высокотоксичное вещество, которое может оказывать воздействие на почки, раздражая глаза, кожу и дыхательные пути. Он используется в морских и фарфоровых красках, сухих батареях и химических реагентах. Он играет важную роль в производстве ртути.
HgO – это формула оксида ртути. Он имеет молярную массу 216,59 г/моль и температуру плавления 500°С. он реагирует с кислотами и нерастворим в спиртах. Это высокотоксичное вещество, которое может оказывать воздействие на почки, раздражая глаза, кожу и дыхательные пути. Он используется в морских и фарфоровых красках, сухих батареях и химических реагентах. Он играет важную роль в производстве ртути.

 34 g/mol (anhydrous) 189.355 g/mol (monohydrate) 315.46 g/mol (octahydrate)
34 g/mol (anhydrous) 189.355 g/mol (monohydrate) 315.46 g/mol (octahydrate)  467 g/mol
467 g/mol 

 355 g/mol (monohydrate) 315.46 g/mol (octahydrate)
355 g/mol (monohydrate) 315.46 g/mol (octahydrate)  467 g/mol
467 g/mol 