Нитрат калия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Нитрат калия — свойства, получение и применение
Содержание
- Физические свойства
- Химические свойства
- Природные источники и месторождения
- Применение
Нитрат калия, азотнокислый калий — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддаётся очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельчённом состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решёткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O:
| Растворитель / Температура, °С | 0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы.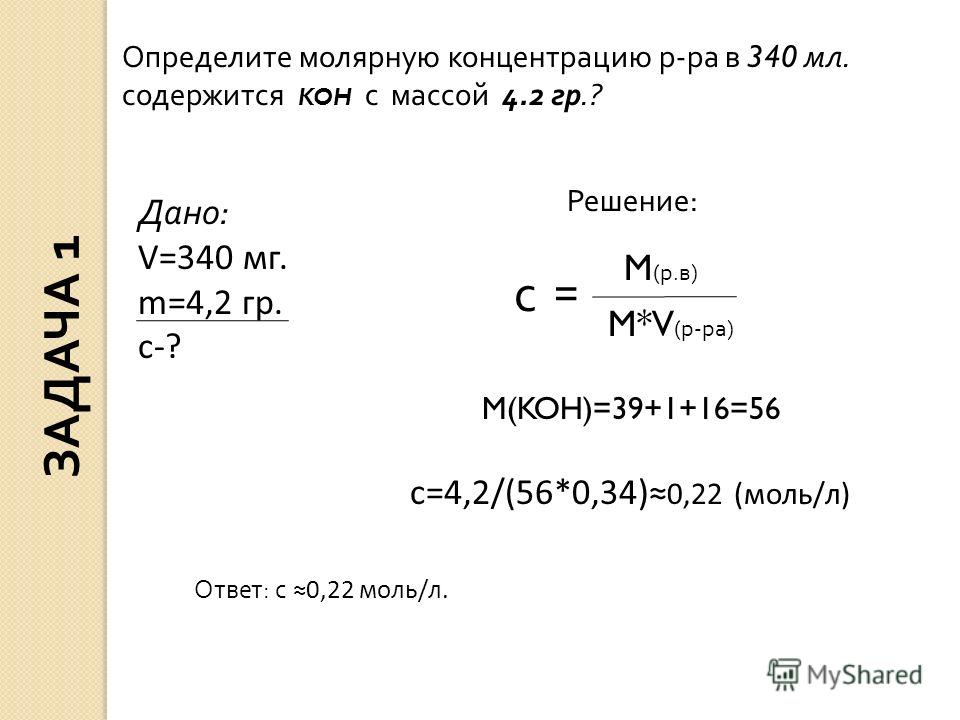 Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная):
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- — в основном, демонстрационная реакция соответствующей кислоты и основания
- — тоже демонстрационная реакция соответствующих кислоты и металла.
- — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
Природные источники и месторождения
В природе нитрат калия распространён в виде минерала нитрокалита. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом. Наиболее известные месторождения нитрата калия находятся в Индии, Боливии, Австралии, Чили, ЮАР, России, США и Шри-Ланке. Он также встречается в Китае, Мексике, и других странах
Он также встречается в Китае, Мексике, и других странах
В очень малых количествах нитрат калия содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стёкол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
Нитрат калия
Нитрат калия, азотнокислый калий (калиевая селитра, калийная селитра, индийская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Природные источники и месторождения
- 5 Применение
калиевая селитра — удобрение
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[3]:
| Растворитель / Температура, °С | 0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- 2KNO3 ⟶ 2KNO2 + O2↑
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[4]:
- Zn + 2HCl ⟶ ZnCl2 + 2H0,
- KNO3 + 2H0 ⟶ KNO2 + H2O.
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.

Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитряницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
- Ca(NO3)2 + K2CO3 ⟶ 2KNO3 + CaCO3↓
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
- Ca(NO3)2 + K2SO4 ⟶ 2KNO3 + CaSO4↓
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
- KCl + NaNO3 ⟶ KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
- KCl + NH4NO3 ⟶ KNO3 + NH4Cl
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- KOH + HNO3 ⟶ KNO3 + H2O — в основном, демонстрационная реакция соответствующей кислоты и основания
- 21K + 26HNO3 ⟶ 21KNO3 + NO↑ + N2O↑ + N2↑ + 13H2O — тоже демонстрационная реакция соответствующих кислоты и металла.

- K2O + 2HNO3 ⟶ 2KNO3 + H2O — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
- 2KOH + N2O5 ⟶ 2KNO3 + H2O
- NH4NO3 + KOH ⟶ NH3 ↑ + KNO3 + H2O
- K2CO3 + 2HNO3 ⟶ 2KNO3 + H2O + CO2↑
Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Индии. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
3.5: Формула массы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16140
- Анонимный
- LibreTexts
Цели обучения
- Для определения формулы массы ионного соединения.
Одним из навыков, необходимых в следующих главах, является умение определять массу формулы ионного соединения. Эта величина называется формулой массы. Масса формулы получается путем сложения масс каждого отдельного атома в формуле соединения. Поскольку правильная формула электрически нейтральна (без дополнительных или потерянных электронов), ионы можно рассматривать как атомы для целей расчета массы формулы.
Масса формулы получается путем сложения масс каждого отдельного атома в формуле соединения. Поскольку правильная формула электрически нейтральна (без дополнительных или потерянных электронов), ионы можно рассматривать как атомы для целей расчета массы формулы.
Начнем с вычисления формулы массы хлорида натрия (NaCl). Эта формула массы представляет собой сумму атомных масс одного атома натрия и одного атома хлора, которую мы находим из периодической таблицы; здесь мы используем массы с точностью до двух знаков после запятой:
| №: | 22,99 а.е.м. |
|---|---|
| Класс: | + 35,45 а.е.м. |
| Итого: | 58,44 а.е.м. |
Масса формулы NaCl с точностью до двух знаков после запятой составляет 58,44 а. е.м.
е.м.
Если ионное соединение имеет более одного аниона или катиона, вы должны помнить об использовании правильного кратного атомной массы рассматриваемого элемента. Чтобы получить формулу массы фторида кальция (CaF 2 ), мы должны умножить массу атома фтора на 2, чтобы учесть два атома фтора в химической формуле:
| Ca: | 1 × 40,08 | 40,08 а.е.м. |
|---|---|---|
| Факс: | 2 × 19,00 = | + 38.00 а.е.м. |
| Итого: | 78,08 а.е.м. |
Формула массы CaF 2 составляет 78,08 а.е.м.
Для ионных соединений с многоатомными ионами сумма должна включать число и массу каждого атома в формуле для многоатомного иона. Например, нитрат калия (KNO 3 ) имеет один атом калия, один атом азота и три атома кислорода:
Например, нитрат калия (KNO 3 ) имеет один атом калия, один атом азота и три атома кислорода:
| К: | 1 × 39,10 | 39.10 а.е.м. |
|---|---|---|
| Н: | 1 × 14,01 | + 14.01 а.е. |
| О: | 3 × 16,00 = | + 48.00 а.е.м. |
| Итого: | 101.11 а.е.м. |
Масса формулы KNO 3 составляет 101,11 а.е.м.
Нитрат калия является ключевым компонентом пороха и используется в качестве мочегонного средства.
Если формула содержит более одной многоатомной единицы в химической формуле, как в Ca(NO 3 ) 2 , не забудьте умножить атомную массу каждого атома в скобках на нижний индекс вне скобок. Это необходимо, потому что нижний индекс относится ко всему многоатомному иону . Так, для Ca(NO 3 ) 2 индекс 2 означает два полных нитрат-иона, поэтому мы должны просуммировать массы двух (1 × 2) атомов азота и шести (3 × 2) атомов кислорода, а также масса одного атома кальция:
Это необходимо, потому что нижний индекс относится ко всему многоатомному иону . Так, для Ca(NO 3 ) 2 индекс 2 означает два полных нитрат-иона, поэтому мы должны просуммировать массы двух (1 × 2) атомов азота и шести (3 × 2) атомов кислорода, а также масса одного атома кальция:
| Ca: | 1 × 40,08 | 40,08 а.е.м. |
|---|---|---|
| Н: | 2 × 14,01 = | + 28.02 а.е.м. |
| О: | 6 × 16,00 = | + 96.00 а.е.м. |
| Всего: | 164,10 а.е.м. |
Ключом к вычислению массы формулы ионного соединения является правильный подсчет каждого атома в формуле и соответствующее умножение атомных масс его атомов.
Периодическую таблицу можно найти по этой ссылке: Периодическая таблица элементов с атомной массой [pubchem.ncbi.nlm.nih.gov]
Пример \(\PageIndex{1}\)
Использовать атомные массы ( округлить до двух знаков после запятой ) из периодической таблицы для определения массы формулы для каждого ионного соединения.
- FeCl 3
- (NH 4 ) 3 Заказ на покупку 4
Решение
| Fe: | 55,84 а.е.м. | |
|---|---|---|
| Класс: | 3 × 35,45 = | + 106,35 а. е.м. е.м. |
| Итого: | 162,19 а.е.м. |
Масса формулы FeCl 3 составляет 162,19 а.е.м.
- Распределив индекс 3 через скобки, содержащие формулу иона аммония, мы увидим, что имеем 3 атома азота и 12 атомов водорода. Таким образом, мы устанавливаем сумму следующим образом:
| №: | 3 × 14,01 = | 42,03 а.е.м. |
|---|---|---|
| Г: | 12 × 1,01 = | + 12.12 а.е.м. |
| П: | + 30,97 а. е.м. е.м. | |
| О: | 4 × 16,00 = | + 64.00 а.е.м. |
| Итого: | 149,12 а.е.м. |
Формула массы для (NH 4 ) 3 PO 4 составляет 149,12 а.е.м.
Упражнение \(\PageIndex{1}\)
Используйте атомные массы ( округленные до двух знаков после запятой ) из периодической таблицы , чтобы определить формулу массы для каждого ионного соединения.
- TiO 2
- AgBr
- Au(№ 3 ) 3
- Fe 3 (ПО 4 ) 2
- Ответ a:
47,87 + 2 (16,00) = 79,87 а.е.м.
- Ответ б:
107,87 + 79,90 = 187,77 а.
 е.м.
е.м.- Ответ c:
196,97 + 3(14,01) + 9(16,00) = 383,00 а.е.м.
- Ответ д:
3(55,84) + 2(30,97) + 8(16,00) = 357,46 а.е.м.
Для вашего здоровья: гидраты
Некоторые ионные соединения содержат воду (\(\ce{h3O}\)) в составе их формульной единицы. Эти соединения, называемые гидратами , имеют характерное количество единиц воды, связанных с каждой формульной единицей соединения. Гидраты представляют собой твердые вещества, а не жидкости или растворы, несмотря на содержащуюся в них воду.
Чтобы написать химическую формулу гидрата, напишите количество единиц воды на формульную единицу соединения после его химической формулы. Две химические формулы разделены вертикально расположенной точкой. Гидрат сульфата меди (II) имеет пять единиц воды, связанных с каждой формульной единицей, поэтому он записывается как \(\ce{CuSO4 • 5h3O}\).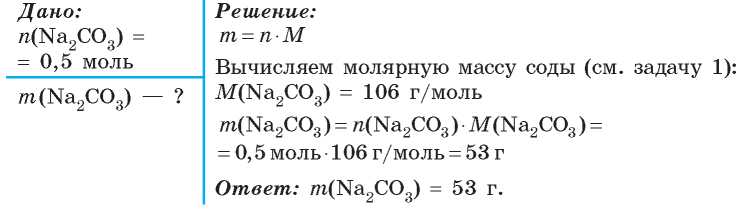 Название этого соединения — пентагидрат сульфата меди (II) с префиксом пента-, указывающим на наличие пяти единиц воды на формульную единицу сульфата меди (II).
Название этого соединения — пентагидрат сульфата меди (II) с префиксом пента-, указывающим на наличие пяти единиц воды на формульную единицу сульфата меди (II).
Гептагидрат сульфата магния. (Общественное достояние; Chemicalinterest ).
Гидраты имеют различное применение в сфере здравоохранения. Полугидрат сульфата кальция (\(\ce{CaSO4•½h3O}\)), известный как гипс, используется для изготовления слепков сломанных костей. Английская соль (\(\ce{MgSO4•7h3O}\)) используется как соль для ванн и слабительное. Гексагидрат хлорида алюминия является активным ингредиентом антиперспирантов. В сопроводительной таблице перечислены некоторые полезные гидраты.
| Формула | Имя | Использование |
|---|---|---|
| AlCl 3 •6H 2 O | алюминия хлорид гексагидрат | антиперспирант |
| CaSO 4 •½H 2 O | гемигидрат сульфата кальция (гипс) | гипсовые повязки (для сломанных костей и отливок) |
| CaSO 4 •2H 2 O | дигидрат сульфата кальция (гипс) | компонент гипсокартона |
| CoCl 2 •6H 2 O | гексагидрат хлорида кобальта(II) | осушитель, индикатор влажности |
| CuSO 4 •5H 2 О | пентагидрат сульфата меди(II) | фунгицид, альгицид, гербицид |
| MgSO 4 •7H 2 O | гептагидрат сульфата магния (английская соль) | слабительное, соль для ванн |
| Na 2 CO 3 •10H 2 O | декагидрат карбоната натрия (стиральная сода) | добавка для стирки/очиститель. КЛЮЧЕВОЙ ВЫВОД КЛЮЧЕВОЙ ВЫВОД |
ОСНОВНЫЕ СВЕДЕНИЯ
- Массы формул ионных соединений можно определить по массам атомов в их формулах.
УПРАЖНЕНИЯ
- Какая связь между атомной массой и формулой массы?
2. Как используются нижние индексы для определения массы формулы, если в химической формуле присутствует более одного многоатомного иона?
3. Какова формула массы ионного соединения, образованного каждой парой ионов?
- Na + и Br −
- Mg 2 + и Br −
- Mg 2 + и S 2−
4. Какова формула массы ионного соединения, образованного каждой парой ионов?
- К + и Кл —
- Mg 2 + и Cl −
- Mg 2 + и Se 2 −
5. Какова формула массы ионного соединения, образованного каждой парой ионов?
Какова формула массы ионного соединения, образованного каждой парой ионов?
- Na + и N 3−
- Mg 2 + и N 3−
- Al 3 + и S 2−
6. Какова формула массы ионного соединения, образованного каждой парой ионов?
- Li + и N 3−
- Мг 2 + и Р 3−
- Li + и P 3−
7. Какова формула массы для каждого соединения?
- FeBr 3
- FeBr 2
- Золото 2 С 3
- Золото 2 С
8. Какова формула массы для каждого соединения?
- Кр 2 О 3
- CrO
- PbCl 2
- PbCl 4
9. Какова формула массы для каждого соединения?
Какова формула массы для каждого соединения?
- Cr(№ 3 ) 3
- Fe 3 (ПО 4 ) 2
- CaCrO 4
- Ал(ОН) 3
10. Какова формула массы для каждого соединения?
- NH 4 НЕТ 3
- К 2 Кр 2 О 7
- Cu 2 CO 3
- NaHCO 3
11. Какова формула массы для каждого соединения?
- Al(HSO 4 ) 3
- мг(HSO 4 ) 2
12. Какова формула массы для каждого соединения?
- Co(HCO 3 ) 2
- LiHCO 3
Ответы
- Масса формулы представляет собой сумму атомных масс атомов в формуле.
- Нижний индекс распределяется по скобкам для определения общего количества атомов в формуле.

3.
- 102,89 а.е.м.
- 184,11 а.е.м.
- 56,38 а.е.м.
4.
- 74,55 а.е.м.
- 95,21 а.е.м.
- 103,28 а.е.м.
5.
- 82,98 а.е.м.
- 100,95 а.е.м.
- 150,17 а.е.м.
6.
- 35,01 а.е.м.
- 134,87 а.е.м.
- 51,79 а.е.м.
7.
- 295,55 а.е.м.
- 215,65 а.е.м.
- 490,15 а.е.м.
- 426.01 а.е.м.
8.
- 152,00 а.е.м.
- 68.00 а.е.м.
- 278,10 а.е.м.
- 349,00 а.е.м.
9.
- 238,03 а.е.м.
- 357,49 а.е.м.
- 156,08 а.е.м.
- 78,01 а.е.м.
10.
- 80,06 а.е.м.
- 294,20 а.е.
 м.
м. - 187,11 а.е.м.
- 84,01 а.е.м.
11.
- 318,22 а.е.м.
- 218,47 а.е.м.
12.
- 180,97 а.е.м.
- 67,96 а.е.м.
Эта страница под названием 3.5: Formula Mass распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Теги
- source@https://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological
Молярная масса kno3
Нахождение атомной массы kno3
Нужно узнать атомную массу молекулы kno3? Наш калькулятор молекулярной массы использует периодическую таблицу и химическую формулу для решения молярная масса химического соединения на основе эмпирической формулы соединения. Калькулятор берет элементный состав соединения и взвешивает элементы, чтобы получить эмпирическая формула массы. Обратите внимание, что калькулятор предполагает чистое вещество — если вы зная о разбавлении или примесях, сделайте соответствующие поправки на молярность данного вещества.
Этот проект начался с калькулятора молекулярной массы для химических реакций. Вы можете использовать наш калькулятор, чтобы решить для
теоретический выход эксперимента. У нас также есть
калькулятор процента выхода, который может помочь вам применить это к реальным экспериментам.
Используйте молярное отношение и эмпирическую формулу, чтобы понять пределы реагентов.
У нас также есть
калькулятор процента выхода, который может помочь вам применить это к реальным экспериментам.
Используйте молярное отношение и эмпирическую формулу, чтобы понять пределы реагентов.
Другие термины: атомная масса kno3, молярная масса kno3, молекулярная масса,
Как работает калькулятор молярной массы?
Берем предоставленную вами формулу (NaCl — поваренная соль — в нашем примере по умолчанию) и распаковываем ее на составные элементы. Тогда мы сравнить каждый атом с таблицей стандартных атомных весов для этого элемента. Мы представляем результаты в таблице внизу калькулятор молярной массы — он покажет количество атомов, атомный вес каждого элемента и молекулярный вес молекулы. Он определяет общую массу молекулярной формулы (средняя молекулярная масса).
Отсюда разбиваем формулу kno3 на части — и т.д.
Мы еще не реализовали скобки (пока), поэтому вам нужно будет распаковать все выражения в скобках. На вес они никак не влияют.
Просто возьмите каждый элемент и умножьте его на количество раз, когда структура в квадратных скобках встречается. Например:
(C 6 H 5 ) 3 PCCO => C18h25PCCO
Например:
(C 6 H 5 ) 3 PCCO => C18h25PCCO
Определение молярной массы других химических соединений
Наш калькулятор молекулярной массы имеет это для множества других соединений: хлорида натрия, углекислый газ, серная кислота, глюкоза…
- Молярная масса воды (h3O)
- Молярная масса гидроксида аммония (Al(OH)3)
- Молярная масса фосфата аммония ((Nh5)3PO4)
- Молярная масса субсалицилата висмута (C7H5BiO4)
- 0 Молярная Масса гидроксида кальция (Ca(OH)2)
- Молярная масса карборунда (SiC)
- Молярная масса соляной кислоты (HCl)
- Молярная масса фосфорной кислоты (h4PO4)
- Молярная масса хлорида аммония (Nh5Cl)
- Молярная масса разрыхлителя (NaHCO3)
- Молярная масса сахарозы (C12h32O11)
- Молярная масса изопропилового спирта ((Ch4)2CHOH)
- Молярная масса монооксида углерода (CO)
- Молярная масса хлорида сурьмы — 3 (SbCl3)
- Молярная масса хлорплатина кислота (h3PtCl6)
- Молярная масса молочной кислоты (C3H6O3)
- Молярная масса сульфата ртути (HgSO4)
- Молярная масса бромата калия (KBrO3)
- Молярная масса тиоцианата калия (KCNS) Молярная масса натрия
- 0 хромат (Na2CrO4)
- Молярная масса тартрата калия натрия (NAKC4H5O6)
- Молярная масса тиореа (CH5N2S)
- Молярная масса киньнабара (HGS)
- Молярная масса аммиа (NH4)
- Molar Moral Molar Ammonium bicarbonate (NH4)
- Molar Molar Ammonium Bicarbonate (NH4)
- Molar Molar Bicarbonate (NH4)
- Molar Bicarbonate (NH4)
- Molar Ammonium bicarbonate (NH4)
- Ammonium bicarbonate (NH4)
- .
 Молярная масса ацетона ((CH3)₂CO)
Молярная масса ацетона ((CH3)₂CO) - Молярная масса фосфата алюминия (AlPO4)
- Молярная масса дубильной кислоты (C76H52O46)
- Молярная масса цитрата натрия (AgC2h4O2)
- Молярная масса карбоната аммония ((Nh5) )2CO3)
- Молярная масса гипохлорита калия (KClO)
- Молярная масса нитрида натрия (Na3N)
- Молярная масса винной кислоты (C4H6O6)
- Молярная масса тетрафторбората серебра (AgBF4)
- Молярная масса нитрида натрия (AgCNOful)
- Молярная масса хлорида золота (AuCl)
- Молярная масса триселенида золота (Au2Se3)
- Молярная масса диметилкадмия (C2H6Cd)
- Молярная масса пропан-1-ола (C3H8O)
- Al Молярная масса алюминия ( )
- Молярная масса аргона (Ar)
- Молярная масса лития (Li)
- Молярная масса пентадекана (C15h42)
- Молярная масса триаконтана (C30H62)
- Молярная масса циклогексана (C6h20) 9 Молярная масса циклогексана (C6h20) 9 Метиламин (MeNh3)
- Молярная масса азота серы (NS)
- Молярная масса оксида кремния (SiO)
- Молярная масса формальдегида (h3CO)
- Молярная масса изотиоциановой кислоты (HNCS)
- Молярная масса гидроксида Ces (CsOH)
- Молярная масса фтороборной кислоты (HBF4)
- Молярная масса дурена (C10h24)
- Молярная масса пикриновой кислоты ((O2N)3C6h3OH)
Создание закладок, сохранение и публикация результатов
может переключаться между различными частями набора задач. Мы рекомендуем вам добавить его в закладки, чтобы вы могли вернуться к нему .
Вы также можете поделиться результатами с партнером по обучению или преподавателем , нажав «Рассчитать» и скопировав URL-адрес этой страницы. Когда ваш партнер по учебе
открывает URL-адрес, они увидят ваши расчеты. Это легко поделиться и сохранить результаты по электронной почте. (Однако обязательно сначала нажмите «Вычислить»)
Мы рекомендуем вам добавить его в закладки, чтобы вы могли вернуться к нему .
Вы также можете поделиться результатами с партнером по обучению или преподавателем , нажав «Рассчитать» и скопировав URL-адрес этой страницы. Когда ваш партнер по учебе
открывает URL-адрес, они увидят ваши расчеты. Это легко поделиться и сохранить результаты по электронной почте. (Однако обязательно сначала нажмите «Вычислить»)
У вас также есть возможность сохранить ссылки на расчеты в файлах ваших научных заметок, чтобы вы могли быстро открыть их или проверить позже. Опять же — сначала нажмите «Рассчитать», чтобы URL-адрес обновлялся с учетом ваших последних изменений. Затем скопируйте и сохраните URL-адрес.
FAQ — Калькулятор молярной массы
Что такое молярная масса в химии?
Молярная масса является важным понятием при адаптации химических формул к реальным условиям. Мы можем сбалансировать химическое уравнение
и определите, что одна молекула водорода соединяется с двумя молекулами кислорода, образуя воду (или соединение по вашему выбору). Но как бы ты
подготовить материалы в лаборатории? Или если бы вы, например, покупали кислород для процесса, как бы вы определили, сколько его нужно использовать?
сделать заданное количество воды? Молярная масса позволяет нам преобразовать химическую реакцию в определенные количества реагентов, необходимых для
процесс. Преобразовав взаимодействие атомов в граммы, мы можем измерить и использовать соответствующее количество необходимых реагентов. Формула массы помогает нам решить эту проблему.
Но как бы ты
подготовить материалы в лаборатории? Или если бы вы, например, покупали кислород для процесса, как бы вы определили, сколько его нужно использовать?
сделать заданное количество воды? Молярная масса позволяет нам преобразовать химическую реакцию в определенные количества реагентов, необходимых для
процесс. Преобразовав взаимодействие атомов в граммы, мы можем измерить и использовать соответствующее количество необходимых реагентов. Формула массы помогает нам решить эту проблему.
Что такое относительная атомная масса/относительная молекулярная масса/средний молекулярный вес?
Относительная атомная масса соединения представляет собой отношение средней массы элементов в химическом соединении к
атомная постоянная массы, которая определяется как 1/12 массы атома углерода 12. Для одного образца относительная атомная
Масса образца представляет собой взвешенное среднее арифметическое масс отдельных атомов, присутствующих в образце (также
называется средней атомной массой). Это зависит от изотопа элемента (например, углерод-12 или углерод-13,
поскольку два изотопа имеют разную атомную массу из-за дополнительных нейтронов). в
В реальном мире это может варьироваться в зависимости от того, где был собран образец — из-за различий в конкретных изотопах
присутствующие элементы (обусловленные различиями в радиоактивном распаде и тем, как материал был агрегирован с самого начала).
Это зависит от изотопа элемента (например, углерод-12 или углерод-13,
поскольку два изотопа имеют разную атомную массу из-за дополнительных нейтронов). в
В реальном мире это может варьироваться в зависимости от того, где был собран образец — из-за различий в конкретных изотопах
присутствующие элементы (обусловленные различиями в радиоактивном распаде и тем, как материал был агрегирован с самого начала).
Как найти молярную массу
Возьмите стандартную химическую формулу молекулы, разделите ее на составные атомы и найдите молярную массу каждого атома. Добавьте вес атомов в молекуле, и вы получите молярную массу молекулы.
Содержание: калькулятор теоретического выхода
Performance Ingenuity
Copyright 2020. политика конфиденциальности
Формула нитрата калия – структура, свойства, применение, примеры вопросов
Калий – это химический элемент с символом K . Его атомный номер 19с электронной конфигурацией 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 . Это четвертый период и элемент первой группы периодической таблицы. это наиболее важно для роста растений. Калий больше всего используется в хлориде калия (KCL), и он используется при изготовлении удобрений. Азот — это химический элемент с символом N. Его атомный номер равен 7, а электронная конфигурация — 1s 2 2s 2 2p 3 . Это бесцветный элемент без запаха и вкуса. Азот является самым распространенным элементом в атмосфере Земли, примерно 78% атмосферы составляет азот. Кислород — химический элемент с символом O. Его атомный номер 8 с электронной конфигурацией 1s 2 2s 2 2p 4 . Он относится к группе древесных углей периодической таблицы. Это очень реактивный неметалл и самый распространенный элемент на Земле. Он в основном используется в производстве пластмасс, стали и стекла.
Это четвертый период и элемент первой группы периодической таблицы. это наиболее важно для роста растений. Калий больше всего используется в хлориде калия (KCL), и он используется при изготовлении удобрений. Азот — это химический элемент с символом N. Его атомный номер равен 7, а электронная конфигурация — 1s 2 2s 2 2p 3 . Это бесцветный элемент без запаха и вкуса. Азот является самым распространенным элементом в атмосфере Земли, примерно 78% атмосферы составляет азот. Кислород — химический элемент с символом O. Его атомный номер 8 с электронной конфигурацией 1s 2 2s 2 2p 4 . Он относится к группе древесных углей периодической таблицы. Это очень реактивный неметалл и самый распространенный элемент на Земле. Он в основном используется в производстве пластмасс, стали и стекла.
Формула нитрата калия
Нитрат калия представляет собой химическое соединение с химической формулой KNO 3 . Он также известен как селитра или селитра, представляет собой химическое соединение, состоящее из калия, азота и кислорода. Нитрат калия представляет собой белое кристаллическое соединение. Это сильный окислитель. Используется в удобрениях как источник азота и калия. Нитрат калия умеренно растворим в воде, но его растворимость увеличивается с повышением температуры. В 1270 году сирийский химик Хасан аль-Рамма описал процесс очистки для получения очищенного нитрата калия из селитры.
Он также известен как селитра или селитра, представляет собой химическое соединение, состоящее из калия, азота и кислорода. Нитрат калия представляет собой белое кристаллическое соединение. Это сильный окислитель. Используется в удобрениях как источник азота и калия. Нитрат калия умеренно растворим в воде, но его растворимость увеличивается с повышением температуры. В 1270 году сирийский химик Хасан аль-Рамма описал процесс очистки для получения очищенного нитрата калия из селитры.
Структура азотнокислого калия
Физические свойства нитрата калия Химические свойства нитрата калия Использование нитрата калия Вопрос 1: Как бы вы отделили йодид свинца от нитрата калия? Ответ: Йодид калия и нитрат свинца добавляют к противоположным сторонам чашки Петри, содержащей воду. Оба ионных соединения разделятся на отдельные ионы. Как только ионы разделены, они гидратируются водой в чашке Петри, что позволяет им переноситься в растворе. Вопрос 2: Почему калий электрически нейтрален? Ответ: Положительно заряженные протоны притягивают отрицательно заряженные электроны, а отрицательно заряженные электроны отталкивают друг друга. атом нейтрален. Вопрос 3: Как нитрат калия используется в качестве удобрения? Ответ: Нитрат калия используется в удобрениях как источник азота и калия. Вопрос 4: Как азот может попасть в почву? Ответ: В результате разложения растений и животных в почву добавляется азот. Затем бактерии, присутствующие в самой почве, преобразуют азот для использования растениями. Позже растения растут, используя мало азота. Опять же, люди едят те же растения, добавляя азот, а затем возвращая его в почву, следовательно, цикл продолжается. Вопрос 5: Каковы факты о кислороде? Ответ: Животные и растения нуждаются в кислороде для дыхания. Фотосинтез растений управляет кислородным циклом. Газообразный кислород необходим для жизни, слишком много его может быть токсичным.

Примеры вопросов
 Азот и калий являются макроэлементами для растений. Внесение калийной селитры в почву производится перед вегетационным периодом. Разбавленный раствор иногда опрыскивают растения для имитации физиологических процессов или для преодоления дефицита питательных веществ.
Азот и калий являются макроэлементами для растений. Внесение калийной селитры в почву производится перед вегетационным периодом. Разбавленный раствор иногда опрыскивают растения для имитации физиологических процессов или для преодоления дефицита питательных веществ.



 е.м.
е.м.
 м.
м.
 Молярная масса ацетона ((CH3)₂CO)
Молярная масса ацетона ((CH3)₂CO)