Гидроксид алюминия цена | ТНМК
Описание
Гидроксид алюминия представляет собой химическое соединение, которое встречается в природе и входит в состав бокситов.
Свойства гидроксида алюминия
Плотность вещества составляет 2,42 г/см3, а температура плавления равна 300 градусов Цельсия. Это аморфный порошок белого цвета, нерастворимый в воде. Однако он растворим в кислых и щелочных растворах. Молярная масса гидроксида алюминия составляет 78,0036 г/моль.
Вещество, которое необходимо использовать в коммерческих целях, изготавливается по специальной технологии. Процесс включает растворение боксита в растворе гидроксида натрия при температуре +270 градусов Цельсия.
После завершения процедуры производится удаление отходов и остается раствор алюмината натрия для осаждения. Минерал, полученный в результате проведения операции, называется гидроксидом алюминия.
Структура вещества
Формула гидроксида алюминия — Alh4О3. Типичная структура соединения состоит из связей водорода и двойных покрытий ионов металла и гидроксильных групп. Амфотерный гиббсит работает в форме основы для получения определенной соли путем улавливания водородных кислот и их нейтрализации. Гидроксида алюминия реакция следует за процедурой, которая заключается в следующем: 3 HCl + Al (OH)3 — AlCl3 + 3 h3O.
Амфотерный гиббсит работает в форме основы для получения определенной соли путем улавливания водородных кислот и их нейтрализации. Гидроксида алюминия реакция следует за процедурой, которая заключается в следующем: 3 HCl + Al (OH)3 — AlCl3 + 3 h3O.
Подготовительные мероприятия
Нет необходимости готовить вещество, так как оно присутствует в огромном количестве в различных геологических системах. Гидроксид алюминия производится с использованием методов спекания для получения глинозема из минерального боксита. Таким образом, 97 процентов соединения, встречающегося в мире, образуется в результате обработки каустической соды и бокситов. В результате процесса получается алюминат натрия, который далее разлагается с использованием процедуры перемешивания для получения рассматриваемого продукта.
Существуют и другие методы, также используемые для получения вещества, и они включают микроэмульсионные и гидротермальные способы. Использование этих технологий может помочь в получении продукта с более высоким уровнем чистоты.
Сфера использования вещества
Применение гидроксида алюминия весьма обширно. Фармацевтическое и химическое использование соединения включает:
- Добавки в различные вакцины;
- Антацид для лечения язв и гастритов.
Раствор гидроксида алюминия также используется в виде вспомогательного вещества в процессе производства некоторых лекарственных средств.
В промышленности наиболее часто он применяется в виде сырья при производстве оксида алюминия или глинозема, что в дальнейшем помогает в производстве чистого металла. Продукт необходим в качестве наполнителя в различных косметических средствах. Также он требуется при изготовлении стекла и водостойких тканей.
Купить товар в нашей компании можно без посредников. Цена вещества у нас выгодна для любого клиента. Для получения дополнительной информации о товаре свяжитесь с менеджером по указанному номеру. Он поможет с оформлением заказа, рассчитает итоговую стоимость и организует доставку в любой регион страны.
Как найти массу из молей и молярной массы: подробные пояснения —
В этой статье мы собираемся проанализировать, как найти массу из молей и молярной массы.
Найти массу из молей и молярной массы очень просто. Это можно сделать, используя приведенное ниже соотношение:
Где,
как найти массу из молей и молярной массыn = количество молей (моль)
m = масса в граммах (г)
M = молярная масса (г/моль)
Мы можем лучше понять это, решив несколько примеров:
Как найти массу из молей и молярной массы Примеры:1. Рассчитайте массу О2, если молярная масса равна 10.2 моль.Решение:
Молярная масса = O2 = 16×2 = 32 г/моль
n = 10.2 моль
m = n × M = 10.2 моль × 32 г/моль = 326.4 г
2. На пляже XYZ в песке много минералов. SiO2 был одним из них, который был оценен, и у него было 12. 5 молей, так какова масса SiO2 ?Изображение кредита: Wikimedia Commons
5 молей, так какова масса SiO2 ?Изображение кредита: Wikimedia CommonsРешение:
Молярная масса = SiO2 = 28 + 16×2 = 60 г.
n = 12.5 моль
m = n × M = 12.5 моль × 60 г/моль = 750 г
3. Рассчитайте массу 7.86 моль Хлорид кальция?Решение:
Мы знаем, что формула хлорида кальция CaCl2.
Молярная масса = CaCl2 = 40 + 35.45×2 = 110.90 г/моль
n = 7.86 моль
m = n × M = 7.86 моль × 110.90 г/моль = 871.674 г
4. Студент в лаборатории приготовил 6.8 моль KNO3 и использовал его для титрования, поэтому для проведения расчетов какова будет его масса?Решение:
Молярная масса = KNO3 = 39 + 14 + 3×16 = 110 г/моль
n = 6.8 моль
m = n×M = 6.8 моль × 110 г/моль = 748 г
5. Рассчитайте массу FeCl3 с числом молей, равным 5.7 моля.Решение:
Молярная масса = FeCl3 = 55.845 +35.453×3 = 162.204 г/моль
n = 5.7 моль
m = n × M = 5. 7 × 162.204 = 924.562 г
7 × 162.204 = 924.562 г
Решение:
Молярная масса = BaSO4 = 137.33 + 32.06 + 64 = 233.39 г/моль
n = 2.7 моль
м = п × М = 2.7 × 233.39 = 630.153 г
7. Рассчитайте массу 3.98 моль хлорида стронция.Решение:
Молярная масса = SrCl2 = 87.62 + 35.453 + 35.453 = 158.52 г/моль.
n = 3.98 моль
м = п × М = 3.98 × 158.52 = 630.90 г
8. Рассчитайте массу 4.32 моля фосфата аммония.Решение:
Молярная масса = (Nh5)3PO4 = 14.01 × 3 + 12 + 30.97 + 16 = 149.12 г/моль.
n = 4.32 моль
м = п × М = 4.32 × 149.12 = 644.198 г
9. Рассчитайте массу 3.7 молей нитрата магния.Решение:
Молярная масса = Mg(NO3)2 = 24 + 2×14 + 6×16 = 148 г/моль
n = 3.7 моль
м = п × М = 3.7 × 148 = 547.6 г
10.Рассчитайте массу 4.24 моль гидроксида алюминия.Решение:
Молярная масса = Al(OH)3 = 27 + 16×3 + 3 = 78 г/моль
n = 4. 24 моль
24 моль
m = n × M = 4.24 × 78 = 330.72 г
11. Рассчитайте массу 1.49 моль йодида свинца (II).Решение:
Молярная масса = PbI2 = 207.2 + 253.80 = 461 г/моль
n = 1.49 моль
m = n × M = 1.49 × 461 = 686.89 г
12. Рассчитайте массу 5.34 молей карбоната магния.Решение:
Молярная масса = МгСО3 = 24 +12 + 16×3 =84 г/моль
n = 5.34 моль
m = n×M = 5.34 + 84 = 448.56 г
13.Рассчитайте массу 6.136 молей мышьяковой кислоты.Решение:
Молярная масса = h4AsO4 = 3 + 74.9 + 3×16 = 141.9 г/моль
n = 6.136 моль
m = n × M = 6.136 × 141.9 = 870.69 г
14. Рассчитайте массу 4.59 моль карбоната лития.Молярная масса = Li2CO3 = 13.88 + 12 + 3×16 = 73.89 г/моль
n = 4.59 моль
m = n × M = 4.59 × 73.89 = 339.15 г
15. Рассчитайте массу 4.999 молей бытового отбеливателя.Решение:
Молярная масса = NaOCl = 23 + 16 + 35. 4 = 74.4 г/моль
4 = 74.4 г/моль
n = 4.999 моль
m = n × M = 4.99 × 74.4 = 371.92 г
16. Рассчитайте массу 2.156 моль дихромата калия.Решение:
Молярная масса = K2Cr2O7 = 78 + 104 + 112 = 294 г/моль
n = 2.156 моль
m = n × M = 2.156 × 294 = 633.96 г
Изображение кредита: ВикипедияУзнайте больше о: Как Чтобы найти молярную массу из молярности: подробное объяснение
Как рассчитать молярную массу без массы ?Обычно наиболее распространенным методом нахождения молярной массы является использование формулы M = m/n, которая подробно обсуждалась в предыдущем разделе.
Используя метод коллигативных свойств, мы можем вычислить молярную массу, не вдаваясь в картину. Давайте проанализируем, как в следующем разделе:
Бензол используется для растворения вещества (неизвестного вещества, молярная масса которого должна быть оценена) и доводится до 1. 55 % (% массы неизвестной смеси к бензолу). Температура кипения бензола повышается примерно на 2.3%.
55 % (% массы неизвестной смеси к бензолу). Температура кипения бензола повышается примерно на 2.3%.
Учитывая коллигативные свойства:
Фактическая температура кипения бензола = 80 градусов по Цельсию.
ΔT = изменение температура кипения (1.84 градуса) 80×0.023
I = Вант-Гофф (коэффициент), для бензола считается быть одним, поскольку это не электролит.
m = моляльность
K = константа для бензола (точка кипения) составляет около 2.53.
Теперь,
= 1.84/1× 2.53
m = 0.728 моль (неизвестно)/кг бензола
Мы взяли смесь 1.55%.
Таким образом, на 1.55 г раствора приходится 1.55% массы, что означает 100 г неизвестного вещества.
Следовательно, неизвестная молярная масса будет отношением:
Молярная масса = рассчитанная из бензольного метода/ 0.728 моль
Эквивалентный вес $Al{(OH)_3}$: A.
 78Б. 39С. 26Д. 35
78Б. 39С. 26Д. 35Последняя обновленная Дата: 27 февраля 2023
•
Общее представление: 251,1K
•
Просмотры сегодня: 2,35K
Ответ
Проверено
251,1K+ виды
HINT:
20202020202020202020202 рассчитывается путем деления атомной массы или молекулярной массы соединения на значение его основности, валентности или кислотности. Валентность – это объединяющая способность атома. Валентность алюминия 3,9.0003
Полный ответ: Дано,
Эквивалентный вес определяется как масса в граммах, которая по химическому составу равна восьми граммам кислорода или одному грамму водорода. Эквивалентная масса равна атомной массе или молекулярной массе, деленной на валентность или кислотность.
Кислотность основания определяется как количество замещаемых гидроксид-ионов, присутствующих в соединении.
Ниже приведена формула расчета эквивалентного веса.
$E.W = \dfrac{M}{A}$
Где
E.W — эквивалентный вес.
М — молекулярная масса соединения.
А – кислотность основания.
Данное соединение представляет собой гидроксид алюминия $Al{(OH)_3}$.
Молекулярная масса гидроксида алюминия рассчитывается как сумма атомных масс отдельных атомов, умноженная на количество атомов.
Атомный номер алюминия 26,98, атомный номер кислорода 15,99 и атомный вес водорода 1.
Молекулярная масса гидроксида алюминия рассчитывается, как показано ниже.
$M = 26,98 + (15,99 + 1,00) \times 3$
$M = 78,003 г/моль$
Таким образом, молекулярная масса гидроксида алюминия равна 78,003 г/моль.
В $Al{(OH)_3}$ присутствуют три заменяемых атома гидроксида. Следовательно, значение кислотности равно 3.
Чтобы рассчитать эквивалентную массу гидроксида алюминия, подставьте в уравнение значение молекулярной массы и кислотности.
$\Rightarrow E.W = \dfrac{{78г/моль}}{3}$
$\Rightarrow E.W = 26$
Таким образом, эквивалентная масса гидроксида алюминия $Al{(OH)_3}$ равна 26,
Следовательно, правильным вариантом является C.
Примечание: Основность используется для кислого соединения, которое обозначает число замещаемых ионов водорода, присутствующих в соединении. Основность, кислотность и валентность — разные термины, но значения схожи.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Какой из следующих элементов имеет самый высокий электродный потенциал 12-го класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 12-го класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11-го класса химии JEE_Main
Получен фосфин из следующей руды А Кальций класс 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класс 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Какой из следующих элементов имеет самый высокий электродный потенциал 12-го класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 12-го класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11-го класса химии JEE_Main
Получен фосфин из следующей руды A Кальций класс 12 химия JEE_Main
Тенденции сомнений
ICSC 0373 — ГИДРОКСИД АЛЮМИНИЯ
ICSC 0373 — ГИДРОКСИД АЛЮМИНИЯ« вернуться к списку результатов поиска
Китайский — ZHАнглийский — ENФинский — FIFФранцузский — FRНемецкий — DEИврит — HEВенгерский — HUIИтальянский — ITЯпонский — JAKКорейский — KOPперсидский — FAПольский — PLПортугальский — PTРусский — RUSиспанский — ES
| ГИДРОКСИД АЛЮМИНИЯ | ICSC: 0373 (март 1998 г. ) ) |
| Глинозем гидрат Оксид алюминия тригидрат Тригидроксиалюминий | |
| Номер CAS: 21645-51-2 |
| Номер ЕС: 244-492-7 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючий. | В случае возгорания поблизости используйте соответствующие средства пожаротушения. |
| ПРЕДОТВРАТИТЬ РАССЕЯНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Используйте местную вытяжку.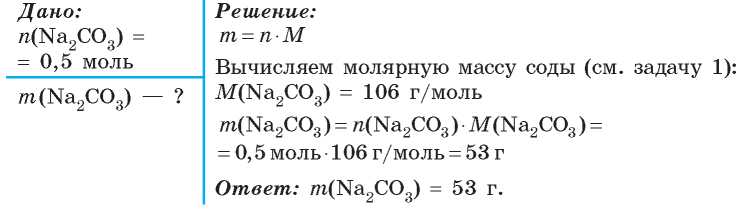 | Свежий воздух, отдых. | |
| Кожа | Защитные перчатки. | Промойте кожу большим количеством воды или под душем. | |
| Глаза | Наденьте защитные очки. | Сначала промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно), затем обратиться за медицинской помощью. | |
| Проглатывание | Прополоскать рот. Отдых. | ||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Смести просыпанное вещество в закрытые контейнеры. Смойте остатки большим количеством воды. | В соответствии с критериями СГС ООН Транспорт |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
| ГИДРОКСИД АЛЮМИНИЯ | КМГС: 0373 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: AlH 3 O 3 / Al(OH) 3 |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
TLV: (вдыхаемая фракция): 1 мг/м 3 , как TWA; A4 (не классифицируется как канцероген для человека). МАК: (вдыхаемая фракция): 4 мг/м 3 ; (вдыхаемая фракция): 1,5 мг/м 3 ; группа риска по беременности: D |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Указана кажущаяся температура плавления, вызванная потерей кристаллической воды. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС |


