Формула соли анализа молекулярная масса сульфата алюминия
Главная Каталог Продукции Химическая Промышленность Неорганическая Соль Другие Неорганические Соли
Описание Товара
Информация о Компании
Описание Товара
Мы Производство сульфата алюминия (CAS №10043-01-3) с 1972 года. Мы Проявим нашей собственной электроэнергией и нашего собственного производства серной кислоты, поэтому цена лучше. Наша производственная мощность — 80000 т/год, срок поставки будет кратким и продуктов могут быть поставлены, непосредственно со склада.
Здесь — технические характеристики сульфата алюминия:
| Чистоты | ≥98% |
| Al2O3 | ≥15, 8% Или 16% Или 17% |
| Из черных металлов (Fe) | ≤0, 005% |
| Неразрешимой | ≤0, 1% |
| Фаза 1% Воды Sloution) | ≥3, 0 |
| Apperance | Чешуйчатый, порошок, гранулированных, системы паушальных выплат |
Добро пожаловать в контакт с нами
Once receive your question, the supplier will answer you as soon as possible.
Отправить ваш запрос напрямую данному поставщику
Горячие Поиски
Больше
1. Характеристика сульфата алюминия. Производство сульфата алюминия из гидроксида алюминия и серной кислоты
Производство сульфата алюминия из гидроксида алюминия и серной кислоты
курсовая работа
Химический состав сульфата алюминия выражается формулой Al2(SО4)3 (молекулярная масса М=342 ). По физико-химическим показателям продукт должен соответствовать требованиям и нормам ГОСТ 12966-85 с изм. № 1,2 «Алюминия сульфат технический очищенный».
Безводный сульфат алюминия представляет собой белые кристаллы. Из водного раствора кристаллизуется Al2(SО4)3 * nО, где n=14-18, представляя собой бесцветные кристаллы. Сульфат алюминия выпускается в форме кусков массой до 10 кг или чешуек с содержанием от 14 до 16.
В небольших количествах сульфат алюминия поставляется в виде раствора, содержащего от 6,7 до 7,7 % мас. Аl2О3, а также в виде очищенного продукта, представляющего собой смесь сульфат алюминия и нерастворимого остатка, преимущественно диоксида кремния. При содержании в продукте менее 15% мас. Аl2О3 наблюдается слеживание, что приводит к незначительным затруднениям при его использовании. Требования к химическому составу технического сернокислого алюминия регламентировано стандартами и представлено в таблице 1
Таблица 1.1 — Требования к химическому составу технического сульфата алюминия
Наименование показателя | Сорт | |||
высшего | Первого | второго | ||
1. Внешний вид | Однородный сыпучий материал с размером частиц не более 20 мм белого цвета | Неслеживающиеся пластинки, брикеты, куски неопределенной формы и разного размера массой не более 10 кг белого цвета | ||
1. | Допускаются бледные оттенки серого, голубого или розового цветов | |||
2. Массовая доля оксида алюминия, % | 16 | 16 | 15 | |
Наименование показателя | Сорт | |||
высшего | Первого | второго | ||
3. Массовая доля железа в пересчете на оксид железа (III), %, не более | 0,02 | 0,02 | 0,30 | |
4. Массовая доля свободной серной кислоты (H2SO4), %, не более | — | — | 0,1 | |
5. Массовая доля мышьяка в пересчете на оксид мышьяка (III), %, не более | 0,001 | 0,001 | 0,003 |
Хранят сульфат алюминия насыпью или в мешках в складских помещениях с твердым напольным покрытием либо в бункерах. Срок хранения продукта не ограничен.
Срок хранения продукта не ограничен.
Транспортируют сульфат алюминия насыпью в крытых железнодорожных вагонах и автомобилях. Упакованный в контейнеры и мешки сульфат алюминия можно транспортировать всеми видами транспорта, кроме самолетов. Продукт, упакованный в контейнеры, допускается транспортировать открытым подвижным составом.
Делись добром 😉
Алюминий и основные его соединения
Глава I. Свойства алюминия
…
Алюминий и основные его соединения
2.1. Оксиды алюминия
Оксид алюминия образует несколько полиморфных разновидностей, или форм, имеющих одинаковый химический состав, различное строение кристаллической решетки и, следовательно, различные свойства…
Алюминий и основные его соединения
2.2. Гидроксиды алюминия
Существует несколько разновидностей гидроксидов алюминия: диаспор, бемит, гиббсит, байерит, норстрандит.
Диаспор и бемит Al2O3*Н2О или AlO(OH) — полиморфные разновидности одноводного оксида алюминия, встречаются в природе в составе бокситов. ..
..
Анодная обработка алюминия (анодирование, полирование, эматалирование). Применение в полиграфии
3. Анодирование алюминия
Анодирование сплавов — электрохимический процесс получения защитного или декоративного покрытия на поверхности различных сплавов (алюминиевых, магниевых, титановых). Например…
Анодная обработка алюминия (анодирование, полирование, эматалирование). Применение в полиграфии
Анодирование алюминия:
Наибольшее распространение для анодирования алюминиевых деталей получил сернокислый процесс. Алюминиевую деталь и свинцовый катод помещают в охлаждаемую ванну с раствором серной кислоты (плотность 200—300 г/л)…
Анодная обработка алюминия (анодирование, полирование, эматалирование). Применение в полиграфии
5. Полирование алюминия
Для полирования алюминия и некоторых его сплавов применяют электролиты на основе фосфорной кислоты и щелочные фосфатные электролиты. В кислых растворах процесс идет при значительно большей плотности тока. ..
..
Анодная обработка алюминия (анодирование, полирование, эматалирование). Применение в полиграфии
6.Эматалирование алюминия
Широкое использование алюминия и алюминиевых сплавов, несмотря на недостаточную антикоррозионную стойкость, возможно благодаря применению надежных противокоррозионных покрытий…
Анодная обработка алюминия (анодирование, полирование, эматалирование). Применение в полиграфии
8.Травление алюминия
Травление алюминия производят в 15-20% растворе едкого натрия подогретого до 60-70°С. Выдержка определяется от момента появления пузырьков и колеблется в зависимости от толщины пленки окисла от нескольких секунд, до 2-3 минут…
Определение содержания меди в техническом препарате сульфата меди методами титриметрии и фотометрии
3.1 Определения массы меди в растворе сульфата меди методом комплексонометрии
1. Приготовление титранта.
Готовим 600 мл раствора ЭДТА с концентрацией = 0,025 моль/л из концентрированного раствора Трилона-Б — 0,05. Для этого берём 300 мл Трилона-Б + 300 мл воды.
2…
Для этого берём 300 мл Трилона-Б + 300 мл воды.
2…
Определение содержания меди в техническом препарате сульфата меди методами титриметрии и фотометрии
3.2. Фотометрическое определение массы меди в растворе сульфата меди по поглощению аммиачных комплексов.
Берём в лаборантской стандартный раствор сульфата меди — 500 мл и ТCu =2,0·10-3 г/мл.; доводим до метки и перемешиваем. 1. Приготовление стандартных растворов для построения градуировочного графика В пять мерных колб вместимостью 50…
Производство сульфата алюминия из гидроксида алюминия и серной кислоты
3.7 Перспективы совершенствования процесса получения сульфата алюминия
Для усовершенствования процесса получения сульфата алюминия из различного исходного сырья необходимо полностью механизировать его, примером такого процесса является получение сульфата алюминия из гидроксида алюминия…
Расчет процесса электролиза цинка из сульфатного раствора
3.3 Очистка раствора сульфата цинка от примесей
Примеси в растворе сульфата цинка в соответствии со способами выведения их из раствора можно разделить на группы. Первая группа объединяет примеси, которые можно удалить из раствора гидролизом, соосаждением, адсорбцией и коагуляцией: железо…
Первая группа объединяет примеси, которые можно удалить из раствора гидролизом, соосаждением, адсорбцией и коагуляцией: железо…
Свойства алюминия и области применения в промышленности и быту
1.1 Общее определение алюминия
Алюминий (лат. Aluminium, от alumen — квасцы) — химический элемент III гр. периодической системы, атомный номер 13, атомная масса 26,98154. Серебристо-белый металл, легкий, пластичный, с высокой электропроводностью, tпл = 660 С…
Свойства алюминия и области применения в промышленности и быту
1.2 История получения алюминия
Документально зафиксированное открытие алюминия произошло в 1825. Впервые этот металл получил датский физик Ганс Христиан Эрстед…
Сульфат кальция, кристаллогидрат и безводная соль
2.1.3 Получение безводного сульфата кальция
Безводный сульфат кальция получают нагреванием при 225±5?С двух- или полуводного CaSO4. Температура, при которой высушивают сульфат кальция, имеет большое значение для препарата. ..
..
Презентация «Решение задач по химической формуле» (16 слайдов)
Слайд 1
Кузнецова О.А. учитель химии МБОУ «СОШ №7» г Обнинск
Решение задач по химической формуле
9 класс
Слайд 2
Определение
Химическая формула – это условная запись состава вещества с помощью химических знаков и математических индексов.
Химическая формула отражает качественный и количественный состав вещества.
Слайд 3
По химической формуле можно рассчитать
Относительную молекулярную массу вещества.
Молярную массу вещества.
Массовые доли элементов, входящих в состав вещества.
Слайд 4
По химической формуле можно рассчитать
Количество вещества.
Массу вещества
Объем газообразного вещества
Число атомов элемента, содержащихся в веществе определенной массы или объема.
Слайд 5
Задание №1
Вычислите относительные молекулярные массы следующих веществ:
Серная кислота
Сульфат алюминия
Гидроксид бария
Помощь
Проверка
Mr(h3SO4)=98
Mr(Al2(SO4)3)=342
Mr (Ba(OH)2)=171
Слайд 6
Подсказка
Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, входящих в состав вещества, с учетом индексов.
!
Слайд 7
Задание №2
Вычислите молярные массы следующих веществ
Нитрат кальция
Карбонат лития
Хлорид магния
проверка
M(Ca(NO3)2=164г/моль
M(Li2CO3)=74г/моль
M(MgCl2)=95г/моль
Слайд 8
Задание №3
Вычислите массовые доли всех элементов , входящих в состав серной кислоты
Помощь
Проверка
Слайд 9
Подсказка
Вычислите массовые доли всех элементов , входящих в состав серной кислоты
Слайд 10
Задание №4
Какая масса серы содержится в 120г серной кислоты?
Дано: Решение:
1.
Найти
2.
Ответ: m(S)=39.18г
Слайд 11
Задание №5
Какая масса алюминия содержится в 300г сульфата алюминия?
Дано: Решение:
1.
Найти
2.
Ответ: m(Al)=43. 37г
37г
Слайд 12
Задание №6
Какая масса хлора содержится в 240г хлорида магния?
Дано: Решение:
1.
Найти
2.
Ответ: m(Сl)=179.38г
Слайд 13
Задание №7
Суточная потребность организма
в железе составляет 0,01-0,02г.
Обеспечит ли суточную
потребность организма в железе
добавление в пищу
0,1г. сульфата железа(II)
при условии его полного усвоения?
Запас – «депо»
(0,5 г)
Железосодержащие
ферменты
(0,4-0,7 г)
Миоглобин – мышечный белок
(0,3-0,6 г)
Гемоглобин крови (3г)
Слайд 14
Задание №7
Дано: Решение:
1.
Найти
2.
3.
Ответ: да
0,037>0.02
Слайд 15
Продолжите решение задач самостоятельно
В эмали зубов человека содержится примерно 7500мг. натрия, а в дентине зубов – 11600мг. Подсчитайте, сколько атомов натрия находится в: а) дентине зубов; б) в эмали зубов человека.
В организме взрослого человека содержится около 140г. магния, причем 2/3 от этого количества приходится на костную ткань. Подсчитайте, сколько атомов магния находится в: а) костной ткани; б) человеческом организме в целом.
В организме взрослого человека содержится около 5г. железа, причем 2/3 от этого количества входит в состав гемоглобина. Подсчитайте, сколько атомов железа находится в: а) гемоглобине; б) человеческом организме в целом.
натрия, а в дентине зубов – 11600мг. Подсчитайте, сколько атомов натрия находится в: а) дентине зубов; б) в эмали зубов человека.
В организме взрослого человека содержится около 140г. магния, причем 2/3 от этого количества приходится на костную ткань. Подсчитайте, сколько атомов магния находится в: а) костной ткани; б) человеческом организме в целом.
В организме взрослого человека содержится около 5г. железа, причем 2/3 от этого количества входит в состав гемоглобина. Подсчитайте, сколько атомов железа находится в: а) гемоглобине; б) человеческом организме в целом.
Слайд 16
Использованная литература
1. О.С. Габриелян Учебник «Химия – 8 класс» – М.: Дрофа, 2012г.
2. О.С. Габриелян Учебник «Химия – 9 класс» – М.: Дрофа, 2012г.
3. Картинки
Гемоглобин: https://www.google.ru/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&uact=8&docid=iIlE0Wz93-1-SM&tbnid=_WLg_gL7aXR3EM:&ved=0CAUQjRw&url=http%3A%2F%2Fwww. syl.ru%2Farticle%2F68576%2Fpovyishennyiy-gemoglobin-prichinyi-i-profilaktika&ei=WD4dU_iwBKa34wTg_IDgBA&bvm=bv.62578216,d.bGE&psig=AFQjCNHftM0ktdGsVoa9J76GHh9XwDxywg&ust=1394511792988621
Печень:https://www.google.ru/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&uact=8&docid=gPK7UZ2fy7NsjM&tbnid=uhu8ZCSv2xz4zM:&ved=0CAUQjRw&url=http%3A%2F%2Fwww.zepper.ru%2Fpublic%2Fcategory%2Fteobiomed%2F&ei=nz4dU9qSE-aZ4wSuoYGICg&bvm=bv.62578216,d.bGE&psig=AFQjCNFwssoit7l-5Cbi2mwgjgdkcvYF9w&ust=1394511892137284
syl.ru%2Farticle%2F68576%2Fpovyishennyiy-gemoglobin-prichinyi-i-profilaktika&ei=WD4dU_iwBKa34wTg_IDgBA&bvm=bv.62578216,d.bGE&psig=AFQjCNHftM0ktdGsVoa9J76GHh9XwDxywg&ust=1394511792988621
Печень:https://www.google.ru/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&uact=8&docid=gPK7UZ2fy7NsjM&tbnid=uhu8ZCSv2xz4zM:&ved=0CAUQjRw&url=http%3A%2F%2Fwww.zepper.ru%2Fpublic%2Fcategory%2Fteobiomed%2F&ei=nz4dU9qSE-aZ4wSuoYGICg&bvm=bv.62578216,d.bGE&psig=AFQjCNFwssoit7l-5Cbi2mwgjgdkcvYF9w&ust=1394511892137284
Формула массы в химии — Стоматология в Химках
Как найти массу в химии
Одним из основополагающих законов в химии является закон сохранения массы (масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ), который говорит о том, что зная массу веществ, вступивших в реакцию мы легко можем рассчитать массу продуктов этой реакции и наоборот.
Для того, чтобы определить Массу вещества используют следующую формулу:
Где n — количество вещества (моль), а М – молярная масса вещества (г/моль), откуда следует, что единицей измерения массы является [г].
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12 С.
Масса одного атома 12 С равна 12 а. е.м., поэтому число атомов в 12 г изотопа 12 С равно:
NA = 12 г / 12 × 1,66057×10 -24 г = 1/1,66057×10 -24 = 6,0221×10 -23 .
Таким образом, моль вещества содержит 6,0221×10 -23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль -1 . Число 6,0221×10 -23 называют числом Авогадро.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что если масса некоторой молекулы равна, например, 44 а. е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Примеры решения задач
| Задание | Рассчитайте массу осадка, который образуется, если к раствору, содержащему сульфат алюминия массой 7,1 г, прилить избыток водного раствора аммиака. |
| Решение | Запишем уравнение реакции взаимодействия сульфата алюминия с водным раствором аммиака: |
В результате реакции образовался осадок – гидроксид алюминия.
Рассчитаем количество вещества сульфата алюминия (молярная масса – 342 г/моль):
N(Al(OH)3) = 2 × 0,021 = 0,042 моль.
Тогда, масса гидроксида алюминия (молярная масса – 78 г/моль) будет равна:
M(Al(OH)3) = 0,042 × 78 = 3,24 г.
SiO2 = 2C = Si + 2CO.
Рассчитайте массу оксида кремния (IV), который можно восстановить с помощью кокса массой 50 г (массовая доля углерода в коксе составляет 95%).
SiO2 = 2C = Si + 2CO.
Определим массу углерода:
M(C) = m(coke) ×ω(C)/100%;
M(C) = 50 ×95/100% = 47,5 г.
Рассчитаем количество вещества углерода (молярная масса – 12 г/моль):
N(С) = 47,5 / 12 = 3,96 моль.
Согласно уравнению реакции n(С) : n(SiO2) = 2:1, значит:
N(SiO2) = 0,5 × 3,96 = 1,98 моль.
Тогда, масса оксида кремния (IV) (молярная масса – 60 г/моль) будет равна:
M C 50 95 100 47,5 г.
Ru. solverbook. com
23.06.2020 22:41:57
2020-06-23 22:41:57
Источники:
Http://ru. solverbook. com/spravochnik/formuly-po-ximii/formula-massy/
Ответы: как найти массу вещества » /> » /> .keyword { color: red; }
Как найти массу в химии
Массу вещества требуется найти во многих задачах. Это можно сделать с помощью специальных формул. Обычно в условии задачи присутствует реакция, с помощью которой находятся некоторые величины.
1. При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
2. В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д. И. Менделеева по обозначение элемента) .
И. Менделеева по обозначение элемента) .
3. Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
4. Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
5. Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Выводите mp x выход продукта m x 100 или m x mp x 100 выход продукта.
Otvet. mail. ru
19.09.2018 19:10:37
2018-09-19 19:10:37
Источники:
Https://otvet. mail. ru/question/84676708
Молярная масса — что это? Как рассчитать? Формулы и примеры » /> » /> .keyword { color: red; }
Как найти массу в химии
Для решения многих задач по химии нужно знать количество молекул или других частиц, необходимое для реакции. Однако оперировать столь малыми числами неудобно, поэтому ученые ввели новые величины. В этой статье вы познакомитесь с такими понятиями, как моль, количество вещества, молярная масса в химии.
Однако оперировать столь малыми числами неудобно, поэтому ученые ввели новые величины. В этой статье вы познакомитесь с такими понятиями, как моль, количество вещества, молярная масса в химии.
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 10 23 . Постоянная Авогадро обозначается NA, а измеряется в моль -1 .
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 10 23 моль -1 .
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой, так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).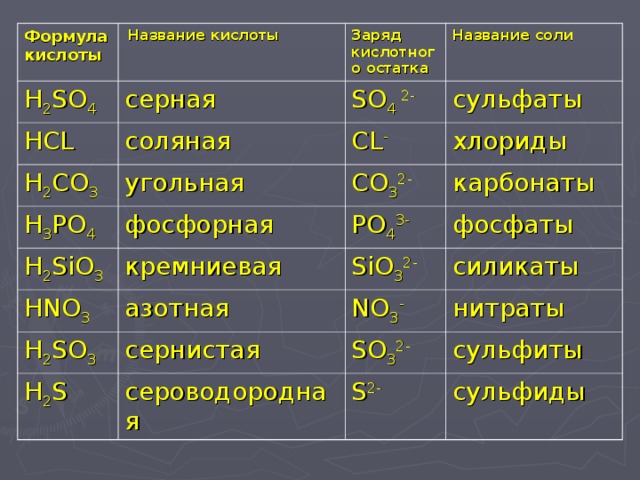
Подставим значение молярной массы в формулу:
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 10 23 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и h3:
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 10 23 молекул. Чему равна молярная масса данного вещества?
N(х) = 12,04 · 10 23 .
Найдем количество вещества моль.
Подставим количество вещества в формулу :
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
По формуле мы можем найти объем.
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 10 23 атомов кислорода. Какова масса этой порции?
N(O) = 8,356 · 10 23 .
Для решения задачи нам подходит формула, т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
Зная количество молекул, рассчитаем количество вещества:
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 10 23 молекул? Назовите это вещество.
N(x) = 15,05 · 10 23 .
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
Исходя из этого, рассчитаем молярную массу:
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород h3S плотнее водорода h3?
Нам требуется вычислить относительную плотность сероводорода по водороду:
Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Skysmart. ru
17.05.2018 1:10:45
2018-05-17 01:10:45
Источники:
Https://skysmart. ru/articles/chemistry/molyarnaya-massa
Сульфат алюминия — frwiki.wiki
Сульфат алюминия (E520), формула Al 2 (SO 4 ) 3, представляет собой соль, образованную комбинацией двух катионов алюминия (Al 3+ ) и трех сульфат- анионов (SO 4 2-).
Резюме
- 1 Использование
- 2 Здоровье
- 3 Примечания и ссылки
- 4 См.
 Также
Также- 4.1 Связанные статьи
Использует
Он находится в продаже в форме кристаллов или в жидком растворе.
Сульфат алюминия используется, в частности, в процессе коагуляции-флокуляции для очистки воды . При очистке воды взвешенные примеси коагулируют в более крупные частицы, а затем легче оседают на дно емкости (или отфильтровываются). Этот процесс называется коагуляцией или флокуляцией.
Он также используется в качестве протравы при крашении и печати текстильных изделий.
При растворении в большом количестве нейтральной или слабощелочной воды сульфат алюминия образует студенистый осадок гидроксида алюминия Al (OH) 3 . При крашении и печати на тканях гелеобразный осадок помогает красителю прилипать к волокнам одежды, делая пигмент нерастворимым.
В строительной промышленности сульфат алюминия используется в качестве герметика и ускорителя схватывания бетона.
Сульфат алюминия иногда используется для снижения pH садовой почвы, поскольку он гидролизуется с образованием осадка гидроксида алюминия и разбавленного раствора серной кислоты. Пример того, что изменение уровня pH почвы может сделать для растений, можно увидеть, взглянув на Hydrangea macrophylla. Садовник может добавить в почву сульфат алюминия, чтобы снизить pH, что, в свою очередь, приведет к изменению цвета цветов гортензии (синему). Алюминий делает цветы синими; при более высоком pH алюминий недоступен для растений.
Пример того, что изменение уровня pH почвы может сделать для растений, можно увидеть, взглянув на Hydrangea macrophylla. Садовник может добавить в почву сульфат алюминия, чтобы снизить pH, что, в свою очередь, приведет к изменению цвета цветов гортензии (синему). Алюминий делает цветы синими; при более высоком pH алюминий недоступен для растений.
Иногда он используется в пищевой промышленности в качестве укрепляющего агента, где он имеет номер E520, и в кормах для животных в качестве бактерицида. Сульфат алюминия можно использовать как дезодорант, вяжущее средство или в гемостатических карандашах для бритья и «квасцах».
Это обычный адъювант вакцины, который работает, способствуя медленному высвобождению антигена из депо вакцины, образующегося в месте инокуляции.
Другое применение — пенообразователь в пене для пожаротушения.
Он также может быть очень эффективным в качестве моллюскицида.
Здоровье
В 2000 году исследование PAQUID, проведенное в департаментах Жиронда и Дордонь, показало, что риск заражения болезнью Альцгеймера в 1,99 раза выше в регионах, где вода содержит более 100 мкг алюминия на литр питьевой воды, а во Франции стандарт — 200 мкг . Это исследование признано недействительнымпо отчету AFSSA . Хотя некоторые эффекты, связанные с хроническим воздействием алюминия, в настоящее время можно считать доказанными (энцефалопатия, психомоторные расстройства, повреждение костной ткани в виде остеомаляции и повреждение кроветворной системы в виде гипохромной анемии), похоже, что для других первоначально предполагаемые эффекты (это случай болезни Альцгеймера), при нынешнем уровне знаний причинно-следственная связь не может быть разумно предусмотрена.
Это исследование признано недействительнымпо отчету AFSSA . Хотя некоторые эффекты, связанные с хроническим воздействием алюминия, в настоящее время можно считать доказанными (энцефалопатия, психомоторные расстройства, повреждение костной ткани в виде остеомаляции и повреждение кроветворной системы в виде гипохромной анемии), похоже, что для других первоначально предполагаемые эффекты (это случай болезни Альцгеймера), при нынешнем уровне знаний причинно-следственная связь не может быть разумно предусмотрена.
Но в 2012 году, в конце исследования Paquid, опубликованный отчет четко указывает на влияние алюминия, растворенного в питьевой воде, на обострение деменции у пожилых людей.
Примечания и ссылки
- ↑ a b и c СУЛЬФАТ АЛЮМИНИЯ , паспорт (-ы) безопасности Международной программы по химической безопасности , проверено 9 мая 2009 г.
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.
 chem.qmul.ac.uk .
chem.qmul.ac.uk . - ↑ « Алюминий сернокислый » в базе данных химических продуктов Reptox в CSST (организации Квебека , ответственного за охрану труда и здоровья), доступ к 25 апреля 2009.
- ↑ « Алюминий октадекагидрат сульфат » в базе данных химических веществ Reptox в CSST (организации Квебека , ответственного за охрану труда и здоровья), доступ к 23 апреля 2009.
- ↑ Рамаросон Х., Хелмер С., Барбергер-Гато П., Летеннер Л., Дартиг Дж. Ф.; Распространенность деменции и болезни Альцгеймера среди субъектов в возрасте 75 лет и старше : обновленные результаты когортной программы PAQUID] (fr) ; PAQUID. ; INSERM Unit 330, Университет Виктора Сегалена Бордо II. Ред. Neurol. (Париж). 2003 апр; 159 (4): 405-11.
- ↑ « Оценка рисков для здоровья, связанных с воздействием алюминия на население Франции » , на сайте anses.
 fr ,.
fr ,. - ↑ «Paquid 2012: иллюстрация и отчет», Inserm Unit 897, Университет Бордо Сегален, CMRR Бордо, Университетская больница Бордо, Бордо, CMRR Бордо, Больница Ксавье Арнозана, Бордо [1]
Смотрите также
Статьи по Теме
- Квасцы
- Сульфат магния
- Сульфат меди
Соединения алюминия | |||||
|---|---|---|---|---|---|
| Al (I) | AlCl · AlF · AlI · Al 2 O | ||||
| Al (II) | AlB 2 · AlB 12 · AlO | ||||
| Al (III) | AlAs · Al (BH 4 ) 3 · AlBr 3 · AlCl 3 · AlF 3 · AlH 3 · AlI 3 · AlN · Al (NO 3 ) 3 · Al 2 (CO 3 ) 3 · Al (OH) 3 · Al (OH) ) 2 OAc · Al (OH) (OAc) 2 · Al (OAc) 3 · Al 2 SO 4 (OAc) 4 · AlP · AlPO 4 · AlSb · Al (C 5 H 7 O 2 ) 3 · Al (MnO 4 ) 3 · Al 2 (MoO 4 ) 3 · Al 2 O 3 · Al 2 O 3 · Al 2 (SO 4 ) 3 · Al 2 If 3 · Al 2 Te 3 · Al 2 SiO 5 · Al 4 C 3 · Aloho · Al (OH) 2 CO 2 C 17 H 5 · NaAlH 2 (OC 2 H 4 OCH 3 ) 2 · LiAlH 2 (OC 2 H 4 OCH 3 ) 2
| ||||
<img src=»//fr. wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Кристаллогидраты. Задачи на кристаллогидраты | CHEMEGE.RU
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
Например, медный купорос:
CuSO4·5H2O
Кристаллогидраты растворяются в воде, при этом протекают сложные физико-химические процессы, но, если говорить про конечный результат, вещество диссоциирует, а кристаллизационная вода отделяется и попадает в раствор. Условно процесс растворения можно записать в виде уравнения:
CuSO4·5H2O → CuSO4 + 5H2O
Но в ЕГЭ по химии лучше не записывать растворение кристаллогидрата, как химическую реакцию!
Названия кристаллогидратов, которые могут встретиться в ЕГЭ по химии:
CuSO4·5H2O — медный купорос, пентагидрат сульфата меди (II)
Na2CO3 × 10H2O — кристаллическая сода, декагидрат карбоната натрия
ZnSO4 × 7H2O — цинковый купорос, гептагидрат сульфата цинка
Как решать задачи на кристаллогидраты?
Рассмотрим приемы, которые можно использовать при решении задач на кристаллогидраты, на примере.
| 1. В 300 мл воды растворили 7,6 г CuSO4·5H2O (медного купороса). Определите массовую долю CuSO4 в образовавшемся растворе. |
Для определения массы соли в составе кристаллогидрата по массе кристаллогидрата можно использовать два способа.
Первый способ.
В составе кристаллогидрата медного купороса на одну частицу кристаллогидрата приходится одна частица сульфата меди (II). На две частицы кристаллогидратов тогда приходится две частицы сульфата меди и т.д. Аналогично на 1 порцию (моль) частиц кристаллогидрата приходится 1 порция (1 моль) частиц сульфата меди (II).
То есть молярное соотношение (отношение количества вещества) кристаллогидрата CuSO4·5H2O и сульфата меди (II) равно CuSO4 1:1
n(CuSO4·5H2O):n(CuSO4) = 1:1
Или:
n(CuSO4·5H2O) = n(CuSO4)
Находим молярные массы гидрата и сульфата меди (II):
М(CuSO4·5H2O) = 64 + 32 + 64 + 5·18 = 250 г/моль
М(CuSO4) = 64 + 32 + 64 = 160 г/моль
Количество вещества кристаллогидрата:
n(CuSO4·5H2O) = m/M = 7,6/250 = 0,0304 моль
n(CuSO4) = n(CuSO4·5H2O) = 0,0304 моль
Масса сульфата меди в составе кристаллогидрата:
m(CuSO4) = M·n = 160 г/моль·0,0304 моль = 4,864 г
Второй способ.
Определим массовую долю сульфата меди в составе кристаллогидрата:
ω(CuSO4) = М(CuSO4)/М(CuSO4·5H2O) = 160 г/моль/250 г/моль = 0,64 или 64%
Тогда массу сульфата меди в образце кристаллогидрата массой 7,6 г можно определить, зная массовую долю сульфата меди:
m(CuSO4) = ω(CuSO4) · m(CuSO4·5H2O) = 0,64 · 7,6 г = 4,864 г
Масса исходной воды:
m(H2O) = ρ·V = 1 г/мл · 300 мл = 300 г
Массу раствора сульфата меди (II) находим по принципу материального баланса: складываем все материальные потоки, которые пришли в систему, вычитаем уходящие материальные потоки.
mр-ра(CuSO4) = m(CuSO4·5H2O) + m(H2O) = 7,6 г + 300 г = 307,6 г
Массовая доля сульфата меди (II) в конечном растворе:
ω(CuSO4) = m(CuSO4)/mр-ра(CuSO4) = 4,864 г/307,6 г = 0,0158 или 1,58%
Ответ: ω(CuSO4) = 0,0158 или 1,58%
2. Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл? Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл? |
| 3. В растворе хлорида алюминия с ω(AlCl3) = 2% растворили 100 г кристаллогидрата AlCl3·6H2O. Вычислите, какой стала массовая доля AlCl3 в полученном растворе, если объём раствора 1047 мл, а его плотность 1,07 г/мл. |
4. Вычислите массы FeSO4·7H2O (железного купороса) и воды, необходимые для приготовления 500 г раствора с массовой долей FeSO4 7%.
5. Вычислите объём воды и массу кристаллогидрата Na2SO4·10H2O (глауберовой соли), которые требуются для приготовления 500 г раствора с массовой долей Na2SO4 15%.
6. Какую массу кристаллогидрата Na2SO4·10H2O необходимо растворить в 400 мл воды, чтобы получить раствор с ω(Na2SO4) = 10%?
7. Нужно приготовить 320 г раствора с ω(CuSO4) = 12%. Рассчитайте массу кристаллогидрата CuSO4·5H2O и массу раствора с ω1(CuSO4) = 8%, которые потребуются для приготовления заданного раствора.
8. Вычислите, какую массу кристаллогидрата AlCl3·6H2O нужно растворить в 1 кг раствора хлорида алюминия с массовой долей AlCl3 2%, чтобы получить раствор с массовой долей AlCl3 3%.
9. Сколько граммов кристаллогидрата Na2SO4·10H2O необходимо добавить к 100 мл раствора сульфата натрия с массовой долей Na2SO4 8% и плотностью 1,07 г/мл, чтобы удвоить массовую долю Na2SO4 в растворе?
10. Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
11. Вычислите массу CuSO4·5H2O (медного купороса), необходимую для приготовления 5 л раствора с массовой долей CuSO4 8% (плотность раствора 1,084 г/мл)? Рассчитайте молярную концентрацию CuSO4 в этом растворе.
12. Массовая доля кристаллизационной воды в кристаллогидрате сульфата натрия (Na2SO4·xH2O) составляет 55,9%. Определите формулу кристаллогидрата. Вычислите массовую долю сульфата натрия в растворе, полученном при
растворении 80,5 г данного кристаллогидрата в 2 л воды.
13. К раствору сульфата железа(II) с массовой долей FeSO4 10% добавили 13,9 г кристаллогидрата этой соли. Получили раствор массой 133,9 г, с массовой долей FeSO4 14,64%. Определите формулу кристаллогидрата.
Определите формулу кристаллогидрата.
14. После растворения 13,9 г кристаллогидрата сульфата железа(II) (FeSO4·xH2O) в 86,1 г воды массовая доля FeSO4 в растворе оказалась равной 7,6%. Определите формулу кристаллогидрата.
15. При охлаждении 200 мл раствора сульфата магния с ω(MgSO4) = 24% (плотность раствора 1,270 г/мл) образовался осадок кристаллогидрата MgSO4·7H2O массой 61,5 г. Определите массовую долю MgSO4 в оставшемся
растворе.
16. При охлаждении 400 мл раствора сульфата меди(II) с массовой долей CuSO4 25% (плотность раствора 1,19 г/мл) образовался осадок кристаллогидрата CuSO4·5H2O массой 50 г. Определите массовую долю CuSO4 в оставшемся растворе.
17. При охлаждении 500 г раствора сульфата железа(II) с массовой долей FeSO4 35% выпало в осадок 150 г кристаллогидрата FeSO4·7H2O. Определите массовую долю FeSO4 в оставшемся растворе.
Определите массовую долю FeSO4 в оставшемся растворе.
18. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 8,4 г железа и после завершения реакции ещё 100 г 9,8%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
19. Медный купорос (CuSO4 × 5H2O) массой 100 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 32,5 г цинка и после завершения реакции ещё 560 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в полученном растворе.
20. К 20%-ному раствору соли, полученному при растворении в воде 50 г медного купороса (CuSO4 × 5H2O), добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 146 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
21. Нитрид натрия массой 8,3 г растворили в 490 г 20%-ного раствора серной кислоты. К полученному раствору добавили 57,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю кислоты в конечном растворе. Учитывать образование только средних солей.
22. Медный купорос (CuSO4 × 5H2O) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
23. Медный купорос (CuSO4 × 5H2O) массой 37,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 11,2 г железа и после завершения реакции ещё 100 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
Определите массовую долю соли в полученном растворе.
24. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 20%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 292 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
25. При растворении 25 г медного купороса (CuSO4 × 5H2O) в воде был получен 20%-ный раствор соли. К этому раствору добавили измельчённую смесь, образовавшуюся в результате прокаливания порошка алюминия массой 2,16 г с оксидом железа(III) массой 6,4 г. Определите массовую долю сульфата меди(II) в полученном растворе.
26. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
27. Свинцовый сахар ((CH3COO)2Pb × 3H2O) массой 37,9 г растворили в воде и получили 10%-ный раствор соли. К этому раствору добавили 7,8 г цинка и после завершения реакции добавили еще 156 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
28. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
29. При растворении в воде 114,8 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
30. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
Ответ: w(NaOH) = 3,8%
31. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 16%. К этому раствору добавили 26 г цинка и после завершения реакции ещё 320 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
32. Фосфид кальция массой 18,2 г растворили в 182,5 г 20%-ного раствора соляной кислоты. К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
Ответ: w(Na2CO3) = 6%
Задачи на состав и определение формулы кристаллогидратов:
- Вычислите массовую долю бария в кристаллогидрате гидроксида бария, в котором число атомов водорода в 1,8 раз больше числа атомов кислорода.
- Имеется смесь равных масс гептагидрата гидрофосфата натрия и дигидрата дигидрофосфата натрия. Сколько в это смеси приходится атомов кислорода на один атом фосфора?
- Число атомов водорода, равное числу Авогадро, содержится в 21,9 г кристаллогидрата ацетата цинка. Установите формулу кристаллогидрата.
- В некоторой порции пентагидрата сульфата меди содержится 0,25 моль воды. Вычислите массу этой порции кристаллогидрата.
- В какой массе дигидрата сульфата кальция содержится число электронов, равное числу Авогадро?
- Вычислите число атомов и число электронов 14г гептагидрата сульфата никеля (II).

- Рассчитайте массу атомов водорода, содержащихся в 143 моногидрата ацетата меди.
- В некоторой порции кристаллогидрата сульфата желез (III) число атомов кислорода в 15 раз больше числа Авогадро, а число атомов железа точно соответствует числу Авогадро. Выведите формулу кристаллогидрата.
- В 0,250 моль кристаллогидрата разница между массой кристаллизационной воды и массой беводной соли равна 59,5. Массовая доля кристаллизационной воды составляет 28,83%. Вычислите относительную молекулярную массу кристаллогидрата.
- В кристаллогидрате, образованном средней солью металла, массовая доля кристаллизационной воды равна 50,0%. Вычислите массу водорода, содержащегося в 100 г этого кристаллогидрата.
- В кристаллогидрате, образованном солью бескислородной кислоты, массовая доля соли равна 0,755. Вычислите массу кислорода, содержащегося в 1.00 г этого кристаллогидрата.
- В некоторой порции кристаллогидрата ацетата магния находится 9,632∙1023 атомов углерода и 3,371∙1024 атомов водорода.
 Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата. - В некоторой порции кристаллогидрата ацетата бария находится 4,816∙1023 атомов углерода и 8,428∙1023 атомов кислорода. Вычислите число атомов водорода, находящихся в этой порции кристаллогидрата.
14. В 0,250 моль дигидрата ацетата металла 2А-группы содержится 1,535∙1025 электронов. Установите, какой металл входит в состав кристаллогидрата.
Задачи на реакции с участием кристаллогидратов:
- Оксид меди (II) массой 16 г обработали 40 мл 5,0 %-го раствора серной кислоты (ρ=1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
- Декагидрат карбоната натрия обработали раствором азотной кислоты массой 150 г, при этом выделилось 2,67 л углекислого газа (н.у.). Вычислите массовую долю азотной кислоты в исходном растворе.
- К сульфиду калия массой 3,30 г, находящемуся в водном растворе, добавили 0,02 моль гексагидрата хлорида меди.
 Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка. - При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
- Какую массу медного купороса необходимо добавить к 150 г 12%-ного раствора гидроксида натрия, чтобы щёлочь полностью прореагировала?
- 7,5 г медного купороса (пентагидрат сульфата меди) растворили в 142,5 воды. К полученному раствору добавили 150 мл 10 %-ного раствора гидроксида калия (плотность 1,1 г/мл). Определить состав полученного раствора в массовых процентах.
- Какую массу декагидрата карбоната натрия необходимо растворить в 130 г 10%-ного раствора хлорида алюминия, чтобы полностью осадить гидроксид алюминия? Определить состав раствора (в массовых процентах) после отделения осадка.
8. В 1 л воды растворили 57,2 г кристаллической соды (декагидрат карбоната натрия). Через полученный раствор пропустили 1,12 л углекислого газа. Найти массовые доли веществ в полученном растворе.
Найти массовые доли веществ в полученном растворе.
Задачи на материальный баланс и растворы с участием кристаллогидратов:
- Медный купорос массой 12,5 г; растворили в 87,5 мл воды. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 200 г раствора сульфата меди (II) с массовой долей соли 4% растворили 50 г медного купороса. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 5 л воды растворили дигидрат хлорида бария массой 250 г. Вычислите массовую долю (в %) безводной соли в полученном растворе.
- В 135,6 г воды растворили глауберову соль массой 64,4 г. Рассчитайте массовую долю (в %) безводной соли в полученном растворе.
- Необходимо приготовить 2 л 0,1 М водного раствора сульфата меди (II). Какая масса медного купороса потребуется для этого?
- Выпарили досуха 0,5 л 15-процентного раствора сульфата натрия (плотность 1,14 г/см3). Вычислите массу полученных кристаллов, учитывая, что соль выделяется в виде кристаллогидрата — декагидрата сульфата натрия.

- До какого объема надо разбавить 500 мл 20-процентного раствора хлорида натрия (плотность 1,152 г/мл), чтобы получить 4,5-процентный раствор плотностью 1,029 г/мл?
- Смешали 500 мл 32 — процентного раствора азотной кислоты плотностью 1,2 г/мл и один литр воды. Вычислите массовую долю (в %) азотной кислоты в полученном растворе.
- Рассчитайте объем 25% раствора сульфата цинка (плотность 1,3 г/мл), который необходимо разбавить водой для получения 0,5 М раствора этой соли объемом 4л.
- Декагидрат карбоната натрия массой 0,05 кг растворили в воде объемом 0,15 л. Вычислите массовую долю безводной соли в полученном растворе.
- В воде объемом 0,157 м3 растворили медный купорос массой 43 кг. Вычислите массовую долю безводной соли в полученном растворе.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Массовая доля безводной соли в кристаллогидрате равна 64%. Какую массу кристаллогидрата нужно взять для приготовления 150 г 50%-го раствора соли?
- В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- В каком объеме воды следует растворить 0,3 моль пентагидрата сульфата меди (II) для получения 12%-го раствора?
- Рассчитайте, сколько г FeSO4×7H2O и воды потребуется для приготовления 200 мл 18 мас % раствора сульфата железа (II) с плотностью 1,19 г/мл.

- Кристаллогидрат фосфата натрия Nа3РО4×12Н2О количеством вещества 1 моль растворили в 75 моль воды. Плотность получившегося раствора оказалась равной 1,098 г/мл. Вычислите молярную концентрацию ионов натрия в этом растворе.
- В 225 г 25,5%-го раствора бромида кальция растворили гексагидрат бромида кальция массой 50,0 г. Вычислите массовые доли веществ в получившемся растворе.
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- К 2% раствору хлорида алюминия добавили 100 г кристаллогидрата АlСl3∙6Н2О.
 Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл. - Сколько граммов кристаллогидрата СuSО4∙5Н2О и какой объем раствора сульфата меди, содержащего 5 мас.% СuSО4 и имеющего плотность 1,045 г/мл, надо взять для приготовления 400 мл раствора сульфата меди, содержащего 7 мас.% СuSО4 и имеющего плотность 1,06 г/см3?
- Сколько граммов кристаллогидрата Nа2СО3∙10 Н2О надо добавить к 400 мл раствора карбоната натрия, содержащего 5 мас.% Na2СО3 и имеющего плотность 1,05 г/см , чтобы получить 16 мас.% раствор, плотность которого 1,17 г/см ?
- Какой объем 5% раствора сульфата натрия надо взять, чтобы растворение в нем 150 г кристаллогидрата Nа2SO4∙10Н2О привело к образованию 14% раствора? Плотности растворов Nа2SО4 равны, соответственно, 1,044 и 1,131 г/мл.
- Алюмокалиевые квасцы КАl(SО4)2∙12Н2О количеством вещества 10 ммоль растворили в 10 моль воды.
 Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе. - В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Какую массу кристаллогидрата сульфата хрома (III), кристаллизующегося с 18 молекулами воды, можно получить из 80 мл раствора с концентрацией сульфата хрома 0,8 моль/л?
Понравилось это:
Нравится Загрузка.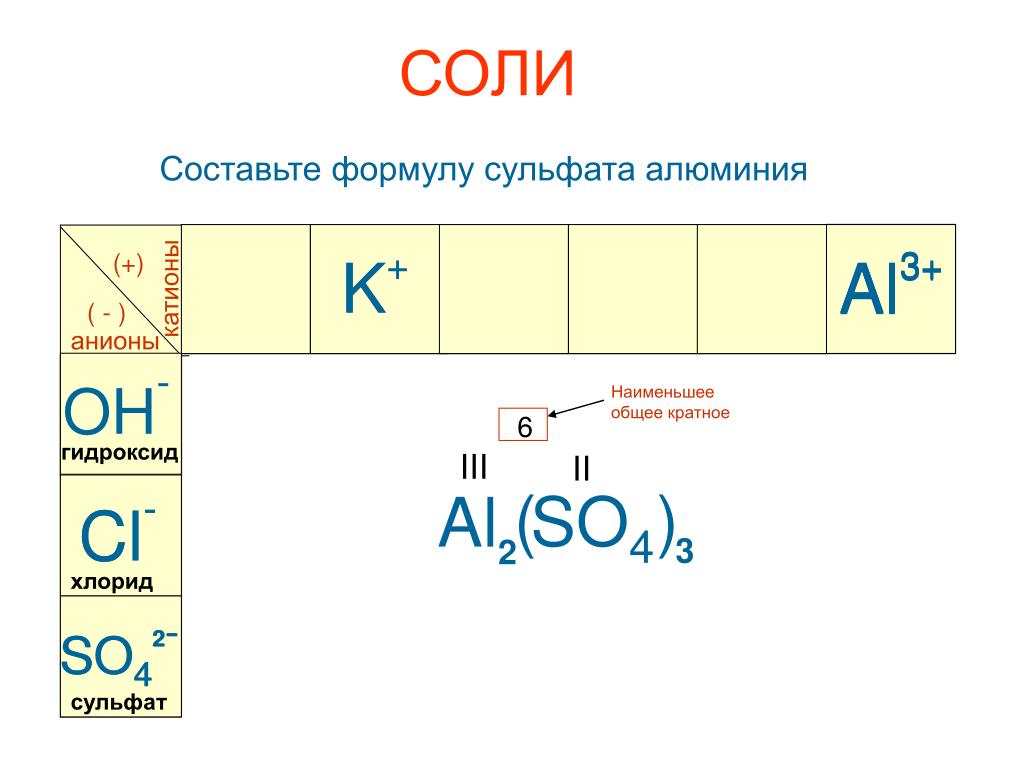 ..
..
Нитрат алюминия | Сульфат алюминия
Нитрат алюминия представляет собой соединение, представляющее собой соль азотной кислоты и алюминия. В нормальных условиях нитрат алюминия существует в виде кристаллогидрата. Что касается визуальной формы нитрата алюминия, то она обычно представляет собой кристаллическое твердое вещество или порошок и имеет желтую окраску. Нитрат алюминия является твердым соединением в соответствии со Стандартной температурой и давлением. Формула соединения – Al(NO3)3.Физические свойства нитрата алюминия
У этого соединения много различных физических свойств. Например, нитрат алюминия имеет молярную массу, равную 212,996 г/моль. Что касается плотности соединения, то она составляет 1,401 г/см3. Кроме того, как и любое другое соединение, нитрат алюминия имеет температуры плавления и кипения, которые составляют 72,8°С и 135°С соответственно. Растворимость нитрата алюминия известна в различных жидкостях. Нитрат алюминия не имеет запаха, а его молекулярная масса составляет 375,13. Химическая формула нитрата алюминия – Al(NO₃)₃.
Химическая формула нитрата алюминия – Al(NO₃)₃.
Получение нитрата алюминия
Вы не сможете легко получить нитрат алюминия, просто объединив азотную кислоту и алюминий. В этом случае алюминий образует пассивирующий слой. Но нитрат алюминия можно получить, если соединить трихлорид алюминия и азотную кислоту. Поступая таким образом, вы также создадите побочный продукт, нитрозилхлорид, который выделяется из раствора в виде газа. Нитрат алюминия можно также получить, если смешать сульфат алюминия и нитрат свинца. Из раствора выпадет сульфат свинца, а в растворе останется только нитрат алюминия.
Растворимость нитрата алюминия в различных веществах
Нитрат алюминия пытались растворить в таких веществах, как вода, метанол, этанол и этиленгликоль. Нитрат алюминия растворим во всех этих веществах. Что касается воды, он растворяется в количестве 160 г/100 мл при 100 °C. В случае метанола растворимый показатель составляет 14,45 г/100 мл. Нитрат алюминия растворяется в этаноле при концентрации 8,63 г/100 мл. А когда дело доходит до этиленгликоля, существует коэффициент растворимости 18,32 г/100 мл.
Нитрат алюминия растворяется в этаноле при концентрации 8,63 г/100 мл. А когда дело доходит до этиленгликоля, существует коэффициент растворимости 18,32 г/100 мл.
Применение нитрата алюминия
Это соединение представляется весьма ценным и имеет множество важных применений. Во-первых, нитрат алюминия оказался очень сильным окислителем. По этой причине он абсолютно бесценен в процессе окисления. Хотя это основное применение нитрата алюминия, существуют и другие применения, и их тоже следует учитывать.
Нитрат алюминия используется для извлечения урана. Процесс добычи урана заключается в извлечении урана из земли. Учитывая, насколько важен уран, без него очень сложно представить современный мир. Нитрат алюминия используется для этого процесса извлечения урана. Поэтому проведение экстракции было бы намного сложнее без нитрата алюминия.
Наверное, каждый человек нашего века знает об антиперспирантах и области их применения. Антиперспиранты относятся к группе дезодорантов и препятствуют потоотделению, а также влияют на запах тела человека. Обычно антиперспиранты наносят под руки. Нитрат алюминия является незаменимым компонентом антиперспирантов, производство которых невозможно без нитрата алюминия.
Обычно антиперспиранты наносят под руки. Нитрат алюминия является незаменимым компонентом антиперспирантов, производство которых невозможно без нитрата алюминия.
Соединение нитрата алюминия также широко используется в качестве компонента ингибиторов коррозии. Ингибиторы коррозии — это вещества, которые добавляют в различные устройства для предотвращения коррозии этих устройств. Например, ингибиторы коррозии широко используются со всеми типами ультразвуковых очистителей. А нитрат алюминия всегда добавляется в ингибиторы коррозии и служит одним из важнейших компонентов этих средств.
Другой важной областью применения нитрата алюминия является крашение, где он используется в качестве протравы. Морилка – это специальное средство, которое служит определенной цели, заключающейся в связывании красителей с материалами. Когда дело доходит до нитрата алюминия, он специально используется с хлопком. Без использования нитрата алюминия красители просто не будут связываться с хлопком. По этой причине нитрат алюминия является очень важным компонентом в процессе окрашивания хлопкового материала.
По этой причине нитрат алюминия является очень важным компонентом в процессе окрашивания хлопкового материала.
Нефть и масла также очищаются нитратом алюминия. Большое значение в промышленности имеют процессы переработки нефти и нефти. Например, благодаря такой переработке сырая нефть может быть преобразована в бензин или газолин, LPG (сжиженный нефтяной газ), керосин, дизельное топливо, мазут и реактивное топливо. И ни один из этих процессов не может осуществляться без использования нитрата алюминия. Это еще одно доказательство важности нитрата алюминия для промышленности.
И, конечно же, азотнокислый алюминий, как химическое соединение, широко используется для демонстрации студентам и учащимся различных типов химических реакций. При применении нитрата алюминия эти реакции приобретают действительно интересный и яркий вид. Видя такие яркие реакции, студенты и школьники лучше понимают процессы, происходящие в химии, становятся более умными и образованными.
Что касается других гидратированных и негидратированных типов нитратов алюминия, они также широко используются в промышленности. Использование, которое выделяется среди всех, заключается в следующем. Соли нитрата алюминия используются для производства глинозема, который затем используется для производства различных видов изоляционной бумаги. Электронно-лучевая трубка состоит из различных элементов, а в ее нагревательных элементах используется нитрат алюминия. Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Использование, которое выделяется среди всех, заключается в следующем. Соли нитрата алюминия используются для производства глинозема, который затем используется для производства различных видов изоляционной бумаги. Электронно-лучевая трубка состоит из различных элементов, а в ее нагревательных элементах используется нитрат алюминия. Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Хорошо известно, что различные соединения широко используются в области медицины, и в этой области также предпринимались попытки применить нитрат алюминия. Однако на данный момент его применяли только к крысам во время различных испытаний. Результаты этих тестов были разными, включая как эффективное, так и неэффективное использование нитрата алюминия по отношению к крысам. Что касается применения нитрата алюминия для человека, то оно еще не применялось. В то же время исследования в этой области продолжаются и, возможно, когда-нибудь нитрат алюминия будет применяться по отношению к человеку. Нитрат алюминия может стать эффективным для лечения людей, как и любое другое соединение.
Нитрат алюминия может стать эффективным для лечения людей, как и любое другое соединение.
Меры предосторожности при пожаре
Несмотря на то, что нитрат алюминия является легковоспламеняющимся соединением, он может вызвать некоторые проблемы, связанные с пожаром, поэтому при работе с ним необходимо соблюдать некоторые меры предосторожности. При сгорании нитрата алюминия могут образовываться токсичные оксиды азота. А если компаунд сгорит вместе с некоторыми горючими продуктами, то пожар в результате может существенно увеличиться. Кроме того, все емкости, служившие для хранения нитрата алюминия, следует тщательно промыть водой. В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
Нитрат алюминия следует хранить вдали от канализации и источников воды. Следует избегать контакта нитрата алюминия с пламенем, искрами и различного рода возгораниями.
Как защитить себя при работе с нитратом алюминия?
Хотя это вещество не очень опасно, вы должны действовать надлежащим образом, чтобы защитить себя при обращении с ним. Например, при работе с нитратом алюминия следует надевать средства защиты. Защитное снаряжение включает лицевой щиток и защитные очки. Кроме того, следует также использовать перчатки из резины и пылезащитные респираторы.
Если вы по какой-то причине проглотили это вещество в большой дозе, у вас будут серьезные осложнения со здоровьем, включая раздражение желудка, рвоту, понос и тошноту. В случае любого из них в результате приема нитрата алюминия следует обратиться к врачу.
Если нитрат алюминия попал в глаза или на кожу, у вас может возникнуть раздражение глаз или кожи. После попадания нитрата алюминия в глаза следует промыть глаза большим количеством воды в течение 15 минут. Поверхность кожи также следует промыть водой с легким мылом.
Формула нитрата алюминия
Al(NO3)3
Свойства нитрата алюминия
Название паспорта безопасности: Алюминий нитрат нонагидрат
Молярная масса: 212,996 г/моль (безводный), 6 г/моль903на4 (безводный), 375,103на4 Температура плавления: 66 ° C (151 ° F, 339 K) (безводный), 73,9 ° C (165,0 ° F, 347,0 K) (без гидрата)
Температура кипения: 150 ° C (302 ° F, 423 K) (без гидрата) разлагается
Плотность: 1,72 г/см3 (нонагидрат)
Сульфат алюминия 18-гидрат чистый | CAS 7784-31-8 | PanReac AppliChem
Только рекомендованные цены. Для получения информации о ценах и заказах обращайтесь к местному дистрибьютору.
Для получения информации о ценах и заказах обращайтесь к местному дистрибьютору.
Цена коробки действительна только при покупке полной коробки.
Размер упаковки (1)
| код | размер упаковки | цена за единицу | цена коробки за единицу | |
|---|---|---|---|---|
| Код и упаковка | Цена за штуку | |||
| код 141101. | размер упаковки 1000 г | цена за единицу сингл $79,35 | цена коробки за единицу 67,45 $ x 6 шт. | |
Технические данные
- Температура плавления:
- 90 °С
- Растворимость:
- вода 600 г/л при 20 °C
- Физическое описание:
- твердый
- Код продукта:
- 141101
- Название продукта:
- Сульфат алюминия 18-гидрат чистый
- Имя качества:
- чистый
- Характеристики:
- Анализ (Al2(SO4)3) (компл.
 ): 51,0-59,0 %
): 51,0-59,0 %
pH раст. 2%: 2,5-4,0Предельно допустимое содержание примесей
Хлорид (Cl): 0,05%
Аммоний (Nh5): 0,05%
Щелочные и щелочноземельные соли: 0,4%
Тяжелые металлы (в виде Pb): 0,004%
As: 0,0003 %
Cu: 0,002 %
Fe: 0,01 %
Ni: 0,002 %
Pb: 0,002 %
- Пиктограммы опасности
- ВГК:
- 1
- Хранение:
- Комнатная температура.

- Сигнальное слово:
- Опасность
- Символы СГС:
- СГС05
- H Фразы:
- х418
- P-фраз:
- P280
P305+P351+P338
P310 - Имя мастера:
- Сульфат алюминия 18-гидрат
- ИНЭКС:
- 233-135-0
- КС:
- 28332200
Загрузите файл TDS для полных спецификаций
Документы
- Паспорт безопасности Скачать
- Технический паспорт Скачать
- Информационные точки Скачать
- Брошюры Скачать
Запрос
- Запросить цену
- Техническая поддержка
Молярная масса алюминия и свойства вещества
- Молярная масса алюминия — что это за химический элемент?
- Как найти молярную массу алюминия?
- Пример использования молярной массы алюминия в задаче
- Физические свойства алюминия
- Химические свойства алюминия
- Изотопы алюминия
- Как люди получают алюминий?
- Где используется алюминий?
Алюминий нашел широкое применение в различных сферах. Свойства алюминиевых сплавов делают их пригодными для использования практически во всех существующих отраслях промышленности. С этим веществом учащиеся сталкиваются при выполнении домашних заданий по химии или лабораторных работ. Поэтому мы создали полезную инструкцию по определению молярной массы Al, так как это самая распространенная задача.
Свойства алюминиевых сплавов делают их пригодными для использования практически во всех существующих отраслях промышленности. С этим веществом учащиеся сталкиваются при выполнении домашних заданий по химии или лабораторных работ. Поэтому мы создали полезную инструкцию по определению молярной массы Al, так как это самая распространенная задача.
Молярная масса алюминия. Что это за химический элемент?
Наименование: Алюминий (Al).
Атомный вес: 26,98.
Молекулярная масса: 26,981539 а.е.м.
Количество атомов: Алюминий содержит только один атом, который состоит из положительно заряженного ядра с 13 протонами, 14 нейтронами внутри и трех электронных оболочек с 13 электронами.
Температура плавления: 660 °C.
Температура кипения: 2518,82 °С.
Молярный объем: 10,0 см³/моль.
Алюминий — легкий и ковкий металл белого цвета, серебристо-матового цвета, благодаря тонкой оксидной пленке, которая сразу же покрывает его на воздухе. Он относится к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,9.8154.
Он относится к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,9.8154.
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил квасцовую землю, которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Он назвал оксид алюминия «окись алюминия», что в переводе с латыни означает «вяжущий». В то время металл не был популярен, так как люди не находили его в чистом виде. Лишь в 1855 году в Париже на Всемирной выставке металлический алюминий произвел фурор.
Как найти молярную массу алюминия?
Чтобы найти молярную массу алюминия, нужно следовать алгоритму:
- Подготовьте таблицу Менделеева, чтобы узнать валентность данного элемента и атомные единицы массы.
- Теперь вам нужно написать химическое уравнение. Элемент всего один — Al, поэтому формула соответственно будет содержать только атом алюминия в нашей задаче.
 Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы.
Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы. - Вернитесь к периодической таблице и запишите валентность алюминия. Алюминий в своих соединениях проявляет валентность, равную III. Эти данные понадобятся вам в дальнейших расчетах.
- Зная валентность, можно найти количество молей в алюминии. В нашей задаче атом всего один, и это Al, так что формула будет выглядеть так:
M = Ar, Ar(Al) = Al · 1 моль = 26,98 г/моль.
Если вашим веществом, например, будет сульфат алюминия, то его химическая формула будет выглядеть так: Al2SO4)3. Как видите, сульфат алюминия содержит три элемента. Следовательно, нужно сложить массы этих элементов и найти моль вещества.
- Вы на пути к финалу — остался всего один шаг. Вам нужно рассчитать массу одного моля алюминия. Можно использовать такую формулу:
м (Al) = Рr (Al) / NA = 27 / 6,02 · 1023 = 4,3 · 1023г.

Как видите, мы округли число 26,98 до 27 для удобства расчетов.
Если вы не до конца понимаете алгоритм или затрудняетесь выучить все эти формулы, вы всегда можете воспользоваться помощью нашей службы написания рефератов.
Пример использования молярной массы алюминия в задаче
Знать и находить молярную массу алюминия необходимо при решении различных задач. В качестве помощи при выполнении домашних заданий мы рассмотрим один из них.
Задача: Растворение оксида алюминия.
Решение: С одной стороны масса оксида алюминия равна:
В этой формуле:
- V — объем растворенного оксида алюминия;
- ρ – его плотность;
- h – толщина барьерного слоя;
- S – площадь оксидной пленки.
С другой стороны, масса алюминия в растворе равна:
В этой формуле:
- vAl3 + количество алюминия;
- cAl3+ – концентрация ионных соединений алюминия;
- mAl – молярная масса алюминия;
- Vp – объем раствора;
- mAl3+ – масса алюминия в растворе.

Так как в оксиде алюминия на два атома алюминия приходится три атома кислорода, массу оксида можно выразить через массу металла:
Таким образом, получаем следующие данные:
Предлагаемый список, фосфорная и соляная кислоты могут быть использованы для растворения оксида алюминия:
Это кислая соль, которая образуется, так как кислота взята в большом избытке. В противном случае растворению мешал бы нерастворимый фосфат алюминия AlPO4.
Кремниевая кислота не может быть использована для растворения оксида алюминия, так как она сама нерастворима в воде.
Физические свойства алюминия
Металлический алюминий характеризуется высокой электропроводностью, теплопроводностью, устойчивостью к коррозии и морозу, пластичностью. Хорошо поддается штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки.
Алюминий имеет высокое сродство к кислороду и на воздухе покрыт тонкой прочной пленкой оксида алюминия. Эта пленка защищает металл от последующего окисления и обеспечивает хорошие антикоррозионные свойства. Алюминий устойчив к морской, а пресная вода практически не взаимодействует с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Эта пленка защищает металл от последующего окисления и обеспечивает хорошие антикоррозионные свойства. Алюминий устойчив к морской, а пресная вода практически не взаимодействует с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства алюминия
Алюминий является довольно активным амфотерным металлом. В нормальных условиях прочная оксидная пленка определяет его сопротивление. Если оксидная пленка разрушена, алюминий действует как динамичный восстанавливающий металл. При высоких температурах металл взаимодействует с кислородом. При нагревании идут реакции с серой, фосфором, азотом, углеродом, йодом. В обычных условиях металл образует отличное химическое соединение с хлором, бромом, магнием, калием. С водородом реакции нет.
При условии очистки от оксидной пленки происходит интенсивное взаимодействие с водой. Реакции с разбавленными кислотами протекают быстро. Реакции с концентрированными азотной и серной кислотами происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашла способность восстанавливать металлы из оксидов и солей — реакция алюминотермии. Также в результате реакции алюминия (Al), воды (h3O) и хлорида натрия (NaCl), образуется хлорид алюминия (AlCl3), водород (h3), гидроксид натрия (NaOH).
Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашла способность восстанавливать металлы из оксидов и солей — реакция алюминотермии. Также в результате реакции алюминия (Al), воды (h3O) и хлорида натрия (NaCl), образуется хлорид алюминия (AlCl3), водород (h3), гидроксид натрия (NaOH).
Изотопы алюминия
Известно, что в природе алюминий может находиться в виде одного стабильного изотопа 27Al. Массовое число равно 27. Ядро изотопа алюминия 27Al содержит тринадцать протонов и четырнадцать нейтронов. Существуют радиоактивные изотопы алюминия с массовыми числами от 21 до 42, среди которых наиболее долгоживущий изотоп 26Al, имеющий период полураспада 720 тысяч лет.
Как люди получают алюминий?
Алюминий входит в число металлов и занимает третье место среди всех элементов по распространенности в земной коре. Этот реагент составляет примерно 8% земной коры, а алюминий встречается в тканях животных, растений как микроэлемент. В природе встречается в связанном виде в виде горных пород, минералов. Каменная оболочка земли, находящаяся в основании материков, образована именно алюмосиликатами, силикатами.
Каменная оболочка земли, находящаяся в основании материков, образована именно алюмосиликатами, силикатами.
Чаще всего люди получают алюминий из бокситов. Месторождения этого минерала распространены в странах тропической и субтропической зон. При извлечении алюминия из нефелина люди попутно получают также поташ, кальцинированную соду, цемент и удобрения.
Где используется алюминий?
Алюминий используется в металлургии в качестве основы для сплавов и легирующего элемента. Люди используют алюминиевые сплавы в быту, архитектуре и строительстве, судостроении и автомобилестроении, космической и авиационной технике. Химики используют алюминий в производстве взрывчатых веществ. Компании используют анодированный алюминий для изготовления украшений. Нитрат алюминия используется на текстильных фабриках для травления тканей перед окрашиванием, играет жизненно важную роль в дублении кожи и используется для изготовления нитей.
Сульфат алюминия октадекагидрат | 7784-31-8
Октадекагидрат сульфата алюминия
Свойства
| Температура плавления | 86 °С |
|---|---|
| Плотность | 1,69 г/см 3 |
| температура хранения | Запечатанный в сухом, комнатной температуре |
| растворимость | 364 г/л |
| форма | Порошок/твердый |
| цвет | Белый |
| Удельный вес | 1,69 |
| Диапазон рН | 3 — 4 |
| РН | 2,5-4,0 (20 г/л, вод. ст., 20 ℃) ст., 20 ℃) |
| Растворимость воды | Растворимый |
| Чувствительный | чувствительный к влаге |
| Справочник по базе данных CAS | 7784-31-8 (Ссылка на базу данных CAS) |
| FDA UNII | TCS9L00G8F |
| Словарь онкологических терминов NCI | квасцы |
| Код УВД | S01XA07 |
| Система регистрации веществ EPA | Серная кислота, соль алюминия (3:2), октадекагидрат (7784-31-8) |
БЕЗОПАСНОСТЬ
Заявления о рисках и безопасности
| Символ (GHS) | СГС05 |
|---|---|
| Сигнальное слово | Опасность |
| Краткая характеристика опасности | х390-х418 |
| Меры предосторожности | П280-П305+П351+П338+П310 |
| Коды опасности | Н-Хн, Си, Н, Хн |
| Заявления о рисках | 51/53-41-36/37/38-22 |
| Заявления о безопасности | 61-37/39-29-26-39 |
| РИДАДР | UN3260 — класс 8 — PG 3 — RQ — Коррозионное твердое вещество, кислотное, неорганическое, н. у.к., HI: все у.к., HI: все |
| WGK Германия | 1 |
| РТЕКС | ВС5697000 |
| Код ТН ВЭД | 2833 22 00 |
| Токсичность | LD50 перорально у кроликов: > 5000 мг/кг |
Октадекагидрат сульфата алюминия цена цена Больше Цена(21)
| Производитель | Номер продукта | Описание продукта | Номер КАС | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | AX0735 | Сульфат алюминия, октадекагидрат соответствует спецификациям ACS GR ACS | 7784-31-8 | 500 г | 265 долларов | 15. 05.2022 05.2022 | Купить |
| Сигма-Олдрич | AX0745 | Сульфат алюминия, октадекагидрат | 7784-31-8 | 5 кг | 449 долларов | 15.05.2022 | Купить |
| Сигма-Олдрич | AX0735 | Сульфат алюминия, октадекагидрат соответствует спецификациям ACS GR ACS | 7784-31-8 | 2,5 кг | 1040 $ | 15. 05.2022 05.2022 | Купить |
| Сигма-Олдрич | 11044 | Октадекагидрат сульфата алюминия Puriss., соответствует аналитической спецификации Ph. Eur., BP, 100-110%, 51,0-59.0% Al2(SO4)3 на основе | 7784-31-8 | 1 кг | 108 долларов | 15.05.2022 | Купить |
| Сигма-Олдрич | 11044 | Октадекагидрат сульфата алюминия Puriss. , соответствует аналитической спецификации Ph. Eur., BP, 100-110%, 51,0-59,0% Al2(SO4)3 на основе , соответствует аналитической спецификации Ph. Eur., BP, 100-110%, 51,0-59,0% Al2(SO4)3 на основе | 7784-31-8 | 6×1 кг | 462 $ | 15.05.2022 | Купить |
| Номер продукта | Упаковка | Цена | Купить |
|---|---|---|---|
| AX0735 | 500 г | 265 долларов | Купить |
| AX0745 | 5 кг | 449 долларов | Купить |
| AX0735 | 2,5 кг | 1040 $ | Купить |
| 11044 | 1 кг | 108 долларов | Купить |
| 11044 | 6×1 кг | 462 $ | Купить |
Октадекагидрат сульфата алюминия Химические свойства, использование, производство
Использование
Соединение широко используется в бумажной промышленности.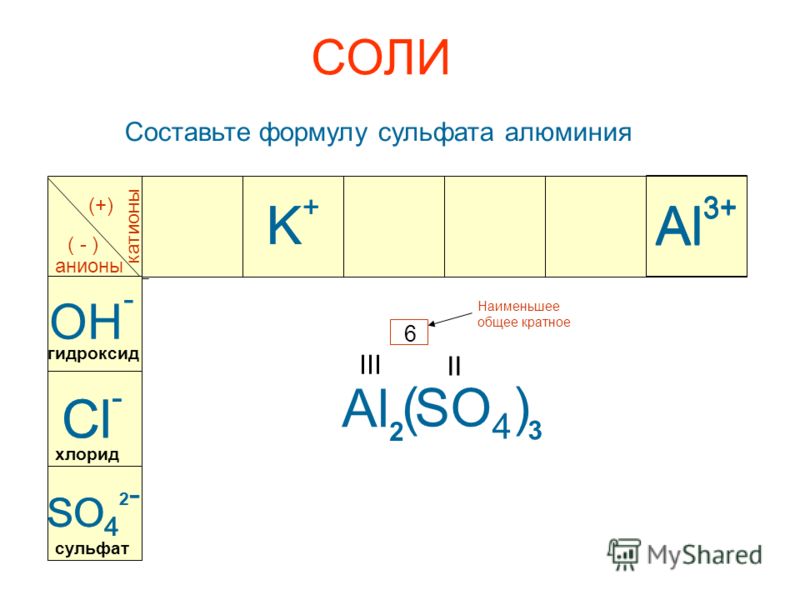 В форме кислого раствора, который содержит небольшой избыток H3SO4, он используется для регулирования pH суспензий пульпы, обработки технической воды, отверждения красителей, а также для осаждения растворенной смолы для придания размера волокнам. В слабоосновной форме (с небольшим избытком Al2O3) используется для очистки питьевых и сточных вод (например, для снижения содержания фосфора). Другие основные области применения включают окрашивание, дубление, катализаторы, модификацию бетона, а также производство различных химических и фармацевтических продуктов.
В форме кислого раствора, который содержит небольшой избыток H3SO4, он используется для регулирования pH суспензий пульпы, обработки технической воды, отверждения красителей, а также для осаждения растворенной смолы для придания размера волокнам. В слабоосновной форме (с небольшим избытком Al2O3) используется для очистки питьевых и сточных вод (например, для снижения содержания фосфора). Другие основные области применения включают окрашивание, дубление, катализаторы, модификацию бетона, а также производство различных химических и фармацевтических продуктов.
Подготовка
Получают из бокситов, каолина или соединений алюминия при реакции с H3SO4. Нерастворимую кремниевую кислоту отфильтровывают; гидрат соли образуется при кристаллизации.
Химические свойства
белый кристаллический порошок и кусочки
Физические свойства
Белый кристалл; сладкий вкус; плотность 1,62 г/см 3 : разлагается при 86,5°C; растворим в воде.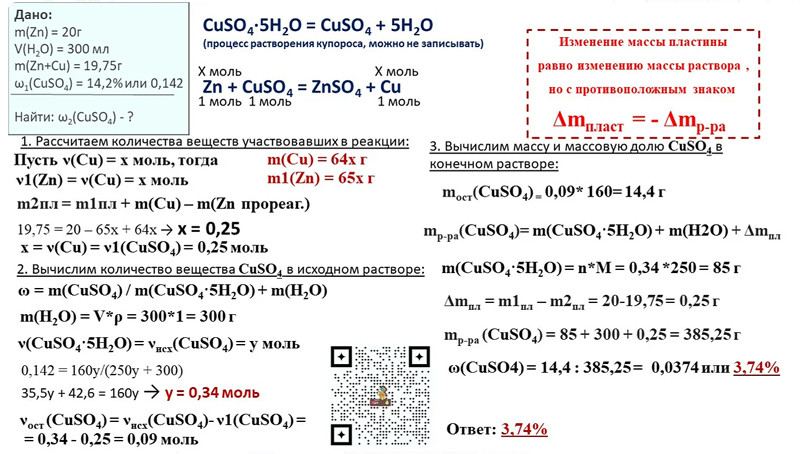
Использование
Октадекагидрат сульфата алюминия представляет собой консервант, включающий термин для нескольких соединений типа ина, таких как сульфат алюминия и сульфат калия. Он используется с этилендиаминтетрауксусной кислотой для предотвращения обесцвечивания картофеля и сохранения прочности пакетов с креветками. Он также используется в соленьях и соленьях.
Определение
ChEBI: гидрат, полученный в результате формального сочетания безводного сульфата алюминия с приблизительно 18 мол. экв. воды. Коммерческий продукт обычно содержит на 5-10% меньше воды, чем теоретический. Это один из самых распространенных гидратов сульфата алюминия.
Октадекагидрат сульфата алюминия Подготовка продуктов и сырья
Сырье
Додекагидрат сульфата алюминия-калия БОКСИТ КАОЛИН Гидроксид алюминия с низким содержанием железа Сульфат алюминия
алунит Гидроксид алюминия
chevron_left
1 из 2
chevron_right
Продукты для подготовки
Посмотреть последнюю цену от производителей октадекагидрата сульфата алюминия
| Изображение | Время обновления | Продукт | Цена | Мин. Заказ Заказ | Чистота | Способность снабжения | Производитель | |
|---|---|---|---|---|---|---|---|---|
| 05.07.2022 | Октадекагидрат сульфата алюминияLEATE 7784-31-8 | 100 долларов США / кг | 1 кг | 0,99 | 20 тонн | Хэбэй Руйяо Биотехнология Лтд | ||
23. 01.2022 01.2022 | Сульфат алюминия октадекагидрат 7784-31-8 | 5,00 долларов США / кг | 1 кг | 0,99 | 25 | XINGTAI XINGJIU NEW MATERIAL TECHNOLOGY CO., LTD. | ||
| 2021-12-01 | Октадекагидрат сульфата алюминия 7784-31-8 | 1,00 долл. США / кг / мешок США / кг / мешок | 10 г | 99 % | 10000 кг | Хэбэй Кровелл Биотех Ко Лтд. |
- Октадекагидрат сульфата алюминияLEATE
7784-31-8
- 100 долларов США / кг
- 0,99
- Хэбэй Руйяо Биотехнология Лтд
- Октадекагидрат сульфата алюминия
7784-31-8
- 5,00 долларов США / кг
- 0,99
- XINGTAI XINGJIU NEW MATERIAL TECHNOLOGY CO.
 , LTD
, LTD
- Октадекагидрат сульфата алюминия
7784-31-8
- 1,00 долл. США / кг / мешок
- 99 %
- Хэбэй Crovell Biotech Co Ltd
Сульфат алюминия, октадекагид
ТОРТ квасцы
СУЛЬФАТ АЛЮМИНИЯ ОКТАДЕКАГИДРАТ
СУЛЬФАТ АЛЮМИНИЯ — 18 ч3О
СУЛЬФАТ АЛЮМИНИЯ, 18-ГИДРАТ
СУЛЬФАТ АЛЮМИНИЯ ГЕКСАДЕКАГИДРАТ
СУЛЬФАТ АЛЮМИНИЯ ГИДРАТИРОВАННЫЙ
АЛЮМИНИЯ СУЛЬФАТ-18-ГИДРАТ
Октадекагидрат сульфата алюминия
СУЛЬФАТ АЛЮМИНИЯ 16х3О
СУЛЬФАТ АЛЮМИНИЯ 18-ГИДРАТ
СУЛЬФАТ АЛЮМИНИЯ ГИДРАТИРОВАННЫЙ
КВАсцы
Триэтид алюминия
СУЛЬФАТ АЛЮМИНИЯ ОКТАДЕКАГИДРАТ, 98+%, А. К.С. РЕАГЕНТ
СУЛЬФАТ АЛЮМИНИЯ ОКТАДЕКАГИДРАТ 98+% &
СУЛЬФАТ АЛЮМИНИЯ-18-ГИДРАТ EXTRA PURE, DAB, PH. ЭУР., Б. П., РН. ФРАНК, USP
Сульфат алюминияОчищенный
Сульфат алюминияGr
АлюминийсульфатUsp
Сульфат алюминия, порошок
Алюминийсульфатгидрат, ACS, 98,0-102%
СУЛЬФАТ АЛЮМИНИЯ 18-ГИДРАТНЫЙ РЕАГ.
Октадекагидрат сульфата алюминия, особо чистый
маринованные квасцы
ПАТЕНТНЫЕ КВАЛЮСЫ
Октадекагидрат сульфата алюминия, для анализа ACS, 98+%
Серная кислота, алюминиевая соль (3:2), октадекагидрат (8CI, 9CI)
Реагент ACS гидрата сульфата алюминия, >=98%
Чистота гидрата сульфата алюминия, соответствует аналитической спецификации Ph.
К.С. РЕАГЕНТ
СУЛЬФАТ АЛЮМИНИЯ ОКТАДЕКАГИДРАТ 98+% &
СУЛЬФАТ АЛЮМИНИЯ-18-ГИДРАТ EXTRA PURE, DAB, PH. ЭУР., Б. П., РН. ФРАНК, USP
Сульфат алюминияОчищенный
Сульфат алюминияGr
АлюминийсульфатUsp
Сульфат алюминия, порошок
Алюминийсульфатгидрат, ACS, 98,0-102%
СУЛЬФАТ АЛЮМИНИЯ 18-ГИДРАТНЫЙ РЕАГ.
Октадекагидрат сульфата алюминия, особо чистый
маринованные квасцы
ПАТЕНТНЫЕ КВАЛЮСЫ
Октадекагидрат сульфата алюминия, для анализа ACS, 98+%
Серная кислота, алюминиевая соль (3:2), октадекагидрат (8CI, 9CI)
Реагент ACS гидрата сульфата алюминия, >=98%
Чистота гидрата сульфата алюминия, соответствует аналитической спецификации Ph. Eur., BP, 100-110%, 51,0-59,0% Al2(SO4)3 на основе
СУЛЬФАТ АЛЮМИНИЯ 18х3О
Гидрат сульфата алюминия, соответствует аналитической спецификации Ph.Eur.BP
Гидрат сульфата алюминия, гидрат
алюминийсульфатокатадекагидрат
алюминийсульфатеокатадекагидрат
сульфат алюминия (неспецифическое название)
алюминийсульфатеокатадекагидрат
торталюмоктадекагидрат
диалюминийсульфатоктадекагидрат
Серная кислота, соль алюминия (3: 2), октадекагидрат
Октадекагидрат сульфата алюминия,98+%(АКС)
гидрат сульфата алюминия, ас
СУЛЬФАТ АЛЮМИНИЯ, КРИСТАЛЛ, FCC
СУЛЬФАТ АЛЮМИНИЯ,ГИДРАТНЫЙ,КРИСТАЛЛ,РЕАГЕНТ,ACS
АЛЮМИНИЙСУЛЬФАТОКТАДЕКАГИДРАТ
Серная кислота, соль алюминия, октадекагидрат
СУЛЬФАТ АЛЮМИНИЯ ОКТАДЕКАГИДРАТ (ACS)
Сульфат алюминия, гранулированный
сульфат алюминия, гидратированный
сульфат алюминия, низкое содержание железа
сульфат алюминия, жидкий
Октадекагидрат сульфата алюминия, для анализа ACS
Октадекагидрат сульфата алюминия,98+%, для анализа ОКС
Серная кислота, соль алюминия (3: 2), окта
Торговый терминфоралум
Алюминия сульфат 18-гидрат, особо чистый, Ph Eur, BP
СУЛЬФАТ АЛЮМИНИЯ (AS)
октадекагидрат сульфата алюминия, 98+%, реагент АЦС
Eur., BP, 100-110%, 51,0-59,0% Al2(SO4)3 на основе
СУЛЬФАТ АЛЮМИНИЯ 18х3О
Гидрат сульфата алюминия, соответствует аналитической спецификации Ph.Eur.BP
Гидрат сульфата алюминия, гидрат
алюминийсульфатокатадекагидрат
алюминийсульфатеокатадекагидрат
сульфат алюминия (неспецифическое название)
алюминийсульфатеокатадекагидрат
торталюмоктадекагидрат
диалюминийсульфатоктадекагидрат
Серная кислота, соль алюминия (3: 2), октадекагидрат
Октадекагидрат сульфата алюминия,98+%(АКС)
гидрат сульфата алюминия, ас
СУЛЬФАТ АЛЮМИНИЯ, КРИСТАЛЛ, FCC
СУЛЬФАТ АЛЮМИНИЯ,ГИДРАТНЫЙ,КРИСТАЛЛ,РЕАГЕНТ,ACS
АЛЮМИНИЙСУЛЬФАТОКТАДЕКАГИДРАТ
Серная кислота, соль алюминия, октадекагидрат
СУЛЬФАТ АЛЮМИНИЯ ОКТАДЕКАГИДРАТ (ACS)
Сульфат алюминия, гранулированный
сульфат алюминия, гидратированный
сульфат алюминия, низкое содержание железа
сульфат алюминия, жидкий
Октадекагидрат сульфата алюминия, для анализа ACS
Октадекагидрат сульфата алюминия,98+%, для анализа ОКС
Серная кислота, соль алюминия (3: 2), окта
Торговый терминфоралум
Алюминия сульфат 18-гидрат, особо чистый, Ph Eur, BP
СУЛЬФАТ АЛЮМИНИЯ (AS)
октадекагидрат сульфата алюминия, 98+%, реагент АЦС
Молярная масса al2s3o12
Нахождение атомной массы al2s3o12
Нужно узнать атомную массу молекулы al2s3o12? Наш калькулятор молекулярной массы использует периодическую таблицу и химическую формулу для решения
молярная масса химического соединения на основе эмпирической формулы соединения. Калькулятор берет элементный состав соединения и взвешивает элементы, чтобы получить
эмпирическая формула массы.
Обратите внимание, что калькулятор предполагает чистое вещество — если вы
зная о разбавлении или примесях, сделайте соответствующие поправки на молярность данного вещества.
Калькулятор берет элементный состав соединения и взвешивает элементы, чтобы получить
эмпирическая формула массы.
Обратите внимание, что калькулятор предполагает чистое вещество — если вы
зная о разбавлении или примесях, сделайте соответствующие поправки на молярность данного вещества.
Этот проект начался с калькулятора молекулярной массы для химических реакций. Вы можете использовать наш калькулятор, чтобы решить для теоретический выход эксперимента. У нас также есть калькулятор процента выхода, который может помочь вам применить это к реальным экспериментам. Используйте молярное отношение и эмпирическую формулу, чтобы понять пределы реагентов.
Другие термины: атомная масса al2s3o12, молярная масса al2s3o12, молекулярная масса,
Как работает калькулятор молярной массы?
Берем предоставленную вами формулу (NaCl — поваренная соль — в нашем примере по умолчанию) и распаковываем ее на составные элементы. Тогда мы
сравнить каждый атом с таблицей стандартных атомных весов для этого элемента. Мы представляем результаты в таблице внизу
калькулятор молярной массы — он покажет количество атомов, атомный вес каждого элемента и молекулярный вес молекулы. Он определяет общую массу молекулярной формулы (средняя молекулярная масса).
Мы представляем результаты в таблице внизу
калькулятор молярной массы — он покажет количество атомов, атомный вес каждого элемента и молекулярный вес молекулы. Он определяет общую массу молекулярной формулы (средняя молекулярная масса).
Отсюда разбиваем формулу ал2с3о12 на части — и т.д.
Мы еще не реализовали скобки (пока), поэтому вам нужно будет распаковать все выражения в скобках. На вес они никак не влияют.
Просто возьмите каждый элемент и умножьте его на количество раз, когда структура в квадратных скобках встречается. Например:
(C 6 H 5 ) 3 PCCO => C18h25PCCO
Определение молярной массы других химических соединений
Наш калькулятор молярной массы имеет это для множества других соединений: хлорида натрия, углекислый газ, серная кислота, глюкоза…
- Молярная масса воды (h3O)
- Молярная масса гидроксида аммония (Al(OH)3)
- Молярная масса фосфата аммония ((Nh5)3PO4)
- Молярная масса субсалицилата висмута (C7H5BiO4)
- 9 Молярная масса
- 9 Масса гидроксида кальция (Ca(OH)2)
- Молярная масса карборунда (SiC)
- Молярная масса соляной кислоты (HCl)
- Молярная масса фосфорной кислоты (h4PO4)
- Молярная масса хлорида аммония (Nh5Cl)
- Молярная масса разрыхлителя (NaHCO3)
- Молярная масса сахарозы (C12h32O11)
- Молярная масса изопропилового спирта ((Ch4)2CHOH)
- Молярная масса монооксида углерода (CO)
- Молярная масса хлорида сурьмы — 3 (SbCl3)
- Молярная масса хлорплатина кислота (h3PtCl6)
- Молярная масса молочной кислоты (C3H6O3)
- Молярная масса сульфата ртути (HgSO4)
- Молярная масса бромата калия (KBrO3)
- Молярная масса тиоцианата калия (KCNS) Молярная масса натрия хромат (Na2CrO4)
- Molar Mass of Sodium potassium tartrate (NaKC4h5O6)
- Molar Mass of Thiourea (Ch5N2S)
- Molar Mass of Cinnabar (HgS)
- Molar Mass of Ammonia (Nh4)
- Molar Mass of Ammonium bicarbonate (Nh5HCO3)
- Молярная масса ацетона ((CH3)₂CO)
- Молярная масса фосфата алюминия (AlPO4)
- Молярная масса дубильной кислоты (C76H52O46)
- Молярная масса цитрата натрия (AgC2h4O2)
- Молярная масса карбоната аммония ((Nh5) )2CO3)
- Молярная масса гипохлорита калия (KClO)
- Молярная масса нитрида натрия (Na3N)
- Молярная масса винной кислоты (C4H6O6)
- Молярная масса тетрафторбората серебра (AgBF4)
- Молярная масса нитрида серебра (AgCNOful)
- Молярная масса хлорида золота (AuCl)
- Молярная масса триселенида золота (Au2Se3)
- Молярная масса диметилкадмия (C2H6Cd)
- Молярная масса пропан-1-ола (C3H8O)
- Молярная масса алюминия (Al) )
- Молярная масса аргона (Ar)
- Молярная масса лития (Li)
- Молярная масса пентадекана (C15h42)
- Молярная масса триаконтана (C30H62)
- Молярная масса циклогексана (C6h22) 9 Молярная масса Метиламин (MeNh3)
- Молярная масса азота серы (NS)
- Молярная масса оксида кремния (SiO)
- Молярная масса формальдегида (h3CO)
- Молярная масса изотиоциановой кислоты (HNCS)
- Молярная масса гидроксида цеза (CsOH)
- Молярная масса фтороборной кислоты (HBF4)
- Молярная масса дурена (C10h24)
- Молярная масса пикриновой кислоты ((O2N)3C6h3OH)
Создание закладок, сохранение и публикация результатов
может переключаться между различными частями набора задач. Мы рекомендуем вам добавить его в закладки, чтобы вы могли вернуться к нему .
Вы также можете поделиться результатами с партнером по обучению или преподавателем , нажав «Рассчитать» и скопировав URL-адрес этой страницы. Когда ваш партнер по учебе
открывает URL-адрес, они увидят ваши расчеты. Это легко поделиться и сохранить результаты по электронной почте. (Однако обязательно сначала нажмите «Вычислить»)
Мы рекомендуем вам добавить его в закладки, чтобы вы могли вернуться к нему .
Вы также можете поделиться результатами с партнером по обучению или преподавателем , нажав «Рассчитать» и скопировав URL-адрес этой страницы. Когда ваш партнер по учебе
открывает URL-адрес, они увидят ваши расчеты. Это легко поделиться и сохранить результаты по электронной почте. (Однако обязательно сначала нажмите «Вычислить»)
У вас также есть возможность сохранить ссылки на расчеты в файлах ваших научных заметок, чтобы вы могли быстро открыть их или проверить позже. Опять же — сначала нажмите «Рассчитать», чтобы URL-адрес обновлялся с учетом ваших последних изменений. Затем скопируйте и сохраните URL-адрес.
FAQ — Калькулятор молярной массы
Что такое молярная масса в химии?
Молярная масса является важным понятием при адаптации химических формул к реальным условиям. Мы можем сбалансировать химическое уравнение
и определите, что одна молекула водорода соединяется с двумя молекулами кислорода, образуя воду (или соединение по вашему выбору). Но как бы ты
подготовить материалы в лаборатории? Или если бы вы, например, покупали кислород для процесса, как бы вы определили, сколько его нужно использовать?
сделать заданное количество воды? Молярная масса позволяет нам преобразовать химическую реакцию в определенные количества реагентов, необходимых для
процесс. Преобразовав взаимодействие атомов в граммы, мы можем измерить и использовать соответствующее количество необходимых реагентов. Формула массы помогает нам решить эту проблему.
Но как бы ты
подготовить материалы в лаборатории? Или если бы вы, например, покупали кислород для процесса, как бы вы определили, сколько его нужно использовать?
сделать заданное количество воды? Молярная масса позволяет нам преобразовать химическую реакцию в определенные количества реагентов, необходимых для
процесс. Преобразовав взаимодействие атомов в граммы, мы можем измерить и использовать соответствующее количество необходимых реагентов. Формула массы помогает нам решить эту проблему.
Что такое относительная атомная масса/относительная молекулярная масса/средний молекулярный вес?
Относительная атомная масса соединения представляет собой отношение средней массы элементов в химическом соединении к
атомная постоянная массы, которая определяется как 1/12 массы атома углерода 12. Для одного образца относительная атомная
Масса образца представляет собой взвешенное среднее арифметическое масс отдельных атомов, присутствующих в образце (также
называется средней атомной массой). Это зависит от изотопа элемента (например, углерод-12 или углерод-13,
поскольку два изотопа имеют разную атомную массу из-за дополнительных нейтронов). в
В реальном мире это может варьироваться в зависимости от того, где был собран образец — из-за различий в конкретных изотопах
присутствующие элементы (обусловленные различиями в радиоактивном распаде и тем, как материал был агрегирован с самого начала).
Это зависит от изотопа элемента (например, углерод-12 или углерод-13,
поскольку два изотопа имеют разную атомную массу из-за дополнительных нейтронов). в
В реальном мире это может варьироваться в зависимости от того, где был собран образец — из-за различий в конкретных изотопах
присутствующие элементы (обусловленные различиями в радиоактивном распаде и тем, как материал был агрегирован с самого начала).
Как найти молярную массу
Возьмите стандартную химическую формулу молекулы, разделите ее на составные атомы и найдите молярную массу каждого атома. Добавьте вес атомов в молекуле, и вы получите молярную массу молекулы.
Содержание: калькулятор теоретического выхода
Performance Ingenuity
Copyright 2020. Политика конфиденциальности
СУЛЬФАТ АЛЮМИНИЯ ТВЕРДЫЙ | CAMEO Chemicals
Добавить в MyChemicals Версия для печати Страница
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
| никто | данные недоступны |
|
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто |
| ||
NFPA 704
данные недоступны
Общее описание
Безводный сульфат алюминия представляет собой белое кристаллическое твердое вещество. Сульфат алюминия также получают в виде 18-гидрата Al2(SO4)3.18h3O. Обе формы растворимы в воде, негорючи и нетоксичны. Основной опасностью является угроза окружающей среде. Необходимо принять немедленные меры для ограничения его распространения в окружающую среду. Он используется в производстве бумаги, в пенах для пожаротушения, а также при очистке сточных вод и воды.
Сульфат алюминия также получают в виде 18-гидрата Al2(SO4)3.18h3O. Обе формы растворимы в воде, негорючи и нетоксичны. Основной опасностью является угроза окружающей среде. Необходимо принять немедленные меры для ограничения его распространения в окружающую среду. Он используется в производстве бумаги, в пенах для пожаротушения, а также при очистке сточных вод и воды.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
- Реагирует с водой
Реакции с воздухом и водой
Растворяется в воде с выделением некоторого количества тепла. Создает кислые растворы.
Создает кислые растворы.
Пожароопасность
Информация отсутствует.
Опасность для здоровья
Вдыхание пыли вызывает раздражение носа и рта. Проглатывание больших доз вызывает раздражение желудка, тошноту, рвоту и понос. Пыль раздражает глаза и кожу. (USCG, 1999)
Профиль реактивности
Водные растворы СУЛЬФАТА АЛЮМИНИЯ являются кислыми. Твердое вещество может вызывать коррозию металлов в присутствии влаги.
Принадлежит к следующей реакционной группе(ам):
- Соли кислотные
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа
включают в себя расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, пожарное реагирование, защитная одежда и первая помощь.
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Информация отсутствует.
Пожаротушение
Информация отсутствует.
Non-Fire Response
Информация отсутствует.
Защитная одежда
Респиратор от пыли; защитные очки или лицевой щиток; резиновые перчатки (USCG, 1999)
DuPont Tychem® Suit Fabrics
Информация отсутствует.
Первая помощь
ВДЫХАНИЕ: промыть нос и рот водой.
ПРОГЛАТЫВАНИЕ: дать большое количество воды.
ГЛАЗА: промывать водой не менее 15 мин.
КОЖА: промыть водой, промыть водой с мылом. (Геологическая служба США, 1999 г.)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников. источники данных.
источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: данные отсутствуют
Давление паров отсутствует
Плотность паров (относительно воздуха): данные отсутствуют
Удельный вес: 2,71 при 68°F 1,7 при 20°С (USCG, 1999)
Температура кипения: данные отсутствуют
Молекулярная масса: 666,4 (USCG, 1999)
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.
PAC (критерии защитных действий)
| Химическая | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Сульфат алюминия (10043-01-3) | 38 мг/м3 | 64 мг/м3 | 380 мг/м3 |
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Сульфат алюминия | 10043-01-3 | 5000 фунтов |
(Список списков Агентства по охране окружающей среды, 2022 г.


 Также
Также chem.qmul.ac.uk .
chem.qmul.ac.uk . fr ,.
fr ,.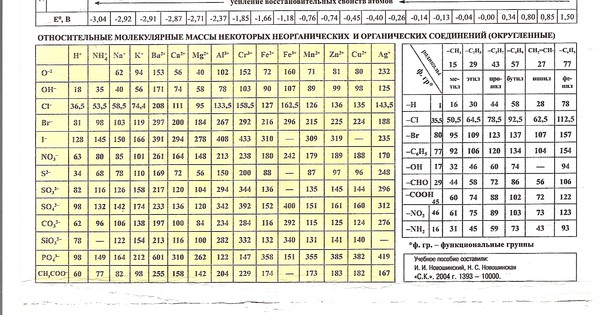
 Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.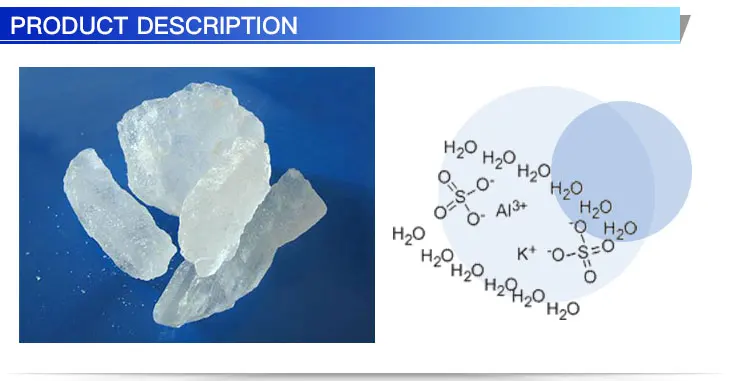

 Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл. Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе. 1211
1211 ): 51,0-59,0 %
): 51,0-59,0 % 
 Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы.
Если бы у вас было соединение оксида алюминия, уравнение было бы Al2O3. Вы можете составить такую формулу, изучив валентности элементов периодической таблицы.

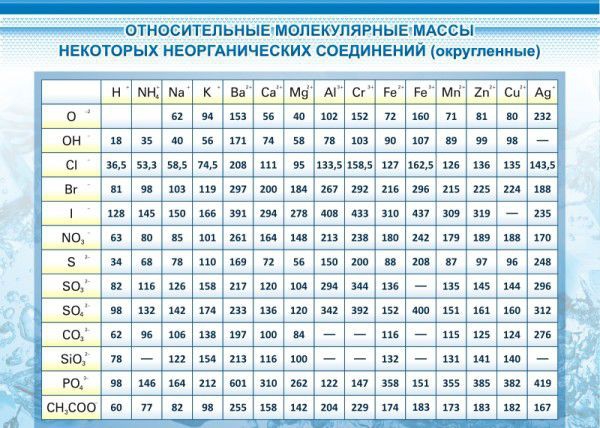 , LTD
, LTD