Контрольные вопросы
1. Основные химические понятия и законы
1. Дайте формулировки основных стехиометрических законов (постоянства состава, простых объемных отношений, простых кратных отношений, Авогадро, эквивалентов).
2. Дайте определения химическим понятиям: атом, молекула, атомная и молекулярная масса, элемент, эквивалент, простое и сложное вещество.
3. Дайте определения химическим понятиям: моль, молярная масса, молярный объем, молярная масса эквивалента, молярный объем эквивалента, относительная плотность газа.
4. Охарактеризуйте типы химических реакций (соединения, разложения, обмена, замещения).
5. Дайте определения основным классам неорганических соединений (оксиды, основания, кислоты, соли).
6. Изложите основные принципы номенклатуры неорганических соединений.
7. Приведите
классификацию и охарактеризуйте свойства
оксидов.
8. Приведите классификацию и охарактеризуйте общие химические свойства кислот.
9. Приведите классификацию и охарактеризуйте общие химические свойства оснований.
10. Приведите классификацию, опишите свойства и способы получения солей.
Пример 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CoCoOCo(OH)2CoCl2.
Данное задание направлено на актуализацию знаний о классах неорганических соединений и их генетических связях. Необходимо написать соответствующие реакции и расставить коэффициенты.
Для получения из кобальта его оксида необходимо окислить металл кислородом:
2Co + O2 = 2CoO
оксид кобальта (II)
2) Оксиду кобальта
соответствует нерастворимый гидроксид,
поэтому его нельзя получить непосредственно
реакцией с водой.
а) CoO + H2SO4 = CoSO4 + H2O
б) CoSO4+2KOH=Co(OH)2+Na2SO4
гидроксид
кобальта(II)
3) Получить соль из гидроксида кобальта (II) можно реакцией нейтрализации с соответствующей кислотой:
Co(OH)2 + 2HCl = 2H2O + CoCl2
хлорид кобальта(II)
Пример 2. Какой объем при н.у. займет углекислый газ, полученный при термическом разложении 10 г карбоната кальция? Какова масса этой порции газа? Сколько молекул она содержит?
Дано: m(CaCO3)= 10 г | Решение. 10 г х (л), у (г) CaCO 3 = CaO + CO2 |
Найти: V(CO2), N(CO2), m(CO2). | М=100 г/моль, Vm=22,4 л/моль М=44 г/моль |
По уравнению реакции из одного моля карбоната кальция получается 1 моль углекислого газа, определим, сколько молей СаСО 3 взято для реакции: =m/М, (СаСО3)=10/100=0,1(моль). Следовательно (СО2)=0,1 моль. Найдем объем этого количества газа: V=Vm, V=0,122,4=2,24(л). Найдем массу газа: m=M, m=0,144=4,4 (г) Найдем число молекул: N=NA, NA=6,021023 моль-1, N=0,16,021023=6,021022(молекул) Ответ: V(CO2)=2,24
л, m(CO2)=4,4
г, N(CO2)=6,021022 молекул. | |
Пример 3.
Определите массу углекислого газа,
который при 17
Дано: | Решение. Воспользуемся уравнением Менделеева – Клапейрона: |
p = 95 кПа = 95103 Па tо = 17oC; V=2 л = 210-3 м3 | pV=mRT/M, откуда m=pVM/RT р=95103Па, V=210-3 м3, Т=17+273=290 К, R=8,314 Дж/мольК, М(СО2)=4410-3 кг/моль, |
Найти: m(СО2) |
m=95103210 -34410-3/8,314290=346,7510-3 (кг)
Ответ: m(CO2)=
346,75 г.
Пример 4. Вычислите молекулярную массу газа, если плотность его по кислороду 1,38.
Дано: D(O2)=1,38 | Решение. D(O2)=Мr(газа )/Мr(О2), Мr(газа ) = D(O2) Мr(О2) |
Найти: Мr(газа) | Мr(O2) = 162=32 , Мr(газа )=1,3832=44. |
Ответ: Мr
Пример 5. При восстановлении водородом 2,68 г оксида металла образовалось 0,648 г воды. Вычислите молярную массу эквивалента металла.
Дано: m(MexOy)=2,68 г | Решение. |
M(H2O) = 0,648 г | |
Найти: МЭ(Ме) | MexOy + H2 Me + H2O |
(O) = (H2O) = 0,036 моль
М(О) = 16 г/моль
m(O) = 0,03616 = 0,576 (г)
Найдем массу металла.
M (Me) = m (MexOy) – m (O)
m (Me) = 2,68 – 0,576 = 2,104 (г)
Найдем молярную массу эквивалента металла, пользуясь законом эквивалентов, учитывая, что МЭ (О)=8 г/моль-экв:
Ответ: МЭ(Ме)
= 29,2 г/моль-экв.
Пример 6. Рассчитайте молярную массу эквивалента соли – Cr2(SO4)3.
Дано: Cr2 | Решение: МЭ=Мf, fсоли=1/число атомов металлавалентность металла |
Найти: МЭ | М(Cr2(SO4)3)=252+3(32+416)=392(г/моль), f(Cr2(SO4)3)= МЭ=3691/6=65,3 (г/моль-экв) |
Ответ: МЭ=65,3 г/моль-экв.
Пример 7. При взаимодействии 2,33 г смеси железа и
цинка с кислотой выделилось 896 мл водорода
при н.у. Вычислите массу железа и цинка
в смеси.
Дано: | Решение: x моль х моль y моль y моль |
m(Zn+Fe)=2,33 г | 2HCl + Zn= ZnCl2 + H2 , Fe + 2HCl = H2 + FeCl2 |
V(H2)=896 мл=0,896 л | 1 моль 1 моль 1 моль 1 моль |
Найти: m(Zn), m(Fe). | M=M, M(Zn)=65 г/моль, M(Fe)=56 г/моль m(Zn)=65x (г), m(Fe)=56y (г) |
(моль) 65х+56у=2,33
х + у = 0,04
х=0,01 моль, m(Zn)=650,01=0,65 (г)
у=0,03 моль, m(Fe)=560,03=1,68 (г).
Ответ: m(Zn)=0,65
г; m(Fe)=1,68
г.
Задания для самостоятельного решения
Вариант 1
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ZnZnOZnSO4Zn(OH)2ZnO.
2. Сколько цинка надо растворить в кислоте для получения 2,8 л водорода (при н.у.)?
3. Какой объем займут 8 г кислорода при 27оС и давлении 5 атмосфер? Сколько молекул содержится в этой порции газа?
4. Чему равна молярная масса эквивалента гидроксида бария в реакции: Ba(OH)2+H2SO4=BaSO4+2H2O?
5. Определите молекулярную массу газа, если его относительная плотность по азоту равна 2,54.
Вариант 2
1. Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
PP2O5H3PO4Na3PO4Ca3(PO4)2.
2. Какое количество вещества водорода потребуется для восстановления меди из 20 г CuO? Какой объем при нормальных условиях займет это количество газа?
3. Вычислите молекулярную массу газа, если плотность его при 127оС и давлении 3 атмосферы равна 4 г/л.
4. Чему равна молярная масса эквивалента фосфорной кислоты в реакции: H3PO4+Ca(OH)2=CaHPO4+2H2O?
5. Относительная плотность газа по воздуху 0,97. Определите молекулярную массу газа.
Вариант 3
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:CaCaOCa(OH)2CaCO3CaCl2.
2. Какова масса хлорида меди, образовавшегося при взаимодействии меди с 11,2 л хлора? Определите число молекул хлора в данной порции газа.
3. Вычислите
молекулярную массу газа, если плотность
его по воздуху 2,45.
4. Чему равна молярная масса эквивалента кальция, если 1 г его вытесняет из кислоты 560 мл водорода?
5. Какой объем займут 56 г азота при температуре 25оС и давлении 120 кПа?
Вариант 4
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: SSO2SO3H2SO4BaSO4.
2. Какой объем и какое количество вещества кислорода потребуется для полного сжигания 1 л сероводорода?
3. Стальной баллон емкостью 20 л наполнен кислородом при температуре 17оС и давлении 108 Па. Вычислите массу кислорода.
4. Молярная масса эквивалента металла равна 23 г/моль. Сколько граммов этого металла необходимо взять для выделения 135,6 мл водорода из кислоты при н.у?
5. Определите
молекулярную массу газа, если его
относительная плотность по воздуху
2,45.
Вариант 5
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: MgMgOMg(NO3)2Mg(OH)2MgO.
2. Какой объем и какое количество вещества углекислого газа образуется при сжигании 32 г метана?
3. Вычислите массу 400 м3 оксида углерода(II) при 27оС и давлении 107 кПа.
4. Рассчитайте молярную массу эквивалента соли – Ca3(PO4)2.
5. Относительная плотность газа по кислороду равна 0,5. Рассчитайте его молекулярную массу.
Вариант 6
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: NNONO2HNO3Al(NO3)2.
2. Вычислите, сколько
моль углекислого газа выделится при
термическом разложении 10 г карбоната
кальция? Какой объем займет этот газ
при н. у.?
у.?
3. Вычислите, какой объем займут 40 м3 газа, взятого при н.у., если температура газа станет равной 36оС, а давление 10 атм.
4. На восстановление 9,2 г металла из его оксида израсходовалось 3,36 л водорода, взятого при н.у. Определите молярную массу эквивалента металла.
5. Рассчитайте молекулярную массу газа, если его относительная плотность по водороду 35,5.
Вариант 7
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: BaBaOBa(OH)2BaCl2BaSO4.
2. Какой объем при н.у. занимает 2,51021 молекул азота? Сколько г аммиака можно получить из такого количества азота?
3. Определите молекулярную массу газа, если при 17оС и давлении 95 кПа 2,15 г его занимают объем 2 л.
4. На восстановление
12,8 г двухвалентного металла из его
оксида потребовалось 4,48 л водорода при
н. у. Определите молярную массу эквивалента
металла.
у. Определите молярную массу эквивалента
металла.
5. Чему равна молекулярная масса газа, относительная плотность которого по кислороду 0,94?
Вариант 8
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CCO2H2CO3Na2CO3CaCO3
2. Определите относительную молекулярную массу газа, если 1,65 г (н.у.) его занимают объем 0,52 л.
3. Вычислить объем 200 г метана (СН4) при температуре 50оС и давлении 253,25 кПа.
4. Рассчитайте молярную массу эквивалента гидроксида алюминия в реакции: Al(OH)3+2HCl=AlOHCl2+2H2O.
5. Сколько молей хлороводорода можно получить из газовой смеси, содержащей при н.у. 10 л водорода и 11 л хлора?
Вариант 9
1. Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
SiSiO2K2SiO3H2SiO3SiO2.
Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
SiSiO2K2SiO3H2SiO3SiO2.
2. Какова масса 12,041025 молекул воды? Какой объем кислорода потребуется для получения такой массы воды?
3. Какой объем займут10 л газа, взятого при н.у., если температура его станет равной 17оС, а давление 20 атмосфер?
4. Рассчитайте молярную массу эквивалента соли – Fe2(SO4)3.
5. Рассчитайте молекулярную массу газа, относительная плотность которого по водороду 22.
Вариант 10
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: FeFe2O3FeCl3Fe(OH)3Fe2O3.
2. Какова масса 5 л
хлора при н. у? Сколько молекул хлора
содержится в этом объеме газа? Какой
объем хлороводорода можно получить из
этого газа?
у? Сколько молекул хлора
содержится в этом объеме газа? Какой
объем хлороводорода можно получить из
этого газа?
3. Вычислите объем 350 г хлора при температуре 37оС и давлении 5 атмосфер.
4. Рассчитайте молярную массу эквивалента СаСО3.
5. Относительная плотность газа по азоту равна 1,57. Какова относительная молекулярная масса этого газа?
Вариант 11
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: AlAl2O3Al(NO3)3Al(OH)3Al2O3.
2. Сколько молекул содержится в 3 л аммиака при н.у.? Какой объем водорода потребуется для получения такого объема аммиака?
3. Какой объем займут 40 г хлора при 27оС и давлении 1012 кПа?
4. Рассчитайте
молярную массу эквивалента Н3РО4.
5. Относительная плотность газа по воздуху равна 0,55. Определите относительную молекулярную массу газа
Вариант 12
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: LiLi2OLiOHLi2SO4LiCl.
2. Определите относительную молекулярную массу газа, если при н.у. 0,4 г его занимают объем 0,56 л. Сколько молекул содержится в данной порции газа?
3. Какова масса 1 м3 воздуха при 27оС и давлении 105 Па, если средняя молекулярная масса воздуха равна 29?
4. Рассчитайте молярную массу эквивалента борной кислоты Н3ВО3.
5. Относительная плотность газа по воздуху 1,17. Определите относительную молекулярную массу газа.
Вариант 13
1. Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
CrCr2O3CrCl3Cr(OH)3Cr2O3.
2. Какое количество вещества содержится в 10 л азота при н.у? Сколько молекул содержит данная порция газа? Какой объем аммиака можно получить из этого газа?
3. Какова масса 1 л воздуха при температуре 25оС и давлении 105 Па, если при н.у. масса 1 л воздуха 1,293 г?
4. Рассчитайте молярную массу эквивалента ВаСО3.
5. Чему равна относительная плотность углекислого газа по воздуху?
Вариант 14
1..Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: SrSrOSr(OH)2Sr(NO3)2SrSO4.
2. Сколько молекул содержится в 3 л кислорода?
3. Какой объем займут 10 г водорода при 100оС и давлении 10 атм?
4. Рассчитайте
молярную массу эквивалента серной
кислоты в реакции: H2SO4+Ca(OH)2=CaSO4+2H2O.
5. Рассчитайте относительную плотность этилена (С2Н4) по азоту.
Вариант 15
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Cl2O7HclO4Ca(ClO4)2CaCO3CO2.
2. Какой объем водорода выделится (н.у.) при взаимодействии 0,2 моль соляной кислоты с цинком? Сколько молекул водорода содержится в этом объеме?
3. Вычислите массу 1 л ацетилена (С2Н2) при температуре 60оС и давлении 5 атм.
4. Рассчитайте молярную массу эквивалента соли — ZnSO4.
5. Чему равна относительная плотность кислорода по воздуху?
Молярная масса — что это? Как рассчитать? Формулы и примеры
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
 Это число такое большое, потому что вода представляет собой такую маленькую молекулу. Итак, хотя два октагидрата гидроксида бария могут показаться не такими уж большими, на самом деле они содержат огромное количество молекул воды.
Это число такое большое, потому что вода представляет собой такую маленькую молекулу. Итак, хотя два октагидрата гидроксида бария могут показаться не такими уж большими, на самом деле они содержат огромное количество молекул воды.Описывает следующие материалы: Октагидрат гидроксида бария Химическая формула Ba(OH)2 x 8h3O Масса (массовая формула) 315,46TSCAR Зарегистрировано (как ангидрид) EINECS241-234-5 (как ангидрид)1 autre
— растворимый кристаллический источник бария , подходящий для использования при более высоких (основных) уровнях pH, можно использовать октагидроксид бария. Атом гидроксида, состоящий из атома кислорода и атома водорода, является распространенным соединением, встречающимся в природе, и является популярным предметом в химии.Для водной собственности пропорция составляет 98 процентов; информацию о свойствах см. на рис. 98,0% Растворимость в воде
Состоит из двух элементов: Ba(OH)2 и h3O2. Согласно этой формуле имеется два атома гидроксида и один атома бария в этом соединении.
Сколько гидратных вод содержится в октагидрате гидроксида бария?
Изображение предоставлено: myshopblocksВ октагидрате гидроксида бария содержится 8 вод гидратации.
Что касается гидратации, 1 моль безводной соли содержит такое же количество молей воды, как 1 моль поваренной соли. Поваренная соль содержит 0,6 моль воды, что соответствует 1023 молям. В результате поваренной соли требуется 6,2 галлона гидратации в день.
Как зовут Ба О 2 h3o?
Изображение сделано: made-in-chinaНа этот вопрос нет однозначного ответа, поскольку названия соединений часто определяются человеком или компанией, которые их создают. Однако некоторые возможные названия соединения Ba(OH)2·h3O могут включать дигидрат гидроксида бария или гидрат гидроксида бария.
Из-за связи с другими минералами, включая магний и кальций, этот минерал известен как мягкий голубовато-белый минерал. На его долю приходится чуть более 0,7% земной коры, и он является относительно распространенным элементом. Хамфри Дэви впервые выделил минерал барий в 1808 году. Позже он был использован для создания бариевых фонарей, которые использовались для освещения кораблей в ночное время. Гидроксид бария, а также бариевая мука являются одними из продуктов, в которых используется этот минерал. Моногидраты белого цвета, растворимые в воде, классифицируются как гидроксид бария. Он используется для производства различных продуктов, в том числе бариевых ламп. Вода и другие вещества также проверяются на наличие гидроксида бария с его использованием.
Хамфри Дэви впервые выделил минерал барий в 1808 году. Позже он был использован для создания бариевых фонарей, которые использовались для освещения кораблей в ночное время. Гидроксид бария, а также бариевая мука являются одними из продуктов, в которых используется этот минерал. Моногидраты белого цвета, растворимые в воде, классифицируются как гидроксид бария. Он используется для производства различных продуктов, в том числе бариевых ламп. Вода и другие вещества также проверяются на наличие гидроксида бария с его использованием.
Октагидрат гидроксида бария Формула
Изображение получено: chemspiderОктагидрат гидроксида бария представляет собой белое кристаллическое твердое вещество без запаха с формулой Ba(OH)2·8h3O. Он используется в различных областях, в том числе в качестве регулятора pH, осушителя и реагента для синтеза других соединений бария .
Молярная масса октагидрата гидроксида бария
Изображение сделано: chemistrylearner Молярная масса октагидрата гидроксида бария составляет 261,34 грамма на моль. Это соединение используется в различных отраслях промышленности, в том числе в производстве соли бария , бумага и керамика. Он также используется в качестве регулятора pH и в производстве некоторых видов стекла.
Это соединение используется в различных отраслях промышленности, в том числе в производстве соли бария , бумага и керамика. Он также используется в качестве регулятора pH и в производстве некоторых видов стекла.
Гидроксид бария имеет молекулярную массу 315,467 г/моль и молярную массу гидроксида натрия 23. Эта жидкость имеет температуру кипения 78 градусов Цельсия при комнатной температуре. Он растворим в воде и малотоксичен, что делает его отличным материалом для стеклянной посуды.
Формула гидроксида бария
Гидроксид бария представляет собой неорганическое соединение с химическая формула Ba(OH)2 . Это белое твердое вещество, нерастворимое в воде.
Барит, также известный как гидроксид бария, представляет собой неорганическое соединение, которое используется в химической промышленности в качестве добавки или реагента. Это также источник металлического бария. Безводный, моногидрат и октагидрат являются распространенными формами соединения с молярной массой 171,34 г моль-1. Структура соединения состоит из двух гидрокси-анионов (ОН-) и одного катиона бария .
Структура соединения состоит из двух гидрокси-анионов (ОН-) и одного катиона бария .
Кислота гидроксида бария или основание
В органическом синтезе используется как сильное основание, например, при гидролизе сложных эфиров и нитрилов (рис. 3.6).
Молекулярная формула гидроксида бария — Ba(OH)2, а его молекулярная масса — 121,6324 г/моль. Поскольку это ангидрид, он бесцветный и призматический. Gr* = 49 400 – 16,6 Тл (кал/моль) в современном диапазоне температур дается как стандартная свободная энергия образования согласно уравнению. Титрование слабых кислот, особенно органических, в аналитической химии проводят гидроксидом бария. Поскольку карбонат бария нерастворим в воде, его используют в водном растворе, не содержащем карбоната, в отличие от 9.0003 гидроксиды щелочных металлов , которые представляют собой гидроксиды щелочных металлов. Его использование в качестве добавки к термопластам (таким как смола и вискоза), а также в качестве стабилизаторов для вискозы и ПВХ улучшает пластические свойства. Он необходим при получении высокотемпературных сверхпроводников, поскольку способствует их формированию.
Он необходим при получении высокотемпературных сверхпроводников, поскольку способствует их формированию.
На основе исследования было исследовано окислительное сочетание метана с углеводородами CxHyn с использованием щелочноземельных металлов, Be, Mg, Ca, Sr и Ba. Его можно найти как в форме октагидрата, так и в форме моногидрата. Этот крем имеет гладкую текстуру и обладает высокой светорассеивающей способностью, и кажется, что он больше фокусируется на глазах, чем на коже, делая мелкие морщинки и поры менее заметными. Из-за присутствия атомов азота в форме третичного амина слабое основание можно определить по реакции алкилгалогенида с C17h33NO3 и четвертичной аммониевой солью. В присутствии щелочного раствора, содержащего гидроксид бария, атропин отщепляет оптически неактивный спирт тропин и рацемическую кислоту (*). 10% Giemsa (Gibco® Invitrogen, #1092-013) 5% Гимза (Gibco® Invitrogen, #1092-013) 5% Гимза (Gibco® Invitrogen, #1092-013) 5% Гимза (Gib Покровное стекло находится в DPX (Sigma-Aldrich, #194544) С помощью микроскопа изучите распространение, подсчет и количество пар хромосом от 30 до 40.
После подтверждения кариотипа и пола линии клеток ES могут быть проверены на передачу зародышевой линии Берберин является широко распространенным алкалоидом который содержит одну метилендиокси и две метоксильные группы в дополнение к его C20h29Состав О5Н. В некоторых реакциях он ведет себя как альдегид, конденсируясь с ацетоном и гидроксиамином и подвергаясь реакции Канниццаро. В этом процессе свойства форполимера могут быть улучшены за счет контроля физических и химических свойств. В результате легкого замыкания лактамного кольца это указывает на то, что аммосодержащая цепь и карбоксильная группа должны быть ортозаместителями устойчивого к окислению ароматического ядра. Бербераль, который находится в более низкой степени окисления, чем бериловая кислота, не образует аминокислот при гидролизе серной кислотой. Меконин можно синтезировать с использованием формальдегида и соляной кислоты, поэтому он должен иметь структуру (18).
Оксиберин представляет собой негидроксильное соединение дигидроберина, являющееся одной из двух реакций Канниццаро на берберине. Уровни креатина можно определить, используя флуоресцентную активность нингидринового производного креатина как в крови, так и в моче. Саркозин является вторичным амином, и при его смешивании с флуорескамином образуется неэлектроотрицательная аминокислота. Креатинин и фосфокреатин, в отличие от флуоресцентных производных, не образуют флуоресцентных красителей, но некоторые соединения гуанидина могут этому мешать. Производное нингидрина креатина можно использовать для определения концентрации креатина в крови и моче. Саркозин представляет собой нефлуоресцентную аминокислоту, образующуюся в результате реакции саркозина с флуорескамином при рН 12. В течение 10 минут при 70°С первичный амин реагирует с пиролиноном, образуя пиролинон, который можно возбуждать до 39°С.0 нм и флуоресцируют до 480 нм.
Уровни креатина можно определить, используя флуоресцентную активность нингидринового производного креатина как в крови, так и в моче. Саркозин является вторичным амином, и при его смешивании с флуорескамином образуется неэлектроотрицательная аминокислота. Креатинин и фосфокреатин, в отличие от флуоресцентных производных, не образуют флуоресцентных красителей, но некоторые соединения гуанидина могут этому мешать. Производное нингидрина креатина можно использовать для определения концентрации креатина в крови и моче. Саркозин представляет собой нефлуоресцентную аминокислоту, образующуюся в результате реакции саркозина с флуорескамином при рН 12. В течение 10 минут при 70°С первичный амин реагирует с пиролиноном, образуя пиролинон, который можно возбуждать до 39°С.0 нм и флуоресцируют до 480 нм.
Гидроксид бария + хлорид аммония
Хлорид аммония вступает в реакцию с гидроксидом бария с образованием аммиака, как показывает реакция. Эта реакция выделения газа с двойным вытеснением известна как б. а. реакция с хлоридом аммония. Продуктами этой реакции являются аммиак и вода. Эта реакция является результатом эндотермической реакции.
а. реакция с хлоридом аммония. Продуктами этой реакции являются аммиак и вода. Эта реакция является результатом эндотермической реакции.
Гидроксид натрия и хлорид аммония производят газообразный аммиак, хлорид натрия и воду.
При смешивании гидроксида натрия и хлорида аммония происходит реакция, при которой образуется газообразный аммиак (основание), хлорид натрия (соль) и вода.
Свойства, химическая структура и применение
Гидроксид бария Формула
Барит, также широко известный как гидроксид бария. Формула гидроксида бария представляет собой Ba(OH)2. Это прозрачно-белый порошок без запаха. Обладает ядовитым характером. Он имеет ионную природу, например, с двумя ионами гидроксида на молекулу гидроксида бария Ba(OH)2 в водном растворе. Единственным описанным реагентом для металлизации карбоксамидов является гидроксид бария. По сравнению с оксидом бария гидроксид бария имеет более низкую скорость разложения.
Гидроксид бария иногда называют «баритом».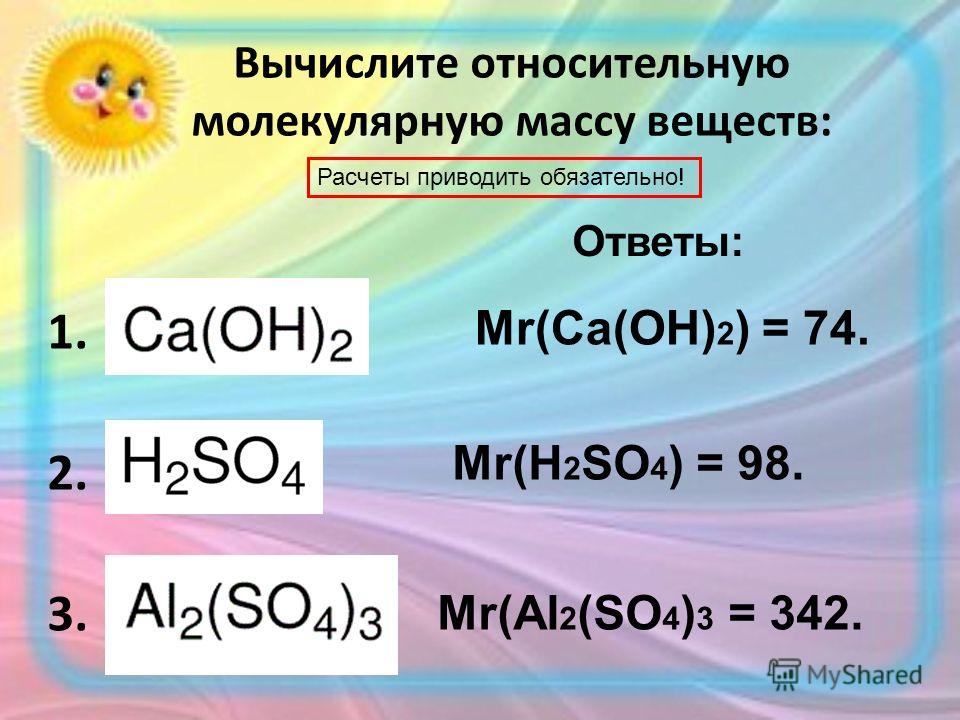 Формула гидроксида бария представляет собой Ba(OH)2. Это порошок без запаха и кристально белого цвета. Кроме того, он обладает высокой токсичностью из-за нескольких рискованных свойств. Он имеет ионный характер, например, когда гидроксид бария Ba(OH)2 растворяется в воде, он может образовывать два иона гидроксида на молекулу. Однако единственным описанным реагентом для металлизации карбоксамидов является гидроксид бария. Гидроксид бария также разлагается медленнее, чем оксид бария. Гидроксид бария Формула представляет собой Ba(OH)2.
Формула гидроксида бария представляет собой Ba(OH)2. Это порошок без запаха и кристально белого цвета. Кроме того, он обладает высокой токсичностью из-за нескольких рискованных свойств. Он имеет ионный характер, например, когда гидроксид бария Ba(OH)2 растворяется в воде, он может образовывать два иона гидроксида на молекулу. Однако единственным описанным реагентом для металлизации карбоксамидов является гидроксид бария. Гидроксид бария также разлагается медленнее, чем оксид бария. Гидроксид бария Формула представляет собой Ba(OH)2.
Структура формулы гидроксида бария
Формула гидроксида бария представляет собой Ba(OH)2. Его можно найти в трех различных формах с молярной массой 171,34 г моль-1 для безводного, 189,955 г моль-1 для моногидрата и 315,46 г моль-1 для октагидрата соответственно. Структура соединения состоит из двух гидроксильных анионов (ОН-) и одного катиона бария (Ва2+).
В случае гидратации катионы и анионы будут окружены от одной до восьми молекул воды. Кроме того, его химическая структура может быть показана ниже на типичных изображениях, которые учащиеся часто используют для описания органических соединений.
Кроме того, его химическая структура может быть показана ниже на типичных изображениях, которые учащиеся часто используют для описания органических соединений.
Свойства гидроксида бария Формула
Атомная масса:
Для определения молярной массы гидроксида бария необходимо добавить молярные массы составляющих элементов. Барий имеет молярную массу или молекулярную массу 137,33. Химическое вещество содержит только один барий. Водород имеет молярную массу 1,008. Химическое вещество содержит два атома водорода. Следовательно, совокупная молярная масса двух атомов водорода равна 2,016. Кислород имеет молярную массу 15,999. Учитывая, что атомов кислорода два, их общая молярная масса составляет 31,9.98. Результат сложения этих чисел — 171,344. Гидроксид бария имеет молярную массу 171,344 г/моль. Формула гидроксида бария представляет собой Ba(OH)2.
Сильное основание оксида бария:
Химическое вещество, известное как основание, взаимодействует с водой с образованием ионов гидроксида. Сильное основание — это такое, которое может полностью диссоциировать в воде с выделением точно такого же количества анионов и катионов, которым обладают компоненты неповрежденного основания. Формула гидроксида бария представляет собой Ва(ОН)2.
Сильное основание — это такое, которое может полностью диссоциировать в воде с выделением точно такого же количества анионов и катионов, которым обладают компоненты неповрежденного основания. Формула гидроксида бария представляет собой Ва(ОН)2.
Распространение
Так как многие минералы содержат гидроксид бария, он часто встречается в природе. Формула гидроксида бария представляет собой Ba(OH)2.
Препарат
Формула гидроксида бария представляет собой Ba(OH)2. Путем реакции оксида бария (BaO) с водой (h3O) учащиеся могут получить гидроксид бария:
Ba(OH)2•8h3O = BaO + 9h3O
Физические свойства
Формула гидроксида бария представляет собой Ba(OH)2. Гидроксид бария представляет собой твердое вещество белого цвета без запаха. Плотность моногидрата гидроксида бария составляет 3,743 г/мл и 2,18 г/мл соответственно (в форме октагидрата). 780°С (в октагидратной форме), 3000°С (в моногидратной форме) и 4070°С являются температурами плавления (в безводной форме).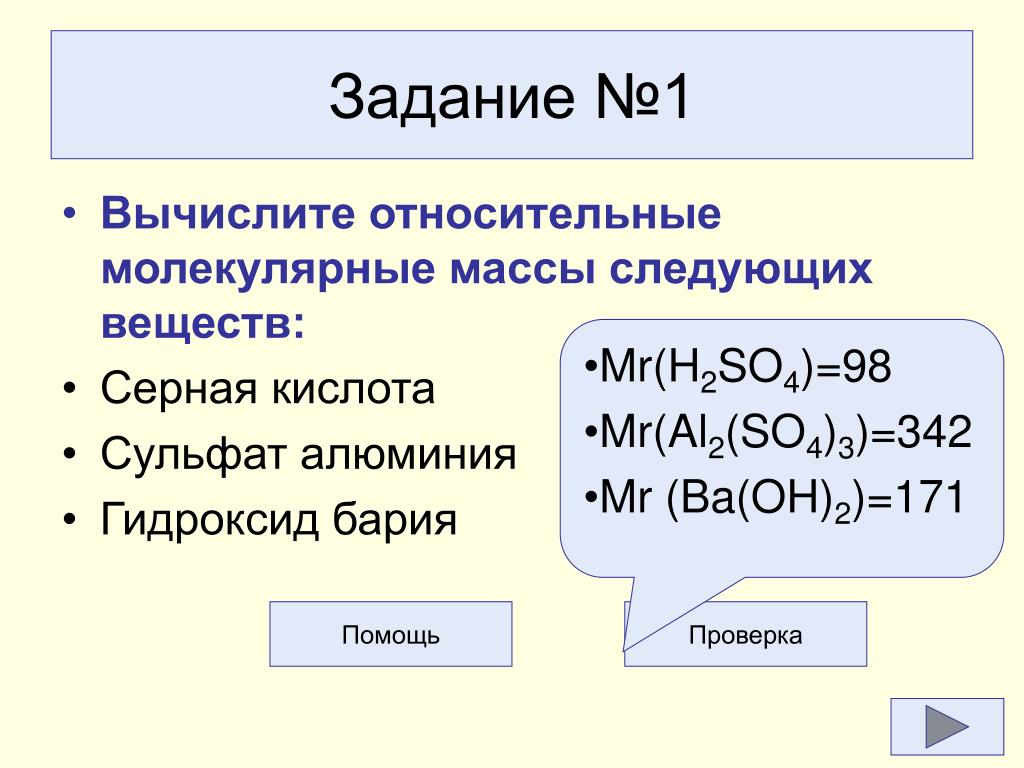 7800С — это температура кипения. При низких температурах растворимость всех трех форм в воде незначительна, но с повышением температуры растворимость увеличивается.
7800С — это температура кипения. При низких температурах растворимость всех трех форм в воде незначительна, но с повышением температуры растворимость увеличивается.
Химические свойства
Когда учащиеся растворяют гидроксид бария в воде, высвобождающиеся гидроксильные анионы вызывают образование щелочных растворов. Из-за того, что он может реагировать с серной, фосфорной и другими кислотами с образованием соответствующих солей, таких как фосфат бария и т. Д., Гидроксид бария полезен для получения солей бария. Формула гидроксида бария представляет собой Ba(OH)2.
Использование
Формула гидроксида бария представляет собой Ba(OH)2. Чтобы получить дополнительные соли бария, такие как фосфат бария, сульфид бария и сульфат бария, которые люди используют в химической промышленности в различных процессах, гидроксид бария можно использовать в качестве источника бария. Из-за его щелочных свойств они также могут использовать гидроксид бария в качестве аналитического стандарта для титрования слабых кислот.

 Напишем уравнение реакции:
Напишем уравнение реакции:
 Найдем массу кислорода. Из схемы
реакции видно, что весь кислород,
входивший в состав оксида, перешел в
воду:
Найдем массу кислорода. Из схемы
реакции видно, что весь кислород,
входивший в состав оксида, перешел в
воду: