Химия щелочноземельных металлы | CHEMEGE.RU
Элементы II группы главной подгруппы
1. Положение в Периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с оксидами неметаллов
7.2.6. Взаимодействие с солями и оксидами металлов
Оксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Амфотерные свойства оксида бериллия
Гидроксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с амфотерными оксидами и гидроксидами
2.4. Взаимодействие с кислыми солями
2.5. Взаимодействие с неметаллами
2.6. Взаимодействие с металлами
2.7. Взаимодействие с солями
2.8. Разложение при нагревании
2.9. Диссоциация
2.10. Амфотерные свойства гидроскида бериллия
Соли щелочноземельных металлов
Жесткость
1. Постоянная и временная жесткость
2. Способы устранения жесткости
Элементы II группы главной подгруппы
Положение в периодической системе химических элементов
Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Электронное строение и закономерности изменения свойств
Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов: ns2, на внешнем энергетическом уровне в основном состоянии находится 2 s-электрона. Следовательно, типичная степень окисления щелочноземельных металлов в соединениях
Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов.
В ряду Be—Mg—Ca—Sr—Ba—Ra, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрицательность.
Физические свойства
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах.
Нахождение в природе
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы:
Доломит — CaCO3 · MgCO3 — карбонат кальция-магния.
Магнезит MgCO3 – карбонат магния.
Кальцит CaCO3 – карбонат кальция.
Гипс CaSO4 · 2H2O – дигидрат сульфата кальция.
Барит BaSO4 — сульфат бария.
Витерит BaCO3 – карбонат бария.

Способы получения
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
или восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C:
4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
Качественная реакция на щелочноземельные металлы — окрашивание пламени солями щелочноземельных металлов
.Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
Качественная реакция на ионы магния: взаимодействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния:
Mg2+ + 2OH— → Mg(OH)2↓
Качественная реакция на ионы кальция, стронция, бария: взаимодействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария:
Ca2+ + CO32- → CaCO3↓
Ba2+ + CO32- → BaCO3↓
Качественная реакция на ионы стронция и бария: взаимодействие с карбонатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция:
Ba2+ + SO42- → BaSO4↓
Sr2+ + SO42- → SrSO4↓
Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами.
Например, при взаимодействии хлорида кальция с фосфатом натрия образуется белый осадок фосфата кальция:
3CaCl2 + 2Na3PO4 → 6NaCl + 2Ca3(PO 4)2↓
Химические свойства
1. Щелочноземельные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочноземельные металлы реагируют с галогенами с образованием галогенидов при нагревании.
Например, бериллий взаимодействует с хлором с образованием хлорида бериллия:
Be + Cl2 → BeCl2
1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфоридов.
Например, кальций взаимодействует с серой при нагревании:
Ca + S → CaS
Кальций взаимодействует с фосфором с образованием
3Ca + 2P → Ca3P2
1.3. Щелочноземельные металлы реагируют с водородом при нагревании. При этом образуются бинарные соединения — гидриды. Бериллий с водородом не взаимодействует, магний реагирует лишь при повышенном давлении.
Mg + H2 → MgH2
1.4. С азотом магний взаимодействует при комнатной температуре с образованием нитрида:
6Mg + 2N2 → 2Mg3N2
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов.
Например, кальций взаимодействует с углеродом с образованием карбида кальция:
Ca + 2C → CaC2
Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида:
2Be + C → Be2C
1.6. Бериллий сгорает на воздухе при температуре около 900°С:
2Be + O2 → 2BeO
Магний горит на воздухе при 650°С с выделением большого количества света. При этом образуются оксиды и нитриды:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды.
Видеоопыт: горение кальция на воздухе можно посмотреть здесь.
2. Щелочноземельные металлы взаимодействуют со сложными веществами:
2.1. Щелочноземельные металлы реагируют с водой. Взаимодействие с водой приводит к образованию щелочи и водорода. Бериллий с водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca0 + 2H2+O = 2Ca+(OH)2 + H20
2.2. Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, магний реагирует с соляной кислотой:
2Mg + 2HCl → MgCl2 + H2↑
2.3. При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера.
Например, при взаимодействии кальция с концентрированной серной кислотой образуется сульфат кальция, сера и вода:
4Ca + 5H2SO4(конц.) → 4CaSO4 + S + 5H2O
2.4. Щелочноземельные металлы реагируют с азотной кислотой. При взаимодействии кальция и магния с концентрированной или разбавленной азотной кислотой образуется оксид азота (I):
4Ca + 10HNO3 (конц) → N2O + 4Сa(NO3)2 + 5H2O
При взаимодействии щелочноземельны металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
4Ba + 10HNO3 → 4Ba(NO3)2 + NH4NO3 + 3H2O
2.5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
Например, при взаимодействии кальция с оксидом кремния (IV) образуются кремний и оксид кальция:
2Ca + SiO2 → 2CaO + Si
Магний горит в атмосфере углекислого газа. При этом образуется сажа и оксид магния:
2Mg + CO2 → 2MgO + C
2.6. В расплаве щелочноземельные металлы могут вытеснять менее активные металлы из солей и оксидов. Обратите внимание! В растворе щелочноземельные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, кальций вытесняет медь из расплава хлорида меди (II):
Ca + CuCl2 → CaCl2 + Cu
Оксиды щелочноземельных металлов
Способы получения
1. Оксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом:
2Ca + O2 → 2CaO
2. Оксиды щелочноземельных металлов можно получить термическим разложением некоторых кислородсодержащих солей — карбонатов, нитратов.
Например, карбонат кальция разлагается на оксид кальция, оксид азота (IV) и кислород:
2Ca(NO3)2 → 2CaO + 4NO2 + O2
MgCO3 → MgO + CO2
СаСО3 → СаО + СО2
3. Оксиды магния и бериллия можно получить термическим разложением гидроксидов:
Mg(OH)2 → MgO + H2O
Химические свойства
Оксиды кальция, стронция, бария и магния — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный.
1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид магния взаимодействует с углекислым газом с образованием карбоната магния:
MgO + CO2 → MgCO3
2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид кальция взаимодействует с соляной кислотой с образованием хлорида кальция и воды:
CaO + 2HCl → CaCl2 + H2O
3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей.
Например, оксид кальция взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
Оксид магния реагирует с водой при нагревании:
MgO + H2O → Mg(OH)2
Оксид бериллия не взаимодействует с водой.
4. Оксид бериллия взаимодействует с щелочами и основными оксидами.
При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты.
Например, оксид натрия реагирует с оксидом бериллия с образованием бериллата натрия:
Na2O + BeO → Na2BeO2
Например, гидроксид натрия реагирует с оксидом бериллия в расплаве с образованием бериллата натрия:
2NaOH + BeO → Na2BeO2 + H2O
При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли.
Например, оксид бериллия реагирует с гидроксидом калия с растворе с образованием тетрагидроксобериллата калия:
2NaOH + BeO + H2O → Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов
Способы получения
1. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих оксидов с водой.
Например, оксид кальция (негашеная известь) при взаимодействии с водой образует гидроксид кальция (гашеная известь):
CaO + H2O → Ca(OH)2
Оксид магния взаимодействует с водой только при нагревании:
MgO + H2O → Mg(OH)2
2. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca + 2H2O → 2Ca(OH)2 + H2
Магний взаимодействует с водой только при кипячении:
2Mg + 2H2O → 2Mg(OH)2 + H2
3. Гидроксиды кальция и магния можно получить при взаимодействии солей кальция и магния с щелочами.
Например, нитрат кальция с гидроксидом калия образует нитрат калия и гидроксид кальция:
Ca(NO3)2 + 2KOH → Ca(OH)2↓ + 2KNO3
Химические свойства
1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами (и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксид магния взаимодействует только с сильными кислотами.
Например, гидроксид кальция с соляной кислотой реагирует с образова-нием хлорида кальция:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид бария с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
Ba(OH)2(избыток) + CO2 → BaCO3 + H2O
Ba(OH)2 + 2CO2(избыток) → Ba(HCO3)2
3. Гидроксиды кальция, стронция и бария реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид бария с оксидом алюминия реагирует в расплаве с образованием алюминатов:
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Ba(OH)2 + Al2O3 + 3H2O → Ba[Al(OH)4]2
4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция:
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
5. Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы.
6. Гидроксиды кальция, стронция и бария взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Ca(OH)2 + Zn → CaZnO2 + H2
В растворе образуются комплексная соль и водород:
Ca(OH)2 + 2Al + 6Н2О = Ca[Al(OH)4]2 + 3Н2
7. Гидроксиды кальция, стронция и бария вступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растоворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты.
Например, хлорид железа (II) реагирует с гидроксидом бария с образованием хлорида бария и осадка гидроксида железа (II):
Ba(OH)2 + FeCl2 = BaCl2+ Fe(OH)2↓
Также с гидроксидами кальция, стронция и бария взаимодействуют соли аммония.
Например, при взаимодействии бромида аммония и гидроксида кальция образуются бромид кальция, аммиак и вода:
2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2
8. Гидроксид кальция разлагается при нагревании до 580оС, гидроксиды магния и бериллия разлагаются при нагревании:
Mg(OH)2 → MgO + H2O
9. Гидроксиды кальция, стронция и бария проявляют свойства сильных оснований. В воде практически полностью диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
Ba(OH)2 ↔ Ba2+ + 2OH—
Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства.
10. Гидроксид и бериллия взаимодействует с щелочами. В расплаве образуются соли бериллаты, а в растворе щелочей — комплексные соли.
Например, гидроксид бериллия реагирует с расплавом гидроксида натрия:
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O
При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Соли щелочноземельных металлов
Нитраты щелочноземельных металлов
Нитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород.
Например, нитрат кальция разлагается при нагревании на нитрит кальция и молекулярный кислород:
Ca(NO3)2 → Ca(NO2)2 + O2
Карбонаты щелочноземельных металлов
1. Карбонаты щелочноземельных металлов при нагревании разлагаются на оксид и воду.
Например, карбонат кальция разлагается при температуре 1200оС на оксид кальция и воду:
CaCO3 → CaO + CO2
2. Карбонаты щелочноземельных металлов под действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты.
Например, карбонат кальция взаимодействует с углекислым газом и водой с образованием гидрокарбоната кальция:
CaCO3 + H2O + CO2 → Ca(HCO3)2
3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды.
Более сильные кислоты вытесняют менее сильные из солей.
Например, карбонат магния взаимодействует с соляной кислотой:
CaCO3 + 2HCl → CaCl2 + CO2↑+ H2O
4. Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов.
Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении.
Например, карбонат кальция взаимодействует с оксидом алюминия при сплавлении:
CaCO3 + Al2O3 → Ca(AlO2)2 + CO2↑
Жесткость воды
Постоянная и временная жесткость
Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости).
Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде.
Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния.
Способы устранения жесткости
Существуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости:
1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты:
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + 2H2O
Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора:
1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты:
CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl
2. Добавление фосфатов. Фосфаты также связывают ионы кальция и магния:
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
Поделиться ссылкой:
chemege.ru
Металлы щелочные и щелочноземельные — Справочник химика 21
Среди элементарных веществ к типичным восстановителям принадлежат активные металлы (щелочные и щелочноземельные, цинк, алюминий, железо и др.), а также некоторые неметаллы, такие, как водород, углерод (в виде угля или кокса), фосфор, кремний. При этом в кислой среде металлы окисляются до положительна заряженных ионов, а в щелочной среде те металлы, которые образуют амфотерные гидроксиды (например, цинк, алюминий, олово), входят в состав отрицательно заряженных анионов или гидроксокомплексов. Углерод чаще всего окисляется [c.164]Помещения цехов, производств, установок с наличием твердых веществ, взаимодействующих с образованием горючих газов и воспламеняющихся на воздухе карбиды щелочных и щелочноземельных металлов щелочные и щелочноземельные металлы (калий, натрий, литий [c.381]
Солеобразные гидриды образуют наиболее активные металлы (щелочные и щелочноземельные). Эти соединения построены по типу ионных, т. е. состоят из поло китель-ных ионов металла и отрицательных ионов водорода. Последнее подтверждается практически — при электролизе расплава соединения водород будет выделяться на аноде. [c.207]
Минеральные компоненты нефти. В состав нефти входят многие элементы. В золе нефтей обнаружены металлы щелочные и щелочноземельные Ь, Ыа, К, Ва, Са, 5г, Мн металлы подгруппы меди Си, Ag, Аи цинка 2п, Сё, Hg бора В, А1, Са ванадия V, [c.31]
Поэтому по окислительной активности водород существенно уступает галогенам. По этой же причине ясно выраженный ионный характер проявляют лишь гидриды наиболее активных металлов — щелочных и щелочноземельных, например КН и СаНа. [c.276]
Углерод непосредственно соединяется со многими металлами, образуя карбиды — соединения, в которых углерод электроотрицателен. Степень окисления углерода в карбидах различна. Различны и химические свойства карбидов. С активными металлами — щелочными и щелочноземельными — углерод образует солеподобные карбиды, в которых атомы углерода связаны между собой тройной связью в группировку — С С —, как, например, в СаС . Степень окисления углерода в них —1. При взаимодействии этих карбидов с водой они подвергаются гидролизу с образованием гидроксида металла и ацетилена [c.203]
Распределительная хроматография на целлюлозе применялась также для выделения тория из руд, при анализе сплавов и сталей, для разделения благородных металлов, щелочных и щелочноземельных металлов и некоторых других элементов [102]. [c.175]
Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными, растворимыми в воде основаниями — щелочами, например, [c.9]
Подобные полярные связи образуются и в том случае, когда для образования связывающего дублета электроны предоставляет каждый из атомов, но только тогда, когда из-эа структурного расположения и неодинакового притяжения электронного дублета различными атомными ядрами связывающая электронная пара смещена от центра связи к одному из ядер. Такая связь образуется в молекуле воды, в которой предполагается значительная степень ионного взаимодействия. Полярные связи образуются при связывании элементов, сильно различающихся по электроотрицательности. Это неудивительно, особенно для связей, которые образует кислород или фтор с некоторыми ионами металлов (щелочные и щелочноземельные металлы). [c.159]
IV. Самовозгорающиеся и самовоспламеняющиеся вещества — металлы щелочные и щелочноземельные (калий, натрий, кальций), металлы пирофорные (алюминий в виде пыли или пудры, цинковая пыль и др.), карбид кальция, перекиси, фосфор белый и желтый, фосфористые натрий и кальций и др. хранение этих веществ недопустимо вместе с другими огнеопасными веществами всех групп. При отсутствии последних вещества группы IV можно хранить в изолированных помещениях общих огнестойких складов. [c.215]
При аналитических операциях необходимо обеспечить присутствие в пламени свободных атомов определяемого элемента. Здесь следует учитывать два фактора возможность образования простых молекул (МеО, МеОН и некоторых других) и степень ионизации атома определяемого металла. Щелочные и щелочноземельные металлы ионизируются сравнительно легко, поэтому при их определении методом атомной абсорбции возникают затруднения. Однако определение кальция и других щелочноземельных элементов облегчается тем, что постоянной примесью воздуха является натрий, который создает высокую фоновую концентрацию электронов. Последняя снижает степень ионизации кальция [22]. [c.147]
Дуговой разряд поддерживается либо между металлическими электродами, если они достаточно устойчивы к нагреванию и окислению, либо между угольными электродами. Каналы в них обычно содержат набивку в виде окислов или солей исследуемых металлов. Непосредственно электродами дуги может служить большинство металлов и их сплавов. Легкоплавкие и легкоокисляемые металлы (щелочные и щелочноземельные) применяются в виде сплавов с более стойкими металлами. Некоторые из них могут служить электродами дуги, если поместить ее в атмосферу инертного газа или в вакуум. Наиболее широко распространена дуга с ртутными электродами [10.16]. Вакуумная ртутная дуга в кварцевом сосуде является одним из широко применяемых источников яркого ультрафиолетового излучения. Одна из конструкций такого рода дуги изображена на рис. 10.11, а. Ртуть в количестве 15—20 см содержится в электродных отростках, которые во время работы охлаждаются ребристыми алюминиевыми радиаторами. Для зажигания дуги ее слегка наклоняют. Переливающаяся из анодного отростка ртуть образует проводящую цепь, при разрыве которой зажигается дуга. [c.265]
Молекулярный водород при обычной температуре химически малоактивен. Только фтор соединяется с ним при обычных условиях , хлор — при освещении, кислород — только при поджигании смеси. При повышенной температуре водород вступает в соединение со многими элементами, преимущественно с неметаллами, но и с сильно электроположительными металлами (щелочными и щелочноземельными). [c.60]
Металлы (щелочные и щелочноземельные) [c.379]
К образованию комплексов способны преимущественно сравнительно малоактивные металлы. Щелочные и щелочноземельные металлы образуют комплексы сравнительно редко. В качестве комплек-сообразователей чаще выступают металлы В-групп и металлы групп П1А и IVA. В центре комплекса располагается атом или ион металла. [c.20]
В качестве окислителя вода вступает в реакцию с активными металлами — щелочными и щелочноземельными. [c.154]
Наиболее активные металлы (щелочные и щелочноземельные) даже при обычных условиях взаимодействуют с водой. Мерой активности металлов могут служить величины их стандартных электродных потенциалов (см. стр. 133). Электродные потенциалы малоактивных металлов (Си, Hg, Ag, Au и других) выражаются положительными величинами, а более активных металлов — отрицательными величинами. [c.350]
Химическ
www.chem21.info
Щелочноземельные металлы Щелочные металлы — Справочник химика 21
Растворимость перхлоратов щелочных, щёлочноземельных металлов, магния и аммония (г/100 мл раствора при 25° С) [c.735]Э. Группа химических элементов, у которых происходит заполнение электронных оболочек 5-электронами включают семейства щелочных и щёлочноземельных металлов, а также водород. [c.508]
Алкоголяты других щелочных и щёлочноземельных металлов, а также алюминия образуются аналогичным образом. Алкоголяты алюминия A1(0R)3, детально изученные в 1899—1906 гг. В. Е. Тищенко (1861—1941 гг.), перегоняются без разложения и могут рассматриваться как сложные эфиры гидроокиси алюминия, обладающей кислотными свойствами. [c.105]
Помимо воды, гидроокиси щелочных металлов очень легко растворяются в спирте. Только гидроокись лития умеренно растворима как в воде, так и в спирте и образует, таким образом, переход к гидроокисям щёлочноземельных металлов. Она также менее гигроскопична, чем гидроокиси других щелочных металлов, но кристаллизуется из водного раствора в виде гидрата ЬЮН-НгО. [c.205]
Неспецифические носители захватывают радионуклиды за счёт процессов сорбции. Поэтому процесс осаждения не является специфическим и коллекторные носители на основе гидроксида железа (III) и гидратированного диоксида марганца широко используются в радиохимическом анализе для отделения радионуклидов металлов, образующих нерастворимые гидроксиды, от радионуклидов щелочных и щёлочноземельных металлов. Примером может служить отделение иттрия-90 от стронция-90 при осаждении гидроксида железа (III). [c.116]
Кристаллогидраты данных соединений гигроскопичны. Нитраты Зт, Ей, 0(1 способны образовывать двойные соединения с нитратами аммония, щелочных, щёлочноземельных и других металлов состава [c.219]
Опыт всецело подтверждает этот вывод. Так, например, щелочные и щёлочноземельные металлы, обладающие малой работой выхода, уменьшают потенциал зажигания, если покрыть катод плёнкой таких металлов. Этим пользуются прп изготовлении приборов газового разряда, рассчитанных на употребление в схемах низкого напряжения. [c.251]
Добывание и предварительная очистка различных газов для наполнения производятся способами, описанными в курсах химии и в электрохимии. В отношении редких инертных газов смотрите монографии [131—133]. Инертные газы добываются из воздуха при его сжижении. Они имеются в продаже в стальных баллонах при давлениях в десятки атмосфер и в этом случае требуют обязательной доочистки пропусканием через активированный уголь, или же спектрально чистые в стеклянных баллонах под давлением около 600 мм В тех исследованиях, при которых сказывается влияние ничтожно малых примесей посторонних газов, спектрально чистые инертные газы также необходимо дополнительно очищать путём длительной тренировки разрядной трубки с применением специальных электродов, покрытых слоем щелочного или щёлочноземельного металла [118, 128]. [c.62]
Поведение щелочных и щёлочноземельных металле находит объяснение в больших атомных объёмах этих металлов, позво-ляющих первичным электронам проникать глубоко в толщу металла, что затем сильно затрудняет свободный вылет вторичных. электронов. В противоположность этому, в случае металлов [c.137]
Рассмотрим сначала способы получения паров металлов. Их два испарение при нагреве и распыление путём бомбардировки поверхности металла быстрыми (1-50 кэВ) ионами или нейтралами. Последнее явление обнаружено в газовых разрядах и поэтому получило название катодного распыления (падающие на катод ионы вызывают распыление катодного вещества). Легко испаряемых металлов немало, в их числе — щелочные и щёлочноземельные, в некоторых изотопах которых имеется постоянная потребность. Испарённые атомы имеют температуру нагревателя (0,1-0,2 эВ), поэтому требуется не только ионизовать пары, но и дополнительно нагреть полученные ионы. [c.315]
Необычайно высокое сродство алюминия к кисл Ц у пс сравнению со всеми другими металлами, кроме щелочных, щёлочноземельных и редкоземельных, непосредственно явствует из табл. на, стр. 148. [c.474]
КРИПТАТЫ, м мн. Комплексные соединения, центральным атомом у которых является главным образом щелочной или щёлочноземельный металл, а лигандами-крип-танды. [c.226]
ЦЕОЛИТЫ. 4 мн. Алюмосиликаты щелочных и щёлочноземельных металлов, твёрдые вещества с регулярной пористой структурой используются при сущке, очистке и разделении смесей веществ, как катализаторы и др. [c.489]
Л2ВК(Х0 )в, (А= щелочной металл, В = РЬ, щелочно или щёлочноземельный металл). [c.930]
Все металлы щелочной и щёлочноземельной групп, а так се металлы третьей группы обладают, несмотря на малые работы выхода электронов, чрезвычайно нВзкими здаченнями коэффициента вторичной эмиссии (во всех случаях 8[c.137]
www.chem21.info
Тест «Щелочные и щелочноземельные металлы»
Тест « Щелочные и щелочноземельные металлы»
(контрольный срез знаний)
Цель: проверить знания и умения учащихся то теме «Щелочные и щелочноземельные металлы»
Умения:
определять положение металлов в периодической системе Д.И. Менделеева;
определять строение атома;
определять степень окисления;
составлять полные и сокращенные ионные уравнения
определять продукты реакции;
решать цепочки уравнений;
определять окислитель и восстановитель, писать электронный баланс;
расставлять коэффициенты;
определять молярную массу и молярный объем;
составлять пропорцию.
Знания:
тривиальные названия соединений;
химические свойства металлов, оксидов и гидроксидов;
качественные реакции;
историю открытия металлов.
Предлагаемые тестовые задания содержат теоретические и практические вопросы, соответствующие требованиям государственного стандарта химического образования: основные понятия, законы химии, строение, свойства, получение важнейших классов веществ, изучаемых в 8 классе и 9 классе (I и II четверть)
Количество вариантов: 2
На решение варианта, состоящего из 15 заданий, отводится 40 минут. Тесты состоят из части А (13 заданий )– с выбором правильного ответа из предложенных, и части В (2 задания – цепочка превращений и задача) — ответы учащиеся должны предложить сами.
Оценивание заданий:
Часть А – 1 балл
Часть Б:
Цепочка превращений:
— получение оксида – 1 балл;
— получение гидроксида – 1 балл;
— получение соли – 1 балл;
— метод электронного баланса – 2 балла;
— ионные уравнения – 1 балл.
Задача:
— составление уравнения – 1 балл;
— определение молярной массы – 1 балл;
— определение молярного объема – 1 балл;
— составление пропорции – 1 балл;
— ответ – 1 балл;
— оформление задачи – 1 балл.
Критерии для оценивания тематического теста:
«2» — менее 12 баллов
«3» — 12 — 17 баллов
«4» — 18 — 23 баллов
«5» — 24 — 25 баллов
Тест «Щелочные и щелочноземельные металлы»
Вариант I
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочноземельные металлы находятся в: 1) I A группе; 2) II А группе; 3) IV А группе 4) VIII А группе | 2 |
2 | Какой из указанных металлов является щелочным: 1) Mg; 2) Zn; 3) Ba; 4) K | 4 |
3 | Степень окисления щелочных металлов: 1) +1; 2) +2; 3) -2; 4) +3 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме магния: 1) 2,8,2; 2) 2,8,1; 3) 2,8,8,1; 4) 1,8,8,1 | 1 |
5 | Щелочноземельные металлы: А. Серебристо – белые. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения не верны; 2) Верны А и Б; 3) Верны А и С | 2 |
6 | При взаимодействии с кислородом натрий образует: 1) оксид; 2) пероксид; 3) натрий не реагирует с кислородом. | 2 |
7 | Каустическая сода: 1) NaOH; 2) KOH; 3) Mg (OH)2; 4) NaCl | 1 |
8 | С каким из следующих веществ реагирует кальций? 1) Na2O; 2) NaCl; 3) Cu; 4) h3O | 4 |
9 | С каким из следующих веществ реагирует гидроксид калия? 1) СO2; 2) NaCl; 3) KNO3; 4) Ba(OH)2 | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Na3PO4 и Ca(NO3)2 1) NaNO3; 2) Ca (OH)2; 3) Ca3(PO4)2; 4) NaOH | 3 |
11 | Какая из следующих реакций относится к реакциям ионного обмена? 1) CaO + h3O → Ca (OH)2 2) Ba (NO3)2 + Na2SO4 → BaSO4 + 2 NaNO3 3) 2 Mg + TiO2 → 2 MgO + Ti 4) 3 Ba + N2 → Ba3N2 | 2 |
12 | Соли калия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 4 |
13 | Английский химик впервые получивший магний в 1808г.: 1) Г.Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон | 1 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Ba → BaO → Ba(OH)2 → BaSO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде
1) 2 Ba0 + O02 → 2 Ba+2O-2
Ba0 – 2e → Ba+2 2 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) BaO + h3O → Ba(OH)2
3) Ba(OH)2 + h3SO4 → BaSO4 + 2 h3O
Ba2+ + 2OH- + 2H+ + SO42- → BaSO4 + 2 h3O
2. Решите задачу (6 баллов). При взаимодействии натрия массой 10 г с водой выделился водород. Определите объём водорода (н.у.).
Дано | Решение |
m(Na) = 10г | 0.43 моль х моль 2Na + 2 h3O → 2NaOH + h3 2 моль 1 моль 1) 2) 3) Ответ: V(h3) = 4.816 (л) |
Найти: V(h3) — ? |
Тест «Щелочные и щелочноземельные металлы»
Вариант II
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочные металлы находятся в: 1) I A группе; 2) III А группе; 3) VII Б группе 4) VI А группе | 1 |
2 | Какой из указанных металлов является щелочноземельным: 1) Sr; 2) Cs; 3) Na; 4) Al | 1 |
3 | Степень окисления щелочноземельных металлов: 1) +2; 2) +4; 3) +3; 4) -1 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме калия: 1) 2,8,7,2; 2) 2,8,8,1; 3) 2,8,1; 4) 1,8,8,2 | 2 |
5 | Щелочные металлы: А. Серебристо – белые. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения верны; 2) Верны А и Б; 3) Верны А и В | 2 |
6 | Реакция сжигания магния сопровождается: 1) взрывом; 2) вспышкой; 3) нет ярко выраженных признаков химической реакции. | 2 |
7 | Английская соль: 1) CaSO4; 2) Ca (OH)2; 3) MgSO4; 4) CaCO3 | 3 |
8 | С каким из перечисленных веществ реагирует калий? 1) Na2O; 2) h3O; 3) Ca (OH)2; 4) Mg | 2 |
9 | С каким веществом реагирует гидроксид кальция? 1) NaOH; 2) Na2O; 3) HCl; 4) h3O | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Ba (NO3)2 и Na2SO4 1) NaNO3; 2)BaSO4; 3)NaHSO4; 4) Ba (OH)2 | 2 |
11 | Какая из следующих реакций выражается сокращенным ионным уравнением H + + OH — → h3O 1) 2 HCl + Cu (OH)2 → CuCl2 + 2 h3O 2) HBr + KOH → KBr + h3O 3) h3SO3 + 2 RbOH → Rb2SO3 + 2 h3O | 2 |
12 | Соли натрия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 3 |
13 | Шведский химик, открывший литий в 1817г: 1) Г.Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон | 4 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Li → Li2O→ LiOH → Li3PO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде.
1) 4 Li0 + O02 → 2 Li+2O-2
Li0 – 1e → Li+ 4 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) Li2O + h3O → 2 LiOH
3) 3LiOH + h4PO4 → Li3PO4 + 3 h3O
3 Li+ + 3OH- + 3H+ + PO43- → Li3PO4 + 3 h3O
2. Решите задачу (6 баллов). При взаимодействии магния с хлором объемом 11,2 л (н.у.), образуется хлорид магния. Определите массу хлорида магния.
Дано | Решение |
V(Cl2) = 11.2 л | 0.5 моль х моль 2Mg + Cl2 → MgCl2 1 моль 1 моль 1) 2) 3) Ответ: m(MgCl2) = 45.5 (г) |
Найти: m(MgCl2) — ? |
xn--j1ahfl.xn--p1ai
Щелочные и щелочно-земельные металлы
- Подробности
Просмотров: 1561
Щелочные и щелочноземельные металлы и их соли (Na, К, Mg, Ca, Sr, Li, Ba). Соли щелочных и щелочноземельных металлов присутствуют в сточных водах машиностроительной, целлюлозно-бумажной, химической, азотнотуковой, электротехнической, красильной, полиграфической и резиновой промышленностей. Поступление калия происходит в результате вымывания из почв калийных удобрений, а также с атмосферной пылью.
Токсичность. Попадая в водоемы, соли щелочных и щелочноземельных металлов в первую очередь повышают соленость и жесткость воды. Их катионы сравнительно легко проникают через жабры в тело рыб и включаются в биохимические процессы, нередко нарушая их течение.
Гипертонические растворы солей, особенно несбалансированные, действуют на пресноводных рыб как настоящие яды. По данным Schmitz, пороговые концентрации хлоридов составляют для карпа и линя 5,0 г/л, окуня — 10,7 г/л, угря и форели — 11,25 г/л. Для большинства пресноводных рыб безвредной границей солености считают 1,0 г/л (1‰). Многие пресноводные рыбы не способны жить и в морской воде, в которой соли сбалансированы Так, уклея, гольян, карп, линь, пескарь погибают в морской воде в среднем за 1 ч. При разбавлении ее до 20-30%-ной концентрации она становится безвредной.
Щелочные и щелочно-земельные металлы относятся к группе слаботоксич* ных веществ (табл. 22).

Таблица 22. Токсичность некоторых соединений щелочных и щелочно-земельных металлов для рыб
В таблице приведены те соединения, токсичность которых обусловлена катионами или изменением солености (о других солях см. в соответствующих разделах). Токсические концентрации этих соединений для кормовых организмов находятся примерно в тех же границах, что и для рыб.
Симптомы и патоморфологические изменения. В высоких концентрациях соли натрия и других элементов обладают локальным действием. Кожа и жабры рыб обильно покрываются слизью. При отравлении солями натрия кожа становится темной, а калия — более светлой. В жабрах наблюдается сморщивание и распад эпителия. При снижении концентрации соли действуют на нервную систему, вызывая паралич нервно-мышечного аппарата. Отравившиеся рыбы плавают кругообразно, а затем толчкообразно, слабо реагируют на раздражения, опрокидываются на бок и гибнут с явлениями паралича. Дыхание у них неравномерное, дыхательный ритм ускорен. Смерть наступает от асфиксии. При воздействии нитритов кровь становится темно-шоколадного Цвета, сохраняющегося несколько часов после смерти. В ней резко повышено количество метгемоглобина.
Повышение содержания ионов калия в воде и крови рыб сопровождается нарушением осмотического равновесия и увеличением или уменьшением размера ядер эритроцитов.
Диагноз основан на анализе характера течения интоксикации, определении степени загрязнения водоема и выявления источников поступления сточных вод, содержащих соединения металлов.
По результатам определения жесткости воды и содержания хлоридов, сульфатов, нитратов судят о степени солености воды. Для определения концентрации металлов применяют специальные колориметрические и спектрографические методы.
Профилактика заключается в соблюдении установленных для рыбоводства гидрохимических нормативов. Допустимые пределы их составляют: жесткость- более 7 мг-экв/л, сульфат-ионы — 100 мг/л, хлорид-ионы — 300 мг/л, нитрат-ионы — 40 мг/л (9,1 мг/л N), нитрит-ионы — 0,08 мг/л (0,02 мг/л N), катионы Na- 120 мг/л, Са — 180 мг/л, К — 50 мг/л, Mg — 40 мг/л.
arktikfish.com
Щелочноземельные металлы
Часть первая. Общая характеристика II А группы Периодической Системы элементов.
В этой группе располагаются следующие элементы: Be, Mg, Ca, Sr, Ba, Ra. Они имеют общую электронную конфигурацию: (n-1)p6 ns2 , кроме Ве 1s2 2s2 . В силу последнего, свойства Ве немного отличаются от свойств подгруппы в целом. Свойства магния тоже отличаются от свойств подгруппы, но в меньшей степени. В ряду Са – Sr – Ba – Ra свойства меняются последовательно. Относительная электроотрицательность в ряду Ве – Ra падает т.к. с увеличением размера атома валентные электроны отдаются охотнее. Свойства элементов IIА подгруппы определяются легкостью отдачи двух ns-электронов. При этом образуются ионы Э2+ . При изучении дифракции рентгеновских лучей выяснилось, что в некоторых соединениях элементы IIА подгруппы проявляют одновалентность. Примером таких соединения являются ЭГ, которые получаются при добавлении Э к расплаву ЭГ2 . Все элементы этого ряда не встречаются в природе в свободном состоянии ввиду высокой активности.
Часть вторая. Бериллий и магний.
История бериллия
Соединения бериллия в виде драгоценных камней были известны еще в древности. С давних пор люди искали и разрабатывали месторождения голубых аквамаринов, зеленых изумрудов, зеленовато-желтых бериллов и золотистых хризобериллов. Но только в конце 18 века химики заподозрили, что в бериллах есть какой-то новый неизвестный элемент. В 1798 году французский химик Льюис Николас Воклен выделил из берилла окись «La terree du beril», отличавшуюся от окиси алюминия. Эта окись придавала солям сладкий вкус, не образовывала квасцов, растворялась в растворе карбоната аммония и не осаждалась оксалатом калия. Металлический бериллий был впервые получен в 1829 году известным немецким ученым Веллером и одновременно французским ученым Бюсси, который получил порошок металлического бериллия восстановлением хлористого бериллия металлическим калием. Начало промышленного производства относится к 30-40 гг. прошлого столетия.
История магния
Свое название элемент получил по местности Магнезия в Древней Греции.Природные магнийсодержащие материалы магнезит и доломит издавна использовались в строительстве.
Первые попытки выделить металлическую основу магнезии в чистом виде были предприняты в начале XIX в. знаменитым английским физиком и химиком Гемфри Дэви (1778–1829) после того, как он подверг электролизу расплавы едкого кали и едкого натра и получил металлический Na и K. Он решил попытаться аналогичным образом осуществить разложение оксидов щелочноземельных металлов и магнезии. В своих первоначальных опытах Дэви пропускал ток через влажные оксиды, предохраняя их от соприкосновения с воздухом слоем нефти; однако при этом металлы сплавлялись с катодом и их не удавалось отделить.
Дэви пробовал применять множество различных методов, но все они по разным причинам оказывались малоуспешными. Наконец, в 1808 г. его постигла удача – он смешал влажную магнезию с оксидом ртути, поместил массу на пластинку из платины и пропустил через нее ток; амальгаму перенес в стеклянную трубку, нагрел, чтобы удалить ртуть, и получил новый металл. Тем же способом Дэви удалось получить барий, кальций и стронций. Промышленное производство магния электролитическим способом было начато в Германии в конце 19 века. Теоретические и экспериментальные работы по получению магния электролитическим способом в нашей стране были выполнены П.П. Федотьевым; процесс восстановления оксида магния кремнием в вакууме исследовал П.Ф. Антипин.
Распространение
Бериллий относится к числу не очень распространенных элементов: его содержание в земной коре составляет 0,0004 вес. %. Бериллий в природе находится в связанном состоянии. Важнейшие минералы бериллия: берилл- Be3 Al2 (SiO3 )6 , хризоберилл- Be(AlO2 )2 и фенакит- Be2 SiO4 . Основная часть бериллия распылена в качестве примесей к минералам ряда других элементов, особенно алюминия. Бериллий содержится также в глубинных осадках морей и золе некоторых каменных углей. Некоторые разновидности берилла, окрашенные примесями в различные цвета, относятся к драгоценным камням. Таковы, например, зеленые изумруды, голубовато-зеленые аквамарины.
Магний – один из самых распространенных в земной коре элементов. Содержание магния составляет 1,4 %. К числу важнейших минералов относятся, в частности, углекислые карбонатные породы, образующие огромные массивы на суше и даже целые горные хребты – магнезит MgCO3 и доломит MgCO3 -CaCO3 . Под слоями различных наносных пород совместно с залежами каменной соли известны колоссальные залежи и другого легкорастворимого магнийсодержащего минерала – карналлита MgCl2 -KCl-6H2 O. Кроме того, во многих минералах магний тесно связан с кремнеземом, образуя, например, оливин [(Mg, Fe)2 SiO4 ] и реже встречающийся форстерит (Mg2 SiO4 ). Другие магнийсодержащие минералы – это бруцит Mg(OH)2, кизерит MgSO4, эпсонит MgSO4 -7H2 O, каинит MgSO4 -KCl-3H2 O. На поверхности Земли магний легко образует водные силикаты (тальк, асбест и др.), примером которых может служить серпентин 3MgO-2SiO2 -2H2 O. Из известных минералов около 13 % содержат магний. Однако природные соединения магния широко встречаются и в растворенном виде. Кроме различных минералов и горных пород, 0,13 % магния в виде MgCl2 постоянно содержатся в водах океана (его запасы здесь неисчерпаемы – около 6-1016 т) и в соленых озерах и источниках. Магний также входит в состав хлорофилла в количестве до 2 % и выступает здесь как комплексообразователь. Общее содержание этого элемента в живом веществе Земли оценивается величиной порядка 1011 тонн.
Получение
Основной (около 70%) способ получения магния – электролиз расплавленного карналлита или MgCl2 под слоем флюса для защиты от окисления. Термический способ получения магния (около 30%) заключается в восстановлении обожженного магнезита или доломита. Бериллиевые концентраты перерабатывают в оксид или гидроксид бериллия, из которых получают фторид или хлорид. При получении металлического бериллия осуществляют электролиз расплава BeCl2 (50 вес.%) и NaCl.Такая смесь имеет температуру плавления 300 о С против 400 о С для чистого ВеCl2 . Также бериллий получают магний- или алюмотермически при 1000-12000 C из Na2 [BeF4 ]: Na2 [BeF4 ] + 2Mg = Be + 2Na + МgF2 . Особо чистый бериллий (в основном для атомной промышленности) получают зонной плавкой, дистилляцией в вакууме и электролитическим рафинированием.
Особенности
Бериллий является “чистым” элементом. В природе магний встречается в виде трех стабильных изотопов: 24 Mg (78,60%), 25 Mg (10,11%) и 26 Mg (11,29%). Искусственно были получены изотопы с массами 23, 27 и 28.
Бериллий имеет атомный номер 4 и атомный вес 9,0122. Он находится во втором периоде периодической системы и возглавляет главную подгруппу 2 группы. Электронная структура атома бериллия — 1s2 2s2 . При химическом взаимодействии атом бериллия возбуждается (что требует затраты 63 ккал/г×атом) и один из 2s-электронов переходит на 2р-орбиталь что определяет специфику химии бериллия: он может проявлять максимальную ковалентность, равную 4, образуя 2 связи по обменному механизму, и 2 по донорно-акцепторному. На кривой потенциалов ионизации бериллий занимает одно из верхних мест. Последнее соответствует его малому радиусу и характеризует бериллий как элемент не особенно охотно отдающий свои электроны, что в первую очередь определяет малую степень химической активности элемента. С точки зрения электроотрицательности бериллий может рассматриваться как типичный переходный элемент между электроположительными атомами металлов, легко отдающих свои электроны, и типичными комплексо-образователями, имеющими тенденцию к образованию ковалентной связи. Бериллий проявляет диагональную аналогию с алюминием в большей мере, чем LicMg и является кайносимметричным элементом. Бериллий и его соединения весьма токсичны. ПДК в воздухе — 2 мкг/м3 .
В периодической системе элементов магний располагается в главной подгруппе II группы; порядковый номер магния – 12, атомный вес 24,312. Электронная конфигурация невозбужденного атома – 1s2 2s2 2p6 3s2 ; строение внешних электронных оболочек атома Mg (3s2 ) соответствует его нульвалентному состоянию. Возбуждение до двухвалентного 3s1 3p1 требует затраты 62 ккал/г-атом. Ионизационные потенциалы магния меньше, чем бериллия, поэтому соединения магния характеризуются большей долей ионности связи. По комплексообразовательной способности магний тоже уступает бериллию. Взаимодействие с элементами IIIВ группы с недостроенными d-оболочками имеет некоторые особенности. В эту группу входят Sc, Y, Ln, и Th. Эти элементы образуют с магнием ряд промежуточных фаз и хорошо растворяются в нем в жидком состоянии. Диаграммы состояния смесей этих элементов с магнием – эвтектического характера. Растворимость этих элементов в магнии в твердом состоянии не велика (2 – 5 % по массе). Со щелочноземельными и особенно со щелочными металлами магний не образует значительной области растворимости в твердом состоянии, что связано с большим различием атомных радиусов. Исключением является литий, атомный радиус которого отличается от атомного радиуса магния на 2 %. Системы магния с медью, серебром и золотом – эвтектического типа. Растворимость серебра при температуре эвтектики –16 % по массе.
Физические свойства
Бериллий – металл серебристо-белого цвета. Довольно тверд и хрупок. Обладает диамагнитными свойствами. На воздухе он покрывается тонкой окисной пленкой предающей металлу серый, матовый цвет и предохраняющей от дальнейшей коррозии. Сжимаемость бериллия очень мала. Меньше всех металлов (в 17 раз меньше Аl) задерживает рентгеновское излучение. Он кристаллизуется в ГПУ-структуре с периодами а=0,228 нм, и с=0,358 нм, КЧ=6. При 1254 о С гексагональная a-модификация переходит в кубическую b. Бериллий образует эвтектические сплавы с Al и Si.
mirznanii.com

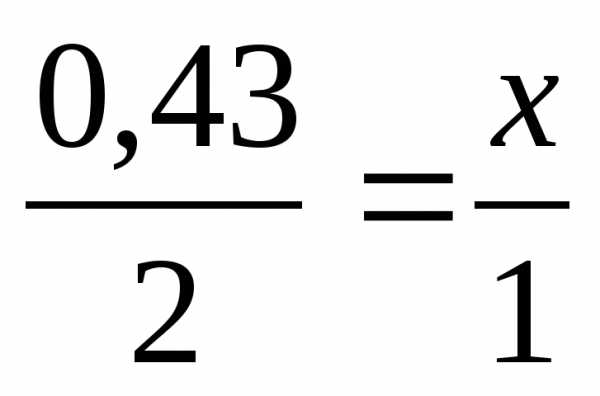 х = 0,215 (моль)
х = 0,215 (моль)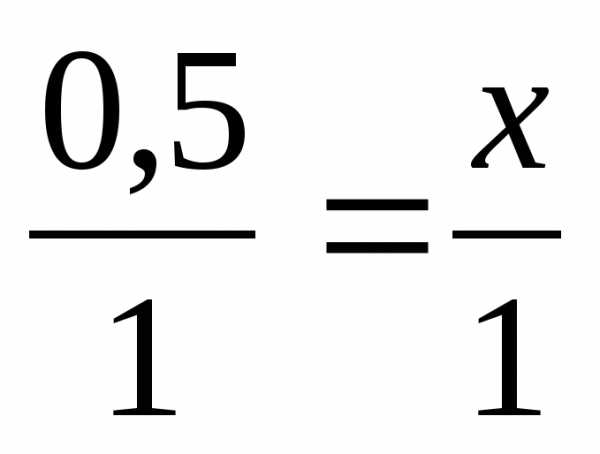 х = 0,5 (моль)
х = 0,5 (моль)