Классификация металлов | Мир сварки
Содержание
- Классификация металлов
- Классификация черных металлов
- Классификация цветных металлов
- Литература
Классификация металлов
Металлы делятся на две группы:
Черные – металлы, которые имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твердость и во многих случаях обладают полиморфизмом. Наиболее типичным металлом этой группы является железо.
Цветные – металлы, которые чаще всего имеют характерную окраску: красную, желтую, белую. Обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления, для них характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь.
Классификация черных металлов
Черные металлы можно подразделить следующим образом:
Железные металлы – железо, кобальт, никель (так называемые ферромагнетики) и близкий к ним по свойствам марганец. Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали.
Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали.
Тугоплавкие металлы, температура плавления которых выше, чем железа (т.е. 1539 °С). Применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов.
Урановые металлы – актиниды, имеющие преимущественное применение в сплавах для атомной энергетики.
Редкоземельные металлы (РЗМ) – лантан, церий, неодим, празеодим и др., объединяемые под названием лантаноидов и сходные с ними по свойствам иттрий и скандий. Эти металлы обладают весьма близкими химическими свойствами, но довольно различными физическими (температура плавления и др.). Их применяют как присадки к сплавам других элементов. В природных условиях они встречаются вместе и вследствие трудностей разделения на отдельные элементы для присадки обычно применяют «смешанный сплав», так называемый мишметалл, содержащий 40-45% Се и 45-50% всех других редкоземельных элементов. К таким смешанным сплавам РЗМ относят ферроцерий (сплав церия и железа с заметными количествами других РЗМ), дидим (сплав неодима и празеодима преимущественно) и др.
К таким смешанным сплавам РЗМ относят ферроцерий (сплав церия и железа с заметными количествами других РЗМ), дидим (сплав неодима и празеодима преимущественно) и др.
Щелочноземельные металлы в свободном металлическом состоянии не применяются, за исключением особых случаев.
Классификация цветных металлов
Цветные металлы по разным признакам делятся на подгруппы:
Легкие металлы, имеющие плотность до 5000 кг/м3 (литий, натрий, магний, калий, алюминий и др.).
Тяжелые металлы, имеющие плотность более 5000 кг/м3 (цинк, медь, олово, свинец, серебро, золото и др.).
Легкоплавкие металлы – цинк, кадмий, ртуть, олово, свинец, висмут, таллий, сурьма и элементы с ослабленными металлическими свойствами – галлий, германий.
Тугоплавкие металлы, температура плавления которых выше, чем у железа (ниобий, молибден, вольфрам и др.).
Благородные металлы – серебро, золото, металлы платиновой группы (платина, палладий, иридий, родий, осмий, рутений).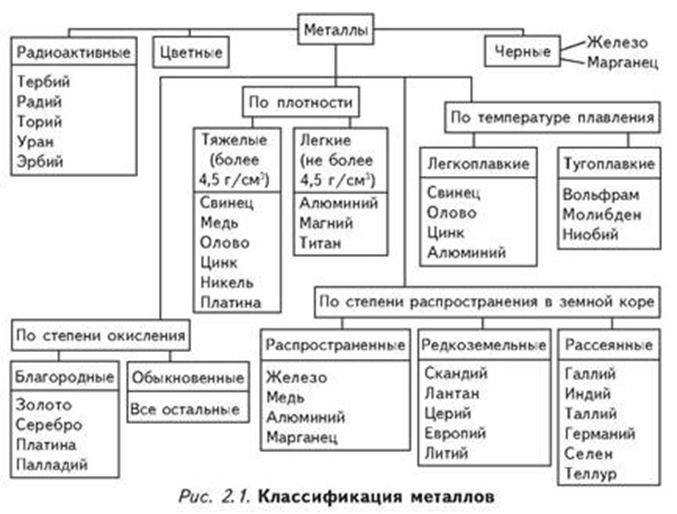 К ним может быть отнесена и «полублагородная» медь. Обладают высокой устойчивостью против коррозии.
К ним может быть отнесена и «полублагородная» медь. Обладают высокой устойчивостью против коррозии.
По строению электронных оболочек металлы принято разделять на нормальные и переходные. У нормальных металлов внутренние электронные оболочки (уровни) полностью заполнены. К таким металлам относят Na, Cu, Mg, Al, Pb и др. У переходных металлов внутренние p и d оболочки недостроены. Наиболее характерные представители переходных металлов Fe, Pd, Pt и им подобные.
Литература
- Материаловедение / Ю.Т. Чумаченко, Г.В. Чумаченко. – Ростов н/Д: Феникс, 2005. – 320 с.
- Металловедение / А.П. Гуляев. М.: Металлургия, 1986. 544 с.
- Материаловедение / А.М. Адаскин, В.М. Зуев. – М.: ПрофОбрИздат, 2001. – 240 с.
Глава 2.1. Понятие о металлах и сплавах — Купити в Харкові, Києві, Україні. Безкоштовне тестування
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой тепло- и электропроводностью. По последнему свойству металлы легко отличить от других веществ (дерево, стекло и т.д.).
По последнему свойству металлы легко отличить от других веществ (дерево, стекло и т.д.).
Все металлы и образованные из них сплавы делят на черные, к которым относят железо и сплавы на его основе (на их долю приходится около 95 % производимой в мире металлопродукции), и цветные. В технике принята условная классификация, по которой цветные металлы делят на группы: легкие (Al, Mg), тяжелые (Си, РЬ), тугоплавкие (W, Мо), благородные (Au, Pt), рассеянные (Gd, In), редкоземельные (Sc, Y), радиоактивные (Ra, U).
Понятие «чистый металл» условно, любой чистый металл содержит примеси. Под этим термином понимается металл, содержащий 0,010…0,001 % примесей. Современная металлургия позволяет получать металлы высокой чистоты (99,999%). Однако примеси, даже в малых количествах, могут оказывать влияние на свойства металла.
Чистые металлы обладают низкой прочностью, поэтому их применение в технике в качестве конструкционных материалов ограниченно.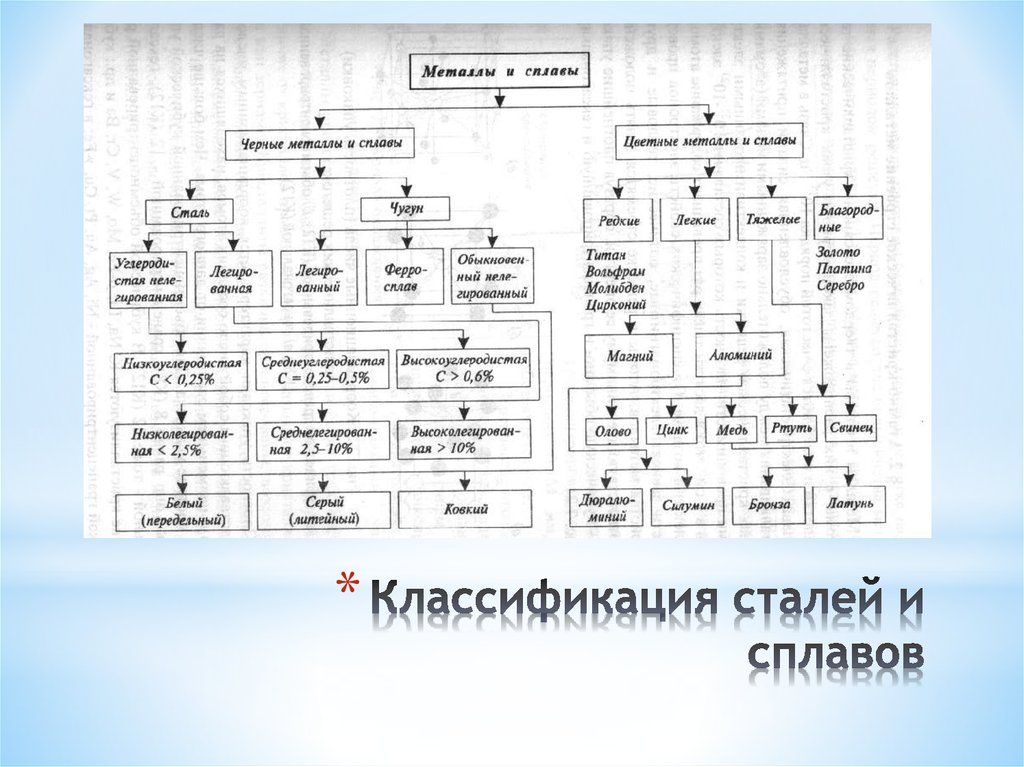 Наиболее широко применяют сплавы, которые по сравнению с чистыми металлами обладают более высокой прочностью и твердостью.
Наиболее широко применяют сплавы, которые по сравнению с чистыми металлами обладают более высокой прочностью и твердостью.
Сплавы — это сложные вещества, получаемые сплавлением или спеканием двух или более компонентов. Компоненты — простые вещества (часто это химические элементы), образующие сплав. При сплавлении все компоненты сплава первоначально находятся в жидком состоянии; при спекании, по крайней мере, один из компонентов находится в твердом состоянии. Сплавы могут состоять только из металлов, например латуни — это сплавы двух металлов: меди и цинка, или металлов и неметаллов, так, наиболее распространенные в технике материалы — стали и чугуны являются сплавами железа и углерода. Строение металлического сплава более сложное, чем у чистого металла.
Для рассмотрения строения, превращений и свойств металлов и сплавов введем понятия «фаза» и «структура».
Фазой называется однородная часть сплава, обладающая одинаковым химическим составом, строением и имеющая границы раздела с другими фазами, при переходе через которые свойства сплава резко меняются.
Под структурой понимается строение металла, т.е. количество фаз, их форма и размер, а также взаимное расположение. Структурными составляющими сплава называются обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями. Структурные составляющие могут состоять из одной, двух или более фаз.
- Наступна
Обзор металлов
Введение
Все металлы можно разделить на две широкие группы: черные и
цветные металлы, причем черные металлы содержат железо. Железо – это
основание такой классификации из-за его распространенности; это очень дешево
металл, который легко очищать, но чрезвычайно универсален благодаря множеству
различные фазы и свойства, которые он может иметь сам по себе или в сочетании с
углерод или другие легирующие металлы.
Сплавы черных металлов
Металлы, содержащие железо в качестве основного компонента, можно разделить на два общие группы, включая стали и чугуны. Разумеется, эти подразделения могут быть далее разделены на множество классификаций. Из всех сталей наиболее первичные классификации:
- низкоуглеродистые стали , содержащие менее 0,25 мас.% углерода (гипоэвтектоидные)
- стали со средним содержанием углерода , содержащие от 0,25% до 0,6% углерода (опять же доэвтектоидные)
Общество автомобильных инженеров имеет классификацию
эти классификации, определяющие систему нумерации для различных сталей
форма XXYY, где XX представляет легирующие металлы в стали, а YY
представляет собой сотые доли процента по массе углерода в сплаве. Например,
1025 стали бы
содержат 0,25% углерода и не содержат легирующих добавок
(обозначается цифрой 10). Общие металлы включены
в стали включает:
Например,
1025 стали бы
содержат 0,25% углерода и не содержат легирующих добавок
(обозначается цифрой 10). Общие металлы включены
в стали включает:
| Класс SAE | Содержимое |
|---|---|
| 10ГГ | обычная сталь с 0,YY мас.% углерода |
| 11ГГ | ресульфурированная сталь (для обрабатываемости) |
| 15ГГ | Марганец 10-20% |
| 40ГГ | Молибден 0,2-0,3% |
| 43ГГ | Никель (1,65-2%) + Хром (0,4-0,9%) + Молибден (0,2-0,3%) |
| 44ГГ | Молибден 0,5% |
Возвращаясь к классификации низко-, средне- и высокоуглеродистых сталей, здесь Вот несколько примеров применения и составов/сплавов этих сталей:
| Обычная сталь | Высокопрочный, низколегированный (HSLA) | Обычная сталь | Термообрабатываемый | Обычная сталь | Инструментальная сталь | Нержавеющая сталь |
|---|---|---|---|---|---|---|
| например, 1010 | например, 4310 | например, 1040 | например, 4340 | например, 1095 | например, 4190 | например, 304 |
| Без других легирующих металлов | Легированный хромом, ванадием, молибденом и/или никелем | Никаких других легирующих металлов | Никаких других легирующих металлов | Легированный хромом, ванадием, молибденом и/или вольфрамом | Легированный хромом, никелем и/или молибденом | |
| Используется в автомобильных рамах | Используется в элементах конструкции и двутавровых балках | Используется в кривошипных валах, болтах, молотках и лезвиях | Используется в поршнях, зубчатых передачах и устройствах с высоким износом | Используется в условиях повышенного износа | Используется в сверлах, пилах и штампах | Используется в высокотемпературных устройствах, например, в газотурбинных двигателях и печах |
Чем больше углерода добавляется в сталь, тем сплав входит в группу чугун режим,
где имеется от 3% до 4,5% углерода по весу. Эти чугуны
часто в сочетании с элементарным кремнием для разложения цементита (железо
карбид, Fe 3 C) фаза и, следовательно, перлитная фаза в железо и
графит. Преимущество этих чугунов в том, что они дешевы, тверды,
хрупкий и, как следует из названия, легко льется. Они находят свое применение в
применения, такие как чугунные блоки цилиндров и тому подобное, и могут быть разобраны
на несколько категорий:
Эти чугуны
часто в сочетании с элементарным кремнием для разложения цементита (железо
карбид, Fe 3 C) фаза и, следовательно, перлитная фаза в железо и
графит. Преимущество этих чугунов в том, что они дешевы, тверды,
хрупкий и, как следует из названия, легко льется. Они находят свое применение в
применения, такие как чугунные блоки цилиндров и тому подобное, и могут быть разобраны
на несколько категорий:
- Серый чугун образуется при медленном охлаждении чугуна с высоким содержанием кремния и характеризуется наличием чешуек графита в структуре которые добавляются как концентраторы напряжений. Они производят благоприятные вибрационные амортизация и износостойкость в ущерб прочности и пластичности; в то время как растягивающее напряжение слабое, серый чугун все еще обладает хорошей прочность на сжатие.
- Ковкий чугун изготавливается при добавлении магния или церия к
сфероидит, продукт отжига перлитного железа.

- Белый чугун содержит менее 1% кремния, что приводит к более остаточный цементит (Fe 3 C), повышающий твердость за счет пластичность.
- Чугун ковкий — продукт отжига белого чугуна при между 800°C и 900°C и характеризуется графитовыми розетками внутри металла. Ковкий чугун более пластичен, чем белый.
Сплавы цветных металлов
Сплавы цветных металлов более широко различаются по своей основной металлической составляющей и поэтому обладают широким спектром свойств.
Медные сплавы
Металлы на основе меди представляют значительный инженерный интерес. Медь берет гранецентрированная кубическая структура в чистом состоянии и поэтому очень пластична. Медь является отличным тепловым и электрическим проводником и обладает умеренная устойчивость к коррозии.
Добавление цинка делает латунь еще более устойчивой к коррозии
и может принимать либо α-фазу (гранецентрированную кубическую и пластичную),
или β′-фаза (объемноцентрированная кубическая и более твердая). Добавление олова
из меди получается бронза, которая часто также содержит алюминий, никель, цинк,
и/или кремний, который прочнее чистой меди.
Добавление олова
из меди получается бронза, которая часто также содержит алюминий, никель, цинк,
и/или кремний, который прочнее чистой меди.
Алюминиевые сплавы
Алюминий также является основой для многих сплавов и имеет структуру FCC, в то время как чистый. Алюминиевые сплавы удивительно легкие из-за алюминия. плотность 2,7 г/куб.см (по сравнению с плотностью 7,9 г/куб.см стали или 4,0 г/куб.см. глинозема) и имеет очень хорошую стойкость к коррозии и окислению благодаря самопассивность. Алюминий часто упрочняют добавлением легирующих металлы.
Другие конструкционные сплавы
Некоторые менее распространенные сплавы включают сплавы на основе магния, который стал
популярен в качестве материала для велосипедных рам из-за чрезвычайно низкой плотности (1,7
г/куб.см) и жесткость благодаря гексагональной плотноупакованной структуре. Титан
сплавы более плотные, чем эти легкие сплавы (плотность титана
4,5 г/куб.см), но очень прочные и имеют замечательное соотношение прочности к весу.
Тугоплавкие сплавы
Многие металлы обладают сильной металлической связью и высокими модулями упругости, которые, наряду с их низким тепловым расширением, делают исключительными в высокотемпературных Приложения. Обычные тугоплавкие металлы включают
- Вольфрам (W) , который плавится при температуре около 3400°C
- Тантал (Ta) , плавящийся при температуре около 3000°C
- Молибден (Mo) , плавящийся при температуре около 2600°C
- Ниобий (Nb) , плавится при температуре около 2400°C
Для сравнения: чистое железо плавится при температуре около 1500°C, а поверхность Солнца около 6000°C. Таким образом, эти тугоплавкие металлы имеют температуру плавления, превышающую температуру плавления сталей в два и более раза.
Суперсплавы
Суперсплавы — это сплавы на основе никеля, кобальта или железа, которые используются в
средах, требующих чрезвычайно низкой ползучести и высокой стойкости к окислению при
температуры выше 1000°С. Например, почти все высококачественные газы
лопатки турбины (т.е. внутренности реактивных двигателей) монокристаллические
лезвия из суперсплава на основе никеля, покрытые термическим (плазменным) напылением циркония.
Они работают при чрезвычайно высоких температурах и подвержены чрезвычайно высоким
напряжения, поэтому требуется исключительное сопротивление ползучести, чтобы предотвратить
лезвия от деформации во время работы.
Например, почти все высококачественные газы
лопатки турбины (т.е. внутренности реактивных двигателей) монокристаллические
лезвия из суперсплава на основе никеля, покрытые термическим (плазменным) напылением циркония.
Они работают при чрезвычайно высоких температурах и подвержены чрезвычайно высоким
напряжения, поэтому требуется исключительное сопротивление ползучести, чтобы предотвратить
лезвия от деформации во время работы.
Благородные металлы
Благородные металлы также представляют интерес из-за их редкости в природе (что делает привлекательные для ювелиров) и инертность во многих химически активных среды (что делает их привлекательными для ученых-материаловедов). Эти металлы включают золото, серебро, платину, иридий, осмий, рений и палладий, и все они устойчивы к окислению.
Металлообработка
Преобразование металлической заготовки в полезную форму обычно осуществляется либо
процессы формования, литья или соединения, а также постформирования, такие как закалка, могут
требуется, чтобы полностью адаптировать свойства металла к конкретному применению.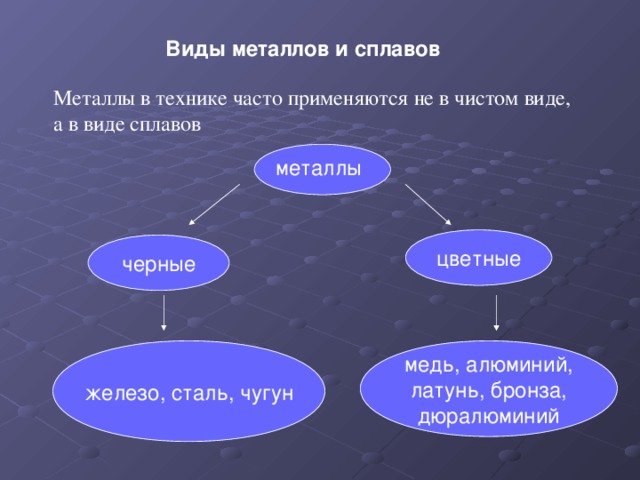 Вместо того, чтобы обсуждать каждый метод формирования металла, ниже приводится краткое объяснение.
различных терминов, распространенных в металлообработке.
Вместо того, чтобы обсуждать каждый метод формирования металла, ниже приводится краткое объяснение.
различных терминов, распространенных в металлообработке.
- Формовка металла
- Горячая ковка включает в себя штамповку куска горячего металла в штампе для придания ему формы. Холодная ковка аналогична, но без горячей части.
- Чертеж используется для изготовления труб и проводов и включает протягивание горячего металла через матрицу или отверстие.
- Экструзия аналогична волочению, за исключением того, что давление используется для проталкивания металла через матрицу или отверстие.
- Прокатка — это когда металл (например, в виде слитка) продавливается через два ролика. Как и ковка, это может быть горячее или холодное.
- Металлическое литье
- Литье в песчаные формы включает заливку жидкого металла в песчаную форму и последующее отделение песка после охлаждения; он используется при формовании блоков двигателей и крупных деталей из-за его относительно низкой стоимости.

- Литье по выплавляемым моделям — это литье жидкого металла в огнеупорные гипсовые формы, формируемые вокруг восковых моделей.
- Литье под давлением Модель использует огнеупорную форму, состоящую из двух частей, для массового производства изделий большого объема.
- Непрерывное литье используется для простых объектов, таких как слитки, и, как следует из названия, представляет собой непрерывный процесс.
- Литье в песчаные формы включает заливку жидкого металла в песчаную форму и последующее отделение песка после охлаждения; он используется при формовании блоков двигателей и крупных деталей из-за его относительно низкой стоимости.
- Соединение металлов
- Порошковая металлургия во многом похожа на обработку керамического порошка, когда компактный металлический порошок спекается в плотное тело.
- Порошковая ковка очень похожа на горячую ковку, за исключением того, что набор порошка штампуется при достаточном напряжении, чтобы вызвать сплавление частиц.
- Сварка используется для соединения больших кусков металла и часто вызывает локальные микроструктурные изменения из-за сильного нагрева, проводимого в области вокруг сварного шва
Другим важным понятием, которое следует учитывать, являются явления затвердевания, которые происходят
в сплавах, что лежит в основе того, почему легирование является таким полезным процессом. Поскольку металлы деформируются за счет движения дислокаций через их решетку,
торможение движения дислокаций упрочняет металлы и делает их менее пластичными.
Упрочнение твердого раствора происходит из-за того, что легированные атомы в первичном металле
кристаллическая структура вызывает напряжения в решетке; эти локализованные
зоны растяжения/сжатия создают области, в которых большие и малые атомы предпочитают
двигаться соответственно. Таким образом, при миграции дислокации через такую область
дислокация должна либо преодолеть эту естественную склонность атомов к
оставайтесь в этих предпочтительных местах или перетащите эти напряженные места вместе с ним.
Поскольку металлы деформируются за счет движения дислокаций через их решетку,
торможение движения дислокаций упрочняет металлы и делает их менее пластичными.
Упрочнение твердого раствора происходит из-за того, что легированные атомы в первичном металле
кристаллическая структура вызывает напряжения в решетке; эти локализованные
зоны растяжения/сжатия создают области, в которых большие и малые атомы предпочитают
двигаться соответственно. Таким образом, при миграции дислокации через такую область
дислокация должна либо преодолеть эту естественную склонность атомов к
оставайтесь в этих предпочтительных местах или перетащите эти напряженные места вместе с ним.
Родственное явление, называемое дисперсионным твердением, происходит, когда сплав
охлаждается ниже предела устойчивости твердого раствора, и начинается вторая фаза
выпадать в осадок. Контролируя, как долго металл удерживается в этом
двухфазной области, размер этих зародышей второй фазы можно контролировать,
тем самым позволяя относительно точно контролировать затвердевание сплава.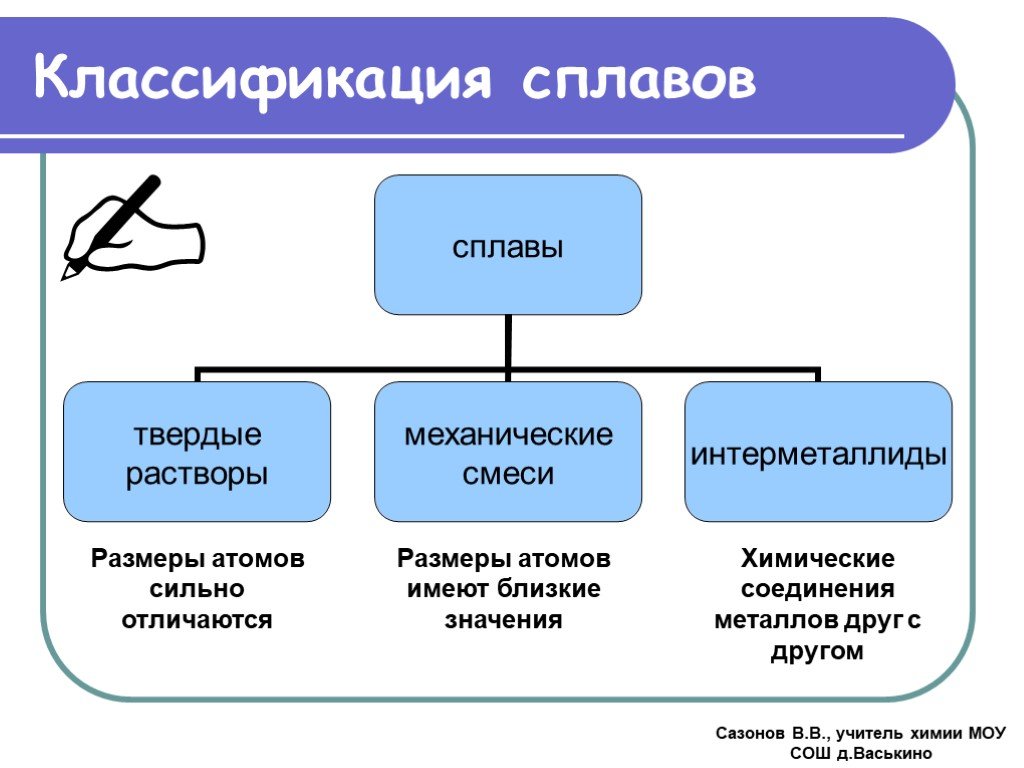
Как периодическая таблица группирует элементы
В классической Периодической таблице химические элементы организованы в соответствии с количеством протонов, которые каждый из них имеет в своем атомном ядре. (Изображение предоставлено: Карл Тейт, автор Livescience.com)Несколько столетий назад ученые имели элементарное представление о периодической таблице элементов. Но в конце 19 века русский химик Дмитрий Менделеев опубликовал свою первую попытку сгруппировать химические элементы по их атомному весу. В то время было известно всего около 60 элементов, но Менделеев понял, что, когда элементы организованы по весу, определенные типы элементов встречаются через равные промежутки времени или периоды.
Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новых элементов в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации. Таблица начинается с простейшего атома, водорода, а затем остальные элементы упорядочены по атомному номеру, то есть количеству протонов, содержащихся в каждом из них. За некоторыми исключениями, порядок элементов соответствует возрастающей массе каждого атома.
За некоторыми исключениями, порядок элементов соответствует возрастающей массе каждого атома.
В таблице семь строк и 18 столбцов. Каждая строка представляет один период; номер периода элемента указывает, на скольких его энергетических уровнях находятся электроны. Например, натрий находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях. Двигаясь вниз по таблице, периоды длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют собой группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов в самой внешней оболочке — лице, которое они показывают миру. Например, элементы группы 18 в крайней правой части таблицы имеют полностью заполненные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлы или неметаллы, но граница между ними размыта. Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы внутри металлов основаны на сходных характеристиках и химических свойствах этих коллекций. В нашем описании периодической таблицы используются общепринятые группы элементов, согласно данным Лос-Аламосской национальной лаборатории .
Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы внутри металлов основаны на сходных характеристиках и химических свойствах этих коллекций. В нашем описании периодической таблицы используются общепринятые группы элементов, согласно данным Лос-Аламосской национальной лаборатории .
Группы периодической таблицы
Щелочные металлы: Щелочные металлы составляют большую часть группы 1, первой колонки таблицы. Блестящие и достаточно мягкие, чтобы их можно было резать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и загораются или даже взрываются при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с его единственным электроном тоже живет в группе 1, но газ считается неметаллом.
Щелочноземельные металлы: Щелочноземельные металлы составляют группу 2 периодической таблицы, от бериллия (Be) до радия (Ra). Каждый из этих элементов имеет два электрона на своем внешнем энергетическом уровне, что делает щелочные земли достаточно реактивными, поэтому они редко встречаются в природе поодиночке. Но они не такие реактивные, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Каждый из этих элементов имеет два электрона на своем внешнем энергетическом уровне, что делает щелочные земли достаточно реактивными, поэтому они редко встречаются в природе поодиночке. Но они не такие реактивные, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Лантаниды: Третья группа слишком длинная, чтобы поместиться в третий столбец, поэтому она разбивается и переворачивается, чтобы стать верхней строкой острова, плавающего внизу таблицы. Это лантаноиды, элементы с 57 по 71 — от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы с 89, актиний (Ac), по 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются в природе на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, оставшиеся группы с 3 по 12 представляют собой остальные переходные металлы. Твердые, но податливые, блестящие и обладающие хорошей проводимостью, эти элементы — это то, о чем вы обычно думаете, когда слышите слово «металл». Многие из величайших хитов мира металла, включая золото, серебро, железо и платину, живут здесь.
Постпереходные металлы: В преддверии прыжка в мир неметаллов общие характеристики не разделены четко по вертикальным групповым линиям. К постпереходным металлам относятся алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми классическими характеристиками переходных металлов, но они, как правило, мягче и хуже проводят ток, чем другие переходные металлы. Во многих периодических таблицах есть жирная линия «лестницы» под диагональю, соединяющей бор с астатом.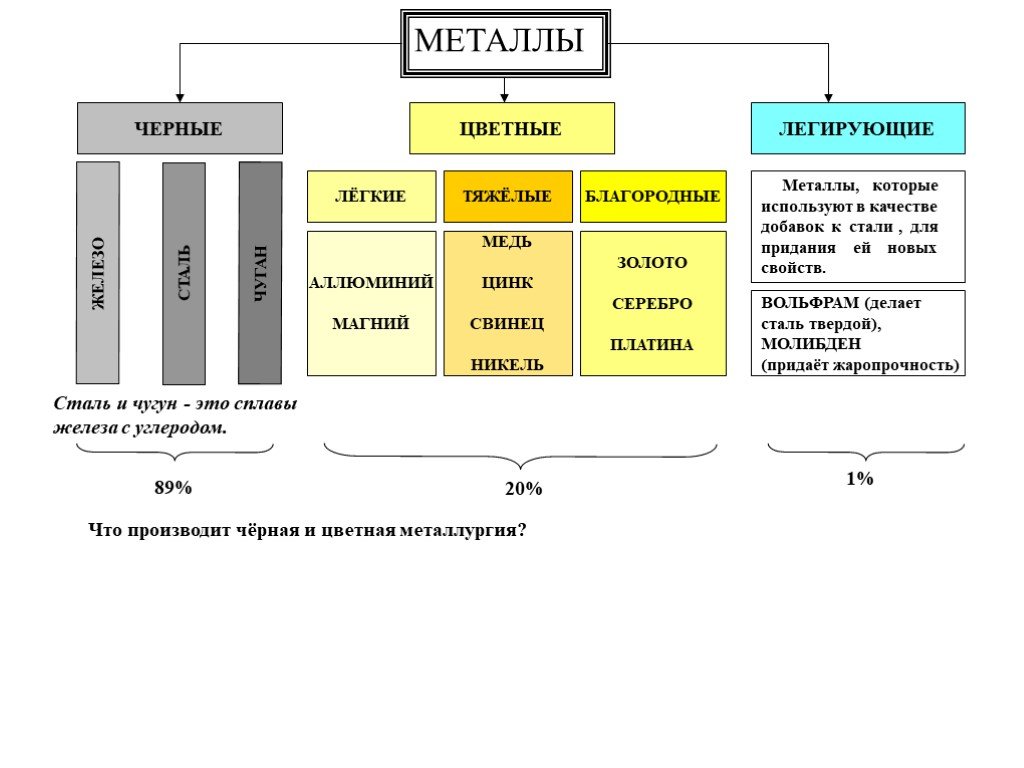 Постпереходные металлы сгруппированы в левом нижнем углу этой линии.
Постпереходные металлы сгруппированы в левом нижнем углу этой линии.
Металлоиды: Металлоиды: бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po). Они образуют лестницу, которая представляет собой постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное вверху справа от лестницы — плюс водород (H), застрявший далеко в группе 1 — является неметаллом. К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически активны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей. Поваренная соль на вашей кухне, например, представляет собой сочетание щелочного металла натрия и галогена хлора.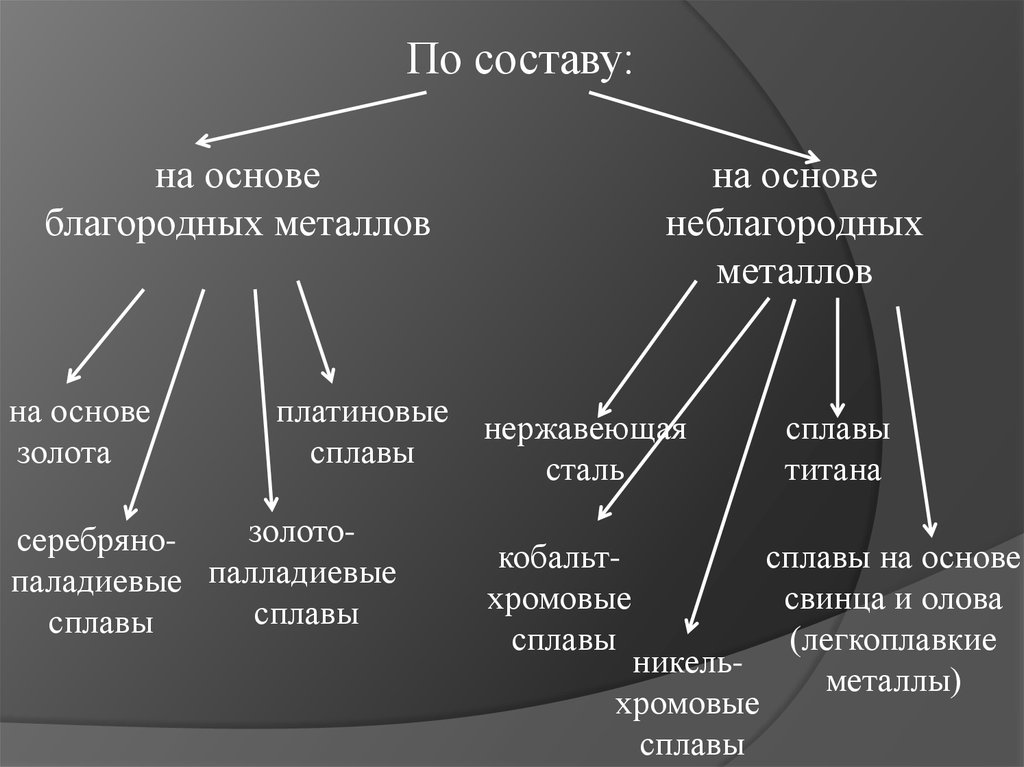
Благородные газы: Бесцветные, без запаха и почти полностью нереакционноспособные, инертные или благородные газы завершают таблицу в Группе 18. Многие химики ожидают, что оганесон (ранее обозначаемый как «унуноктий»), один из четырех недавно названных элементов, разделить эти характеристики; однако, поскольку период полураспада этого элемента измеряется миллисекундами, никто не смог проверить его напрямую. Оганесон завершает седьмой период таблицы Менделеева, так что если кому удастся синтезировать элемент 119(и гонка за это уже началась), он зациклится, чтобы начать восьмой ряд в столбце щелочных металлов.
Из-за циклического характера, создаваемого периодичностью, которая дала название таблице, некоторые химики предпочитают визуализировать таблицу Менделеева в виде круга.
Дополнительные ресурсы:
- Посмотрите это короткое видео о периодической таблице и группах элементов из Crash Course (откроется в новой вкладке).
- Пролистайте эту интерактивную периодическую таблицу элементов на ptable.

