Итоговая контрольная работа по химии 9 класс
Итоговая (стандартизированная) контрольная работа по химии
за курс «Химия. 9 класс»
Вариант № 1
А1. Распределение электронов по энергетическим уровням 2е, 8е, 2е соответствует частице 1) Мg0 2) О2- 3) Мg2+ 4) S2-
А2. В ряду элементов Na – Mg – Al — Si
уменьшаются радиусы атомов
уменьшается число протонов в ядрах атомов
увеличивается число электронных слоёв в атомах
уменьшается высшая степень окисления атомов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
природа реагирующих веществ
температура
концентрация реагирующих веществ
4)тип химической реакции
А4. Наиболее электропроводным металлом из перечисленных является
Наиболее электропроводным металлом из перечисленных является
цинк 3) свинец
медь 4) хром
А5. Металл, не относящийся к щёлочноземельным,
1)магний 3) стронций
2)кальций 4) барий
А6. Наиболее активно реагирует с водой
скандий 3) калий
магний 4) кальций
А7. Агрегатное состояние иода при нормальных условиях
жидкое 2) твёрдое 3) газообразное
А8.Металл, с которым не взаимодействует концентрированная серная кислота,
1)железо 2)магний 3)цинк 4)натрий
Часть В. Тестовые задания на соответствие.
В1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Реагирующие Продукты их
вещества взаимодействия
А) Cu +Cl2 1) Cu(OH)2 и Cl2
Б) CuО + HCl 2) CuCl
В) Cu 2О + HCl 3) CuCl2 и H2O
4) CuCl2
5) CuCl и H2O
В2. Установите соответствие между типами и уравнениями химических реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) соединения, ОВР, необратимая
Б) разложения, ОВР, эндотермическая
В) соединения, ОВР, гомогенная
УРАВНЕНИЯ РЕАКЦИЙ
N2(г) + 3H2(г) ↔ 2NH3(г) + Q
2КNO3 = 2KNO2 + O2 +Q
FeO + C → Fe + CO -Q
4Fe + 3O2 + 6H2O = 4Fe(OH)3
2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения Zn → ZnCl2 → Zn(OH)2 → ZnO
Запишите уравнения реакций, с помощью которых можно осуществить превращения Zn → ZnCl2 → Zn(OH)2 → ZnO
Для перехода 2 запишите ионное уравнение.
С2. . К 34,8г сульфата калия прилили раствор, содержащий 83,2 г хлорида бария. Определите массу образовавшегося осадка. (5б).
С3.Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu +HNO3→Cu(NO3)2+NO +H2O.
Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс».
Вариант № 2
А1. Распределение электронов по энергетическим уровням 2е, 8е, 6е соответствует атому
углерода 3) фосфора
серы 4) хлора
А2. В ряду элементов С –N — О — F
уменьшается высшая степень окисления элементов в соединениях
увеличиваются радиусы атомов
уменьшается восстановительная способность простых веществ
увеличивается высшая степень окисления элементов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
Фактор, не влияющий на скорость химических реакций,
катализатор
способ получения реагентов
природа реагирующих веществ
концентрация реагирующих веществ
А4. Металл, не относящийся к щелочным металлам,
калий 3) литий
кальций 4) натрий
А5. Свойство ртути, которое ограничивает её применение в бытовых термометрах
агрегатное состояние
температура плавления
токсичность
высокая плотность
А6. Водород нельзя получить путём взаимодействия металлов с кислотой
азотной 3) соляной
серной 4) фосфорной
А7. Свойство, характерное для озона,
хорошо растворяется в воде
не имеет запаха
бактерициден
легче воздуха
А8. Вода взаимодействует с каждым из веществ, формулы которых
1)Ca и Na2O 2) Na2O и Cu 3)CuO и N2O5 4)ZnO и SO2
Часть В.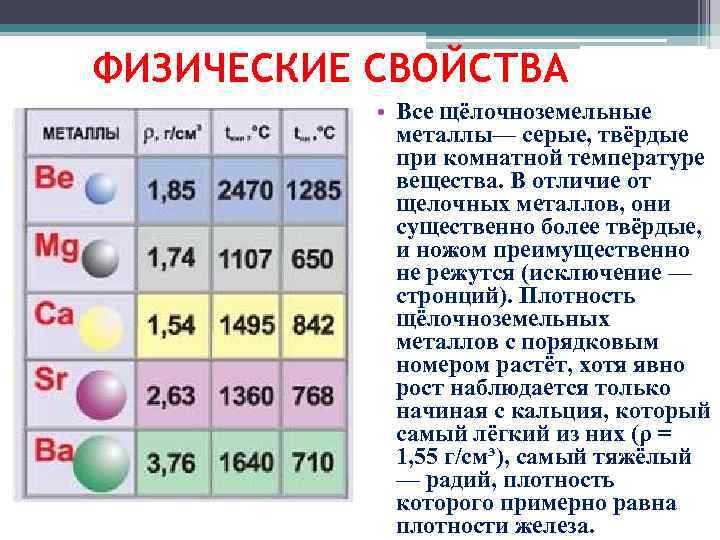 Тестовые задания на соответствие.
Тестовые задания на соответствие.
В2. Установите соответствие между исходными веществами и продуктами реакций.
Исходные вещества Продукты реакции
А) Na и H2O 1) Na2SO3 и H2O
Б) Na2O и H2O 2) NaOH и H2O
В ) NaOH и SO2 3) NaOH и H2
4) NaOH
В2. Установите соответствие между типами и уравнениями реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) замещения, ОВР, эндотермическая
Б) разложения, ОВР, экзотермическая
В) соединения, ОВР, необратимая
УРАВНЕНИЯ РЕАКЦИЙ
N2(г) + 3H2(г) ↔ 2NH3(г) + Q
2КNO3 = 2KNO2 + O2 +Q
FeO + C → Fe + CO -Q
4Fe + 3O2 + 6H2O = 4Fe(OH)3
2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения MgO→ MgCI2→Mg(OH)2→ Mg(NO3)2
Для перехода 3 запишите ионное уравнение.
С2. К раствору, содержащему 63,9г нитрата алюминия, прилили раствор, содержащий 39,2г фосфорной кислоты. Определите массу фосфата алюминия.
С3. Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu + HNO3→ Cu(NO3)2 + NO2 + H2O
Рекомендации по оцениванию работы
Максимальное количество баллов – 21 балл
Задания базового уровня (А1-А8), только один правильный ответ. (1 балл)
Задания повышенного уровня (В1-В2), найти соответствие. (2 балла)
Задание С1, С2, С3 — требуют полного ответа. (3 балла)
Соответствие баллов, полученных за выполнение заданий, отметке/оценке по пятибалльной шкале оценивания
Отметка | 2 | 3 | 4 | 5 |
Число баллов за работу | 0-9 | 10-13 | 14-17 | 18-21 |
Ответы: Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс
9 класс
Вариант 1. Часть А. 1 1 4 1 1 3 2 1 Часть В. А-4, Б-3, В-5. А-4, Б-2, С- 1. Часть С. 1. Zn + Cl2 = ZnCl2 ZnCl2 + 2KOH = Zn(OH)2 + 2KCl Zn(OH)2 = ZnO + h3O 2. Задача 34,8г 83,2г х К2SO4 + BaCl2 → BaSO4 + 2KCl 1*174г 1*208г 1*233 Х = 0,2*233 = 46,6г 3. 3Cu⁰+8HN⁺⁵O3(разб.)=3Cu⁺²(NO3)2+2N⁺²O+4h3O | Вариант 2 Часть А. 3 3 2 2 3 1 3 1 Часть В. А-3, Б-4, В-1. А-3, Б-2, В- 4. Часть С. 1. MgO+2HCl=MgCl2+h3O MgCl2+2KOH=Mg(OH)2+2KCl Mg(OH)2+2HNO3=Mg(NO3)2+2h3O 2. Задача 63,9г 39,2г х Al(NO3)3 + H3PO4 → AlPO4 + 3HNO3 1*213г 1*98г 1*122г Х = 0,3*122 = 36,6г 3. Cu⁰+4HN⁺⁵O3(конц.)=Cu⁺²(NO3)2+2N⁺⁴O2+2h3O |
Итоговая (стандартизированная) контрольная работа по химии 9 класс О.С. Габриелян | Методическая разработка по химии (9 класс):
Лист самооценки по химии
__________________________ (ФИ) _______ класс_______________ учебный год
Умение | Номер заданий из стандартизированной работы | Уровень усвоения | Возникшие трудности | ||
Не умею | Решаю с трудом, допускаю ошибки | умею | |||
описывать строение атома | А1 | ||||
объяснять закономерности изменения строения атомов, свойств элементов в пределах малых периодов и главных подгрупп; определять по положению в ПС принадлежность элемента к определенной группе веществ | А2, А5 | ||||
определять факторы, влияющие на скорость химической реакции | А3 | ||||
характеризовать физические и химические свойства | А4,А6, А7,А8, В1 | ||||
классифицировать химические реакции по различным признакам | В2 | ||||
осуществлять цепочки превращения, применяя знания химических свойств неорганических соединений, составлять химические реакции, записывать уравнения в молекулярном и ионном виде | С1 | ||||
Проводить вычисления по химическим формулам и уравнениям. | С2 | ||||
составлять уравнения окислительно-восстановительных реакций, определять окислитель и восстановитель; | С3 | ||||
СПЕЦИФИКАЦИЯ
Итоговой (стандартизированной) контрольной работы по химии
за курс «Химия. 9 класс» МБОУ технического лицея № 176 Карасукского района Новосибирской области.
Назначением работы является проведение промежуточной аттестации учащихся 9-х классов по предмету химия. Работа проводится в форме стандартизированной контрольной работы по окончанию 9 класса.
Цель – определение уровня (степени) достижения планируемых результатов освоения основной образовательной программы основного общего образования по предмету химия за курс 9 класса.
Документы, определяющие содержание работы. Содержание диагностической работы соответствует нормативным документам:
- Федеральный закон от 29.12.2012 г. № 273-ФЗ «Об образовании в Российской Федерации».
- Федеральный государственный образовательный стандарт основного общего образования (Приказ Министерства образования и науки Российской Федерации от 17.12.2010 № 1897).
- Основная образовательная программа МБОУ технического лицея № 176 Карасукского района Новосибирской области.
- Рабочие программы к УМК О.С.Габриеляна: Химия.8-9 классы: учебно-методическое пособие/ сост. Т.Д.Гамбурцева. – 2-е изд., стереотип. – М.:Дрофа, 2014
- 2 Примерные программы по учебным предметам. Химия. 8-9 классы:проект. – М.: Просвещение, 2010.- 48 с- ( стандарты второго поколения).
- Рабочая программа по химии.
Структура диагностической работы
Диагностическая работа состоит из трех частей, различающихся формой и уровнем сложности заданий. Всего в работе 13 заданий.
Всего в работе 13 заданий.
Работа содержит 8 заданий базового уровня сложности с выбором ответа; 2 задания повышенного уровня сложности на установление соответствия, 3 задания требуют полного ответа.
Распределение заданий диагностической работы по проверяемым умениям и элементам содержания
Отбор содержания, подлежащего проверке, в работе осуществляется в соответствии с требованиями ФГОС к уровню подготовки выпускников и с учетом содержания учебника (Приказ Министерства образования и науки Российской Федерации от 31.03.2014 г. № 253), описанными в виде предметных умений так, чтобы обеспечить проверку их сформированности в соответствии с предметными планируемыми результатами освоения обучающимися основной образовательной программы основного общего образования по химии за курс 9 класса.
Кодификатор
Распределение заданий работы в соответствии с планируемыми предметными результатами
№ задания | Раздел/тема программы | Проверяемые предметные достижения | Уровень сложности | Максимальный балл |
Общая характеристика химических элементов и химических реакций. | Определять число электронов у частиц (атомов, молекул). | базовый | 1 | |
Общая характеристика химических элементов и химических реакций. | Устанавливать закономерности положения химического элемента в ПС и их свойств. | базовый | 1 | |
Общая характеристика химических элементов и химических реакций. | Определять влияние факторов на скорость химической реакции. | базовый | 1 | |
Общая характеристика химических элементов и химических реакций. | Классифицировать химические реакции по различным признакам. | повышенный | 2 | |
Металлы. | Определять физические свойства металлов. | базовый | 1 | |
Металлы. | Определять принадлежность металла к определенной группе. | базовый | 1 | |
Металлы. | Определять химические свойства металлов. | базовый | 1 | |
Неметаллы. | Определять физические свойства неметаллов. | базовый | 1 | |
Неметаллы. | Определять химические свойства неметаллов. | базовый | 1 | |
Обобщение знаний по химии за курс основной школы. | Определять по исходным веществам продукты реакции. | повышенный | 2 | |
Обобщение знаний по химии за курс основной школы. | Составлять уравнения химических реакций на основе знаний о химических свойствах простых веществ и основных классов неорганических веществ, писать реакции в ионном виде. | повышенный | 3 | |
Обобщение знаний по химии за курс основной школы. | Выполнять расчеты по химическим уравнениям. | повышенный | 3 | |
Обобщение знаний по химии за курс основной школы. | Расставлять степени окисления, составлять электронный баланс, определять окислитель, восстановитель. | повышенный | 3 | |
Всего | 21 |
Распределение заданий по разделам программы
Раздел программы | Количество заданий базового уровня сложности | Количество заданий повышенного уровня сложности |
Общая характеристика химических элементов и химических реакций. | 3 | 1 |
Металлы. | 3 | — |
Неметаллы. | 2 | — |
Обобщение знаний по химии за курс основной школы. | — | 4 |
Всего заданий | 8 (62 %) | 5 (38%) |
Заданий базового уровня сложности – 8 (62 %), повышенного – 5 (38%).
Итоговая (стандартизированная) контрольная работа по химии
за курс «Химия. 9 класс».
Вариант № 1
А1. Распределение электронов по энергетическим уровням 2е, 8е, 2е соответствует частице 1) Мg0 2) О2- 3) Мg2+ 4) S2-
А2. В ряду элементов Na – Mg – Al — Si
В ряду элементов Na – Mg – Al — Si
- уменьшаются радиусы атомов
- уменьшается число протонов в ядрах атомов
- увеличивается число электронных слоёв в атомах
- уменьшается высшая степень окисления атомов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
- природа реагирующих веществ
- температура
- концентрация реагирующих веществ
4)тип химической реакции
А4. Наиболее электропроводным металлом из перечисленных является
- цинк 3) свинец
- медь 4) хром
А5. Металл, не относящийся к щёлочноземельным,
1)магний 3) стронций
2)кальций 4) барий
А6. Наиболее активно реагирует с водой
- скандий 3) калий
- магний 4) кальций
А7. Агрегатное состояние иода при нормальных условиях
- жидкое 2) твёрдое 3) газообразное
А8. Металл, с которым не взаимодействует концентрированная серная кислота,
Металл, с которым не взаимодействует концентрированная серная кислота,
1)железо 2)магний 3)цинк 4)натрий
Часть В. Тестовые задания на соответствие.
В1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Реагирующие Продукты их
вещества взаимодействия
А) Cu +Cl2 1) Cu(OH)2 и Cl2
Б) CuО + HCl 2) CuCl
В) Cu 2О + HCl 3) CuCl2 и h3O
4) CuCl2
5) CuCl и h3O
В2. Установите соответствие между типами и уравнениями химических реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) соединения, ОВР, необратимая
Б) разложения, ОВР, эндотермическая
В) соединения, ОВР, гомогенная
УРАВНЕНИЯ РЕАКЦИЙ
- N2(г) + 3h3(г) ↔ 2Nh4(г) + Q
- 2КNO3 = 2KNO2 + O2 +Q
- FeO + C → Fe + CO -Q
- 4Fe + 3O2 + 6h3O = 4Fe(OH)3
- 2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения Zn → ZnCl2 → Zn(OH)2 → ZnO
Для перехода 2 запишите ионное уравнение.
С2. . К 34,8г сульфата калия прилили раствор, содержащий 83,2 г хлорида бария. Определите массу образовавшегося осадка. (5б).
С3.Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu +HNO3→Cu(NO3)2+NO +h3O.
Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс».
Вариант № 1
А1. Распределение электронов по энергетическим уровням 2е, 8е, 6е соответствует атому
- углерода 3) фосфора
- серы 4) хлора
А2. В ряду элементов С –N — О — F
- уменьшается высшая степень окисления элементов в соединениях
- увеличиваются радиусы атомов
- уменьшается восстановительная способность простых веществ
- увеличивается высшая степень окисления элементов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
Фактор, не влияющий на скорость химических реакций,
- катализатор
- способ получения реагентов
- природа реагирующих веществ
- концентрация реагирующих веществ
А4. Металл, не относящийся к щелочным металлам,
- калий 3) литий
- кальций 4) натрий
А5. Свойство ртути, которое ограничивает её применение в бытовых термометрах
- агрегатное состояние
- температура плавления
- токсичность
- высокая плотность
А6. Водород нельзя получить путём взаимодействия металлов с кислотой
- азотной 3) соляной
- серной 4) фосфорной
А7. Свойство, характерное для озона,
- хорошо растворяется в воде
- не имеет запаха
- бактерициден
- легче воздуха
А8. Вода взаимодействует с каждым из веществ, формулы которых
1)Ca и Na2O 2) Na2O и Cu 3)CuO и N2O5 4)ZnO и SO2
Часть В. Тестовые задания на соответствие.
Тестовые задания на соответствие.
В2. Установите соответствие между исходными веществами и продуктами реакций.
Исходные вещества Продукты реакции
А) Na и h3O 1) Na2SO3 и h3O
Б) Na2O и h3O 2) NaOH и h3O
В ) NaOH и SO2 3) NaOH и h3
4) NaOH
В2. Установите соответствие между типами и уравнениями реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) замещения, ОВР, эндотермическая
Б) разложения, ОВР, экзотермическая
В) соединения, ОВР, необратимая
УРАВНЕНИЯ РЕАКЦИЙ
- N2(г) + 3h3(г) ↔ 2Nh4(г) + Q
- 2КNO3 = 2KNO2 + O2 +Q
- FeO + C → Fe + CO -Q
- 4Fe + 3O2 + 6h3O = 4Fe(OH)3
- 2Al + Fe2O3 = 2Fe + Al2O3 +Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения MgO→ MgCI2→Mg(OH)2→ Mg(NO3)2
Для перехода 3 запишите ионное уравнение.
С2. К раствору, содержащему 63,9г нитрата алюминия, прилили раствор, содержащий 39,2г фосфорной кислоты. Определите массу фосфата алюминия.
С3. Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu + HNO3→ Cu(NO3)2 + NO2 + h3O
Рекомендации по оцениванию работы
Максимальное количество баллов – 21 балла
Задания базового уровня (А1-А8), только один правильный ответ. (1 балл)
Задания повышенного уровня (В1-В2), найти соответствие. ( 2 балла)
Задание С1, С2, С3 — требуют полного ответа. ( 3 балла)
Ответы: Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс». контрольная работа по химии
за курс «Химия. 9 класс».
Вариант 1. Часть А.
Часть В.
Часть С. 1.
2. Задача 34,8г 83,2г х К2SO4 + BaCl2 → BaSO4 + 2KCl 1*174г 1*208г 1*233
Х = 0,2*233 = 46,6г
| Вариант 2 Часть А.
Часть В.
Часть С. 1. MgO+2HCl=MgCl2+h3O MgCl2+2KOH=Mg(OH)2+2KCl Mg(OH)2+2HNO3=Mg(NO3)2+2h3O 2. Задача 63,9г 39,2г х Al(NO3)3 + h4PO4 → AlPO4 + 3HNO3 1*213г 1*98г 1*122г
Х = 0,3*122 = 36,6г 3. Cu⁰+4HN⁺⁵O3(конц. |
неорганическая химия — Является ли бериллий щелочноземельным металлом?
спросил
Изменено 1 год, 3 месяца назад
Просмотрено 12 тысяч раз
$\begingroup$
Для контекста: мне задали вопрос: «Какие из следующих щелочноземельные металлы не окрашивают пламя?». Я быстро отметил $\ce{Be}$ и $\ce{Mg}$ и получил отрицательные оценки.
Далее цитата из моей книги (курсив в оригинал):
Элементы группы 2 включают бериллий, магний, кальций, стронций, барий и радий. Эти элементы, за исключением бериллия, широко известны как щелочноземельных металлов .
Они так называются, потому что их оксиды и гидроксиды имеют щелочную природу, и эти оксиды металлов находятся в земной коре.
Как видите, сказано, что бериллий не является щелочноземельным металлом!
Является ли бериллий щелочноземельным металлом или нет?
- неорганическая химия
- терминология
- щелочноземельные металлы
$\endgroup$
5
$\begingroup$
Существуют некоторые разногласия в использовании среди авторов, но стандартная номенклатура ИЮПАК одобряет название бериллия щелочноземельный металл , как объяснено на странице 51 последней Красной книги ИЮПАК .
На самом деле, все элементы, принадлежащие к группе 2, $\ce{Be,Mg,Ca,Sr,Ba,Ra}$, называются щелочноземельными металлами с одобрения IUPAC.
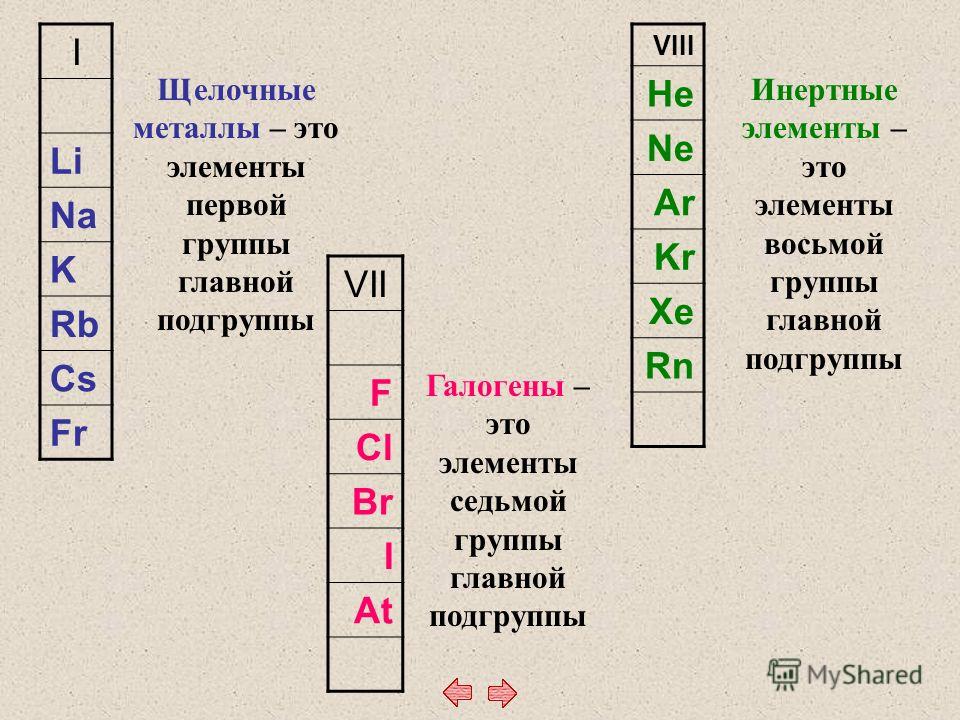
Другими распространенными традиционными названиями, утвержденными IUPAC, являются щелочных металлов для элементов группы 1, кроме водорода, т.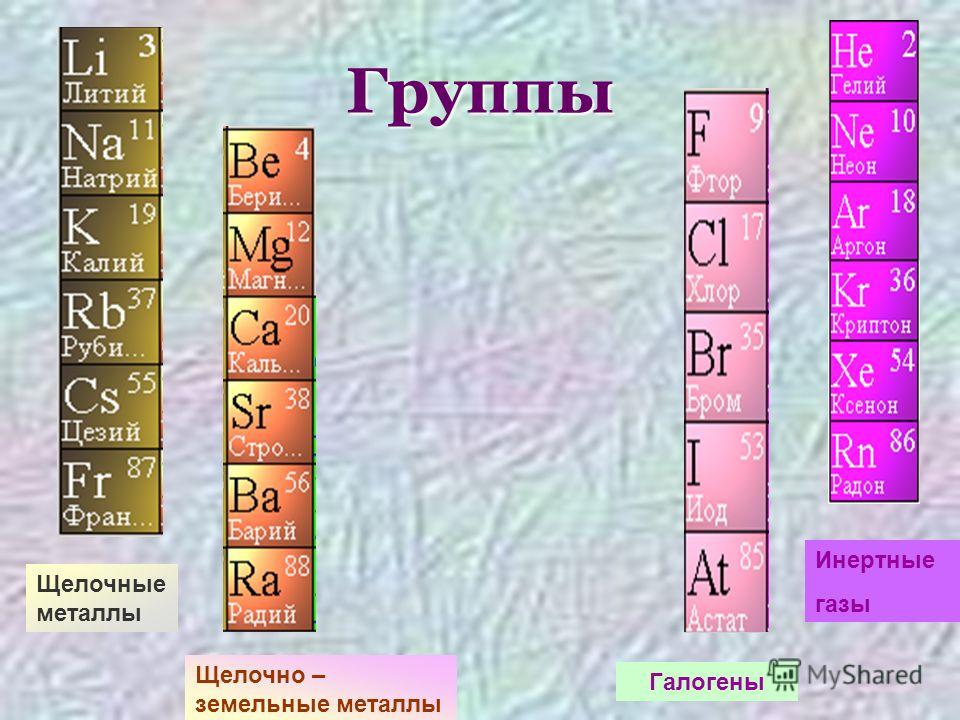 е. $\ce{Li,Na,K,Rb,Cs,Fr}$; галогенов для $\ce{F,Cl,Br,I,At}$ в группе 17, единственный член которой исключен из такого обозначения $\ce{Uus}$ (теперь $\ce{Ts}$), и благородных газов для всех элементов группы 18, кроме $\ce{Uuo}$ (сейчас $\ce{Og}$), т.е. $\ce{He,Ne,Ar,Kr,Xe,Rn}$.
е. $\ce{Li,Na,K,Rb,Cs,Fr}$; галогенов для $\ce{F,Cl,Br,I,At}$ в группе 17, единственный член которой исключен из такого обозначения $\ce{Uus}$ (теперь $\ce{Ts}$), и благородных газов для всех элементов группы 18, кроме $\ce{Uuo}$ (сейчас $\ce{Og}$), т.е. $\ce{He,Ne,Ar,Kr,Xe,Rn}$.
$\endgroup$
$\begingroup$
Если мы будем придираться к тому, что щелочноземельные металлы являются «щелочноземельными» в собственном смысле, то их всего два: кальций и магний. Оксид бериллия не может быть щелочным, а более тяжелые оксиды группы 2 (или гидроксиды, образующиеся при реакции с водой) слишком легко растворимы, чтобы действительно быть «землями».
По сравнению с другими металлами группы 2, кальций и магний настолько распространены, что фактически (без каламбура) являются тезками всей группы. Таким образом, как утверждает ИЮПАК, фраза «щелочноземельные металлы» распространилась на всю группу 2.
$\endgroup$
$\begingroup$
Щелочные металлы называются так по двум причинам:
Их получают из земли в виде руд
Их оксиды и гидроксиды имеют основную (щелочную) природу.
Бериллий соответствует первому критерию, но не второму, поскольку его оксиды и гидроксиды проявляют амфотерное поведение, а не щелочное. Таким образом, он не считается щелочноземельным металлом в истинном смысле, хотя и напоминает их по другим свойствам.
Итак, если спросить, какой металл группы 2 не считается щелочноземельным металлом, то ваш ответ должен быть бериллий. В противном случае вам, вероятно, следует рассматривать бериллий как щелочноземельный металл.
$\endgroup$
1
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Элементы обычно можно описать как металлы или неметаллы. Металлические элементы обычно являются хорошими проводниками как электричества, так и тепла. Разделительная линия между металлами и неметаллами не является жесткой и быстрой, поэтому различие между «постпереходными металлами» и «металлоидами» представлено по-разному в разных версиях Периодической таблицы. Например, в некоторых таблицах группа 12 отнесена к категории постпереходных металлов, а в другие включены алюминий и олово, которые характеризуются как металлоиды или плохие металлы. В нашей версии таблицы мы выбрали наиболее общепринятые границы между этими элементами.
- Щелочные металлы. Щелочные металлы составляют группу 1 Таблицы и включают Li до Fr. У них очень похожее поведение и характеристики. Водород относится к группе 1, но обладает некоторыми характеристиками металла и часто относится к категории неметаллов.

- Металлы щелочноземельные. Щелочноземельные металлы составляют группу 2 периодической таблицы, от Be до Ra. Щелочноземельные металлы имеют очень высокие температуры плавления и оксиды, которые имеют основные щелочные растворы. Их характеристики хорошо описаны и соответствуют группе.
- Переходные металлы. Переходные элементы представляют собой металлы с частично заполненной подоболочкой d (Справочник CRC по химии и физике) и включают группы с 3 по 12, а также лантаниды и актиниды (см. ниже).
- Постпереходные металлы. Постпереходными элементами являются Al, Ga, In, Tl, Sn, Pb и Bi. Как следует из их названия, они обладают некоторыми характеристиками переходных элементов. Они, как правило, мягче и хуже проводят ток, чем переходные металлы.
- Металлоид (или «полуметалл» или «плохой металл»). Металлоиды: B, Si, Ge, As, Sb, Te, Po. Иногда они ведут себя как полупроводники (B, Si, Ge), а не как проводники.

- Лантаниды. Лантаниды включают элементы с 57 (лантан, отсюда и название группы) по 71. Они сгруппированы вместе, потому что имеют сходные химические свойства. Их, наряду с актинидами, часто называют «f-элементами», потому что они имеют валентные электроны в 9Корпус 0020 ф .
- Актиниды. Актиниды включают элементы с 89 по 103. Их, наряду с лантаноидами, часто называют «f-элементами», потому что они имеют валентные электроны в оболочке f . Только торий и уран являются природными актинидами в значительном количестве. Все они радиоактивны.
- Неметаллы. Термин «неметаллы» используется для классификации элементов H, C, N, P, O, S и Se.
- Галогены. Галогенные элементы являются подмножеством неметаллов. Они составляют группу 17 периодической таблицы, от F до At. Как правило, они очень химически активны и присутствуют в окружающей среде в виде соединений, а не в виде чистых элементов.










 )=Cu⁺²(NO3)2+2N⁺⁴O2+2h3O
)=Cu⁺²(NO3)2+2N⁺⁴O2+2h3O Они так называются, потому что их оксиды и гидроксиды имеют щелочную природу, и эти оксиды металлов находятся в земной коре.
Они так называются, потому что их оксиды и гидроксиды имеют щелочную природу, и эти оксиды металлов находятся в земной коре.