Реакция магния и азота
Химические реакции
Виктор Потехин
Реакция взаимодействия магния и азота.
Уравнение реакции взаимодействия магния и азота:
Магний взаимодействует с азотом.
3Mg + N2 → Mg3N2 (t = 780-800 °C).
Реакция магния и азота протекает при условии: при температуре 780-800 °C.
В результате реакции магния и азота образуется нитрид магния.
Все химические реакции.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности 721
- ← Гликоген, вещество, синтез и расщепление
- Реакция алюминия с азотом →
Мировая экономика
Нефть Brent и WTI
USD/JPY
USD/AUD
USD/CHF
USD/GBP
USD/CAD
Серебро
Палладий
Золото
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг.

- Экономика Второй индустриализации России (103 751)
- Этилен (этен), получение, свойства, химические реакции (30 510)
- Программа искусственного интеллекта ЭЛИС (30 411)
- Метан, получение, свойства, химические реакции (27 294)
- Крахмал, свойства, получение и применение (27 025)
- Природный газ, свойства, химический состав, добыча и применение (25 958)
- Целлюлоза, свойства, получение и применение (25 649)
- Пропилен (пропен), получение, свойства, химические реакции (24 355)
- Прямоугольный треугольник, свойства, признаки и формулы (24 309)
Еще технологии
Поиск технологий
Выберите отрасль экономики или все отраслиПоиск по всем отраслямБиотехнологииВодоснабжение и водоотведениеДобыча, обработка и переработка полезных ископаемыхЗдравоохранениеИнформация и связьЛегкая промышленностьЛесная и деревообрабатывающая промышленностьНаноиндустрияНефтехимическая промышленностьОбразование.
Поиск технологий
Финансирование:Технологии ожидают финансирования
В процессе разработки:Технологии в процессе разработки
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.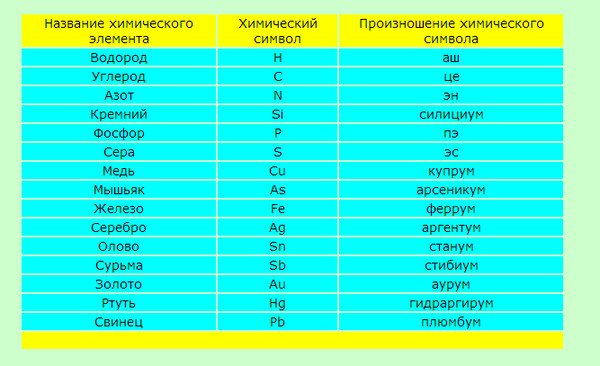
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Может быть интересно:
Магний, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t° пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл
=1495°Ct°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Для чего растениям нужен магний. Листовые подкормки магнием.
Для чего растениям нужен магний. Листовые подкормки магнием.
Сентябрь 21, 2021 1032 от admin в Статьи
Главной задачей магния является активация ферментов, особенно тех, которые участвуют в углеводном и белковом обмене внутри растения, расходуя при этом большое количество магния поступающего в растение.
Пример: Растение усвоило углекислый газ при помощи фермента, который активизирует магний, после этого углекислый газ и вода преобразовались до углеводов с помощью Аденозинтрифосфорной кислоты и того же магния, после чего эти углеводы магний забирает и спускает в сосудистую систему растений, затем перенаправляет их в корневую систему. Так как углеводы это питание для корней растений, то они активно начинают расти, потреблять больше влаги, больше элементов питания, как из почвы, так и из минеральных удобрений.
А что будет происходить, когда растению не хватает мания? Фотосинтез будет вырабатывать сахара, которые будут перенаправляться в корневую систему, что будет тормозить развитие корневой системы, соответственно в надземную часть растения меньше поступает влаги и элементов питания.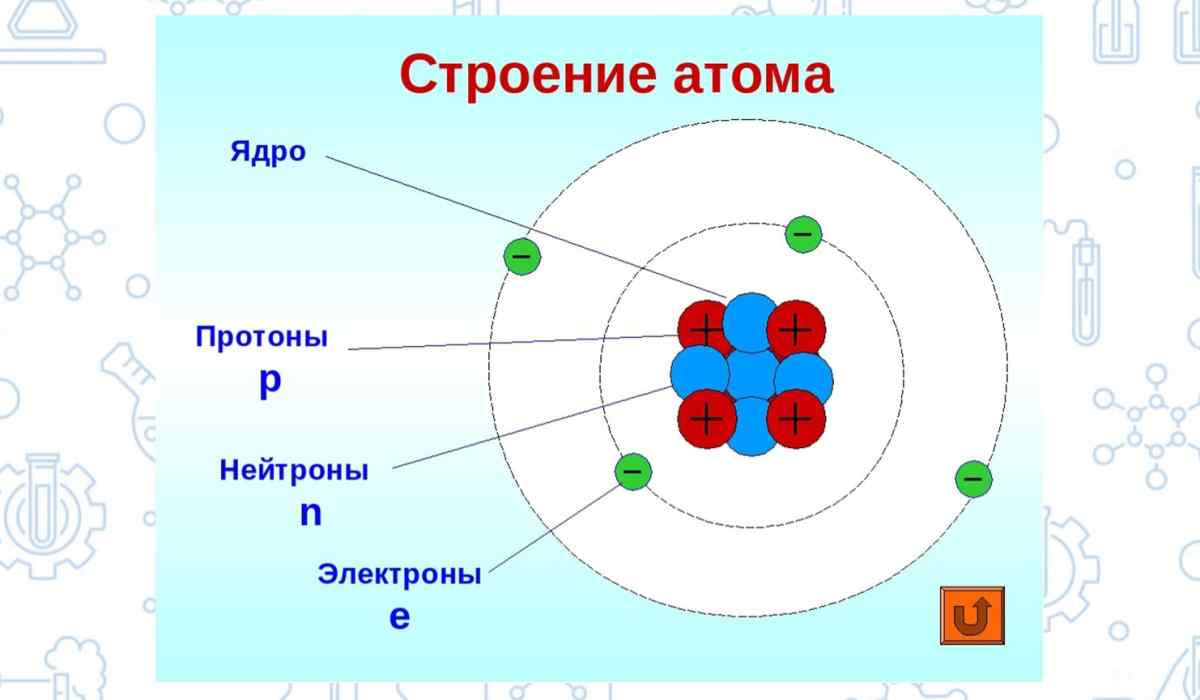 Так же при накоплении в надземной части растения сахаров будет ухудшаться процесс фотосинтеза, так как растению уже не надо столько сахаров и соответственно растение переходит примерно через 10-15 дней в состояние стресса.
Так же при накоплении в надземной части растения сахаров будет ухудшаться процесс фотосинтеза, так как растению уже не надо столько сахаров и соответственно растение переходит примерно через 10-15 дней в состояние стресса.
Как магний влияет на засухоустойчивость?
Во время засухи из корневой системы меньше поступает влаги и элементов питания, в том числе и магния. Если до наступления засухи растению не хватало магния, то засушливый период из проблемы превращается в катастрофу для растения.
Как сильно недостаток магния влияет на устойчивость растения к засухе? В засушливый период растение активно вырабатывает так называемый гормон старости, по-научному – этилен. Этилен вырабатывается у растения в стрессовой ситуации, при созревании плодов и в процессе старения листьев. Чем меньше в растении содержится магния, тем больше вырабатывается этилена, из-за чего при нехватке магния растение больше испытывает стресс.
Обычно засуха характеризуется высокой температурой и безоблачной погодой. Из-за этого растениям приходится переходить на энергосберегающий режим, но при этом хлорофилл продолжает вырабатывать энергию, которая не нужна растению, из-за этого разрушаются такие питательные вещества как: углеводы, белки, нуклеиновые кислоты. Это проявляется в ожогах листьев, вплоть до того, что растение погибает. Растения борются с этой проблемой с помощью специальной системы ферментов антиоксидантов, при работе этой системы активно участвует магний. Во время засухи, лучше всего в качестве дополнительного питания растения магнием будут листовые подкормки, содержащие этот элемент питания. Магний способствует улучшению работы растения в безоблачную погоду, мгновенно проникая через листву.
Из-за этого растениям приходится переходить на энергосберегающий режим, но при этом хлорофилл продолжает вырабатывать энергию, которая не нужна растению, из-за этого разрушаются такие питательные вещества как: углеводы, белки, нуклеиновые кислоты. Это проявляется в ожогах листьев, вплоть до того, что растение погибает. Растения борются с этой проблемой с помощью специальной системы ферментов антиоксидантов, при работе этой системы активно участвует магний. Во время засухи, лучше всего в качестве дополнительного питания растения магнием будут листовые подкормки, содержащие этот элемент питания. Магний способствует улучшению работы растения в безоблачную погоду, мгновенно проникая через листву.
Влияние магния на эффективность усвоения фосфора и азота в растении.
Магний благоприятно влияет на рост корней растений, тем самым улучшая усвоение азота и других элементов питания из почвы. Магний так же активнейшим образом будет участвовать в синтезе и транспортировке белков и аминокислот в растении, то есть магний будет влиять на скорость переваримости азота внутри растения. Чем быстрее магний будет переваривать азот, тем соответственно быстрее будет снабжаться надземная часть растения еще большим количеством азота.
Чем быстрее магний будет переваривать азот, тем соответственно быстрее будет снабжаться надземная часть растения еще большим количеством азота.
Взаимодействие между собой магния и фосфора.
В почве магний и фосфор образуют между собой соединение, которое не доступно для растений, то есть в почве они очень жесткие антагонисты, но внутри растения у них очень тесная связь. Магний участвует в перемещении фосфатов из корней растения в надземную часть, после этого магний эти фосфаты встраивает в органические соединения клетки растения, так же магний способствует транспортировке энергии АТФ внутри растения.
Магний с фосфором сотрудничают в семенах, в составе фитина именно магний и фосфор, а фитин нужен растению для прорастания семян, в качестве источника фосфора и магния. При нехватке в растении магния, азот и фосфор будут через корневую систему поступать в меньшей степени, что в конечном итоге очень сильно повлияет на конечный урожай. Это лишь малая доля функций выполняемых магнием в нутрии растения, он активизирует работу более трех ста ферментов внутри растения.
Каким образом вносятся минеральные удобрения, в состав которых входит магний?
В почве содержатся 2% соединения магния, но из них доступны всего от двух до восьми процентов. Минимальное количество магния содержится в легких песчаных почвах, потому что магнию там негде закрепиться, так же магния мало в кислых почвах с низким водородным показателем, потому что ионы магния начинают конкурировать с ионами алюминия и железа в таком грунте. Если говорить о щелочных почвах, где водородный показатель больше 7,5, магний уже будет в почве соперничать с кальцием. В грунте у магния большое количество антагонистов, таких как: фосфор, калий, аммонийный азот, кальций.
Магний хорошо взаимодействует только с нитратным азотом. На степень усвоения магния так же оказывает влияние засуха либо же наоборот обильные осадки. Поэтому лучшим решением, по мнению агрономов, будут листовые подкормки. Лучше всего листовые подкормки производить с использованием семи водного сульфата магния, который хорошо растворяется в воде и содержит в себе 17% магния и 13% серы. Концентрация рабочего раствора подбирается в зависимости от культуры и от содержания магния в почве и варьируется от одного до пяти процентов. Также обработка у озимых культур сульфатом магния будет обязательным условием, так как магний оказывает влияние на степень повышения сахаров как в узле кущения у зерновых культур, так и в соке корневой шейки у озимого рапса.
Концентрация рабочего раствора подбирается в зависимости от культуры и от содержания магния в почве и варьируется от одного до пяти процентов. Также обработка у озимых культур сульфатом магния будет обязательным условием, так как магний оказывает влияние на степень повышения сахаров как в узле кущения у зерновых культур, так и в соке корневой шейки у озимого рапса.
Макроэлементы | справочник Пестициды.ru
Показать все
Содержание:
- Физические и химические свойства
- Содержание макроэлементов в природе
- Роль в растении
- Биохимические функции
- Из атмосферы
- Следующими по значимости
- Следующие макроэлементы
- Недостаток (дефицит) макроэлементов в растениях
- Избыток макроэлементов в растениях
- Содержание макроэлементов в различных соединениях
- Азотные удобрения
- Фосфорные удобрения
- Калийные удобрения
- Магниевые удобрения
- Серосодержащие удобрения
- Железосодержащие удобрения
- Известковые удобрения
- Содержание макроэлементов в органических удобрениях
- Свежий навоз на соломенной подстилке
- Полупревший подстилочный навоз
- Подстилочный птичий помет
- Навозная жижа
- Способы и сроки внесения минеральных удобрений
- Калийные и фосфорные удобрения
- Фосфоритная мука, фосфатшлаки
- Эффект от применения минеральных удобрений
- Азотная подкормка озимой пшеницы в период колошения
- Фосфорные и калийные удобрения
Элементы
Макроэлементы принимают непосредственное участие в построении органических и неорганических соединений растения, составляя основную массу его сухого вещества. Большей частью они представлены в клетках ионами.
Большей частью они представлены в клетках ионами.
Макроэлементы и их соединения являются действующими веществами различных минеральных удобрений. В зависимости от вида и формы, они применяются в качестве основного, припосевного удобрения и подкормки. К макроэлементам относятся: углерод, водород, кислород, азот, фосфор, калий, кальций, магний, сера и некоторые другие, однако основными элементами питания растений являются азот, фосфор и калий.
В теле взрослого человека содержится порядка 4 граммов железа, 100 г натрия, 140 г калия, 700 г фосфора и 1 кг кальция. Несмотря на такие разные цифры, вывод очевиден: вещества, объединенные под названием «макроэлементы», жизненно необходимы нам для существования.[8] Большую потребность в них испытывают и другие организмы: прокариоты, растения, животные.
Сторонники эволюционного учения утверждают, что необходимость в макроэлементах определяется условиями, в которых зародилась жизнь на Земле. Когда суша состояла из твердых пород, атмосфера была насыщенна углекислотой, азотом, метаном и водяными парами, а вместо дождя на землю выпадали растворы кислот, именно макроэлементы были единственной матрицей, на основе которых могли появиться первые органические вещества и примитивные формы жизни. Поэтому даже сейчас, миллиарды лет спустя, все живое на нашей планете продолжает испытывать необходимость в обновлении внутренних ресурсов магния, серы, азота и других важных элементов, образующих физическую структуру биологических объектов.
Поэтому даже сейчас, миллиарды лет спустя, все живое на нашей планете продолжает испытывать необходимость в обновлении внутренних ресурсов магния, серы, азота и других важных элементов, образующих физическую структуру биологических объектов.
Физические и химические свойства
Макроэлементы различны как по химическим, так и по физическим свойствам. Среди них выделяются металлы (калий, кальций, магний и прочие) и неметаллы (фосфор, сера, азот и прочие).
Некоторые физические и химические свойства макроэлементов, согласно данным:[2] | |||||||
Макроэлемент | Атомный номер | Атомная масса | Группа | Cвойства | Т. кип, °C | Т. плавл, °C | Физическое состояние при нормальны условиях |
Азот (N) | 7 | 14,0 | V | неметалл | 195,8 | 210,00 | бесцветный газ |
Фосфор (P) (белый фосфор) | 15 | 30,97 | V | неметалл | 44,1 | 257 | твердое вещество |
Калий (K) | 19 | 39,1 | I | металл | 771 | 63,5 | металл серебристо-белого цвета |
Кальций (Ca) | 20 | 40,8 | II | металл | 1495 | 842 | твердый белый металл |
Магний (Mg) | 12 | 24,31 | II | металл | 1095 | 650 | металл серебристо-белого цвета |
Сера (S) | 16 | 3,07 | VI | неметалл | 444, 6 | 112,8 | хрупкие кристаллы желтого цвета |
Железо (Fe) | 26 | 55,85 | VIII | металл | 1539 | 2870 | металл серебристого цвета |
Содержание макроэлементов в природе
Макроэлементы содержатся в природе повсеместно: в почве, горных породах, растениях, живых организмах. Некоторые из них, такие, как азот, кислород и углерод, являются составными элементами земной атмосферы.
Некоторые из них, такие, как азот, кислород и углерод, являются составными элементами земной атмосферы.
Симптомы недостатка некоторых элементов питания у сельскохозяйственных культур, согласно данным:[6] | ||
Элемент | Общие симптомы | Чувствительные культуры |
Азот | Изменение зеленой окраски листьев на бледно-зеленую, желтоватую и бурую, Уменьшается размер листьев, Листья узкие и расположены под острым углом к стеблю, Число плодов (семян, зерен) резко уменьшается | Картофель, Капуста белокочанная и цветная, Томаты, Репчатый лук, Огурцы, Свекла, Земляника, Черная смородина, Яблоня |
Фосфор | Скручивание краев листовой пластинки, Образование фиолетовой окраски | Картофель, Капуста, Томаты, Свекла, Лук, Земляника, Малина, Красная смородина, Яблоня |
Калий | Краевой ожог листьев, Вялость листьев, Свисание листьев, Полегание растений, Нарушение цветения, Нарушение плодоношения | Картофель, Томаты, Свекла, Морковь, Лук, Огурцы, Земляника, Малина, Черная смородина, Яблоня |
Кальций | Побеление верхушечной почки, Побеление молодых листьев, Кончики листьев загнуты вниз, Края листьев закручиваются вверх | Картофель, Томаты, Капуста белокочанная и цветная, Яблоня |
Магний | Хлороз листьев | Картофель, Капуста белокочанная и цветная, Томаты, Огурцы, Лук, Свекла, Малина, Черная смородина, Вишня, Яблоня |
Сера | Изменение интенсивности зеленой окраски листьев, Стебли – деревянистые, Замедление роста, Низкое содержание белков | Томаты, Огурцы, Подсолнечник, Бобовые, Горчица, Капуста |
Железо | Окраска листьев меняется до белой, Хлороз листьев
| Плодовые, Люпин, Картофель, Кукуруза, Капуста, Томаты |
- Азот в связанном состоянии присутствует в водах рек, океанов, литосфере, атмосфере.
 Большая часть азота в атмосфере содержится в свободном состоянии. Без азота невозможно формирование белковых молекул.[2]
Большая часть азота в атмосфере содержится в свободном состоянии. Без азота невозможно формирование белковых молекул.[2] - Фосфор легко окисляется и в этой связи в чистом виде в природе не обнаруживается. Однако в соединениях встречается практически повсеместно. Является важной составляющей белков растительного и животного происхождения.[2]
- Калий присутствует в почве в виде солей. В растениях откладывается в основном в стеблях.[2]
- Магний распространен повсеместно. В массивных горных породах содержится в виде алюминатов. В почве есть сульфаты, карбонаты и хлориды, но преобладают силикаты. В виде иона содержится в морской воде.[1]
- Кальций – один из самых распространенных в природе элементов. Его отложения можно встретить в виде мела, известняка, мрамора. В растительных организмах обнаруживается в виде фосфатов, сульфатов, карбонатов.[4]
- Сера в природе очень широко распространена: как в свободном состоянии, так и в виде различных соединений.
 Обнаруживается и в горных породах, и в живых организмах.[1]
Обнаруживается и в горных породах, и в живых организмах.[1] - Железо – один из самых распространенных металлов на Земле, однако в свободном состоянии встречается только в метеоритах. В минералах земного происхождения железо присутствует в сульфидах, оксидах, силикатах и многих других соединениях.[2]
Роль в растении
Биохимические функции
Высокий урожай любой сельскохозяйственной культуры возможен только при условии полноценного и достаточного питания. Кроме света, тепла и воды, растениям необходимы питательные вещества. В состав растительных организмов входит более 70 химических элементов, из них 16 абсолютно необходимых – это органогены (углерод, водород, азот, кислород), зольные микроэлементы (фосфор, калий, кальций, магний, сера), а также железо и марганец.
Каждый элемент выполняет в растениях свои функции, и заменить один элемент другим совершенно невозможно.
в растения в основном поступают кислород, углерод и водород. На их долю приходится 93,5 % сухой массы, в том числе, на углерод – 45 %, на кислород – 42 %, на водород – 6,5 %.[7]
На их долю приходится 93,5 % сухой массы, в том числе, на углерод – 45 %, на кислород – 42 %, на водород – 6,5 %.[7]
- Углерод поглощается из воздуха листьями растений и немного корнями из почвы в виде двуокиси углерода (CO2). Является основой состава всех органических соединений: жиров, белков, углеводов и прочих.
- Водород потребляется в составе воды, крайне необходим для синтеза органических веществ.
- Кислород поглощается листьями из воздуха, корнями из почвы, а также выделяется из состава других соединений. Необходим как для дыхания, так и для синтеза органических соединений.[7]
для растений элементами являются азот, фосфор и калий:
- Азот – важнейший элемент для развития растений, а именно, для образования белковых веществ. Его содержание в белках варьирует от 15 до 19 %. Он входит в состав хлорофилла, а значит, участвует в фотосинтезе.
 Азот обнаруживается в ферментах – катализаторах различных процессов в организмах.[7]
Азот обнаруживается в ферментах – катализаторах различных процессов в организмах.[7] - Фосфор присутствует в составе ядер клеток, ферментов, фитина, витаминов и прочих не менее важных соединений. Участвует в процессах преобразования углеводов и азотосодержащих веществ. В растениях он содержится как в органической, так и в минеральной форме. Минеральные соединения – соли ортофосфорной кислоты – применяются при синтезе углеводов. Растения используют и органические фосфорные соединения (гексофосфаты, фосфатиды, нуклеопротеиды, сахарофосфаты, фитин).[7]
- Калий играет важную роль в белковом и углеводном обмене, усиливает эффект от использования азота из аммиачных форм. Питание калием – мощный фактор развития отдельных органов растений. Этот элемент благоприятствует накоплению сахара в клеточном соке, что повышает устойчивость растений к неблагоприятным природным факторам в зимний период, способствует развитию сосудистых пучков и утолщает клетки.
 [7]
[7]
не менее важны для успешной жизнедеятельности растений. Их баланс влияет на множество важнейших процессов растения:
- Сера входит в состав аминокислот – цистеина и метионина, играет важную роль как в белковом обмене, так и в окислительно-восстановительных процессах. Положительно влияет на образование хлорофилла, способствует образованию клубеньков на корневой части бобовых растений, а также клубеньковых бактерий, усваивающих азот из атмосферы.[7]
- Кальций – участник углеводного и белкового обмена, оказывает положительное влияние на рост корней. Остро необходим для нормального питания растений. Известкование кислых почв кальцием обеспечивает повышение плодородия почвы.[7]
- Магний участвует в фотосинтезе, его содержание в хлорофилле достигает 10 % от его общего содержания в зеленых частях растений. Потребность в магнии у растений неодинакова.
 [7]
[7] - Железо в состав хлорофилла не входит, однако участвует в окислительно-восстановительных процессах, крайне важных для образования хлорофилла. Играет большую роль в дыхании, поскольку является составной частью дыхательных ферментов. Оно необходимо как зеленым растениям, так и бесхлорофильным организмам.[7]
Недостаток (дефицит) макроэлементов в растениях
О дефиците того или иного макроэлемента в почве, а следовательно, и в растении отчетливо свидетельствуют внешние признаки. Чувствительность каждого вида растений к недостатку макроэлементов строго индивидуальна, однако имеются и некоторые схожие признаки. Например, при недостатке азота, фосфора, калия и магния страдают старые листья нижних ярусов, при нехватке кальция, серы и железа – молодые органы, свежие листья и точка роста.
Особенно отчетливо недостаток питания проявляется у высокоурожайных культур.
Избыток макроэлементов в растениях
На состояние растений влияет не только недостаток, но и избыток макроэлементов. Он проявляется, прежде всего, в старых органах, и задерживает рост растений. Часто признаки недостатка и избытка одних и тех же элементов бывают несколько схожи.[6]
Он проявляется, прежде всего, в старых органах, и задерживает рост растений. Часто признаки недостатка и избытка одних и тех же элементов бывают несколько схожи.[6]
Симптомы избытка макроэлементов в растениях, согласно данным:[6] | |
Элемент | Симптомы |
Азот | Подавляется рост растений в молодом возрасте Во взрослом – бурное развитие вегетативной массы Снижается урожайность, вкусовые качества и лежкость плодов и овощей Затягивается рост и созревание Снижается устойчивость к грибным заболеваниям Повышается концентрация нитратов Хлороз развивается на краях листьев и распространяется между жилками Коричневый некроз Концы листьев свертываются Листья опадают |
Фосфор | Листья желтеют На концах и краях более старые листья становятся желтоватыми или коричневыми Появляются яркие некротические пятна Раннее опадение листьев |
Калий | Неравномерность созревания Полегание Снижение сопротивляемости грибковым заболеваниям Снижение устойчивости к неблагоприятным климатическим условиям Ткань не некротическая Слабый рост Удлинение междоузлий На листьях пятна Листья вянут и опадают |
Кальций | Межжилковый хлороз с беловатыми некротическими пятнами Пятна окрашены либо имеют наполненные водой концентрические кольца Рост листовых розеток Отмирание побегов Опадание листьев |
Магний | Листья темнеют Листья немного уменьшаются Сморщивание молодых листьев Концы листьев втянуты и отмирают |
Сера | Снижается урожай Общее огрубение растений |
Железо | Ткань не некротическая Хлороз развивается между жилками молодых листьев Жилки зеленые, позднее весь лист – желтый и беловатый |
Содержание макроэлементов в различных соединениях
Азотные удобрения
Рекомендуются к применению на достаточно увлажненных дерново-подзолистых, серых лесных почвах, а также на выщелоченных черноземах. Они способны обеспечить до половины от общей прибавки урожая, получаемой от полной минеральной подкормки (NPK).
Они способны обеспечить до половины от общей прибавки урожая, получаемой от полной минеральной подкормки (NPK).
Однокомпонентные азотные удобрения делят на несколько групп:
- Нитратные удобрения. Это соли азотной кислоты и селитры. Азот содержится в них в нитратной форме.
- Аммонийные и аммиачные удобрения: выпускают твердые и жидкие. Содержат азот в аммонийной и, соответственно, аммиачной форме.
- Аммонийно-нитратные удобрения. Это азот в аммонийной и нитратной форме. Пример – аммиачная селитра.
- Амидные удобрения. Азот в амидной форме. К ним относятся мочевина и карбамид.
- КАС. Это карбамид-амиачная селитра, водный раствор мочевины и аммиачной селитры.
Источник получения промышленных азотных удобрений – синтетический аммиак, образованный из молекулярного азота и воздуха.[5]
Фосфорные удобрения
Рекомендуется к применению на почвах легкого гранулометрического состава, а также на всех прочих почвах с низким содержанием подвижного фосфора.
Фосфорные удобрения делят на несколько групп:
- Содержащие фосфор в водорастворимой форме – суперфосфаты простой и двойной. Фосфор удобрений данной группы легко доступен растениям.
- Содержащие фосфор, не растворимый в воде, но растворимый в слабых кислотах (в 2%-ной лимонной) и щелочном растворе цитрата аммония. К ним относятся томасшлак, преципитат, термофосфаты и другие. Фосфор доступен растениям.
- Содержащие фосфор, не растворимый в воде и плохо растворимый в слабых кислотах. Полностью фосфор данных соединений может растворяться только в сильных кислотах. Это костяная и фосфоритная мука. Считаются наиболее труднодоступными источниками фосфора для растений.
Основные источники получения фосфорных удобрений – природные фосфорсодержащие руды (апатиты и фосфориты). Кроме того, для получения этого вида удобрений используют богатые фосфором отходы металлургической промышленности (мартеновские шлаки, томасшлак). [5]
[5]
Калийные удобрения
Применение этого вида удобрений рекомендовано на почвах с легким гранулометрическим составом, а также на торфянистых почвах с низким содержанием калия. На прочих почвах с высоким валовым запасом калия потребность в данных удобрениях возникает только при возделывании калиелюбивых культур. К ним относятся корнеплоды, клубнеплоды, силосные, овощные культуры, подсолнечник и прочие. Характерно, что эффективность калийных удобрений тем сильнее, чем выше обеспеченность растений прочими основными элементами питания.
Калийные удобрения подразделяют на:
- Местные калийсодержащие материалы. Это непромышленные калийсодержащие материалы: сырые калийные соли, кварц-глауконитовые пески, отходы алюминиевой и цементной продукции, растительная зола Однако использование этих источников неудобно. В районах с залежами калийсодержащих материалов их действие ослаблено, а дальняя транспортировка нерентабельна.
- Промышленные калийные удобрения.
 Получают в результате обработки калийных солей промышленными способами. К ним относятся хлористый калий, хлоркалий-электролит, калимагнезия, калимаг и другие.
Получают в результате обработки калийных солей промышленными способами. К ним относятся хлористый калий, хлоркалий-электролит, калимагнезия, калимаг и другие.
Источник производства калийных удобрений – природные месторождения калийных солей.[5]
Магниевые удобрения
По составу подразделяют на:
- Простые – содержат только один питательный элемент. Это магнезит и дунит.
- Сложные – содержат два и более питательных элемента. К ним относятся азотно-магниевые (аммошенит или доломит-аммиачная селитра), фосфорно-магниевые (фосфат магниевый плавленый), калийно-магниевые (калимагнезия, полигалит карналлит), бормагниевые (борат магния), известково-магниевые (доломит), содержащие азот, фосфор и магний (магний-аммонийфосфат).
Источники производства магнийсодержащих удобрений – природные соединения. Некоторые используются непосредственно как источники магния, другие перерабатываются.[4]
Симптомы недостатка и избытка фосфора
Симптомы недостатка и избытка фосфора
Симптомы недостатка и избытка фосфора у пшеницы:
1 – избыток; 2 – недостаток
Использованы изображения:[11][12]
Серосодержащие удобрения
Элементарная сера применяется незначительно, поскольку доступной растениям она становится только после перевода в сульфатную форму с помощью микроорганизмов. Процесс это достаточно долговременный. Для обогащения почв серой в основном используют простой суперфосфат, фосфогипс, гипс. Последний обычно применяется для мелиорации солонцов.[4]
Процесс это достаточно долговременный. Для обогащения почв серой в основном используют простой суперфосфат, фосфогипс, гипс. Последний обычно применяется для мелиорации солонцов.[4]
Железосодержащие удобрения
Рекомендуются к употреблению на карбонатных почвах и на почвах с высоким содержанием усвояемых фосфатов.
Соединения железа в почву не вносят, поскольку железо способно очень быстро переходить в неусвояемые растениями формы. Исключение составляют хелаты – органические соединения железа. Для обогащения железом растения опрыскивают железным купоросом, слабыми растворами хлорного и лимоннокислого железа.[4]
Известковые удобрения
Известкование почв – это один из методов химической мелиорации. Считается самым выгодным способом повышения урожайности на кислых почвах. Действующее вещество известковых удобрений – это кальций (Ca) в форме карбоната кальция (CaCO3) или оксида кальция СаО.
Известковые удобрения делятся на:
- Твердые известковые породы, которым необходимы размол и обжиг.
 Это известняки, известняки доломитизированные, доломиты.
Это известняки, известняки доломитизированные, доломиты. - Мягкие известковые породы, не требующие размола, – известковые туфы, озерная известь (гажа).
- Отходы промышленности с высоким содержанием извести – сланцевая зола, дефекационная грязь (дефекат).[4]
Навоз на соломенной подстилке –
органический источник макроэлементов
Навоз на соломенной подстилке –
органический источник макроэлементов
Использовано изображение:[9]
Содержание макроэлементов в органических удобрениях
Органические удобрения содержат значительное количество макроэлементов и являются важным средством для воспроизводства плодородия почв и роста продуктивности земледелия. Содержание макроэлементов в органических удобрениях колеблется от долей процента до нескольких процентов и зависит от многих природных факторов.
включает в состав весь спектр необходимых для жизни растения микроэлементов: азота – 0,45 – 0, 83 %, фосфора – 0,19 – 0,28 %, калия 0,50 – 0,67%, кальция 0,18 – 0,40 %, магния 0,09 – 0,18 %, серы 0,06 – 0,15% от всего объема вещества, включая воду и органику.
содержит несколько больше макроэлементов: азота – 0,5 – 0,86%, фосфора – 0,26 – 0,47 %, калия – 0,59 – 0,60%.
Торф, в зависимости от вида, содержит от 0,1 до 3,3% различных макроэлементов.
Птичий помет, особенно куриный, является важным источником макроэлементов. Их содержание в нем для различных элементов колеблется от 0,2 до 2,4 %.
, в зависимости от вида подстилки, содержит азота от 1,6 до 2,22%, фосфора от 1,4 – 2,0%, калия от 0,62 – 0,78 %.
содержит в процентном соотношении несколько меньше макроэлементов. Однако это наиболее быстродействующее удобрение из числа органических. Содержание макроэлементов и других питательных веществ в ней различно. В среднем количество азота колеблется от 0,26-0,39 %, фосфора – 0,06 – 0, 12%, а калия – 0,36 – 0,58 %.
Содержание макроэлементов в органических удобрениях, %, согласно данным:[4] | ||||||
Вид удобрения | Макроэлементы | |||||
Азот (общий) N | Фосфор, по P2O5 | Калий, по K2O | Кальций, по CaO | Магний, по MgO | Сера, по SO3 | |
Свежий навоз на соломенной подстилке | ||||||
Крупного рогатого скота | 0,45 | 0,28 | 0,50 | 0,40 | 0,11 | 0,06 |
Конский | 0,58 | 0,28 | 0,63 | 0,21 | 0,14 | 0,07 |
Овечий | 0,83 | 0,23 | 0,67 | 0,33 | 0,18 | 0,15 |
Свиной | 0,45 | 0,19 | 0,60 | 0,18 | 0,09 | 0,08 |
Торф | ||||||
Верховой | 0,8 – 1,2 | 0,06 – 0,12 |
< 0. | н.д. | н.д. | н.д. |
Переходный | 1,0 – 2,3 | 0,1 – 0,2 | 0,1 | н.д. | н.д. | н.д. |
Низинный | 2,3 – 3,3 | 0,12 – 0,5 | < 0.15 | н.д. | н.д. | н.д. |
Птичий помет | ||||||
Куриный | 1,6 | 1,5 | 0,8 | 2,4 | 0,7 | 0,4 |
Гусиный | 0,7 | 0,9 | 0,6 | 1,1 | 0,2 | 0,3 |
Утиный | 0,5 | 0,5 | 0,9 | 0,8 | 0,2 | 0,3 |
Навозная жижа | ||||||
При молочно-товарных фермах | 0,26 | 0,38 | 0,12 |
н. | н.д. | н.д. |
При свиноводческих | 0,31 | 0,36 | 0,06 | н.д. | н.д. | н.д. |
При конюшнях | 0,39 | 0,58 | 0,08 | н.д. | н.д. | н.д. |
Способы и сроки внесения минеральных удобрений
Способы и сроки внесения минеральных удобрений зависят от физико-химических свойств различных видов удобрений, а также от почвенных условий и особенностей биологии выращиваемой культуры. Способы внесения удобрений различны:
Основное внесение
органических удобрений
Основное внесение
органических удобрений
Использовано изображение:[10]
- Допосевное или основное внесение.
 Включает в себя внесение наибольшей части (70 – 80 %) общей дозы минеральных удобрений. Удобрения заделывают под вспашку в глубокие увлажненные почвенные слои. Такое внесение призвано обеспечить растения питанием на протяжении практически всего периода вегетации.[7]
Включает в себя внесение наибольшей части (70 – 80 %) общей дозы минеральных удобрений. Удобрения заделывают под вспашку в глубокие увлажненные почвенные слои. Такое внесение призвано обеспечить растения питанием на протяжении практически всего периода вегетации.[7] - Припосевное или припосадочное внесение. В данном случае удобрения вносят одновременно с посевом или посадкой. Глубина заделки – 2 – 3 см ниже уровня заделки семян или комбинированной сеялкой, в которой семена и удобрения смешаны. Удобрения вносятся рядковым или гнездовым способом. Эти способы рассчитаны на обеспечение растений питанием в самом начале их развития. Припосевное удобрение вносится в малых дозах и призвано обеспечивать растение питанием только первые 2 – 3 недели жизни.[7]
- Послепосевное внесение служит для корневой и внекорневой подкормки возделываемых культур в отдельные периоды их развития.[7]
Аммиачная селитра, карбамид, жидкие азотные удобрения, сульфат аммония, калийные и другие удобрения, содержащие питательные вещества в формах, легко доступных растениям, в районах с достаточным увлажнением вносят под яровые культуры в полной норме. Обычно это мероприятие проводят весной при предпосевной обработке почвы.
Обычно это мероприятие проводят весной при предпосевной обработке почвы.
под озимые зерновые культуры рекомендуется вносить в полной дозе осенью, под вспашку.
Азотные удобрения добавляются под озимые культуры. Первую половину вносят осенью при бороновании почвы, а вторую – ранней весной при подкормке озимых.
, содержащие питательные вещества в малорастворимой форме, рекомендуется вносить под вспашку для озимых культур и под зяблевую вспашку для яровых культур.
В лесостепных и степных районах с меньшим количеством осадков все минеральные удобрения, в частности, фосфорные и калийные, рекомендуется вносить осенью и под озимые, и под яровые культуры. В этом случае обеспечивается заделка удобрений в более глубокий почвенный слой, менее подверженный иссушению.
Минеральные удобрения вносят и в подкормку пропашных культур во время вегетации. Этот способ применяется в орошаемом земледелии, в частности, под хлопчатник. [7]
[7]
Эффект от применения минеральных удобрений
Минеральные удобрения повышают урожай сельскохозяйственных культур. Установлено, что каждый четвертый житель Земли питается продуктами, полученными при применении удобрений.
За счет применения удобрений урожай на дерново-подзолистых почвах повышается на 55 %, на серых лесных – на 28 %, а на черноземах – на 25 %.
Значение минеральных удобрений состоит также в том, что при их применении не только повышается урожайность, но и улучшается качество возделываемых культур.
ведет к повышению белка в зерне от 1 до 3 %.
увеличивают крахмалистость клубней картофеля, сахаристость корней корнеплодов, выход волокна у льна-долгунца.
Эффективность применения минеральных удобрений в Центральном районе России на дерново-подзолистых суглиныстых почвах, согласно данным:[7] | ||||
Культура | Средняя норма удобрения кг/га | Средняя прибавка урожая ц/га | ||
N | P2O5 | K2O |
| |
Озимая пшеница | 60 | 60 | 40 | 10,2 |
Озимая рожь | 60 | 60 | 40 | 8,2 |
Яровой ячмень | 60 | 60 | 40 | 11,2 |
Овес | 35 | 40 | 40 | 5,3 |
Картофель | 90 | 60 | 60 | 54 |
Лен-долгунец | 30 | 55 | 75 | 5,7 |
Капуста | 90 | 80 | 150 | 215 |
Многолетние травы | 70 | 55 | 55 | 14 |
Естественные сенокосы и пастбища | 90 | 50 | 50 | 30 |
Огромное влияние оказывают минеральные удобрения и на плодородие почвы. Они улучшают агрохимические, физические и биологические свойства почв.
Они улучшают агрохимические, физические и биологические свойства почв.
Известкование кислых почв устраняет вредное влияние кислотности, создает благоприятные условия для растений, повышает урожайность. Кроме того, известкование кислых почв снижает подвижность радиоактивных элементов, тяжелых металлов и пестицидов в почве, чем препятствует их поступлению в конечный растительный продукт.[3]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Власюк П.А. Биологические элементы в жизнедеятельности растений. Издательство «Наукова Думка», Киев, 1969
2.
Глинка Н.Л. Общая химия. Учебник для ВУЗов. Изд: Л: Химия, 1985 г, с 731
3.
Калинский А.А., Вильдфлуш И.Р., Ионас В.А. и др. – Агрохимия в вопросах и ответах – Мн.: Урожай,1991. – 240 с.: ил.
4.
Минеев В. Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., [16] л. ил.: ил. – (Классический университетский учебник).
Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., [16] л. ил.: ил. – (Классический университетский учебник).
5.
Муравин Э.А. Агрохимия. – М. КолосС, 2003.– 384 с.: ил. – (Учебники и учебные пособия для студентов средних учебных заведений).
6.
Петров Б.А., Селиверстов Н.Ф. Минеральное питание растений. Справочное пособие для студентов и огородников. Екатеринбург, 1998. 79 с.
7.
Соколовский А. А.; Унанянц Т.П. Краткий справочник по минеральным удобрениям. М., «Химия», 1977. – 376 с.
8.
Энциклопедия для детей. Том 17. Химия. / Глав. ред. В.А. Володин. – М.: Аванта +, 2000. – 640 с., ил.
Изображения (переработаны):
9.
Big Pile of Steaming Dung, by Karoly Lorentey, по лицензии CC BY
10.
Fertilization, by K.A. Barbarick, Bugwood.org, по лицензии CC BY
11.
Phosphorus deficiency in wheat, by CIMMYT, по лицензии CC BY-NC-SA
12.
Phosphorus toxicity in wheat, by CIMMYT, по лицензии CC BY-NC-SA
СвернутьСписок всех источников
Кальцийсодержащие удобрения | «Буйский химический завод»
Удобрения с кальцием широко представлены в ассортименте «Буйского химического завода», но их вид и способы применения разные. А вот цель одна – обеспечить растение «строительным» материалом.
Кальций (Са) крайне важный элемент для растений. Без кальция не возможен рост корневой системы, формирование клеточных стенок, проницаемость мембран, активность ферментов, секреция, деление клеток и прочее.
При недостатке кальция в первую очередь страдают корни. Прекращается рост боковых корней и корневых волосков. Как результат – недообеспечение растения водой и минеральным питанием. Недостаток кальция приводит к ослизнению и разрушению клеток, что приводит к разрушению клеточной ткани – гибели корней, загниванию отдельных частей стебля и листьев растений. Сначала белеют края листьев, потом они чернеют. Происходит скручивание и искривление листьев. На яблоках и других плодах, овощах появляются некротические пятна.
Недостаток кальция приводит к ослизнению и разрушению клеток, что приводит к разрушению клеточной ткани – гибели корней, загниванию отдельных частей стебля и листьев растений. Сначала белеют края листьев, потом они чернеют. Происходит скручивание и искривление листьев. На яблоках и других плодах, овощах появляются некротические пятна.
Обычно недостаток кальция наблюдается на торфяных, сильно кислых или засоленных почвах. На растениях недостаток кальция также может проявляться в результате слабого развития корневой системы или в результате неблагоприятных погодных условий.
Для начала разделим кальцийсодержащие «Буйские удобрения» по принципу их использования: удобрения основного внесения и удобрения для подкормок в виде полива или опрыскивания.
Почвенные удобрения – Мука известняковая, Добавка микроэлементная удобрительная, ФК «Осень», Суперфосфат гуминизированный, Кальций-аммиачная селитра.
Водорастворимые удобрения для подкормок – Кальциевая селитра, Хелат кальция, Аквамикс.
Напомним важный постулат – 90% минерального питания растения получают через корневую систему. Некорневые подкормки могут обеспечить лишь 10% минерального питания от необходимой нормы. Они хороши для профилактики и/или исправления ситуации в случае проявления явных признаков хлороза, недостатка того или иного элемента, которые можно определить визуально.
Сделаем расчет расхода удобрений на сотку и количество кальция (Са), вносимого с этим количеством удобрений. Для понимания приведем пример количества выносимого кальция — со средним урожаем картофеля с сотки (200-300 кг) из почвы ежегодно забирается от 0,6 до 1,2 кг кальция. Конечно, скажите вы, все почвы обладают какими-то запасами кальция и это правда. Но эти запасы не бесконечны, особенно в условиях ежегодно используемого одного и того же участка земли.
Так как данные удобрения не являются чисто кальциевыми и находятся в разных химических соединениях в сочетании с другими элементами питания, то и влияние на почву и растение они оказывают разное.
Мука известняковая– это в первую очередь почвенный мелиорант, раскислитель. Чаще всего порошок – от мелкого до крупного, в зависимости от помола руды. Продукт природного происхождения, который в основе своей содержит карбонаты кальция и магния. Мука известняковая применяется на кислых, торфяных почвах для уменьшения ее кислотности. Так как карбонаты слаборастворимые соединения, то и расход удобрения большой. Но с другой стороны длительное действие от разового применения – до 5 лет, а максимальный эффект наблюдается на 2-3-й год.
Несомненно, мука известняковая обеспечивает почву и растения кальцием в большом количестве (таблица), но он «медленный» и эффекта от применения приходится ждать долго. Для нейтральных или карбонатных почв применять муку известняковую не рекомендуется.
Добавка микроэлементная удобрительная – это удобрение в некоторой степени также можно считать почвенным мелиорантом.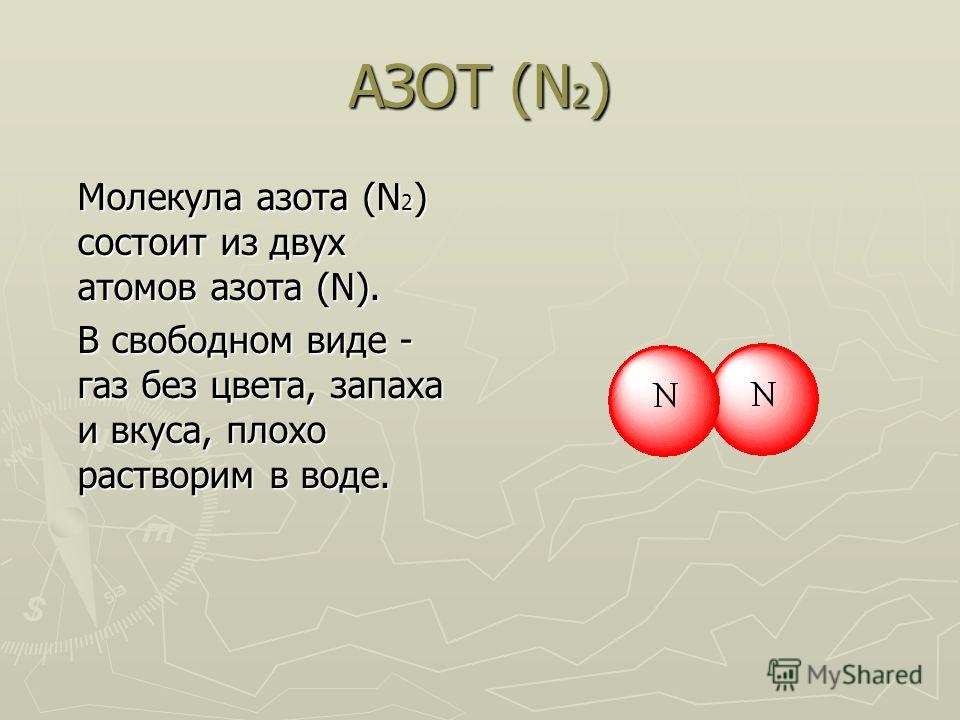 Оно содержит сульфатные, карбонатные формы кальция, магния в медленно растворимой форме. Удобрение пролонгированного действия. Кроме того, в составе есть ряд микроэлементов доступных для растений таких, как бор, железо, цинк, марганец. Гранулированная форма удобрения позволяет его мешать с другими почвенными гранулированными удобрениями, не вызывая расслоения смеси в период перевозки, хранения и обеспечить равномерное внесение смеси в почву. Использование Добавки совместно, например, с NPK удобрением позволяет сделать хорошее почвенное комплексное удобрение, которое обеспечит любую культуру всем необходимым набором элементов питания.
Оно содержит сульфатные, карбонатные формы кальция, магния в медленно растворимой форме. Удобрение пролонгированного действия. Кроме того, в составе есть ряд микроэлементов доступных для растений таких, как бор, железо, цинк, марганец. Гранулированная форма удобрения позволяет его мешать с другими почвенными гранулированными удобрениями, не вызывая расслоения смеси в период перевозки, хранения и обеспечить равномерное внесение смеси в почву. Использование Добавки совместно, например, с NPK удобрением позволяет сделать хорошее почвенное комплексное удобрение, которое обеспечит любую культуру всем необходимым набором элементов питания.
Как и в случае с Мукой известняковой, кальция в почву с Добавкой микроэлементной приходит достаточно много, но он такой же медленнодействующий. Эффект от применения наблюдается при ежегодном применении данного удобрения, а последействие до 2-3 лет. Эффективность данного удобрения будет снижаться на нейтральных почвах, а на карбонатных, скорее всего, будет не заметен.
ФК «Осень» — это фосфорно-калийное удобрение, которое дополнительно содержит в своем составе значительное количество кальция (8%) и серы (12%). Это также почвенное удобрение, медленного растворения. В виду того, что удобрение разрабатывалось для осеннего внесения в почву, то в его состав не включили азот и оно содержит около 10% хлора, что исключает возможность его применения весной в рядок или в лунку даже в смеси с азотными удобрениями, но только если при глубокой обработке почвы.
При внесении осенью в почву полной дозы удобрения мы можем рассчитывать на минимальную компенсацию кальция при выносе его из почвы картофелем, как из ранее приведенного примера. Поэтому ежегодное применение ФК «Осень» под осеннюю перекопку на нашем огороде или при подкормке многолетних насаждений осенью в дополнении с другими, например водорастворимыми кальцийсодержащими удобрениями, может обеспечивать наши растения кальцием.
Суперфосфат гуминизированный – это фосфорное удобрение, но содержит в своем составе, кроме того, азот, магний и кальций. Последний в большей степени находится в карбонатной форме, что делает его медленнодействующим элементом. Поэтому даже при таком высоком содержании кальция в продукте внесение удобрения будет осуществляться исходя из норм внесения фосфора, но в этом случае компенсации выноса кальция происходить не будет. Потребуется дополнительное использование других видов кальциевых удобрений.
Последний в большей степени находится в карбонатной форме, что делает его медленнодействующим элементом. Поэтому даже при таком высоком содержании кальция в продукте внесение удобрения будет осуществляться исходя из норм внесения фосфора, но в этом случае компенсации выноса кальция происходить не будет. Потребуется дополнительное использование других видов кальциевых удобрений.
Кальций-аммиачная селитра – азотное удобрение с небольшим содержанием кальция. Как и в случае с суперфосфатом, нормы внесения удобрения рассчитываются от азота, поэтому влияние пусть и полностью водорастворимого, «быстрого» кальция не значительно. С другой стороны, кальций-аммиачная селитра может использоваться и в полив, как водорастворимое удобрение, поэтому действие удобрения на растения быстрое и незначительное количество кальция может оказывать профилактическое, поддерживающее действие на вегетирующие растения.
Кальциевая селитра – водорастворимое удобрение с высоким содержанием нитратного азота и кальция, полностью доступного для растений. Удобрение рекомендуется в первую очередь для полива с использованием всех возможных систем, в том числе и капельного, и гидропоники, а также для некорневых подкормок опрыскиванием. Но оно может применяться и в сухом виде, как аммиачная селитра с нормой расхода 20 г/м2 или 10-20 г на погонный метр при подкормке вегетирующих растений, как овощных, так и декоративных. Как мы видим из норм прихода кальция с удобрением в почву и то, что мы можем в течение вегетации сделать несколько таких подкормок, то делаем вывод, что вполне компенсируем потребность любой культуры по кальцию. Что и происходит на практике. Кальциевая селитра – это основное и самое популярное кальциевое удобрение среди овощеводов открытого и защищенного грунта, садоводов.
Удобрение рекомендуется в первую очередь для полива с использованием всех возможных систем, в том числе и капельного, и гидропоники, а также для некорневых подкормок опрыскиванием. Но оно может применяться и в сухом виде, как аммиачная селитра с нормой расхода 20 г/м2 или 10-20 г на погонный метр при подкормке вегетирующих растений, как овощных, так и декоративных. Как мы видим из норм прихода кальция с удобрением в почву и то, что мы можем в течение вегетации сделать несколько таких подкормок, то делаем вывод, что вполне компенсируем потребность любой культуры по кальцию. Что и происходит на практике. Кальциевая селитра – это основное и самое популярное кальциевое удобрение среди овощеводов открытого и защищенного грунта, садоводов.
Хелат кальция – это новое высокотехнологичное удобрение. Соль органической кислоты (этилендиаминтетрауксусной, EDTA), которая держит в «клешне» кальций и не дает ему взаимодействовать в растворах с другими веществами, сохраняя его полностью для поглощения растением. По этой причине хелатные соединения имеют высокую практическую эффективность. В виду особенностей вещества (химического соединения) дозы внесения Хелата кальция для полива, а тем более для опрыскивания незначительны и не могут компенсировать недостаток кальция в почве в полном объеме. Но, с другой стороны, это единственное удобрение, которое содержит полностью доступный для растений кальций без «нагрузки» в виде других элементов питания. В тех случаях, когда культура «жирует», а из подходящих удобрений только кальциевая селитра с быстрым азотом, то лучшим вариантом как раз и будет Хелат кальция. Пролив удобрением или опрыскивание быстро решат острый дефицит кальция. Например, при вершинной гнили у перекормленных азотом томатов.
По этой причине хелатные соединения имеют высокую практическую эффективность. В виду особенностей вещества (химического соединения) дозы внесения Хелата кальция для полива, а тем более для опрыскивания незначительны и не могут компенсировать недостаток кальция в почве в полном объеме. Но, с другой стороны, это единственное удобрение, которое содержит полностью доступный для растений кальций без «нагрузки» в виде других элементов питания. В тех случаях, когда культура «жирует», а из подходящих удобрений только кальциевая селитра с быстрым азотом, то лучшим вариантом как раз и будет Хелат кальция. Пролив удобрением или опрыскивание быстро решат острый дефицит кальция. Например, при вершинной гнили у перекормленных азотом томатов.
Аквамикс – это комплекс микроэлементов, «скорая помощь» для растений. Бор и молибден в составе неорганических солей, а остальные – железо, цинк, медь, марганец и кальций в хелатной форме. Про эффективность кальция в этом удобрении можно сказать тоже самое, что и ранее сказанное про Хелат кальция, с той лишь разницей, что его в этом удобрении в 4 раза меньше, а нормы расхода удобрений одинаковые.
Но важной особенностью «Аквамикса» является то, что это комплекс микроэлементов и задача, которую решает данный микс более широкая, чем просто вершинная гниль или укрепление корневой системы. Микроэлементы являются регуляторами всех основных процессов в растении – от дыхания и питания, до синтеза и разложения сложных органических соединений, таких как белки, жиры и углеводы, аминокислоты и все возможные ферменты. Проводя подкормки «Аквамиксом», мы активно боремся с хлорозами, активируем все растительные процессы, «включаем» функции жизнедеятельности растения особенно в стрессовых ситуациях, вызванных техногенными причинами, погодными условиями или обработками ядохимикатов.
Среди множества различных видов «Буйских удобрений» есть группа, которая может решать проблему недостатка кальция в почве с разным эффектом по времени и усвоению. С таким набором «инструментов» легко спланировать будущие посадки и насаждения, промежуточные работы, заведомо решая вопрос по качеству выращиваемой продукции и ее количеству. Вопросы с кальциевой недостаточностью можно решать заранее почвенными удобрениями или оперативно водорастворимыми.
Вопросы с кальциевой недостаточностью можно решать заранее почвенными удобрениями или оперативно водорастворимыми.
Хороших вам урожаев!
Автор: Д. А. Белозеров, Начальник отдела маркетинга ОАО «Буйский химический завод»
Розалик Mg, Mn, S, N (Магний, Марганец, Сера, Азот), 10л., цена 200 грн
укр
рус
😍 Специально для вас
Помощь
Характеристики и описание
Розалик Mg, Mn, S, N — концентрированное азотно-магниевое удобрение с высоким содержанием марганца и серы, для обработки листовой поверхности растений и капельного орошения в интенсивных технологиях выращивания сельскохозяйственных культур.
Состав препарата: N (общего азота): 51 г/л или 3,8%; МgO (оксида магния водорастворимого): 72 г/л или 5,4%; Mn (марганца водорастворимого): 44 г/л или 3,3%; SO3 (оксида серы): 218 г/л или 16,3%.
Производитель: ROSIER S. A, Бельгия.
A, Бельгия.
Препаративная форма: Концентрат суспензии.
Тара: Пластиковые канистры 10 л.
Минимальное количество для заказа — 1 канистра (10 литров).
Преимущества препарата:
- Оптимизирует питание растения магнием и марганцем.
- Обеспечивает интенсивное образование хлорофилла.
- Способствует быстрому нарастанию листовой поверхности.
- Ускоряет накопление сухих веществ в процессе фотосинтеза.
- Способствует интенсивному нарастанию рабочей поверхности корневой системы.
- Увеличивает усвоение растениями азота и фосфора из почвы.
- Продлевает работу фотосинтетического аппарата растения.
Сфера применения удобрения:
| Культура | Фаза | Доза, л/га |
|---|---|---|
| Подсолнечник | 6-8 листков | 1,5-3 |
| Сорго | 6-8 листков | 1-2 |
| Сахарная свекла | 8-10 листков и через 10-14 дней | 2-3 |
| Соя | 4-5 тройчастых листоков | 2-3 |
| Горох | 3-5 листков | 2-3 |
| Рапс озимый | Начало стеблевания | 2-3 |
| Рапс яровой | Начало стеблевания | 2-3 |
| Пшеница яровая | Кущения | 2-4 |
| Пшеница озимая | Кущения | 2-4 |
| Ячмень озимый | Кущения | 2-4 |
| Ячмень яровой | Кущения | 2-4 |
| Виноград | После цветения та через 12-14 дней | 2-3 |
| Яблоня | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Груша | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Вишня | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Черешня | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Персик | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Абрикос | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Слива | До 4-х раз от образования завязи до начала созревания плодов | 2-3 |
| Картофель | При высоте растений15-20 см и через 10-14 дней | 2-3 |
| Помидор | 4-5 листков и через 12-14 дней | 2-3 |
| Баклажан | 4-5 листков и через 12-14 дней | 2-3 |
| Перец | 4-5 листков и через 12-14 дней | 2-3 |
| Свекла столовая | 8-10 листков и через 10-14 дней | 2-3 |
| Смородина | Начало роста листков; Через 10-14 дней; Через 10-14 дней | 2-3 |
| Чечевица | За неделю до бутонизации | 2-3 |
| Нут | 3-5 листков | 2-3 |
| Овес | Начало выхода в трубку | 2-3 |
| Рожь | Начало выхода в трубку | 2-3 |
| Вика | 3-5 листков | 2-3
|
Наивысшая эффективность использования удобрения наблюдается при внекорневой подкормке картофеля, сахарной свеклы, рапса, озимой пшеницы, плодовых деревьев при выращивании на почвах с низким содержанием доступных форм марганца и магния, а также серы.
Отзывы о продавце
Был online: Вчера
Продавец Агрохимия, семена, микроудобрения. АГРОИНКОМ+
2 года на Prom.ua
10+ заказов
- Каталог продавца
- Отзывы
3
г. Полтава. Продавец Агрохимия, семена, микроудобрения. АГРОИНКОМ+
Был online: Вчера
Код: 7595
Доставка из г. Полтава
10+ купили
200
грн/л
235
грн/л
скидка еще 13 дней
заказ от 10 л
198 — 200 грн
от 2 продавцов
Тут принимают
Тут доставляют
Доставка
Оплата и гарантии
Популярные производители в категории Микроудобрения
Минералис Украина
Киссон
Долина
Valagro
УКРАВИТ
Реаком
ЛиСт-Forte
ENZIM Agro
Unifer
Новоферт
Квадрат
Екоорганік
Quantum
У нас покупают
Инсектициды
Средства защиты растений
Удобрения
Протравители семян
Микроудобрения
Прилипатели
Полевые культуры
Десиканты
Регуляторы роста растений
Масличные культуры
Зерновые культуры
Бактерициды
Гербициды
Бактериальные удобрения
Фунгициды
Бобовые культуры
Азотные удобрения
Канистры пластиковые
Плодоовощные культуры
Комплексные удобрения
ТОП теги
Гербициды/Инсектициды/Фунгициды
Оракул мультикомплекс
Рапс растение
Минеральные удобрения royal mix
Лазурь ролакс светлый дуб
Хелатный кальций удобрение
Удобрение кальциевая селитра
Перейти в кабинет компании
Перейти в личный кабинет
Покупателям
Продавцам
Партнеры
- EVO.
 business
business - Kabanchik.ua
- Вчасно
- Crafta.ua
- Zakupki.prom.ua
- Shafa
- IZI.ua
- Туры на Rozetka Travel
- Bigl.ua
- Официальные дилеры prom.ua
- EVO.
Бета-тест© prom.ua, 2008-2022
Насколько вам
удобно на проме?
Внутренний круговорот азота, калия и магния в молодняке ели ситхинской | Физиология деревьев
Фильтр поиска панели навигации Физиология деревьевЭтот выпускНауки о растениях и лесоводствоКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Физиология деревьевЭтот выпускНауки о растениях и лесоводствоКнигиЖурналыOxford Academic Термин поиска на микросайте
Расширенный поиск
Журнальная статья
А. Уэзеролл,
Уэзеролл,
А. Уэзеролл
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
М. Ф. Про,
М. Ф. Про
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Дж. Крейг,
Дж. Крейг
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
А. Д. Кэмерон,
А. Д. Кэмерон
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Эй Джей Мидвуд
Эй Джей Мидвуд
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Физиология деревьев , том 26, выпуск 5, май 2006 г. , страницы 673–680, https://doi.org/10.1093/treephys/26.5.673
, страницы 673–680, https://doi.org/10.1093/treephys/26.5.673
Опубликовано:
01 мая 2006 г.
3 История статьи
Получено:
24 мая 2005 г.
Принято:
25 августа 2005 г.
Опубликовано:
01 мая 2006 г.
Фильтр поиска панели навигации Физиология деревьевЭтот выпускНауки о растениях и лесоводствоКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Физиология деревьевЭтот выпускНауки о растениях и лесоводствоКнигиЖурналыOxford Academic Термин поиска на микросайте
Расширенный поиск
Калий (K) и магний (Mg) являются важными макроэлементами, но мало что известно о том, как они циркулируют в растениях. Исследования стабильных изотопов показали, что внутренний круговорот азота (N) не зависит от текущего запаса питательных веществ у видов деревьев умеренного пояса. Это имеет важное экологическое значение, поскольку позволяет деревьям давать быстрый рост побегов весной независимо от текущего поглощения азота почвой. Мы использовали стабильные изотопы для количественного определения N, K и Mg в новых побегах ели ситхинской ( Picea sitchensis (Bong.) Carr.) и сравнить относительный вклад поглощения тока и внутреннего цикла. Двухлетние сеянцы ели ситкинской маркировали 15 N, 41 K и 26 Mg в обильном или ограниченном запасе на один вегетационный период. Деревья были пересажены в последующий период покоя, чтобы предотвратить дальнейшее поглощение корнями обогащенных изотопов, и обеспечены обильным или ограниченным запасом немеченых питательных веществ до сбора урожая в начале лета следующего года. Для половины деревьев на второй год подача была переключена для создания четырех режимов питательных веществ.
Исследования стабильных изотопов показали, что внутренний круговорот азота (N) не зависит от текущего запаса питательных веществ у видов деревьев умеренного пояса. Это имеет важное экологическое значение, поскольку позволяет деревьям давать быстрый рост побегов весной независимо от текущего поглощения азота почвой. Мы использовали стабильные изотопы для количественного определения N, K и Mg в новых побегах ели ситхинской ( Picea sitchensis (Bong.) Carr.) и сравнить относительный вклад поглощения тока и внутреннего цикла. Двухлетние сеянцы ели ситкинской маркировали 15 N, 41 K и 26 Mg в обильном или ограниченном запасе на один вегетационный период. Деревья были пересажены в последующий период покоя, чтобы предотвратить дальнейшее поглощение корнями обогащенных изотопов, и обеспечены обильным или ограниченным запасом немеченых питательных веществ до сбора урожая в начале лета следующего года. Для половины деревьев на второй год подача была переключена для создания четырех режимов питательных веществ. Обогащение 15 N, 41 K и 26 Mg в текущем году прирост был приписан внутреннему циклу поглощения N, K и Mg из предыдущего года. Обработка питательными веществами в первый год значительно повлияла на внутренний цикл азота, калия и магния в новых побегах. Снабжение питательными веществами на второй год повлияло на скорость роста деревьев, но не повлияло на количество азота, калия или магния, внесенных в результате внутреннего круговорота. Таким образом, внутренний круговорот K и Mg у ели ситхинской, как и N, не зависит от текущей обеспеченности питательными веществами.
Обогащение 15 N, 41 K и 26 Mg в текущем году прирост был приписан внутреннему циклу поглощения N, K и Mg из предыдущего года. Обработка питательными веществами в первый год значительно повлияла на внутренний цикл азота, калия и магния в новых побегах. Снабжение питательными веществами на второй год повлияло на скорость роста деревьев, но не повлияло на количество азота, калия или магния, внесенных в результате внутреннего круговорота. Таким образом, внутренний круговорот K и Mg у ели ситхинской, как и N, не зависит от текущей обеспеченности питательными веществами.
Этот контент доступен только в формате PDF.
© 2006 Heron Publishing—Victoria Canada
© 2006 Heron Publishing—Victoria Canada
Раздел выпуска:
Оригинальные статьи
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Последний
Самые читаемые
Самые цитируемые
Анатомическое наблюдение и транскриптомный анализ почек выявили связь между семейством генов AP2 и репродуктивной индукцией у гибридной лиственницы (Larix kaempferi × L. olgensis)
olgensis)
Эктопическая экспрессия HIOMT улучшает устойчивость и эффективность использования азота у трансгенных яблонь в условиях засушливого стресса
Воздействие болезнетворных грибов голландского вяза на фотосинтетические характеристики листвы и летучие вещества у видов Ulmus с различной устойчивостью к патогенам
По крайней мере, это сухой холод: глобальное распределение стресса от замораживания-оттаивания и засухи и признаки, которые могут придавать политолерантность хвойным деревьям
Комментарий: Источники воды, которая составляет биомассу деревьев
Реклама
ИсследованиеMetabolomics выявило различные реакции метаболизма углерода и азота на дефицит магния в листьях и корнях сои [Glycine max (Linn.) Merr.]
Введение
Магний (Mg) является одним из основных макроэлементов, необходимых для роста растений. Mg занимает центральное положение в структуре хлорофилла и, таким образом, имеет решающее значение для сбора солнечной энергии при фотосинтезе (Verbruggen and Hermans, 2013). Кроме того, Mg выступает в качестве кофактора для многих ферментов, таких как фосфатазы, киназы и АТФазы (Verbruggen, Hermans, 2013). Физиологические процессы, требующие Mg, включают фотосинтетический углекислый газ (CO 2 ) фиксация, выделение углерода, образование хлорофилла, синтез белка, образование активных форм кислорода (АФК) и снижение токсичности алюминия и свинца (Shaul, 2002; Cakmak and Kirkby, 2008; Bose et al., 2013; Hermans и др., 2013; Кобаяши и Таной, 2015; Шен и др., 2016).
Кроме того, Mg выступает в качестве кофактора для многих ферментов, таких как фосфатазы, киназы и АТФазы (Verbruggen, Hermans, 2013). Физиологические процессы, требующие Mg, включают фотосинтетический углекислый газ (CO 2 ) фиксация, выделение углерода, образование хлорофилла, синтез белка, образование активных форм кислорода (АФК) и снижение токсичности алюминия и свинца (Shaul, 2002; Cakmak and Kirkby, 2008; Bose et al., 2013; Hermans и др., 2013; Кобаяши и Таной, 2015; Шен и др., 2016).
Mg является восьмым по распространенности минеральным элементом на Земле (Maguire and Cowan, 2002). Однако концентрация доступного для растений магния варьируется в зависимости от типа почвы от 0,12 до 8,5 мМ (Вестерманн, 1996; Гранзее и Фюрс, 2013). Катион Mg 2+ слабо связывается с отрицательно заряженными почвенными коллоидами и стенками клеток корней и обладает высокой подвижностью по сравнению с другими катионами (Chen et al., 2017a). В результате Mg подвергается выщелачиванию в значительных количествах, что зависит от водного баланса, кислотности (ионы H + ) и концентрации других катионов в почве (Gransee, Führs, 2013; Chen et al. , 2017а). В кислых почвах, сильно насыщенных катионами, таких как H + , Al 3+ и Mn 2+ , выщелачивание Mg сильно выражено, особенно в зонах с большим количеством осадков (Gransee and Führs, 2013; Chen et al., 2017a).
, 2017а). В кислых почвах, сильно насыщенных катионами, таких как H + , Al 3+ и Mn 2+ , выщелачивание Mg сильно выражено, особенно в зонах с большим количеством осадков (Gransee and Führs, 2013; Chen et al., 2017a).
Несмотря на риск потери Mg, удобрение Mg уже давно игнорируется во многих сельскохозяйственных практиках (Cakmak and Yazici, 2010; Senbayram et al., 2015). В настоящее время дефицит Mg в сельском хозяйстве является широко распространенной проблемой, влияющей на продуктивность и качество сельскохозяйственных культур (Guo et al., 2015; Senbayram et al., 2015). Характерным признаком дефицита Mg является межжилковый хлороз из-за деградации молекулы хлорофилла (Cakmak, Yazici, 2010; Hermans et al., 2013; Chen et al., 2017a). Тем не менее, хлороз, по-видимому, является поздней реакцией на дефицит Mg, тогда как более ранней реакцией растений на дефицит Mg является накопление фотоассимилятов в листьях-источниках и их снижение в тканях-акцепторах (Gransee, Führs, 2013). В течение дней дефицита магния в листьях-источниках наблюдается накопление сахара и крахмала, что связано с нарушением распределения углерода в тканях-акцепторах (Cakmak et al., 19).94а,б; Германс и др., 2004, 2005; Какмак и Киркби, 2008 г.). Накопление углеводов в листьях-источниках с дефицитом магния происходит до того, как наблюдаются какие-либо заметные изменения в росте побегов (Cakmak et al., 1994a; Hermans et al., 2004). Это указывает на то, что влияние дефицита Mg на распределение углерода специфично для процесса переноса сахара от источника к приемнику. Высокая восприимчивость распределения углерода к дефициту Mg может быть связана с насыщением флоэмы сахарозой исходных листьев. Считается, что дефицит Mg влияет на загрузку флоэмы сахарозой за счет снижения доступности Mg-АТФ, что приводит к снижению активности Н+-АТФазы и уменьшению протонного градиента, который активизирует активную загрузку флоэмы (Brooker and Slayman, 19).83; Чакмак и др., 1994а; Какмак и Киркби, 2008 г.). При недостатке Mg в исходных листьях также было обнаружено накопление свободных аминокислот, что объяснялось либо угнетением синтеза белка, либо замедлением экспорта ассимилятов флоэмой (Fischer et al.
В течение дней дефицита магния в листьях-источниках наблюдается накопление сахара и крахмала, что связано с нарушением распределения углерода в тканях-акцепторах (Cakmak et al., 19).94а,б; Германс и др., 2004, 2005; Какмак и Киркби, 2008 г.). Накопление углеводов в листьях-источниках с дефицитом магния происходит до того, как наблюдаются какие-либо заметные изменения в росте побегов (Cakmak et al., 1994a; Hermans et al., 2004). Это указывает на то, что влияние дефицита Mg на распределение углерода специфично для процесса переноса сахара от источника к приемнику. Высокая восприимчивость распределения углерода к дефициту Mg может быть связана с насыщением флоэмы сахарозой исходных листьев. Считается, что дефицит Mg влияет на загрузку флоэмы сахарозой за счет снижения доступности Mg-АТФ, что приводит к снижению активности Н+-АТФазы и уменьшению протонного градиента, который активизирует активную загрузку флоэмы (Brooker and Slayman, 19).83; Чакмак и др., 1994а; Какмак и Киркби, 2008 г.). При недостатке Mg в исходных листьях также было обнаружено накопление свободных аминокислот, что объяснялось либо угнетением синтеза белка, либо замедлением экспорта ассимилятов флоэмой (Fischer et al. , 1998). Кроме того, снижение фотосинтетической фиксации CO 2 , изменение дыхания, производство АФК, изменение эффективности использования воды и солеустойчивости также наблюдались как реакции на дефицит Mg (Terry and Ulrich, 1974; Cakmak and Marschner, 19).92; Тевари и др., 2006 г.; Фархат и др., 2015; Транкнер и др., 2016; Чен и др., 2017b; Ли и др., 2017).
, 1998). Кроме того, снижение фотосинтетической фиксации CO 2 , изменение дыхания, производство АФК, изменение эффективности использования воды и солеустойчивости также наблюдались как реакции на дефицит Mg (Terry and Ulrich, 1974; Cakmak and Marschner, 19).92; Тевари и др., 2006 г.; Фархат и др., 2015; Транкнер и др., 2016; Чен и др., 2017b; Ли и др., 2017).
Поскольку Mg является важным компонентом многих метаболических и сигнальных путей, эффекты дефицита Mg на метаболические процессы кажутся быстрыми и дифференцированными в тканях источника и стока. У Arabidopsis thaliana голодание по магнию индуцировало отчетливые транскриптомные реакции в корнях и листьях в течение 24 часов после удаления магния (Hermans et al., 2010a). Кратковременные реакции дефицита магния включают нарушение работы генов циркадных часов в корнях и активацию сигнальных генов абсцизовой кислоты (АБК). Через 1 неделю Мг голодания 114 и 2,9Был идентифицирован 91 ген, который по-разному регулируется в корнях и побегах, с высоким распределением в категории «метаболизма» (Hermans et al. , 2010b). Например, гены повышающей регуляции были обогащены в пути биосинтеза этилена и в детоксикации АФК (Hermans et al., 2010b).
, 2010b). Например, гены повышающей регуляции были обогащены в пути биосинтеза этилена и в детоксикации АФК (Hermans et al., 2010b).
Несмотря на достигнутые успехи, ранний метаболический профиль растений в ответ на дефицит Mg остается неясным. Метаболический анализ позволяет одновременно отслеживать предшественники, промежуточные продукты и продукты метаболических путей. Это инструмент обнаружения, который может обнаруживать глобальные метаболические реакции на стимулы окружающей среды. Здесь мы провели метаболомный анализ с помощью газовой хроматографии и времяпролетной масс-спектрометрии (GC-TOF/MS) для изучения метаболических реакций сои [9].0257 Glycine max (Linn.) Merr.] зрелые листья и корни к дефициту Mg, до появления визуальных симптомов. Мы обратили внимание на первичные метаболиты, такие как сахара, аминокислоты и органические кислоты. Результаты показали, что дефицит Mg может вызывать массивные и отчетливые изменения метаболитов в листьях и корнях соответственно.
Материалы и методы
Растительный материал и условия выращивания
В этом исследовании использовали сорт сои Yue Chun 03-3. Yue Chun 03-3 коммерциализируется на юге Китая, где выщелачивание магния представляет собой серьезную проблему, связанную с подкислением почвы. Растения сои дикого типа выращивали в ростовой камере при следующих условиях: интенсивность света 400 мкмоль фотонов м -2 с -1 , 13 ч/26°С дневной и 11 ч/24°С ночной режим, влажность 65%. Семена стерилизовали газообразным хлором и проращивали на стерилизованном и увлажненном вермикулите. Через четыре дня после прорастания проростки переносили на гидропонную культуру в резервуарах, как описано (Li et al., 2012). Компоненты гидропонной культуры следующие: NH 4 NO 3 0,4 ммоль, Ca(NO 3 ) 2 1,2 ммоль, KNO 3 1,5 ммоль, (NH 8 4 902)0237 2 SO 4 0,3 ммоль, KH 2 PO 4 0,25 ммоль, MNSO 4 0,5 мкмоль, ZNSO4 1,5 мкмоль, CUSO 4 88. 10288.10288.10288.10288.10288.1028.1028.10238. 1,5 мкмоль, NaB 4 O 7 0,2 мкмоль, Fe·EDTA 0,04 ммоль, K 2 SO 4 0,8 ммоль, MgCl 2 0,5 ммоль. pH питательного раствора доводили до 5,8 добавлением 1 М КОН каждые 2 дня, чтобы избежать подкисления раствора. Питательный раствор меняли каждую неделю. Через 10 дней культивирования, когда первый трехлистный лист полностью разросся и считается «исходным листом», растения сои переносили в раствор, не содержащий магния, или в контрольный раствор в 10:00 дня. Для раствора, не содержащего Mg, MgCl 2 был исключен из СМИ.
10288.10288.10288.10288.10288.1028.1028.10238. 1,5 мкмоль, NaB 4 O 7 0,2 мкмоль, Fe·EDTA 0,04 ммоль, K 2 SO 4 0,8 ммоль, MgCl 2 0,5 ммоль. pH питательного раствора доводили до 5,8 добавлением 1 М КОН каждые 2 дня, чтобы избежать подкисления раствора. Питательный раствор меняли каждую неделю. Через 10 дней культивирования, когда первый трехлистный лист полностью разросся и считается «исходным листом», растения сои переносили в раствор, не содержащий магния, или в контрольный раствор в 10:00 дня. Для раствора, не содержащего Mg, MgCl 2 был исключен из СМИ.
Сбор образцов
Образцы растений для анализа биомассы собирали через 10 дней после стресса (DAS), сушили нагреванием при 60°C в течение 72 часов в сушильном шкафу и взвешивали. Для метаболомного анализа и анализа содержания крахмала листья и корни собирали для анализа в 4 и 8 DAS в 10:00 дня (через 2 ч после освещения). Для образца листьев использовали целые первые тройчатые листья. Что касается корней, то целая корневая система имеет большие размеры и ее трудно обрабатывать при извлечении образца. Поэтому брали первичные корни на расстоянии 10 см от кончика корня. Все образцы были помещены в жидкий азот сразу после извлечения. Для каждой обработки анализировали шесть биологических повторностей. Для каждого биологического образца объединяли листья или корни трех отдельных растений. Таким образом, для каждой обработки было отобрано в общей сложности 18 растений. Замороженные образцы растирали ступкой и пестиком в мелкий порошок, лиофилизировали в концентраторе с охлаждаемой ловушкой Labconco Centrivap (Fisher Scientific Inc., США), затем разделяли на три технические повторности для метаболомного анализа.
Что касается корней, то целая корневая система имеет большие размеры и ее трудно обрабатывать при извлечении образца. Поэтому брали первичные корни на расстоянии 10 см от кончика корня. Все образцы были помещены в жидкий азот сразу после извлечения. Для каждой обработки анализировали шесть биологических повторностей. Для каждого биологического образца объединяли листья или корни трех отдельных растений. Таким образом, для каждой обработки было отобрано в общей сложности 18 растений. Замороженные образцы растирали ступкой и пестиком в мелкий порошок, лиофилизировали в концентраторе с охлаждаемой ловушкой Labconco Centrivap (Fisher Scientific Inc., США), затем разделяли на три технические повторности для метаболомного анализа.
Анализ содержания Mg и хлорофилла
Для определения содержания Mg корни и побеги сои сушили при 75°C в течение 2 дней в сушильном шкафу и взвешивали сухую массу. После обработки концентрированной HNO 3 концентрацию Mg определяли с помощью атомно-абсорбционного спектрометра (AAS, PerkinElmer, Шелтон, США). Для определения содержания хлорофилла 0,25 г свежих листьев экстрагировали 80% ацетоном, затем центрифугировали при 4000 об/мин в течение 4 мин. Оптическую плотность супернатанта измеряли на спектрометре (V-1600, MAPADA Instruments Co., Ltd., Шанхай, Китай) при длине волны 663 и 645 нм соответственно. Содержание хлорофилла рассчитывали, как описано (Porra et al., 1989).
Для определения содержания хлорофилла 0,25 г свежих листьев экстрагировали 80% ацетоном, затем центрифугировали при 4000 об/мин в течение 4 мин. Оптическую плотность супернатанта измеряли на спектрометре (V-1600, MAPADA Instruments Co., Ltd., Шанхай, Китай) при длине волны 663 и 645 нм соответственно. Содержание хлорофилла рассчитывали, как описано (Porra et al., 1989).
Анализ содержания крахмала
Содержание крахмала определяли методом антрон-H 2 SO 4 , модифицированным методом McCready et al. (1950). 2 мг лиофилизированных листьев и 20 мг лиофилизированных образцов корней инкубировали в 1 мл 80%-ного этанола при 80°С в течение 30 мин. Оставшийся осадок ресуспендировали в воде и инкубировали при 95°С в течение 15 мин и определяли крахмал спектрофотометром (UV-1780, SHIMADZU Co., Киото, Япония) при длине волны 620 нм.
Экстракция образца для ГХ-ВП
Для метаболического анализа были приобретены растворители и реагенты высокой чистоты, чтобы избежать появления мешающих пиков МС и высокого фона. Экстракцию образцов проводили, как описано ранее (Fiehn, 2006; Fiehn et al., 2008). Вкратце, 5 мг лиофилизированных образцов добавляли к 1 мл предварительно охлажденного и дегазированного буфера для экстракции, состоящего из хлороформа, метанола и воды (1:2,5:1 [об/об/об]), затем добавляли 12 мкл арабитола (1 мг/мл). как внутренний стандарт. Образец встряхивали в течение 10 с и встряхивали на пластине для перемешивания в течение 6 мин при 4°C. После центрифугирования в течение 2 мин при 14000 rcf 500 мкл супернатанта переносили в новую пробирку, а затем сушили в концентраторе с охлаждаемой ловушкой Labconco Centrivap (Fisher Scientific Inc., Уолтем, Массачусетс, США). Для дериватизации к каждому образцу добавляли по 80 мкл раствора метоксиамина (15 мг/мл в пиридине) и встряхивали в течение 2 ч при 37°С, 200 об/мин. Затем к каждой пробе добавляли по 80 мкл МСТФА и встряхивали 30 мин при 37°С, 200 об/мин. Сто пятьдесят микролитров образцов реакционных растворов переносили в стеклянные флаконы, подходящие для автоматического пробоотборника ГХ-МС.
Экстракцию образцов проводили, как описано ранее (Fiehn, 2006; Fiehn et al., 2008). Вкратце, 5 мг лиофилизированных образцов добавляли к 1 мл предварительно охлажденного и дегазированного буфера для экстракции, состоящего из хлороформа, метанола и воды (1:2,5:1 [об/об/об]), затем добавляли 12 мкл арабитола (1 мг/мл). как внутренний стандарт. Образец встряхивали в течение 10 с и встряхивали на пластине для перемешивания в течение 6 мин при 4°C. После центрифугирования в течение 2 мин при 14000 rcf 500 мкл супернатанта переносили в новую пробирку, а затем сушили в концентраторе с охлаждаемой ловушкой Labconco Centrivap (Fisher Scientific Inc., Уолтем, Массачусетс, США). Для дериватизации к каждому образцу добавляли по 80 мкл раствора метоксиамина (15 мг/мл в пиридине) и встряхивали в течение 2 ч при 37°С, 200 об/мин. Затем к каждой пробе добавляли по 80 мкл МСТФА и встряхивали 30 мин при 37°С, 200 об/мин. Сто пятьдесят микролитров образцов реакционных растворов переносили в стеклянные флаконы, подходящие для автоматического пробоотборника ГХ-МС. Среди каждых 5 испытанных образцов также вводили 1 образец контроля качества (смесь всех испытанных образцов).
Среди каждых 5 испытанных образцов также вводили 1 образец контроля качества (смесь всех испытанных образцов).
Сбор данных с помощью GC-TOF-MS
Профилирование GC-TOF-MS было выполнено с использованием 1 мкл, введенного автоматическим пробоотборником на капиллярную колонку (RESTEK Rxi ® — 5sil MS) (длина 30 м, 0,25 мм внутренний диаметр и толщина пленки 0,25 мкм) (RESTEK Co., Беллефонте, Пенсильвания, США) и газовый хроматограф Agilent G6890B с инжекцией без разделения и электронным контролем давления (Agilent Co., Санта-Клара, Калифорния), установленный на Pegasus HT Time летный масс-спектрометр (LECO Co., Сент-Джозеф, Мичиган, США).
В качестве газа-носителя использовали гелий при скорости потока газа через колонку 2 мл/мин. ГХ начинают при 80°C и 2 мин изотермической обработки, затем повышают со скоростью 15°C/мин до 330°C и 6 мин изотермической. Температура линии передачи составляла 275°C. Использовали ионизацию электронным ударом при напряжении 70 В при температуре источника ионов 250°С. Энергия нити источника ионов была установлена равной 70 эВ. После 240-секундной задержки растворителя включали филамент и регистрировали масс-спектры в режиме полного сканирования при разрешающей способности по массе 9.0257 R = 600 от m/z 45 до 500 при 20 спектрах в секунду и напряжении детектора 1460 В без включения опции дефекта массы. Запись закончилась через 1200 с.
Энергия нити источника ионов была установлена равной 70 эВ. После 240-секундной задержки растворителя включали филамент и регистрировали масс-спектры в режиме полного сканирования при разрешающей способности по массе 9.0257 R = 600 от m/z 45 до 500 при 20 спектрах в секунду и напряжении детектора 1460 В без включения опции дефекта массы. Запись закончилась через 1200 с.
Для расчета индексов удерживания (RI) готовили смесь маркеров индекса внутреннего удерживания (RI) с использованием метиловых эфиров жирных кислот из смеси линейных цепей C12, C15, C19, C22, C32, C36 и вводили в каждой хроматограмме в качестве стандартных добавок.
Обработка данных и идентификация метаболитов
Хроматограммы оценивали вручную после масс-спектральной деконволюции (Chroma TOF, версия программного обеспечения 4.5X, LECO, Сент-Джозеф, Мичиган, США). Смещение базовой линии = 1, Smoothin = Auto, Ширина пика = 5 с, отношение сигнал/шум = 10. Высота пика не менее трех массовых фрагментов, представляющих каждый аналит, была нормализована с использованием внутренней стандартизации Arabitol. RI рассчитывали с помощью методов индекса удерживания программного обеспечения Chroma TOF путем нормализации с использованием внутренних маркеров RI. Характеристики были охарактеризованы из базы данных с использованием интегрированной в программное обеспечение LECO/Fiehn Metabolomics Library, а соответствующие метаболиты были обозначены с помощью программного обеспечения с порогом подобия > 800. Для углеводов, органических кислот и аминокислот, которые описаны в этом исследовании, стандарты метаболитов были приобретены у Sigma (Sigma-Aldrich Co., Сент-Луис, Миссури, США) или Fluka (Fluka Chemical Co., Милуоки, Висконсин, США), и была создана внутренняя библиотека для подтверждения идентификации метаболитов. Эти метаболиты идентифицировали путем сравнения времени удерживания и масс-спектров вручную со стандартами.
RI рассчитывали с помощью методов индекса удерживания программного обеспечения Chroma TOF путем нормализации с использованием внутренних маркеров RI. Характеристики были охарактеризованы из базы данных с использованием интегрированной в программное обеспечение LECO/Fiehn Metabolomics Library, а соответствующие метаболиты были обозначены с помощью программного обеспечения с порогом подобия > 800. Для углеводов, органических кислот и аминокислот, которые описаны в этом исследовании, стандарты метаболитов были приобретены у Sigma (Sigma-Aldrich Co., Сент-Луис, Миссури, США) или Fluka (Fluka Chemical Co., Милуоки, Висконсин, США), и была создана внутренняя библиотека для подтверждения идентификации метаболитов. Эти метаболиты идентифицировали путем сравнения времени удерживания и масс-спектров вручную со стандартами.
Анализ данных
Перед статистическим анализом площади пиков метаболитов в каждом образце сначала нормализовали в соответствии с внутренним стандартом (арабит) среди образцов. Затем относительное содержание каждого метаболита в каждом образце трансформировали путем сравнения с внутренним стандартом. В нашем анализе данных среднее значение из трех технических повторов было рассчитано с помощью Excel, которое использовалось в качестве значения каждого биологического повторения в статистическом анализе.
Затем относительное содержание каждого метаболита в каждом образце трансформировали путем сравнения с внутренним стандартом. В нашем анализе данных среднее значение из трех технических повторов было рассчитано с помощью Excel, которое использовалось в качестве значения каждого биологического повторения в статистическом анализе.
Тепловая карта была создана с помощью сервера MetaboAnalyst (Xia and Wishart, 2011; Xia et al., 2015). В одном образце из 8 корней DAS концентрация всех метаболитов была необычно низкой (чрезвычайно темно-синий цвет по сравнению с другими образцами), что должно быть вызвано экспериментальной ошибкой (например, плохой инъекцией), а не изменчивостью нормального распределения. Таким образом, этот образец был исключен из набора данных (рис. S2).
Для многовариантного анализа на веб-сайт MetaboAnalyst был загружен файл Excel с нормализованными данными биологических повторов и выполнена функция анализа главных компонентов (PCA). Для моновариантного анализа и тест Стьюдента t , и анализ кратных изменений были выполнены с использованием MetaboAnalyst соответственно.
Результаты
План эксперимента для анализа дефицита магния и метаболизма
Мы провели анализы дефицита магния в растениях сои в гидропонной системе (рис. S1). Обработку дефицитом магния применяли к 2-недельным растениям (4 дня на вермикулите, а затем 10 дней на гидропонике), когда первый трехлистный лист полностью разросся и считался «исходным листом». Чтобы оценить ранние метаболические реакции, которые являются прямым следствием дефицита Mg, мы собрали первые зрелые тройчатые листья и корни на 4 и 8 DAS для метаболического анализа с помощью GC-TOF (рис. S1). При 4 DAS запасы Mg уже истощаются в зрелых листьях, в то время как в корнях снижается лишь умеренно (рис. 1А). Этот результат показал, что гомеостаз Mg более чувствителен в зрелых листьях, чем в корнях. На этой стадии на растениях, подвергшихся стрессу, не наблюдалось никаких симптомов, а содержание хлорофилла неотличимо от нормального растения (рис. 1С). Таким образом, 4 образца DAS отражают очень раннюю метаболическую реакцию, когда стрессированные растения еще визуально неотличимы от контрольных растений. При 8 DAS содержание Mg было истощено как в листьях, так и в корнях (рис. 1В), и на более молодых листьях начинают проявляться фенотипы хлороза. В зрелых тройчатых листьях 8 DAS содержание хлорофилла снижено лишь умеренно (9).0257 p -значение <0,05) (рис. 1C). Таким образом, 8 образцов DAS представляют собой метаболические реакции при появлении симптомов дефицита Mg.
При 8 DAS содержание Mg было истощено как в листьях, так и в корнях (рис. 1В), и на более молодых листьях начинают проявляться фенотипы хлороза. В зрелых тройчатых листьях 8 DAS содержание хлорофилла снижено лишь умеренно (9).0257 p -значение <0,05) (рис. 1C). Таким образом, 8 образцов DAS представляют собой метаболические реакции при появлении симптомов дефицита Mg.
Рисунок 1 . Влияние дефицита Mg на растения сои. (A,B) Содержание Mg (A) через 4 дня после стресса (DAS) и (B) 8 DAS растений сои. (C) Содержание хлорофилла в 4 DAS и 8 DAS листьях. CK-L, контрольные листья через 4 или 8 дней после стресса; CK-R, контрольные корни через 4 или 8 дней после стресса; 4 DAS-L, Mg-дефицитные листья через 4 дня после стресса; 4 DAS-R, корни с дефицитом магния через 4 дня после стресса; 8 DAS-L, листья с дефицитом Mg через 8 дней после стресса; 8 DAS-R, корни с дефицитом магния через 8 дней после стресса.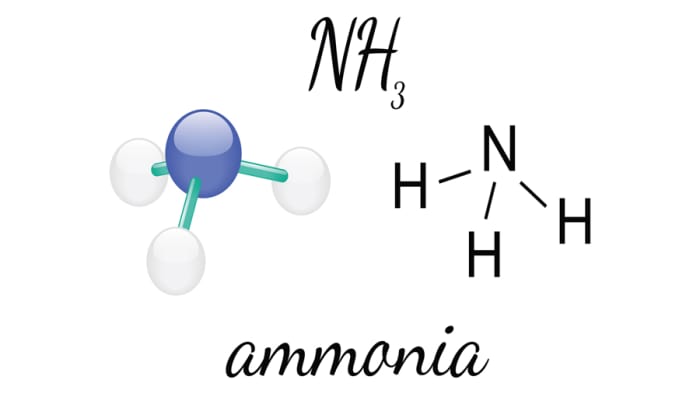 *** p — значение < 0,001 в t — тест; * p -значение < 0,05.
*** p — значение < 0,001 в t — тест; * p -значение < 0,05.
Резкие метаболические изменения в растениях сои с дефицитом Mg
После нормализации данных был проведен PCA для проверки наличия метаболических различий в реакциях на дефицит Mg, определения вариаций во времени и оценки вариаций образца. Чтобы исключить влияние стационарной тканевой специфичности, которая имеет наибольшее значение для различий между образцами, мы провели два АКП с образцами листьев и корней соответственно. PCA показал, что два основных компонента PC1 и PC2 вместе составляют 36,3 и 26,6% общей дисперсии в наборах данных листьев и корней соответственно (рис. 2A, B). В обоих наборах данных первый компонент, PC1, разрешал временные точки, что указывает на большую разницу между стадиями развития. Второй основной компонент, PC2, устранял реакции дефицита Mg на метаболическом уровне. График оценки PCA показал, что образцы листьев 4 растений DAS отличимы от контроля, в то время как образцы корней 4 DAS не были четко отделены от контроля (рис..jpg) 2A, B). Этот результат согласуется с более значительным истощением Mg в листьях, чем в корнях, при 4 DAS. Различия между дефицитом Mg и контрольными растениями отчетливы при 8 DAS, что согласуется со значительным фенотипом, вызванным дефицитом Mg (рис. 2A, B).
2A, B). Этот результат согласуется с более значительным истощением Mg в листьях, чем в корнях, при 4 DAS. Различия между дефицитом Mg и контрольными растениями отчетливы при 8 DAS, что согласуется со значительным фенотипом, вызванным дефицитом Mg (рис. 2A, B).
Рисунок 2 . PCA-анализ метаболомных данных. (A) Образцы листьев (B) Образцы корней. Четыре CK-L, управление выезжает на 4 DAS; 4 DAS-L, дефицит Mg уходит при 4 DAS. Четыре CK-R, контрольные корни на 4 DAS; 4 DAS-R, корни с дефицитом магния при 4 DAS. Восемь CK-L, управление выезжает в 8 DAS; 8 DAS-L, дефицит Mg уходит при 8 DAS. Восемь CK-R, контрольные корни на 8 DAS; 8 DAS-R, корни с дефицитом магния при 8 DAS.
Для моновариантного анализа дифференцированно накопленных метаболитов при дефиците Mg процедура двойной фильтрации с t — тест и кратное изменение. Мы установили пороговое значение p -value < 0,05 в тесте Стьюдента t и более 20% кратности изменения (|log2FC| > 0,26) для метаболитов, которые считаются «отзывчивыми» (Misra et al. , 2016). ; Чжу и Ассманн, 2017). Кроме того, чувствительные функции со значением p <0,001 и кратностью изменения более 50% (|log2FC|> 0,59) считались «очень значительными» изменениями (таблица S1). В общей сложности 85 идентифицированных метаболитов показали статистические ответы (|log2FC| > 0,26, p -значение <0,05) по крайней мере в одном сравнении между контрольной тканью и тканями с дефицитом магния (таблица S1).
, 2016). ; Чжу и Ассманн, 2017). Кроме того, чувствительные функции со значением p <0,001 и кратностью изменения более 50% (|log2FC|> 0,59) считались «очень значительными» изменениями (таблица S1). В общей сложности 85 идентифицированных метаболитов показали статистические ответы (|log2FC| > 0,26, p -значение <0,05) по крайней мере в одном сравнении между контрольной тканью и тканями с дефицитом магния (таблица S1).
В 4 листьях DAS из-за дефицита магния было изменено в общей сложности 28 метаболитов, включая 10 органических кислот, 9 аминокислот, 6 других метаболитов и 3 углевода (рис. 3А). Только 5 метаболитов были очень значительно чувствительными, из которых глюконовый лактон был наиболее истощен, а D-глицерол-1-фосфат был единственным значительно повышенным метаболитом (рис. 3B, таблица S1). В корнях 25 метаболитов реагировали на дефицит Mg при 4 DAS, включая 7 органических кислот, 10 аминокислот, 5 других метаболитов и 3 углевода (рис. 3А). Только 3 метаболита были очень значительно изменены, включая глютамин (Gln), который наиболее индуцировал, и мочевину, которая была наиболее снижена (рис. 3C, таблица S1). Большие метаболические вариации наблюдались в 8 листьях DAS, при этом 60 метаболитов были идентифицированы как реагирующие, включая 21 органическую кислоту, 19аминокислоты, 10 углеводов и 10 других метаболитов (рис. 3А). Двадцать шесть метаболитов были очень значительно изменены, при этом фенилаланин (Phe) показал наибольшее увеличение, а метилмалоновая кислота — наибольшее снижение (рис. 3D, таблица S1). В 8 корнях DAS было идентифицировано 33 измененных метаболита, при этом 16 показали очень значительный ответ, который был менее значительным, чем 8 листьев DAS (рис. 3A). Аллантоиновая кислота была наиболее индуцирована среди повышенных метаболитов, а янтарная кислота была наиболее снижена в 8 корнях DAS (рис. 3E, таблица S1). Приведенные выше результаты согласовывались с результатом анализа PCA, согласно которому растения с 8 DAS более отличимы от контрольных растений, чем с 4 растениями с DAS.
3C, таблица S1). Большие метаболические вариации наблюдались в 8 листьях DAS, при этом 60 метаболитов были идентифицированы как реагирующие, включая 21 органическую кислоту, 19аминокислоты, 10 углеводов и 10 других метаболитов (рис. 3А). Двадцать шесть метаболитов были очень значительно изменены, при этом фенилаланин (Phe) показал наибольшее увеличение, а метилмалоновая кислота — наибольшее снижение (рис. 3D, таблица S1). В 8 корнях DAS было идентифицировано 33 измененных метаболита, при этом 16 показали очень значительный ответ, который был менее значительным, чем 8 листьев DAS (рис. 3A). Аллантоиновая кислота была наиболее индуцирована среди повышенных метаболитов, а янтарная кислота была наиболее снижена в 8 корнях DAS (рис. 3E, таблица S1). Приведенные выше результаты согласовывались с результатом анализа PCA, согласно которому растения с 8 DAS более отличимы от контрольных растений, чем с 4 растениями с DAS.
Рисунок 3 . Унивариантный анализ метаболомных данных. (A) Сводка статистических изменений метаболитов в каждом образце. (B–E) Наибольшее увеличение и уменьшение количества метаболитов в каждом образце. (B) 4 листа DAS. CK-L, управляющие листья; 4 DAS-L, дефицит Mg уходит при 4 DAS. (C) 4 корня DAS. CK-R, контрольные корни; 4 DAS-R, корни с дефицитом магния при 4 DAS. (D) 8 листов DAS. CK-L, управляющие листья; 8 DAS-L, дефицит Mg уходит при 8 DAS. (E) CK-R, контрольные корни; 8 DAS-R, корни с дефицитом магния при 8 DAS. *** p -значение <0,001 в t -тест, |log2FC| > 0,59 в кратном изменении.
(A) Сводка статистических изменений метаболитов в каждом образце. (B–E) Наибольшее увеличение и уменьшение количества метаболитов в каждом образце. (B) 4 листа DAS. CK-L, управляющие листья; 4 DAS-L, дефицит Mg уходит при 4 DAS. (C) 4 корня DAS. CK-R, контрольные корни; 4 DAS-R, корни с дефицитом магния при 4 DAS. (D) 8 листов DAS. CK-L, управляющие листья; 8 DAS-L, дефицит Mg уходит при 8 DAS. (E) CK-R, контрольные корни; 8 DAS-R, корни с дефицитом магния при 8 DAS. *** p -значение <0,001 в t -тест, |log2FC| > 0,59 в кратном изменении.
Выделение углерода соей нарушено в ответ на дефицит Mg
Предыдущее исследование показало, что характерным фенотипом растений, испытывающих дефицит магния, является нарушение распределения углерода (Cakmak et al., 1994a; Hermans et al., 2004, 2005; Cakmak и Киркби, 2008). Поэтому мы исследовали влияние дефицита Mg на основные углеводы, участвующие в распределении углерода и дыхании, включая сахарозу, глюкозу, фруктозу, глюкозо-6-фосфат (G6P) и фруктозо-6-фосфат (F6P). В листьях при 4 DAS наблюдалось небольшое количество ответов, тогда как при 8 DAS наблюдалось сильное увеличение содержания сахарозы. Кроме того, уровень глюкозы, фруктозы, G6P и F6P также увеличился (рис. 4). В корнях в любой момент времени наблюдалось несколько существенных изменений, за исключением снижения содержания сахарозы при 8 DAS. Подобно сахарозе, крахмал не изменился в 4 образцах ДАС, накапливался в 8 листьях ДАС и статистически уменьшался в 8 корнях ДАС (рис. 4).
В листьях при 4 DAS наблюдалось небольшое количество ответов, тогда как при 8 DAS наблюдалось сильное увеличение содержания сахарозы. Кроме того, уровень глюкозы, фруктозы, G6P и F6P также увеличился (рис. 4). В корнях в любой момент времени наблюдалось несколько существенных изменений, за исключением снижения содержания сахарозы при 8 DAS. Подобно сахарозе, крахмал не изменился в 4 образцах ДАС, накапливался в 8 листьях ДАС и статистически уменьшался в 8 корнях ДАС (рис. 4).
Рисунок 4 . Углеводные изменения в листьях и корнях 8 DAS. + указывает на контрольные образцы; – указывает на образцы с дефицитом Mg. 4 д, 4 ДАС; 8 д, 8 ДАС. Красный фон указывает на очень значительное увеличение. *** p -значение <0,001 в t -тест, |log2FC| > 0,59 в кратности изменения; * p -значение < 0,05, |log2FC| > 0,26.
Распределение биомассы растений сои анализировали через 12 дней после стресса (DAS). По сравнению с контрольными растениями, растения, подвергшиеся воздействию магниевого голодания, показали снижение биомассы как в побегах, так и в корнях (рис. S3A, B). В частности, корни более ингибированы, чем побеги, что приводит к снижению соотношения корней и побегов (рис. S3C). Этот результат подтвердил, что на распределение биомассы от побега к корню влияет дефицит Mg в растениях сои, что согласуется с нарушением распределения углерода (Cakmak et al., 19).94б; Германс и др., 2005; Тевари и др., 2006 г.; Чакмак и Киркби, 2008 г.; Чакмак и Язычи, 2010).
S3A, B). В частности, корни более ингибированы, чем побеги, что приводит к снижению соотношения корней и побегов (рис. S3C). Этот результат подтвердил, что на распределение биомассы от побега к корню влияет дефицит Mg в растениях сои, что согласуется с нарушением распределения углерода (Cakmak et al., 19).94б; Германс и др., 2005; Тевари и др., 2006 г.; Чакмак и Киркби, 2008 г.; Чакмак и Язычи, 2010).
Органические кислоты значительно уменьшились в корнях с дефицитом магния
Затем мы проанализировали органические кислоты, которые являются промежуточными продуктами или тесно связаны с гликолизом и циклом трикарбоновых кислот (TCA) дыхания. В листьях содержание щавелевой и пировиноградной кислот снижалось при 4 DAS. В 8 листьях DAS содержание янтарной, шикимовой и 2-кетоглутаровой кислот было очень значительно увеличено, а пировиноградной и фумаровой кислот снижено. В корнях повышены пировиноградная и фумаровая кислоты, тогда как лимонная и щавелевая кислоты снижаются при 4 DAS. При 8 DAS метаболические реакции органических кислот резко снижались (рис. 5). Органические кислоты, участвующие в гликолизе и цикле трикарбоновых кислот, включая пировиноградную кислоту, лимонную кислоту, 2-кетоглутаровую кислоту, янтарную кислоту, фумаровую кислоту и яблочную кислоту, были значительно снижены (рис. 5).
При 8 DAS метаболические реакции органических кислот резко снижались (рис. 5). Органические кислоты, участвующие в гликолизе и цикле трикарбоновых кислот, включая пировиноградную кислоту, лимонную кислоту, 2-кетоглутаровую кислоту, янтарную кислоту, фумаровую кислоту и яблочную кислоту, были значительно снижены (рис. 5).
Рисунок 5 . Органические изменения в 8 листьях и корнях DAS. + указывает на контроль; – свидетельствует о дефиците Mg. 4 д, 4 ДАС; 8 д, 8 ДАС. Красный фон указывает на очень значительное увеличение; синий фон указывает на очень значительное снижение. *** p -значение <0,001 в t -тест, |log2FC| > 0,59 в кратности изменения; * p -значение < 0,05, |log2FC| > 0,26.
Аминокислоты были значительно повышены в листьях с дефицитом Mg
Аминокислоты и близкие промежуточные продукты также демонстрировали резкие реакции на дефицит Mg. По сравнению с небольшими изменениями углеводов и органических кислот при 4 DAS аминокислоты, по-видимому, были более чувствительными. В 4 листьях DAS содержание лейцина (Leu) было значительно повышено, тогда как содержание аспарагиновой кислоты (Asp) и аланина (Ala) снижено. В корнях содержание глутаминовой кислоты (Glu) повышалось при 4 DAS. При 8 DAS в листьях наблюдалось поразительное увеличение большинства аминокислот, включая Phe, аспарагин (Asn), Leu, изолейцин (Ile), глицин (Gly), глутамин (Gln) и серин (Ser) (рис. 6). В отличие от листьев, в корнях 8 DAS наблюдалось гораздо меньше изменений, причем значительно уменьшились только Ala и Ser (рис. 6).
В 4 листьях DAS содержание лейцина (Leu) было значительно повышено, тогда как содержание аспарагиновой кислоты (Asp) и аланина (Ala) снижено. В корнях содержание глутаминовой кислоты (Glu) повышалось при 4 DAS. При 8 DAS в листьях наблюдалось поразительное увеличение большинства аминокислот, включая Phe, аспарагин (Asn), Leu, изолейцин (Ile), глицин (Gly), глутамин (Gln) и серин (Ser) (рис. 6). В отличие от листьев, в корнях 8 DAS наблюдалось гораздо меньше изменений, причем значительно уменьшились только Ala и Ser (рис. 6).
Рисунок 6 . Аминокислотные изменения в 8 листьях и корнях DAS. + указывает на контроль; – свидетельствует о дефиците Mg. 4 д, 4 ДАС; 8 д, 8 ДАС. Красный фон указывает на очень значительное увеличение; синий фон указывает на очень значительное снижение. *** p -значение <0,001 в t -тест, |log2FC| > 0,59 в кратности изменения; * p -значение < 0,05, |log2FC| > 0,26.
Обсуждение
В этом исследовании представлен обзор ранних метаболических фенотипов, вызванных дефицитом магния в зрелых листьях (исходная ткань) и корнях (ткань-приемник). Метаболомный анализ позволяет проводить одновременный непредвзятый мониторинг предшественников, промежуточных продуктов и продуктов метаболических путей. В нашем метаболическом исследовании с помощью GC-TOF мы обратили внимание на первичный метаболизм, включая сахара, гликолиз, цикл трикарбоновых кислот и биосинтез аминокислот. Многовариантный и моновариантный анализ показал, что метаболические сети затрагиваются при 4 DAS, в то время как эффект был умеренным, а некоторые метаболиты демонстрировали значительные изменения. В 8 ДАС, когда первые зрелые тройчатые листья еще визуально неотличимы от контроля, наблюдалось массивное перепрограммирование метаболизма как в листьях, так и в корнях. Наши результаты сначала подтверждают предыдущие выводы о нарушении распределения углерода из-за дефицита Mg (Cakmak et al., 19).94а; Германс и др., 2004, 2005; Cakmak and Kirkby, 2008) (рис. 7). Более того, метаболический фенотип был различен в листьях и корнях при 8 DAS. Примечательно, что большинство аминокислот демонстрировало выраженное накопление в листьях, в то время как большинство органических кислот значительно уменьшалось в корнях (рис.
Метаболомный анализ позволяет проводить одновременный непредвзятый мониторинг предшественников, промежуточных продуктов и продуктов метаболических путей. В нашем метаболическом исследовании с помощью GC-TOF мы обратили внимание на первичный метаболизм, включая сахара, гликолиз, цикл трикарбоновых кислот и биосинтез аминокислот. Многовариантный и моновариантный анализ показал, что метаболические сети затрагиваются при 4 DAS, в то время как эффект был умеренным, а некоторые метаболиты демонстрировали значительные изменения. В 8 ДАС, когда первые зрелые тройчатые листья еще визуально неотличимы от контроля, наблюдалось массивное перепрограммирование метаболизма как в листьях, так и в корнях. Наши результаты сначала подтверждают предыдущие выводы о нарушении распределения углерода из-за дефицита Mg (Cakmak et al., 19).94а; Германс и др., 2004, 2005; Cakmak and Kirkby, 2008) (рис. 7). Более того, метаболический фенотип был различен в листьях и корнях при 8 DAS. Примечательно, что большинство аминокислот демонстрировало выраженное накопление в листьях, в то время как большинство органических кислот значительно уменьшалось в корнях (рис. 7).
7).
Рисунок 7 . Реакция первичных метаболических путей на дефицит Mg в листьях и корнях. Верхняя панель представляет метаболические реакции в листьях с дефицитом Mg, в которых повышено содержание большинства углеводов и аминокислот. Нижняя панель показывает метаболические реакции в корнях с дефицитом Mg, в которых наблюдается тенденция к снижению содержания большинства углеводов и органических кислот. Метаболиты с повышенной активностью отмечены красным цветом, а метаболиты с пониженной активностью — синим. Тона красного или синего цвета указывают на величину кратного изменения. Верхняя панель, листья; нижняя панель, корни.
Дефекты распределения углеводов более выражены в листьях-источниках на 8 DAS
У большинства растений дефицит Mg приводит к заметному увеличению отношения сухого веса побегов к корням, что связано с накоплением сахарозы и крахмала в листьях (Cakmak et al., 1994b; Hermans et al., 2005; Cakmak and Kirkby, 2008). Имеющиеся на сегодняшний день данные подтверждают, что накопление сахара в листьях с дефицитом Mg происходит в первую очередь из-за нарушения экспорта сахарозы из источников, а не из-за снижения активности поглощения (Cakmak and Yazici, 2010). В нашем исследовании мы также обнаружили, что первые тройчатые листья сои при 8 DAS демонстрируют значительное увеличение содержания углеводов (крахмала, сахарозы, глюкозы и фруктозы) (рис. 7). Между тем, в корнях наблюдалось лишь умеренное снижение содержания сахарозы и крахмала и отсутствие изменений содержания глюкозы и фруктозы (рис. 7). Таким образом, наши результаты показывают, что выгрузка сахара из корней при 8 DAS может еще не быть серьезно затронута, а накопление сахара в листьях более вероятно при 9.0257 in situ следствие магниевого голодания.
В нашем исследовании мы также обнаружили, что первые тройчатые листья сои при 8 DAS демонстрируют значительное увеличение содержания углеводов (крахмала, сахарозы, глюкозы и фруктозы) (рис. 7). Между тем, в корнях наблюдалось лишь умеренное снижение содержания сахарозы и крахмала и отсутствие изменений содержания глюкозы и фруктозы (рис. 7). Таким образом, наши результаты показывают, что выгрузка сахара из корней при 8 DAS может еще не быть серьезно затронута, а накопление сахара в листьях более вероятно при 9.0257 in situ следствие магниевого голодания.
Специфическое для корней истощение органических кислот может быть связано с перепрограммированием множественных метаболических путей при дефиците магния токсичность (Янг и др., 2007; Бозе и др., 2013; Чен и Ма, 2013; Чен и Ляо, 2016). Однако метаболические реакции органических кислот на дефицит Mg в растениях остаются неясными. Наши результаты показали, что 8 растений сои DAS демонстрируют выраженное снижение большинства органических кислот, особенно в корнях (рис.
 7). Органические кислоты являются интермедиатами фотосинтеза и дыхания, а также служат предшественниками для синтеза многих других соединений (Дринкович и др., 2016). Благодаря тесной метаболической связи с первичным и вторичным метаболизмом органические кислоты участвуют в регуляции широкого спектра основных клеточных процессов (Lopez-Bucio et al., 2000). Таким образом, механизмы, лежащие в основе изменений органических кислот при дефиците Mg, сложны и, по-видимому, являются результатом перепрограммирования многих метаболических путей. 9Было показано, что 0003
7). Органические кислоты являются интермедиатами фотосинтеза и дыхания, а также служат предшественниками для синтеза многих других соединений (Дринкович и др., 2016). Благодаря тесной метаболической связи с первичным и вторичным метаболизмом органические кислоты участвуют в регуляции широкого спектра основных клеточных процессов (Lopez-Bucio et al., 2000). Таким образом, механизмы, лежащие в основе изменений органических кислот при дефиците Mg, сложны и, по-видимому, являются результатом перепрограммирования многих метаболических путей. 9Было показано, что 0003 Mg имеет решающее значение для активности нескольких ферментов клеточного дыхания, основного пути метаболизма углерода, влияющего на содержание органических кислот (Terry and Ulrich, 1974; Garfinkel and Garfinkel, 1985). Влияние дефицита Mg на дыхание оказалось дифференцированным во времени и пространстве. В листьях сахарной свеклы показатели фотодыхания значительно снижены. Однако при недостатке Mg дыхание в темноте усиливалось (Terry, Ulrich, 1974). У цитрусовых темновое дыхание также усиливалось в листьях и уменьшалось в корне (Li et al., 2017). В нашем исследовании возможно, что дефицит Mg может привести к угнетению дыхания, что способствует снижению содержания органических кислот в корнях 8 DAS. Однако в 8 листьях DAS, которые были собраны в течение дня с предположительно сниженным дыханием, также было значительно снижено только содержание фумаровой кислоты (рис. 7). Таким образом, кажется, что снижение углеродного метаболизма может быть не единственной причиной истощения органических кислот в корнях 8 DAS.
У цитрусовых темновое дыхание также усиливалось в листьях и уменьшалось в корне (Li et al., 2017). В нашем исследовании возможно, что дефицит Mg может привести к угнетению дыхания, что способствует снижению содержания органических кислот в корнях 8 DAS. Однако в 8 листьях DAS, которые были собраны в течение дня с предположительно сниженным дыханием, также было значительно снижено только содержание фумаровой кислоты (рис. 7). Таким образом, кажется, что снижение углеродного метаболизма может быть не единственной причиной истощения органических кислот в корнях 8 DAS.
Вторым фактором, который может быть связан с истощением органических кислот, является гомеостаз pH. Органические кислоты, имеющиеся в растительных клетках в изобилии, играют важную роль в поддержании гомеостаза рН. Было показано, что магний необходим для активности Н+-АТФазы, критического регулятора цитозольного pH (Brooker and Slayman, 1983; Yang et al., 2007). Следовательно, дефицит Mg в корне может привести к ингибированию Н + -АТФазы, что вызовет закисление цитоплазмы. Когда Н + ингибируется, растительные клетки в основном используют метаболизм органических кислот для регуляции рН цитоплазмы (Lopez-Bucio et al., 2000). В ответ на дефицит Mg биосинтез органических кислот может снижаться, чтобы сбалансировать закисленный цитозольный pH.
Когда Н + ингибируется, растительные клетки в основном используют метаболизм органических кислот для регуляции рН цитоплазмы (Lopez-Bucio et al., 2000). В ответ на дефицит Mg биосинтез органических кислот может снижаться, чтобы сбалансировать закисленный цитозольный pH.
Наконец, было задокументировано, что ассимиляция аммония тесно связана с метаболизмом органических кислот. Органические кислоты необходимы для усвоения аммония и синтеза аминокислот (Goodchild and Givan, 1990; Hoffmann et al., 2007). При выращивании растений на среде с высоким содержанием аммония часто наблюдалось истощение органических кислот, особенно яблочной и лимонной (Hachiya et al., 2012). В растениях с дефицитом Mg поглощение аммиака будет увеличиваться из-за снижения конкуренции между положительно заряженными ионами. В нашем исследовании мочевина значительно накапливается как в листьях, так и в корнях 8 DAS, что может свидетельствовать о повышенном содержании аммония (рис. 7). Учитывая, что первичная ассимиляция аммония происходит в основном в корнях, накопление аммония может способствовать истощению органических кислот в корнях 8 ДАС.
Как указано выше, кислая почва с избытком H + , Al и Mn склонна к дефициту Mg. Учитывая, что органические кислоты играют важную роль в снижении токсичности алюминия и марганца (Rengel and Robinson, 1990; Senbayram et al., 2015), истощение органических кислот в корнях, вызванное дефицитом магния, может усугубить токсичность алюминия в кислой почве. Таким образом, наши результаты согласуются с предыдущими мнениями о том, что внешнее внесение Mg в кислых условиях почвы имеет решающее значение для защиты сельскохозяйственных культур от токсичности Al и Mn (Yang et al., 2007; Chen and Ma, 2013).
Накопление аминокислот в листьях при дефиците Mg может быть связано с нарушением метаболизма азота
Индукция свободных аминокислот при дефиците Mg была задокументирована предыдущими исследованиями, но подробный механизм остается неясным (Fischer et al., 1998). Здесь мы показываем, что накопление аминокислот стало очень значительным на относительно ранних стадиях (8 DAS) и специфично для листьев. Было высказано предположение, что дефицит Mg может ингибировать сборку и активность рибосом (Schuwirth et al., 2005), ответственных за трансляцию, и вызывать накопление свободных аминокислот (Weiss et al., 19).73; Сперрацца и Спремулли, 1983). Кроме того, нарушение загрузки флоэмы также может привести к нарушению ремобилизации азота и, таким образом, объяснить накопление свободных аминокислот в листьях 8 DAS. Однако шпинат подвергался стрессу из-за дефицита Mg, хотя аминокислоты также были повышены в исходных листьях, концентрация аминокислот существенно не влияла на флоэмный сок растений с дефицитом Mg (Fischer et al., 1998). Этот результат свидетельствует о том, что ремобилизация аминокислот во флоэме может не ограничиваться дефицитом Mg.
Было высказано предположение, что дефицит Mg может ингибировать сборку и активность рибосом (Schuwirth et al., 2005), ответственных за трансляцию, и вызывать накопление свободных аминокислот (Weiss et al., 19).73; Сперрацца и Спремулли, 1983). Кроме того, нарушение загрузки флоэмы также может привести к нарушению ремобилизации азота и, таким образом, объяснить накопление свободных аминокислот в листьях 8 DAS. Однако шпинат подвергался стрессу из-за дефицита Mg, хотя аминокислоты также были повышены в исходных листьях, концентрация аминокислот существенно не влияла на флоэмный сок растений с дефицитом Mg (Fischer et al., 1998). Этот результат свидетельствует о том, что ремобилизация аминокислот во флоэме может не ограничиваться дефицитом Mg.
Помимо вышеуказанных возможностей, мы предполагаем, что хлороз может способствовать накоплению аминокислот (Fischer and Bremer, 1993; Fischer et al., 1998; Hermans et al., 2004, 2005). Деградация хлоропластов, которая может быть вызвана гетеротрофными условиями в исходных тканях листьев, может привести к колоссальному высвобождению азота в форме аминокислот (Sage et al. , 1987; Crafts-Brandner et al., 1990; Masclaux). -Daubresse et al., 2010; Araujo et al., 2011). В нашем исследовании количество аминокислот резко увеличилось в 8 листьях DAS, что совпадает с фенотипом деградации хлоропластов: аспарагин и глутамин, два ключевых фактора ремобилизации азота и транспорта на большие расстояния, были среди аминокислот с наибольшим увеличением в 8 листьях DAS (рис. 7). ) (Роша и Бутен, 19 лет)91; Masclaux-Daubresse и др., 2010). Соответственно, 2-оксоглутаровая кислота и янтарная кислота также были повышены в 8 листьях DAS (рис. 7), которые, как было установлено, являются альтернативными последующими продуктами аминокислот от деградации белка до входа в дыхание (Araujo et al., 2011; Foyer et al. ., 2011). Поэтому мы предполагаем, что хлороз может быть важным фактором, влияющим на содержание свободных аминокислот в листьях при дефиците Mg.
, 1987; Crafts-Brandner et al., 1990; Masclaux). -Daubresse et al., 2010; Araujo et al., 2011). В нашем исследовании количество аминокислот резко увеличилось в 8 листьях DAS, что совпадает с фенотипом деградации хлоропластов: аспарагин и глутамин, два ключевых фактора ремобилизации азота и транспорта на большие расстояния, были среди аминокислот с наибольшим увеличением в 8 листьях DAS (рис. 7). ) (Роша и Бутен, 19 лет)91; Masclaux-Daubresse и др., 2010). Соответственно, 2-оксоглутаровая кислота и янтарная кислота также были повышены в 8 листьях DAS (рис. 7), которые, как было установлено, являются альтернативными последующими продуктами аминокислот от деградации белка до входа в дыхание (Araujo et al., 2011; Foyer et al. ., 2011). Поэтому мы предполагаем, что хлороз может быть важным фактором, влияющим на содержание свободных аминокислот в листьях при дефиците Mg.
Заключение
Таким образом, это исследование позволило нам отслеживать вызванное дефицитом Mg перепрограммирование первичного метаболизма в листьях и корнях сои, что дает новое представление о влиянии минеральных питательных веществ на первичный метаболизм растений. В целом количество ассимилятов и промежуточных продуктов метаболизма имеет тенденцию к увеличению в исходных листьях (углеводы, аминокислоты) и уменьшению в корнях (углеводы, органические кислоты) (рис. 7). Эти реакции могут быть связаны с перепрограммированием множества метаболических путей при дефиците Mg. В будущих исследованиях могут быть введены другие аналитические методы, такие как жидкостная хроматография-масс-спектрометрия, для мониторинга вторичного метаболизма, чтобы дополнить ограничение метода ГХ-ВП-МС на первичный метаболизм. Более того, для ответа на неуловимые вопросы необходимы генетические и молекулярные исследования. Например, какие ключевые регуляторы контролируют отчетливые метаболические реакции на дефицит Mg в листьях и корнях? Каковы молекулярные механизмы замедленного выделения углерода при дефиците Mg? Каковы основные факторы, приводящие к накоплению аминокислот в листьях и истощению органических кислот в корнях при недостатке Mg?
В целом количество ассимилятов и промежуточных продуктов метаболизма имеет тенденцию к увеличению в исходных листьях (углеводы, аминокислоты) и уменьшению в корнях (углеводы, органические кислоты) (рис. 7). Эти реакции могут быть связаны с перепрограммированием множества метаболических путей при дефиците Mg. В будущих исследованиях могут быть введены другие аналитические методы, такие как жидкостная хроматография-масс-спектрометрия, для мониторинга вторичного метаболизма, чтобы дополнить ограничение метода ГХ-ВП-МС на первичный метаболизм. Более того, для ответа на неуловимые вопросы необходимы генетические и молекулярные исследования. Например, какие ключевые регуляторы контролируют отчетливые метаболические реакции на дефицит Mg в листьях и корнях? Каковы молекулярные механизмы замедленного выделения углерода при дефиците Mg? Каковы основные факторы, приводящие к накоплению аминокислот в листьях и истощению органических кислот в корнях при недостатке Mg?
Вклад авторов
YG: внес свой вклад в разработку концепции исследования и написал рукопись.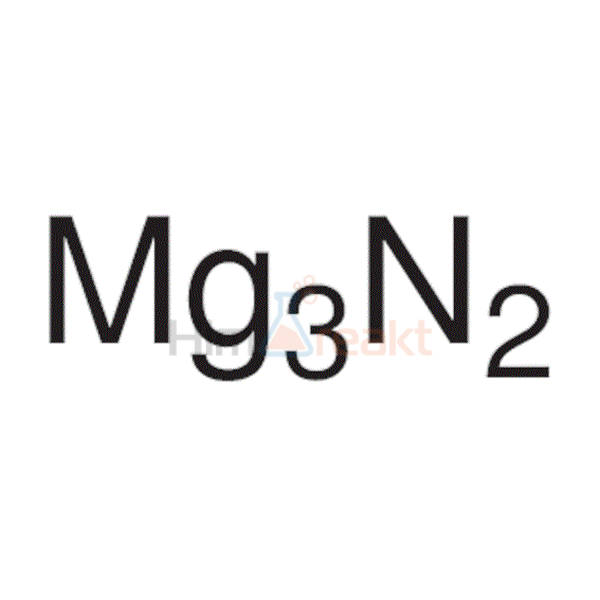 Нью-Йорк: выполнено большинство экспериментов, анализ данных и подготовка рисунков. JJ, HX, MB, QX и XW: помогали в извлечении проб, измерении биомассы, измерении содержания Mg и подготовке фигур. XY: помощь с GC-TOF и анализом данных. ZC: участие в измерении содержания Mg и хлорофилла и подготовке рукописи.
Нью-Йорк: выполнено большинство экспериментов, анализ данных и подготовка рисунков. JJ, HX, MB, QX и XW: помогали в извлечении проб, измерении биомассы, измерении содержания Mg и подготовке фигур. XY: помощь с GC-TOF и анализом данных. ZC: участие в измерении содержания Mg и хлорофилла и подготовке рукописи.
Финансирование
Эта работа поддерживается Национальной ключевой программой исследований и разработок Китая (2016YFD0100700). NY, MB и QX поддерживаются стипендией K+S от Международного института магния.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим профессора Оливера Фина (Калифорнийский университет в Дэвисе) за советы по метаболическим исследованиям и г-на Сили Фана (Калифорнийский университет в Дэвисе) за предложения по статистическому анализу. Мы благодарим основной метаболический центр HBMC FAFU за поддержку метаболического анализа.
Мы благодарим основной метаболический центр HBMC FAFU за поддержку метаболического анализа.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fpls.2017.02091/full#supplementary-material
Рисунок S1 . План эксперимента и отбор проб для метаболомного анализа. Семена сои стерилизовали газообразным хлором и проращивали на стерилизованном и увлажненном вермикулите. Через четыре дня после всходов рассаду переводили в гидропонную культуру в емкости на 10 дней. Когда первый трехлистный лист полностью разросся и считался «исходным листом», растения сои переносили в раствор, не содержащий магния (Mg), или в контрольный раствор. Для анализа метаболизма и содержания крахмала листья и корни собирали для анализа через 4 и 8 дней после стресса (DAS). СК, контрольные образцы.
Рисунок S2 . Тепловая карта и кластеризация нормализованных данных. Были показаны топ-30 тепловой карты. В этом исследовании было обнаружено, что один образец из 8 контрольных корней DAS выделяется (зеленый образец с темно-синими графиками на правой панели), поскольку уровень всех метаболитов необычайно ниже, чем у других образцов. Этот образец был изъят из дальнейшего анализа.
Были показаны топ-30 тепловой карты. В этом исследовании было обнаружено, что один образец из 8 контрольных корней DAS выделяется (зеленый образец с темно-синими графиками на правой панели), поскольку уровень всех метаболитов необычайно ниже, чем у других образцов. Этот образец был изъят из дальнейшего анализа.
Рисунок S3 . Биомасса и соотношение корней и побегов после 12-дневного дефицита Mg. (A) Биомасса листьев. (B) Корневая биомасса. (C) Соотношение корней и побегов. Синий фон указывает на очень значительное снижение. *** p -значение < 0,001 в t -тест.
Таблица S1 . Отзывчивые метаболиты при лечении дефицита магния. Красный цвет указывает на статистические ответы; Жирный красный цвет указывает на очень значительные изменения. Косая черта означает, что в образцах не обнаружено.
Ссылки
Араужо В.Л., Тоге Т., Ишизаки К., Ливер С.Дж. и Ферни А. Р. (2011). Деградация белка — альтернативный дыхательный субстрат для стрессовых растений. Тенденции Растениеводство. 16, 489–498. doi: 10.1016/j.tplants.2011.05.008
Р. (2011). Деградация белка — альтернативный дыхательный субстрат для стрессовых растений. Тенденции Растениеводство. 16, 489–498. doi: 10.1016/j.tplants.2011.05.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бозе Дж., Бабурина О., Шабала С. и Ренгель З. (2013). Устойчивость арабидопсиса к низкому pH и алюминию коррелирует с высоким содержанием магния в цитозоле и повышенным поглощением магния корнями растений. Физиол клеток растений. 54, 1093–1104. doi: 10.1093/pcp/pct064
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Брукер, Р. Дж., и Слейман, К. В. (1983). Влияние ионов Mg2+ на [H+]-АТФазу плазматической мембраны Neurospora crassa . II. Кинетические исследования. J. Biol. хим. 258, 8833–8838.
Реферат PubMed | Google Scholar
Чакмак И., Хенгелер К. и Маршнер Х. (1994a). Изменение флоэмного экспорта сахарозы листьями в ответ на дефицит фосфора, калия и магния у растений фасоли. Дж. Экспл. Бот. 45, 1251–1257.
Дж. Экспл. Бот. 45, 1251–1257.
Google Scholar
Чакмак И., Хенгелер К. и Маршнер Х. (1994b). Распределение сухого вещества побегов и корней и углеводов у растений фасоли, страдающих дефицитом фосфора, калия и магния. Дж. Экспл. Бот. 45, 1245–1250.
Google Scholar
Чакмак И. и Киркби Э. А. (2008). Роль магния в разделении углерода и уменьшении фотоокислительного повреждения. Физиол. Завод 133, 692–704. doi: 10.1111/j.1399-3054.2007.01042.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Чакмак И. и Маршнер Х. (1992). Дефицит магния и высокая интенсивность света усиливают активность супероксиддисмутазы, аскорбатпероксидазы и глутатионредуктазы в листьях фасоли. Завод физиол. 98, 1222–1227. doi: 10.1104/pp.98.4.1222
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чакмак И. и Язычи А. М. (2010). Магний: забытый элемент в растениеводстве. Завод по улучшению сельскохозяйственных культур 94, 23–25.
Google Scholar
Чен З. К. и Ляо Х. (2016). Анионы органических кислот: эффективное защитное оружие растений от алюминиевой токсичности и дефицита фосфора в кислых почвах. Ж. Жене. Геномика 43, 631–638. doi: 10.1016/j.jgg.2016.11.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен З. К. и Ма Дж. Ф. (2013). Транспортеры магния и их роль в устойчивости растений к алюминию. Растительная почва 368, 51–56. doi: 10.1007/s11104-012-1433-y
CrossRef Full Text | Google Scholar
Чен З. К., Пэн В. Т., Ли Дж. и Ляо Х. (2017a). Функциональная диссекция и транспортный механизм магния в растениях. Семин. Сотовый Дев. Биол . doi: 10.1016/j.semcdb.2017.08.005. [Epub перед печатью].
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Чен З. К., Ямаджи Н., Хори Т., Че Дж., Ли Дж., Ан Г. и др. (2017б). Переносчик магния OsMGT1 играет решающую роль в устойчивости риса к соли. Физиол растений. 174, 1837–1849 гг. doi: 10.1104/pp.17.00532
Физиол растений. 174, 1837–1849 гг. doi: 10.1104/pp.17.00532
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Crafts-Brandner, SJ, Salvucci, ME, and Egli, D.B. (1990). Изменения содержания рибулозобисфосфаткарбоксилазы/оксигеназы и рибулозо-5-фосфаткиназы и фотосинтетической способности во время старения листьев. Фотосин. Рез. 23, 223–230. doi: 10.1007/BF00035013
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Дринкович М.Ф., Фолл Л.М. и Маурино В.Г. (2016). О разнообразии ролей органических кислот. Фронт. Растениевод. 7:1592. doi: 10.3389/fpls.2016.01592
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фархат Н., Иванов А. Г., Крол М., Рабхи М., Смауи А., Абделли К. и др. (2015). Преимущественное повреждающее действие ограниченной биодоступности магния на фотосистему I в растениях Sulla carnosa . Планта 241, 1189–1206. doi: 10.1007/s00425-015-2248-x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Фин, О. (2006). «Профилирование метаболитов в арабидопсисе», в Протоколы арабидопсиса , редакторы Дж. Салинас и Дж. Дж. Санчес-Серрано (Тотова, Нью-Джерси: Humana Press), 439–447.
(2006). «Профилирование метаболитов в арабидопсисе», в Протоколы арабидопсиса , редакторы Дж. Салинас и Дж. Дж. Санчес-Серрано (Тотова, Нью-Джерси: Humana Press), 439–447.
Google Scholar
Фин О., Вольгемут Г., Шольц М., Кинд Т., Ли Д. Ю., Лу Ю. и др. (2008). Контроль качества для метаболомики растений: отчеты об исследованиях, соответствующих требованиям MSI. Завод J. 53, 691–704. doi: 10.1111/j.1365-313X.2007.03387.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Фишер Э. С. и Бремер Э. (1993). Влияние дефицита магния на скорость роста листьев, накопление крахмала и сахарозы и общую ассимиляцию у Phaseolus vulgaris . Физиол. Завод. 89, 271–276. doi: 10.1111/j.1399-3054.1993.tb00153.x
Полный текст CrossRef | Google Scholar
Фишер Э.С., Лохаус Г., Хайнеке Д. и Хельдт Х.В. (1998). Дефицит магния приводит к накоплению углеводов и аминокислот в исходных и стоковых листьях шпината. Физиол. Завод. 102, 16–20.
Завод. 102, 16–20.
Google Scholar
Фойер, Ч. Х., Ноктор, Г., и Ходжес, М. (2011). Дыхание и усвоение азота: воздействие на метаболизм, связанный с митохондриями, как средство повышения эффективности использования азота. Дж. Экспл. Бот. 62, 1467–1482. doi: 10.1093/jxb/erq453
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гарфинкель Л. и Гарфинкель Д. (1985). Магний регулирует гликолитический путь и вовлеченные ферменты. Магний 4, 60–72.
Реферат PubMed | Google Scholar
Гудчайлд, Дж. А., и Гиван, К. В. (1990). Влияние аммония и внеклеточного рН на содержание аминокислот и органических кислот в суспензионной культуре клеток Acer pseudoplatanus . Физиол. Завод. 78, 29–37. doi: 10.1111/j.1399-3054.1990.tb08710.x
Полный текст CrossRef | Google Scholar
Гранзее А. и Фюрс Х. (2013). Мобильность магния в почвах как проблема для анализа почвы и растений, удобрения магнием и поглощения корнями в неблагоприятных условиях роста. Растительная почва 368, 5–21. doi: 10.1007/s11104-012-1567-y
Растительная почва 368, 5–21. doi: 10.1007/s11104-012-1567-y
CrossRef Full Text | Google Scholar
Го, В. Л., Назим, Х., Лян, К., и Ян, Д. Ф. (2015). Дефицит магния у растений: актуальная проблема. Урожай J 4, 83–91. doi: 10.1016/j.cj.2015.11.003
Полный текст CrossRef | Google Scholar
Хачия Т., Ватанабэ С. К., Фуджимото М., Исикава Т., Такахара К., Каваи-Ямада М. и др. (2012). Добавление нитратов снижает токсичность аммония без уменьшения накопления аммония, истощения органических кислот и истощения неорганических катионов в Побеги Arabidopsis thaliana . Физиол клеток растений. 53, 577–591. doi: 10.1093/pcp/pcs012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Германс К., Буржис Ф., Фоше М., Штрассер Р. Дж., Делрот С. и Вербрюгген Н. (2005). Дефицит магния у сахарной свеклы изменяет распределение сахара и нагрузку на флоэму в молодых зрелых листьях. Планта 220, 541–549. doi: 10. 1007/s00425-004-1376-5
1007/s00425-004-1376-5
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Германс, К., Конн, С.Дж., Чен, Дж.Г., Сяо, К.Ю., и Вербрюгген, Н. (2013). Обновленная информация о механизмах гомеостаза магния в растениях. Металломика 5, 1170–1183. doi: 10.1039/c3mt20223b
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Германс, К., Джонсон, Г. Н., Штрассер, Р. Дж., и Вербрюгген, Н. (2004). Физиологическая характеристика дефицита магния у сахарной свеклы: акклиматизация к низкому содержанию магния по-разному влияет на фотосистемы I и II. Планта 220, 344–355. doi: 10.1007/s00425-004-1340-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Германс К., Вуйльстеке М., Коппенс Ф., Крачун А., Инзе Д. и Вербрюгген Н. (2010a). Ранние транскриптомные изменения, вызванные дефицитом магния у Arabidopsis thaliana , выявляют изменение экспрессии генов циркадных часов в корнях и запуск генов, чувствительных к абсцизовой кислоте. Новый фитол. 187, 119–131. дои: 10.1111/j.1469-8137.2010.03258.x
Новый фитол. 187, 119–131. дои: 10.1111/j.1469-8137.2010.03258.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Херманс К., Вуйлстеке М., Коппенс Ф., Кристеску С. М., Харрен Ф. Дж. М., Инзе Д. и др. (2010б). Системный анализ ответов на длительный дефицит магния и восстановление у Arabidopsis thaliana . Новый фитол. 187, 132–144. doi: 10.1111/j.1469-8137.2010.03257.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хоффманн А., Мильде С., Дезель К., Хюмпель А., Кайзер Х., Хаммес Э. и др. (2007). N-форма-зависимая задержка роста Проростки Arabidopsis thaliana , выявленные в результате физиологических исследований и исследований на микрочипах. J. Питательные вещества для растений. Почвовед. 170, 87–97. doi: 10.1002/jpln.200625032
Полный текст CrossRef | Google Scholar
Кобаяши Н. И. и Таной К. (2015). Критические вопросы изучения систем транспорта магния и симптомов дефицита магния у растений. Междунар. Дж. Мол. науч. 16, 23076–23093. doi: 10.3390/ijms160923076
Междунар. Дж. Мол. науч. 16, 23076–23093. doi: 10.3390/ijms160923076
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Li, C.C., Gui, S.H., Yang, T., Walk, T., Wang, X.R., and Liao, H. (2012). Идентификация генов пурпурной кислой фосфатазы сои и реакции их экспрессии на доступность фосфора и симбиоз. Энн. Бот. 109, 275–285. doi: 10.1093/aob/mcr246
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Li, C.-P., Qi, Y.-P., Zhang, J., Yang, L.-T., Wang, D.-H., Ye, X., et al. (2017). Вызванные дефицитом магния изменения газообмена, основных метаболитов и ключевых ферментов различаются между корнями, нижними и верхними листьями 9 растений.0257 Саженцы Citrus sinensis . Три Физиол 37, 1564–1581. doi: 10.1093/treephys/tpx067
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лопес-Бусио, Дж., Ньето-Якобо, М.Ф., Рамирес-Родригес, В.В., и Эррера-Эстрелла, Л. (2000). Обмен органических кислот в растениях: от адаптивной физиологии к трансгенным сортам для выращивания в экстремальных почвах. Растениевод. 160, 1–13. doi: 10.1016/S0168-9452(00)00347-2
Обмен органических кислот в растениях: от адаптивной физиологии к трансгенным сортам для выращивания в экстремальных почвах. Растениевод. 160, 1–13. doi: 10.1016/S0168-9452(00)00347-2
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Магуайр, М.Е., и Коуэн, Дж.А. (2002). Химия и биохимия магния. Биометаллы 15, 203–210. doi: 10.1023/A:1016058229972
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Masclaux-Daubresse, C., Daniel-Vedele, F., Dechorgnat, J., Chardon, F., Gaufichon, L., and Suzuki, A. (2010). Поглощение, ассимиляция и ремобилизация азота в растениях: проблемы устойчивого и продуктивного сельского хозяйства. Энн. Бот. 105, 1141–1157. дои: 10.1093/aob/mcq028
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Маккриди Р. М., Гуггольц Дж., Сильвьера В. и Оуэнс Х. С. (1950). Определение крахмала и амилозы в овощах. Аналитик. хим. 22, 1156–1158. doi: 10.1021/ac60045a016
doi: 10.1021/ac60045a016
CrossRef Полный текст | Google Scholar
Мисра Б. Б., Де Армас Э. и Чен С. (2016). Дифференциальные метаболические реакции иммунитета, запускаемого PAMP, и иммунитета, запускаемого эффектором, у Arabidopsis суспензионные клетки. Метаболомика 12:61. doi: 10.1007/s11306-016-0984-y
CrossRef Full Text | Google Scholar
Порра, Р. Дж., Томпсон, В. А., и Кридеманн, П. Е. (1989). Определение точных коэффициентов экстинкции и одновременных уравнений для анализа хлорофиллов a и b, экстрагированных четырьмя различными растворителями: проверка концентрации стандартов хлорофилла с помощью атомно-абсорбционной спектроскопии. Биохим. Биофиз. Акта 975, 384–394. doi: 10.1016/S0005-2728(89)80347-0
CrossRef Full Text | Google Scholar
Ренгель З. и Робинсон Д.Л. (1990). Моделирование поглощения магния из кислой почвы: I. Отношения питательных веществ на границе почва-корень. Почвоведение. соц. Являюсь. J. 54, 785–791. doi: 10.2136/sssaj1990.03615995005400030027x
J. 54, 785–791. doi: 10.2136/sssaj1990.03615995005400030027x
CrossRef Full Text | Google Scholar
Роша К. и Бутин Ж.-П. (1991). Метаболизм аминокислот флоэмы в материнских тканях плодов клубенькового или питавшегося нитратами гороха ( Pisum sativum L .). Дж. Экспл. Бот. 42, 207–214. doi: 10.1093/jxb/42.2.207
CrossRef Full Text
Sage, R.F., Pearcy, R.W., and Seemann, J.R. (1987). Эффективность использования азота растениями С(3) и С(4): III. Влияние азота листьев на активность карбоксилирующих ферментов у Chenopodium album (L.) и Amaranthus retroflexus (L.). Завод физиол. 85, 355–359. doi: 10.1104/pp.85.2.355
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Шувирт, Б.С., Боровинская, М.А., Хау, К.В., Чжан, В., Вила-Санджурджо, А., Холтон, Дж.М., и соавт. (2005). Структуры бактериальной рибосомы с разрешением 3,5 Å. Наука 310, 827–834. doi: 10.1126/science.1117230
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сенбайрам М.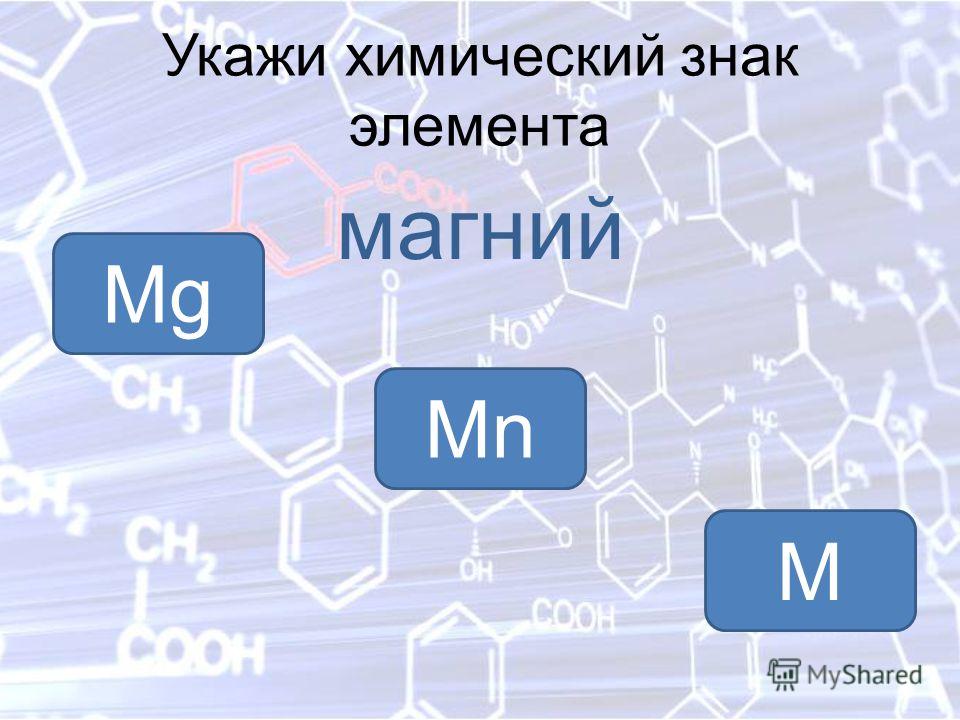 , Гранси А., Вале В. и Тиль Х. (2015). Роль магниевых удобрений в сельском хозяйстве: континуум «растение-почва». Пастбищные науки. 66, 1219–1229. doi: 10.1071/CP15104
, Гранси А., Вале В. и Тиль Х. (2015). Роль магниевых удобрений в сельском хозяйстве: континуум «растение-почва». Пастбищные науки. 66, 1219–1229. doi: 10.1071/CP15104
Полный текст CrossRef | Google Scholar
Шауль, О. (2002). Транспорт и функция магния в растениях: верхушка айсберга. Биометаллы 15, 309–323. doi: 10.1023/A:10160585
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шен Дж., Сонг Л., Мюллер К., Ху Ю., Сонг Ю., Ю, В. и др. (2016). Магний смягчает неблагоприятное воздействие свинца на рост, фотосинтез и ультраструктурные изменения Сеянцы Torreya grandis . Фронт. Растениевод. 7:1819. doi: 10.3389/fpls.2016.01819
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сперрацца, Дж. М., и Спремулли, Л. Л. (1983). Количественное определение связывания катионов с рибосомами зародышей пшеницы: влияние на равновесие ассоциации субъединиц и активность рибосом. Рез. нуклеиновых кислот. 11, 2665–2679. doi: 10.1093/nar/11.9.2665
нуклеиновых кислот. 11, 2665–2679. doi: 10.1093/nar/11.9.2665
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Терри, Н., и Ульрих, А. (1974). Влияние дефицита магния на фотосинтез и дыхание листьев сахарной свеклы. Завод физиол. 54, 379–381.
Реферат PubMed | Google Scholar
Тевари Р.К., Кумар П. и Шарма П.Н. (2006). Дефицит магния вызывал окислительный стресс и антиоксидантные реакции у растений тутового дерева. науч. Хортик. 108, 7–14. doi: 10.1016/j.scienta.2005.12.006
CrossRef Полный текст | Академия Google
Транкнер М., Джакли Б., Тавакол Э., Гейлфус С.М., Чакмак И., Диттерт К. и др. (2016). Дефицит магния снижает эффективность использования воды биомассой и увеличивает эффективность использования воды листьями и окислительный стресс у растений ячменя. Почва для растений 406, 409–423. doi: 10.1007/s11104-016-2886-1
Полный текст CrossRef | Google Scholar
Вербрюгген, Н. , и Херманс, К. (2013). Физиологические и молекулярные реакции на дисбаланс магния в растениях. Почва для растений 368, 87–99. doi: 10.1007/s11104-013-1589-0
, и Херманс, К. (2013). Физиологические и молекулярные реакции на дисбаланс магния в растениях. Почва для растений 368, 87–99. doi: 10.1007/s11104-013-1589-0
Полный текст CrossRef | Google Scholar
Weiss, R.L., Kimes, B.W., and Morris, D.R. (1973). Катионы и строение рибосом. 3. Влияние на 30S- и 50S-субъединицы замены связанного Mg2+ неорганическими катионами. Биохимия 12, 450–456. doi: 10.1021/bi00727a014
CrossRef Полный текст | Google Scholar
Вестерманн, Д. Т. (1996). Биодоступность питательных веществ в почве: механистический подход, 2-е изд. Почвоведение. 161, 140–141. doi: 10.1097/00010694-199602000-00012
Полный текст CrossRef | Google Scholar
Ся Дж. Г., Синельников И. В., Хан Б. и Уишарт Д. С. (2015). MetaboAnalyst 3.0 делает метаболомику более значимой. Рез. нуклеиновых кислот. 43, W251–W257. doi: 10.1093/nar/gkv380
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ся, Дж. Г., и Уишарт, Д. С. (2011). Интернет-вывод биологических паттернов, функций и путей на основе метаболомных данных с использованием MetaboAnalyst. Нац. протокол 6, 743–760. doi: 10.1038/nprot.2011.319
Г., и Уишарт, Д. С. (2011). Интернет-вывод биологических паттернов, функций и путей на основе метаболомных данных с использованием MetaboAnalyst. Нац. протокол 6, 743–760. doi: 10.1038/nprot.2011.319
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ян Дж. Л., Ю Дж. Ф., Ли Ю. Ю., Ву П. и Чжэн С. Дж. (2007). Магний усиливает индуцированную алюминием секрецию цитрата в корнях рисовых бобов ( Vigna umbellata ) за счет восстановления активности Н+-АТФазы плазматической мембраны. Физиол клеток растений. 48, 66–73. doi: 10.1093/pcp/pcl038
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Чжу, М., и Ассманн, С.М. (2017). Метаболические сигнатуры в ответ на обработку абсцизовой кислотой (АБК) в замыкающих клетках Brassica napus , выявленные с помощью метаболомики. науч. Респ. 7:12875. doi: 10.1038/s41598-017-13166-w
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Торговая марка Nitrogen Corporation 66,5% раствор нитрата магния
Поставщик: Торговая марка Nitrogen Corporation
Магний нитрат 66,5% раствор представляет собой жидкость без запаха от бесцветной до слегка желтоватой. Этот высокочистый раствор можно использовать в различных промышленных химических процессах.
Этот высокочистый раствор можно использовать в различных промышленных химических процессах.
Функция: питательное вещество
Количество заказа
Цена
Доступна при цитате
Минимальное количество заказа
Цитата Требуется
Время заказа
Требуется QUOTE
Дополнительные INCOTERMS
QUOTE.
Требуемая цитата
Название продукта Семейства продуктовПрименение
Технический паспорт
Товарный знак Nitrogen Corporation 66,5% раствор нитрата магния Этикетка образца
Товарный знак Nitrogen Corporation Магний нитрат 66,5 % Этикетка образца раствора
Технический паспорт
Технический паспорт
Товарный знак Nitrogen Corporation Магний нитрат 66,5 % Раствор Технический паспорт
Товарный знак Nitrogen Corporation 90 % Технические данные 60
Технический паспорт
Паспорт безопасности
Товарный знак Nitrogen Corporation Раствор нитрата магния 66,5 % Паспорт безопасности
Товарная марка азота корпорация магния нитрат 66,5%.
Питательный компонент
Химическая формула
Mg(NO3)2
CAS №
13446-18-9
Технологии
Agrochemicals
Семейства продуктов
Фертилия и питательные вещества,
Торговая азота.
Рынки
Сельское хозяйство и корма
Применение
Другие сельскохозяйственные культуры,
Properties
Physical Form
Liquid
Odor
Odorless
Physical Properties
| Value | Units | Test Method / Conditions | |
| Удельный вес (68°F) | 1,35 | — | — |
| Значение pH | 6 — 7 | — | — |
| Salt-Out Temperature | 21. 0 0 | °F | — |
| Weight Per Gallon | 11.26 | lbs/gal | — |
Typical Properties
| Value | Units | Test Method / Conditions | |
| Magnesium Nitrate {Mg(NO3)2} | 66.5 | % | — |
| Total Nitrogen (N) | 7.2 | % | — |
| Magnesium (Mg) | 6. 3 3 | % | — |
Regulatory & Compliance
Chemical Inventions
TSCA (США)
Безопасность и здоровье
Меры предосторожности
- Не вдыхайте туман или пар.
- Тщательно вымойте после работы.
- Использовать только на открытом воздухе или в хорошо проветриваемом помещении.
- При обращении с продуктами; носить химически защитные перчатки, защитные очки, защитную одежду и средства защиты лица.
- Избегайте контакта с глазами, кожей и одеждой.
Опасности
При вдыхании:
- Немедленно вывести пострадавшего на свежий воздух.
- Если дыхание затруднено, дайте кислород.
- При необходимости обратитесь за медицинской помощью.

При попадании на кожу:
- Снять всю загрязненную одежду.
- Промывайте кожу большим количеством воды в течение не менее 15 минут.
- При необходимости обратитесь за медицинской помощью.
При попадании в глаза:
- Немедленно промыть глаза водой в течение не менее 15 минут, время от времени поднимая веки.
- Если раздражение не проходит, обратитесь за медицинской помощью.
При проглатывании:
- Не вызывать рвоту.
- Пейте воду.
- Никогда не давайте ничего в рот человеку, находящемуся без сознания.
- Обратитесь за медицинской помощью.
Острая опасность для здоровья:
- Вреден при проглатывании или вдыхании.
- Разрушительно для слизистых оболочек и верхних дыхательных путей, глаз и кожи.
- Может возникнуть покраснение и раздражение тканей.

- Хронические опасности для здоровья:
- Длительное воздействие соединений марганца может привести к отравлению марганцем, может привести к инвалидности.
- Органы-мишени включают дыхательную систему, центральную нервную систему, легкие, кровь и почки.
Упаковка и доступность
Тип упаковки
барабаны, Totes (IBC)
Доступность
Решение магнея нитрат. Хранение и обращение
Хранение
- Хранить при температуре выше 45°F в хорошо проветриваемом месте.
- Держите контейнер плотно закрытым.
Изотопный состав углерода, азота, магния, кремния и титана в одиночных межзвездных зернах карбида кремния из углеродистого хондрита Мерчисон
NASA/ADS
ИЗОТОПНЫЙ СОСТАВ УГЛЕРОДА, АЗОТА, МАГНИЯ, КРЕМНИЯ И ТИТАНА ОДИНОЧНЫХ ЗЕРЕН МЕЖЗВЕЗДНОГО КАРБИДА КРЕМНИЯ ИЗ УГЛЕРОДИСТОГО ХОНДРИТА МЕРЧИСОН
- Хоппе, Питер ;
- Амари, Сатико ;
- Циннер, Эрнст ;
- Ирландия, Тревор ;
- Льюис, Рой С.

Реферат
Семьсот двадцать зерен SiC из хондрита Murchison CM2 размером от 1 до 10 микрометров были проанализированы с помощью масс-спектрометрии с ионным микрозондом на их C-изотопный состав. Подмножества зерен также были проанализированы на изотопы N (450 зерен), Si (183 зерна), Mg (179 зерен) и Ti (28 зерен). Эти результаты сравниваются с предыдущими измерениями на 41 более крупном зерне SiC (до 15 x 26 микрометров) из другого образца Мерчисона, проанализированного Virag et al. (1992) и Ирландия, Зиннер и Амари (1991a). Все зерна в настоящем исследовании являются изотопно-аномальными с отношениями C-12/C-13 в диапазоне от 0,022 до 28,4 x солнечного, отношения N-14/N-15 от 0,046 до 30 x солнечного, Si-29/Si-28 от 0,54. до 1,20 солнечной энергии, Si-30/Si-28 от 0,42 до 1,14 солнечной энергии, Ti-49/Ti-48 от 0,96 до 1,95 солнечной энергии и Ti-50/Ti-48 от 0,94 до 1,39 солнечной энергии. Многие зерна имеют большие избытки Mg-26 в результате распада Al-26 с предполагаемыми отношениями Al-26/Al-27 в диапазоне до 0,61, или 12 200 x отношение 5 x 10 -5 предполагается для ранней Солнечной системы. Среди зерен SiC можно выделить несколько групп. Большинство зерен имеют избыток C-13 и N-14, а их изотопный состав Si (в основном избытки Si-29 и Si-30) имеет график, близкий к линии наклона 1,34 на зависимости Delta Si-29/Si-28 от Delta. Трехизотопный график Si-30/Si-28. Зерна с малым отношением C-12/C-13 (менее 10), как правило, имеют меньший избыток N-14 или его отсутствие, а также высокое отношение Al-26/Al-27 (до 0,01). Зерна с C-12/C-13 более 150 делятся на две группы: зерна X имеют избыток N-15 и Si-29.дефицит Si-30 и самые высокие (от 0,1 до 0,6) отношения Al-26/Al-27; зерна Y имеют избыток N-14 и располагаются на линии наклона 0,35 на трехизотопной диаграмме Si. Кроме того, крупные зерна SiC из Virag et al. (1992) делятся на три различных кластера в соответствии с их изотопным составом C, Si и Ti.
Многие зерна имеют большие избытки Mg-26 в результате распада Al-26 с предполагаемыми отношениями Al-26/Al-27 в диапазоне до 0,61, или 12 200 x отношение 5 x 10 -5 предполагается для ранней Солнечной системы. Среди зерен SiC можно выделить несколько групп. Большинство зерен имеют избыток C-13 и N-14, а их изотопный состав Si (в основном избытки Si-29 и Si-30) имеет график, близкий к линии наклона 1,34 на зависимости Delta Si-29/Si-28 от Delta. Трехизотопный график Si-30/Si-28. Зерна с малым отношением C-12/C-13 (менее 10), как правило, имеют меньший избыток N-14 или его отсутствие, а также высокое отношение Al-26/Al-27 (до 0,01). Зерна с C-12/C-13 более 150 делятся на две группы: зерна X имеют избыток N-15 и Si-29.дефицит Si-30 и самые высокие (от 0,1 до 0,6) отношения Al-26/Al-27; зерна Y имеют избыток N-14 и располагаются на линии наклона 0,35 на трехизотопной диаграмме Si. Кроме того, крупные зерна SiC из Virag et al. (1992) делятся на три различных кластера в соответствии с их изотопным составом C, Si и Ti. Изотопное разнообразие зерен и скопление их изотопных составов предполагают различные и множественные звездные источники. C- и N-изотопный состав большинства зерен согласуется с H-горением в цикле CNO. Эти и s-процессы Kr, Xe, Ba и Nd предполагают, что асимптотическая ветвь гигантов (AGB) или звезды Вольфа-Райе являются вероятными источниками зерен, но существующие модели нуклеосинтеза в этих звездных участках не в состоянии подробно объяснить все наблюдаемые явления. изотопные составы. Особые проблемы представляют собой зерна с С-12/С-13 менее 10 и почти нормальным и тяжелым N-изотопным составом. Также составы изотопов Si и Ti с избытком Si-29и Si-30 по отношению к Si-28 и избыток всех изотопов Ti по отношению к Ti-48 не совсем соответствуют составам, предсказанным для захвата медленных нейтронов. Необходимы дополнительные теоретические усилия для понимания изотопного состава зерен SiC и их звездных источников.
Изотопное разнообразие зерен и скопление их изотопных составов предполагают различные и множественные звездные источники. C- и N-изотопный состав большинства зерен согласуется с H-горением в цикле CNO. Эти и s-процессы Kr, Xe, Ba и Nd предполагают, что асимптотическая ветвь гигантов (AGB) или звезды Вольфа-Райе являются вероятными источниками зерен, но существующие модели нуклеосинтеза в этих звездных участках не в состоянии подробно объяснить все наблюдаемые явления. изотопные составы. Особые проблемы представляют собой зерна с С-12/С-13 менее 10 и почти нормальным и тяжелым N-изотопным составом. Также составы изотопов Si и Ti с избытком Si-29и Si-30 по отношению к Si-28 и избыток всех изотопов Ti по отношению к Ti-48 не совсем соответствуют составам, предсказанным для захвата медленных нейтронов. Необходимы дополнительные теоретические усилия для понимания изотопного состава зерен SiC и их звездных источников.
- Публикация:
Астрофизический журнал
- Дата публикации:
- август 1994 г.

- DOI:
- 10.1086/174458
- Бибкод:
- 1994ApJ…430..870H
- Ключевые слова:
- Изотопы углерода;
- Изотопы магния;
- Метеоритный состав;
- Мерчисонский метеорит;
- Изотопы азота;
- Карбиды кремния;
- Изотопы кремния;
- Звездная композиция;
- Изотопы титана;
- Изобилие;
- Астрофизика;
- Космическая пыль;
- Межзвездная химия;
- Масс-спектроскопия;
- Ядерный синтез;
- Астрофизика;
- МЕТЕОРОИДЫ;
- ЯДЕРНЫЕ РЕАКЦИИ;
- НУКЛЕОСИНТЕЗ;
- ИЗОБИЛИЕ
Возможная роль дополнительного поступления магния и азота для облегчения стресса, вызванного высокой радиацией и температурой у лимонных деревьев 9o}нио Кваджио и Дирсеу Маттос}, журнал = {Растение и почва}, год = {2020}, страницы={1-14} }
- R.
 M. Boaretto, F. Hippler, D. Mattos
M. Boaretto, F. Hippler, D. Mattos - Опубликовано 18 июня 2020 г.
- Химия
- Растения и почва
Цели Цитрусовые деревья во время цветения подвержены изменению условий окружающей среды, особенно в течение годового цикла и набор фруктов. Жара повлияла на условия окружающей среды, необходимые для оптимального роста сельскохозяйственных культур, и привела к снижению урожайности и качества фруктов во всем мире. Это исследование было направлено на оценку дополнительного поступления магния (Mg) и/или азота (N) для повышения устойчивости цитрусовых к чрезмерному повышенному облучению и последующей температуре воздуха. Методы Молодые лимонные деревья были…
Вид на Springer
Различия в морфофизиологических особенностях проростков цитрусовых связаны с транспортом Mg от родительского растения к органам ветвления
- Yamin Jia, Hao Xu, Jiuxin Guo
Медицина
9007BMC0 Биология растений 2021
Дефицит Mg подавляет рост родительских органов и ветвей цитрусовых растений, при этом высокая подвижность Mg способствует различиям в физиологическом метаболизме, что позволяет предположить, что управление Mg должно быть оптимизировано для устойчивого производства цитрусовых.
Magnesium Foliar Supplementation Increases Grain Yield of Soybean and Maize by Improving Photosynthetic Carbon Metabolism and Antioxidant Metabolism
- V. A. Rodrigues, C. Crusciol, R. Lollato
Medicine
Plants
- 2021
Foliar Mg fertilization может улучшить метаболизм антиоксидантов, тем самым снижая экологический стресс, с которым растения сталкиваются во время цикла выращивания в тропических полевых условиях, и повышать метаболизм сельскохозяйственных культур, что приводит к увеличению урожайности зерна.
Сверхэкспрессия гена тирозиндекарбоксилазы MdTyDC в яблоне повышает долговременную умеренную засухоустойчивость и WUE.
Разделение биомассы и фотосинтез в поисках эффективности использования азота для видов цитрусовых деревьев.
- V. Dovis, N. M. Erismann, E. Machado, J. A. A. Quaggio, R. M. Boaretto, Dirceu Mattos Júnior
Environmental Science
Tree Physiology
- 2020
ЭИА для лимонных деревьев строится на основе оценки роста и распределения биомассы, а также фотохимических и биохимических характеристик фотосинтеза и предполагает, что лимоны могут демонстрировать более низкую стоимость строительства биомассы, чем апельсины.
Физиологические и молекулярные достижения в питании магний растений
- Xin-Yue Tian, Dongrui HE, Zhichang Chen
Биология
лежащих в основе биологической функциональности Mg, а также транспорта Mg и симптомов дефицита Mg в растениях, и предполагает, что срочно необходимы дополнительные подходы для повышения концентрации Mg в съедобных частях сельскохозяйственных культур.
Физиологическая сущность магния в растениях и его широко распространенный дефицит в системе земледелия Китая
Магний (Mg) является важным питательным веществом для широкого спектра фундаментальных физиологических и биохимических процессов в растениях. В основном это связано с синтезом, производством, транспортировкой хлорофилла и…
Чрезмерное употребление глифосата хронически нарушает путь шикимата и может повлиять на фотосинтез и урожайность цитрусовых деревьев.
- Р. Мартинелли, Луис Ренато Руфино, Фернандо Алвес де Азеведо
Медицина
Хемосфера
- 2022
Сообщается о чрезмерном использовании глифосата в бразильских цитрусовых садах, тогда как существуют предположения о его последствиях, а опубликованные исследования противоречивы и неубедительны.
 Это исследование было направлено…
Это исследование было направлено…Электрические свойства плазматической мембраны клеток корней растений влияют на смягчение фитотоксичности Al и Cu катионами Ca и Mg
Результаты подтвердили концепцию о том, что сила ослабления катионов Ca и Mg зависит от обоих видов растений. и токсиканты, которые они облегчают.
Магний в растениеводстве и качестве продуктов питания
- И. Чакмак, П. Уайт
Биология
Растение и почва
- 2020
После очень успешного международного симпозиума по производству продуктов питания и качества Magnesium , Германия, в мае 2012 г., и в Сан-Паулу, Бразилия, в ноябре 2014 г., 3-й Международный…
TaWRKY70 позитивно регулирует повышенную толерантность к Cd TaCAT5 у трансгенного арабидопсиса
ПОКАЗАНЫ 1-10 ИЗ 63 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантность Наиболее влиятельные документыНедавность
Окислительный стресс, вызванный нарушениями питания Cu у цитрусовых, зависит от наличия азота и кальция
- F.
 Hippler, R. M. Boaretto, R. A. Quaggio, J. Azevedo, Dirceu Mattos-Jr
Hippler, R. M. Boaretto, R. A. Quaggio, J. Azevedo, Dirceu Mattos-Jr Химия, медицина
Scientific Reports
- 2018
Рациональное снабжение N или Ca сводит к минимуму стрессовые повреждения корней и листьев растений, вызванные медью, путем непосредственного усиления антиоксидантной системы и защищая активность связанных антиоксидантных ферментов при сохранении фотосинтеза.
Облегчение температурного стресса путем управления питательными веществами в сельскохозяйственных культурах: обзор
- E. Waraich, R. Ahmad, A. Halim, T. Aziz
Биология
- 2012
Температурный стресс и роль некоторых макроэлементов (азот, калий, кальций и магний), микроэлементов и салициловой кислоты подробно обсуждаются, а также то, как эти питательные вещества играют свою роль в смягчении температурного стресса у культурных растений.
Механизмы снижения стресса меди у цитрусовых деревьев после поглощения металла листьями или корнями
- F.
 Hippler, Guilherme Petená, R. M. Boaretto, J. A. Quaggio, R. Azevedo, Dirceu Mattos-Jr
Hippler, Guilherme Petená, R. M. Boaretto, J. A. Quaggio, R. Azevedo, Dirceu Mattos-Jr Химия окружающей среды, медицина
Science and Pollution Research- 2018
Избыток Cu приводил к повреждению роста и метаболизма растений, когда металл поглощался либо корнями, либо листьями, а самый высокий уровень Cu применялся через листву в виде сульфата, Cu удалялась корни растений, повышая уровень металлов в ризосферной почве.
Влияние снабжения азотом на фотосинтетическую активность листьев кофейных растений, подвергающихся воздействию яркого света
- М. А. Нунес, Ж. Рамальо, М. А. Диас эффективность и выход флуоресценции, а также чистая скорость фотосинтеза в воздухе были снижены как из-за закрытия устьиц, так и из-за изменений на фотохимическом уровне, что указывает на то, что растения, удобренные азотом, были менее подвержены фотоингибированию.
Влияние кальция на антиоксидантную активность и водные отношения, связанные с устойчивостью к жаре у двух прохладных трав.

Обработка экзогенным Ca2+ повышала устойчивость к жаре как у овсяницы тростниковой, так и у мятлика кентуккийского, и это улучшение было связано с поддержанием антиоксидантной активности и снижением перекисного окисления липидов мембраны, но не с регуляцией осмотического потенциала и регулированием осмоса.
ВЛИЯНИЕ ВЫСОКОЙ ТЕМПЕРАТУРЫ НА ГАЗОБМЕН, ЦВЕТЕНИЕ, КАЧЕСТВО ПЛОДА И УРОЖАЙНОСТЬ ЦИТРУСОВЫХ АПЕЛЬСИНОВЫХ ЛИСТЬЕВ
- A. Otero, C. Goñi, J. Jifon, J. Syvertsen
Биология
- 2011
листья подвергаются воздействию прямых солнечных лучей.
Роль магния в разделении углерода и уменьшении фотоокислительного повреждения.
- И. Чакмак, Э. А. Киркби
Науки об окружающей среде
Physiologia plantarum
- 2008
Результаты показывают, что фотоокислительное повреждение способствует развитию хлороза листьев при дефиците Mg, предполагая, что растения в условиях яркого освещения имеют более высокую физиологическую потребность в Mg.

Магний в динамике углеводов и антиоксидантного метаболизма саженцев кофе на двух уровнях излучения
- Kaio Gonçalves de Lima Dias, P. T. G. Guimarães, A.E. F. Neto, V. Faquin, Eduane José de Páimeae, A. E. F. neto, V. faquin, eduane josé de Páimeare, A.E. F. neto, V. faquin, eduane josé deaeare.0097
Химия
Науки о кофе
- 2018
Целью этого исследования было проверить физиологическое воздействие и динамику углеводов Coffea arabica, проростков, подвергнутых воздействию возрастающих концентраций магния (Mg) и двух облучений3
Тепловые и засушливые стрессы сельскохозяйственных культур и подходы к их смягчению
- М. Ламауи, М. Джемо, Р. Датла, Ф. Беккауи
Биология, медицина
Фронт. хим.
- 2018
Представлены последние достижения в ключевых областях, связанных с устойчивостью растений к засухе и жаре, а также представлен обзор и последствия физиологических, биохимических и генетических аспектов в контексте жары и засухи.

Бор снижает токсичность алюминия в тройчатом апельсине, регулируя систему антиоксидантной защиты и уменьшая повреждение клеток корня.
Дефицит питательных веществ / RHS Садоводство
- Консультация
- Поиск советов
- Руководство для начинающих
- В этом месяце
- Выращивайте сами
- Благополучие
Если растения не растут, несмотря на адекватную подготовку почвы, полив и мульчирование, это может быть признаком дефицита питательных веществ. Особенно уязвимы фрукты и овощи, а также растения в контейнерах и растения, растущие на очень кислых или щелочных почвах. Желтые или красноватые листья, замедленный рост и плохое цветение – все это частые симптомы дефицита азота, магния или калия.
Сохранить в Мой альбом
Дефицит магния в помидорах. Кредит: RHS/Сад.
Краткая информация
Пораженные растения: Все растения
Основные причины: Очень кислые или щелочные, или маломощные песчаные почвы; плохие условия роста
Время: Обычно весна или летоПерейти к
- Что такое дефицит питательных веществ?
- Симптомы, причина и устранение
Что такое дефицит питательных веществ?
Некоторые садовые почвы и горшечные компосты страдают от недостатка питательных веществ, что приводит к симптомам дефицита у растений, растущих в них.

Растения также могут страдать от дефицита, если условия выращивания плохие и растения не могут усваивать питательные вещества, присутствующие в почве. Очень кислые или щелочные условия, сухость и заболачивание могут затруднить усвоение растениями питательных веществ из почвы.
Недостаток питательных веществ вызывает такие симптомы, как пожелтение или потемнение листьев, иногда с характерными признаками. Это может сопровождаться задержкой роста и плохим цветением или плодоношением.
Симптомы, причина и устранение
Дефицит азота
- Симптомы: Веретенообразные желтые растения или желтые листья, иногда с розовым оттенком.
- Причина: Азот способствует росту зелени и листвы, а дефицит приводит к пожелтению и замедлению роста. Азот очень хорошо растворим, поэтому легко вымывается из почвы зимними дождями, оставляя почву в дефиците весной, когда растения только начинают расти. Дефицит азота – частая причина пожелтения листьев весной.

- Средство: В долгосрочной перспективе мульчирование органическими веществами (такими как перегнивший садовый компост или навоз) обеспечивает постоянный приток азота для стабилизации уровня. В краткосрочной перспективе эту проблему решит внесение удобрений с высоким содержанием азота, таких как сульфат аммиака или гранулы птичьего помета.
Дефицит калия
- Симптомы: Желтые или фиолетовые оттенки листьев с коричневым налетом по краям листьев и плохое цветение или плодоношение.
- Причина: Калий необходим для контроля как поглощения воды, так и процесса, позволяющего растениям использовать энергию солнца (фотосинтез). Калий способствует цветению, плодоношению и общей зимостойкости. Недостаток более вероятен на легких, песчаных или известняковых почвах, где калий легко вымывается. Глинистые почвы, напротив, содержат калий в своей структуре.
- Способ устранения: Внесите удобрения с высоким содержанием калия, такие как сульфат калия, подкормка для томатов или некоторые органические источники калия, полученные при переработке сахарной свеклы.

Дефицит фосфора
- Симптомы: Медленный рост и тускло-желтая листва.
- Причина: Фосфор необходим для здоровых корней и роста побегов. Нехватка фосфора в почве встречается редко, но может возникать в районах с большим количеством осадков и тяжелой глинистой почвой.
- Способ устранения: Внесите удобрения, такие как суперфосфат или костная мука.
Дефицит магния
- Симптомы: Пожелтение между жилками листьев, иногда с красновато-коричневыми оттенками и раннее опадение листьев. Дефицит магния характерен для томатов, яблок, винограда, малины, роз и рододендронов.
- Причина: Магний необходим для здоровых листьев и для того, чтобы растения могли использовать энергию солнца (фотосинтез). Недостаток магния в почве чаще встречается на легких песчаных почвах. Чрезмерное использование удобрений с высоким содержанием калия (таких как подкормка для томатов) может вызвать дефицит магния, поскольку растения поглощают калий, а не магний.

- Средство: В краткосрочной перспективе применяйте английскую соль в качестве внекорневой подкормки летом. Разбавьте соли из расчета 20 г английской соли на литр воды (1/3 унции на пинту) плюс несколько капель жидкого моющего средства. Наносите два или три раза с интервалом в две недели, опрыскивая в пасмурную погоду, чтобы избежать ожога листьев. В долгосрочной перспективе нанесите на почву вокруг корней доломитовый известняк (карбонат кальция и магния) в количестве 100 г на кв. м (4 унции на кв. ярд) или английскую соль (сульфат магния) в количестве 30 г на кв. м (1 унцию на кв. ярд). Доломитовый известняк сделает почву более щелочной, поэтому его не следует использовать вокруг вересковых (любящих кислоту) растений, таких как рододендроны или камелии, или там, где почва уже щелочная.
Дефицит марганца и железа
- Симптомы: Пожелтение между жилками листьев с побурением краев листьев у кислотолюбивых растений.
- Причина: Марганец и железо важны для того, чтобы растения могли использовать энергию солнца (фотосинтез).
 Нехватка почвы бывает редко, но марганец и железо могут быть недоступны для корней растений в щелочных условиях. Вересковые (кислолюбивые) растения особенно уязвимы при выращивании на щелочных почвах или горшечном компосте.
Нехватка почвы бывает редко, но марганец и железо могут быть недоступны для корней растений в щелочных условиях. Вересковые (кислолюбивые) растения особенно уязвимы при выращивании на щелочных почвах или горшечном компосте. - Средство: Нанесите хелатные препараты железа и марганца, такие как Sequestrene, на почву вокруг корней растений.
Дефицит молибдена
- Симптомы: Удлиненные скрученные листья цветной капусты или других крестоцветных, растущих в щелочной почве. Дефицит молибдена обычно наблюдается у цветной капусты и крестоцветных, особенно при выращивании в недостаточно щелочной почве.
- Причина: Молибден необходим для различных процессов роста растений, но в очень малых количествах. Нехватка молибдена в почве встречается редко, но в кислых условиях он может быть менее доступен для корней растений.
- Устранение: Обработайте измельченными микроэлементами (см.
 наши рекомендации по удобрениям). Известкование почвы поможет в долгосрочной перспективе, так как повышение щелочности почвы поможет сделать молибден более доступным. Подробнее см. в наших советах по извести и известкованию.
наши рекомендации по удобрениям). Известкование почвы поможет в долгосрочной перспективе, так как повышение щелочности почвы поможет сделать молибден более доступным. Подробнее см. в наших советах по извести и известкованию.
Дефицит бора
- Симптомы: Задержка роста и отмирание верхушек салата, коричневые трещины на сельдерее; гнилая брюква, репа и сельдерей; ямочки на грушах с коричневыми пятнами под ними.
- Причина: Бор необходим для формирования клеток здоровых растений. Нехватка почвы встречается редко, но это питательное вещество может быть менее доступно для корней растений в щелочных условиях.
- Способ устранения: Обработайте почву растворенными микроэлементами (см. наши рекомендации по удобрениям) или внесите в почву буру (двунатрийтетраборат) перед посевом овощей или в качестве внекорневой подкормки для грушевых деревьев. Нормы внесения буры в почву: 35 г на 20 кв. м (1 унция на 20 кв.



 Большая часть азота в атмосфере содержится в свободном состоянии. Без азота невозможно формирование белковых молекул.[2]
Большая часть азота в атмосфере содержится в свободном состоянии. Без азота невозможно формирование белковых молекул.[2] Обнаруживается и в горных породах, и в живых организмах.[1]
Обнаруживается и в горных породах, и в живых организмах.[1] Азот обнаруживается в ферментах – катализаторах различных процессов в организмах.[7]
Азот обнаруживается в ферментах – катализаторах различных процессов в организмах.[7] [7]
[7] [7]
[7] Получают в результате обработки калийных солей промышленными способами. К ним относятся хлористый калий, хлоркалий-электролит, калимагнезия, калимаг и другие.
Получают в результате обработки калийных солей промышленными способами. К ним относятся хлористый калий, хлоркалий-электролит, калимагнезия, калимаг и другие. Это известняки, известняки доломитизированные, доломиты.
Это известняки, известняки доломитизированные, доломиты. 1
1 д.
д. Включает в себя внесение наибольшей части (70 – 80 %) общей дозы минеральных удобрений. Удобрения заделывают под вспашку в глубокие увлажненные почвенные слои. Такое внесение призвано обеспечить растения питанием на протяжении практически всего периода вегетации.[7]
Включает в себя внесение наибольшей части (70 – 80 %) общей дозы минеральных удобрений. Удобрения заделывают под вспашку в глубокие увлажненные почвенные слои. Такое внесение призвано обеспечить растения питанием на протяжении практически всего периода вегетации.[7] business
business Weatherall, MF Proe, J. Craig, A.D. Cameron, A.J. Midwood, Внутренний круговорот азота, калия и магния в молодой ситхинской ели, Физиология деревьев , том 26, выпуск 5, май 2006 г., страницы 673–680, https://doi.org/10.1093/treephys/26.5.673
Weatherall, MF Proe, J. Craig, A.D. Cameron, A.J. Midwood, Внутренний круговорот азота, калия и магния в молодой ситхинской ели, Физиология деревьев , том 26, выпуск 5, май 2006 г., страницы 673–680, https://doi.org/10.1093/treephys/26.5.673



 M. Boaretto, F. Hippler, D. Mattos
M. Boaretto, F. Hippler, D. Mattos Это исследование было направлено…
Это исследование было направлено… Hippler, R. M. Boaretto, R. A. Quaggio, J. Azevedo, Dirceu Mattos-Jr
Hippler, R. M. Boaretto, R. A. Quaggio, J. Azevedo, Dirceu Mattos-Jr Hippler, Guilherme Petená, R. M. Boaretto, J. A. Quaggio, R. Azevedo, Dirceu Mattos-Jr
Hippler, Guilherme Petená, R. M. Boaretto, J. A. Quaggio, R. Azevedo, Dirceu Mattos-Jr



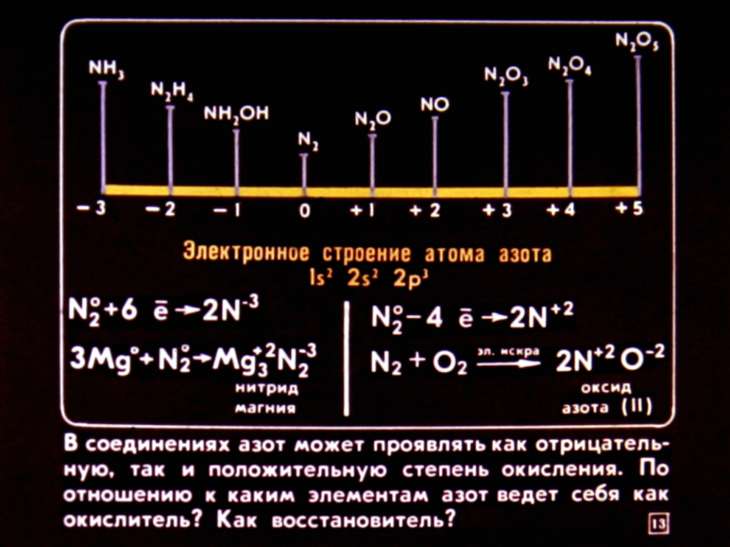


 Нехватка почвы бывает редко, но марганец и железо могут быть недоступны для корней растений в щелочных условиях. Вересковые (кислолюбивые) растения особенно уязвимы при выращивании на щелочных почвах или горшечном компосте.
Нехватка почвы бывает редко, но марганец и железо могут быть недоступны для корней растений в щелочных условиях. Вересковые (кислолюбивые) растения особенно уязвимы при выращивании на щелочных почвах или горшечном компосте. наши рекомендации по удобрениям). Известкование почвы поможет в долгосрочной перспективе, так как повышение щелочности почвы поможет сделать молибден более доступным. Подробнее см. в наших советах по извести и известкованию.
наши рекомендации по удобрениям). Известкование почвы поможет в долгосрочной перспективе, так как повышение щелочности почвы поможет сделать молибден более доступным. Подробнее см. в наших советах по извести и известкованию.