Пара-ксилол, химические свойства, структурная формула, Ch4-C6h5-Ch4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Арены (ароматические соединения)
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ксилол | Encyclopedia.com
Gale
Просмотры Обновлено июнь 08 2018
Термин «ксилол» относится к любому из трех бензола Произворя. 3 ) 2 , но различаются по своей молекулярной структуре. Они используются в качестве растворителей, добавок для повышения октанового числа авиационного топлива, а также в качестве сырья для производства волокон, пленок, красителей и других синтетических продуктов. Из-за высокой летучести они классифицируются как ароматические 9.0010 углеводороды (летучие соединения, содержащие только атомов углерода и атомов водорода ). Ксилольные фракции впервые были выделены из каменноугольной смолы в середине девятнадцатого века в Германии. Каменноугольная смола представляет собой густой жидкий продукт карбонизации или деструктивной перегонки угля, процесса, при котором уголь нагревается без доступа воздуха до температуры выше 1600°F (862°C).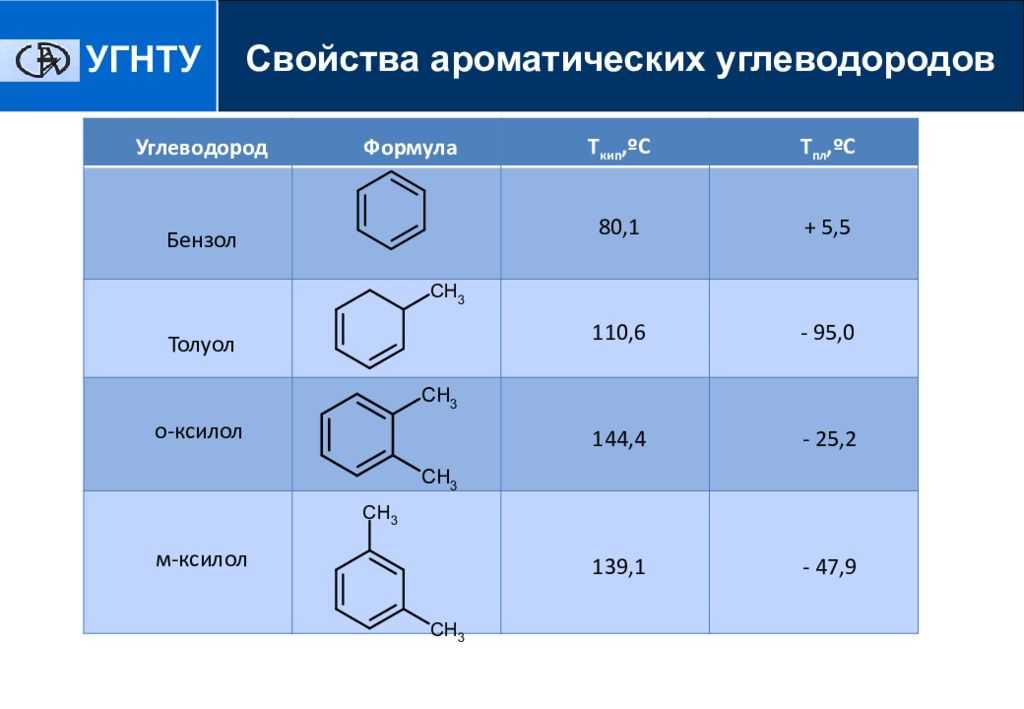 Бензол и толуол , два ароматических углеводорода, подобных ксилолу, образуются в одном и том же процессе. Каменноугольная смола оставалась источником ксилола до тех пор, пока промышленный спрос не превысил предложение. Позже были разработаны методы получения ксилола из переработка нефти , и сегодня нефть является основным источником.
Бензол и толуол , два ароматических углеводорода, подобных ксилолу, образуются в одном и том же процессе. Каменноугольная смола оставалась источником ксилола до тех пор, пока промышленный спрос не превысил предложение. Позже были разработаны методы получения ксилола из переработка нефти , и сегодня нефть является основным источником.
Три изомерных ксилола классифицируются по расположению метильных (CH 3 ) групп, замещающих атомы водорода в бензольном кольце. В каждом случае метильные группы заменяют два атома водорода, присоединенные к шестиуглеродному бензольному кольцу, но структура и химические свойства каждого изомера зависят от того, какие атомы водорода заменены. Ортоксилол (о-ксилол) имеет метильные группы на двух соседних атомах углерода в структуре бензольного кольца, в то время как в мета-ксилоле (м-ксилоле) метилсодержащие атомы углерода разделены водородсодержащим атомом углерода. В пара-ксилоле (п-ксилоле) два водородосодержащих атома углерода разделяют метилсодержащие атомы углерода, размещая метильные группы на противоположных концах молекулы.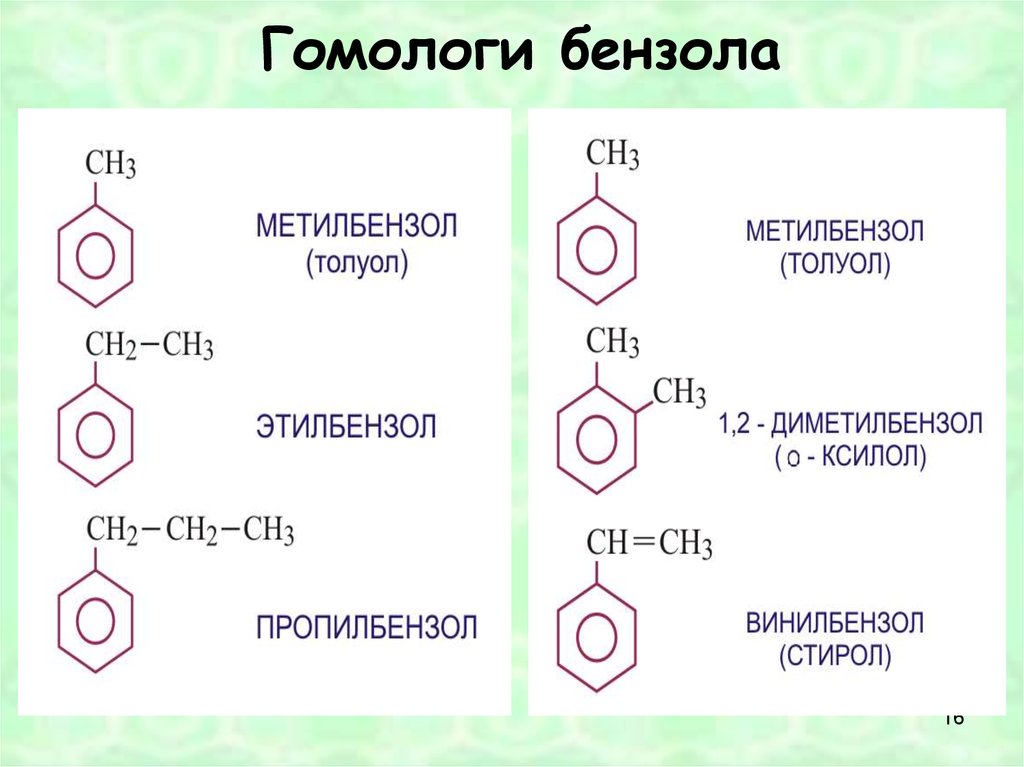 Ортоксилол, наименее летучий из трех форм, служит сырьем для изготовления покрытий и пластик . Пара-ксилол используется для производства полиэфиров. Мета-ксилол, менее полезный, чем другие формы, используется для изготовления покрытий, пластмасс и красителей. Коммерческая смесь ксилолов в виде бесцветной легковоспламеняющейся невязкой токсичной жидкости используется в качестве растворителя лаков и резиновых цементов. Эмульгированный ксилол использовался как экономичный и эффективный способ борьбы с водными сорняками в ирригационных системах , но необходимо тщательно контролировать концентрацию, чтобы не нанести вред растениям и рыбам, подвергшимся воздействию остатков.
Ортоксилол, наименее летучий из трех форм, служит сырьем для изготовления покрытий и пластик . Пара-ксилол используется для производства полиэфиров. Мета-ксилол, менее полезный, чем другие формы, используется для изготовления покрытий, пластмасс и красителей. Коммерческая смесь ксилолов в виде бесцветной легковоспламеняющейся невязкой токсичной жидкости используется в качестве растворителя лаков и резиновых цементов. Эмульгированный ксилол использовался как экономичный и эффективный способ борьбы с водными сорняками в ирригационных системах , но необходимо тщательно контролировать концентрацию, чтобы не нанести вред растениям и рыбам, подвергшимся воздействию остатков.
Летучесть ксилола приводит к тому, что он легко попадает в атмосферу . Если не соблюдать осторожность, его пары вскоре проникнут в воздух в лабораториях, где он используется. Хотя его растворимость в воде довольно ограничена, ксилол (наряду с бензолом и толуолом) классифицируется как один из основных компонентов «водорастворимой» фракции нефти. Широкое использование ксилола в производстве привело к значительным выбросам этого химического вещества в воздух и воду в окружающей среде 9.0011 . Токсичность ксилола в воде зависит от солености , температуры и присутствия других токсичных материалов. Он влияет на проницаемость клеток и действует как нейротоксин для рыб и других животных. При высоких концентрациях ксилола у рыб наблюдается ряд поведенческих изменений, включая беспокойство (быстрое и неустойчивое плавание), потерю равновесия, паралич и смерть. Хотя каждая из трех форм ксилола может быть детоксицирована микроорганизмами , пара-ксилол детоксицировать труднее, и поэтому он представляет более постоянную угрозу.
Широкое использование ксилола в производстве привело к значительным выбросам этого химического вещества в воздух и воду в окружающей среде 9.0011 . Токсичность ксилола в воде зависит от солености , температуры и присутствия других токсичных материалов. Он влияет на проницаемость клеток и действует как нейротоксин для рыб и других животных. При высоких концентрациях ксилола у рыб наблюдается ряд поведенческих изменений, включая беспокойство (быстрое и неустойчивое плавание), потерю равновесия, паралич и смерть. Хотя каждая из трех форм ксилола может быть детоксицирована микроорганизмами , пара-ксилол детоксицировать труднее, и поэтому он представляет более постоянную угрозу.
[ Дуглас К. Пратт ]
КНИГИ
Буйкема, Л., и А.С. Хендрикс. Бензол, ксилол и толуол в водных системах: обзор . Вашингтон, округ Колумбия: Американский нефтяной институт, 1980.
Хэнкок, Э. Г., изд. Толуол, ксилолы и их промышленные производные . Амстердам; Нью-Йорк: Elsevier, 1982.
Амстердам; Нью-Йорк: Elsevier, 1982.
Parmeggiani, L., изд. Энциклопедия охраны труда и техники безопасности . 3-е изд. Женева: Международное бюро труда, 19.83.
Уолш Д.Ф., изд. Остатки эмульгированного ксилола при борьбе с сорняками в воде и их влияние на радужную форель, Salmo gairdneri . Денвер, Колорадо: Министерство внутренних дел США [Бюро мелиорации, инженерно-исследовательский центр, отдел общих исследований, отделение прикладных наук], 1977.
Encyclopedia Encyclopedia Pratt, Douglas C.
oxford
просмотров обновлено 21 мая 2018
ксилол ( C 6 H 4 (CH 3 ) 2 ) Органическое химическое соединение, полученное из дистиллятов каменноугольной смолы и нефти и важное в качестве растворителя. Химически это диметилбензол, который существует в трех изомерных формах: орто-, мета- и пара-ксилол. Изомеры имеют разные физические свойства.
Изомеры имеют разные физические свойства.
Всемирная энциклопедия
Оксфорд
просмотра обновлено 11 июня 2018 г.
xy·lene / ˈzīˌlēn/ • н. хим. летучий жидкий углеводород, C 6 H 4 (CH 3 ) 2 , получаемый путем перегонки древесины, каменноугольной смолы или нефти и используемый в качестве топлива и растворителей, а также в химическом синтезе.
Оксфордский карманный словарь современного английского языка
oxford
просмотра обновлено 11 июня 2018 г. жидкость, используемая для повышения прозрачности тканей, подготовленных для микроскопического исследования после их обезвоживания.
Словарь медсестер
Оксфорд
просмотра обновлено 08 июня 2018 г.
ксилолы См. диметилбензолы.
диметилбензолы.
Биологический словарь
Что такое ксилол?
Ксилол технически является не одним, а тремя изомерами диметилбензола и может относиться к любой комбинации этих трех изомеров. Изомеры ксилола представляют собой бесцветные легковоспламеняющиеся жидкости, находящие широкое применение в промышленности. Эти изомеры имеют одинаковую химическую формулу, и хотя все они также имеют центральное бензольное кольцо с двумя метильными группами, присоединенными в качестве заместителей, их химическая структура на самом деле немного отличается.
В этом посте:
Ксилол относится либо к одному из изомеров диметилбензола, либо к смеси изомерных соединений. Он естественным образом содержится в сырой нефти в небольшом количестве около 0,5-1%, в зависимости от источника сырой нефти. Он также содержится в очень небольших количествах в бензине и авиационном топливе.
В промышленных масштабах ксилол можно производить в процессе каталитического риформинга, а также путем карбонизации угля при производстве коксового топлива. С другой стороны, промышленное производство ксилолов осуществляется путем добавления метильных групп к толуолу и бензолу. Ксилолы лабораторного качества, используемые в коммерческих целях, содержат 40-65% м-ксилола и до 20% о-ксилола, п-ксилола и этилбензола.
С другой стороны, промышленное производство ксилолов осуществляется путем добавления метильных групп к толуолу и бензолу. Ксилолы лабораторного качества, используемые в коммерческих целях, содержат 40-65% м-ксилола и до 20% о-ксилола, п-ксилола и этилбензола.
В зависимости от типа изомера и смеси изомеров физические и химические свойства ксилола различаются. Например, его температура плавления может варьироваться от -47,87 ° C для м-ксилола до 13,26 ° C для п-ксилола. Вот некоторые основные свойства различных изомеров:
1,2-диметилбензол (о-ксилол)
- Плотность и фаза: 0,88 г/мл, жидкость
- Температура кипения: 144 °C
- 0,18 Вязкость2: сП при 20 °С
- Температура воспламенения: 17 °C
1,3-диметилбензол (м-ксилол)
- Плотность и фаза: 0,86 г/мл, жидкость
- Температура кипения: 138 1sc 2c 901: 901: сП в 20 °C
- Температура воспламенения: 25 °C
1, 4-диметилбензол (п-ксилол)
- Плотность и фаза: 0,86 г/мл, жидкость 1 Вязкость 18°С 90°С 93 состав: 0,34 сП при 30 °C
- Температура воспламенения: 25 °C
Все эти изомеры полярны, что делает их практически нерастворимыми в воде. Они также легко воспламеняются, потому что имеют относительно низкую температуру воспламенения. Температура вспышки любой летучей жидкости — это самая низкая возможная температура, при которой ее пары могут воспламениться от источника воспламенения, например, от пламени свечи.
Они также легко воспламеняются, потому что имеют относительно низкую температуру воспламенения. Температура вспышки любой летучей жидкости — это самая низкая возможная температура, при которой ее пары могут воспламениться от источника воспламенения, например, от пламени свечи.
Химическая формула ксилола (CH 3 ) 2 C 6 H 4 , и она одинакова для всех трех изомеров. Каждая молекула изомера имеет бензольное кольцо и две присоединенные к нему метильные группы. Основное различие между различными химическими структурами заключается в расположении метильных групп, как показано на диаграмме ниже:
Обозначения орто- (о-), мета- (м-) и пара- (п-) для ксилола описывают расположение двух метильных групп, т. е. к каким атомам углерода бензольного кольца они присоединены.
Каково применение ксилола?От использования в качестве прекурсоров в производстве пластиков из полиэтилентерефталата (ПЭТФ) до лабораторных растворителей для удаления синтетических иммерсионных масел с объективов микроскопа, ксилолы имеют широкий спектр промышленных и коммерческих применений:
- Прекурсоры полимеров
Пластиковые бутылки обычно изготавливаются из экструдированного или формованного полиэтилентерефталата (ПЭТФ).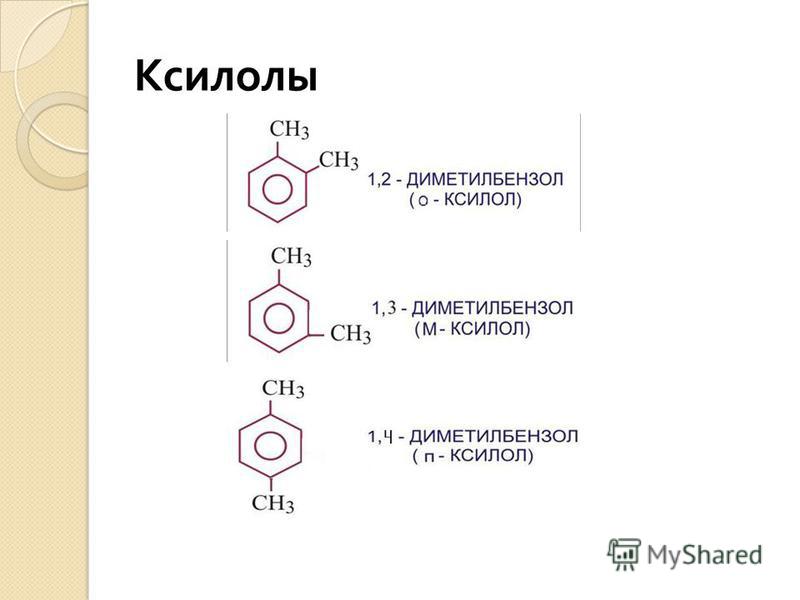 Пластиковые полимеры и полиэфирные ткани получают из мономеров терефталевой кислоты и диметилтерефталата. Изомер 1,4-диметилбензол, также известный как п-ксилол, необходим для производства этих мономеров, поскольку он используется в качестве предшественника для производства полимеров. Фактически таким образом используется примерно 98% всего производства п-ксилола.
Пластиковые полимеры и полиэфирные ткани получают из мономеров терефталевой кислоты и диметилтерефталата. Изомер 1,4-диметилбензол, также известный как п-ксилол, необходим для производства этих мономеров, поскольку он используется в качестве предшественника для производства полимеров. Фактически таким образом используется примерно 98% всего производства п-ксилола.
Около половины всех производимых ксилолов используется в промышленном производстве пластмасс и полимерных тканей. Например, 1,2-диметилбензол, также известный как о-ксилол, используется в качестве предшественника фталевого ангидрида, который является еще одним важным химическим веществом, используемым в крупномасштабном производстве пластмасс, поскольку он снижает вязкость и увеличивает гибкость полимеров.
- Коммерческий растворитель
Ксилолы также используются в качестве растворителей и наиболее эффективны в этом случае, когда изомеры смешиваются друг с другом. При использовании в качестве растворителя в смесь также добавляют небольшое количество этилбензола. Этот вид растворителя бесцветен, легко воспламеняется и сладко пахнет.
При использовании в качестве растворителя в смесь также добавляют небольшое количество этилбензола. Этот вид растворителя бесцветен, легко воспламеняется и сладко пахнет.
Ксилоловый растворитель используется в различных отраслях промышленности, таких как полиграфия, производство резины и обработка кожи. Таким образом, он является важным компонентом чернил, резины и различных клеев. В качестве неполярной смеси ксилоловый растворитель также отлично растворяет неполярные вещества, такие как краски и лаки. Вот почему его часто используют в качестве разбавителя. Если вам нужно медленно высушить краску, ксилоловый растворитель можно использовать даже вместо толуола. Это делает его очень полезным в работах по консервации и реставрации произведений искусства, где его используют для проверки растворимости красок, используемых на произведениях искусства.
- Чистящее средство
Ксилол используется в качестве чистящего средства в различных областях, от стоматологии и электроники до нефтяной промышленности. Он очень полезен в качестве чистящего средства для стали и электронных компонентов, таких как интегральные схемы и кремниевые пластины, потому что он не повреждает поверхность, на которой он используется. Ксилол также находит применение в стоматологии, где он используется для растворения гуттаперчи, материала для лечения корневых каналов.
Он очень полезен в качестве чистящего средства для стали и электронных компонентов, таких как интегральные схемы и кремниевые пластины, потому что он не повреждает поверхность, на которой он используется. Ксилол также находит применение в стоматологии, где он используется для растворения гуттаперчи, материала для лечения корневых каналов.
Между тем, нефтяная промышленность использует ксилол в качестве компонента растворителей парафина для трубок, забитых парафином. Его эффективность в растворении серы также делает его полезным ингредиентом в косметических продуктах для удаления чрезмерного количества ушной серы или ушной серы.
Ксилол вызывает коррозию? Хотя ксилолы являются эффективными растворителями с превосходной растворяющей способностью, на самом деле они не вызывают коррозию. Коррозия – это химическая реакция, вызывающая разрушение или образование новых соединений посредством окислительных процессов. Коррозионные вещества вызывают коррозию или окисление других веществ, включая металлы и органические соединения или биологические ткани.
Коррозионные вещества могут быть такими элементами, как кислород в O 3 (т. е. в форме озона) или соединения, особенно кислот, оснований и ионных растворов. Хотя ксилолы могут растворять неполярные органические соединения, они обычно не вступают в химическую реакцию с другими веществами в нормальных условиях. Поэтому ксилолы не считаются коррозионно-активными. С другой стороны, они могут быть преобразованы в кислоты, такие как монокарбоновые кислоты (толуиловые кислоты) и дикарбоновые кислоты (фталевые кислоты) при окислении, которые являются коррозионными веществами.
Однако то, что он не вызывает коррозии, не означает, что ксилол не опасен. Как и другие углеводороды, ксилолы токсичны и опасны для здоровья. Если вы вдыхаете его пары в небольших количествах, вы можете почувствовать головокружение, тошноту, сонливость и головную боль. Если вы подвергаетесь воздействию большого количества паров, серьезные симптомы включают сонливость, нарушение координации движений мышц, нерегулярное сердцебиение и потерю сознания. Если не оказать медицинскую помощь, воздействие паров ксилола может даже привести к летальному исходу.
Если не оказать медицинскую помощь, воздействие паров ксилола может даже привести к летальному исходу.
Кроме того, жидкий ксилол может вызвать болезненное ощущение жжения на коже и повредить глаза при контакте. Пары также слегка раздражают слизистые оболочки, глаза, легкие и кожу. Не обнаружено никаких доказательств того, что ксилолы являются канцерогенными, несмотря на присутствие бензольной группы. Таким образом, хотя по определению это не коррозионное вещество, всегда соблюдайте меры предосторожности при работе с ксилолом.
Отказ от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте.
