Тайна стекла

Как это все же удивительно — ученые совершенно ясно представляют себе структуру сложнейших синтетических пластмасс в то время, как «устройство» древнейшей пластмассы — стекла остается белым пятном на карте наших знаний! Человек сумел расщепить атом урана, разгадать генетический код, выйти в космос, но у него пока не хватает знаний для того, чтобы разобраться в сущности стекловидного состояния вещества.
Кристалл или не кристалл
Науке пока не удалось найти такую схему, в которую «вмещались» бы все стекла, которая объясняла бы все возможности их состояния. Мы знаем; что стекло — это твердое вещество, получившееся в результате охлаждения расплава. Но оно перешла в твердое состояние как-то «неправильно», не согласуясь с нашими представлениями о затвердевании жидкостей. В стекле нет «решетки», характерной для кристаллических веществ. Мы не находим в нем регулярного повторения одних и тех же структурных элементов? В то же время полного хаоса в массе стекла тоже нет, оно изотропно, его средняя структура одинакова во всех направлениях. Сложность проблемы усугубляется еще тем, что различные стекла имеют самый различный химический состав и «умудряются» при это обладать весьма похожими свойствами.
Существующие взгляды на структуру стекла можно разделить на две большие группы. У каждой из них есть свои защитники и противники. Нужно помнить, однако, что работы в этой области еще далеко не закончены и что всякое схематическое деление влечет с собою опасность излишне упростить проблему. (К слову о стекле, этот товар издревле был весьма необычным и имел особые требования к качеству и прочности, разумеется, в былые времена люди не могли просто так почитать в интернете отзывы о товарах как могут сделать сегодня, скажем на сайте http://ask-why.ru/otzivi/, поэтому для проверки качества стеклянных изделий купцы средневековья имели с собой чуть ли не маленькую передвижную химическую лабораторию).
Почти классическая теория
Во главе первого лагеря стоит В. Захарпасен, выдвинувший теорию «деформированной решетки». Эта, ставшая уже почти классической, теория предполагает, что в стекле все-таки есть решетка — непрерывная система взаимосвязанных анионов и катионов. Основа такой решетки — тетраэдр кремнекислоти или ее стеклообразующей модификации. По Захарпасену, тетраэдры расположены так, что возникают «пустоты», которые у многокомпонентных стекол заполняются катионами других элементов. При медленном застывании стекла именно эти элементы, затвердевающие первыми, становятся центрами, вокруг которых располагаются тетраэдры стеклообразующей кремнекислоты.
Захарпасен считает, что без решетки невозможна упорядоченная структура сложного вещества. «Но чем же объяснить все аномалии стекла?» — спрашивают противники «почти классической» теории. Почему при переходе стекла из пластического состояния в твердое отсутствует характерный для всех других веществ «скачок», вызываемый кристаллизацией? Захарпасен и его сторонники призвали на помощь теоретическое представление о «неправильности» структурной решетки в стекле. Возьмите кристаллический кварц, говорят они, каждый тетраэдр кремнекислоти в нем расположен в строгом согласии с другими. Но превратите кварц в стекло, и решетка окажется «деформированной», отдельные тетраэдры в ней уже не будут правильно ориентированы один относительно другого. К сожалению подобная «модель» не могла объяснить многих экспериментальных фактов многих свойств стекла, и в итоге пришлось отказаться от деформированной решетки да и от решетки вообще.
«Намек» на кристаллизацию
Ученый академик А. А. Лебедев с самого начала выбрал другой путь. Он представляет себе стекло как аморфное вещество, у которого, однако, есть «намек» на кристаллизацию. Процесс остановился на стадии микрокристаллических образований, в которых настоящая кристаллическая решетка проявляется лишь частично. Эти структурные элементы Лебедев назвал «кристаллитами» — неполными, несовершенными кристаллами, которые собраны в конгломераты, составляющие основу всей структуры стекла.
Ученики Лебедева дополнили его теорию многочисленными опытами. Американские исследователи нашли, что кристаллитная теория Лебедева объясняет многие явления, не объяснимые теорией Захарпасена. Но в дальнейшем американцы столкнулись с фактами, идущими вразрез и с той и с другой теорией. Сейчас исследования продолжаются — ученые ищут общую концепцию, пригодную для всех видов стекла, для всех его свойств и во всех условиях, но эта концепция еще не родилась.
У стекла есть одно свойство — оно известно уже много столетий,— которое могло бы оказаться ключом к разгадке структуры. Стекло — это некристаллическое вещество, но у него есть склонность к кристаллизации, образно говоря, «желанно» кристаллизоваться. Способность к кристаллизации подавлена в момент перехода в твердое состояние, но в благоприятных условиях может проявиться, как только получит к этому стимул. Можно сказать, что в стекле имеются «революционные напряжения», направленные к созданию внутреннего порядка. Благоприятные условия для «революционной» перестройки структуры может создать определенная температура: область, в которой стекло окончательно кристаллизуется, стеклоделы называют критической, а сам процесс кристаллизации — расстекловыванием, или девитрификацией.
Неожиданный союзник
Девитрификация является кошмаром для каждого директора стекольного завода. Прекрасная, прозрачная, аморфная стекломасса заполняется кристалликами, «камешками», которые превращают стекло в брак.
Девитрификаци считалась вредной много столетий. Но, как это уже не раз бывало в других областях техники, стеклоделы научились управлять своим «врагом», научились использовать его в своих интересах. Так родилась технология «управляемой рекристаллизации». Этот процесс по аналогии с каталитическим синтезом (аналогии, впрочем, не совсем точной) иногда называют каталитическим центрообразованием. Катализатором, вызывающим лавину, является очень малое количество некоторых элементов, добавленное к расплаву. При определенных температурах они создают в аморфном веществе центры кристаллизации, и это приводит к образованию решетки.
Тверже стали, легче алюминия
В результате термической обработки в присутствии центрообразователей стекло перестает быть стеклом. Оно превращается: в вещество с удивительными механическими свойствами. Называют это вещество по-разному — «ситалл», «стеклокерамика» или «пирокерам».
Ситаллы называют материалом будущего, но уже сегодня они находят применение в промышленности. Они незаменимы там, где нужны износостойкие и особо легкие детали машин, работающие в тяжелых условиях, где нужен материал легко формирующийся и очень прочный. Ситаллы используют также для сварки стеклянных изделий, например, кинескопов, работающих в условиях глубокого вакуума. Область применения ситаллов поистине безгранична — от кухни (жаропрочная посуда) до космических кораблей. Вскоре мы, по-видимому, совсем привыкнем к управляемой рекристаллизации и забудем, что у его истоков стоял такой высокотеоретический вопрос — решетка Захарпасена или кристаллит Лебедева.
Продолжение следует.
Автор: Ярослав Марка.
www.poznavayka.org
Почему стекло — это жидкость? 🚩 Естественные науки
Если быть точным, то не застывшая, а переохлажденная. Поскольку стекло сохраняет основные свойства жидкости даже в привычном твердом состоянии. Вполне понятны возражения – мол стекло не течет! Все очень просто при комнатной температуре оно почти не течет, вернее течет, но крайне медленно, но стоит его только нагреть, движение сразу станет наглядным.
Нагревание стекла или изделия из него до температуры 600 — 900 градусов полностью меняет его свойства. Стекло становится мягким и пластичным, что позволяет придавать ему любую форму.
Это свойственно всем аморфным веществам, к которым относится и стекло, также в эту категорию можно включить все смолы как натуральные, так и искусственные, различные клеи, резину отдельные виды пластических масс.
Разумеется, существует разница в температурах, при которых эти вещества теряют твердость, но принцип везде одинаков.
Главное отличие аморфных веществ от кристаллических, в том, что аморфные не имеют упорядоченной кристаллической решетки. Сохраняя структуру ближних связей, аморфное вещество не имеет дальнего порядка расположения атомов и молекул. Таким образом, для аморфных тел типична изотропия свойств и отсутствие определенной точки плавления. То есть по мере повышения температуры аморфные тела постепенно размягчаются и незаметно переходят в жидкое состояние.
Отсюда следует, что кристаллическое тело отличается от жидкости не только и не столько количественно, но и главным образом качественно. То есть аморфное тело смело можно рассматривать как жидкость с бесконечно большой вязкостью.
Как человечество познакомилось со стеклом и когда научилось его вырабатывать, узнать уже невозможно. Очевидно, что знакомство это началось с природных аналогов стекла — обсидианов и тектитов.
Известно лишь, что самым древним из найденных на сегодня изделий из рукотворного стекла считается светло-зеленая бусинка размером 9х5,5 мм, обнаруженная в окрестностях города Фивы датируемая 35 годом до н.э.
У Плиния находится и предание о том, как появилось стекло, будто торговцы содой, причалив к берегу, принялись готовить обед. Поскольку они не отыскали подходящих камней, им пришлось подпереть котлы кусками соды — и спустя некоторое время сода разогрелась и смешалась с речным песком. Появилась незнакомая ранее жидкость. Несмотря на то, что попытки повторить опыт оказались безуспешными, предание продолжает жить.
Скорее всего, стекло было получено людьми как побочный продукт при выплавке меди.
www.kakprosto.ru
Структура, свойства и технология стекла. Структура стекла.
На первый взгляд, термин «структура стекла» может показаться нелепым. Как могут вещества, по определению не имеющие дальнего порядка и периодической структуры, обладать структурой, характерной для конкретного состава? В то же время известно, что свойства трех разных образцов стекла одного состава, полученных независимо в трех разных лабораториях и отожженных в одном режиме, в разумных пределах будут одинаковыми. Фундаментальные знания о строении твердого тела позволяют предсказать, что такие стекла обладают если не идентичными, то очень похожими структурами. Следовательно, отсутствие дальнего порядка и периодичности не исключает существование структуры на том уровне, который определяет свойства вещества.
Прежние дискуссии о строении стекла были посвящены в основном силикатным стеклам, особенно стеклообразному оксиду кремния и щелочносиликатным стеклам. Первые модели структуры стекол основывались на структурах кристаллов силикатов. Согласно микрокристаллической гипотезе, стекла рассматривались как совокупность очень мелких кристаллов или микрокристаллов. Малыми размерами кристаллов объясняли отсутствие структуры на рентгеновских дифрактограммах. Лебедев и другие русские ученые отдавали предпочтение другой версии микрокристаллической модели, которую они назвали кристаллитной моделью. По этой гипотезе, кристаллиты отличаются от микрокристаллов тем, что их структуры деформированы, т.е. нарушена пространственная решетка; и кристаллиты нельзя рассматривать как очень маленькие кристаллы. Предполагается, что стекло состоит из кристаллитов, связанных между собой аморфными участками (напоминающими границы зерен). Средний состав стекла определяют с учетом концентрации двух или более соответствующих кристаллических фаз, чьи составы находят по фазовой диаграмме изучаемой системы.
Большинство современных структурных моделей стекла, объединенных в так называемую теорию неупорядоченной сетки, основано на идеях Захариасена. Изначально его работа, уже ставшая классической, предназначалась не для обсуждения структурных моделей, а для объяснения склонности веществ к стеклообразованию, и как таковой термин «неупорядоченная сетка» не применялся. В результате широкого использования и дальнейшего развития идеи Захариасена превратились в правила Захариасена для стекло-образования, и в настоящее время применяются для обоснования структурных моделей стекла. Эти правила, дополненные тремя правилами для более сложных систем, просто формулируют условия образования бесконечной трехмерной сетки, но ничего не говорят о степени ее упорядоченности. Фактически, они достаточно точно описывают структуры многих кристаллических фаз, особенно тех, что характерны для силикатных систем.
Правила Захариасена для стеклообразования в простых оксидах
1) Каждый атом кислорода связан не более чем с двумя катионами.
2) Координационное число сеткообразующего катиона по кислороду мало.
3) Кислородные полиэдры связаны только вершинами, но не ребрами или гранями.
4) Для образования трехмерной сетки должны быть связаны по крайней мере три вершины каждого кислородного полиэдра.
Дополнительные правила для сложных стекол
5) Процентное содержание сеткообразующих катионов, окруженных тетраэдрами или треугольниками из атомов кислорода, должно быть высоко.
6) Тетраэдры или треугольники связаны между собой только вершинами.
7) Некоторые атомы кислорода связаны только с двумя катионами-сеткообразователями и не образуют никаких других связей.
Модель Захариасена позволяет описывать сеточные структуры независимо от того, относятся они к стеклам или нет. В нее было внесено дополнение, согласно которому стеклообразование происходит в результате искажения сетки, нарушения дальнего порядка и периодичности на больших расстояниях. Такие искажения могут достигаться за счет изменения длин связей или валентных углов и вращения структурных единиц вокруг собственных осей.
Структурные модели силикатных стекол
Обсуждения структурных моделей оксидных стекол почти всегда начинают со стеклообразного оксида кремния и щелочносиликатных стекол. Модели большинства других стекол на основе оксида кремния являются производными от моделей этих систем, как и большинство применяющихся терминов.
Стеклообразный оксид кремния
Структурная модель стеклообразного оксида кремния легко описывается правилами Захариасена. Основной структурной единицей, образующей сетку, является кремниевокислородный тетраэдр. Координационное число по О равно четырем, что соответствует второму правилу Захариасена. Эти тетраэдры имеют высокую степень внутреннего порядка, что обеспечивает ближний порядок структуры стекла. Тетраэдры объединяются через все четыре вершины (правила 3 и 4), образуя бесконечную трехмерную сетку. Каждый атом кислорода связан с двумя атомами кремния, которые находятся в центрах связанных тетраэдров. Нарушение порядка в такой структуре происходит за счет изменения угла между соседними тетраэдрами. Дополнительное разупорядочение вносится благодаря возможности вращения соседних тетраэдров вокруг центра, занятого атомом кислорода, связывающим тетраэдры, и вокруг одной из связей Si-О. Поскольку угол Si-О-Si и углы поворота характеризуются распределением, а не единственным значением, как в кристаллической решетке, дальний порядок в стеклообразных веществах отсутствует.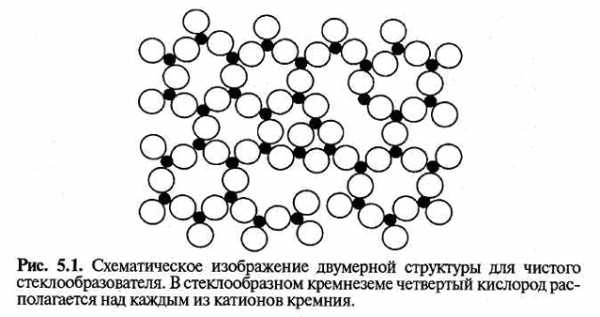
Двумерное изображение такой структуры представлено на рис. 5.1. Четвертый кислород, расположенный непосредственно над маленьким ионом кремния, не показан. Отметим, что в структуре присутствуют кольца, состоящие из трех или большего числа тетраэдров, и полости разных размеров и форм.
Дифракционными методами установлено, что минимальное расстояние Si-O в структуре кремнезема составляет приблизительно 0,162 нм, а минимальное расстояние О…О приблизительно 0,265 нм. Эти значения согласуются с соответствующими величинами для кристаллического кремнезема и силикатных минералов. Возможны только незначительные колебания этих величин, что доказывает высокую степень порядка на коротких расстояниях в пределах основного строительного блока — тетраэдра. Изменение расстояния между атомами кремния, находящимися в центрах связанных тетраэдров, обусловлено изменениями угла Si-O-Si, в среднем оно составляет 0,312 нм. Значительно более широкое распределение расстояний обнаружено для пар атомов кремний — второй кислород (приблизительно 0,415 нм) и кислород — второй кислород (приблизительно 0,51 нм).
Эти распределения межатомных расстояний обусловлены распределением углов Si—О—Si. Область изменения угла Si-О-Si охватывает значения от 120 до 180 °, максимум распределения приходится на приблизительно 144°. Распределение достаточно узкое, большинство углов отличается не более чем на ±10% от данного значения. Из-за ограниченности экспериментальных данных точное распределение значений углов может быть предметом разногласий, однако это общее описание оказывается адекватным для основных особенностей структуры стеклообразного кремнезема.
В стеклообразном кремнеземе существуют области сильно сжатых связей и дефекты типа кислородных вакансий, образованные связями Si-Si, а также дефекты, представляемые связями Si-О-O-Si. Кроме того, встречаются дефекты, вызванные внедрившимися примесями, особенно водородсодержащими частицами типа SiOH и SiH.
Щелочносиликатные стекла
Щелочносиликатные стекла с высоким содержанием щелочных оксидов можно легко получить плавлением оксида кремния со щелочными карбонатами или нитратами. Из-за высокой вязкости стекла, содержащие менее 10 мол.% оксида щелочного металла, расплавить значительно труднее. В литиевых и натриевых силикатных системах наблюдается метастабильная несмешиваемость. Пределы несмешиваемости простираются до 33 мол.% в литиевосиликатной системе и до 20 мол.% в натриевосиликатной системе.
Если исключить области несмешиваемости, то добавление к кремнезему любого щелочного оксида для образования двухкомпонентного стекла приводит к значительному снижению вязкости расплава (на много порядков) и температуры перехода в стеклообразное состояние (-500 К). Плотность, показатель преломления и коэффициент термического расширения стекол возрастают с увеличением содержания щелочного оксида и ростом атомного номера (массы) соответствующего щелочного металла. Электропроводность щелочносиликатных стекол, возникающая за счет диффузии ионов щелочных металлов, возрастает на несколько порядков с увеличением количества щелочного оксида.
Эти закономерности в изменении свойств обусловлены образованием немостиковых атомов кислорода, которые снижают связность расплава. Структуру можно рассматривать как сетку из кремниевокислородных тетраэдров со случайными обрывами, которые обусловливают образование немостиковых атомов кислорода. Каждый немостиковый атом кислорода должен быть связан с близлежащим щелочным ионом, чтобы обеспечить локальную нейтральность. Эти щелочные ионы занимают пустоты в структурной сетке и уменьшают свободный объем структуры. Концентрация немостиковых атомов кислорода увеличивается, а мостиковых атомов кислородов снижается пропорционально концентрации щелочного оксида, до тех пор пока сохраняется сетка. Двумерное изображение такой структуры, содержащей наряду со щелочными и щелочноземельные ионы, представлено на рис. 5.2.
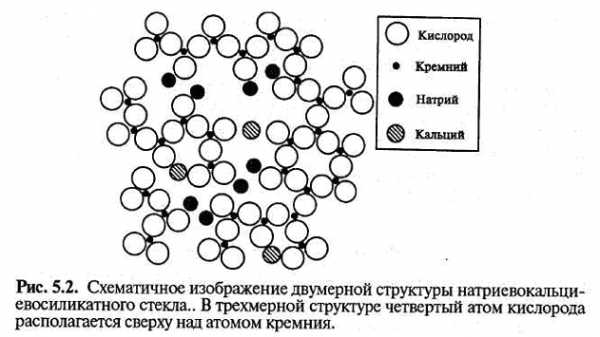 Щелочнощелочноземельносиликатные стекла
Щелочнощелочноземельносиликатные стеклаСтекла тройной системы, содержащей оксид кремния, щелочноземельные и щелочные оксиды, называют содоизвестковосиликатными. Они обычно содержат 10—20 мол.% щелочного оксида, главным образом Na2O (соду), 5—15 мол.% щелочноземельного оксида, в основном СаО (извести), и 70—75 мол.% оксида кремния. Во многих случаях часть соды заменяют на К2О, реже — на Li2О.
Простая модель щелочнощелочноземельносиликатных стекол в основном похожа на модель щелочносиликатных стекол.
Структурные модели боратных стекол
Принятая в настоящее время модель структуры стеклообразного оксида бора значительно отличается от модели стеклообразного оксида кремния. В кристаллических веществах бор встречается как в тригональной, так и в тетраэдрической координации по кислороду. Считается, что в стеклообразном оксиде бора его атомы находятся в тригональном окружении. Треугольники объединяются через мостиковые атомы кислорода всеми своими вершинами и образуют полностью связанную сетку. Однако, поскольку ее основной строительный блок не трехмерный, а плоский, трехмерная сетка, как в случае связанных тетраэдров, не возникает. Трехмерная структура появляется в результате деформации сетки, подобно тому как двумерный рисунок, выполненный на листе бумаги, становится трехмерным, если бумагу скомкать. Поскольку первоначально связи существовали только в плоскости, то связи в третьем измерении (в данном случае ван-дер-ваальсовы) очень слабые, и структура легко разрушается. Этим обусловлена низкая по сравнению с кремнеземом температура перехода в стеклообразное состояние, которая составляет всего 260 °С (для SiO2 Tg=1100 °С). Стеклообразный оксид бора, как полагают, содержит значительное количество промежуточных структурных групп, которые состоят из трех борокислородных треугольников, образующих так называемые бороксольные циклы или бороксольные группы. Они достаточно хорошо изучены. Эти структурные группы связаны через атомы кислорода так, что угол В-О-В может изменяться, при этом происходит скручивание и отклонение от плоскости бороксольной группы (рис. 5.4).
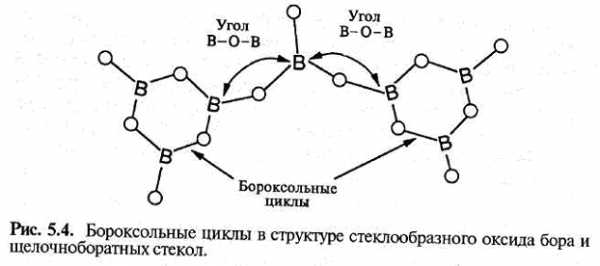
Источник: «Структура, свойства и технология стекла» Дж.Шелби
lenaborodulina.livejournal.com
Российский химико-технологический университет им. Д.И.Менделеева
Курсовая работа
по материаловедению на тему:
«Стекла. Классификация. Свойства. Области применения».
Выполнил: | |
| Проверил: |
Москва 2008г.
Содержание:
Введение…………………………………………………..…2
Строение стекла……………………………………….…..2
Кристаллохимическое описание строения стекол……3
Свойства стекол……………………………………………7
Классификация стекол…………………………………….9
Применение стекол……………………………………….11
Список используемой литературы……………………..16
Введение
Вещества в твердом состоянии при обычной температуре и давлении могут иметь кристаллическое или аморфное строение. В природе наиболее распространены кристаллические твердые вещества, для структуры которых характерен геометрически строгий порядок расположения частиц (атомов, ионов) в трехмерном пространстве. Кристаллическое состояние является стабильным при обычных условиях и характеризуется наиболее низкой внутренней энергией. Твердые кристаллические вещества имеют четкие геометрические формы, определенные температуры плавления, в большинстве случаев проявляют анизотропию, т.е. их физические свойства (показатель преломления, теплопроводность, скорости растворения и роста кристаллов и др.) неодинаковы при измерении в различных направлениях.
Стеклообразное состояние вещества представляет собой аморфную разновидность твердого состояния. Стеклообразное состояние является метастабильным, т. е. характеризуется избытком внутренней энергии. Пространственное расположение частиц вещества, находящегося в стеклообразном состоянии, является неупорядоченным, что подтверждается результатами рентгеноструктурных исследований.
Согласно законам химической термодинамики переход веществ из стеклообразного состояния в кристаллическое должен осуществляться самопроизвольно, однако высокая вязкость твердых веществ делает невозможным поступательное движение частиц, направленное на перестройку структуры. В твердых телах частицы совершают только колебательные движения относительно положения равновесия.
Строение стекла
Физические свойства веществ зависят от их состава и строения. Строение стекол является одним из разделов единой проблемы строения вещества. В связи с этим необходимо подчеркнуть, что современные представления о строении стекла базируются на фундаментальных положениях теоретических разделов неорганической и физической химии, кристаллохимии, химии и физики твердого состояния, и, кроме того, включают идеи и обобщенные положения отдельных гипотез строения стекла, основу которых составляют эмпирические зависимости свойств от состава и строения.
Отсутствие прямых методов исследования аморфных веществ, отсутствие способов плоскостного изображения объемно неупорядоченных структур пока не позволяют создать завершенную теорию строения стекла.
Существует несколько теоретических направлений решения проблемы строения стекла, среди которых наиболее широкое распространение получили кристаллохимическое и валентно-химическое. Они рассматривают строение стекла на электронном, атомном или молекулярном уровнях, базируясь на основных положениях кристаллохимии, теорий химической связи, зонного строения твердых тел . Преимущественное развитие этих направлений обусловлено в первую очередь прогрессом в области изучения структуры веществ, находящихся в кристаллическом состоянии. Следует отметить, что основополагающие гипотезы строения стекла А. А. Лебедева (1921) и Захариасена (1931) появились вскоре после открытия прямого метода изучения структуры кристаллов—метода рентгеноструктурного анализа (Лауэ, 1912). Менее распространены представления о полимерном строении стекол, кинетический подход к процессам твердения расплавов в виде стекла, а также представления о строении стекол на основе концепций о строении жидкостей или расплавов.
Учитывая сложность и многоплановость вопроса строения стекла, ограничимся рассмотрением основных положений кристаллохимического и валентно-химического направлений, иллюстрируя их конкретными примерами строения силикатных стекол по мере усложнения их состава — от простейшего по составу однокомпонентного кварцевого стекла до двух-, трех- и многокомпонентных составов промышленных стекол.
Кристаллохимическое описание строения стекол
В основе данного описания лежат понятия ближнего и дальнего порядка в структуре веществ. Ближний порядок в общем случае, означает правильное расположение отдельных атомов относительно некоторого фиксированного атома. Для оксидных стекол ближний порядок характеризует расположение атомов кислорода относительно катионов. Например, атомы кремния всегда окружены четырьмя атомами кислорода. Координационные группировки [SiО2]4 сохраняются в расплавленном, кристаллическом или стеклообразном состояниях диоксида кремния. Это означает, что в структуре стекла сохраняется ближний порядок в расположении анионов относительно катионов кремния, характерный для координационной структуры кристаллов.
Дальним порядком называется строго периодическое и последовательное расположение атомов или группировок из атомов в пространстве, которое обусловливает образование единой трехмерной решетки.
Если для кристаллических структур характерно наличие ближнего и дальнего порядков, то особенность строения стекол состоит в том, что в их структуре имеется ближний порядок, но отсутствует дальний порядок в расположении координационных групп атомов. Отсутствие дальнего порядка в структуре характерно для жидкостей и аморфных тел.
Основными элементами структуры силикатных стекол являются тетраэдры [SiО4]4, которые, соединяясь, друг с другом вершинами, способны образовывать непрерывную в одном, двух, или трех измерениях пространственную структуру (структурную сетку по Захариасену).
Протяженность сетки определяется содержанием в составе стекла диоксида кремния. Апериодическую сетку, образующуюся путем сочленения координационных полиэдров вершинами, можно рассматривать как анион сложного состава. Компоненты стекла, способные самостоятельно образовывать структурную непрерывную сетку, такие, как SiO2, и другие, принадлежат к группе стеклообразователей. Компоненты стекла, не способные самостоятельно образовывать структурную непрерывную сетку, называются модификаторами. К группе модификаторов, как правило, принадлежат оксиды элементов первой и второй групп периодической системы, а также некоторых элементов других групп.
Катионы модификаторов располагаются в свободных полостях структурной сетки, компенсируя избыточный отрицательный заряд сложного аниона. Кислородное окружение катионов модификаторов формируется в соответствии с их координационными требованиями. Прочность связи модификатор — кислород значительно ниже прочности связи стеклообразователь — кислород, поэтому модификаторы не образуют прочных координационных групп.
Координационное число катиона модификатора в стекле представляет собой некоторое среднестатистическое число атомов кислорода, приходящееся на один атом модификатора. В отличие от геометрически правильных группировок координационных полиэдров стеклообразователей координационные группировки модификаторов могут не иметь геометрически правильной фигуры.
В структуре стекла различают два возможных состояния атомов кислорода: атомы, соединяющие соседние полиэдры, называют мостиковыми, а соединяющие катионы модификаторов со сложным анионом, называют немостиковыми.
Кварцевое стекло
Структурной основной единицей кварцевого стекла является кремнекислородный тетраэдр. Атом кремния окружен четырьмя атомами кислорода, расположенными симметрично в вершинах тетраэдра.
Структура кварцевого стекла выполнена из тетраэдров SiО4, соединенных друг с другом вершинами через атомы кислорода. В результате образуется непрерывный пространственный каркас, отличающийся от геометрически правильных решеток кристаллических модификаций кварца отсутствием дальнего порядка в расположении и ориентации тетраэдров. Тетраэдры SiО4 не образуют в пространстве геометрически правильных сочленений в виде шести членных колец, характерных для структуры высокотемпературного кристобалита.
Структурная сетка стекла выглядит как искаженная кристаллическая решетка. Искажение заключается в произвольном варьировании значений угла связи Si—О—Si между соседними тетраэдрами в структуре стекла.
Группировка [SiО4]4— имеет избыточный отрицательный заряд (-4), но каркасная сетка из тетраэдров SiО4 в целом электронейтральна, так как каждый атом кислорода связан с двумя атомами кремния. В структуре кварцевого стекла все атомы кислорода мостиковые.
Структуры кристаллических и стеклообразной форм диоксида кремния не являются плотноупакованными, так как тетраэдры соединяются вершинами, а не ребрами и не гранями . В кварцевом стекле имеются свободные структурные полости, ограниченные в пространстве мостиковыми атомами кислорода.
Именно благодаря наличию в структуре свободных полостей, кварцевое стекло обладает наиболее высокой газопроницаемостью (гелий, водород, неон) по сравнению с другими силикатными стеклами, в составе которых кроме диоксида кремния присутствуют оксиды щелочных и щелочноземельных металлов.
Бинарные щелочно-силикатные стекла
Бинарные щелочно-силикатные стекла систем Ме2О—SiО2 (где Me—Li, Na, К, Rb, Cs, Tl). Введение в состав стекла оксидов щелочных металлов приводит к разрыву структурной сетки и выстраиванию атомов щелочных металлов по месту разрыва по схеме:
В том месте, где выстроились ионы щелочного металла, отсутствует химическая связь между элементами структуры (место разрыва на схеме обозначено пунктирным овалом). Ионы щелочных металлов являются модификаторами. По мере увеличения концентрации Me2О в составе стекла растет число разрывов в структурной сетке и число не мостиковых атомов кислорода, приходящихся на один тетраэдр SiО4. При концентрациях Ме2О более 60 мол. в % создаются условия для образования изолированных тетраэдров SiО4. Кристаллизуются подобные расплавы чрезвычайно быстро, так как облегчаются условия переориентации структурных единиц, в то время как застывание расплава в виде стекла при этом затруднено.
Области стеклообразования в бинарных щелочно-силикатных системах непрерывны. В системе с Li2O содержание предельных концентраций SiO2 составляет 100—64 мол.%, с Na2О 100—48 мол.%, с К2О 100-46 мол. %, с TI2O 50—33 мол. %.
Фосфатные стекла
Фосфатные стекла построены из тетраэдров [PО4]3 . Один из атомов кислорода тетраэдра не может участвовать в образовании связи с другими компонентами структуры из-за наличия двойной связи фосфор — кислород. В структуре фосфатных стекол мостиковыми могут быть только три атома кислорода фосфор кислородного тетраэдра.
В этом отношении структура Р203 отличается от структур других стеклообразователей, у которых все атомы кислорода мостиковые. Пространственная структура фосфатных стекол может состоять из колец различного размера, образованных чередующимися атомами фосфора и кислорода, лент или цепочек из тетраэдров РО4.
Результаты рентгеноструктурного анализа показывают, что структура двойных фосфатных стекол подобна структуре двойных силикатных стекол по следующим двум параметрам: структурной основной единицей являются тетраэдрические элементокислородные группировки; с добавлением модифицирующих оксидов растет число не мостиковых атомов кислорода.
Микронеоднородное строение стекол.
Согласно современным представлениям, все однофазные стекла имеют микронеоднородное строение. Речь идет об образовании в структуре микрообластей размером от 1 до 20 нм, отличающихся химическим составом или геометрическим упорядочением в расположении частиц. Прямые доказательства микронеоднородного строения стекол были получены методами рентгеноструктурного, электронномикроскопичес-кого, спектрального анализов.
Микрообласти не имеют поверхностей раздела фаз. Они являются неотъемлемой частью структуры сложного однофазного стеклообразного силиката, но концентрация модифицирующих компонентов в них выше или ниже средней статистической.
Идея о микронеоднородном строении стекол была заложена в гипотезе А. А. Лебедева и получила развитие в работах Е. А. Порай-Коши-ца, К. С. Евстропьева, Н. В. Гребенщикова, О. С. Молчановой, С. П. Жданова.
Щелочно-боросиликатные стекла являются одним из примеров того, что при микронеоднородном строении может наступить фазовое разделение, сопровождающееся образованием границ раздела фаз. При выщелачивании стекол в области составов, растворами соляной, уксусной и других кислот образуется высокопористый кремнеземистый каркас (95—96 % SiO2), сохраняющий исходную форму, размеры и прочность (кварцоидные стекла, викор). Средний диаметр пор, в которых располагается натриево-боратная фаза, составляет 2—6 нм.
studfiles.net
СТЕКЛООБРАЗНОЕ И КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЯ
Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Газ — состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Особенности строения и свойств газов, жидкостей и твёрдых тел некристаллического строения
(стеклообразных аморфных).
Обычно понятие «стекло» определяется не просто как материал, а как некоторое особое состояние твердого тела, стеклообразное состояние, противопоставляемое кристаллическому. Известно, что одно и то же вещество может быть газообразным, жидким и кристаллическим. Для каждого такого состояния характерна своя группа специфических признаков. Стекло же не может быть полностью отнесено по совокупности признаков ни к одному из них. Рассмотрим вещества, находящиеся в указанных агрегатных состояниях, с точки зрения взаимного расположения частиц (атомов, ионов, молекул), образующих вещество, и их взаимодействия между собой. При очень высоких температурах многие неорганические вещества существуют в виде газа. В газе частицы вещества располагаются и движутся хаотически. При низком давлении, например атмосферном, взаимодействия между частицами чрезвычайно слабы. При понижении температуры газ конденсируется в жидкость, которая при дальнейшем снижении температуры кристаллизуется. В жидкостях и кристаллах частицы располагаются несравненно более компактно,
между ними действуют значительные по величине силы, которые создают известную упорядоченность в расположении атомов или молекул: в кристаллах почти идеальную, в жидкостях — существенно менее полную. Основной особенностью кристаллов является то, что их можно получить путем повторения элементарной ячейки во всех трех направлениях. Элементарная ячейка состоит из некоторого числа атомов (ионов, молекул), строго определенным образом расположенных друг относительно друга. Такое повторение элементарной ячейки называют дальним порядком. В жидкостях нельзя выделить такой элементарной ячейки. Для жидкости можно с уверенностью говорить о существовании ближнего порядка, то есть о ближайших соседних частицах, окружающих центральную. Таким образом, для жидкости характерен ближний порядок, но нет дальнего. Мы воспользуемся здесь широко применяемым определением стекла: стекло — это такое состояние аморфного вещества, которое получается при затвердевании переохлажденной жидкости. Стекло неравновесно по отношению к кристаллическому состоянию, которое может реализовываться при том же составе и при тех же внешних условиях. Отличие стекла от кристаллов состоит в отсутствии периодичности строения, в отсутствии дальнего порядка в структуре.
Кроме традиционного пути получения стекол — охлаждения расплава, стали широко применяться и другие способы получения стекол. Сюда относятся стеклообразные пленки, получаемые напылением из газовой фазы; «метамиктные стекла», образующиеся под воздействием ударных давлений и при бомбардировке кристаллов нейтронами; стекла, получаемые по золь-гель- технологии. В этой связи неудивительно, что разные исследователи дают различные определения стекла, отличные от приведенного нами. При этом они руководствуются выборочными признаками стеклообразного состояния. За основу принимаются, например, структурные признаки, способ получения стекла, тип химической связи и т.д. Терминологическая дискуссия по этому вопросу ведется уже давно, и она далека от завершения, что, безусловно, свидетельствует о сложности объекта исследования.
СТРУКТУРА СТЕКОЛ
Приведенное выше определение стекла, связанное с традиционным способом его производства и с общими сведениями о его структуре, привело к двум различным направлениям в развитии теории стеклообразного состояния. А.А. Лебедев предположил, что структуру стекла образуют субмикроскопические кристаллы — кристаллиты, расположенные друг относительно друг друга хаотическим образом. Согласно кристаллитной гипотезе стекло является химически однородным.
Исследование стекол методом рентгеноструктурного анализа явилось качественным скачком в понимании природы стеклообразного состояния. Согласно полученным данным было показано следующее: 1) кристаллиты содержат 1 — 2 элементарных ячейки, да и то искаженных, то есть терялся смысл самого понятия «кристаллит», 2) высказано предположение о химически неоднородном строении стекла. Исторически кристаллитная гипотеза сыграла большую роль в понимании природы стеклообразного состояния, но ее пригодность для описания большинства стеклообразных веществ оказалась невелика.
Наряду с кристаллитной гипотезой получили развитие представления шведского ученого В. Захариасена, который на основе успехов кристаллохимии силикатов высказал предположение, что структуру оксидных стекол образуют элемент-кислородные полиэдры, аналогичные таковым в кристаллах, но их сочленение не имеет строгого порядка и периодичности, как в кристаллах. Было установлено, что рентгенограммы кварцевого стекла лучше всего интерпретируются в рамках модели непрерывной беспорядочной сетки тетраэдров SiO4. Атом кремния, окруженный четырьмя атомами кислорода, и отражает ближний порядок в структуре стекла. Как показали многочисленные рентгеновские и нейтронографические (основанные на изучении рассеяния нейтронов стеклом) исследования, наличие неупорядоченной сетки подтверждается применительно к структуре однокомпонентных стекол, таких, как B2O3, SiO2, As2O3, Si, B, и некоторых других. Исследования поведения
стеклянных электродов в растворах электролитов также позволили высказать определенные суждения о ближнем порядке в стеклах. На базе экспериментального материала по изучению поведения электродов из разных стекол в растворах электролитов и его теоретического осмысления автором был предложен метод изучения элементов структуры стекла по типу комплексных ионов, таких, например, как [AlO4/2]1 — [BO4/2]1.
Позже ионообменные процессы нашли широкое применение в градиентной оптике, в производстве стеклянных электродов и в производстве рН-метров, которые можно встретить на многих предприятиях и в лабораториях в качестве средства контроля и измерения кислотности среды и определения содержания в ней щелочных металлов.
Однако для стекол, содержащих два или более компонентов, характерна химическая неоднородность. Так, при введении в SiO2 оксида натрия в результате взаимодействия оксидов, несмотря на сохранение координации атомов кремния относительно кислорода, непрерывность кремнекислородной сетки нарушается за счет частичных обрывов связей Si-O-Si, соединяющих тетраэдры между собой. Появляются так называемые немостиковые атомы кислорода. В бездефектном кварцевом стекле существуют только мостиковые атомы кислорода. Для таких сложных стекол гипотеза неупорядоченной сетки Захариасена становится недостаточной, и для определения их общей структуры мало знать только ближний порядок; необходимо определить их строение на расстояниях, превышающих межатомные, так называемый средний порядок.
Результаты исследования стекол структурно-чувствительными методами (ЯМР — ядерный магнитный резонанс, ЭПР — электронный парамагнитный резонанс, инфракрасная и рамановская спектроскопии и др.) хорошо интерпретируются в предположении существования в стеклах структурных группировок, аналогичных, но несколько искаженных по отношению к имеющимся в соответствующих кристаллах. Например, предполагается, что стеклообразный борный ангидрид в основном построен из бороксольных колец, образованных тремя борокислородными треугольниками BO3. В
щелочноборатных стеклах в зависимости от отношения M2O / B2O3, кроме бороксольных колец, предполагается образование диборатных, триборатных, пентаборатных группировок, в которых атом бора может быть окружен как тремя, так и четырьмя атомами кислорода (рис. 2). Наличие таких группировок
иотносится к среднему порядку.
Ксожалению, диапазон размеров указанных выше группировок составляет 10 — 12 ангстрем и является наиболее трудным для структурного анализа. Поэтому в настоящее время неясно, каков средний порядок и какова его роль в организации структуры стекла. При этом кристаллитная гипотеза и гипотеза непрерывной неупорядоченной сетки являются лишь отправными точками для поиска компромисса при описании структуры реальных стекол. В этой связи часто используются определенные модельные представления о структуре стекла. Рассмотрим одно из них, основанное на теории идеальных ассоциированных растворов, в соответствии с которой структура расплавов и стекол представляется состоящей из структурно-химических группировок, подобных, но несколько искаженных по отношению к имеющимся в соответствующих кристаллах. Это наряду с результатами исследований структурно-чувствительными методами позволило автору совместно с сотрудниками на основе исследования термодинамических свойств стекол и расплавов рассчитать количественные соотношения этих структурнохимических группировок.
Предельным случаем химически неоднородного стекла являются стекла ликвационной природы. При охлаждении ряда стеклообразующих расплавов образуются стекла, состоящие из стекол разного состава, отделенных друг от друга поверхностями раздела, как бы стекло в стекле. Одна составляющая структуры обогащена легко растворимыми компонентами стекла (щелочные оксиды, оксид бора) и является химически нестойкой, а другая — нерастворимыми (оксиды кремния и алюминия) и является химически стойкой.
Окончательное доказательство существования таких стекол было получено в результате исследования рассеяния ими рентгеновских лучей под
studfiles.net
Металлическое стекло | Мир невидимого

В Калифорнийском технологическом институте разработан новый метод изготовления чрезвычайно перспективных конструкционных материалов – объемных металлических стекол. Они представляют из себя сплавы нескольких металлов, не имеющие кристаллической структуры. В этом они похожи на обычное стекло – отсюда и название. Металлическое стекло возникает при очень быстром охлаждении расплавов, из-за которого те просто не успевают кристаллизоваться и сохраняют аморфную структуру. Сначала таким способом научились получать тонкие ленты металлических стекол, которые легче заставить быстро терять температуру. Объемные металлические стекла изготовлять куда труднее.
Металлические стекла обладают множеством достоинств. Кристаллические решетки обычных металлов и сплавов всегда содержат те или иные структурные дефекты, которые снижают их механические качества. В металлических стеклах таких дефектов нет и не может быть, поэтому они отличаются особой твердостью. Некоторые металлические стекла к тому же сопротивляются коррозии даже лучше нержавеющей стали. Поэтому специалисты полагают, что эти материалы ожидает блестящее будущее.
До сих пор объемные металлические стекла имели один крупный недостаток – низкую пластичность. Они хорошо выдерживают изгибы и сжатия, но ломаются при растяжении. Теперь Даглас Хоффман и его коллеги изобрели технологию изготовления объемных металлических стекол на основе сплавов титана, циркония, ниобия, меди и бериллия, которая приводит к рождению материалов, не уступающих по прочности лучшим титановым и стальным сплавам.
Разработчики полагают, что сначала они найдут применение в авиакосмической индустрии, а потом, когда удастся снизить их себестоимость, и в других отраслях.
Внутри металлического стекла
Ученым впервые удалось «рассмотреть» до уровня отдельных атомов структуру металлического стекла, определяющую механизм перехода этого аморфного материала из жидкого состояния в твердое.
В своих экспериментах группа исследователей из Австралии и США использовала разработанную ей новейшую методику исследований материалов. Анализируя дифракционные картины рассеяния электронов, полученные с помощью электронного микроскопа университета Монаша , ученые смогли обнаружить симметрии отдельных атомных кластеров в металлическом стекле на основе циркония.
Оказалось, что атомы в таком стекле сгруппированы в 13-атомные кластеры, имеющие форму икосаэдра – правильного двадцатигранника с двенадцатью вершинами. Икосаэдры, имеющие 12 осей симметрии пятого порядка, не могут быть плотно упакованы в упорядоченную кристаллическую решетку, поэтому расплав циркониевого металлического стекла при охлаждении постепенно увеличивает свою вязкость и твердеет, не кристаллизуясь.
Возможность формирования аморфной структуры таким способом уже предсказывалась теоретиками, но получила экспериментальное подтверждение впервые.
Аморфная структура придает металлическим стеклам уникальные качества. Эти стекла имеют более высокое отношение прочности к массе, чем алюминиевые и титановые сплавы, и являются очень перспективными конструкционными материалами.
Металлическое стекло — победа над хрупкостью
Благодаря своей аморфной структуре металлические стекла могут быть прочными, как сталь, и пластичными, как полимерные материалы, они способны проводить электрический ток и обладают высокой коррозионной стойкостью. Такие материалы могли бы получить широкое распространение при изготовлении медицинских имплантатов и разнообразных электронных устройств, если бы не одно неприятное свойство: хрупкость. Металлические стекла, как правило, являются ломкими и неравномерно сопротивляются усталостным нагрузкам, что ставит под вопрос их надежность. Использование многокомпонентных аморфных металлов решает эту проблему, однако для монолитных металлических стекол она до сих пор актуальна.
В рамках нового исследования. проведенного совместно учеными из Лаборатории Беркли и Калифорнийского технологического института, был найден способ повысить усталостную прочность объемных металлических стекол. Объемное металлическое стекло на основе палладия, подвергнутое усталостным нагрузкам, проявило себя ничуть не хуже, чем лучшие из композитных металлических стекол. Его усталостная прочность сравнима с этим показателем для широко используемых поликристаллических конструкционных металлов и сплавов, таких как сталь, алюминий и титан.
Под нагрузкой на поверхности палладиевого металлического стекла образуется полоса сдвига — локальная область значительной деформации, которая принимает ступенчатую форму. При этом по краям трещин, разделяющих «ступени», возникают такие же полосы сдвига, что притупляет вершины трещин и препятствует их дальнейшему распространению.
Палладий характеризуется высоким соотношением модулей объемного сжатия и сдвига. что скрадывает присущую стеклообразным материалам хрупкость, поскольку образование «многоуровневых» полос сдвига, препятствующих дальнейшему росту трещин, оказывается энергетически более выгодным, чем формирование крупных трещин, приводящих к быстрому разрушению образца. Вкупе с высоким пределом выносливости материала эти механизмы значительно повышают усталостную прочность объемного металлического стекла на основе палладия.
Китайцы сделали сверхгибкое металлическое стекло
В новом металлическом стекле напряжение ослабляется за счёт многочисленных трещин, позволяющих материалу гнуться. Изобретение стекла, которое может гнуться, уже само по себе кажется чем-то необычным. А вот гнущееся стекло, которое сделали специалисты из института физики Китайской академии наук под руководством профессора Вэй Хуа Вана , к тому же представляет собой металлический сплав.
Разработкой сверхтонких металлических стёкол исследователи занимаются уже давно. Значительный прорыв в этой области был сделан около 10 лет назад, когда учёные научились выращивать такие материалы в виде тонких пластин. Область применения этих разработок оказалась очень широкой. Впрочем, у гибких стёкол есть существенный недостаток – высокая хрупкость.
Ранее для улучшения механических характеристик учёные добавляли специальные наночастицы в состав таких стёкол. Трещина, образовывавшаяся в таких материалах, распространялась до точки «встречи» с наночастицей, на которой и останавливалась.
Подробные материалы оказывались довольно дорогостоящими, поэтому профессор Ван и его коллеги решили заняться поиском более простого решения.
В результате серии экспериментов они смогли сделать стекло из сплава, созданного из циркония, алюминия, меди и никеля. Особенность получившегося материала в том, что в его структуре распределены зоны, состоящие из твёрдых и плотных областей, окружённых мягкими и менее плотными.
Из-за этого при изгибе не возникает большой трещины, а появляется множество мелких трещинок. Благодаря им сила, приложенная к изделию из такого стекла, распределяется равномерно по сечению изделия. Как утверждают исследователи, это свойство делает данный материал более гибким по сравнению с другими существующими аналогами.
Металлические стекла также называют аморфными металлами или метглассами. Метод получения метглассов был разработан и впервые применен в 1960 году в Калифорнийском технологическом институте группой ученых, возглавлял которую профессор Пол Дювез. Им впервые удалось получить металлическое стекло. Сегодня аморфные металлы получают путем охлаждения расплавленного металла со скоростью до 106 К/c, вследствие чего структура вещества становится аморфной, т.е. без кристаллической решетки. Также разработаны методы изготовления аморфных металлов путем электрохимического осаждения и облучения металлов с кристаллической структурой мощными потоками нейтронов и ионов.
Свойства металлических стекол
Особенность метглассов заключается в том, что металлы в аморфном и кристаллическом состоянии имеют совершенно разные физико-химические свойства. При переходе металлов в аморфное состояние их прочность возрастает. однако упругость снижается. Так при снятии нагрузки метглассы способны восстанавливать свою изначальную форму, но если степень нагрузки превысит допустимое значение, металлическое стекло разрушится.
Одним из главных преимуществ металлических стекол можно назвать их исключительные антикоррозийные свойства. Многие из метглассов по этому показателю даже опережают лучшие марки нержавеющих сталей. Считается, что эта особенность обусловлена отсутствием кристаллической решетки и соответственно границ между зернами. Металлические стекла не подвержены воздействию многих агрессивных сред. таких к примеру, как кислоты и морская вода.
Применение металлических стекол
Область применения металлических стекол довольно ограничена. поскольку получают метглассы обычно в виде тонких лент. Изготовление объемных металлических стекол сопряжено с рядом трудностей, основная из которых заключается в том, что с увеличением толщины металлической пленки ее стабильность падает. На сегодняшний день металлические стекла применяются в производстве магнитных головок и экранов, сердечников трансформаторов, армирующих и электродных материалов. Широкое распространение аморфных металлов сдерживает их высокая себестоимость и малые размеры получаемых изделий. Также использование аморфных материалов при изготовлении крупногабаритных конструкций довольно проблематично, ввиду их низкой термической устойчивости.
Упоминая слово «стекло» первое, что приходит на ум, это, конечно же, оконное стекло. Но при определенных условиях, металлы тоже могут образовывать стекла. Металлические стекла достаточно сложно получить, но исследователь Todd Hufnagel из Университета Джонса Хопкинса пытается производить металлические стекла которые превосходят металл в традиционном понимании по прочности, эластичности и магнитным свойствам.
Работая в этом направлении, ученый исследует множество микроскопических процессов, которые происходят в момент, когда расплавленный металл остывает в твердое вещество. Этот критический период и является моментом рождения металлических стекол.
С точки зрения науки, стеклом является любой материал, который может быть охлажден из жидкого состояния в твердое тело без процесса кристаллизации. Большинство металлов кристаллизуются при охлаждении и образуют пространственную структуру расположения атомов, которая имеет название – кристаллическая решетка. Но, если кристаллизация не происходит, и атомы располагаются в случайном порядке, в этом случает получается металлическое стекло.
Простое оконное стекло так же имеет случайное расположение атомов в своем строении. Металлическое стекло в отличии от обычного стела не является прозрачным, но его необычная атомная структура дает ему дополнительные механические и магнитные свойства.
Как указано выше, стеклом его называют именно из за случайного расположения в нем атомов. Конечно, никаких механических сходств со стеклом оно не имеет. Оно не прозрачное и не хрупкое.
Большинство традиционных металлов достаточно легко подвергаются деформации, и если постоянно сгибать и разгибать металл, то на нем, несомненно, проявится множество дефектов. Это объясняется тем, что происходит нарушение кристаллической решетки. Металлические стекла значительно проще вернуть к изначальной форме.
Исследования ученого финансируются Национальным фондом науки и бюро исследований армии США. Он пытается создать металлическое стекло, которое не кристаллизуется при более высоких температурах, что сделало бы его полезным при производстве деталей двигателя или бронебойных снарядов.
По мнению ученого, металлическое стекло при столкновении с препятствием не подвергнется грибообразной деформации и это поспособствует его скорости проникновения.
Открыт дешевый метод обработки металлического стекла
Американские ученые нашли дешевый способ обработки металлического стекла — чрезвычайно прочного материала с огромным потенциалом. Крепче и прочнее стали и титана – металлическое стекло является идеальным материалом в различных отраслях промышленности, от производства мобильных телефонов до авиационных деталей. Однако до недавнего времени проблема состояла в том, что обработка металлического стекла была довольно дорогостоящим процессом.
Ученые Калифорнийского технологического института разработали новый метод изменения формы металлического стекла. При этом используются те же недорогие процессы, которые применяются при выплавке пластиковых деталей. Исследователи научились нагревать металлическое стекло на миллион градусов за несколько секунд и придавать ему любую необходимую форму за несколько миллисекунд.
По словам профессора машиностроения и прикладной науки Уильяма Джонсона, им удалось совершить сдвиг парадигмы в металлургии и сделать прорыв в обработке металлов. Описание эксперимента приводится в статье в издании Science от 13 мая.
Металлическое стекло, впервые полученное в Caltech в 1960 году, начали сравнительно массово выплавлять в виде глыб в начале 90-х годов. В отличие от обычного стекла, оно непрозрачно. По сути это – металл с беспорядочной атомной структурой стекла. Обычное стекло относительно крепкое и устойчивое против постоянной деформации, однако легко разбивается и трескается. Металл, наоборот, не трескается и не бьется, однако имеют ограниченную прочность. Металлическое стекло объединяет в себе лучшие качества прочности как металла, так и стекла.
Для обработки металлического стекла его необходимо нагреть до 500-600 градусов Цельсия. Материал становится густой жидкостью, которой можно придать нужную форму. В этом виде атомы образовывают структуру, как в кристаллах. Чтобы материал сохранял прочность, необходимо избегать его кристаллизации, что раньше было довольно сложно из-за долгого времени нагревания и обработки.
Для этого металлическое стекло нагревали до 1000 градусов и заливали в стальные формы. Но проблема в том, что формы не выдерживали более 600 градусов и плавились, в результате чего их приходилось часто менять, чем и была вызвана дороговизна обработки. Потому ученые и применили омический нагрев, что позволило нагревать металлическое стекло за считанные секунды. Затем жидкость разливается в форму и очень быстро охлаждается – до того, как начнет кристаллизоваться.
Источники: www.razgovorium.ru, www.absolutelyfirst.com, www.popmech.ru, www.membrana.ru, metall-moscow.ru, www.metallopt.ru, iscience.ru
Где лучше построить бетонный завод

Весьма выгодно располагать завод на водной магистрали, связывающей завод с карьером. В этом случае судоходная река служит целям бесперевалочной транспортировки исходных …
Черный великан
Ближе к центру города, на углу Даева переулка и Сретенки на стене дома на углу на уровне третьего …
Советский золотой червонец
Чеканка золотых монет проводится практически всеми государствами и здесь Россия не является исключением. Монета Золотой червонец — одна из …
Аркаим заповедник
Аркаим — укрепленное поселение бронзового века. Возраст поселения составляет 4 тысячи лет, поселок был создан по заранее продуманному плану, с …
Лего автомобили
Автомобили это сухопутное средство передвижения появившееся на рубеже XIX и XX веков. Благодаря внедрению конвейерной сборке и доступности они быстро завоевали …
Лесной дух

Главарь темной чащи… С давних времен леший считается повелителем всей растительности и темных троп, наводящих страх и заводящих в …
Планшетный компьютер для детей
Прогресс не стоит на месте, и современная цивилизация развивается семимильными шагами. Повальная компьютеризация захватывает абсолютно все сферы общества, в том числе …
www.objectiv-x.ru
Цвет стекла, хрусталь, кварцевое стекло
Стекло представляет собой аморфную (не кристаллическую) очень густую массу. Её получают спеканием различных солей металлов. Главным образом, в химический состав стекла входят соли щелочных, щелочноземельных металлов (Na, K) и их оксиды. Обычный речной песок состоит из этих же оксидов металлов и некоторых неметаллов, например в состав кварцевого стекла входит оксид кремния SiO2Обычное оконное стекло — это силикат состава Na2O•CaO•6SiO2.
Цветное стеклоЦветное стеклоЦветное стеклоИногда в стекле возникают области кристаллизации, что приводит к потере прочности. Получают стекло сплавлением кварцевого песка SiO2, известняка СаСО3 и соды Na2CO3:
Процесс осуществляют в печах при температуре 1100—1600 °С, после чего образовавшуюся стекломассу постепенно охлаждают. Обычное стекло размягчается при температуре 500—600 °С. Есть ещё так называемое природное стекло, которое носит название «обсидиан». Это вещество широко применяется в ювелирных украшениях.
В технике и медицине широко применяется кварцевое стекло.В отличии от обычного оконного оно пропускает ультрафиолетовые лучи.
Кварцевое стекло
Кварцевое стекло образуется при быстром охлаждении расплавленного кварца (кристаллического диоксида кремния SiO2). Кварцевое стекло обладает химической стойкостью и благодаря этому свойству применяется для изготовления лабораторной посуды. Кварц почти не расширяется при нагревании, поэтому, если раскалённое докрасна кварцевое стекло охладить под струёй холодной воды, то оно не растрескается.
Кварцевое стеклоТемпературы плавления, которая характеризует тела кристаллического строения, у стекла не существует: размягчение по мере повышения температуры происходит постепенно. Вещества с подобными свойствами так и называются — стеклообразные или просто стёкла.
Доказательством того, что стекло — это очень вязкое аморфное тело, может служить замер толщины Вашего окна, который при желании можете провести дома. Попробуйте, замерьте его по толщине сверху и снизу, — если оно достаточно старое, то окажется не одинаковым (стекает вниз).
Вязкость стекла. Само понятие вязкость свойство жидкости (или газа) оказывать сопротивление перемещению отдельных слоёв друг относительно друга, а также перемещению твёрдого тела, помещённого в жидкость. В Международной системе единиц (СИ) вязкость имеет размерность Па•с, но на практике распространена внесистемная единица вязкости пуаз (П): 1 П = 0,1 Па•с. Она названа в честь французского физика Жана Луи Пуазейля (1799—1869). Оценки, основанные на определении вязкости разогретых выше 500 °С стёкол, дают для 20 °С значение 1021 П. Для сравнения: вязкость воды при 20 °С равна 0,01 П, глицерина — 15 П, смолы — примерно 108 П. Вязкость стекла по сравнению, например, со смолой — в 10 трлн. раз более вязкая жидкость, чем смола.
Стекло трудно однозначно отнести к одному из двух состояний материи — жидкому или твёрдому. Оно обладает свойствами твёрдых веществ, но в то же время имеет структуру жидкостей. Почему же при расплавлении и последующем охлаждении оно не кристаллизуется? Дело в том, что при его охлаждении вязкость возрастает очень быстро, и ионы не успевают перестроиться и образовать правильную кристаллическую решётку. Подобным же образом ведёт себя, например, глицерин, который трудно закристаллизовать (tпл=20°С). В стеклообразном состоянии можно получить даже металл, если его расплавить, а потом охладить с очень большой скоростью — миллионы градусов в секунду.
Тем не менее в специальных условиях стекло можно всё же получить и в кристаллическом состоянии. Такие материалы называются ситаллами. Они обладают ценными механическими, оптическими (в том числе цвет стекла) и электрическими свойствами, которые можно целенаправленно менять, изменяя их химический состав.
Введение в расплав определённых элементов позволяет получить различный цвет и изменить его свойства. Например, чтобы цвет стекла измелился на зелёный или жёлтый, вводя в расплав ионы хрома или его оксиды. Цвет стекла — оранжевый — получают с помощью добавления серебра; синий цвет придаёт кобальт Co. Бутылочный цвет или изумрудно-зелёнй — придаёт железо, медь – голубой и синий. При внесении в расплав ионов золота оно приобретает кроваво-красный цвет. При добавлении в жидкое стекло ионов бора получают высокопрочное стекло, используемое в химических лабораториях.
Особыми механическими свойствами обладает хрусталь, который отличается от обыкновенного наличием ионов свинца и бария.
Хрусталь
Хрусталь — разновидность стекла, содержащая значительное количество оксида свинца PbO, а также, возможно, окись бария BaO. Добавка оксида свинца увеличивает показатель преломления и дисперсию света в нём (с ювелирной точки зрения «игру цвета», «огонь»). Добавка оксида бария в основном увеличивает только показатель преломления. Добавка оксида свинца также увеличивает пластические свойства и, соответственно, возможности по обработке — огранке, резьбе и т.п.
 Хрусталь
ХрустальОгранка хрусталя, подобно огранке драгоценных камней, позволяет хрусталю в полной мере проявить свойства, обусловленные большим показателем преломления и дисперсией. Название было дано по аналогии с горным хрусталем. Изготавливают сплавлением оксида свинца PbO с кремнеземом, соединением натрия или калия (содой или поташoм) и малыми добавками других оксидов. Свинцово-калиево-силикатные стекла дороже известковых, однако они легче плавятся и проще в изготовлении. Это позволяет использовать высокие концентрации PbO и низкие — щелочного металла — без ущерба для легкоплавкости. Высокое содержание PbO дает высокие значения показателя преломления и дисперсии — двух параметров, весьма важных в некоторых оптических приложениях. Те же самые характеристики придают свинцовым стеклам сверкание и блеск, украшающие самые утонченные изделия столовой посуды и произведения искусства.
Хрусталь — это свинцово-силикатное стекло, содержащее 13—30 % и более окислов свинца и до 17 % окислов калия. Из хрусталя производят высококачественную посуду и декоративные изделия. Оно обладает повышенной массой, прозрачностью, лучепреломляемостью и блеском, но меньшей термостойкостью по сравнению с другими его видами. Благодаря содержанию свинца и определённому подбору углов, образуемых гранями изделия из хрусталя отличаются необыкновенно яркой, многоцветной игрой света. Обладают красивым звоном. Хрусталем называется также высококачественное венецианское и чешское стекло. Стиль художественного стекла (хрусталь) — торжественно-парадный, сувенирно-подарочный. Способы обработки изделий из хрусталя: гравировка, огранка, резьба, шлифовка
www.kristallikov.net
