Указать класс и название веществ:. Hg(NO2)2 ; Ni(OH)2 ; HCN ; Ag2O ; BaSO4? — Спрашивалка
Указать класс и название веществ:. Hg(NO2)2 ; Ni(OH)2 ; HCN ; Ag2O ; BaSO4? — СпрашивалкаМП
Максим Примоченко
Указать класс и название веществ:. Hg(NO2)2 ; Ni(OH)2 ; HCN ; Ag2O ; BaSO4? название класс вещество
51
7
0
Ответы
Юличка Кушниренко
нитрит гидраргиума — соль; гидроксид никеля — щелочь, родонит — кислота,оксид аргентума — оксид; сульфат бария — соль
0
МП
Максим Примоченко
спасибо:)
1
Юличка Кушниренко
да не за что. только по ходу третье вещество неправильно
только по ходу третье вещество неправильно
1
МП
Максим Примоченко
на счёт остальных уверенна?
1
Юличка Кушниренко
ну да
1
МП
Максим Примоченко
спасибо
1
Юлия Гриценко
сіль нітрит меркурію, основа гідроксид нікелю, синильна кислота,оксид срібла, сіль сульфат барію.
0
МП
Максим Примоченко
шырли-мырли
1
Юлия Гриценко
1
Аршат Спабекова
8 класс. .. нитрат азота, гидроксид никеля, оксид серебра, сульфат бария…
.. нитрат азота, гидроксид никеля, оксид серебра, сульфат бария…
0
МП
Максим Примоченко
спасибо,а классы этих веществ можешь написать?(соль там это или кислота…)
1
Аршат Спабекова
металл, оксид, кислота и соль. Я надеюсь что правильно…
1
МП
Максим Примоченко
там ведь 5 элементов)who is who?
1
Аршат Спабекова
оксид серебра оксид, гидроксид никеля металл, сульфат бария соль, нитрат азота кислота или…
1
МП
Максим Примоченко
или что?
1
Аршат Спабекова
Забыла
1
АЧ
Анютик Чубарова
оксид серебра больше ниче не помню. . давно было
. давно было
0
МП
Максим Примоченко
и на том спасибо
1
Наталья Маркова
А класс-это в каком классе проходили?
0
МП
Максим Примоченко
я не знаю)
1
Арай Булумбаева
химия )Я с ней не дружу )
0
Светлана
может кислоты
0
МП
Максим Примоченко
подробнее?
1
Светлана
подробнее))я в этом то на 100% не уверена
1
МП
Максим Примоченко
жаль
1
Другие вопросы
Какая моя наследственная доля?
Установлен ли максимальный срок для командирования работника организации на трерритории РФ?
Почему бы украинским олигархам не скинуться, и не купить газ для Украины?
выемка авто! должен ли я заплатить за стоянку?
ребенок исписал маркером холодильник обои двери
А буддет ли украина возводить стену вокруг Луганска и Донецка?
есть решение суда, но на нем не была принята статья 56 ГПК РФ могу ли я обратиться с заявлением в суд по ст 56 ГПК РФ
Здравствуйте.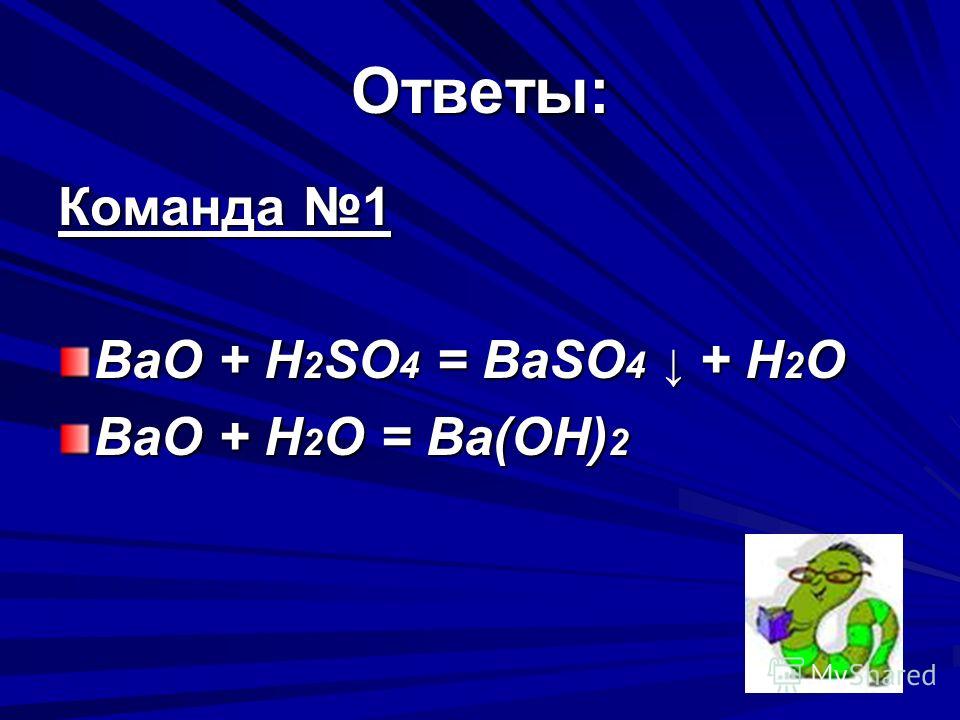 Я купила приватизированный участок в садовом обществе.
Я купила приватизированный участок в садовом обществе.
человек должен мне денег но скрывается от меня (вопрос внутри)
Подскажите название фильмов, о зомби
где можно скачать майкрософт офис?
Вот свалили укропы Ленина и бабла не прибавилось, а свали ли бы Ахметку могли 20 млрд$ вернуть?
Ты разведенка с маленьким рибенкам?
Господа иллюстраторы и близкие к теме, помогите выяснить либо имя автора, либо стиль в котором он (а) работает!
Нужен совет по установке замка для гаража
Классификация веществ. Химические свойства неорганических соединений основных классов. Основные классы неорганических веществ
Классификация веществ. Химические свойства неорганических соединений основных классов. Основные классы неорганических веществ.
В настоящее время известно более 500 тысяч неорганических соединений, знать их формулы, названия, а тем более свойства практически невозможно. Для того чтобы легче ориентироваться в огромном многообразии химических веществ, все вещества разделены на отдельные классы, включающие соединения, сходные по строению и свойствам.
Для того чтобы легче ориентироваться в огромном многообразии химических веществ, все вещества разделены на отдельные классы, включающие соединения, сходные по строению и свойствам.
Первоначально все химические вещества делятся на простые и сложные.
Простые вещества подразделяются на металлы и неметаллы.
Помимо типичных металлов и неметаллов есть большая группа веществ, обладающая промежуточными свойствами, их называют металлоидами.
Сложные вещества подразделяются на четыре класса химических соединений: оксиды, основания, кислоты и соли. Эта классификация разработана выдающимися химиками XVIII–XIX веков Антуаном Лораном Лавуазье, Михаилом Васильевичем Ломоносовым, Йёнсом Якобом Берцелиусом, Джоном Дальтоном
При сравнительно небольшом количестве химических элементов (открыто 118 элементов, часть из них получена только искусственным путём) существует бесконечное многообразие химических соединений.
На рис. 1 представлена упрощенная классификация веществ.
Рис. 1. Упрощенная классификация веществ
По составу, свойствам и наличию различных функциональных групп все сложные неорганические и органические вещества делятся на классы. Классификация сложных неорганических соединений представлена на рис. 2.
Рис. 2. Классификация основных сложных неорганических соединений
Среди сложных неорганических соединений выделяются следующие основные классы: оксиды, гидроксиды, соли.
Оксиды – это соединения атомов элементов с кислородом. По составу и химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основные оксиды – соединения атомов металлов с кислородом (Na2O, CaO, MgO и пр.). Получаются при непосредственном взаимодействии металла с кислородом: 2Na+O2 =2Na2O,либо при термическом разложении солей: CaCO2CaO + CO2.
Основные оксиды взаимодействуют с кислотами и кислотными оксидами, образуя соли:
1) CaO + h3SO4 = CaSO4 + h3O
CaO + 2H+ + SO42- = Ca2+ + SO42- + h3O
CaO + 2H+ = Ca2+ + h3O,
2) СaO + CO2 = CaCO3.
При взаимодействии некоторых растворимых основных оксидов с водой образуются основания (щелочи):
K2O + h3O = KOH
K2O + h3O = K+ + OH-.
Кислотные оксиды – соединения атомов неметаллов или некоторых металлов в высшей степени окисления (V+5, Mn+7, Cr+6 и др.) с кислородом. Образуются при взаимодействии атомов элементов непосредственно с кислородом: S + O2 = SO2, при разложении некоторых кислот: h3CO3 CO2 + h3O, либо в ходе окислительно-восстановительных реакций: 2SO2 + O2 = 2SO3.
Кислотные оксиды взаимодействуют с растворимыми основаниями и основными оксидами с образованием солей:
1) SO2 + 2KOH = K2SO3 + h3O
SO2 + 2K+ + 2OH- = 2K+ + SO32- + h3O
SO2 + 2OH- = SO32- + h3O,
2) SiO2 + CaO CaSiO3,
3) Mn2O7 + 2NaOH = 2NaMnO4 + h3O
Mn2O7 + 2Na+ + 2OH- = 2Na+ + 2MnO4- + h3O
Mn2O7 + 2OH- = 2MnO4- + h3O.
При взаимодействии некоторых кислотных оксидов с водой образуются кислоты:
SO3 + h3O = h3SO4
SO3 + h3O = 2H+ + SO42-.
Амфотерные оксиды – соединения атомов амфотерных элементов с кислородом (Al2O3, ZnO, BeO, Cr2O3, PbO2 и др.). Образуются при непосредственном окислении атомов элементов кислородом или косвенным путем, проявляют свойства как основных, так и кислотных оксидов:
1) ZnO + h3SO4 = ZnSO4 + h3O
ZnO + 2H+ + SO42- = Zn2+ + SO42- + h3O
ZnO + 2H+ = Zn2+ + h3O,
2) ZnO + 2NaOH Na2ZnO2 + h3O
ZnO + 2Na+ + 2OH- = 2Na+ + ZnO22- + h3O
ZnO + 2OH- = ZnO22- + h3O.
Гидроксиды – это продукты прямого взаимодействия оксидов с водой, либо косвенных процессов. Они делятся на кислотные, основные и амфотерные.
Кислоты – вещества, диссоциирующие в растворах с образованием ионов водорода (т. е. доноры протонов). По составу молекул кислоты делятся на бескислородные (HCl, h3S, HJ и др.) и кислородсодержащие (HNO3, h3SO4, h4PO4 и др.) (см. названия основных неорганических кислот и их солей в табл. 1 приложения). По количеству катионов водорода в молекуле кислоты бывают одно- (HNO3, HCl, HJ) и многоосновные (h3SO4, h4PO4, h3S). По характеру диссоциации на ионы в растворе кислоты делятся на сильные (HNO3, h3SO4, HCl) и слабые (h4PO4, h3CO3), (см. величины констант диссоциации сильных и слабых электролитов в табл. 2 приложения). При записи ионно-молекулярных уравнений реакций в растворах слабые кислоты на ионы не расписываются.
По характеру диссоциации на ионы в растворе кислоты делятся на сильные (HNO3, h3SO4, HCl) и слабые (h4PO4, h3CO3), (см. величины констант диссоциации сильных и слабых электролитов в табл. 2 приложения). При записи ионно-молекулярных уравнений реакций в растворах слабые кислоты на ионы не расписываются.
Характерными химическими свойствами кислот является способность реагировать с основными оксидами, основаниями, амфотерными оксидами и гидроксидами и солями с образованием солей, как одного из продуктов реакции:
1) 2HCl + CaO = CaCl2 + h3O
2H+ + 2Cl- + CaO = Ca2+ + 2Cl- + h3O
2H+ + CaO = Ca2++ h3O,
2) 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2h3O
2H+ + 2NO3- + Cu(OH)2 = Cu2+ + 2NO3- + 2h3O
2H+ + Cu(OH)2 = Cu2+ + 2h3O,
3) h3SO4 + BaCl2 = BaSO4↓+ 2HCl
2H+ + SO42+ + Ba2+ + 2Cl- = BaSO4↓+ 2H+ + 2Cl-
SO42+ + Ba2+ = BaSO4↓.
Растворы кислот реагируют с активными металлами (Mg, Zn, Al, Ca и пр.) с образованием солей и выделением газообразного водорода:
h3SO4 + Mg = MgSO4 + h3↑
2H+ + SO42- + Mg0 = Mg2+ + SO42- + h30↑
2H+ + Mg0 = Mg2++ h30↑.
Иначе ведет себя азотная кислота (HNO3). Наличие в ней активного окислителя (N5+) позволяет реагировать даже с малоактивными металлами (Cu, Ag и др.), однако водород при этом не выделяется:
4HNO3 + Cu = Cu(NO3)2 +2NO2 + 2h3O.
Более подробно о реакциях кислот различной концентрации и состава с металлами см. в основной учебной литературе.
Основания – вещества, диссоциирующие в растворах с образование гидроксид-ионов. По числу гидроксид-ионов в молекуле основания делятся на одно- (NaOH, AgOH) и многокислотные (Ca(OH)2, Fe(OH)3). Большинство оснований нерастворимо в воде. Растворимыми являются основания, образованные щелочными и щелочноземельными металлами (NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.).
Основания реагируют с кислотами, кислотными и амфотерными оксидами, солями:
1) Ba(OH)2 + h3SO4 = BaSO4↓+ 2h3O
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2h3O,
2) Ca(OH)2 + CO2 = CaCO3↓ + h3O
Ca2+ + 2OH- + CO2 = CaCO3↓ + h3O,
3) 2NaOH + BeO + h3O = Na2[Be(OH)4]
2Na+ + 2OH- + BeO + h3O = 2Na+ + [Be(OH)4]2-
2OH- + BeO + h3O = [Be(OH)4]2-,
4) 2KOH + CuSO4 = Cu(OH)2↓ + K2SO4
2K+ + 2OH- + Cu2+ + SO42- = Cu(OH)2↓ + 2K+ + SO42-
2OH- + Cu2+ = Cu(OH)2↓.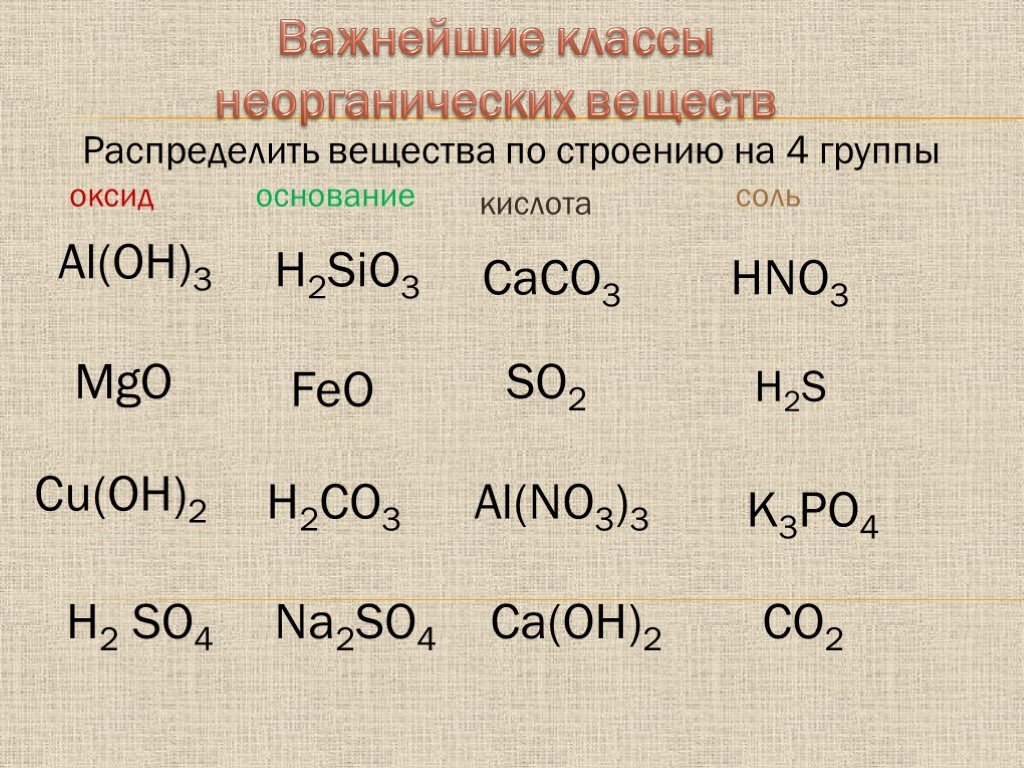
Некоторые гидроксиды обладают не только основными, но и кислотными свойствами, их называютамфотерными. К ним относятся гидроксиды амфотерных металлов: Zn(OH)2, Be(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)2, Cr(OH)3 и др. Например:
1) Zn(OH)2 + 2KOH = K2[Zn(OH)4]
Zn(OH)2 + 2K+ + 2OH- = 2K+ + [Zn(OH)4]2-
Zn(OH)2 + 2OH- = [Zn(OH)4]2-,
2) Zn(OH)2 + 2HCl = ZnCl2 + 2h3O
Zn(OH)2 + 2H+ + 2Cl- = Zn2+ + 2Cl- + 2h3O
Zn(OH)2 + 2H+ = Zn2+ + 2h3O.
Соли – продукты полного или частичного замещения ионов водорода в молекуле кислоты ионами металлов или продукты полного или частичного замещения гидроксид-ионов в молекуле основания кислотными остатками.
При полном замещении ионов водорода в молекуле кислоты на ионы металлов образуются средние (нормальные) соли:
h3SO4 + 2NaOH = Na2SO4 + 2h3O
2H+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + 2h3O
2H+ + 2OH- = 2h3O.
Na2SO4 – сульфат натрия (средняя соль).
Кислые соли (гидросоли) образуются при неполном замещении
ионов водорода в молекуле кислоты на ионы металлов. Это наблюдается при взаимодействии многоосновных кислот с основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли:
Это наблюдается при взаимодействии многоосновных кислот с основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли:
h3CO3 + KOH = KHCO3 + h3O
недостаток
h3CO3 + K+ + OH- = K+ + HCO3- + h3O
h3CO3 + OH- = HCO3- + h3O.
KHCO3 – гидрокарбонат калия (кислая соль).
Основные соли (гидроксосоли) образуются при частичном замещении гидроксид-ионов в молекуле основания кислотными остатками.
Основные соли могут быть образованы только многокислотными основаниями в тех случаях, когда количества кислоты недостаточно для получения средней соли:
Cu(OH)2 + HNO3 = CuOH(NO3) + h3O
недостаток
Cu(OH)2 + H+ + NO3- = CuOH+ + NO3- + h3O
Cu(OH)2 + H+ = CuOH+ + h3O.
CuOH(NO3) –нитрат гидроксомеди (II) (основная соль).
Соли вступают в химические реакции с кислотами, растворимыми основаниями и другими солями. Обязательным условием последнего процесса является растворимость обеих солей в воде (см.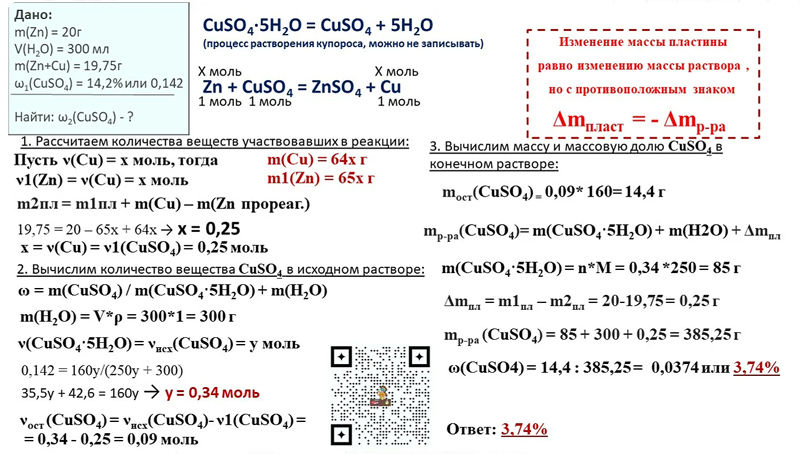 табл. 3приложения).
табл. 3приложения).
Примеры:
1) BaCl2 + h3SO4 = BaSO4↓+ 2HCl
Ba2+ + 2Cl- + 2H+ + SO42+ = BaSO4↓+ 2H+ + 2Cl-
Ba2+ + SO42+ = BaSO4↓,
2) CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
Cu2+ + SO42- +2K+ + 2OH- = Cu(OH)2↓ + 2K+ + SO42-
Cu2+ + 2OH- = Cu(OH)2↓,
3) NaCl + AgNO3 = AgCl↓ + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ NO3-
Cl- + Ag+ = AgCl↓.
Сульфат бария – свойства, применение, побочные эффекты и формула
Это неорганическое соединение с химическим названием сульфат бария.
Сульфат бария состоит из двух компонентов: катиона бария и сульфатного аниона. Сера связана с четырьмя атомами кислорода. BaSO 4 представляет собой сульфатную соль бария, которую можно найти в форме минерального барита. Это кристаллическое твердое вещество белого цвета, нерастворимое в воде и спирте, но растворимое в концентрированных кислотах. Он без запаха.
Сульфат бария представляет собой щелочной двухвалентный металл. Он нетоксичен и безопасен для медицинского применения. Он широко используется в добыче нефти и природного газа для получения буровых растворов высокой плотности, не допуская попадания в скважины горных пород.
Он нетоксичен и безопасен для медицинского применения. Он широко используется в добыче нефти и природного газа для получения буровых растворов высокой плотности, не допуская попадания в скважины горных пород.
Химия – предмет, требующий от учащихся глубокого понимания каждой из тем. И, следовательно, даже если вы хорошо изучили тему сульфата бария – BaSO 4 во время начальных занятий, вам также придется пройти ее позже, особенно в период вашего пересмотра. Теперь, если за это время вы найдете объяснение сульфата бария — BaSO 4 который сложно понять, то он вам вообще не пригодится. Наоборот, это может негативно на вас повлиять. Потому что это может заставить вас почувствовать, что у вас вообще нет никаких предыдущих знаний по теме сульфата бария — BaSO 4 .
Таким образом, для лучшего понимания учащимися темы сульфата бария – BaSO 4 и устранения всех сомнений в отношении того же важно объяснение, написанное на языке, который может быть легко понят учащимся. студентов, и в то же время он должен охватывать все темы Сульфат бария – BaSO 4 которые необходимы студентам. Следовательно, Веданту предоставляет всем студентам такое объяснение темы сульфата бария — BaSO 4 . Но есть еще кое-что, а именно объяснение, которое Веданту дает для темы сульфата бария — BaSO 4 , совершенно бесплатно, и, следовательно, все студенты, изучающие естественные науки, могут воспользоваться им.
студентов, и в то же время он должен охватывать все темы Сульфат бария – BaSO 4 которые необходимы студентам. Следовательно, Веданту предоставляет всем студентам такое объяснение темы сульфата бария — BaSO 4 . Но есть еще кое-что, а именно объяснение, которое Веданту дает для темы сульфата бария — BaSO 4 , совершенно бесплатно, и, следовательно, все студенты, изучающие естественные науки, могут воспользоваться им.
Свойства сульфата бария
Barium Sulphate Formula | BaSO 4 | ||
Molecular Mass of Barium Sulphate | 233.38g/mol | ||
Density | 4.5g/cm 3 | ||
Петирование точки | 1580 O C | ||
Растворие в | 16009 O | 16009955 O | 1600955 O. |
Классификация | Сульфат |
Физические свойства
чистый сульфат бара 1580°С и температура кипения 1600°С.
Химические свойства
Сульфат бария имеет очень плохую растворимость в универсальном водном растворителе. Он также нерастворим в спиртах и растворим в концентрированных кислотах. Он бурно реагирует с алюминиевой пудрой. Сульфат бария имеет множество применений в медицине и радиовизуализации из-за его нерастворимости в воде и рентгеноконтрастных свойств.
Сульфат бария Использование
Сульфат бария является контрастным веществом. Сульфат бария начинает действовать, покрывая внутреннюю часть пищевода, желудка или кишечника, что позволяет их более четко увидеть на компьютерной томографии или другом рентгенологическом (рентгеновском) исследовании.

Сульфат бария используется для диагностики определенных заболеваний пищевода, желудка или кишечника.
Сульфат бария также может использоваться для лечения некоторых других факторов, не указанных в данном руководстве по лекарствам. Буровые растворы
Около 80% производимого в мире сульфата бария, в основном очищенного минерала, потребляется в качестве компонента бурового раствора для нефтяных скважин. Это увеличивает плотность жидкости, увеличивая гидростатическое давление в скважине и снижая вероятность выброса.
Рентгеноконтрастное вещество
Суспензия сульфата бария
Сульфат бария в виде суспензии в настоящее время снова и снова используется в медицине в качестве рентгеноконтрастного специалиста для рентгеновской визуализации и других ориентировочных стратегий. Он регулярно используется для визуализации желудочно-кишечного тракта во время так называемого «бариевого приема пищи». Его принимают перорально или путем очищения кишечника в виде суспензии мелких частиц в густом молоке (часто с добавлением подсластителей и приправ). Хотя барий является тяжелым металлом и его смеси с водой обычно ядовиты, низкая растворимость сульфата бария ограждает больного от захватывающих разрушительных действий металла. Сульфат бария также быстро выводится из организма, в отличие от торотраста, который он заменил. Из-за высокого атомного числа (Z = 56) бария его соединения поглощают рентгеновские лучи более однозначно, чем соединения, полученные из более легких ядер.
Он регулярно используется для визуализации желудочно-кишечного тракта во время так называемого «бариевого приема пищи». Его принимают перорально или путем очищения кишечника в виде суспензии мелких частиц в густом молоке (часто с добавлением подсластителей и приправ). Хотя барий является тяжелым металлом и его смеси с водой обычно ядовиты, низкая растворимость сульфата бария ограждает больного от захватывающих разрушительных действий металла. Сульфат бария также быстро выводится из организма, в отличие от торотраста, который он заменил. Из-за высокого атомного числа (Z = 56) бария его соединения поглощают рентгеновские лучи более однозначно, чем соединения, полученные из более легких ядер.
Оттенок
Большинство производимых сульфатов бария используется в составе белых красок для красок. В масляной краске сульфат бария практически прозрачен и используется в качестве наполнителя или для изменения консистенции. Один крупный производитель масляных красок для художников продает «вечную белизну», которая содержит смесь титанового белого оттенка (TiO 2 ) и сульфата бария. Смесь сульфата бария и сульфида цинка (ZnS) представляет собой неорганический пигмент, называемый литопон. В фотографии он используется в качестве покрытия для некоторых фотобумаг.
Смесь сульфата бария и сульфида цинка (ZnS) представляет собой неорганический пигмент, называемый литопон. В фотографии он используется в качестве покрытия для некоторых фотобумаг.
Побочные эффекты сульфата бария
Вам следует обратиться за неотложной медицинской помощью, если у вас есть признаки гиперчувствительности: крапивница; затрудненное дыхание; расширение лица, губ, языка или горла.
Немедленно позвоните своему врачу, если у вас:
сильная боль в животе;
сильные спазмы, диарея или запор;
звон в ушах;
потливость, спутанность сознания, учащенное сердцебиение; или
бледность кожи, синюшность кожи, слабость.

легкие желудочные спазмы
тошнота, рвота; или
жидкий стул или легкий запор.
Формула сульфата бария
Сульфат бария — важное неорганическое химическое вещество, имеющее несколько применений, в том числе в медицине.
Структура и формула сульфата бария: Химическая формула сульфата бария: BaSO 4 и его молярная масса 233,43 г/моль. Это соль, состоящая из катиона бария (Ba 2 + ) и сульфатного аниона (SO 4 2 — ), в котором сера соединена с четырьмя атомами кислорода. Металлический барий присутствует в степени окисления +2 — . Химическая структура сульфата бария показана ниже:
Происхождение: сульфат бария встречается в природе в виде минерала барита, который широко распространен и может рассматриваться как основной источник бария и других соединений бария.
Знаете ли вы?
Сульфат бария нерастворим в воде. Если при определенных условиях растворить его в воде, раствор будет очень токсичным.
Сульфат бария обычно используется для рентгенографии желудка и кишечника.
Он также широко используется в производстве красок и очков.
Знаете ли вы, что придает вашему фейерверку зеленый цвет? Именно присутствие нитрата бария придает ему ярко-зеленый цвет при взрыве.
Преимущества объяснения сульфата бария – BaSO
4 от Vedantu.Для студентов, изучающих естественные науки, есть много преимуществ в объяснении сульфата бария — BaSO 4 , которое предоставлено Vedantu. Некоторые из этих преимуществ сульфата бария – BaSO 4 выделены ниже:
Учебный материал самого высокого качества: все материалы, которые предоставляет Vedantu, подготовлены опытными преподавателями, и, следовательно, Vedantu обещает гарантию качества материал, предоставленный учащимся.
 А по качеству это означает, что все пункты, которые студенты должны знать по теме Сульфат бария – BaSO 4 включен таким образом, чтобы его могли легко понять все учащиеся.
А по качеству это означает, что все пункты, которые студенты должны знать по теме Сульфат бария – BaSO 4 включен таким образом, чтобы его могли легко понять все учащиеся.Доступный язык: Vedantu предоставляет полное объяснение темы сульфата бария – BaSO 4 на доступном языке, то есть на языке, который легко понять учащимся, но в то же время также время, поддерживая уровень сложности, чтобы ученики не находили это однообразным, а вместо этого тема становилась веселой и интересной для учеников.
Это бесплатно: Да, объяснение, которое Vedantu предоставляет для сульфата бария – BaSO 4 , совершенно бесплатно для всех студентов. И, следовательно, все студенты, которые хотят изучить и освоить тему сульфата бария — BaSO 4 , могут иметь к нему доступ.
Кроме того, если вы хотите узнать о формуле сульфата бария, вы можете перейти по этой ссылке.
Порошок сульфата бария, BaSO4 (CAS № 7727-43-7)
Порошок сульфата бария, BaSO4 (CAS № 7727-43-7)Порошок сульфата бария Описание
Порошок сульфата бария или порошок сульфата бария представляет собой белый порошок или небольшие кристаллы, не имеющие запаха и совершенно нерастворимые в воде. Его белый непрозрачный внешний вид и высокая плотность используются в его основных областях применения. Наиболее известно его применение в качестве рентгеноконтрастного агента для диагностики заболеваний желудочно-кишечного тракта.
Спецификации порошка сульфата бария
Чистота | >98 % |
Размер частиц | Субмикронный |
КАС | 7727-43-7 |
Температура кипения | 1600 °С |
Плотность | 4,25–4,5 г/см³ |
Кристаллическая структура | Полиморфный |
Форма | Порошок |
Порошок сульфата бария Применение
Порошок сульфата бария (порошок BaSO4) имеет больше применений в промышленности, за исключением использования в качестве рентгеноконтрастного вещества. Некоторые примеры:
Некоторые примеры:
— Красители
— Защитные
— Наполнители для пластмасс
— Чернила
— Военные
— Краски
— Пигменты
— Пиротехника
Barium Sulfate Powder Safety Information
Storage Class Code
13 — Non Combustible Solids
WGK
nwg
Flash Point(F)
Not applicable
Flash Point(C)
Not applicable
ПОСЛЕДНЯЯ РЕКОМЕНДУЕМАЯ
BA1286 Порошок хромата бария, BaCrO4 (CAS № 10294-40-3)
BA1287 Порошок титаната бария, BaTiO3 (CAS № 12047-27-7)
BA1843 Порошок сульфида бария, BaS (CAS № 21109-95-5)
BA1964 Порошок титаната бария-стронция (CAS № 12430-73-8)
BA2666 Порошок метафосфата бария (CAS 13762-83-9)
BA3060 Гексафторгерманат бария (CAS: 60897-63-4)
BA3934 Порошок сульфата бария для бурения (CAS № 7727-43-7)
BA3935 Порошок сульфата бария класса краски (CAS № 7727-43-7)
BA3936 Микронизированный порошок сульфата бария (CAS № 7727-43-7)
ЗАПРОСИТЬ ЦЕНУ
Пожалуйста, заполните ваши данные, и один из наших экспертов по материалам свяжется с вами в течение 24 часов.

 0066 C
0066 C