формула, свойства и области применения :: SYL.ru
Диоксид углерода (углекислый газ) — часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения — гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так: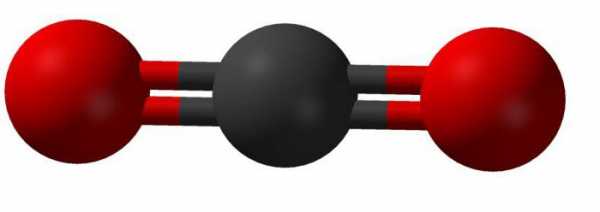
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + H2O;
NaOH + CO2 = NaHCO3.
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO2 + H2O ↔ H2CO3.
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.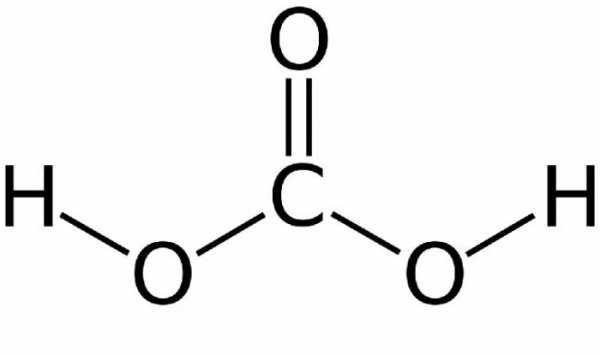
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н+ и соединения НСО3— . В очень небольшом количестве образуются ионы СО3—.
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Получение диоксида углерода
Если требуется получить небольшое количество СО2,можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO3 + HCl = CaCl2 + H2O + CO2 ↑.
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2H2O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO3 = CaO + CO2 ↑.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
www.syl.ru
Кислоты: классификация и химические свойства
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие (H2SO4 серная кислота, H2SO3 сернистая кислота, HNO3 азотная кислота, H3PO4 фосфорная кислота, H2CO3 угольная кислота, H2SiO3 кремниевая кислота) и бескислородные (HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, H2S сероводородная кислота).
В зависимости от числа атомов водорода в молекуле кислоты кислоты бывают одноосновные (с 1 атомом Н), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н). Например, азотная кислота HNO
|
|
К И С Л О Т Ы |
|
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная |
H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO 3 угольная H2SiO3 кремниевая |
H3PO4 фосфорная |
Неорганических соединений, содержащих четыре атома водорода, способных замещаться на металл, очень мало.
Часть молекулы кислоты без водорода называется кислотным остатком.
Кислотные остатки могут состоять из одного атома (-Cl, -Br, -I) – это простые кислотные остатки, а могут – из группы атомов (-SO3, -PO4, -SiO3) – это сложные остатки.
В водных растворах при реакциях обмена и замещения кислотные остатки не разрушаются:
H2SO4 + CuCl2 → CuSO4 + 2 HCl↑
Слово ангидрид означает безводный, то есть кислота без воды. Например,
H2SO4 – H2O → SO3. Бескислородные кислоты ангидридов не имеют.
Своё название кислоты получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная» и реже «вая»: H2SO4 – серная; H2SO3 – угольная; H2SiO3 – кремниевая и т.д.
Элемент может образовать несколько кислородных кислот. В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
Кислоты можно получать растворением ангидридов в воде. В случае, если ангидриды в воде не растворимы, кислоту можно получить действием другой более сильной кислоты на соль необходимой кислоты. Этот способ характерен как для кислородных так и бескислородных кислот. Бескислородные кислоты получают так же прямым синтезом из водорода и неметалла с последующим растворением полученного соединения в воде:
H2 + Cl2 → 2 HCl;
H2 + S → H2S.
Растворы полученных газообразных веществ HCl и H2S и являются кислотами.
При обычных условиях кислоты бывают как в жидком, так и в твёрдом состоянии.
Химические свойства кислот
Растворыв кислот действуют на индикаторы. Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Индикаторы – это вещества сложного строения. Они меняют свою окраску в зависимоти от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O.
Взаимодействуют с основанными оксидами с образованием воды и соли (реакция нейтрализации). Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H3PO4 + Fe2O3 → 2 FePO4 + 3 H2O.
Взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H +).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl2 + H2↑;
Cu + 4HNO3 → CuNO3 + 2 NO2 + 2 H2O.
Остались вопросы? Хотите знать больше о кислотах?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Кислородсодержащие соединения углерода
Оксид углерода (II)
Получение CO осуществляют обезвоживанием муравьиной кислоты, которое происходит под воздействием серной кислоты:
HCOOH = CO + H2O
При обычных условиях оксид углерода (II) не взаимодействует с водой, кислотами и щелочами, т.е. является несолеобразующим. Однако, при пропускании СО через расплав щелочи вод давлением происходит следующая реакция:
CO + NaOH = HCOONa
На воздухе СО горит синим пламенем:
2CO + O2 = 2CO2
СО проявляет восстановительные свойства – поскольку углерод повышает свою степень окисления до «+4». Так, СО способен восстанавливать металлы из их оксидов:
NiO + CO = Ni + CO2 (реакция протекает при нагревании)
Оксид углерода (IV). Угольная кислота. Соли угольной кислоты
Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
CaCO3 = CaO + CO2 (реакция протекает при нагревании) (1)
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O (2)
Углекислый газ – типичный кислотный оксид. Он реагирует с основными и амфотерными оксидами и основаниями, образуя соли угольной кислоты – карбонаты:
CO2 + CaO = CaCO3
Al2O3 + 3CO2 = Al2(CO3)3
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Последняя реакция является качественной на углекислый газ – помутнение известковой воды за счет образования белого осадка карбоната кальция.
При растворении углекислого газа в воде частично образуется угольная кислота – H
H2O + CO2↔H2CO3↔H+ + HCO3—↔2H+ + CO32-
Угольная кислота – очень слабая, она неустойчива и разлагается на углекислый газ и воду. В связи с возможностью равновесий, указанных выше, угольная кислота образует два типа солей – средние – карбонаты (кислотный остаток — CO32-) и кислые – гидрокарбонаты (кислотный остаток — HCO 3—). Качественная реакция на эти соли – выделение углекислого газа при действии на них сильных кислот:
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
Соли угольной кислоты могут быть получены действием CO 2 на щелочи или по обменной реакции между растворимыми солями угольной кислоты и солями других кислот:
NaOH + CO2 = NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Все карбонаты, за исключением карбонатов щелочных металлов, при нагревании подвергаются разложению на CO2 и соответствующие оксиды:
MgCO3 = MgO + CO2↑
CaCO3 = CaO + CO2↑
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3 = Na2CO3 + CO2↑ + H2O
Примеры решения задач
Угольный ангидрид угольная кислота — Знаешь как
Угольный ангидрид, или углекислый газ, постоянно образуется в природе при всевозможных процессах окисления органических веществ (гниение растительных и животных остатков, сжигание топлива, дыхание). В больших количествах углекислый газ выделяется из трещин земли в вулканических местностях и из воды минеральных источников.
В лабораториях угольный ангидрид обычно получают, действуя на мрамор СаСО3 соляной кислотой:
СаСО3 + 2НСl =СаСl2 + Н2О + СО2
В промышленности большие количества угольного ангидрида получают как побочный продукт при выжигании извести:
CaCO3 = CaO+CO2
Угольный ангидрид при обыкновенных условиях — бесцветный газ, примерно в полтора раза тяжелее воздуха, благодаря чему его можно переливать, как жидкость, из одного сосуда в другой. Один литр угольного ангидрида при нормальных условиях весит 1,98 г. Вода растворяет значительные количества угольного ангидрида. При 20° один объем воды растворяет 0,88 объемов СO2, а при 0° 1,7 объема. Применяется угольный ангидрид главным образом при получении соды по аммиачному способу , для синтеза мочевины, для получения солей угольной кислоты, в свеклосахарной промышленности, а также для газирования фруктовых и минеральных вод, вина, пива и других напитков.
Под давлением около 60 ат угольный ангидрид при обыкновенной температуре превращается в жидкость. Жидкий угольный ангидрид хранят в стальных баллонах. При быстром выливании ею из баллона поглощается, вследствие испарения, так много тепла, что угольный ангидрид превращается в твердую белую снегообразную массу, которая, не плавясь, возгоняется при—78,5°.
Твердый угольный ангидрид под названием «сухого льда» применяется для охлаждения скоропортящихся продуктов, для производства и сохранения мороженого, а также во многих других случаях, когда требуется получение низкой температуры.
Раствор угольного ангидрида в воде имеет слегка кисловатый вкус и обнаруживает слабокислую реакцию на лакмус, обусловленную присутствием в растворе небольших количеств угольной кислоты Н2СО3, образующейся в результате следующей обратимой реакции:
СО, + Н2O ⇄ Н2СO3
Равновесие этой реакции сильно сдвинуто влево, так что не больше 1 % растворенного со2превращается в угольную кислоту.
Угольная кислота Н2СO3 может существовать только в водном растворе^При нагревании раствора углекислый газ улетучивается, равновесие смещается влево и, в конце концов, остается чистая вода. Формула угольной кислоты установлена на основании анализа ее солей.
Угольная кислота является очень слабой кислотой. В растворе она распадается главным образом на ионы Н• и НСО3‘ и лишь в самом ничтожном количестве образует ионы СО3«:
H2CO3 ⇄ H• + HCO3‘ ⇄ 2H• + CO3»
Как кислота двухосновная, угольная кислота образует два ряда солей — нормальные и кислые; нормальные соли называются карбонатами, кислые — гидрокарбонатами.
Соли угольной кислоты могут быть получены или действием на щелочи углекислого газа, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:
NaOH + СО2= NaHCО3
NaHCO3 + NaOH = Na2CО3+ H2О BaCl2 + Na2CО3 = ↓BaCО3 + 2NaCl
Co слабыми основаниями угольная кислота в большинстве случаев дает только основные соли, примером которых может служить основной карбонат меди Cu2(ОH)2CО3. Встречающийся в природе минерал такого состава называется малахитом.
При действии кислот, даже таких слабых, как уксусная, все соли угольной кислоты разлагаются с выделением углекислого газа. Эта реакция очень характерна и часто служит для открытия карбонатов, так как выделение углекислого газа легко обнаружить по происходящему при этом шипению или с помощью горящей лучинки.
При более или менее сильном нагревании все соли угольной кислоты, кроме солей щелочных металлов, разлагаются с выделением углекислого газа. Продуктами разложения в большинстве случаев являются окислы соответствующих металлов. Например:
MgCО3 = MgO + CО2
СаСО3=СаО + СО2
Гидрокарбонаты щелочных металлов при нагревании переходят в карбонаты:
2NaHCО3 = Na2CО3 + СО2 + Н2О
Карбонаты калия, натрия и аммония, а также большинство гадрокарбонатов растворимы в воде, карбонаты других металлов в воде нерастворимы.
Растворы карбонатов калия и натрия, вследствие гидролиза, имеют сильно щелочную реакцию:
Na2CО3 + Н2О ⇄ NaHCО3 + NaOH
или
СО3» + h3O ⇄ HCO3‘ + OH’
Этим объясняется, между прочим, их применение при стерке белья (щелочи способствуют удалению жиров с грязного белья).
Так же действует и настой золы на воде (так называемый «щелок») вследствие содержания в нем карбоната калия.
Из солей угольной кислоты в природе чрезвычайно распространен карбонат кальция СаСО3. Он встречается в различных видах: известняк, мел, мрамор — все это лишь разновидности карбоната кальция. Эта же соль содержится почти во всякой почве.
Карбонат кальция нерастворим в воде. Поэтому известковая вода при пропускании через нее углекислого газа мутнеет:
Ca(OH)2 + СO2 = ↓СаСO3 + Н2O
Однако если долгое время пропускать сквозь известковую воду углекислый газ, то, мутная вначале, жидкость постепенно светлеет и, наконец, становится совершенно прозрачной. Растворение происходит вследствие образования кислой соли — гидрокарбоната кальция:
СаСO3 + Н2O + СO2 = Са(НСO3)2
Гидрокарбонат кальция — вещество непрочное. При кипячении раствора или просто при продолжительном его стоянии на воздухе гидрокарбонат разлагается с выделением углекислого газа и образованием нормальной соли.
Растворимостью гидрокарбонатов в воде объясняется постоянное передвижение карбонатов в природе. Дождевая вода, содержащая углекислый газ, поглощенный ею из воздуха, просачиваясь сквозь почву и особенно сквозь пласты известняка, растворяет карбонат кальция и уносит его с собой в виде гидрокарбоната в ручьи, реки и моря. Оттуда он попадает в организмы морских животных и идет на построение их скелетов или, теряя углекислый газ, снова превращается в карбонат кальция и отлагается в виде пластов.
Кроме карбоната кальция, в природе встречается в больших количествах карбонат магния MgCO3, известный под названием магнезита. Карбонат магния, так же как и карбонат кальция, легко растворяется в воде, содержащей углекислый газ, переходя в растворимую кислую соль.
Некоторые карбонаты являются ценными рудами и служат для получения металлов (например, шпатовый железняк FeCO3, галмей ZnCO3 и др.).
В технике и домашнем обиходе широкое применение имеют карбонаты и гидрокарбонаты натрия и калия.
Карбонат натрия Na2СO3, или сода, является одним из главных продуктов основной химической промышленности. В огромных количествах сода потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности, а также служит для получения различных солей натрия. Применение соды в домашнем обиходе общеизвестно.
До конца XVIII в. вся сода, применявшаяся в промышленности, получалась исключительно из природных источников. Такими источниками являлись естественные отложения карбоната натрия, встречающиеся в Египте и некоторых других местах, зола морских водорослей и растений, произрастающих на солончаковой почве, и содовые озера. В 1775 г. французская академия наук, ввиду недостатка щелочей во Франции, назначила премию за изобретение наилучшего способа получения соды из поваренной соли. Однако прошло 16 лет, прежде чем заинтересовавшийся этим вопросом французский врач Николай Леблан разработал экономически выгодный сульфатный способ получения соды и в 1791 г. осуществил его в производственном масштабе.
Сульфатный способ в основном сводится к следующим процессам. Сначала поваренная соль действием серной кислоты превращается в сульфат натрия:
2NaCl + H2SО4 = 2НСl + Na2SO4
Сульфат натрия смешивают с известняком и углем и подвергают прокаливанию. Уголь восстанавливает сульфат в сульфид натрия:
Na2SO4 + 2С = Na2S + 2СO2
Сульфид натрия вступает в реакцию с известняком, образуя сульфид кальция и соду:
Na2S + СаС03= Na2CO3 + CaS
Сплав, состоящие из соды, сульфида кальция, избытка угля и извести, обрабатывают водой для растворения карбоната натрия. Присутствие избытка извести, образующейся при разложении СаСО3, препятствует гидролизу сульфида кальция и превращению его в растворимую кислую соль Ca(HS)2, что позволяет полностью извлечь карбонат натрия из сплава. Раствор карбоната сгущают выпариванием до начала кристаллизации. При низкой температуре образуются легко выветривающиеся на воздухе кристаллы декагидрата Na2CO3 • Н2О; при более высокой температуре выкристаллизовывается моногидрат Na2CO3 • Н2О.
Побочными продуктами при получении соды по сульфатному способу являются: сульфид кальция, не имеющий промышленного применения, и хлористый водород, который в первое время выпускался на воздух, теперь же используется для получения соляной кислоты.
В 60-х годах XIX в. Сольвеем был предложен новый «аммиачный» способ получения соды из поваренной соли.
Аммиачный способ основан на образовании гидрокарбоната натрия при реакции между поваренной солью и гидрокарбонатом аммония в водном растворе.
В промышленности эта реакция осуществляется следующим образом. Концентрированный раствор поваренной соли насыщают при охлаждении аммиаком, а затем пропускают в него под давлением углекислый газ, получаемый обжигом известняка. При взаимодействии аммиака, углекислого газа и воды образуется гидрокарбонат аммония:
NH3+ СO2 + Н2O = NH4HCO3
который, вступая в обменную реакцию с поваренной солью, дает хлорид аммония и гидрокарбонат натрия:
NH4HCO3 + NaCl = ↓NaHCO3 + NH4Cl
Течение этой реакции обусловлено тем, что гидрокарбонат натрия трудно растворим в холодной воде и выделяется в виде осадка который может быть отделен фильтрованием.
При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и углекислый газ, вновь поступающий в производство:
2NaHCO3= Na2CO3 + СO2 + Н2O
Нагревая раствор, содержащий хлористый аммоний, с известью, выделяют обратно аммиак:
2NH4Cl + Са (ОН)2 = 2NH3+СаСl2 + 2Н2O
Таким образом, при аммиачном способе получения соды единственным отходом производства является хлористый кальций, остающийся в растворе после выделения аммиака и имеющий ограниченное применение.
Полученная по аммиачному способу сода не содержит кристаллизационной воды и называется кальцинированной содой.
Часть гидрокарбоната натрия поступает в продажу. Гидрокарбонат натрия применяется |в медицине (так называемая «питьевая сода»), а также вместо дрожжей.
В настоящее время аммиачный способ почти полностью вытеснил из употребления сульфатный способ Леблана. Главное преимущество аммиачного способа перед сульфатным заключается в малом расходе топлива.
Производство кальцинированной соды в СССР непрерывно растет. В 1957 г. оно достигло 1618 тыс. т, примерно втрое превысив объем производства 1940 г.
Карбонат калия к2со3, или поташ. В прежнее время поташ получали исключительно из золы растений, выщелачивая ее водой и выпаривая полученный раствор. Теперь поташ получается главным образом действием углекислого газа на раствор едкого кали, образующийся при электролизе раствора хлористого калия
KOH + CO2 = KHCO3KHCO3 + KOH = K2CO3 + H2O
Поташ представляет собой белое порошкообразное вещество,, расплывающееся во влажном воздухе и легко растворимое в воде. Применяется он при производстве мыла, при изготовлении тугоплавкого стекла, в фотографии и т. д.
158 159 160
Вы читаете, статья на тему Угольный ангидрид угольная кислота
znaesh-kak.com
Угольная кислота — это… Что такое Угольная кислота?
У́гольная кислота́ — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива[2]. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
См. также
Примечания
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
veter.academic.ru
Угольная кислота — это… Что такое Угольная кислота?
У́гольная кислота́ — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива[2]. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
См. также
Примечания
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
med.academic.ru
Угольная кислота — это… Что такое Угольная кислота?
У́гольная кислота́ — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива[2]. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
См. также
Примечания
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
dal.academic.ru
