Углекислый газ (диоксид углерода) — Актуальные публикации на сайте компании «НИИ КМ»
Он не пригоден для поддержания жизни. Однако именно им «питаются» растения, превращая его в органические вещества. К тому же он является своеобразным «одеялом» Земли. Если этот газ вдруг исчезнет из атмосферы, на Земле станет гораздо прохладнее, а дожди практически исчезнут.
«Одеяло Земли»
Углекислый газ (двуокись углерода, диоксид углерода, CO2) формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые, в свою очередь, производят кислород.
Углекислый газ бесцветен и тяжелее воздуха. Замерзает при температуре −78.5°C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать.
Углекислый газ — это «одеяло» Земли. Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство. И если вдруг углекислый газ исчезнет из атмосферы, то это в первую очередь скажется на климате. На Земле станет гораздо прохладнее, дожди будут выпадать очень редко. К чему это в конце концов приведет, догадаться нетрудно.
Правда, такая катастрофа нам пока еще не грозит. Скорее даже, наоборот. Сжигание органических веществ: нефти, угля, природного газа, древесины – постепенно увеличивает содержание углекислого газа в атмосфере. Значит, со временем надо ждать значительного потепления и увлажнения земного климата. Кстати, старожилы считают, что уже сейчас заметно теплее, чем было во времена их молодости…
Двуокись углерода выпускается жидкая низкотемпературная, жидкая высокого давления и газообразная. Ее получают из отбросных газов производств аммиака, спиртов, а также на базе специального сжигания топлива и других производств. Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м3. Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Углекислый газ нетоксичен и невзрывоопасен. При концентрациях более 5% (92 г/м3) двуокись углерода оказывает вредное влияние на здоровье человека — она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Получение двуокиси углерода
В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
«Сухой лед» и прочие полезные свойства диоксида углерода
В повседневной практике углекислый газ используется достаточно широко. Например, газированная вода с добавками ароматных эссенций – прекрасный освежающий напиток. В пищевой промышленности диоксид углерода используется и как консервант — он обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Углекислотными огнетушителями пользуются при пожарах. Биохимики нашли, что удобрение… воздуха углекислым газом весьма эффективное средство для увеличения урожайности различных культур. Пожалуй, такое удобрение имеет единственный, но существенный недостаток: применять его можно только в оранжереях. На заводах, производящих диоксид углерода, сжиженный газ расфасовывают в стальные баллоны и отправляют потребителям. Если открыть вентиль, то из отверстия с шипением вырывается… снег. Что за чудо?
Если открыть вентиль, то из отверстия с шипением вырывается… снег. Что за чудо?
Все объясняется просто. Работа, затраченная на сжатие газа, оказывается значительно меньше той, которая требуется на его расширение. И чтобы как-то компенсировать возникающий дефицит, углекислый газ резко охлаждается, превращаясь в «сухой лед». Он широко используется для сохранения пищевых продуктов и перед обычным льдом имеет значительные преимущества: во-первых, «хладопроизводительность» его вдвое выше на единицу веса; во-вторых, он испаряется без остатка.
Углекислый газ используется в качестве активной среды при сварке проволокой, так как при температуре дуги углекислота разлагается на угарный газ СО и кислород, который, в свою очередь, и входит во взаимодействие с жидким металлом, окисляя его.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Органический амин поглотил 99 процентов углекислого газа
Сложность 4.2
Зависимость доли поглощенного углекислого газа от времени для разных соединений. Красная линия соответствует амину на основе изофорона
Seiji Yamazoe et al. / ACS Environmental Au, 2022
Японские химики научились собирать до 99 процентов углекислого газа из его смеси с азотом. Они использовали органический амин, который реагировал с углекислым газом с образованием нерастворимой карбаминовой кислоты. При небольшом нагревании кислота выделяла углекислый газ обратно, пишут ученые в журнале ACS Environmental Au.
Чтобы сократить количество углекислого газа в атмосфере, химики ищут способы избирательной фиксации этого газа из воздуха. Часто для этих целей они применяют органические амины. При взаимодействии с углекислым газом амины образуют гидрокарбонаты — соли угольной кислоты, которая получается при растворении углекислого газа в воде. Эти соли, как правило, хорошо растворяются в воде, и чтобы выделить из них углекислый газ обратно, раствор приходится сильно нагревать. Кроме того, из-за обратимости процесса поглощение часто оказывается неэффективным.
Но есть еще один подход, позволяющий фиксировать CO2 более эффективно. Дело в том, что некоторые амины при взаимодействии с углекислым газом дают карбаминовые кислоты. Эти соединения плохо растворяются в воде и выпадают в осадок при пропускании углекислого газа через раствор амина. Но у них тоже есть недостаток — часто они неустойчивы и слишком легко выделяют углекислый газ обратно.
Реакция амина с углекислым газом приводит к карбаминовой кислоте. Именно этот амин использовали японские химики
Именно этот амин использовали японские химикиSeiji Yamazoe et al. / ACS Environmental Au, 2022
Поделиться
Химики под руководством Сэйдзи Ямадзоэ (Seiji Yamazoe) из Токийского столичного университета проверили несколько разных аминов и выяснили, что первичные амины, связанные с шестичленными циклами из атомов углерода, легко образуют нерастворимые карбаминовые кислоты. Они решили, что эти соединения можно применить для фиксации CO2 из воздуха.
Химики взяли для эксперимента амин, содержащий изофороновый фрагмент. Они растворили его в диметилсульфоксиде и пробулькали через раствор смесь углекислого газа с азотом (концентрация углекислого газа — четыре десятитысячных процента). Концентрацию CO Через 21 час поглощение газа полностью прекратилось.
Через 21 час поглощение газа полностью прекратилось.
Установка для проверки эффективности поглощения углекислого газа. Через 2,5 часа эксперимента в пробирке с амином выпал осадок
Seiji Yamazoe et al. / ACS Environmental Au, 2022
Поделиться
Далее химики повторили эксперимент, но в этот раз они использовали смесь газов с одной третью CO2 в ее составе. В этом случае доля поглощенного CO2 была ниже, но первые несколько минут эксперимента она превышала 90 процентов. Авторы статьи подчеркивают, что этот результат показывает превосходство их амина над этаноламином — одним из лучших на сегодняшний день поглотителей CO 2.
Удостоверившись, что поглощение происходит эффективно, ученые решили проверить, можно ли выделить углекислый газ из карбаминовой кислоты обратно. Они провели термогравиметрическое исследование и выяснили, что весь поглощенный CO2 выделяется при нагревании кислоты до 60 градусов Цельсия. Так химики показали, что поглощенный углекислый газ можно при желании выделить обратно.
Так химики показали, что поглощенный углекислый газ можно при желании выделить обратно.
Далее химики провели пять последовательных экспериментов, в которых они сначала пробулькивали CO2 через раствор амина, а затем нагревали карбаминовую кислоту до полного выделения поглощенного газа. В результате они выяснили, что эффективность поглощения газа не падает при многократном использовании их амина.
Так химики предложили одну из самых эффективных на сегодняшний день методик поглощения CO
Собранный из атмосферы углекислый газ можно применять в некоторых химических реакциях. Например, недавно мы рассказывали, как CO2 может ускорять реакции синтеза амидов.
Михаил Бойм
Тоники и лимонады
здоровый подход
к газированным напиткам
Уникальная рецептура на основе экстрактов из трав, ягод, фруктов или цветов
В 8 раз меньше сахара и калорий,
по сравнению с аналогами
В МАГАЗИН
В МАГАЗИН
МЫ 10 ЛЕТ ТЕСТИРОВАЛИ ИНГРЕДИЕНТЫ СО ВСЕГО ЗЕМНОГО ШАРА
Сладость природы
В наших напитках в 8 раз меньше сахара, по сравнению с аналогами других производителей. Сахар содержится в ягодах и фруктах, поэтому мы добавляем всего 6,7 гр. на 100 мл.
Сахар содержится в ягодах и фруктах, поэтому мы добавляем всего 6,7 гр. на 100 мл.
Ингредиенты для
здоровья
В основе наших тоников — кора хинного дерева. Она снимает воспалительные процессы, выводит токсины из организма. Шалфей и имбирь укрепляют иммунную систему. Цитрусовые улучшают состояние человека
Баланс горечи и сладости
Сладкие напитки уже не в моде. Популярность набирают сложные горьковатые вкусы.
Мы нашли баланс в виде главной составляющей наших тоников –– хинина, который не только приносит пользу организму, но и насыщает напитки легкой приятной горечью
Бутылка из тёмного стекла или алюминия объёмом 0,33 литра сохраняет полезные свойства от воздействия ультрафиолета.
Храните напиток не больше 270 дней с даты производства при температуре +3 — +25°C.
Не оставляйте напиток на солнце и при комнатной температуре больше, чем на 3 часа.
Энергетическая ценность на 100 мл:
белки 0,2 гр, жиры 0,1 гр, углеводы 6,7 гр
УСЛОВИЯ ХРАНЕНИЯ
Добавьте кубики льда или используйте как основу для коктейлей
ФИРМЕННЫЕ ТОНИКИ
Tonic Water Classic
Классический тоник имеет абсолютно чистый вкус.
 В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.
В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты (цедра лимона, цедра апельсина), хинин
В магазин Tonic Water Herbal
Смешав различные травы и цветы со всего мира, добавив кору хинного дерева из Конго, мы получили яркий и ароматный травяной тоник. Во вкусе можно уловить ноты болгарской розы, французской лаванды, розмарина с гор Греции и сибирского чабреца.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (мята, чабрец, розмарин, роза, лаванда, лемонграсс), хинин
В магазин Tonic Water Floberry
Легкие цветочные ноты французской лаванды в сочетании со сладостью болгарской розы, малиной и чёрной смородиной — это наш ягодный тоник.
 Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.
Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.Состав: подготовленная вода, концентрированный сок малины (5%), концентрированный сок черной смородины (5%), сахар, лимонная кислота, СО2 экстракты (роза, лаванда), хинин
В магазин Tonic Water Blueberry
Тайский лемонграсс, краснодарская мята, таёжная черника и кора хинного дерева из Конго — это черничный тоник. Свежий и лёгкий тоник, не только утолит жажду, но и будет полезен организму.
Состав: подготовленная вода, концентрированный сок черники (10%), сахар, лимонная кислота, СО2 экстракты (мята, лемонграсс), хинин
В магазин
Tonic Water Classic
Классический тоник имеет абсолютно чистый вкус.
 В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.
В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты (цедра лимона, цедра апельсина), хинин
В магазин Tonic Water Herbal
Смешав различные травы и цветы со всего мира, добавив кору хинного дерева из Конго, мы получили яркий и ароматный травяной тоник. Во вкусе можно уловить ноты болгарской розы, французской лаванды, розмарина с гор Греции и сибирского чабреца.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (мята, чабрец, розмарин, роза, лаванда, лемонграсс), хинин
В магазин Tonic Water Floberry
Легкие цветочные ноты французской лаванды в сочетании со сладостью болгарской розы, малиной и чёрной смородиной — это наш ягодный тоник.
 Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.
Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.Состав: подготовленная вода, концентрированный сок малины (5%), концентрированный сок черной смородины (5%), сахар, лимонная кислота, СО2 экстракты (роза, лаванда), хинин
В магазин Tonic Water Bluberry
Тайский лемонграсс, краснодарская мята, таёжная черника и кора хинного дерева из Конго — это черничный тоник. Свежий и лёгкий тоник, не только утолит жажду, но и будет полезен организму.
Состав: подготовленная вода, концентрированный сок черники (10%), сахар, лимонная кислота, СО2 экстракты (мята, лемонграсс), хинин
В магазин
Tonic Water Classic
Классический тоник имеет абсолютно чистый вкус.
 В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.
В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты (цедра лимона, цедра апельсина), хинин
В магазин Tonic Water Herbal
Смешав различные травы и цветы со всего мира, добавив кору хинного дерева из Конго, мы получили яркий и ароматный травяной тоник. Во вкусе можно уловить ноты болгарской розы, французской лаванды, розмарина с гор Греции и сибирского чабреца.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (мята, чабрец, розмарин, роза, лаванда, лемонграсс), хинин
В магазин Tonic Water Floberry
Легкие цветочные ноты французской лаванды в сочетании со сладостью болгарской розы, малиной и чёрной смородиной — это наш ягодный тоник.
 Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.
Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.Состав: подготовленная вода, концентрированный сок малины (5%), концентрированный сок черной смородины (5%), сахар, лимонная кислота, СО2 экстракты (роза, лаванда), хинин
В магазин Tonic Water Bluberry
Тайский лемонграсс, краснодарская мята, таёжная черника и кора хинного дерева из Конго — это черничный тоник. Свежий и лёгкий тоник, не только утолит жажду, но и будет полезен организму.
Состав: подготовленная вода, концентрированный сок черники (10%), сахар, лимонная кислота, СО2 экстракты (мята, лемонграсс), хинин
В магазин
Пейте в жаркую погоду как самостоятельный напиток
НАТУРАЛЬНЫЕ ЛИМОНАДЫ
Strawberry Sage
Мы добавили в лёгкий имбирный эль садовую клубнику и богатый аромат пряного шалфея.
 В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время.
В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время.Состав: подготовленная вода, концентрированный сок клубники (10 %), сахар, лимонная кислота, СО2 экстракт шалфея
В магазин Ginger Beer
Для этого лимонада мы используем органический экстракт китайского имбиря. Он носит яркий и знойный характер. Вкус ещё долго будет оставаться на языке, ровно, как и ощущение жгучести. Идеально подходит для любителей имбиря, а так же для согревания после мороза.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракт имбиря
В магазин Ginger Ale
В лимонаде «имбирный эль» мы используем экстракт китайского имбиря и целый набор специй со всего мира.
 Вкус и аромат лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета
Вкус и аромат лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитетаСостав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (имбирь, гвоздика, корица, мускатный орех, цедра апельсина, кардамон)
В магазин
Strawberry Sage
Мы добавили в лёгкий имбирный эль садовую клубнику и богатый аромат пряного шалфея. В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время.

Состав: подготовленная вода, концентрированный сок клубники (10 %), сахар, лимонная кислота, СО2 экстракт шалфея
В магазин Ginger Beer
Для этого лимонада мы используем органический экстракт китайского имбиря. Он носит яркий и знойный характер. Вкус ещё долго будет оставаться на языке, ровно как и ощущение жгучести. Идеально подходит для любителей имбиря, а так же для согревания после мороза.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракт имбиря
В магазин Ginger Ale
В лимонаде «Имбирный эль» мы используем экстракт китайского имбиря и целый набор специй со всего мира.
 Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (имбирь, гвоздика, корица, мускатный орех, цедра апельсина, кардамон)
В магазин
Strawberry Sage
Мы добавили в лёгкий имбирный эль садовую клубнику и богатый аромат пряного шалфея. В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время.

Состав: подготовленная вода, концентрированный сок клубники (10 %), сахар, лимонная кислота, СО2 экстракт шалфея
В магазин Ginger Beer
Для этого лимонада мы используем органический экстракт китайского имбиря. Он носит яркий и знойный характер. Вкус ещё долго будет оставаться на языке, ровно, как и ощущение жгучести. Идеально подходит для любителей имбиря, а так же для согревания после мороза.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракт имбиря
В магазин Ginger Ale
В лимонаде «Имбирный эль» мы используем экстракт китайского имбиря и целый набор специй со всего мира.
 Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (имбирь, гвоздика, корица, мускатный орех, цедра апельсина, кардамон)
В магазин
Strawberry Sage
Мы добавили в лёгкий имбирный эль садовую клубнику и богатый аромат пряного шалфея. В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время.

Состав: подготовленная вода, концентрированный сок клубники (10 %), сахар, лимонная кислота, СО2 экстракт шалфея
В магазин Ginger Beer
Для этого лимонада мы используем органический экстракт китайского имбиря. Он носит яркий и знойный характер. Вкус ещё долго будет оставаться на языке, ровно, как и ощущение жгучести. Идеально подходит для любителей имбиря, а так же для согревания после мороза.
Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракт имбиря
В магазин Ginger Ale
В лимонаде «Имбирный эль» мы используем экстракт китайского имбиря и целый набор специй со всего мира.
 Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.Состав: подготовленная вода, сахар, лимонная кислота, CO2 экстракты трав и специй (имбирь, гвоздика, корица, мускатный орех, цедра апельсина, кардамон)
В магазин
ИЗ ЧЕГО СОСТОЯТ ТОНИКИ И ЛИМОНАДЫ
Кора хинного дерева
Кору добывают в Конго и провозят в Китай, где из неё добывают порошок хинин — такой же полезный, как имбирь, но не столь распространённый ингредиент. Хинин снимает воспалительные процессы и выводит токсины из организма. А напитку он придаёт аккуратный горьковатый вкус
Травы и имбирь
Травы добавляют каждому напитку тонкий аромат и вкус, но кроме этого хорошо влияют на организм: убирают воспаления, успокаивают нервную систему, улучшают кровообращение. Имбирь нам привозят с плантаций Китая, лаванду из Франции, розмарин из Греции. Чабрец и мяту получаем из Сибири, а лемонграсс из Тая
Чабрец и мяту получаем из Сибири, а лемонграсс из Тая
Ягоды и фрукты
Лимон из Сицилии, а горький апельсин из Мексики — натуральные соки цитрусовых помогают накопить необходимые витамины, чтобы не заболеть осенью. Клубнику, малину, чёрную смородину и розу нам доставляют из Краснодарского края, а чернику — из Сибири. Ягоды улучшают здоровье кожи и волос
Специи
Гвоздика, корица, мускатный орех, цедра апельсина и кардамон — приезжают к нам из самых разных стран. Они завершают вкусовую композицию напитков и тоже улучшают здоровье, делая иммунитет организма выносливее
Производство:
Москва, Новодмитровская 1с1, Хлебозавод
© 2020. Все права защищены
+7 (995) 903-62-15
Политика конфиденциальности
Гарвардский физик улавливает CO2 из атмосферы на деньги Билла Гейтса
Варвара Гранкова
В Глазго начинает работу открывшаяся вчера 26-я климатическая конференция ООН (COP26, 31 октября – 12 ноября).
Занимающая 4-е место по выбросам парниковых газов Россия предложит на саммите концепцию, что уголь, нефть и газ можно потреблять в одном месте, а связывать парниковые газы в другом, приводит The Bell прогноз Bloomberg. Огромный потенциал для этого есть у российских лесов, которые занимают 20% территории страны. Создание лесных карбоновых ферм и продажа углеродных кредитов позволит продлить использование ископаемого углеводородного топлива.
Огромный потенциал для этого есть у российских лесов, которые занимают 20% территории страны. Создание лесных карбоновых ферм и продажа углеродных кредитов позволит продлить использование ископаемого углеводородного топлива.
В марте тот же Bloomberg отмечал, что Канада с ее 3-м местом в мире по площади лесов и экономикой, в значительной степени базирующейся на добыче ископаемого топлива, также создает рынок углеродных кредитов, но система будет работать параллельно с усилиями по достижению углеродной нейтральности к середине века.
Канадский стартап Carbon Engineering собирается в промышленных масштабах извлекать CO2 из атмосферы и перерабатывать его в синтетическое топливо для автомобилей и кораблей. Компания не одинока в своих разработках. В Швейцарии над похожей технологией трудится стартап Climeworks, в США – Global Thermostat, а в Великобритании при Дэвиде Кэмероне была целая госпрограмма, но незадолго до его ухода в 2016 г. с поста премьер-министра ее финансирование стали сворачивать, и теперь пилотная установка CCS на угольной электростанции Феррибридж заброшена.
Carbon Engineering значительно опережает конкурентов, утверждает интернет-издание Canadian Business (до 2016 г. – печатный деловой журнал, издававшийся с 1927 г.). Экспериментальная установка стартапа работает с 2015 г. в окрестностях канадского города Сквомиш. В 2024 г. в Пермском нефтегазоносном бассейне в юго-западной части США начнет работу завод, который ежегодно будет извлекать из воздуха 1 млн т CO2. Проектируется и завод на 0,5–1 млн т на северо-западе Шотландии.
Небо в алмазах
Есть два типа геоинженерных решений для борьбы с потеплением, объяснял основатель Carbon Engineering в интервью на сайте Гарвардского университета. Первый – долгосрочные проекты по удалению CO2 из окружающей среды. Это не только технология Carbon Engineering, сюда же относится идея искусственно повысить содержание железа в Мировом океане, чтобы спровоцировать размножение планктона.
Второй – гораздо более быстродействующие проекты по созданию щита, который блокирует попадание части солнечного света на Землю. Эту идею изучали в том числе советские ученые из Института дождя профессора Оболенского в Ленинграде. Как сделать щит, подсказывает сама природа. В июле 1816 г. британская газета The Morning Post успокаивала читателей, что не они одни страдают от холодного лета: оно поразило почти всю Европу. В том же году писательница Мэри Шелли жаловалась в Женеве в своем дневнике, что холод и дождь держат их с мужем в четырех стенах. Они гостили на вилле лорда Байрона и коротали время за написанием историй о сверхъестественных явлениях – именно тогда Шелли выдумала Франкенштейна. Причиной такой погоды было извержение годом ранее вулкана Тамбора в Индонезии.
Эту идею изучали в том числе советские ученые из Института дождя профессора Оболенского в Ленинграде. Как сделать щит, подсказывает сама природа. В июле 1816 г. британская газета The Morning Post успокаивала читателей, что не они одни страдают от холодного лета: оно поразило почти всю Европу. В том же году писательница Мэри Шелли жаловалась в Женеве в своем дневнике, что холод и дождь держат их с мужем в четырех стенах. Они гостили на вилле лорда Байрона и коротали время за написанием историй о сверхъестественных явлениях – именно тогда Шелли выдумала Франкенштейна. Причиной такой погоды было извержение годом ранее вулкана Тамбора в Индонезии.
Три составляющие
Установка Кита выглядит как мешанина труб, гигантских блоков от кондиционеров, резервуаров и насосов. Как следует из описания Canadian Business, используя гидроксид кальция (гашеная известь), установка забирает CO2 с эффективностью 70–80%. То есть если во входящем воздухе 0,04% углекислого газа, то на выходе – около 0,01%. В ходе реакций на выходе снова получается гашеная известь (которая многократно используется для улавливания CO2) и чистый CO2.
В ходе реакций на выходе снова получается гашеная известь (которая многократно используется для улавливания CO2) и чистый CO2.
Экспериментальная установка в окрестностях канадского города Сквомиш действует с 2015 г. В день она собирает около тонны углекислого газа. Поначалу его выбрасывали обратно в атмосферу. Затем стали утилизировать.
С CO2 можно делать три вещи. Закачивать в подземное хранилище. Закачивать в нефтяные или газовые скважины для повышения эффективности добычи. Или делать то, чем в последние годы занимается Carbon Engineering: получать синтетическое топливо с помощью реакции углекислого газа с водородом. Этот процесс в компании назвали A2F – аir to fuels («воздух в топливо»). Как говорил Дэвид Кит Vox, себестоимость производства 1 л такого топлива – примерно $1, т. е. оно проигрывает в цене не только топливу из полезных ископаемых, но и многим видам биотоплива. 70% себестоимости приходится на водород. Его Carbon Engineering получает с помощью возобновляемых источников энергии. Но Кит надеется, что благодаря развитию технологий зеленой электроэнергетики к 2025 г. стоимость производства водорода снизится минимум на 25%.
Но Кит надеется, что благодаря развитию технологий зеленой электроэнергетики к 2025 г. стоимость производства водорода снизится минимум на 25%.
В апреле 1991 г. схожий эффект запустил вулкан Пинатубо на Филиппинах, который выбросил миллиарды тонн серы, приведшей к появлению облаков с повышенным отражением солнечного света. По оценкам ученых, это временно снизило среднюю глобальную температуру на 0,5 ˚C, пишет Christian Science Monitor. Вместо вулкана вполне хватит пары переоборудованных самолетов Gulfstream, раз в год распыляющих серную кислоту на высоте 20 км в районе экватора, уверял Кит журналистов MIT Technology Review. После соединения с водяным паром образуется сульфатный аэрозоль – частицы диаметром менее микрона. Ветер рассеет его по всему земному шару вплоть до полюсов. Аэрозоль будет отражать около 1% солнечных лучей.
Государственное управление космических исследований Швеции думало провести подобный эксперимент в ограниченном масштабе – распылить столько кислоты, чтобы только хватило для научных наблюдений. Но в апреле этого года отказалось от идеи под давлением местных общин и экологов. Одним из главных аргументов активистов было то, что фундаментальное исследование возможностей этой технологии может подорвать волю политиков к борьбе против выбросов парниковых газов.
Но в апреле этого года отказалось от идеи под давлением местных общин и экологов. Одним из главных аргументов активистов было то, что фундаментальное исследование возможностей этой технологии может подорвать волю политиков к борьбе против выбросов парниковых газов.
Упоминалось, конечно, и что сера – это загрязнитель атмосферы, разрушающий озоновый слой. Поэтому Кит говорил, что лучше всего было бы распылять измельченные алмазы. Но и этим вряд ли кто-то рискнет заняться. Вопрос не только в стоимости. Дело в том, что алмазная пыль рано или поздно упадет на землю и окажется в почве и в воде. Никто не в силах предсказать, будет ли это представлять опасность для природы и человека.
Меньшее из зол
Кит отнюдь не приверженец светоотражающих щитов. В интервью журналу Canadian Geographic он предостерегал: «Не надо спешить. Мы еще не знаем, как управлять планетой. И у нас нет ни институтов, ни властных структур для этого». Но вполне вероятно, что скоро, по его выражению, «человечество установит такие щиты и начнет вращать регулирующие их ручки». Потому что щит будет выглядеть меньшим из зол.
Потому что щит будет выглядеть меньшим из зол.
«Даже если мы сократим выбросы [парниковых газов] до нуля уже завтра, у нас все равно будет большая проблема с климатом», – говорил Кит Christian Science Monitor. Дело в том, что повышенная концентрация CO2 в атмосфере сохранится в течение десятилетий. Даже с нулевыми выбросами потепление будет продолжаться по инерции (по некоторым теориям, до 1000 лет).
Кита нельзя причислить к фанатичным борцам с потеплением. Он старается рассматривать проблему с разных сторон, и часто его высказывания вызывают бурю негодования у экологического сообщества. Canadian Geographic приводит два примера. «С экономической точки зрения не ясно, является ли глобальное потепление негативным фактором, – говорил Кит в 2006 г. – Кое-кто уже прикидывает, как его компания станет бурить нефтяные скважины [за Полярным кругом], когда потеплеет арктическое лето. То же относится и к [более южным] регионам Канады. Людям нравится там, где тепло, и вы дурак, если думаете, что для мест вроде Канады нет никаких преимуществ в том, что постепенно становится теплее».
А еще раньше Кит опубликовал в журнале PNAS Национальной академии наук США статью о возможном вреде для природы ветрогенераторов. Его исследование, проведенное вместе с коллегами, показало, что их массовое использование меняет характер ветров, а это, в свою очередь, меняет местный климат и даже климат больших регионов, поскольку изменяется количество переносимых ветрами тепла и влаги. В статье Кит задавался вопросом, насколько климатическая выгода от ветроэнергетики перевешивает климатические потери. Его ответ: возможно, вред отнимает пятую часть пользы. Но Кит призывал не отказываться от ветровой энергии, а просто тщательно исследовать ее побочные эффекты.
Моржи и птицы
На стене рабочего кабинета Кита в Гарварде висит бейдж, который его отец носил на конференции ООН по проблемам окружающей среды в 1972 г. в Стокгольме. И увлечение природой у него от отца-канадца. Кит родился в 1964 г. в Висконсине (США), где его отец учился в аспирантуре. Когда единственному ребенку исполнилось два года, семья переехала в Оттаву, где отец стал биологом канадской Службы охраны дикой природы. Мать Кита преподавала историю в Карлтонском университете в Оттаве, а мачеха была биологом.
Мать Кита преподавала историю в Карлтонском университете в Оттаве, а мачеха была биологом.
Вместе с отцом и мачехой Кит путешествовал по диким уголкам Канады. Вместе с дядей, который был одним из основателей Американской ассоциации птицеводов, наблюдал за птицами США и Канады. А коллега отца, изучавший белых медведей, был частым гостем в их доме. Сам Кит в 23 года на четыре месяца отправился на необитаемый остров Девон в составе Канадского Арктического архипелага, чтобы поработать помощником биолога. «Мы жили в маленькой фанерной хижине с видом на морскую гладь, – воспоминал он в интервью Canadian Geographic. – С помощью гидрофонов мы пытались различать моржей по их крикам. А чтобы идентифицировать их, наблюдая в бинокль, мы ставили на них метки». Кит сохранил увлечение природой – он отдыхает, сплавляясь по канадской реке Йеллоунайф, отправляясь в поход по острову Холмен или катаясь на лыжах по морскому льду в окрестностях эскимосского поселения Иглулик. Во время одной из таких вылазок на природу он познакомился с будущей женой, с которой у него двое детей – и с ними то ходят в поход по Скалистым горам, то едут в ливийскую пустыню, чтобы наблюдать солнечное затмение.
Однако работа биолога его не привлекала. Кит решил изучать физику. С учебой поначалу не складывалось. Дэвид не умел читать до третьего класса (позже у него диагностировали дислексию). Порой он получал плохие оценки на контрольных, потому что знал ответы, но не успевал их написать в отведенное время. «Вплоть до аспирантуры у меня чередовались очень плохие и очень хорошие отметки, – продолжал воспоминания Кит в разговоре с Canadian Geographic. – Даже сейчас моя орфография настолько плоха, что мне неловко, когда приходится писать от руки, без помощи компьютерной проверки правописания».
Но знания Кит всегда усваивал легко и умел их применять. На экзамене по физике в восьмом классе учитель поставил ему 99 баллов вместо максимальных 100 за то, что Кит уверял, что лучи света изгибаются под действием силы притяжения. Пожилой учитель просто не поверил, что это правда. А дома Кит собрал компьютер и написал для него собственную оперативную систему.
Помощь, а не панацея
Когда Дэвид учился в старших классах, друг семьи физик Пол Коркум три лета подряд брал его поработать в своей лазерной лаборатории. Вот почему Кит решил изучать физику. В 1986 г., учась в Университете Торонто, он занял 1-е место на всеканадском экзамене студентов-третьекурсников по физике. Коркум посоветовал ему продолжить обучение в MIT – и в 1991 г. Кит защитил там докторскую.
Вот почему Кит решил изучать физику. В 1986 г., учась в Университете Торонто, он занял 1-е место на всеканадском экзамене студентов-третьекурсников по физике. Коркум посоветовал ему продолжить обучение в MIT – и в 1991 г. Кит защитил там докторскую.
В MIT Кит руководил группой, создавшей первый атомный интерферометр (интерферометры применяются для измерения и исследования звуковых и электромагнитных волн). Это был очень громкий проект для аспиранта, про него написало немало научных журналов, включая американский Science и британский Nature. Но сам Кит был разочарован: «Во время этой работы не возникло ни одного вопроса о природе, на который мы бы не знали ответа». Область, в которой для человечества было полно белых пятен, Кит обнаружил в совместном курсе MIT и Гарварда по геоинженерии. «У нас была необычная учебная группа – мы знали больше, чем наши профессора», – говорил он Christian Science Monitor.
В 1992 г., будучи научным сотрудником Университета Карнеги Меллон, Кит совместно с профессором Хади Довлатабади опубликовал в американском журнале Eos статью «Серьезный взгляд на геоинженерию», где рассматривал способы борьбы с изменением климата. Как пишет Christian Science Monitor, тогда солнечная геоинженерия считалась уделом фриков от науки – широко обсуждать эту тему стали лишь в последнее десятилетие. А статья Кита и Довлатабади была одной из первых серьезных работ в этой области.
Как пишет Christian Science Monitor, тогда солнечная геоинженерия считалась уделом фриков от науки – широко обсуждать эту тему стали лишь в последнее десятилетие. А статья Кита и Довлатабади была одной из первых серьезных работ в этой области.
После этого Кит отправился в Гарвард, где шесть лет трудился в исследовательской группе известного ученого-климатолога Джеймса Андерсона. Затем снова работал в Университете Карнеги Меллон, а в 2004 г. вернулся в родную Канаду, в Университет Калгари.
Там, в Калгари, в 2005 г. и был проведен эксперимент – пятиметровая установка улавливала CO2 из воздуха и закачивала его в подземное хранилище. В 2009 г. Кит решил коммерциализировать эти исследования и основал в Канаде Carbon Engineering. Средства дали благотворительные фонды Билла Гейтса и канадского нефтяного магната Нормана Мюррея Эдвардса. В 2011 г. Кит уволился из Университета Калгари и переехал в США, чтобы работать в Гарварде, где и числится поныне.
Обычно фильтры для выбросов монтируют в трубах заводов. Но поскольку углекислый газ присутствует повсюду, то по замыслу Кита заводы могут ставить оборудование Carbon Engineering в любом месте. Главное, чтобы мощность оборудования превосходила объем выбросов углекислого газа заводом. Кит, однако, не устает повторять, что его технология хотя и помогает бороться с потеплением, но сама по себе не панацея: без сокращения выбросов парниковых газов человечеству все равно не обойтись.
Но поскольку углекислый газ присутствует повсюду, то по замыслу Кита заводы могут ставить оборудование Carbon Engineering в любом месте. Главное, чтобы мощность оборудования превосходила объем выбросов углекислого газа заводом. Кит, однако, не устает повторять, что его технология хотя и помогает бороться с потеплением, но сама по себе не панацея: без сокращения выбросов парниковых газов человечеству все равно не обойтись.
Углекислый газ вред и польза
Ещё в прошлом веке были проведены различные исследования по влиянию CO2 на организм человека. В 60-ых годах учёная О. В. Елисеева в своей диссертации приводит детальное исследование, как влияет углекислый газ в концентрациях 0,1% (1000 ррm) до 0,5% (5000 ррm) на организм человека, и пришла к выводу, что кратковременное вдыхание здоровыми людьми двуокиси углерода в этих концентрациях вызывает отчетливые сдвиги в функции внешнего дыхания, кровообращении и значительные ухудшения электрической активности головного мозга. Согласно ее рекомендациям, содержание CO2 в воздухе жилых и общественных зданий не должно превышать 0,1% (1000 ррm), а среднее содержание CO2 должно быть около 0,05% (500 ррm).
Исследователи знают, что существует связь между концентрацией CO2 и ощущением духоты. Это ощущение возникает у здорового человека уже на уровне 0,08%, т. е. 800 ррm. Хотя в современных офисах бывает 2000 ррm и более. И человек может не ощущать опасного воздействия CO2. Когда речь идёт о больном человеке, то порог чувствительности ещё увеличивается.
Основные изменения происходят, конечно же, в центральной нервной системе, и носят они при гиперкапнии фазный характер: сначала повышение, а затем снижение возбудимости нервных образований. Ухудшение условнорефлекторной деятельности наблюдается при концентрациях, близких 2%, понижается возбудимость дыхательного центра мозга, уменьшается вентиляторная функция лёгких, также нарушается гомеостаз (равновесие внутренней среды) организма, путем либо повреждения клеток, либо путем раздражения рецепторов неадекватным уровнем определенного вещества. А при содержании углекислого газа до 5% происходит значительное снижение амплитуды вызванных потенциалов головного мозга, десинхронизация ритмов спонтанной электроэнцефалограммы с дальнейшим угнетением электрической активности мозга.
Что происходит при повышении концентрации CO2 в воздухе, который попадает в организм? Увеличивается парциальное давление CO2 в наших альвеолах, его растворимость в крови повышается, и образуется слабая угольная кислота (CO2 + Н2O = Н2СО3), распадающаяся, в свою очередь, на Н+ и НССО3–. Кровь закисляется, что по-научному и называется ацидозом. Чем выше концентрация CO2 в воздухе, которым мы постоянно дышим, тем ниже рН крови и тем более кислую реакцию она имеет.
Когда начинается ацидоз, то сначала организм защищается, повышая концентрацию бикарбоната в плазме крови, — об этом свидетельствуют многочисленные биохимические исследования. Чтобы компенсировать ацидоз, почки усиленно выделяют Н+ и задерживают НССО3–. Потом включаются другие буферные системы, и вторичные биохимические реакции организма. Поскольку слабые кислоты, в т. ч. и угольная (Н2СО3), могут образовывать с ионами металлов слаборастворимые соединения (СаСО3), то они откладываются в виде камней, прежде всего в почках.
Сотрудник медицинской научно-исследовательской лаборатории военно-морского подводного флота США Карл Шафер исследовал, как влияют различные концентрации углекислого газа на морских свинок. Грызунов восемь недель содержали при 0,5% CO2 (кислород был в норме — 21%), после чего у них наблюдалась значительная кальцификация почек. Она отмечалась даже после длительного воздействия на морских свинок меньших концентраций — 0,3% CO2 (3000 ррm). Но это еще не все. Шафер и его коллеги нашли у свинок через восемь недель воздействия 1%-го CO2 деминерализацию костей, а также структурные изменения в легких. Исследователи расценили эти заболевания как адаптацию организма к хроническому воздействию CO2.
Отличительной особенностью долгосрочной гиперкапнии (повышенное CO2) является длительное отрицательное последствие. Несмотря на нормализацию атмосферного дыхания, в организме человека продолжительное время наблюдаются изменения биохимического состава крови, снижение иммунологического статуса, устойчивости к физическим нагрузкам и другим внешним воздействиям.
В нашем выдохе, примерно 4,5% углекислого газа. А если создать прибор накапливающий CO2. А если начать на нём дышать. То получится прибор «мечта начальника концлагеря». При этом в удушающую камеру жертвы направляются сами, потому что на входе написано «здоровье» и обещание, что когда у вас CO2 в крови будет 6,5%, то получите обещанное. И не важно, что по пути вы будете получать отравления мелкими дозами, привыкните и подготовитесь. Подготовитесь к разочарованию, так как отметка 6,5 это не причина здоровья, а следствие совсем противоположного действия.
Кто-то может сказать: «Когда двигаются деревья, то они создают ветер». Нет, всё наоборот. Дыхание с лечебным сопротивлением и с пониженным содержанием кислорода (как в горах) становится редким и глубоким. Кислород начинает хорошо усваиваться, расщепляются токсины и шлаки, содержащие кислород, проявляется естественный анаэробный способ получения энергии в теле человека. Каждая клетка организма начинает оживать. В результате потребность в кислороде уменьшается, а углекислый газ, отчасти занимает место кислорода. Как балансный газ он создаст устойчивую среду в организме.
Как балансный газ он создаст устойчивую среду в организме.
Именно такая идея описана в древних трактатах по дыханию, именно это доказал на практике доктор медицинских наук Стрелков Р. Б. и другие учёные детально показав эффективность гипоксической терапии (умеренное уменьшение кислорода во вдыхаемом воздухе). Именно такую задачу ставили В. Ф. Фролов и Е. Ф. Кустов, создавая дыхательный прибор ТДИ-01 для каждого человека на этой планете.
Тем не менее, несмотря на заявления Министерства Здравоохранения и видных научных деятелей страны продолжается выпуск и широкая реализация дыхательных приборов, работающих без внутреннего давления, как накопители CO2 под маркой «Самоздрав».
С середины 19 века содержание CO2 катастрофически растёт на 1,7% каждый год, что в конечном счёте может привести к выводу из равновесия систему Земля. И, похоже, производители «Самоздравов» поставили задачу ускорить приближение конца света. Перефразируя классика можно закончить словами:
Уж сколько раз твердили миру,
Что ложь гнусна, вредна; но только все не впрок,
И в сердце ложь всегда отыщет уголок.
Источник http://www.lotos-blagova.com/articles/polza-i-vred-uglekislogo-gaza/
Газированная вода – это напиток, любимый всеми поколениями, от малышей до бабушек. Колючие пузырьки углекислого газа в ней еще никого не оставили равнодушными. Но так ли безвредна газированная вода или ее употребление стоит ограничить?
Из чего состоит?
Состав газированной воды очень простой. Она содержит непосредственно воду и углекислый газ. Такой состав имеет простая газированная вода. Вред или польза будет от нее организму – это предмет непрекращающихся споров сторонников и противников правильного питания. Все зависит от того, какая вода в составе. Она бывает простой, минеральной или сладкой с добавлением красителей и ароматизаторов.
В зависимости от уровня насыщения углекислым газом вода бывает трех видов. Это слабогазированная, среднегазированная и сильногазированная вода. Уровень содержания углекислого газа в ней составляет от 0,2 до 0,4 процента соответственно.
Полезные свойства
Природная газированная вода известна человеку еще с древних времен. Изначально ее использовали только в качестве лечебного средства. Все желающие могли приехать к природному источнику, набрать воды и даже искупаться в ней. В XVIII веке вода начала разливаться в промышленных масштабах. Но поскольку такое предпринимательство оказалось невыгодным, так как жидкость быстро выдыхалась и теряла большую часть своих полезных свойств, было принято решение газировать ее искусственным путем.
Изначально ее использовали только в качестве лечебного средства. Все желающие могли приехать к природному источнику, набрать воды и даже искупаться в ней. В XVIII веке вода начала разливаться в промышленных масштабах. Но поскольку такое предпринимательство оказалось невыгодным, так как жидкость быстро выдыхалась и теряла большую часть своих полезных свойств, было принято решение газировать ее искусственным путем.
Положительное влияние на организм может оказать только газированная минеральная вода. Вред или польза от этого продукта будет зависеть от количества и качества употребляемого напитка. В целом природная минеральная вода назначается врачом в лечебных целях. Не рекомендуется злоупотреблять этим напитком, несмотря на то, что он способствует выработке желудочного сока при пониженной кислотности, поддерживает щелочной баланс, активизирует работу ферментов, предотвращает вымывание кальция из организма.
Помимо природной газированной воды, полезными для организма могут быть и сладкие напитки на основе лекарственных трав («Тархун», «Байкал», «Саяны»).
Негативное влияние и противопоказания
Вода, которая искусственно стала газированной благодаря добавлению в нее углекислого газа, имеет синтетическое происхождение и никакой пищевой ценности в себе не несет. Особенно это касается сладких напитков.
Вред газированной воды на организм человека заключается в том, что углекислота, которая присутствует в составе этого продукта, вызывает метеоризм, отрыжку и вздутие кишечника.
Сладкие газированные напитки особенно вредны для человека. Они способствуют нарушению работы поджелудочной железы и печени, вызывают сбои в эндокринной системе, провоцируют развитие сахарного диабета и других серьезных заболеваний.
Газированная вода, вред или польза которой заключаются в ее составе, может либо восстановить и поддержать водно-солевой баланс, либо нарушить его.
Минеральная газированная вода
Полезные микро- и макроэлементы, а также минеральные соединения делают продукт полезным для организма. Следует отметить, что, кроме уровня газирования, такая вода бывает разной минерализации. Слабая и средняя «минералка» подходит для ежедневного употребления. Она не только прекрасно утолит жажду, но и насытит организм полезными соединениями. А вот газированная вода с высокой степенью минерализации предназначена для использования в лечебных целях. Употреблять ее нужно только в ограниченном количестве, поскольку содержание полезных элементов в ней достаточно велико для повседневного использования.
Слабая и средняя «минералка» подходит для ежедневного употребления. Она не только прекрасно утолит жажду, но и насытит организм полезными соединениями. А вот газированная вода с высокой степенью минерализации предназначена для использования в лечебных целях. Употреблять ее нужно только в ограниченном количестве, поскольку содержание полезных элементов в ней достаточно велико для повседневного использования.
Газированная минеральная вода, вред или польза которой зависит от количества важных соединений в ней, безусловно, является более качественной, чем сладкие напитки. Но в каждом правиле есть исключения.
Сладкая газированная вода
Газированные напитки могут быть полезными. Все зависит от содержимого бутылки. Сладкая газированная вода, вред или польза которой являются предметом споров врачей, диетологов и производителей, может иметь в своем составе искусственные пищевые добавки или экстракты лекарственных трав.
«Дюшес» и «Тархун» содержат эстрагон, который является эффективным сосудосуживающим средством, улучшает работу пищеварительной системы и повышает аппетит. Газированная вода «Саяны» и «Байкал» имеет в своем составе экстракт растения левзея, который способствует снятию усталости, повышению активности мышц и нормализации нервной системы.
Газированная вода «Саяны» и «Байкал» имеет в своем составе экстракт растения левзея, который способствует снятию усталости, повышению активности мышц и нормализации нервной системы.
Помимо натуральных компонентов, в составе воды могут быть и вредные пищевые добавки: красители, консерванты, усилители вкуса. Такие газированные напитки могут вызвать привыкание, появление высыпаний и аллергических реакций, поражение слизистой оболочки желудка, повреждение эмали зубов.
Вред «шипучей» воды для ребенка
В последние годы диетологи и педиатры бьют тревогу. Родители все чаще стали покупать своим маленьким детям газированные напитки. Последствия от таких неразумных поступков налицо: количество мальчиков и девочек, страдающих ожирением, с каждым годом неуклонно растет. К чему может привести злоупотребление газировкой? Повышенная нервная возбудимость, проблемы с костной и эндокринной системами, плохие зубы. Все это лишь малая часть того, какой может быть вред сладкой газированной воды для организма.
Кроме детей, сладкую газировку следует исключить беременным женщинам и кормящим мамам, а также людям, которые ведут борьбу с лишним весом, заболеваниями органов желудочно-кишечного тракта, и аллергикам.
Газированная вода: вред или польза для похудения
Всем известно, что любая диета основана на достаточном потреблении жидкости, а именно чистой воды. В противном случае вес будет стоять на месте. Никакой пищевой и энергетической ценности газированная вода не несет. В ней не содержатся белки, жиры и углеводы, ее калорийность также равна нулю.
Способствовать похудению она будет точно так же, как и простая вода. Известно, что жидкость в желудке придает чувство сытости. Поэтому ее нужно пить обязательно тем, кто ведет активную борьбу с лишним весом. При этом вред газированной воды может проявляться в том, что она вызывает вздутие и метеоризм, то есть некоторый дискомфорт в кишечнике. Но если это не доставляет неудобств, то худеть можно с любой водой, и с газированной в том числе.
Следует отметить, что речь идет только о простой газированной воде, без пищевых добавок: подсластителей, консервантов, ароматизаторов, красителей. В противном случае вместо снижения веса можно заработать несколько дополнительных килограммов.
Подведение итогов
Сложно однозначно ответить на вопрос, что принесет организму газированная вода, вред или польза будет от ее употребления. Прежде всего, при выборе этого напитка следует обратить внимание на то, какое он имеет происхождение: природное или синтетическое. Натуральная минеральная вода содержит в своем составе полезные микроэлементы, которые способствуют оздоровлению организма. Газировка, особенно сладкая, полученная искусственным путем, не может быть полезной. От употребления напитков на ее основе следует ожидать только негативных последствий, ухудшения работы организма.
Источник http://fb.ru/article/202297/gazirovannaya-voda-vred-ili-polza-dlya-organizma
Ещё в прошлом веке были проведены различные исследования по влиянию CO2 на организм человека. В 60-ых годах учёная О.В.Елисеева в своей диссертации привела детальное исследование, как влияет углекислый газ в концентрациях 0,1% (1000 ррm) до 0,5% (5000 ррm) на организм человека и пришла к выводу, что кратковременное вдыхание здоровыми людьми двуокиси углерода в этих концентрациях вызывает отчетливые сдвиги в функции внешнего дыхания, кровообращении и значительные ухудшения электрической активности головного мозга. Согласно ее рекомендациям, содержание CO2 в воздухе жилых и общественных зданий не должно превышать 0,1% (1000 ррm), а среднее содержание CO2 должно быть около 0,05% (500 ррm).
В 60-ых годах учёная О.В.Елисеева в своей диссертации привела детальное исследование, как влияет углекислый газ в концентрациях 0,1% (1000 ррm) до 0,5% (5000 ррm) на организм человека и пришла к выводу, что кратковременное вдыхание здоровыми людьми двуокиси углерода в этих концентрациях вызывает отчетливые сдвиги в функции внешнего дыхания, кровообращении и значительные ухудшения электрической активности головного мозга. Согласно ее рекомендациям, содержание CO2 в воздухе жилых и общественных зданий не должно превышать 0,1% (1000 ррm), а среднее содержание CO2 должно быть около 0,05% (500 ррm).
Специалисты знают, что существует прямая связь между концентрацией CO2 и ощущением духоты. Это ощущение возникает у здорового человека уже на уровне 0,08% (т. е. 800 ррm). Хотя в современных офисах очень часто бывает 2000 ррm и более. И человек может не ощущать опасного воздействия CO2. Когда речь идёт о больном человеке, то порог его чувствительности ещё увеличивается.
Зависимость физиологических проявлений от содержания CO2 в воздухе приведена в таблице:
Основные изменения при вдыхании повышенных концентраций углекислого газа (гиперкапнии) происходят в центральной нервной системе, и носят они при этом фазный характер: сначала повышение, а затем снижение возбудимости нервных образований. Ухудшение условнорефлекторной деятельности наблюдается при концентрациях, близких к 2% – понижается возбудимость дыхательного центра мозга, уменьшается вентиляторная функция лёгких, нарушается гомеостаз (равновесие внутренней среды) организма путем либо повреждения клеток, либо путем раздражения рецепторов неадекватным уровнем определенного вещества. А при содержании углекислого газа до 5% происходит значительное снижение амплитуды вызванных потенциалов головного мозга, десинхронизация ритмов спонтанной электроэнцефалограммы с дальнейшим угнетением электрической активности мозга.
Ухудшение условнорефлекторной деятельности наблюдается при концентрациях, близких к 2% – понижается возбудимость дыхательного центра мозга, уменьшается вентиляторная функция лёгких, нарушается гомеостаз (равновесие внутренней среды) организма путем либо повреждения клеток, либо путем раздражения рецепторов неадекватным уровнем определенного вещества. А при содержании углекислого газа до 5% происходит значительное снижение амплитуды вызванных потенциалов головного мозга, десинхронизация ритмов спонтанной электроэнцефалограммы с дальнейшим угнетением электрической активности мозга.
Что именно происходит при повышении концентрации CO2 в воздухе, который попадает в организм? Увеличивается парциальное давление CO2 в альвеолах, его растворимость в крови повышается, и образуется слабая угольная кислота (CO2 + Н2O = Н2СО3), распадающаяся, в свою очередь, на Н+ и НССО3-. Кровь закисляется, что по-научному называется газовым ацидозом. Чем выше концентрация CO2 в воздухе, которым мы дышим, тем ниже рН крови и тем более кислую реакцию она имеет.
Когда начинается ацидоз, то сначала организм защищается, повышая концентрацию бикарбоната в плазме крови, – об этом свидетельствуют многочисленные биохимические исследования. Чтобы компенсировать ацидоз, почки усиленно выделяют Н+ и задерживают НССО3-. Потом включаются другие буферные системы, и вторичные биохимические реакции организма. Поскольку слабые кислоты, в т. ч. и угольная (Н2СО3), могут образовывать с ионами металлов слаборастворимые соединения (СаСО3), то они откладываются в виде камней, прежде всего в почках.
Сотрудник медицинской научно-исследовательской лаборатории военно-морского подводного флота США Карл Шафер исследовал, как влияют различные концентрации углекислого газа на морских свинок. Грызунов восемь недель содержали при 0,5% CO2 (кислород был в норме – 21%), после чего у них наблюдалась значительная кальцификация почек. Она отмечалась даже после длительного воздействия на морских свинок меньших концентраций – 0,3% CO2 (3000 ррm). Но это еще не все. Шафер и его коллеги нашли у свинок через восемь недель воздействия 1%-го CO2 деминерализацию костей, а также структурные изменения в легких. Исследователи расценили эти заболевания как адаптацию организма к хроническому воздействию повышенного уровня CO2.
Исследователи расценили эти заболевания как адаптацию организма к хроническому воздействию повышенного уровня CO2.
Отличительной особенностью долгосрочной гиперкапнии (повышенное CO2) являются длительные отрицательные последствия. Несмотря на нормализацию атмосферного дыхания, в организме человека продолжительное время наблюдаются изменения биохимического состава крови, снижение иммунологического статуса, устойчивости к физическим нагрузкам и другим внешним воздействиям.
Вывод – во избежание негативных последствий, содержание углекислого газа во вдыхаемом воздухе нужно обязательно контролировать. Для этой цели отлично подходит современный и надежный прибор – Детектор углекислого газа.
Источник http://alfaeco.su/o-vrede-uglekislogo-gaza-co2/
Диоксид углерода, Е290 – что это такое?
Диоксид углерода, также называемый углекислым газом, известен применяется в производстве продуктов питания как добавка E290. Химическая формула добавки E290 – CO2. Диоксид углерода при обычных условиях – это не имеющий запаха, бесцветный газ. Углекислый газ легко растворим в воде (1 литр CO2 в одном литре воды при температуре 15 °С) и образует при этом слабую кислоту.
Углекислый газ легко растворим в воде (1 литр CO2 в одном литре воды при температуре 15 °С) и образует при этом слабую кислоту.
Углекислый газ образуется в результате горения и биологического разложения (гниения) различных органических веществ, в процессе жизнедеятельности живых организмов (при гниении и разложении гумуса почв, при лесных пожарах, в результате сжигания нефтяных продуктов, газа и угля, в процессе дыхания растений, животных и человека. Организм человека, в котором диоксид углерода играет важнейшую роль, выделяет его в количестве, примерно равном 2,3 кг в сутки.
Углекислый газ относится к веществам, которые очень распространены в природе. Углекислота в колоссальных количествах присутствует в атмосфере и в минеральных источниках, значительное ее количество растворено в воде морей и океанов. В атмосфере нашей планеты концентрация углекислого газа примерно равна 0,04 %. Плотность диоксида углерода в полтора раза превышает плотность воздуха. Данное вещество является одним из так называемых парниковых газов, и его накопление в атмосфере – одна из причин ускорения глобального потепления. Диоксид углерода также входит в состав атмосферы нескольких планет нашей Солнечной системы: например, Марса и Венеры, и составляет значительную ее часть.
Диоксид углерода также входит в состав атмосферы нескольких планет нашей Солнечной системы: например, Марса и Венеры, и составляет значительную ее часть.
В промышленных количествах углекислый газ получают из дымовых газов или в процессе разложения минеральных карбонатов (доломита и известняка), а также как побочный продукт спиртового брожения. Полученную смесь газов подвергают разделению, очистке и получают конечный продукт – чистый диоксид углерода. Также существует способ получения E290 при производстве чистого кислорода, аргона и азота на установках для разделения воздуха.
Диоксид углерода, E290 – влияние на организм, вред или польза?
Углекислый газ нетоксичен и не опасен для здоровья. Необходимо помнить, что диоксид углерода ускоряет всасывание в слизистую оболочку желудка различных веществ, и может служить причиной быстрого опьянения при употреблении алкогольных напитков, его содержащих. Газированные диоксидом углерода напитки представляют собой фактически разбавленный раствор слабой угольной кислоты, поэтому активное употребление напитков, содержащих добавку Е290, противопоказано людям, имеющим медицинские проблемы с желудком и желудочно-кишечным трактом (гастриты, язвы и т. п.).
п.).
Пищевая добавка Е290, углекислый газ – применение в продуктах питания
При производстве пищевых продуктов добавка Е290 находит применение в роли газа для насыщения напитков, консерванта, антиоксиданта, регулятора кислотности и защитного газа. Диоксид углерода повсеместно используется при производстве безалкогольных и алкогольных газированных напитков. Угольная кислота, которая образуется при растворении CO2 в воде, проявляет антимикробные и обеззараживающие свойства.
В кондитерском и хлебопекарном производстве добавка Е290 находит применение в качестве разрыхлителя, придавая объем кондитерским и хлебобулочным изделиям. Также диоксид углерода широко используется в виноделии, где он выполняет функцию регулятора брожения. Углекислый газ используется как защитный газ при хранении различных пищевых продуктов.
Источник http://is-it-good.info/additives/e290-dioksid-ugleroda
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
Углеаммонийная сольПолученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Оксид цинкаZn + CO2 → ZnO + CO
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
Горение газа на плитеCH4 + 2O2 → CO2 + 2H2O + 891кДж
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
Молекула этанолаC2H5OH + 3O2 = 3H2O + 2CO2 + Q
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
youtube.com/embed/ZDWODmh3yNQ» allowfullscreen=»allowfullscreen»>Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
Образование глюкозы6CO2 + 6H2O → C6H12O6 + 6O2
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрияОбразование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Подкисление океана | Национальное управление океанических и атмосферных исследований
Основные направления:
Образование
Темы:
закисление океана
образование
За более чем 200 лет, прошедших с начала промышленной революции, концентрация углекислого газа (CO 2 ) в атмосфере увеличилась из-за действий человека. За это время рН поверхностных вод океана снизился на 0,1 единицы рН. Может показаться, что это не так уж и много, но шкала pH логарифмическая, поэтому это изменение соответствует примерно 30-процентному увеличению кислотности.
>
Показано, что панцирь птеропода со временем растворяется в морской воде с более низким pH. Когда углекислый газ поглощается океаном из атмосферы, химический состав морской воды изменяется.
(НОАА)
Когда углекислый газ поглощается океаном из атмосферы, химический состав морской воды изменяется.
(НОАА)
Загрузить изображение
Океан поглощает около 30% углекислого газа (CO 2 ), который выбрасывается в атмосферу. По мере того как уровни атмосферного CO 2 увеличиваются в результате деятельности человека, такой как сжигание ископаемого топлива (например, выбросы автомобилей) и изменение характера землепользования (например, вырубка лесов), количество углекислого газа, поглощаемого океаном, также увеличивается. Когда СО 2 поглощается морской водой, происходит ряд химических реакций, в результате которых увеличивается концентрация ионов водорода. Этот процесс имеет далеко идущие последствия для океана и существ, которые там живут.
Шкала рН
Шкала рН проходит от 0 до 14, где 7 соответствует нейтральному рН. Все, что выше 7, является основным (или щелочным), а все, что ниже 7, является кислым. Шкала pH является обратной величиной концентрации ионов водорода, поэтому большее количество ионов водорода приводит к более высокой кислотности и более низкому pH.
Шкала pH является обратной величиной концентрации ионов водорода, поэтому большее количество ионов водорода приводит к более высокой кислотности и более низкому pH.
Углекислый газ и морская вода
Углекислый газ, естественно присутствующий в атмосфере, растворяется в морской воде. Вода и углекислый газ объединяются, образуя угольную кислоту (H 2 CO 3 ), слабую кислоту, которая расщепляется (или «диссоциирует») на ионы водорода (H + ) и ионы бикарбоната (HCO 3 — ).
Из-за повышенного уровня углекислого газа в атмосфере, вызванного деятельностью человека, больше CO 2 растворяется в океане. Средний рН океана сейчас составляет около 8,1 за пределами площадки, что является щелочным (или щелочным), но поскольку океан продолжает поглощать больше CO 2 рН снижается, и океан становится более кислым.
NOAA представляет 10-летнюю дорожную карту по борьбе с окислением океана и Великих озер д. , начальник отдела морских экосистем Управления науки и технологий Службы рыболовства NOAA.
, начальник отдела морских экосистем Управления науки и технологий Службы рыболовства NOAA.
Воздействие закисления океана на строителей раковин
Подкисление океана уже оказывает воздействие на многие виды океанов, особенно на такие организмы, как устрицы и кораллы, которые образуют твердые раковины и скелеты, объединяя кальций и карбонат из морской воды. Однако по мере повышения кислотности океана доступные ионы карбоната (CO32-) связываются с избытком водорода, в результате чего меньше ионов карбоната доступно для кальцифицирующих организмов для создания и поддержания своих раковин, скелетов и других структур карбоната кальция. Если рН становится слишком низким, раковины и скелеты могут даже начать растворяться.
Птеропод, или «морская бабочка», представляет собой крошечную морскую улитку размером с небольшую горошину. Птероподы являются важной частью многих пищевых сетей и поедаются организмами размером от крошечного криля до китов. Когда раковины птероподов были помещены в морскую воду с уровнем pH и карбонатом, прогнозируемым на 2100 год, раковины медленно растворялись через 45 дней. Исследователи уже обнаружили серьезные уровни растворения панцирей птероподов в Южном океане, который окружает Антарктиду.
Исследователи уже обнаружили серьезные уровни растворения панцирей птероподов в Южном океане, который окружает Антарктиду.
Выращивание морских водорослей может улучшить качество воды
Местные морские водоросли можно выращивать в прибрежных водах Калифорнии и использовать для смягчения последствий локального окисления океана, согласно новому исследованию, финансируемому Калифорнийским морским грантом NOAA.
Воздействие подкисления океана на рыбу и водоросли
Изменения в химическом составе океана могут также повлиять на поведение некальцифицирующих организмов. Способность некоторых рыб, таких как рыба-клоун, обнаруживать хищников снижается в более кислых водах. Исследования показали, что снижение уровня pH также влияет на способность личинок рыбы-клоуна за пределами участка находить подходящую среду обитания. Когда эти организмы находятся в опасности, вся пищевая сеть также может оказаться в опасности.
В то время как некоторые виды пострадают от закисления океана, водоросли и морские травы могут выиграть от более высокого содержания CO 2 в океане, поскольку им требуется CO 2 для фотосинтеза, как и растениям на суше. В настоящее время проводятся некоторые исследования, изучающие, может ли выращивание морских водорослей помочь замедлить закисление океана.
В настоящее время проводятся некоторые исследования, изучающие, может ли выращивание морских водорослей помочь замедлить закисление океана.
NOAA инвестирует в новые инструменты для измерения состояния океана
Четыре новых исследовательских проекта расширяют возможности NOAA по измерению, отслеживанию и прогнозированию закисления, потепления и других важных показателей состояния океана.
Наш изменяющийся океан
Оценки будущих уровней углекислого газа, основанные на сценариях обычных выбросов, показывают, что к концу этого века поверхностные воды океана могут иметь pH около 7,8. Последний раз, когда pH океана был этот минимум был в среднем миоцене, 14-17 миллионов лет назад. Земля была на несколько градусов теплее, и происходило крупное вымирание.
Закисление океана в настоящее время затрагивает весь океан, включая прибрежные эстуарии и водные пути. Миллиарды людей во всем мире полагаются на пищу из океана как на основной источник белка. Многие рабочие места и экономики в США и во всем мире зависят от рыбы и моллюсков, которые живут в океане.
Текущие исследования
Закисление океана является одним из аспектов глобального изменения климата. Все, что мы делаем сегодня для смягчения последствий изменения климата, принесет пользу и будущему океану. За последнее десятилетие научное сообщество уделяло большое внимание изучению потенциальных последствий закисления океана. Программа NOAA по подкислению океана служит для налаживания отношений между учеными, менеджерами по ресурсам, политиками и общественностью с целью исследования и мониторинга последствий изменения химического состава океана для экономически и экологически важных экосистем, таких как рыболовство и коралловые рифы.
Поскольку постоянные усилия по мониторингу закисления океана во всем мире только начинаются, в настоящее время невозможно точно предсказать, как воздействие закисления океана будет распространяться по всей морской пищевой сети и влиять на общую структуру морских экосистем. С ускорением темпов закисления океана ученые, менеджеры по ресурсам и политики признают настоятельную необходимость укрепления науки как основы для принятия обоснованных решений и действий.
Популярные крабы могут пострадать от окисления океана
Исследование, финансируемое NOAA, документально подтвердило, что закисление океана вдоль тихоокеанского северо-западного побережья США влияет на панцири и органы чувств некоторых молодых крабов Дандженесса, ценных ракообразных, которые поддерживают самый ценный промысел на Западном побережье.
EDUCATION CONNECTION
Закисление океана — это проблема, которая затрагивает океанскую экосистему, а также коммерческие отрасли, такие как устричные фермы. Эту тему можно преподавать в сочетании с уроками о пищевых цепях и экосистемах, воздействии изменения климата на окружающую среду и CO 2 выбросы и уроки химии, касающиеся реальных применений. Учащиеся могут изучать данные, в том числе информацию об уровне углекислого газа в морской воде и атмосфере в режиме реального времени.
Углекислый газ может сделать раствор кислым | Глава 6: Химические изменения
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 6.10
Ключевые понятия
- Двуокись углерода (CO 2 ) газ, растворенный в воде, может сделать воду кислой.
- Кислотность воды из-за растворенного CO 2 можно снизить с помощью щелочи, такой как пищевая сода (бикарбонат натрия).
Сводка
Учитель дует в раствор универсального индикатора, пока он не изменит цвет. Учащиеся интерпретируют это изменение цвета и объясняют, что раствор становится кислым. Учащиеся выясняют, может ли углекислый газ из других источников, а именно газированная вода и химическая реакция между пищевой содой и уксусом, сделать раствор кислым. Затем учащиеся применяют свои наблюдения к экологической проблеме закисления океана, проводя исследования по этому вопросу.
Задача
Учащиеся смогут объяснить, что углекислый газ из любого источника вступает в химическую реакцию с водой с образованием угольной кислоты. Они также смогут использовать изменение цвета универсального индикатора для отслеживания изменения рН раствора во время химической реакции.
Они также смогут использовать изменение цвета универсального индикатора для отслеживания изменения рН раствора во время химической реакции.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся надеваете подходящие защитные очки во время занятия и моете руки после него. Универсальный индикатор на спиртовой основе легко воспламеняется. Используйте уксус в хорошо проветриваемом помещении. Прочтите и соблюдайте все предупреждения о безопасности на этикетке. Утилизируйте все жидкие отходы в канализацию или в соответствии с местными правилами.
Демонстрационные материалы
- Универсальный индикаторный раствор
- Вода
- 2 прозрачных пластиковых стаканчика
- Солома
Материалы для каждой группы
- Вода
- Универсальный индикаторный раствор в чашке
- Цветная шкала универсального индикатора pH
- Газированная вода (газированная или сельтерская) в широком прозрачном пластиковом стакане
- Пищевая сода в широкой прозрачной пластиковой чашке
- Уксус
- Алка-Зельтцер таблетка
- 2 маленьких прозрачных пластиковых стаканчика
- 4 широких прозрачных пластиковых стакана
- 4 высоких прозрачных пластиковых стаканчика
- Градуированный цилиндр
- Пластиковый пакет с застежкой-молнией для перекуса
О материалах
Для этого урока каждой группе понадобится цветовая таблица универсального индикатора pH. Распечатайте на цветном принтере достаточное количество страниц этих диаграмм, чтобы у каждой группы была своя собственная диаграмма. Вы также можете приобрести их в компании Flinn Scientific, номер продукта AP8765.
Распечатайте на цветном принтере достаточное количество страниц этих диаграмм, чтобы у каждой группы была своя собственная диаграмма. Вы также можете приобрести их в компании Flinn Scientific, номер продукта AP8765.
Каждой группе также потребуется универсальный индикаторный раствор, продукт Flinn № U0002, и бикарбонат натрия (пищевая сода), продукт Flinn № C0136 (500 грамм).
Проведите демонстрацию, чтобы показать, что добавление газа CO
2 в воду может сделать воду кислой.Материалы для демонстрации
- Универсальный индикаторный раствор
- Вода
- 2 прозрачных пластиковых стаканчика
- Солома
Подготовка учителя
Сделать индикаторный раствор для групп учащихся
- Приготовьте разбавленный универсальный индикаторный раствор для этой демонстрации и для каждой группы учащихся, смешав 625 мл воды с 25 мл универсального индикаторного раствора.
- Налейте не менее 80 мл разбавленного универсального индикаторного раствора в чистую пластиковую чашку для каждой группы учащихся.

Примечание. Вода из вашего местного водопровода, скорее всего, подойдет для демонстрации и занятий на этом уроке. Если индикаторный раствор, который вы готовите, не зеленого цвета, это означает, что ваша вода либо кислая, либо щелочная. В этом случае используйте дистиллированную воду, которую можно приобрести в супермаркетах и аптеках.
Примечание. Для выполнения заданий каждой группе потребуется 80 мл индикаторного раствора. Убедитесь, что вы приготовили достаточное количество раствора. Для демонстрации вам понадобится около 50–60 мл индикаторного раствора. Если 650 мл раствора недостаточно, сделайте больше, используя те же пропорции.
Подготовка к демонстрации
Налейте примерно 25–30 мл индикаторного раствора в каждую из двух прозрачных пластиковых чашек для демонстрации.
Процедура
- Покажите учащимся оба образца раствора универсального индикатора. Поместите соломинку в один из образцов так, чтобы соломинка доходила до дна чашки.

Держите чашку так, чтобы учащиеся могли хорошо видеть жидкость. Дуйте в соломинку, пока цвет индикаторного раствора не изменится с зеленого на желтый.
Спросите студентов:
- Изменяет ли pH индикаторный раствор вдувание в него?
- Да, цвет меняется, значит, должно быть и изменение рН.
- Раствор становится немного более кислым или немного щелочным?
- Изменение цвета показывает, что раствор стал немного более кислым.
Расскажите учащимся, что между молекулами CO 2 и молекулами H 2 O происходит химическая реакция с образованием очень небольшого количества кислоты, называемой угольной кислотой (H 2 CO 3 ).
Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций.
 Чтобы найти ответы на лист с заданиями, перейдите в раздел загрузок в онлайн-версии этого урока.
Чтобы найти ответы на лист с заданиями, перейдите в раздел загрузок в онлайн-версии этого урока.Предложите учащимся использовать газированную воду в качестве источника CO
2 , чтобы посмотреть, изменит ли этот газ pH раствора индикатора.Вопрос для расследования
Изменяет ли углекислый газ из газированной воды рН раствора индикатора?
Материалы для каждой группы
- Универсальный индикаторный раствор в пластиковом стаканчике
- Вода
- Газированная вода (газированная или сельтерская) в широком прозрачном пластиковом стакане
- 1 широкая прозрачная пластиковая чашка
- 2 высоких прозрачных пластиковых стаканчика
- Градуированный цилиндр
- Цветовая шкала универсального индикатора pH
Подготовка учителя
Налейте 25 мл газированной воды в широкий прозрачный пластиковый стакан для каждой группы.
Процедура
- Отмерьте 30 мл универсального индикаторного раствора и равномерно разделите его на две маленькие прозрачные пластиковые чашки.

- Добавьте 25 мл воды в широкий пластиковый стакан и 25 мл газированной воды в другой широкий стакан.
Поместите маленькие чашки с раствором индикатора в жидкость в более широких чашках, как показано на рисунке.
- Переверните две высокие чашки вверх дном и поместите их над двумя более широкими чашками.
Удерживая верхнюю и нижнюю чашечки, чтобы они были вместе, аккуратно покрутите обе чашечки. Следите за цветом индикатора в обеих чашках, чтобы увидеть, есть ли какие-либо изменения.
- Сравните цвет индикатора с цветовой шкалой pH, чтобы определить, является ли раствор кислым, нейтральным или щелочным.
Ожидаемые результаты
Индикатор внутри стаканчиков с водой остался зеленым, а индикатор с газированной водой стал желтым.
Обсудите наблюдения учащихся и то, что произойдет в следующем упражнении.
Спросите студентов:
- Один из индикаторов изменил цвет?
- Только индикатор с газированной водой изменил цвет.

- Что изменение цвета говорит вам о рН раствора индикатора? Он кислотный или основной?
- Раствор индикатора стал кислым.
- Газированная вода не должна попасть на индикатор. Почему раствор индикатора изменил цвет в одном наборе чашек?
- Диоксид углерода из газированной воды, растворенный в растворе индикатора. Молекулы углекислого газа прореагировали с водой, образовав угольную кислоту, и изменили цвет индикатора.
Сообщите учащимся, что они видели, как углекислый газ из вашего дыхания и углекислый газ из газированной воды делают раствор индикатора кислым.
Спросите студентов:
- Как вы думаете, углекислый газ, образующийся во время химической реакции, также делает раствор индикатора кислым?
- Углекислый газ из любого источника должен сделать раствор индикатора кислым. Количество углекислого газа, образующегося и растворяющегося в растворе индикатора, может привести к изменению цвета индикатора, но в кислую сторону.

- Какая из известных вам химических реакций может привести к образованию углекислого газа?
- Учащиеся должны помнить, что уксус и пищевая сода вступают в реакцию с образованием углекислого газа. Скажите учащимся, что в следующем упражнении они будут сочетать пищевую соду и уксус.
Используйте химическую реакцию для получения CO
2 , чтобы увидеть, изменяет ли она pH раствора индикатора.Вопрос для расследования
Будет ли газообразный диоксид углерода, образующийся в результате реакции пищевой соды и уксуса, изменять рН раствора индикатора?
Материалы для каждой группы
- Универсальный индикаторный раствор в чашке
- Цветная шкала универсального индикатора pH
- Вода
- Пищевая сода в широком прозрачном пластиковом стакане
- Уксус в стаканчике
- 2 маленьких прозрачных пластиковых стаканчика
- 1 широкий прозрачный пластиковый стаканчик
- 2 высоких прозрачных пластиковых стакана
- Градуированный цилиндр
Подготовка учителей
- Налейте около 50 мл уксуса в широкий пластиковый стакан для каждой группы.

- Поместите около ½ чайной ложки пищевой соды в небольшой прозрачный пластиковый стаканчик для каждой группы.
Процедура
- Отмерьте и налейте 25 мл уксуса в два широких пластиковых стакана.
- Налейте 15 мл универсального индикатора в два чистых маленьких пластиковых стаканчика.
- Насыпьте всю пищевую соду в одну из чашек с уксусом. В другую ничего не лейте.
Поставьте маленькие чашки с индикаторным раствором в обе широкие чашки, как показано на рисунке.
- Переверните две высокие чашки вверх дном и поместите их над двумя более широкими чашками.
Удерживая верхнюю и нижнюю чашечки, чтобы они были вместе, аккуратно покрутите обе чашечки. Следите за цветом индикатора в обеих чашках, чтобы увидеть, есть ли какие-либо изменения.
- Сравните цвет индикатора с цветовой шкалой pH, чтобы определить, является ли раствор кислым, нейтральным или щелочным.
Ожидаемые результаты
Индикатор внутри чашки только с уксусом оставался зеленым, а индикатор внутри чашки с реакцией уксуса и пищевой соды стал желтым.

Обсудите наблюдения учащихся.
Спросите студентов:
- Один из индикаторов изменил цвет?
- Изменился цвет только индикатора с химической реакцией.
- Почему в одном наборе чашек на дне был только уксус?
- Возможно, уксус сам по себе вызывает изменение цвета индикатора. Поскольку этот индикатор не изменил цвет, это должен быть углекислый газ, образовавшийся в результате химической реакции, а не только уксус, вызвавший изменение цвета. Индикаторный раствор в наборе чашек с одним уксусом на дне служит контролем.
- Что цвет раствора индикатора говорит вам о рН каждого раствора? Он кислотный, нейтральный или основной?
- Изменение цвета показывает, что раствор индикатора слегка кислый.
- Что можно добавить в кислый раствор индикатора, чтобы нейтрализовать его?
- Поскольку раствор индикатора кислый, учащиеся должны предложить добавить основание. Скажите учащимся, что пищевая сода является основой.

Объясните, что углекислый газ из любого источника может сделать воду кислой.
Спросите студентов:
- Что сделали с водой углекислый газ из дыхания, газированная вода и реакция пищевой соды и уксуса?
- CO 2 из каждого источника реагировал с водой и делал ее кислой.
Спроектируйте иллюстрацию CO
2 Реакция с водой.Расскажите учащимся, что углекислый газ реагирует с водой с образованием угольной кислоты. Учащиеся могут подсчитать количество атомов в каждой части уравнения, чтобы показать, что оно уравновешено. Укажите, что двойная стрелка в этом уравнении означает, что угольная кислота легко распадается с образованием углекислого газа и воды.
Объясните учащимся, что избыток CO 2 в атмосфере вызывает нагревание Земли и ее атмосферы. Но избыток CO 2 может сделать еще кое-что, что они видели в химическом уравнении и в своих экспериментах.
 Углекислый газ может сделать воду более кислой, что вызывает большую проблему в океанах. Избыток кислоты в океанской воде, называемый подкислением океана, мешает некоторым организмам формировать раковины и особенно вреден для кораллов.
Углекислый газ может сделать воду более кислой, что вызывает большую проблему в океанах. Избыток кислоты в океанской воде, называемый подкислением океана, мешает некоторым организмам формировать раковины и особенно вреден для кораллов.Объясните, чем закисление океана вредно для организмов, образующих раковины, и покажите видео о закислении океана.
Объясните, что океан на самом деле является основным. рН океана составляет около 8,2. Термин «закисление океана» означает, что океан имеет тенденцию становиться более кислым или менее щелочным. Он переместился примерно с 8.2 на 8.1. Это может показаться незначительным изменением, но это очень большое изменение для организмов в океане, которые очень чувствительны к изменениям рН. Когда океанская вода становится более кислой, это создает две основные проблемы для организмов, образующих раковины, таких как моллюски, устрицы и кораллы:
- Этим организмам становится труднее создавать свои раковины
- Если вода становится слишком кислой, нормальные раковины могут реагировать с более кислой водой, вызывая разрушение раковины
Моллюски, устрицы, кораллы и другие организмы, формирующие раковины, состоят из двух ионов: иона кальция (Ca +2 ) и иона карбоната (CO 3 -2 ). Когда эти два иона соединяются вместе, они образуют карбонат кальция (CaCO 3 ), который является основным веществом для структуры оболочки. Закисление океана влияет на ион карбоната. Вот как:
Когда эти два иона соединяются вместе, они образуют карбонат кальция (CaCO 3 ), который является основным веществом для структуры оболочки. Закисление океана влияет на ион карбоната. Вот как:
Спроектируйте иллюстрацию Углекислота и Карбонат-ион.
Напомните учащимся, что вода и углекислый газ вступают в реакцию с образованием угольной кислоты.
Атом водорода из угольной кислоты попадает в воду в виде иона водорода (H + ). Этот ион водорода связывается с ионом карбоната в океанской воде и создает ион бикарбоната (HCO — 3 ), которые не могут использовать организмы, образующие раковины. Это означает, что у существ меньше ионов карбоната, к которым они могут прикрепить ион кальция, что затрудняет их производство карбоната кальция, необходимого для создания их раковин.
Дополнительные ионы водорода в воде также делают воду более кислой. Если вода в конечном итоге станет слишком кислой, она может вступить в реакцию с карбонатом кальция в раковинах, что приведет к их разрушению.
Покажи видео Окисление океана.
Примечание: Повествование и действия в видео проходят довольно быстро, поэтому вы можете остановить видео в нескольких местах, чтобы помочь учащимся понять, о чем идет речь.
Зеленые точки обозначают избыток углекислого газа в атмосфере из-за сжигания ископаемого топлива. Океан поглощает большое количество этого углекислого газа.
Маленькие оранжевые буквы обозначают ионы карбоната, в которых нуждаются организмы, формирующие раковины. Они используют ионы карбоната и ионы кальция, чтобы сделать карбонат кальция для построения своих раковин.
Углекислый газ вступает в реакцию с водой и образует угольную кислоту (зеленое пятно неправильной формы), которая производит ионы водорода. Эти ионы связываются с ионами карбоната и создают вещество (ион бикарбоната не показан), которое организмы не могут использовать.
Из-за того, что раковины трудно изготовить, моллюски и другие организмы, производящие раковины, будут меньше и не будут воспроизводиться так часто, поэтому существа, которые их едят, могут не получать достаточно пищи. Это может повлиять на всю пищевую цепочку.
Это может повлиять на всю пищевую цепочку.
Дополнительные ионы водорода не просто связываются с ионом карбоната, они также делают воду более кислой.
В будущем океаны могут стать настолько кислыми, что раковины из карбоната кальция могут вступить в реакцию с водой и разрушиться.
Предложите учащимся изучить способы уменьшения количества углекислого газа, выбрасываемого в атмосферу.
Подавляющее большинство избыточного углекислого газа в атмосфере Земли образуется в результате сжигания ископаемого топлива, такого как нефть, природный газ и уголь. Большая часть этого топлива используется для автомобилей, грузовиков и других видов транспорта, для работы электростанций, производящих электроэнергию, а также для отопления домов и предприятий.
Предложите учащимся изучить альтернативные источники энергии, которые помогут сжигать меньше ископаемого топлива. Учащиеся могут представить свои исследования в виде короткой статьи с иллюстрациями, в формате Power Point, на трехслойной доске или любым другим способом, который, по вашему мнению, будет работать. Студенты должны описать, как работает возобновляемый источник энергии, а также преимущества и проблемы этой технологии.
Студенты должны описать, как работает возобновляемый источник энергии, а также преимущества и проблемы этой технологии.
Возможные темы:
Возобновляемые источники энергии
- Ветер
- Солнечная
- Геотермальная
- Биотопливо
- Гидроэлектростанция
Новые транспортные технологии
- Электромобили
- Водородные топливные элементы
угольная кислота | Формула, использование и факты
- Похожие темы:
- мочевина барбитуровая кислота дициклогексилкарбодиимид изоцианат карбамат
См. все связанные материалы →
угольная кислота , (H 2 CO 3 ), соединение элементов водорода, углерода и кислорода. Он образуется в небольших количествах при растворении его ангидрида, двуокиси углерода (CO 2 ), в воде.
CO 2 + H 2 O ⇌ H 2 CO 3 Преобладающими видами являются просто свободно гидратированные молекулы CO 2 . Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты, содержащие HCO 3 − и карбонаты, содержащие CO 3 2− . H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 −
Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты, содержащие HCO 3 − и карбонаты, содержащие CO 3 2− . H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 −
HCO 3 − + H 2 O ⇌ H 3 O + + CO 3 2− Однако кислотно-основное поведение угольной кислоты зависит от различных скоростей некоторых вовлеченных реакций, а также от их зависимости от pH системы. Например, при рН менее 8 основные реакции и их относительная скорость следующие: СО 2 + H 2 O ⇌ H 2 CO 3 (slow)
H 2 CO 3 + OH − ⇌ HCO 3 − + H 2 O ( Быстрый) выше рН 10. Следующие реакции важны: CO 2 + OH — ⇌ HCO 3 — (медленное)
HCO 3 — + OH — ⇌ CO 3 + OH — ⇌ CO 3 4 41414141414141414141414141414141414141414141414141414141414141. + OH — . 2- + H 2 O (быстро) При значениях pH от 8 до 10 все вышеперечисленные равновесные реакции являются значимыми.
+ OH — . 2- + H 2 O (быстро) При значениях pH от 8 до 10 все вышеперечисленные равновесные реакции являются значимыми.
Дополнительная информация по этой теме
оксикислота: угольная кислота и карбонатные соли
Углекислота (h3CO3) образуется в небольших количествах при растворении ее ангидрида, двуокиси углерода (CO2), в…
Углекислота играет роль в формировании пещер и пещерных образований, таких как сталактиты и сталагмиты. Самые большие и наиболее распространенные пещеры образуются в результате растворения известняка или доломита под действием воды, богатой углекислотой, полученной в результате недавних дождей. Кальцит в сталактитах и сталагмитах происходит из вышележащего известняка вблизи границы раздела коренной породы и почвы. Дождевая вода, просачивающаяся через почву, поглощает углекислый газ из богатой углекислым газом почвы и образует разбавленный раствор угольной кислоты. Когда эта кислая вода достигает основания почвы, она вступает в реакцию с кальцитом в известняковой породе и переводит часть его в раствор. Вода продолжает свой нисходящий поток через узкие трещины и трещины в ненасыщенной зоне с незначительной дальнейшей химической реакцией. Когда вода выходит из свода пещеры, углекислый газ теряется в атмосфере пещеры, а часть карбоната кальция выпадает в осадок. Проникающая вода действует как кальцитовый насос, удаляя его с верхней части коренной породы и повторно откладывая в пещере внизу.
Вода продолжает свой нисходящий поток через узкие трещины и трещины в ненасыщенной зоне с незначительной дальнейшей химической реакцией. Когда вода выходит из свода пещеры, углекислый газ теряется в атмосфере пещеры, а часть карбоната кальция выпадает в осадок. Проникающая вода действует как кальцитовый насос, удаляя его с верхней части коренной породы и повторно откладывая в пещере внизу.
Угольная кислота играет важную роль в переносе углекислого газа кровью. Углекислый газ поступает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани. Когда углекислый газ попадает в кровь, он соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H + ) и ионы бикарбоната (HCO 3 — ). Высвобождаемые ионы водорода минимально влияют на кислотность крови, поскольку белки крови, особенно гемоглобин, являются эффективными буферными агентами. (Буферный раствор сопротивляется изменению кислотности за счет соединения с добавленными ионами водорода и, по существу, их инактивации. ) Естественное превращение двуокиси углерода в угольную кислоту — относительно медленный процесс; однако карбоангидраза, белковый фермент, присутствующий внутри эритроцита, катализирует эту реакцию с достаточной скоростью, чтобы она выполнялась всего за доли секунды. Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме. Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида. Одновременный обмен этих двух ионов, известный как хлоридный сдвиг, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита. Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму.
) Естественное превращение двуокиси углерода в угольную кислоту — относительно медленный процесс; однако карбоангидраза, белковый фермент, присутствующий внутри эритроцита, катализирует эту реакцию с достаточной скоростью, чтобы она выполнялась всего за доли секунды. Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме. Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида. Одновременный обмен этих двух ионов, известный как хлоридный сдвиг, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита. Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму. Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и дополнена Эриком Грегерсеном.
Роль CO2, O2 и кислоты в артериовенозной разнице [H+] при мышечных сокращениях
. 1988 г., октябрь; 65 (4): 1803-10.
doi: 10.1152/jappl.1988.65.4.1803.
W N Стейнсби 1 , П. Д. Эйцман
принадлежность
- 1 Кафедра физиологии, Медицинский колледж, Университет Флориды, Гейнсвилл 32610.
- PMID: 2846498
- DOI:
10.
 1152/яппл.1988.65.4.1803
1152/яппл.1988.65.4.1803
W N Stainsby et al. J Appl Physiol (1985). 1988 Октябрь
. 1988 г., октябрь; 65 (4): 1803-10.
doi: 10.1152/jappl.1988.65.4.1803.
Авторы
W N Стейнсби 1 , П. Д. Эйцман
принадлежность
- 1 Факультет физиологии, Медицинский колледж, Университет Флориды, Гейнсвилл 32610.
- PMID: 2846498
- DOI:
10.1152/яппл.1988.
 65.4.1803
65.4.1803
Абстрактный
Для выяснения причин артериовенозной [Н+] разницы мышц во время сокращений брали пары образцов артериальной и мышечно-венозной крови до и через 0,5, 5,0 и 30,0 мин изометрических подергиваний икроножно-подошвенной группы мышц под наркозом через 0,5, 5,0 и 30,0 мин. собаки. Эти образцы были проанализированы на PO2, PCO2 и pH, концентрации O2, CO2, K+, Na+, La- и Cl- в цельной крови и La-, K+, Na+ и Cl- в плазме. Цельную кровь гемолизировали и анализировали на PO2, PCO2 и pH. Чистое поглощение O2, выход CO2, L, K+, Na+ и Cl- рассчитывались в дополнение к чистому выходу не содержащей CO2 кислоты (HA) и разности сильных ионов ([SID]) и общего иона [SID] ([K+] + [Na+] — [Cl-] — [La-]). На основе этих данных мы разделили происхождение артериовенозной разницы [H+] с помощью общей диаграммы PCO2-pH и с помощью диаграммы [H+]-PCO2 и определили, отражают ли истинные артериовенозные различия [H+] плазмы и клетки артериовенозные различия [H+]. Артериовенозные различия [H+] плазмы и гемолизированной крови были одинаковыми, показывая, что истинная плазма действительно отражает плазму и клетки. K+ показал небольшой значительный, но временный результат. Na+ не был значительным, тогда как Cl- демонстрировал значительное кратковременное поглощение. Выход лактата и HA, рассчитанные для кислотно-щелочного состояния крови собак, показали переходные значения и были одинаковыми. Через 5,0 мин, когда артериовенозная разница была наибольшей, только CO2 увеличил бы [H+] 15,9нмоль/л, тогда как десатурация гемоглобина снизила бы [H+] на 4,2 нмоль/л, а лактат мог бы повысить [H+] на 1,0 нмоль/л.
Артериовенозные различия [H+] плазмы и гемолизированной крови были одинаковыми, показывая, что истинная плазма действительно отражает плазму и клетки. K+ показал небольшой значительный, но временный результат. Na+ не был значительным, тогда как Cl- демонстрировал значительное кратковременное поглощение. Выход лактата и HA, рассчитанные для кислотно-щелочного состояния крови собак, показали переходные значения и были одинаковыми. Через 5,0 мин, когда артериовенозная разница была наибольшей, только CO2 увеличил бы [H+] 15,9нмоль/л, тогда как десатурация гемоглобина снизила бы [H+] на 4,2 нмоль/л, а лактат мог бы повысить [H+] на 1,0 нмоль/л.
Похожие статьи
Спринтерские тренировки улучшают ионную регуляцию во время интенсивных упражнений у мужчин.
МакКенна М.Дж., Хайгенхаузер Г.Дж., МакКелви Р.С., Макдугалл Д.Д., Джонс Н.Л. McKenna MJ и др.
28 Бесплатная статья ЧВК. Дж. Физиол. 1997 г., 15 июня; 501 (часть 3) (часть 3): 687–702. дои: 10.1111/j.1469-7793.1997.687бм.х.
Дж. Физиол. 1997.
PMID:
Дж. Физиол. 1997 г., 15 июня; 501 (часть 3) (часть 3): 687–702. дои: 10.1111/j.1469-7793.1997.687бм.х.
Дж. Физиол. 1997.
PMID:[Избыток основания] и [сильная разница ионов] во время обмена O2-CO2.
Шлихтиг Р. Шлихтиг Р. Adv Exp Med Biol. 1997;411:97-102. doi: 10.1007/978-1-4615-5865-1_12. Adv Exp Med Biol. 1997. PMID: 9269416
Лактатный и кислотно-щелочной обмен при кратковременных интенсивных сокращениях скелетных мышц in situ.
Brechue WF, Стейнсби WN. Бречу В.Ф. и соавт. J Appl Physiol (1985). 1994 г., июль; 77 (1): 223–30. doi: 10.1152/jappl.1994.77.1.223. J Appl Physiol (1985). 1994. PMID: 7961237
Контроль и последствия адренергической активации Na+/H+ обмена эритроцитов на транспорт кислорода и углекислого газа в крови у рыб.

Томас С., Перри С.Ф. Томас С. и др. Джей Эксп Зоол. 1992 15 августа; 263(2):160-75. doi: 10.1002/jez.1402630206. Джей Эксп Зоол. 1992. PMID: 1323642 Обзор.
Одержимость CO2.
Джонс Н.Л. Джонс НЛ. Appl Physiol Nutr Metab. 2008 авг; 33 (4): 641-50. дои: 10.1139/H08-040. Appl Physiol Nutr Metab. 2008. PMID: 18641706 Обзор.
Посмотреть все похожие статьи
Цитируется
Лактат и Н+ выделяются из скелетных мышц человека во время интенсивных динамических упражнений.
Бангсбо Дж., Йохансен Л., Грэм Т., Салтин Б. Бангсбо Дж. и др. Дж. Физиол. 1993 март; 462:115-33. doi: 10.1113/jphysiol.1993.sp019546. Дж.
 Физиол. 1993.
PMID: 8331579
Бесплатная статья ЧВК.
Физиол. 1993.
PMID: 8331579
Бесплатная статья ЧВК.Баланс интерстициальной глюкозы и лактата в скелетных мышцах и жировой ткани человека изучался методом микродиализа.
Росдал Х., Унгерштедт У., Йорфельдт Л., Хенрикссон Дж. Росдаль Х. и др. Дж. Физиол. 1993 ноябрь; 471: 637-57. doi: 10.1113/jphysiol.1993.sp019920. Дж. Физиол. 1993. PMID: 8120827 Бесплатная статья ЧВК.
Непрерывный мониторинг внеклеточной концентрации лактата с помощью микродиализной лактографии для изучения метаболизма мышц крыс in vivo.
де Бур Дж., Постема Ф., Плийтер-Грендийк Х., Корф Дж. де Бур Дж. и др. Арка Пфлюгера. 1991 августа; 419(1):1-6. дои: 10.1007/BF00373739. Арка Пфлюгера. 1991. PMID: 1945755
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- AM-30187/AM/NIADDK NIH HHS/США
Прямой синтез муравьиной кислоты из диоксида углерода гидрированием в кислой среде
Прямой синтез муравьиной кислоты из диоксида углерода гидрированием в кислой среде
Скачать PDF
Скачать PDF
- Открытый доступ
- Опубликовано:
- Северин Море 1 ,
- Пол Дж. Дайсон 1 и
- Габор Лоуренси 1
Связь с природой том 5 , Номер статьи: 4017 (2014) Процитировать эту статью
52k доступов
455 цитирований
41 Альтметрический
Сведения о показателях
Субъекты
- Катализ
- Неорганическая химия
Abstract
Химическое преобразование двуокиси углерода в полезные продукты становится все более важным, поскольку уровни CO 2 в атмосфере продолжают расти в результате деятельности человека. В этой статье мы описываем прямое гидрирование CO 2 в муравьиную кислоту с использованием гомогенного рутениевого катализатора в водном растворе и в диметилсульфоксиде (ДМСО) без каких-либо добавок. В воде при 40 °C можно получить 0,2 M муравьиную кислоту при 200 бар, однако в ДМСО тот же катализатор дает 1,9М муравьиная кислота. В обоих растворителях катализаторы можно использовать многократно без снижения активности. Мировой спрос на муравьиную кислоту продолжает расти, особенно в контексте носителя водорода из возобновляемых источников энергии, а ее производство из CO 2 без основания путем прямого каталитического гидрирования двуокиси углерода значительно более устойчиво, чем существующие способы.
В этой статье мы описываем прямое гидрирование CO 2 в муравьиную кислоту с использованием гомогенного рутениевого катализатора в водном растворе и в диметилсульфоксиде (ДМСО) без каких-либо добавок. В воде при 40 °C можно получить 0,2 M муравьиную кислоту при 200 бар, однако в ДМСО тот же катализатор дает 1,9М муравьиная кислота. В обоих растворителях катализаторы можно использовать многократно без снижения активности. Мировой спрос на муравьиную кислоту продолжает расти, особенно в контексте носителя водорода из возобновляемых источников энергии, а ее производство из CO 2 без основания путем прямого каталитического гидрирования двуокиси углерода значительно более устойчиво, чем существующие способы.
Введение
Опасения по поводу уровня углекислого газа в атмосфере, который достиг ок . 400 стр./мин. 1,2 , ведут к политическим целям и научно-техническим усилиям по сокращению выбросов CO 2 и улавливанию CO 2 и хранению его в пористых горных породах 3,4,5,6 . Преобразование CO 2 в полезное сырье, химикаты и топливо представляет собой еще одну важную стратегию, которая не только удаляет CO 2 из атмосферы, но и снижает зависимость от нефтехимических продуктов 7,8 . В этом контексте в последние годы был достигнут значительный прогресс, и несколько реакций были коммерциализированы. Примеры продуктов, получаемых в настоящее время из CO 2 включает мочевину, салициловую кислоту и полиолы 3 . Недавно компания в Исландии начала использовать возобновляемые источники энергии для преобразования CO 2 в метанол в объеме около 1600 т в год 9 . Однако человеческая деятельность выбрасывает в атмосферу ~35 GT CO 2 в год, и явно существует значительный разрыв между количеством производимого CO 2 и его потреблением.
Преобразование CO 2 в полезное сырье, химикаты и топливо представляет собой еще одну важную стратегию, которая не только удаляет CO 2 из атмосферы, но и снижает зависимость от нефтехимических продуктов 7,8 . В этом контексте в последние годы был достигнут значительный прогресс, и несколько реакций были коммерциализированы. Примеры продуктов, получаемых в настоящее время из CO 2 включает мочевину, салициловую кислоту и полиолы 3 . Недавно компания в Исландии начала использовать возобновляемые источники энергии для преобразования CO 2 в метанол в объеме около 1600 т в год 9 . Однако человеческая деятельность выбрасывает в атмосферу ~35 GT CO 2 в год, и явно существует значительный разрыв между количеством производимого CO 2 и его потреблением.
В идеале множество химических продуктов должно быть получено из CO 2 (ссылка 10), и важной, поскольку она может использоваться как в качестве химического сырья, так и в качестве топлива, является муравьиная кислота. В настоящее время мировое производство муравьиной кислоты, полученной из комбинации метанола и монооксида углерода с сильным основанием, составляет порядка 800 000 тонн в год и используется в текстильной промышленности, чистящих средствах и в качестве консерванта, и это лишь некоторые из них. Спрос может значительно возрасти благодаря разработке эффективных катализаторов дегидрирования муравьиной кислоты, которые могли бы найти широкое применение в контексте водородной экономики 11 . Сегодня, за исключением ископаемого топлива, практические системы хранения водорода используют баллоны под давлением или криогенные условия 12 . Поскольку муравьиная кислота (HCOOH) имеет объемную плотность водорода 53 г H 2 на литр, малотоксична и является жидкостью в условиях окружающей среды, она является идеальным материалом для хранения водорода для определенных применений 13,14 . Производство водорода из муравьиной кислоты было достигнуто с помощью различных гомогенных и гетерогенных катализаторов 15,16 .
В настоящее время мировое производство муравьиной кислоты, полученной из комбинации метанола и монооксида углерода с сильным основанием, составляет порядка 800 000 тонн в год и используется в текстильной промышленности, чистящих средствах и в качестве консерванта, и это лишь некоторые из них. Спрос может значительно возрасти благодаря разработке эффективных катализаторов дегидрирования муравьиной кислоты, которые могли бы найти широкое применение в контексте водородной экономики 11 . Сегодня, за исключением ископаемого топлива, практические системы хранения водорода используют баллоны под давлением или криогенные условия 12 . Поскольку муравьиная кислота (HCOOH) имеет объемную плотность водорода 53 г H 2 на литр, малотоксична и является жидкостью в условиях окружающей среды, она является идеальным материалом для хранения водорода для определенных применений 13,14 . Производство водорода из муравьиной кислоты было достигнуто с помощью различных гомогенных и гетерогенных катализаторов 15,16 . Хотя большинство катализаторов основано на благородных металлах, недавние комплексы на основе железа (дешевого и распространенного элемента) подчеркивают пригодность таких систем в контексте водородной экономики 17 . Однако концепция хранения водорода в виде муравьиной кислоты была бы еще более привлекательной, если бы стал доступен жизнеспособный катализатор обратной реакции, то есть катализатор, восстанавливающий углекислый газ водородом и в отсутствие основания . 18,19,20,21,22 (рис. 1).
Хотя большинство катализаторов основано на благородных металлах, недавние комплексы на основе железа (дешевого и распространенного элемента) подчеркивают пригодность таких систем в контексте водородной экономики 17 . Однако концепция хранения водорода в виде муравьиной кислоты была бы еще более привлекательной, если бы стал доступен жизнеспособный катализатор обратной реакции, то есть катализатор, восстанавливающий углекислый газ водородом и в отсутствие основания . 18,19,20,21,22 (рис. 1).
Изображение с полным размером
Для обеих реакций доступно несколько катализаторов, и, как правило, производство или потребление водорода регулируется рН раствора 23,24,25,26 . Однако превращение диоксида углерода в муравьиную кислоту затруднено из-за высокой кинетической и термодинамической стабильности CO 2 . Реакция в газовой фазе имеет положительное значение ΔG из-за энтропийного вклада (ΔG 0 = +33 КДж моль -1 ), а образование муравьиной кислоты более благоприятно в водном растворе (ΔG 0 = -4 КДж моль -1 ) (ссылка 20). Для реакций, проводимых в воде, необходимо учитывать равновесие CO 2 /H 2 CO 3 /HCO 3 − , а также второе депротонирование до CO 3 2−, . учетная запись (дополнительный рис. 1). Из этих равновесий и кинетических исследований гидрирования бикарбонатов при различных значениях pH 27 очевидно, что реакция протекает благоприятно в основных средах, в условиях, где фактическим субстратом является HCO 3 − (ΔG 0 = −35 KJ моль −1 ) или CO 3 4 90 − .
Для реакций, проводимых в воде, необходимо учитывать равновесие CO 2 /H 2 CO 3 /HCO 3 − , а также второе депротонирование до CO 3 2−, . учетная запись (дополнительный рис. 1). Из этих равновесий и кинетических исследований гидрирования бикарбонатов при различных значениях pH 27 очевидно, что реакция протекает благоприятно в основных средах, в условиях, где фактическим субстратом является HCO 3 − (ΔG 0 = −35 KJ моль −1 ) или CO 3 4 90 − .
В отличие от прямой реакции H 2 с CO 2 , гидрирование карбоната и бикарбоната является хорошо известными реакциями 28,29,30 , которые были достигнуты в самых разных органических растворителях, ионных жидкости, вода и сверхкритический CO 2 (ссылка 20). В настоящее время катализаторы, проявляющие высокую активность в гидрировании СО 2 , требуют добавок, таких как основания 31,32 , в том числе амины 33 или буферы 34,35 , образующие формиатные соли. Ого и др. . 34,35 смогли получить муравьиную кислоту (0,06 M) в результате прямой реакции H 2 с CO 2 в кислом буфере. Присутствие основания также усложняет выделение муравьиной кислоты из реакционной смеси, хотя были разработаны оригинальные подходы для преодоления этих сложностей 30,36 . Здесь мы описываем гомогенный рутениевый катализатор, который гидрирует CO 2 до муравьиной кислоты в кислой среде без необходимости использования каких-либо оснований, аминов или буферов. В водном растворе можно получить 0,2 М муравьиную кислоту, в диметилсульфоксиде (ДМСО) фосфиновый катализатор рутения (II) дает 1,9 М муравьиную кислоту.
Ого и др. . 34,35 смогли получить муравьиную кислоту (0,06 M) в результате прямой реакции H 2 с CO 2 в кислом буфере. Присутствие основания также усложняет выделение муравьиной кислоты из реакционной смеси, хотя были разработаны оригинальные подходы для преодоления этих сложностей 30,36 . Здесь мы описываем гомогенный рутениевый катализатор, который гидрирует CO 2 до муравьиной кислоты в кислой среде без необходимости использования каких-либо оснований, аминов или буферов. В водном растворе можно получить 0,2 М муравьиную кислоту, в диметилсульфоксиде (ДМСО) фосфиновый катализатор рутения (II) дает 1,9 М муравьиную кислоту.
Результаты
Прямое гидрирование диоксида углерода в воде
В наших первоначальных исследованиях гидрирование CO 2 изучалось в кислых водных растворах с использованием рутениевых(II) или родиевых(I) катализаторов с водорастворимыми фосфиновыми лигандами, т. е. 1,3,5-триаза-7-фосфаадамантан (PTA), 3-метил-1,3,5-триаза-7-фосфаадамантан (MePTA), мета-моносульфонированный трифенилфосфин (TPPMS) и мета-трисульфонированный трифенилфосфин (TPPTS; дополнительный Таблица 1). Из этих исследований [RuCl 2 (PTA) 4 ] оказался наиболее активным катализатором, дающим муравьиную кислоту в качестве единственного продукта в условиях реакции (в конце реакции pH раствора составляет 2,70, рис. 2 и дополнительный рис. 2). Рутениевые катализаторы обычно в 10 раз более активны, чем родиевые аналоги, а самые высокие выходы получены для комплексов, содержащих лиганды типа ФТА, т. е. аналогичная активность наблюдается для лигандов ФТА и МеФТА, тогда как комплексы с ТППМС и ТППТС менее активны. . Условия реакции были оптимизированы для [RuCl 2 (PTA) 4 ] для повышения производительности и зависимость катализатора от концентрации, давления, соотношения P (H 2 )/ P (CO 2 ) (табл.
е. 1,3,5-триаза-7-фосфаадамантан (PTA), 3-метил-1,3,5-триаза-7-фосфаадамантан (MePTA), мета-моносульфонированный трифенилфосфин (TPPMS) и мета-трисульфонированный трифенилфосфин (TPPTS; дополнительный Таблица 1). Из этих исследований [RuCl 2 (PTA) 4 ] оказался наиболее активным катализатором, дающим муравьиную кислоту в качестве единственного продукта в условиях реакции (в конце реакции pH раствора составляет 2,70, рис. 2 и дополнительный рис. 2). Рутениевые катализаторы обычно в 10 раз более активны, чем родиевые аналоги, а самые высокие выходы получены для комплексов, содержащих лиганды типа ФТА, т. е. аналогичная активность наблюдается для лигандов ФТА и МеФТА, тогда как комплексы с ТППМС и ТППТС менее активны. . Условия реакции были оптимизированы для [RuCl 2 (PTA) 4 ] для повышения производительности и зависимость катализатора от концентрации, давления, соотношения P (H 2 )/ P (CO 2 ) (табл. 1) и температуры ( Была разъяснена дополнительная таблица 2) по производству муравьиной кислоты.
1) и температуры ( Была разъяснена дополнительная таблица 2) по производству муравьиной кислоты.
[RuCl 2 10 P 40 40] (2,76 мМ) растворяли в D 2 O (2 мл) в атмосфере N 2 в сапфировой ЯМР-трубке среднего давления. Этот раствор подвергали давлению при комнатной температуре до 50 бар с помощью CO 2 и доводили до 100 бар с помощью H 2 . Систему нагревали до 60 °С и за реакцией следили с помощью спектроскопии ЯМР 13 С (100 МГц). На рисунке показана эволюция сигналов ЯМР 13 C D C OOD при 166,3 м.д. (разница во времени между спектрами Δ t =189 мин). Триплетный сигнал муравьиной кислоты обусловлен обменом водорода на дейтерий в HCOOH (поскольку в качестве растворителя использовали D 2 O). Время реакции: 148 ч.
Время реакции: 148 ч.
Полный размер
Таблица 1 Образование муравьиной кислоты в зависимости от концентрации катализатора (конц.), давления и соотношения P (H 2 )/ P (CO 2 )*.Полноразмерный стол
В относительно мягких условиях (60 °C, 30 бар CO 2 , 30 бар H 2 , 2,76 мМ катализатор), [RuCl 2 (PTA) 4 ] гидрирует CO 2 с получением 0,03 мМ раствора муравьиной кислоты. Концентрация образующейся муравьиной кислоты зависит от давления газа. При соотношении P (H 2 )/ P (CO 2 ), равном 1, увеличение общего давления газа с 60 бар до 100 бар дает 0,083 М раствор муравьиной кислоты (таблица 1), а при при полном давлении газа 200 бар полученная концентрация муравьиной кислоты составляет 0,204 M (рис. 3).
Рисунок 3: Зависимость давления от концентрации муравьиной кислоты, полученной при каталитическом гидрировании СО 2 .
Условия: катализатор растворяли в 2 мл H 2 O ([RuCl 2 (PTA) 4 ]=2,76 мМ) в атмосфере N 2 . Этот раствор подвергали давлению при комнатной температуре с помощью CO 2 (50 бар) и доводили до желаемого давления с помощью H 2 . Систему нагревали до 60 °С и перемешивали до достижения равновесия реакции (72–96 ч). Конечный выход муравьиной кислоты определяли с помощью 1 H ЯМР-спектроскопии с DSS в качестве внутреннего стандарта. Значения усредняются по результатам трех-шести измерений с воспроизводимостью ±15%. Линия тренда показана в качестве ориентира и не является математическим соответствием данных.
Реакцию также изучали при температуре от 23 до 90 °C в стандартных условиях ([RuCl 2 (PTA) 4 ]=2,76 мМ, полное давление=100 бар и P (H 2 )/ P (CO 2 ) степень давления = 1, см. рис. 4 и дополнительный рис. 3 и дополнительную таблицу 2). Поскольку гидрирование CO 2 является экзотермическим, повышение температуры снижает конечную концентрацию муравьиной кислоты, которая снижается до 0,032 M при 90 °C. Температурная зависимость скорости реакции подчиняется закону Аррениуса, из которого была получена энтальпия активации +96 кДж моль -1 (дополнительный рис. 4).
Поскольку гидрирование CO 2 является экзотермическим, повышение температуры снижает конечную концентрацию муравьиной кислоты, которая снижается до 0,032 M при 90 °C. Температурная зависимость скорости реакции подчиняется закону Аррениуса, из которого была получена энтальпия активации +96 кДж моль -1 (дополнительный рис. 4).
Условия: [RuCl 2 (PTA) 4 ] растворяли в H 2 O (2,76 мМ, 2 мл) в атмосфере N 2 . Раствор подвергали давлению при комнатной температуре с помощью CO 2 (50 бар) и добавляли H 2 до 100 бар. Систему нагревали до желаемой температуры, и за реакцией следили по 9 часов. 0041 1 H ЯМР-спектроскопия до достижения равновесия реакции. Значения усредняются по результатам трех-шести измерений с воспроизводимостью ±15%.
0041 1 H ЯМР-спектроскопия до достижения равновесия реакции. Значения усредняются по результатам трех-шести измерений с воспроизводимостью ±15%.
Изображение с полным размером
С использованием оптимизированной каталитической системы были проведены эксперименты по переработке, и было обнаружено, что катализатор можно использовать повторно без потери активности (дополнительная таблица 3).
Гидрирование двуокиси углерода в других растворителях
As [RuCl 2 (PTA) 4 ] способен непосредственно гидрировать диоксид углерода в водном кислом растворе, то есть при pH=2,70, дальнейшие исследования проводились в смешивающихся с водой ионных жидкостях, то есть 1-бутил-3-метилимидазолия терафторбората ([BMIM][BF 4 ]) и 1-бутил-3-метилимидазолия тозилат ([BMIM][tos], где tos = p -CH 3 C 6 H 4 SO 3 — анион) , а также в тетрагидрофуране и ДМСО (табл. 2).
Таблица 2 Каталитическое гидрирование диоксида углерода до муравьиной кислоты в различных смесях растворителей.
Полный размер таблицы
Высокие активности наблюдались в ДМСО/H 2 O, при этом каталитическая активность увеличивалась по мере уменьшения соотношения вода/растворитель. В чистом ДМСО при 50 °С был получен 1,93 М раствор муравьиной кислоты при 100 бар с соотношением P (H 2 )/ P (CO 2 ), равным 1. Обширные исследования активности [RuCl 2 (PTA) 4 ] в чистых органических растворителях, то есть спиртах, ацетонитриле, пропиленкарбонате и толуоле (дополнительная таблица 4), показало, что катализатор активен в нескольких растворителях, хотя ни один из них не был так эффективен, как ДМСО. Дальнейший скрининг других катализаторов в ДМСО (дополнительная таблица 5) подтвердил превосходство [RuCl 2 (PTA) 4 ] в гидрировании CO 2 , то есть [RuCl 2 (PTA) 4 ] в ~20 раз активнее в ДМСО по сравнению с другими оцениваемыми катализаторами. Таким образом, эффективность [RuCl 2 (PTA) 4 ] в ДМСО была изучена в зависимости от общего давления газа (рис. 5 и дополнительная таблица 6) и P (H 2 ) / P ( CO 2 ) парциальное давление. Аналогичные тенденции наблюдались и в воде.
5 и дополнительная таблица 6) и P (H 2 ) / P ( CO 2 ) парциальное давление. Аналогичные тенденции наблюдались и в воде.
Условия реакции: [RUCL 2 (PTA) 4 ] (2,76 мм), T = 50 ° C, P (H 2 )/ P (CO 2 ). из 1, время реакции 120 ч, ДМСО (2 мл), средние значения нескольких (от двух до шести) измерений. Линия тренда показана в качестве ориентира и не является математическим соответствием данных.
Изображение полного размера
Зависимость конечной концентрации муравьиной кислоты и скорости реакции от температуры определяли в ДМСО (рис. 6, дополнительный рис. 5 и дополнительная таблица 7). Как и в водной системе, конечная концентрация муравьиной кислоты увеличивается с понижением температуры, тогда как скорость реакции увеличивается с повышением температуры.
Условия: катализатор растворяли в 2 мл ДМСО ([RuCl 2 (PTA) 4 ]=2,76 мМ) в атмосфере N 2 . Этот раствор подвергали давлению при комнатной температуре с помощью CO 2 (50 бар) и добавляли H 2 до 200 бар ( P (H 2 )/ P (CO 2 )=3). Систему нагревали до нужной температуры и перемешивали до достижения равновесия реакции. Конечный выход муравьиной кислоты определяли с помощью 1 H ЯМР-спектроскопии с DSS в качестве внутреннего стандарта. Линия тренда показана в качестве ориентира и не является математическим соответствием данных. Значения усредняются по результатам трех-шести измерений с воспроизводимостью ±15%.
Изображение полного размера
Катализатор, [RuCl 2 (PTA) 4 ], был переработан и повторно использован несколько раз (Таблица 3) без какого-либо наблюдаемого снижения активности, в результате чего общее число оборотов (TON) составило 749 после четырех повторных циклов, что указывает на то, что могут быть достигнуты значительно более высокие значения TON.
Полноразмерная таблица
Исследования механизма с катализатором [RuCl
2 (PTA) 4 ] Кроме того, возможные каталитические промежуточные соединения были идентифицированы в каталитических условиях с использованием сапфировых трубок среднего давления с помощью спектроскопии ядерного магнитного резонанса (ЯМР). [RuCl 2 (PTA) 4 ] катализатор как в воде, так и в ДМСО-d 6 вместе с DSS (4,4-диметил-4-силапентан-1-сульфокислота) в качестве внутреннего стандарта до 100 бар с соотношением давлений P (H 2 )/ P (CO 2 ) 1 и нагревом до 50 °C. Гидридная область полученных спектров ЯМР 1 H показывает присутствие моногидридных и дигидридных соединений, то есть [RuH 2 (PTA) 4 ] и [RuH (PTA) 4 Cl], полученный из мультиплета при −11,2 ppm. и дублет квартетов при -9,2 ppm, ранее наблюдавшийся в водном растворе (дополнительный рис. 6) 37 . В спектрах ЯМР 1 H { 31 P} было показано, что два гидридных сигнала коллапсируют в синглетные резонансы (дополнительная рис. 7). На основе этих наблюдений и предыдущей литературы 18,37 можно предложить предварительный каталитический цикл (рис. 7).
и дублет квартетов при -9,2 ppm, ранее наблюдавшийся в водном растворе (дополнительный рис. 6) 37 . В спектрах ЯМР 1 H { 31 P} было показано, что два гидридных сигнала коллапсируют в синглетные резонансы (дополнительная рис. 7). На основе этих наблюдений и предыдущей литературы 18,37 можно предложить предварительный каталитический цикл (рис. 7).
Предлагаемый каталитический цикл для гидрирования диоксида углерода с использованием [RuCl 2 (PTA) 4 ] в воде или ДМСО.
Полный размер
Обсуждение
Комплекс [RuCl 2 (PTA) 4 ] катализирует прямое гидрирование CO 2 в ДМСО с образованием муравьиной кислоты в беспрецедентно высоких концентрациях, т.е. ~15% по объему). Важно отметить, что катализатор работает без основания (или каких-либо других добавок), обладает высокой стабильностью и может быть переработан и использован повторно без потери активности. Поскольку потребность в муравьиной кислоте продолжает расти, особенно в качестве потенциального переносчика водорода (HCOOH может избирательно разлагаться на H 2 и CO 2 , дополнительные рис. 8 и 9) 38,39,40 ; Жизнеспособные каталитические процессы, которые напрямую превращают CO 2 в муравьиную кислоту, такие как описанный здесь, могут способствовать развитию экономики, основанной на водороде.
Поскольку потребность в муравьиной кислоте продолжает расти, особенно в качестве потенциального переносчика водорода (HCOOH может избирательно разлагаться на H 2 и CO 2 , дополнительные рис. 8 и 9) 38,39,40 ; Жизнеспособные каталитические процессы, которые напрямую превращают CO 2 в муравьиную кислоту, такие как описанный здесь, могут способствовать развитию экономики, основанной на водороде.
Методы
Общие соображения
NaHCO 3 , NaOH, HCl, HCOOH и 3-(триметилсилил)-1-пропансульфонат натрия (DSS) были приобретены у Fluka, BASF или Merck. H 2 (99,95%) и CO 2 (99,9%) был получен от Carbagas-CH, обогащенный 13 CO 2 (99% в 13 C) был получен от Cambridge Isotope Laboratories. Бидистиллированная вода, ДМСО (Sigma-Aldrich), метанол (Fluka), этанол (Fluka), ацетонитрил (Merck), пропиленкарбонат (Acros), толуол (Merk), ионные жидкости [BMIM][BF 4 ] и [ В качестве растворителей использовали BMIM][tos] (Fluka). Лиганды PTA, TPPTS и TPPMS были приобретены у ABCR и Fluka соответственно. Лиганд MePTA и комплексы [RuCl 2 (PTA) 4 ], [RhCl(TPPMS) 3 ], [RuCl 2 (PTA)([9]aneS 3 )], [Ru(H 2 O) 4 (MePTA) 2 ](tos) 4 , [RuCl 2 (TPPMS) 2 ], [RuCl 2 (TPPTS) 2 ] 2 and [RuCl 2 (п-цимол)] 2 были синтезированы согласно литературным данным 41,42,43,44,45,46,47,48,49,50 .
Лиганды PTA, TPPTS и TPPMS были приобретены у ABCR и Fluka соответственно. Лиганд MePTA и комплексы [RuCl 2 (PTA) 4 ], [RhCl(TPPMS) 3 ], [RuCl 2 (PTA)([9]aneS 3 )], [Ru(H 2 O) 4 (MePTA) 2 ](tos) 4 , [RuCl 2 (TPPMS) 2 ], [RuCl 2 (TPPTS) 2 ] 2 and [RuCl 2 (п-цимол)] 2 были синтезированы согласно литературным данным 41,42,43,44,45,46,47,48,49,50 .
Все манипуляции проводились в бескислородных условиях с дегазированными растворителями по методике линии Шленка с N 2 в качестве защитного газа. Реакции проводили в сапфировых ЯМР-трубках среднего давления до 100 бар и сопровождались спектроскопией ЯМР 1 H и 13 C ЯМР. При более высоких давлениях использовали автоклавы Parr (25 мл, SS 316). Спектры ЯМР регистрировали на ЯМР-спектрометре Bruker DRX 400 и аппроксимировали спектры программой WIN-NMR. Концентрации муравьиной кислоты определяли количественным методом ЯМР 1 H и 13 C, методом ионной хроматографии на приборе ICS-9.0 и методом ВЭЖХ на приборе Agilent 1260 Infinity.
Концентрации муравьиной кислоты определяли количественным методом ЯМР 1 H и 13 C, методом ионной хроматографии на приборе ICS-9.0 и методом ВЭЖХ на приборе Agilent 1260 Infinity.
Гомогенные каталитические реакции гидрирования
Предварительные исследования с различными катализаторами проводили в мультиавтоклаве (HEL CAT 7) путем приготовления 2,76 × 10 −3 М (2,76 мМ) раствора соответствующего катализатора в дегазированной воде (2,76 мМ). мл). Затем растворы подвергали давлению до 30 бар CO 2 , а затем доводили до 60 бар с помощью H 2 (частичное давление H 2 = 30 бар). Систему нагревали до 60 °С и перемешивали до завершения реакции. Выходы муравьиной кислоты определяли по 1 H ЯМР-спектроскопия с использованием DSS в качестве внешнего стандарта (c=0,0130 M) и подтверждены с помощью ионной хроматографии и ВЭЖХ.
Для кинетических измерений катализаторы растворяли в дегазированных растворителях (2 мл), которые вводили в сапфировую ЯМР-пробирку или в автоклав в атмосфере N 2 . Растворы подвергали давлению до 20–55 бар с помощью CO 2 , а затем доводили до 60–200 бар с помощью H 2 . Систему нагревали до необходимой температуры (23–135 °С) и встряхивали/перемешивали. В сапфировых ЯМР-трубках выделение [HCOOH] и [CO 2 ] с последующей количественной 1 H или 13 C ЯМР-спектроскопией с DSS в качестве внутреннего стандарта 51 . Для автоклавов выход муравьиной кислоты определяли измерением ЯМР 1 H в конечном растворе с DSS в качестве внешнего стандарта (раствор 0,0130 M) и контролировали с помощью ионной хроматографии и ВЭЖХ. В ходе исследований с использованием различных органических растворителей (в которых ДСС нерастворим) конечные концентрации муравьиной кислоты определяли методом 1 H ЯМР с использованием стандартного метода добавления (с известным раствором [HCOOH]) и контролем с помощью ионной хроматографии и ВЭЖХ.
Растворы подвергали давлению до 20–55 бар с помощью CO 2 , а затем доводили до 60–200 бар с помощью H 2 . Систему нагревали до необходимой температуры (23–135 °С) и встряхивали/перемешивали. В сапфировых ЯМР-трубках выделение [HCOOH] и [CO 2 ] с последующей количественной 1 H или 13 C ЯМР-спектроскопией с DSS в качестве внутреннего стандарта 51 . Для автоклавов выход муравьиной кислоты определяли измерением ЯМР 1 H в конечном растворе с DSS в качестве внешнего стандарта (раствор 0,0130 M) и контролировали с помощью ионной хроматографии и ВЭЖХ. В ходе исследований с использованием различных органических растворителей (в которых ДСС нерастворим) конечные концентрации муравьиной кислоты определяли методом 1 H ЯМР с использованием стандартного метода добавления (с известным раствором [HCOOH]) и контролем с помощью ионной хроматографии и ВЭЖХ.
Концентрации растворенного CO 2 и H 2 контролировали с помощью 13 C и 1 H ЯМР во время реакций каталитического гидрирования с использованием сапфировых ЯМР-трубок среднего давления 52,53 и жидкости, фаз в условиях реакции.
Эксперименты по переработке
Эксперименты по переработке катализатора проводили с использованием 10 мМ растворов [RuCl 2 (PTA) 4 ] в воде или ДМСО при давлении P (общее) = 100 бар, P (H 2 ) / P (CO 2 ) отношение 1, t =60 °C. Когда реакция достигала равновесия, давление в системах сбрасывали и определяли концентрацию муравьиной кислоты. Растворитель и муравьиную кислоту удаляли в вакууме, а оставшийся твердый катализатор растворяли в соответствующем растворителе (H 2 O или ДМСО), под давлением до 100 бар, P (H 2 )/ P (CO 2 ) в соотношении 1. После каждой реакции концентрацию муравьиной кислоты определяли по 1 Повторяли спектроскопию ЯМР 1Н и процедуру рециркуляции. Кроме того, полученную муравьиную кислоту можно дегидрировать до водорода и диоксида углерода с использованием иммобилизованного катализатора, описанного ранее 40 .
Дополнительная информация
Как цитировать эту статью: Море, С. и др. . Прямой синтез муравьиной кислоты из углекислого газа гидрированием в кислой среде. Нац. коммун. 5:4017 doi: 10.1038/ncomms5017 (2014).
Ссылки
Обсерватория Мауна-Лоа, Гавайи http://co2now.org/ (2014).
Толлефсон, Дж. Рост сельскохозяйственных преимуществ для климата. Природа 462 , 966–967 (2009).
КАС Статья Google ученый
Aresta, M. Извлечение и утилизация углекислого газа Kluwer Academic Publishers: Dordrecht, (2010).
Мец, Б., Дэвидсон, О., Де Конинк, Х., Лоос, М. и Мейер, Л. Улавливание и хранение углекислого газа Издательство Кембриджского университета: Кембридж, Великобритания, (2005).

Дзубак А.Л. и др. L. Улавливание углерода Ab initio в металлоорганических каркасах открытого участка. Нац. хим. 4 , 810–816 (2012).
КАС Статья Google ученый
Лин Л.-К. и другие. Скрининг материалов, улавливающих углерод, in silico. Нац. Mater 11 , 633–641 (2012).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Balaraman, E., Gunanathan, C., Zhang, J., Shimon, L.J.W. & Milstein, D. Эффективное гидрирование органических карбонатов, карбаматов и формиатов указывает альтернативные способы получения метанола на основе CO2 и CO. 909:10 Нац. хим. 3 , 609–614 (2011).
КАС Статья Google ученый
Сенти Г. и Ператонер С. Возможности и перспективы химической переработки углекислого газа в топливо.
 Катал. Сегодня 148 , 191–205 (2009).
Катал. Сегодня 148 , 191–205 (2009).КАС Статья Google ученый
Carbon Recycling International http://cri.is/ (2013).
Aresta, M. & Dibenedetto, A. Использование CO2 в качестве химического сырья: возможности и проблемы. Далтон Транс. 2975–2992 (2007).
Schlapbach, L. & Züttel, A. Материалы для хранения водорода для мобильных устройств. Природа 414 , 353–358 (2001).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Дейлбрук, А. Ф., Ган, В., Граземанн, М., Морет, С. и Лауренци, Г. Хранение водорода: выход за рамки традиционных методов. Хим. коммун. 49 , 8735–8751 (2013).
КАС Статья Google ученый
Энталер, С.
 , фон Лангерманн, Дж. и Шмидт, Т. Углекислый газ и муравьиная кислота — пара для экологически безопасного хранения водорода? Энергетика Окружающая среда. науч. 3 , 1207–1217 (2010).
, фон Лангерманн, Дж. и Шмидт, Т. Углекислый газ и муравьиная кислота — пара для экологически безопасного хранения водорода? Энергетика Окружающая среда. науч. 3 , 1207–1217 (2010).КАС Статья Google ученый
Джу, Ф. Прорывы в области хранения водорода — муравьиная кислота как устойчивый материал для хранения водорода. ChemSusChem 1 , 805–808 (2008).
КАС Статья Google ученый
Граземанн, М. и Лауренци, Г. Муравьиная кислота как источник водорода – последние разработки и будущие тенденции. Энергетика Окружающая среда. науч. 5 , 8171–8181 (2012).
КАС Статья Google ученый
Барнард, Дж. Х., Ван, К., Берри, Н. Г. и Сяо, Дж. Л. Бифункциональный катализ металл-лиганд дальнего действия: циклометаллированные иридиевые катализаторы для мягкого и быстрого дегидрирования муравьиной кислоты.
 Хим. науч. 4 , 1234–1244 (2013).
Хим. науч. 4 , 1234–1244 (2013).КАС Статья Google ученый
Boddien, A. et al. Эффективное дегидрирование муравьиной кислоты с использованием железного катализатора. Наука 333 , 1733–1736 (2011).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Федерсел К., Джекстелл Р. и Беллер М. Современные катализаторы для гидрирования диоксида углерода. 909:10 Анжю. хим. Междунар. Эд. 49 , 6254–6257 (2010).
КАС Статья Google ученый
Джессоп, П.Г., Джу, Ф. и Тай, К.С. Последние достижения в области гомогенного гидрирования диоксида углерода. Координ. хим. Ред. 248 , 2425–2442 (2004 г.).
КАС Статья Google ученый
Джессоп П.
 Г., Икария Т. и Нойори Р. Гомогенное каталитическое гидрирование сверхкритического диоксида углерода. Nature 368 , 231–233 (1994).
Г., Икария Т. и Нойори Р. Гомогенное каталитическое гидрирование сверхкритического диоксида углерода. Nature 368 , 231–233 (1994).КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Лейтнер, В. Углекислый газ как сырье для синтеза муравьиной кислоты и ее производных из СО2. Анжю. хим. Междунар. Эд. 34 , 2207–2221 (1995).
КАС Статья Google ученый
Jessop, P.G. в Справочнике по гомогенному гидрированию 489–511Wiley-VCH: Weinheim, (2007).
Танака Р., Ямашита М. и Нодзаки К. Каталитическое гидрирование диоксида углерода с использованием комплексов Ir(III)-клещи. Дж. Ам. хим. соц. 131 , 14168–14169 (2009).
КАС Статья Google ученый
Папп, Г.
 , Чорба, Дж., Лауренци, Г. и Йоу, Ф. Зарядно-разрядное устройство для хранения и производства химического водорода. Анжю. хим. Междунар. Эд. 50 , 10433–10435 (2011).
, Чорба, Дж., Лауренци, Г. и Йоу, Ф. Зарядно-разрядное устройство для хранения и производства химического водорода. Анжю. хим. Междунар. Эд. 50 , 10433–10435 (2011).КАС Статья Google ученый
Халл, Дж. Ф. и др. Обратимое хранение водорода с использованием CO2 и переключаемого протонами иридиевого катализатора в водной среде при умеренных температурах и давлениях. Нац. хим. 4 , 383–388 (2012).
КАС Статья Google ученый
Boddien, A. et al. К разработке водородной батареи. Энергетика Окружающая среда. науч. 5 , 8907–8911 (2012).
КАС Статья Google ученый
Laurenczy, G., Joo, F. & Nadasdi, L. Образование и характеристика водорастворимых комплексов гидридо-рутения (II) 1,3,5-триаза-7-фосфаадамантана и их каталитическая активность в гидрировании CO2 и HCO3 − в водном растворе.
 Неорг. хим. 39 , 5083–5088 (2000).
Неорг. хим. 39 , 5083–5088 (2000).КАС Статья Google ученый
Preti, D., Squarcialupi, S. & Fachinetti, G. Получение аддуктов HCOOH/NEt3 путем включения CO2/h3 в чистый NEt3. Анжю. хим. Междунар. Эд. 49 , 2581–2584 (2010).
КАС Статья Google ученый
Тай, К.С., Чанг, Т., Роллер, Б. и Джессоп, П.Г. Комбинаторный скрининг гомогенных катализаторов под высоким давлением: гидрирование диоксида углерода. Неорг. хим. 42 , 7340–7341 (2003).
КАС Статья Google ученый
Шауб, Т. и Пациелло, Р. А. Процесс синтеза муравьиной кислоты путем гидрирования СО2: термодинамические аспекты и роль СО. Angew. хим. Междунар. Эд. 50 , 7278–7282 (2011).
КАС Статья Google ученый
Чжао Г.
 Ю. и Джу Ф. Свободная муравьиная кислота путем гидрирования диоксида углерода в растворах формиата натрия. Катал. коммун. 14 , 74–76 (2011).
Ю. и Джу Ф. Свободная муравьиная кислота путем гидрирования диоксида углерода в растворах формиата натрия. Катал. коммун. 14 , 74–76 (2011).КАС Статья Google ученый
Joszai, I. & Joo, F. Гидрирование водных смесей карбоната кальция и диоксида углерода с использованием водорастворимого комплексного катализатора родий(I)–третичный фосфин. Дж. Мол. Катал. Хим. 224 , 87–91 (2004).
КАС Статья Google ученый
Graf, E. & Leitner, W. Прямое образование муравьиной кислоты из диоксида углерода и диводорода с использованием каталитической системы [{Rh(cod)Cl}2]-Ph3P(Ch3)4PPh3. J. Chem. соц. хим. коммун. 623–624 (1992).
Ого, С., Хаяси, Х. и Фукузуми, С. Водное гидрирование диоксида углерода, катализируемое водорастворимыми аквакомплексами рутения в кислых условиях.
 Хим. коммун. 2714–2715 (2004 г.).
Хим. коммун. 2714–2715 (2004 г.).Ого, С., Кабе, Р., Хаяши, Х., Харада, Р. и Фукузуми, С. Исследование механизма гидрирования СО2 аквакомплексами Ru(II) и Ir(III) в кислых условиях: два каталитические системы, отличающиеся характером скорости определяющей стадии. Далтон Транс. 4657–4663 (2006).
Вессельбаум, С., Хинтермайр, У. и Лейтнер, В. Непрерывное гидрирование диоксида углерода до чистой муравьиной кислоты с использованием интегрированного процесса scCO2 с иммобилизованным катализатором и основанием. Анжю. хим. Междунар. Эд. 51 , 8585–8588 (2012).
КАС Статья Google ученый
Лоренци Г., Джеднер С., Алессио Э. и Дайсон П. Дж. In situ ЯМР-характеристика промежуточного продукта каталитического гидрирования CO2 и HCO3 − в водном растворе. Неорг. хим. коммун. 10 , 558–562 (2007).

КАС Статья Google ученый
Fellay, C., Dyson, P.J. & Laurenczy, G. Жизнеспособная система хранения водорода, основанная на селективном разложении муравьиной кислоты с рутениевым катализатором. Анжю. хим. Междунар. Эд. 47 , 3966–3968 (2008).
КАС Статья Google ученый
Феллай К., Ян Н., Дайсон П.Дж. и Лауренци Г. Селективное разложение муравьиной кислоты для производства водорода под высоким давлением: механистическое исследование. Хим. Евро. J. 15 , 3752–3760 (2009).
КАС Статья Google ученый
Ган, В., Дайсон, П.Дж. и Лоуренси, Г. Гетерогенные рутениево-фосфиновые катализаторы на носителе из диоксида кремния для селективного разложения муравьиной кислоты. ChemCatChem 5 , 3124–3130 (2013).

КАС Статья Google ученый
Дейгл, Д. Дж., Пепперман, А. Б. и Вейл, С. Л. Синтез монофосфорного аналога гексаметилентетрамина. J. Гетероцикл. хим. 11 , 407–408 (1974).
КАС Статья Google ученый
Дейгл, Д. Дж. и Пепперман, А. Б. Химическое доказательство предпочтительной кватернизации азота в 1,3,5-триаза-7-фосфаадамантане. Дж. Гетероцикл. хим. 12 , 579–580 (1975).
КАС Статья Google ученый
Darensbourg, D. J. et al. Водорастворимые металлоорганические соединения 4. Каталитическое гидрирование альдегидов в водной двухфазной системе растворителей с использованием 1,3,5-триаза-7-фосфаадамантанового комплекса рутения. Неорг. хим. 33 , 200–208 (1994).
КАС Статья Google ученый
Даренсбург, Д.
 Дж., Джу, Ф., Каннисто, М., Като, А. и Рейбенспайс, Дж. Х. Водорастворимые металлоорганические соединения.2. каталитическое гидрирование альдегидов и олефинов новыми водорастворимыми 1,3,5-триаза-7-фосфаадамантановыми комплексами рутения и родия. Металлоорганические соединения 11 , 1991–1993 (1992).
Дж., Джу, Ф., Каннисто, М., Като, А. и Рейбенспайс, Дж. Х. Водорастворимые металлоорганические соединения.2. каталитическое гидрирование альдегидов и олефинов новыми водорастворимыми 1,3,5-триаза-7-фосфаадамантановыми комплексами рутения и родия. Металлоорганические соединения 11 , 1991–1993 (1992).Google ученый
Joó, F. et al. (Мета-сульфонатофенил)дифенилфосфин, натриевая соль и его комплексы с родием(I), рутением(II), иридием(I). Неорг. Синтез. 32 , 1–8 (1998).
Google ученый
Серли, Б. и др. Является ли ароматический фрагмент соединений рутения из пианино-табурета существенным признаком противораковой активности? Разработка новых аналогов RuII-[9]aneS3. евро. Дж. Неорг. хим. 3423–3434 (2005).
Bennett, M.A. & Smith, A.K. Ареновые комплексы рутения (II), образованные дегидрированием циклогексадиенов трихлоридом рутения (III).
 J. Chem. соц. Далтон 233–241 (1974).
J. Chem. соц. Далтон 233–241 (1974).Гандольфи, К., Хеккенрот, М., Нильс, А., Лауренци, Г. и Альбрехт, М. Хелатирование комплексов NHC рутения (II) в качестве надежных гомогенных катализаторов гидрирования. Металлоорганические соединения 28 , 5112–5121 (2009).
КАС Статья Google ученый
Пручник Ф.П., Смоленский П., Галдецка Э. и Галдецки З. Структурные, спектроскопические и каталитические свойства водорастворимых гидридных комплексов родия [RhH(Rtpa + I — )4]h3O (R=Me, Et). Неорг. Чим. Acta 293 , 110–114 (1999).
КАС Статья Google ученый
Kovacs, J., Joo, F., Benyei, A.C. & Laurenczy, G. Реакции [Ru(h3O)6] 2+ с водорастворимыми третичными фосфинами. Далтон Транс. 2336–2340 (2004 г.
 ).
).Море, С., Дайсон, П.Дж. и Лауренци, Г. Прямое определение на месте pH и концентраций растворенных веществ при дегидрировании муравьиной кислоты и гидрировании CO2 в водных растворах под давлением с использованием 1 H и 13 C ЯМР-спектроскопия. Далтон Транс. 42 , 4353–4356 (2013).
КАС Статья Google ученый
Саймонс, Э. А. Растворимость газообразного водорода в системе диметилсульфоксид-вода: еще один ключ к разгадке структуры растворителя в этих средах. Кан. Дж. Хим. 49 , 3940–3947 (1971).
КАС Статья Google ученый
Дайсон, П.Дж., Лауренци, Г., Олин, К.А., Валланс, Дж. и Велтон, Т. Определение концентрации водорода в ионных жидкостях и влияние (или отсутствие) на скорость гидрирования. Хим. коммун. 2418–2419 (2003).

Скачать ссылки
Благодарности
Швейцарский национальный научный фонд, EOS Holding и EPFL выражаем благодарность за финансовую поддержку.
Информация об авторе
Авторы и организации
Institut Des Sciences et Ingénierie Chimiques, Ecole Polytechnique Fédérale de Lausanne (EPFL), Lausanne, CH-1015, Switzerland
789898989888898 1111111111111111111111111111111117ERINE1111111111111111111111111111111117ERINE111111111111111111111111111111111111111111РУС. Просмотр публикаций автораВы также можете искать этого автора в PubMed Google Scholar
- Paul J. Dyson
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Gábor Laurenczy
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Взносы
С. М. проводил синтезы и кинетические измерения; П.Дж.Д. участвовал в научных дискуссиях; Г.Л. разработал и руководил проектом, руководил исследовательской работой; С.М., П.Дж.Д. и Г.Л. участвовали в подготовке рукописи.
М. проводил синтезы и кинетические измерения; П.Дж.Д. участвовал в научных дискуссиях; Г.Л. разработал и руководил проектом, руководил исследовательской работой; С.М., П.Дж.Д. и Г.Л. участвовали в подготовке рукописи.
Автор, ответственный за переписку
Связь с Габор Лауренси.
Декларации этики
Конкурирующие интересы
Подана заявка на патент (PCT/IB2014/058883). Авторы заявляют об отсутствии конкурирующих финансовых интересов
Дополнительная информация
Дополнительная информация
Дополнительные рисунки 1-9, дополнительные таблицы 1-7 и дополнительные ссылки (PDF 795 kb) Commons Attribution-NonCommercial-ShareAlike 3.0 Неперенесенная лицензия. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке; если материал не включен в лицензию Creative Commons, пользователям необходимо будет получить разрешение от держателя лицензии на воспроизведение материала. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by-nc-sa/3.0/
Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by-nc-sa/3.0/
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Каталитическая конверсия глюкозы и ее биополимеров в возобновляемые соединения за счет разрыва и образования связи C–C.
- Харшита Н. Анчан
- Навья Субрей Бхат
- Сайкат Дутта
Конверсия биомассы и биопереработка (2022)
Эффективное гидрирование диоксида углерода до муравьиной кислоты буферными ионными жидкостями
- Андреас Вейлхард
- Стивен П.
 Арджент
Арджент - Виктор Санс
Nature Communications (2021)
Эффективный цикл химической фиксации и дефиксации углекислого газа в условиях окружающей среды
- Саумен Хайра
- Анураг Бисвас
Научные отчеты (2020)
Электрохимическое восстановление CO2 до высококонцентрированных чистых растворов муравьиной кислоты в полностью твердотельном реакторе
- Лэй Фан
- Чуан Ся
- Хаотянь Ван
Nature Communications (2020)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Скачать PDF
Краткое руководство по кислотно-щелочному балансу
Категория: Медицинский
Тема: Кислотно-щелочной баланс
Уровень: АЕМТ
Следующая единица: Ацидоз и алкалоз
19 минут чтения
Кислотно-щелочной баланс — это просто!
pH является показателем кислотности. Он просто измеряет, насколько что-то кислое. Когда мы говорим о кислотности, мы говорим об избытке ионов водорода (H+), но мы просто будем использовать общий термин «кислота». Это пугающая иностранная фраза, но она просто означает «процент кислот». Кислота не всегда так плоха, как в кино. Шкала pH варьируется от 0 до 14, поэтому нейтральный уровень равен 7 (вода нейтральна). Организму требуется pH 9. 0575 7.35-7.45 для поддержания гомеостаза. 0,5 в любую сторону далеко не способствует жизни. Итак, когда мы находим кого-то, чей уровень кислотности не способствует жизни, мы противодействуем этой проблеме и восстанавливаем гомеостаз. Вы хотите, чтобы тело не было ни слишком кислым, ни слишком щелочным, вы хотите сбалансировать его. Это все средства кислотно-щелочного баланса.
0575 7.35-7.45 для поддержания гомеостаза. 0,5 в любую сторону далеко не способствует жизни. Итак, когда мы находим кого-то, чей уровень кислотности не способствует жизни, мы противодействуем этой проблеме и восстанавливаем гомеостаз. Вы хотите, чтобы тело не было ни слишком кислым, ни слишком щелочным, вы хотите сбалансировать его. Это все средства кислотно-щелочного баланса.
КИСЛОТА — СЛИШКОМ МНОГО КИСЛОТЫ — Ниже чем 7,35 означает, что в вашей системе слишком много кислоты.
НОРМАЛЬНЫЙ — В самый раз! pH между 7,35 и 7,45 идеально подходит для гомеостаза.
ЩЕЛОЧНАЯ — НЕДОСТАТОЧНО КИСЛОТЫ – это просто означает НЕДостаточно кислая. pH 90 575 выше 90 576 , чем 7,45 , считается щелочным.
ДЕЙСТВИТЕЛЬНО ВАЖНО
Вы вдыхаете кислород, ваше тело превращает кислород в углекислый газ, вы выдыхаете и удаляете углекислый газ из вашего тела.
Углекислый газ является «дыхательной кислотой». Когда вы не дышите адекватно, вы не избавляетесь от этой «дыхательной кислоты», и она накапливается в тканях. Дополнительные молекулы CO2 соединяются с водой в вашем теле, образуя угольную кислоту, что приводит к повышению pH. Это плохо.
Как мы это измеряем?
Мы можем измерить количество дыхательной кислоты в артериальной крови, используя газы крови. Они измеряют количество каждого газа в крови. Мы измеряем рН , количество углекислого газа ( ПаСО2 ) и количество кислорода в крови ( ПаО2 ).
PaCO2 является парциальным давлением двуокиси углерода . Мы можем измерить его, чтобы увидеть, сколько дыхательной кислоты (CO2) содержится в крови. Мы используем анализ газов артериальной крови, чтобы проверить это. Сколько дыхательной кислоты (CO2) должно быть? Нормальное значение – 9.0575 35-45 мм рт. ст. (мм рт. ст. означает миллиметры ртутного столба, это измерение давления). (a) в PaCO2 просто означает артериальное. Если вы измеряли газы венозной крови, то уровни другие, и используется PvCO2. Если СО2 ВЫСОКИЙ, это означает, что в дыхательных путях скопились кислоты, потому что он не выдыхает достаточное количество СО2. Если ваш pH кислый, а CO2 ВЫСОКИЙ, это считается респираторным ацидозом. Если СО2 НИЗКИЙ, это означает, что дыхательных кислот недостаточно, потому что он, вероятно, гипервентилирует слишком много СО2. Когда pH высокий, а CO2 низкий, это называется респираторным алкалозом.
(мм рт. ст. означает миллиметры ртутного столба, это измерение давления). (a) в PaCO2 просто означает артериальное. Если вы измеряли газы венозной крови, то уровни другие, и используется PvCO2. Если СО2 ВЫСОКИЙ, это означает, что в дыхательных путях скопились кислоты, потому что он не выдыхает достаточное количество СО2. Если ваш pH кислый, а CO2 ВЫСОКИЙ, это считается респираторным ацидозом. Если СО2 НИЗКИЙ, это означает, что дыхательных кислот недостаточно, потому что он, вероятно, гипервентилирует слишком много СО2. Когда pH высокий, а CO2 низкий, это называется респираторным алкалозом.
Полевое примечание: На грузовиках иногда используется pETCO2 (двуокись углерода в конце выдоха) и выражается в процентах вместо измерения давления в мм рт.ст. для измерения эффективности вентиляции и циркуляции. pETCO2 на уровне 5–6 % примерно соответствует PaCO2 на уровне 35–45 мм рт. ст., поэтому титруйте вентиляцию, чтобы достичь 5–6 % pETCo2.
Краткое правило тестирования ЕМТ
Неадекватное дыхание — Респираторный ацидоз — PH будет низким, уровень CO2 будет высоким, потому что он не выдыхается.
Пациенты с гипервентиляцией — Респираторный алкалоз — PH будет высоким, уровень CO2 будет низким, потому что они выдыхают слишком много CO2.
Если CO2 НИЗКИЙ , тогда УМЕНЬШИТЕ частоту и глубину вентиляции.
Если уровень CO2 ВЫСОКИЙ , то УВЕЛИЧИТЬ частоту и глубину вентиляции.
Обзор
Респираторный ацидоз
НЕ Дышите адекватно — НЕ выдыхаете достаточно, значит, вы не избавляетесь от СО2, следовательно, рСО2 (процент СО2 ВЫСОК!) , головная боль
Причина: Затрудненное дыхание или отсутствие дыхания (ХОБЛ, передозировка, пневмония, вдыхание дыма, пневмоторакс, обструкция дыхательных путей)
Лечение — Увеличьте частоту и глубину вентиляции — Упакуйте их, чтобы избавиться от некоторого количества CO2 для них .
Респираторный алкалоз
Выброс слишком большого количества CO2, как при гипервентиляции. Когда в крови недостаточно СО2, организм использует бикарбонат, чтобы компенсировать недостаток дыхательной кислоты. (Метаболическая компенсация)
Когда в крови недостаточно СО2, организм использует бикарбонат, чтобы компенсировать недостаток дыхательной кислоты. (Метаболическая компенсация)
Клиническая картина: Онемение или подергивание мышц пальцев рук и ног, судороги
Причина: Шок, ДКА Куссмауля Дыхание — Глубокое и БЫСТРОЕ дыхание! (Организм пытается компенсировать свой метаболический ацидоз, специально вызывая респираторный алкалоз.) Вызванный (беспокойством, болью, лихорадкой, гипотензией, гипоксией, ЗСН, ТЭЛА, сепсисом)
Лечение: уменьшение скорости и глубины вентиляции. (Успокойте их или перестаньте так быстро набирать мешки.)
Метаболический
Метаболический просто означает, что он имеет отношение к метаболизму. Метаболизм просто означает химические изменения, которые поддерживают жизнь. Кислород соединяется с глюкозой для создания энергии. Углекислый газ является побочным продуктом этого процесса. Затем СО2 переносится из крови в альвеолы в легкие для выдоха. Мы сдуваем эту респираторную кислоту, когда вентиляция становится достаточной. Ваше тело вырабатывает щелочной буфер, известный как бикарбонат, который связывает излишки кислот и делает его нейтральным. Бикарбонат похож на Tums для вашего кровотока.
Затем СО2 переносится из крови в альвеолы в легкие для выдоха. Мы сдуваем эту респираторную кислоту, когда вентиляция становится достаточной. Ваше тело вырабатывает щелочной буфер, известный как бикарбонат, который связывает излишки кислот и делает его нейтральным. Бикарбонат похож на Tums для вашего кровотока.
HCO3 количество бикарбоната в кровотоке. HCO3 — это просто химическое название бикарбоната. В норме 22-26 /мэкв/л (миллиэквивалентов на литр). Он измеряет, сколько Tums в крови связывает избыток кислоты. Если ваш уровень HCO3 (Tums) равен 10, это означает, что его не хватает, и поэтому кислота в вашей крови просто накапливается, и общий pH вашего тела падает! Это называется метаболическим ацидозом. Чтобы это исправить, мы повышаем уровень бикарбоната, вводя его внутривенно! Если его слишком много, он связывает слишком много кислоты, а ее недостаточно, поэтому теперь ваш pH становится щелочным! Это называется метаболическим алкалозом. Исправьте это, удерживая вашего пациента в стабильном состоянии достаточно долго, чтобы бикарбонат сработал сам.
Исправьте это, удерживая вашего пациента в стабильном состоянии достаточно долго, чтобы бикарбонат сработал сам.
Метаболический ацидоз
Кислота в крови используется для соединения с кислородом и его метаболизма. Если у вас недостаточно циркулирующей крови, богатой кислородом, кислота не используется и накапливается.
Клиническая картина: Тахикардия, отек легких, тахипноэ, спутанность сознания или кома . Подумайте о бикарбонате — это как Tums для вашей крови. Он связывает кислоту в вашем теле и превращает ее в нейтральную.
Метаболический алкалоз
Слишком много бикарбоната, недостаточно кислоты
Клиническая презентация: приступы, головная боль, кожи. живут достаточно долго, чтобы их тело израсходовало избыток бикарбоната.
Краткий справочник Handy Dandy
Почки
На почках также имеется аварийный выключатель.

 В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.
В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона. Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.
Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.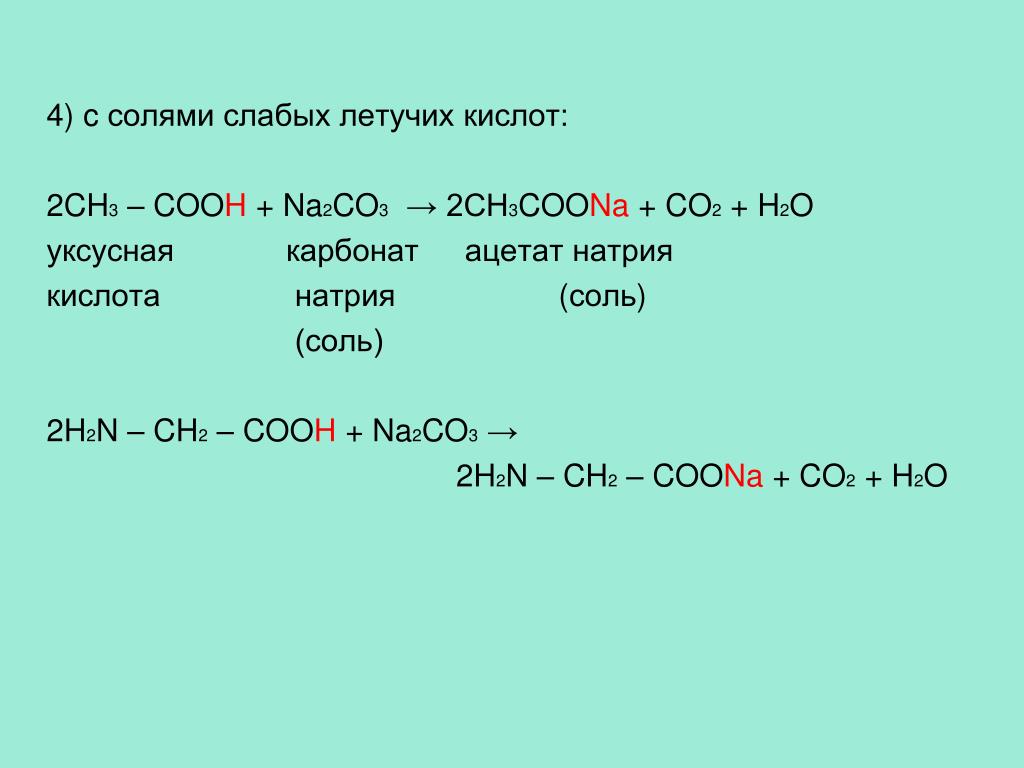 В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.
В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона. Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.
Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение. В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона.
В основе — кора хинного дерева из Конго, эфирное масло горького апельсина из Мексики и эфирное масло сицилийского лимона. Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение.
Лёгкая горчинка и свежесть приятно утолит жажду и поднимет настроение. В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время.
В результате получился мягкий клубничный лимонад с ореховым послевкусием. А специи остаются на языке ещё долгое время. Вкус и аромат лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета
Вкус и аромат лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета
 Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
 Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
 Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.
Вкус лёгкий, пряный, с долгим цитрусовым оттенком. Идеально подходит для утоления жажды и употребления в холодное время года для поддержания иммунитета.