Барий, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
К термодинамике взаимодействия комплексных раскислителей, содержащих барий, с кислородом в металлических расплавах Текст научной статьи по специальности «Химические науки»
УДК 669.15.046.516
К ТЕРМОДИНАМИКЕ ВЗАИМОДЕЙСТВИЯ КОМПЛЕКСНЫХ РАСКИСЛИТЕЛЕЙ, СОДЕРЖАЩИХ БАРИЙ, С КИСЛОРОДОМ В МЕТАЛЛИЧЕСКИХ РАСПЛАВАХ
Г.Г. Михайлов, Л.А. Макровец
THERMODYNAMICS OF INTERACTIONS OF COMPLEX DEOXIDIZERS CONTAINING BARIUM WITH OXYGEN IN METAL MELTS
G.G. Mikhailov, L.A. Makrovets
Рассмотрены термодинамические аспекты процессов раскисления стали и модифицирования неметаллических включений в стали сплавами, содержащими барий. Построены многокомпонентные диаграммы растворимости компонентов в жидком металле. Показано, что ввиду малой растворимости бария в металле его раскисляющее действие минимально. По-видимому, модифицирующее действие бария заключается в его высокой поверхностной активности.
Ключевые слова: барий, неметаллические включения, диаграммы, модифицирование.
Thermodynamic aspects of steel deoxidation processes and modification of non-metallic inclusions in steel with alloys containing barium are studied. Multicomponent charts of component solubility in liquid metal are constructed. It is shown that due to low solubility of barium in metal its deoxidizing effect is minimal. Apparently, barium modifying effect is in its high surface activity.
Keywords: barium, nonmetallic inclusions, charts, modifying.
В научной и технологической литературе уже более 30 лет идет обсуждение раскислительной и модифицирующей способности бария. Получение сплавов с барием, а также с кремнием, кальцием и алюминием в настоящее время не представляет технологических сложностей [1]. Это делает привлекательным использование лигатур с барием, так как упругость пара бария при температурах сталеварения по различным определениям составляет от 0,5 до 0,8 атмосфер, тогда как упругость пара кальция при 1600 °С составляет величину около 1,7 атм. Последнее приводит к пиротермич-ности процессов раскисления стали силикокальци-ем и требует специальных технологических приемов при введении сплавов с кальцием в сталь. В литературе также отмечается, что пиротермичность процесса раскисления стали сплавами, содержащими и кальций, и барий существенно ниже, чем при раскислении стали сплавами типа СК-30. Это связано с тем, что при введении в сталь сплавов типа 81-Са-Ба кремний быстрее растворяется в железе, нежели кальций и барий, и поэтому на какой-то стадии в металле находятся капли кальция и бария, а это снижает парциальное давление кальция над раскисляющей лигатурой.
Последнее приводит к пиротермич-ности процессов раскисления стали силикокальци-ем и требует специальных технологических приемов при введении сплавов с кальцием в сталь. В литературе также отмечается, что пиротермичность процесса раскисления стали сплавами, содержащими и кальций, и барий существенно ниже, чем при раскислении стали сплавами типа СК-30. Это связано с тем, что при введении в сталь сплавов типа 81-Са-Ба кремний быстрее растворяется в железе, нежели кальций и барий, и поэтому на какой-то стадии в металле находятся капли кальция и бария, а это снижает парциальное давление кальция над раскисляющей лигатурой.
В работе [2] было проведено сравнительное исследование раскислительной способности сплавов 8Юа, 81СаБа, СаБа после предварительного введения алюминия. Было установлено, что при введении сплава 81СаБа получено несколько меньшее содержание кислорода в стали, нежели
при введении сплава 8Юа. Но использование сплава СаА1 позволяет получить меньшее содержание кислорода в стали. В неметаллических включениях барий обнаруживался через 10 с после введения лигатуры с барием. В более ранних и поздних пробах барий во включениях не обнаруживался.
В неметаллических включениях барий обнаруживался через 10 с после введения лигатуры с барием. В более ранних и поздних пробах барий во включениях не обнаруживался.
В работе [3] описываются результаты продувки трубной стали в ковше порошками силикобария и силикокальция. Общее количество включений при продувке силикокальцием и силикобарием оказалось одинаковым. В значительном количестве работ отмечается, что использование бария в лигатурах приводит к уменьшению количества крупных неметаллических включений [3]. Оставшиеся включения обычно содержат кальций, кремний, алюминий, связанные с кислородом. Содержание ВаО отмечается лишь в единичных включениях. Отмечается также отсутствие бария в твердом металле. По-видимому, эффект модифицирования структуры и повышение эксплуатационных свойств стали, отмеченные в литературе, происходят где-то на наноуровне [4]. Высокая эффективность модифицирования транспортного металла сплавами с барием убедительно подтверждается в работе [5].
Из анализа литературных данных следует, что попытки систематизировать раскислительный аспект проблемы использования сплавов с барием носят отрывочный характер и требуют упорядочения.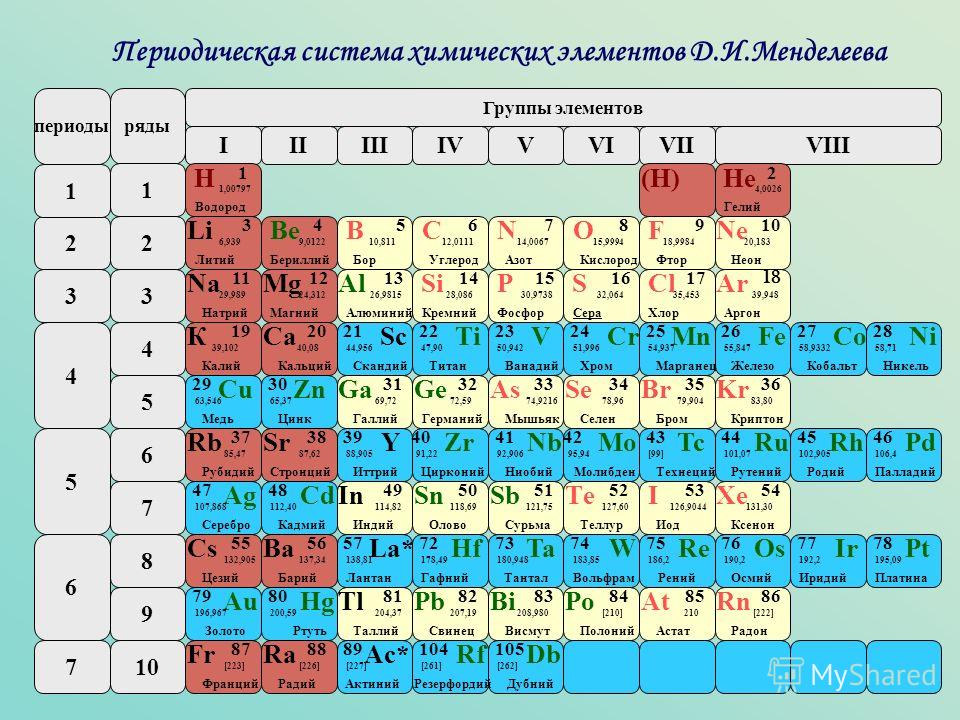
В настоящей работе выполнен термодинамический анализ процессов взаимодействия с кисло-
родом, растворенным в стали, при введении в сталь в качестве раскислителей кальция, бария и алюминия. Предварительным анализом установлено, что в равновесии с металлом в целом могут находиться следующие оксидные фазы: оксидный расплав, содержащий БеО, СаО, ВаО, А1203, гер-цинит БеА12О4, алюминаты бария 3Ва0 А1203, ВаОА12О3, ВаО6А12О3, А1203 и ВаО, твердые растворы БеО-СаО, а также газовая фаза (СО, СО2, пары Са).
Результаты расчетов удалось обобщить в виде оксидных диаграмм состояния, сопряженных с областью существования жидкого металла и построенных поверхностей растворимости компонентов в жидком металле (ПРКМ). Зависимости констант равновесия от температуры для основных реакций раскисления приведены в табл. 1.
Активности компонентов оксидных расплавов рассчитаны по теории субрегулярных ионных растворов в варианте квадратичной зависимости энергии смешения от состава расплава [6]. Энергетические параметры теории представлены в табл. 2. Активности компонентов металлического расплава рассчитаны с использованием параметров взаимодействия первого порядка, приведенных в табл. 3.
Энергетические параметры теории представлены в табл. 2. Активности компонентов металлического расплава рассчитаны с использованием параметров взаимодействия первого порядка, приведенных в табл. 3.
На рис. 1 представлена высокотемпературная часть диаграммы БеО-ВаО-СаО. Из нее видно, что если использовать крупку кальция и бария в порошковой проволоке для раскисления, все продукты раскисления будут твердыми. Это же следует и из рис. 2. На представленной ПРКМ (рис. 2) приведены составы жидкого металла, равновесного с указанными оксидными фазами. На жирных линиях заданы составы металла, равновесного с
Таблица 1
Зависимости констант равновесия реакций раскисления от температуры
Реакция 1й К = -А/Т + В
А В
(РеО) = ре] + [О] 6320 4,734
(СаО) = [Са] + [О] 7220 -3,29
(ВаО) = [Ва] + [О] 20 384 7,36
(Л12О3) = 2[А1] + 3[О] 58 320 18,02
РеО I = [Ре] + [О] 8069 5,80
I СаО | = [Са] + [О] 9843 -2,377
І РеОАЬОэ I = [Ре] + 2[А1] + 4[О] 74 580 26,37
І СаО ЛІ2Оз I = [Са] + 2[А1] + 4[О] 71 047 15,212
I СаО2А12О31 = [Са] + 4[А1] + 7[О] 137 521 36,476
I СаО6А12О31 = [Са] + 12[А1] + 19[О] 401 927 122,115
ВаОА12Оз = [Ва] + 2[А1] + 4[О] 84 000 25,76
І 3ВаО-АЬОз I = 3[Ва] + 2[А1] + 6[О] 127 800 40,95
I ВаО 6А12Оз I = [Ва] + 12[А1] + 19[О] 402 350 125,99
I ВаО I = [Ва] + [О] 23 400 8,73
I А12Оз I = 2[А1] + 3[О] 64 000 20,48
{СО} = [С] + [О] 1168 -2,07
{СО2} = [С] + 2[О] 9616 2,51
а] [С 2 = 2} а С { -1912 -2,69
Таблица 2
Значения параметров теории субрегулярных ионных растворов для системы РеО-Ва0-ОаО-Л!2О3
Системы Энергетические параметры, кал/моль
От °іккк
РеО-ВаО -5000 -10 000 -5000
РеО-СаО -6897 -13 794 -6897
РеО-А12О3 661 -16 329 -4917
ВаО-СаО 0 0 0
ВаО-АЬО3 -21 194 -10 073 -32 395
СаО-АЬО3 -12 302 -41 264 -23 342
°іі/к °укк
РеО-ВаО-СаО -10 000 0 -10 000
РеО-ВаО-А12О3 -10 000 -20 000 -30 000
РеО-СаО-А12О3 -20 000 -20 000 -40 000
ВаО-СаО-АЬО3 -45 500 -48 900 -81 400
Таблица 3
Параметры взаимодействия в- , Т =1600 °С, растворитель — жидкое железо
Элемент 1 Элемент]
А1 Са О С Ва
А1 0,045 -0,0515 -1,62 0,0966 -0,064
Са 0,072 -0,07 -3,507 -0,324 0
О -0,96 -1,41 -0,2 -0,45 -0,95
С 0,043 -0,097 -0,34 0,14 -0,0059
Ва -0,325 0 -8,155 -0,068 0
СаО
Рис.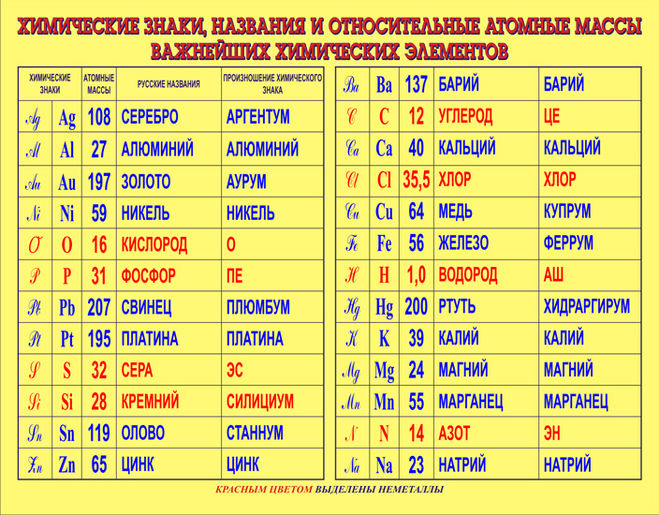 1. Диаграмма состояния системы РеО-ВаО-ОаО
1. Диаграмма состояния системы РеО-ВаО-ОаО
7 Г
Рис. 2. ПРКМ системы Ре-Ва-Оа-О, Т = 1600 °О, Робщ = 1 атм
двумя оксидными фазами. Тонкими линиями проведены изокислородные сечения поверхности. Видно, что жидкие оксидные фазы могут появиться в равновесии с металлом лишь при высокой его оксиленности и малых концентрациях кальция и бария в стали. Следует также отметить, что выше проведенной штриховой линии на рис. 2 структуру ПРКМ следует считать виртуальной.
В литературе указывается на применение при раскислении и модифицировании сплава кальция,
алюминия и бария. В связи с этим были проведены расчеты диаграммы состояния ВаО-СаО-А12О3 (рис. 3) и на основании строения этой диаграммы установлены оксидные фазы, которые могут образоваться при раскислении стали кальцием, барием и алюминием. На рис. 4 построена поверхность растворимости кальция, бария и алюминия в стали, содержащей 0,1 % углерода и кислород. Видно, что гексаалюминат бария может образоваться при введении в сталь совместно с кальцием и алюми-
Рис. 3. Диаграмма состояния системы ВаО-ОаО-А!2О3
3. Диаграмма состояния системы ВаО-ОаО-А!2О3
Рис. 4. ПРКМ системы Fe-Ba-Ca-Ai-G-C, [Al] = 0,01, [C] = 0,1 мас. %, Т = 1600 °C, Робщ = 1 атм
Михайлов Г.Г., Макровец Л.А.
нием в весьма узкой области, ниже штриховой линии при очень низких концентрациях кальция. Учитывая, что в связи с малой растворимостью в железе значительная часть бария находится в металле в виде микрокапельного состояния (своеобразной эмульсии), на границах микрокапельки может образоваться алюминат кальция. Концентрация же бария в оксидном расплаве (область I на рис. 4) не превышает тысячных атомных долей. Вид поверхности растворимости разъясняет, почему барий почти не обнаруживается в неметаллических включениях. Кальций и алюминий не дают возможности барию взаимодействовать с кислородом.
Выводы
1. Растворимость бария в железе, по крайней мере, на порядок меньше, чем растворимость кальция. Если считать, что содержание бария в железе достигло насыщения (0,001 %), то барий сможет связать 0,001-16/137 « 0,0001 мас. % кислорода. Поэтому раскисление стали барием может происходить только по механизму гетерогенного раскисления, микрокапельками бария. Этот процесс может быть организован либо интенсивным введением в металл порошковой проволоки, либо продувкой барийсодержащими лигатурами.
% кислорода. Поэтому раскисление стали барием может происходить только по механизму гетерогенного раскисления, микрокапельками бария. Этот процесс может быть организован либо интенсивным введением в металл порошковой проволоки, либо продувкой барийсодержащими лигатурами.
2. Барий присутствует буквально в большинстве неметаллических включений при проведении раскисления никельхромовых жаропрочных сталей. Никель повышает растворимость бария в металле и барий входит в состав неметаллических включений. Поэтому снижение содержания крупных неметаллических включений в стали, модифицированной сплавами с барием, возможно, связано не с особой скоростью удаления этих включений, а с образованием большого количества мелких включений, зарождению которых способствует высокая поверхностная активность бария.
3. Благоприятное влияние бария на структуру стали, уставленное на рельсовом и трубном металле несомненно, но сказать что-либо определенное о механизме этого явления пока невозможно. Содержание бария в твердом металле практически неопределимо. Его распределение по микрокристаллам и кристаллической решетке железа пока неизвестно.
Его распределение по микрокристаллам и кристаллической решетке железа пока неизвестно.
Литература
1. Кожевников, Г.Н. Электротермия лигатур щелочноземельных металлов с кремнием /Г.Н. Кожевников, В.П. Зайко, М.А. Рысс. — М.: Наука, 1978. — 224 с.
2. Deoxidation and Desulphyrization of liquid iron with barium and barium bearing calcium alloys / Y. Kataura, T. Shoji, K. Topawa, T. Takahashi // Trans. Iron and Steel Inst. Japan. — 1980. — Vol. 20, № 12. — P. 801.
3. Перспективное применение барийсодержащих лигатур для раскисления и модифицирования транспортного металла / К.В. Григорович, К.Ю. Демин, А.И. Арсенкин и др. // Металлы. -2011. — № 5. — С. 146-156.
4. К вопросу использования карбонатита для микролегирования / О.И. Нохрина, В.И. Дмитриен-ко, И. Д. Рожихина и др. // Современные проблемы электрометаллургии стали. — Челябинск: Издат. центр ЮУрГУ, 2010. — Ч. 2. — С. 60-64.
5. Эффективность нанотехнологий модифицирования рельсовой стали барием / А. А. Дерябин, В. В. Павлов, В. В. Могильный и др. // Сталь. — 2007. -№ 11. — С. 134-141.
Дерябин, В. В. Павлов, В. В. Могильный и др. // Сталь. — 2007. -№ 11. — С. 134-141.
6. Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. — М.: Издат. дом МИСиС, 2009. — 520 с.
Поступила в редакцию 15 октября 2012 г.
Реакции элементов 2 группы с кислородом
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3677
- Джим Кларк
- Школа Труро в Корнуолле
Элементы 2 группы (бериллий, магний, кальций, стронций и барий) реагируют с кислородом. для образования оксидов металлов. В этом модуле рассматривается, почему трудно наблюдать аккуратную картину этой реактивности.
Образование простых оксидов
В целом металлы сгорают в кислороде с образованием простого оксида металла. Бериллий не горит, если только он не находится в виде пыли или порошка. Бериллий имеет очень прочный (но очень тонкий) слой оксида бериллия на своей поверхности, и это предотвращает попадание любого нового кислорода на нижележащий бериллий для реакции с ним.
\[ 2X_{(s)} + O_{2(g)} \rightarrow 2XO_{(s)}\]
где \(X\) представляет любой металл группы 2.
Практически невозможно найти какую-либо закономерность в реакции металлов с кислородом. Было бы совершенно неверным сказать, что они горят тем сильнее, чем дальше вы спускаетесь по Группе. Чтобы иметь возможность провести какое-либо разумное сравнение, вы должны были бы иметь куски металла, которые были бы в равной степени свободны от оксидного покрытия, с точно такой же площадью поверхности и формой, с точно таким же потоком кислорода вокруг них и нагреты до точно такой же температуры. степени, чтобы начать их.
Как выглядят металлы, когда они горят, немного проблематично!
- Бериллий : По моему мнению, это те же серебристые искры, которыми горят порошки магния или алюминия, если их рассыпать в пламя, но я не уверен в этом.
- Магний горит типичным интенсивным белым пламенем.
- Кальций очень неохотно начинает гореть, но затем резко вспыхивает, горя интенсивным белым пламенем с красным оттенком в конце.
- Стронций также неохотно загорается, но затем горит интенсивным почти белым пламенем с красным оттенком, особенно снаружи.
- Барий : Бледно-зеленое пламя, которое кажется белым с некоторыми бледно-зелеными оттенками. Это было не более драматично, чем знакомое пламя магния.
Образование пероксидов
Стронций и барий также реагируют с кислородом с образованием пероксида стронция или бария. Стронций образует его при нагревании в кислороде под высоким давлением, а барий образует перекись бария только при обычном нагревании в кислороде. Будут производиться смеси оксида бария и пероксида бария.
Будут производиться смеси оксида бария и пероксида бария.
\[ Ba_{(s)} + O_{2(s)} \rightarrow BaO_{2(s)}\]
Уравнение для стронция будет выглядеть точно так же.
Реакции с воздухом
Реакции металлов группы 2 с воздухом, а не с кислородом, осложняются тем фактом, что все они реагируют с азотом с образованием нитридов. В каждом случае вы получите смесь оксида металла и нитрида металла. Общее уравнение для группы:
\[ 3X_{(s)} + N_{2(g)} \rightarrow X_3N_{2(s)}\]
Например, знакомый белый пепел, который вы получаете, когда вы сжигаете магниевую ленту на воздухе, представляет собой смесь оксида магния и нитрида магния.
\[ 2Mg_{(s)} + O_{2(g)} \rightarrow 2MgO_{(s)}\]
\[ 3Mg_{(s)} + N_{2(g)} \rightarrow Mg_3N_{ 2(s)}\]
В горении металлов нет простых закономерностей. Хотя было бы заманчиво сказать, что реакции становятся более энергичными по мере того, как вы спускаетесь по группе, но это неправда. Общее количество тепла, выделяемое при образовании одного моля оксида из металла и кислорода, также не имеет простой закономерности:
Во всяком случае, есть небольшая тенденция к уменьшению количества выделяемого тепла по мере продвижения вниз по Группе. Но то, насколько реактивным кажется металл, зависит от того, насколько быстро происходит реакция (т.е. кинетика), а не от общего количества выделяемого тепла (т.е. термодинамика). Скорость контролируется такими факторами, как наличие поверхностных покрытий на металле и величина энергии активации.
Но то, насколько реактивным кажется металл, зависит от того, насколько быстро происходит реакция (т.е. кинетика), а не от общего количества выделяемого тепла (т.е. термодинамика). Скорость контролируется такими факторами, как наличие поверхностных покрытий на металле и величина энергии активации.
Вы можете возразить, что энергия активации будет падать по мере того, как вы спускаетесь по Группе, и это ускорит реакцию. Энергия активации упадет, потому что упадут энергии ионизации металлов. Однако в этом случае эффект падения энергии активации маскируется другими факторами — например, наличием существующих оксидных слоев на металлах и невозможностью точно контролировать, сколько тепла вы подводите к металлу в чтобы заставить его начать гореть.
Почему некоторые металлы при нагревании в кислороде образуют пероксиды?
Бериллий, магний и кальций не образуют перекиси при нагревании в кислороде, в отличие от стронция и бария. Существует тенденция к образованию перекиси по мере продвижения вниз по Группе. Ион пероксида O 2 2- выглядит следующим образом:
Ион пероксида O 2 2- выглядит следующим образом:
Ковалентная связь между двумя атомами кислорода относительно слаба. Теперь представьте, что небольшой ион 2+ приближается к пероксидному иону. Электроны пероксидного иона будут сильно притягиваться к положительному иону. Тогда это на пути к образованию простого оксидного иона, если правый атом кислорода (как показано ниже) разрывается.
Мы говорим, что положительный ион поляризует отрицательный ион. Лучше всего это работает, если положительный ион мал и сильно заряжен — если он имеет высокую плотность заряда.
Высокая плотность заряда просто означает, что большое количество заряда упаковано в небольшой объем.
Ионы металлов в верхней части группы имеют такую высокую плотность заряда (потому что они такие маленькие), что любой пероксидный ион рядом с ними распадается на части, образуя оксид и кислород. По мере того, как вы спускаетесь по Группе и положительных ионов становится больше, они не так сильно влияют на пероксидный ион.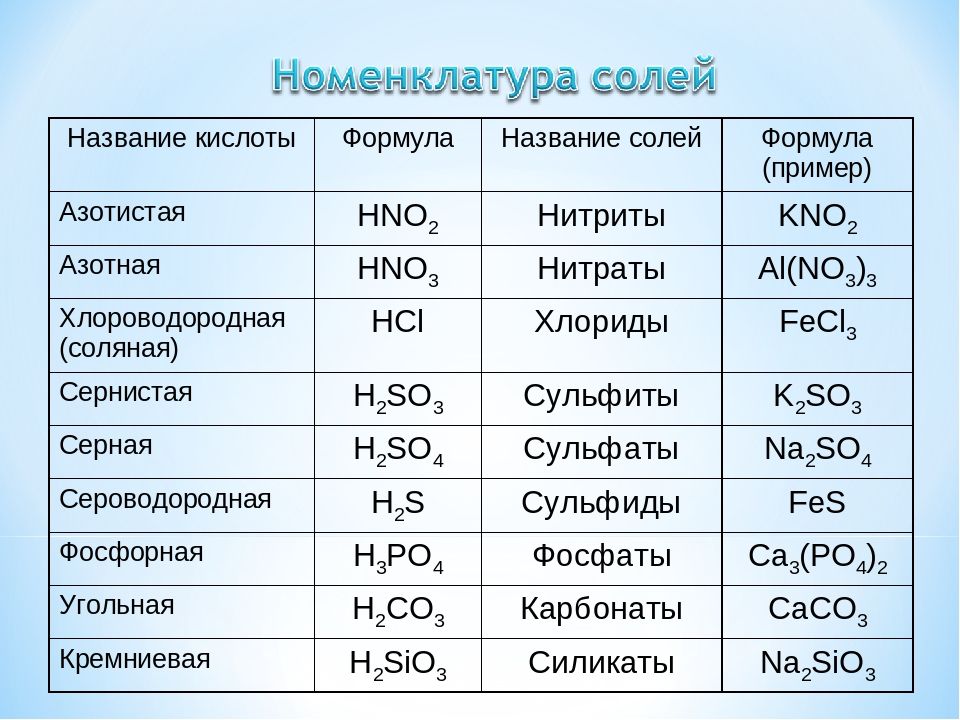 Например, пероксид бария может образовываться, потому что ион бария настолько велик, что он не оказывает такого разрушительного воздействия на ионы пероксида, как металлы, расположенные дальше по группе.
Например, пероксид бария может образовываться, потому что ион бария настолько велик, что он не оказывает такого разрушительного воздействия на ионы пероксида, как металлы, расположенные дальше по группе.
Почему эти металлы образуют нитриды при нагревании на воздухе?
Азот часто считают довольно нереакционноспособным, однако все эти металлы соединяются с ним с образованием нитридов, X 3 N 2 , содержащих X 2 + и N 3 — 9 ионов. . Азот довольно неактивен из-за очень большого количества энергии, необходимой для разрыва тройной связи, соединяющей два атома в молекуле азота, N 2 . Когда образуется что-то вроде нитрида магния, вы должны предоставить всю энергию, необходимую для образования ионов магния, а также для разрыва связей азот-азот и последующего образования N 9.0100 3 — ионы. Все эти процессы поглощают энергию. Эта энергия должна откуда-то восстанавливаться, чтобы дать общую экзотермическую реакцию — если энергия не может быть восстановлена, общее изменение будет эндотермическим и не произойдет.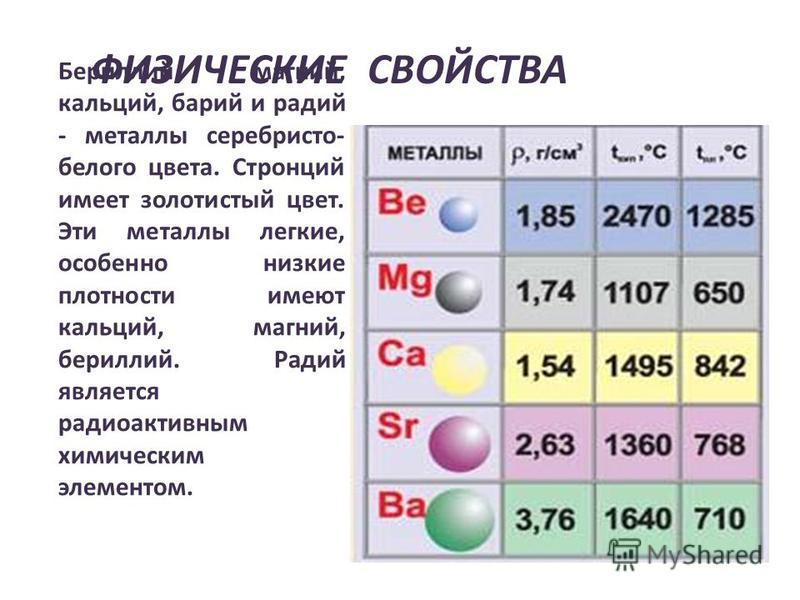
Энергия выделяется, когда ионы объединяются, образуя кристаллическую решетку (энергия решетки или энтальпия). Величина энергии решетки зависит от притяжения между ионами. Энергия решетки максимальна, если ионы маленькие и сильно заряженные — ионы будут сближаться с очень сильным притяжением. Во всей группе 2 притяжение между ионами металла 2+ и ионами нитрида 3 достаточно велико, чтобы создавать очень высокие энергии решетки. Когда формируются кристаллические решетки, высвобождается столько энергии, что она более чем компенсирует энергию, необходимую для производства различных ионов. Выделившаяся избыточная энергия делает весь процесс экзотермическим.
Это отличается от того, что происходит в группе 1 периодической таблицы (литий, натрий, калий, рубидий и цезий). Их ионы несут только один положительный заряд, поэтому энергия решетки их нитридов будет намного меньше.
Литий — единственный металл группы 1, образующий нитрид. Литий имеет самый маленький ион в группе, поэтому нитрид лития имеет самую большую энергию решетки из всех возможных нитридов группы 1. Только в случае лития высвобождается достаточно энергии, чтобы компенсировать энергию, необходимую для ионизации металла и азота, и, таким образом, вызвать экзотермическую реакцию в целом. Во всех других элементах группы 1 общая реакция будет эндотермической. Этих реакций не происходит, и нитриды натрия, и остальные не образуются.
Только в случае лития высвобождается достаточно энергии, чтобы компенсировать энергию, необходимую для ионизации металла и азота, и, таким образом, вызвать экзотермическую реакцию в целом. Во всех других элементах группы 1 общая реакция будет эндотермической. Этих реакций не происходит, и нитриды натрия, и остальные не образуются.
Авторы и авторство
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Воздух
- барий
- Бериллий
- кальций
- Магний
- оксиды металлов
- Нитриды
- Кислород
- пероксиды
- поляризует
- простые оксиды
- стронций


 Это объясняет, почему трудно наблюдать множество аккуратных закономерностей.
Это объясняет, почему трудно наблюдать множество аккуратных закономерностей. Это невозможно!
Это невозможно!
 Все остальное, что я смог найти в коротком клипе с YouTube, касалось испытания пламенем соединения бария, независимо от того, как это было описано в видео.
Все остальное, что я смог найти в коротком клипе с YouTube, касалось испытания пламенем соединения бария, независимо от того, как это было описано в видео.
 Скорость контролируется такими факторами, как наличие поверхностных покрытий на металле и величина энергии активации.
Скорость контролируется такими факторами, как наличие поверхностных покрытий на металле и величина энергии активации. Калий плавится при низкой температуре и почти мгновенно превращается в лужицу расплавленного оксида калия. Энергия активации настолько мала, что реакция протекает очень быстро при довольно низкой температуре. Часто от пламени не остается и следа. Это может быть довольно скучно!
Калий плавится при низкой температуре и почти мгновенно превращается в лужицу расплавленного оксида калия. Энергия активации настолько мала, что реакция протекает очень быстро при довольно низкой температуре. Часто от пламени не остается и следа. Это может быть довольно скучно! Существует тенденция к образованию перекиси по мере продвижения вниз по Группе.
Существует тенденция к образованию перекиси по мере продвижения вниз по Группе. По мере того, как вы спускаетесь по Группе и положительных ионов становится больше, они не так сильно влияют на пероксидный ион.
По мере того, как вы спускаетесь по Группе и положительных ионов становится больше, они не так сильно влияют на пероксидный ион. Все эти процессы поглощают энергию.
Все эти процессы поглощают энергию. Во всей группе 2 притяжение между ионами металла 2+ и ионами нитрида 3 достаточно велико, чтобы создавать очень высокие энергии решетки.
Во всей группе 2 притяжение между ионами металла 2+ и ионами нитрида 3 достаточно велико, чтобы создавать очень высокие энергии решетки.