Соли угольной кислоты. 9-й класс
Цели урока: изучить свойства солей угольной кислоты карбонатов и гидрокарбонатов.
Задачи урока:
– отработать навыки в решении расчетных и экспериментальных задачах;
– повторить свойства и строение угольной кислоты, гидролиз солей и реакции обмена;
– воспитывать коммуникативную культуру, уверенность в себе и своих знаниях, навыки контроля и самоконтроля.
Тип урока: изучение новой темы
Методические приемы: рассказ, демонстрации опытов.
Оборудование: раствор Na2CO3; раствор HCl, h3SO4, Ca(OH)2, Na2CO3 твердая, индикатор – фенолфталеин, штатив, газоотводная трубка; карточки – задания
Ход урока
I.
 Оргмомент.
Оргмомент.
II. Проверка домашнего задания.
Сегодня на уроке мы должны изучить соли угольной кислоты. Но прежде чем отправимся в увлекательный мир карбонатов, нам надо повторить свойства и строение h3CO3.
(2 человека у доски, 3 человека на рабочем месте)
У доски
1. Дать характеристику угольной кислоте: сила, основность, содержание кислорода. Составить уравнение диссоциации.
2. Химические свойства угольной кислоты.
На месте.
- Дать характеристику аллотропным модификациям углерода.
- Дать сравнительную характеристику физических и химических свойств оксида углерода (VI) и оксида углерода (II): строение молекул, физические и химические свойства.
- Допишите определения:
б) процесс выделения поглощенных веществ называется …
Пока ребята готовят ответы на вопрос, мы проведем небольшую письменную работу (10 вопросов)
- Разновидности простого вещества, образованного одним и тем же химическим элементом? (Аллотропные видоизменения)
- Электронная формула атома углерода.
 (1s22s22p2)
(1s22s22p2) - Количество электронов на внешнем уровне у элементов IV группы главной подгруппы (четыре)
- Летучие водородные соединения С и Si? (СН4 – метан, SiН4 – силан)
- Формула высших оксидов элементов IV группы главной подгруппы? (RО2)
- Масса 0,5 моль СО2 ? (22г)
- Объем 2 моль СН4 при н.у.? (44,8 л)
- Чего больше по массе в угарном газе углерода или кислорода? (кислорода С:О=3:4)
- Степень окисления углерода в угарном газе и углекислом газе? (+2;+ 4)
- Что такое сухой лед?
Проверка (правильные ответы на доске)
Ребята проверяют исправляют ошибки, выставляют себе оценки.
Проверка ответов у доски: рассмотрим свойства h3CO3.
III. Объяснение нового материала.

h3CO3 диссоциирует в две стадии. Сколько типов солей образует данная соль?
(По ходу опроса записывают схему на доске)
h3CO3
В повседневной жизни мы часто сталкиваемся с солями угольной кислоты (питьевая сода, известняк, мрамор, мел и т.п.)
Списывают с доски в тетрадь тривиальные названия солей.
Стихотворение о карбонатах. (Пока учащиеся пишут)
На земле живут три брата
Из семейства карбонатов.
Старший брат красавец – мрамор.
Славен именем каррары
Превосходный зодчий он
Строил Рим и Парфенон.
Всем известен известняк
Потому и назван так.
Знаменит своим трудом
Возводя за домом дом.
И способен и умел младший
Мягкий братец мел.
Как рисует посмотри
Этот …СаСО3.
CaCO3 – мел, известняк, мрамор
NaHCO3 – питьевая сода
Na2CO3 – кальцинированная сода
Na2CO3·10h3O – кристаллическая сода
CaCO3 – жемчуг (минерал арагонит)
Получение солей: назовите лабораторный способ получения солей.
(кислота + основание–> соль + вода – реакция нейтрализации)
Для получения солей угольной кислоты используют –>C02
2NaOH+CO2–>Na2CO3+h3O, если избыток CО2 получаются кислые соли
Na2CO3+CO2+h3O–>2NaHCO3
Химические свойства.
- Отношение к нагреванию.
- Реагирует солями (тип реакций?)
- С кислотами
- Гидролизу подвергаются соли угольной кислоты образуя в результате кислые соли в щелочной среде.
CaCO3–> CaO + CO2
CaHCO3–>CaCO3+CO2+h3O
(Это свойство позволяет использовать гидрокарбонаты в пищевой промышленности в качестве разрыхлителя теста)
В результате реакций выделяется CO2, как его обнаружить?– лучина тухнет.
— через раствор известковой воды (Ca (OH)2) образуется осадок белого цвета.
Ca(OH)2+CO2–>CaCO3+h3O,
но если дальше пропускать CO2 осадок растворяется
CaCO3+CO2+h3O–>Ca(HCO3)2
Na2CO3+CaSO4–>K2SO4+CaCO3
(На доске расписывает ученик полное и сокращенное ионное уравнение)
Na2CO3+2HCl–>2NaCl+CO2+h3O
Наблюдение “вскипание”.
Реакция взаимодействия солей h3CO3 с кислотами – качественная.
Геологи используют это свойство для определения карбонатных минералов.
Опыт. |
Na2CO3+HCl Na2CO3(р-р)+HCl CaCO3(мел)+HCl |
вскипание |
Самостоятельно составьте уравнения
химических реакций.
Испытать раствор Na2CO3 индикатором фенолфталеином (раствор малинового цвета)
Вывод: соли угольной кислоты имеют общие свойства солей и специфические: 1) взаимодействие с кислотами; 2) гидролиз.
IV. Решение задачи
Какой объем СО2 выделится (при н.у.) при обжиге 230 кг известняка, содержащего 10 % примесей.
V. Подведение итогов урока
(выставление оценок).
VI. Домашнее задание
§ 33, № 21-22 (с. 91-92)
устно, задача 3 (с.92).
Карбонатные соли | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Реактивная группа Лист данных
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом.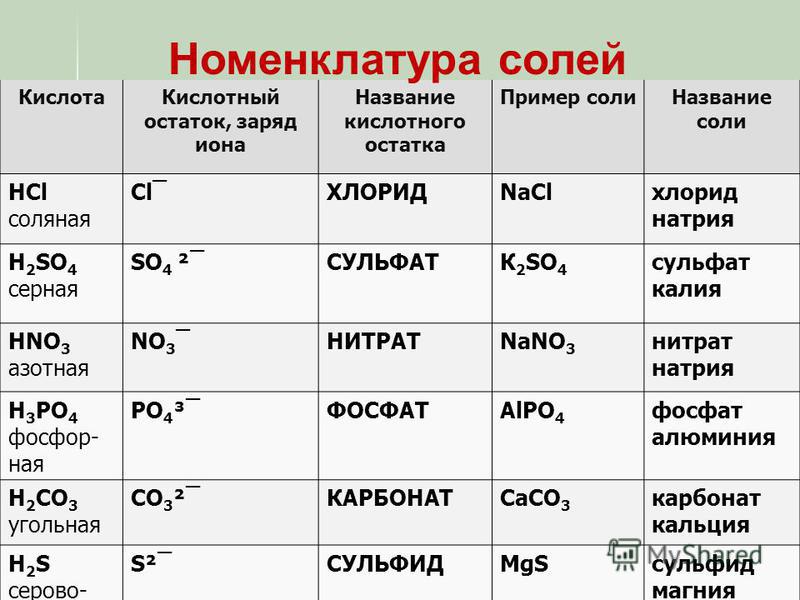 способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 13 химических паспортов относятся к этой реактивной группе.
Описание
Воспламеняемость
Карбонатные соли являются негорючими материалами.
Реакционная способность
Карбонатные соли действуют как слабые основания и поэтому участвуют в кислотно-щелочных реакциях с выделением тепла и выделением углекислого газа. Производство CO2 может вызвать повышение давления в сосудах, содержащих карбонаты.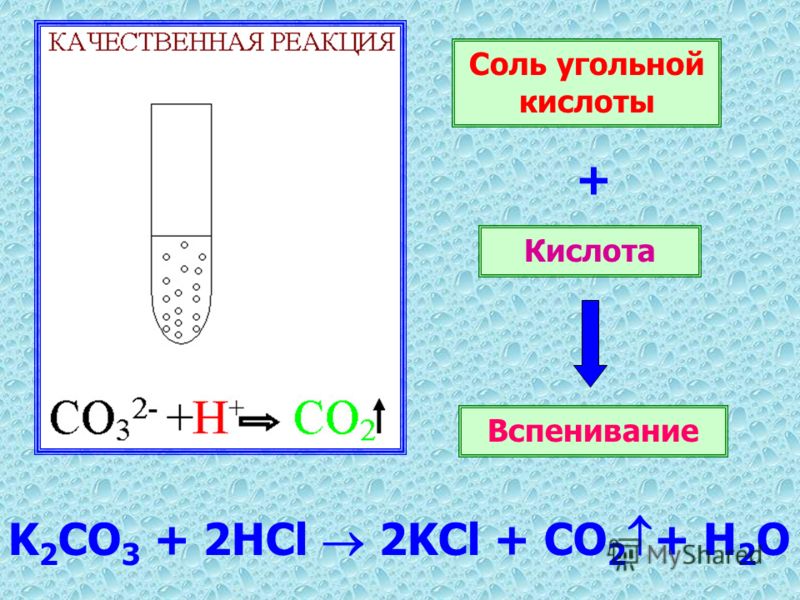
Токсичность
Обычно нетоксичен. Бикарбонат натрия используется в качестве противокислотного препарата.
Прочие характеристики
Карбонаты получают в результате реакции между угольной кислотой (водной двуокисью углерода) и основанием (или щелочью). Они имеют формулу Mx(CO3)y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями и окрашивают лакмусовую бумажку в синий цвет. Карбонаты широко используются в производстве стекла, целлюлозы и бумаги, химикатов для очистки воды, текстильного производства, чистящих составов, пищевых добавок и т. д.
Примеры
Бикарбонат аммония, карбонат бария, карбонат кальция, магнезит, перкарбонаты натрия, карбонат натрия, бикарбонат натрия.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым реактивных групп в базе данных.
Прогнозируемые опасности и побочные продукты газа для каждой пары реактивных групп будут
отображаться, а также документация и ссылки, которые использовались для
делать прогнозы реактивности.
Смешать Карбонатные соли с:
- Ацетали, кетали, полуацетали и полукетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окислители
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины, не содержащие ацетиленового водорода
- Амиды и имиды
- Амины ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо-, диазо-, азидо-, гидразиновые и азидные соединения
- Базы, Сильные
- Базы, слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Цианиды неорганические
- Соли диазония
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Соли фтора, растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды, алифатические ненасыщенные
- Углеводороды, ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементальные и порошковые, активные
- Металлы менее химически активные
- Соединения нитратов и нитритов, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Неокислительно-восстановительные неорганические соединения
- Не химически активный
- Металлоорганические соединения
- Окислители, сильные
- Окислители, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные аммониевые и фосфониевые соли
- Восстанавливающие агенты, сильные
- Восстанавливающие агенты, слабые
- Соли кислотные
- Соли основные
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Сложные эфиры и соли тиокарбамата/ Сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
Оксикислоты | химическое соединение | Британика
оксикислота
См. все средства массовой информации
все средства массовой информации
- Связанные темы:
- сульфоновая кислота серная кислота фосфорная кислота азотная кислота пероксикислота
См. все сопутствующие материалы →
оксикислота , любая кислородсодержащая кислота. Большинство ковалентных оксидов неметаллов реагируют с водой с образованием кислых оксидов; то есть они реагируют с водой с образованием оксикислот, которые дают ионы гидроксония (H 3 O + ) в растворе. Есть некоторые исключения, такие как окись углерода, CO, закись азота, N 2 O и окись азота, NO.
Сила оксикислоты определяется степенью ее диссоциации в воде (т. е. ее способностью образовывать ионы H + ). В общем, относительную силу оксикислот можно предсказать на основе электроотрицательности и степени окисления центрального атома неметалла. Сила кислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, поскольку электроотрицательность хлора (Cl) выше, чем у серы (S), которая, в свою очередь, выше, чем у фосфора (P), можно предположить, что хлорная кислота HClO 4 , более сильная кислота, чем серная кислота, H 2 SO 4 , которая должна быть более сильной кислотой, чем фосфорная кислота, H 3 PO 4 . Для данного центрального атома неметалла сила кислоты увеличивается по мере увеличения степени окисления центрального атома. Например, азотная кислота HNO 3 , в которой атом азота (N) имеет степень окисления +5, является более сильной кислотой, чем азотистая кислота HNO 2 , в которой степень окисления азота равна +3. Таким же образом серная кислота H 2 SO 4 , с серой в степени окисления +6, является более сильной кислотой, чем сернистая кислота, H 2 SO 3 , где существует степень окисления серы +4.
Для данного центрального атома неметалла сила кислоты увеличивается по мере увеличения степени окисления центрального атома. Например, азотная кислота HNO 3 , в которой атом азота (N) имеет степень окисления +5, является более сильной кислотой, чем азотистая кислота HNO 2 , в которой степень окисления азота равна +3. Таким же образом серная кислота H 2 SO 4 , с серой в степени окисления +6, является более сильной кислотой, чем сернистая кислота, H 2 SO 3 , где существует степень окисления серы +4.
Соль оксикислоты представляет собой соединение, образующееся при взаимодействии кислоты с основанием: кислота + основание → соль + вода. Этот тип реакции называется нейтрализацией, потому что раствор становится нейтральным.
Оксикислоты азота
Азотная кислота, HNO 3 , была известна алхимикам 8-го века как «aqua fortis» (сильная вода). Он образуется в результате реакции как пятиокиси азота (N 2 O 5 ) и диоксид азота (NO 2 ) с водой. Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов). Нитрат калия, KNO 3 , иногда называемая бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), NaNO 3 и NaHSO 4 – нелетучие соли, азотная кислота легко удаляется перегонкой.
Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов). Нитрат калия, KNO 3 , иногда называемая бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), NaNO 3 и NaHSO 4 – нелетучие соли, азотная кислота легко удаляется перегонкой.
Викторина «Британника»
Наука: правда или вымысел?
В промышленных масштабах азотная кислота производится по процессу Оствальда. Этот процесс включает окисление аммиака NH 3 до оксида азота NO, дальнейшее окисление NO до диоксида азота NO 2 и последующее превращение NO 2 в азотную кислоту (HNO 3 ). . Это поточный процесс, при котором смесь аммиака и избыточного воздуха нагревается до 600–700 °C (от 1100 до 1300 °F) и проходит через платино-родиевый катализатор. (Катализатор увеличивает скорость реакции, не расходуясь при этом сам.) Когда происходит окисление до NO, эта газообразная смесь буквально горит пламенем. Добавляется дополнительный воздух для окисления NO до NO 9.0201 2 . NO 2 , избыток кислорода и нереакционноспособный азот из воздуха пропускают через распыляемую воду, где образуются HNO 3 и NO по мере диспропорционирования NO 2 . Газообразный NO рециркулируется в процессе с большим количеством воздуха, а жидкая HNO 3 отбирается и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
Газообразный NO рециркулируется в процессе с большим количеством воздуха, а жидкая HNO 3 отбирается и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
В чистом виде азотная кислота представляет собой бесцветную жидкость, которая кипит при 86 ° C (187 ° F) и замерзает при -42 ° C (-44 ° F). Под воздействием света или тепла он разлагается с образованием кислорода, воды и смеси оксидов азота (в основном NO 2 ).
4HNO 3 + свет (или тепло) → 4ΝΟ 2 + 2H 2 O + O 2 Следовательно, азотная кислота часто имеет желтый или коричневый цвет из-за NO 2 , который образуется при ее разложении. Азотная кислота устойчива в водном растворе, а 68-процентные растворы кислоты (т. е. 68 г HNO 3 на 100 г раствора) продаются в виде концентрированной HNO 3 . Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.
Кроме того, многие соединения окисляются HNO 3 . Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («королевская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.
Кроме того, многие соединения окисляются HNO 3 . Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («королевская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Действие азотной кислоты на металл обычно приводит к восстановлению кислоты (т. е. к уменьшению степени окисления азота). Продукты реакции определяются концентрацией HNO 3 , вовлеченным металлом (т.е. его реакционной способностью) и температурой. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно нереакционноспособные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), уменьшают концентрацию HNO 3 прежде всего на NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O. При очень разбавленной HNO 3 , может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
е. к уменьшению степени окисления азота). Продукты реакции определяются концентрацией HNO 3 , вовлеченным металлом (т.е. его реакционной способностью) и температурой. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно нереакционноспособные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), уменьшают концентрацию HNO 3 прежде всего на NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O. При очень разбавленной HNO 3 , может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
Нитраты, представляющие собой соли азотной кислоты, образуются при взаимодействии металлов или их оксидов, гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде, и азотная кислота в основном используется для получения растворимых нитратов металлов. Все нитраты разлагаются при нагревании и могут происходить со взрывом. Например, при нагревании нитрата калия (KNO 3 ) образуется нитрит (соединение, содержащее NO 2 — ) и выделяется газообразный кислород.
2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .
Нитрат аммония (NH 4 ) 2 NO 3 производит закись азота N 2 O и особенно опасен для нагревания или детонации.
Большинство нитратов растворимы в воде, и азотная кислота в основном используется для получения растворимых нитратов металлов. Все нитраты разлагаются при нагревании и могут происходить со взрывом. Например, при нагревании нитрата калия (KNO 3 ) образуется нитрит (соединение, содержащее NO 2 — ) и выделяется газообразный кислород.
2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .
Нитрат аммония (NH 4 ) 2 NO 3 производит закись азота N 2 O и особенно опасен для нагревания или детонации.
Азотная кислота широко используется в лаборатории и в химической промышленности как сильная кислота и как окислитель. Кислота широко используется в производстве взрывчатых веществ, красителей, пластмасс и лекарств.
