Урок «Соли.Решение тренировочных упражнений»
| 12+ Свидетельство СМИ ЭЛ № ФС 77 — 70917 Лицензия на образовательную деятельность №0001058 | Пользовательское соглашение Контактная и правовая информация |
Педагогическое сообщество | Бесплатные всероссийские конкурсы | Бесплатные сертификаты | Нужна помощь? Инструкции для новых участников | Бесплатная онлайн-школа для 1-4 классов |
Всё для аттестацииПубликация в сборникеВебинарыЛэпбукиПрофтестыЗаказ рецензийНовости
Библиотека▪Публикации▪Статьи
Материал опубликовала
#11 класс #Химия #ФГОС #Методические разработки #Урок #Учитель-предметник #Школьное образование #УМК Г. Е. Рудзитиса, Ф. Г. Фельдмана
Е. Рудзитиса, Ф. Г. Фельдмана
Соли. Решение тренировочных упражнений. 11 класс.
План работы. Мини-модуль 1. Работа у доски Проблемный вопрос Беседа Тест Подумать Удиви меня
Данные о классе вещества СОСТАВ МЕТАЛЛ+ КИСЛОТНЫЙ ОСТАТОК Свойства Применение
Установить соответствие Формула соли А . NaHCO 3 Б . (CuOH)2 CO3 В . CuSO 4 * 5 h3 O Г . NaCl Д .KCl* NaCl Класс соли 1 . Комплексная (кристаллогидрат) Кислая Средняя Основная Двойная
Классификация солей Средняя NaCl галит Кислая NaHCO3 гидрокарбонат натрия Основная (CuOH)2CO3 малахит Комплексная CuSO4*5h3O Медный купорос Двойная KCl*NaCl сильвинит
Подумать и дать ответ Определить класс солей и дать им названия : K H SO4 ПОДСКАЗКА AlCl3 нитрат Cu (NO3)2 хлорид карбонат Al(OH)2Cl гидросульфат Nah3PO4 дигидроксохлорид СаСО3 дигидрофосфат
План работы. Мини-модуль2
Просмотр презентации
Химическая лаборатория
Решение задач
Мини-модуль2
Просмотр презентации
Химическая лаборатория
Решение задач
Гидрокарбонат натрия питьевая сода
Профессии ПОВАР КОСМЕТОЛОГ ГАСТРОЭНТЕРОЛОГ ДОМОХОЗЯЙКА СТОМАТОЛОГ
МЕДНЫЙ КУПОРОС Профессии АГРОНОМ СЕЛЕКЦИОНЕР СТРОИТЕЛЬ НАРОДНАЯ МЕДИЦИНА
Поваренная соль, питьевая соль, галит Повар кулинар консервация приправа Металлурги химики Обработка мехов Варка мыла, получение кальцинированной соды медицина Физиологический раствор Йодированная пищевая соль
Основной карбонат меди, гидрокарбонат меди, малахит Бажов «Малахитовая шкатулка» Метрополитены Малахитовая комната Драгоценности
Сильвинит медицина Соляные комнаты
Химические свойства солей, получение СОЛЬ Соль + металл соль + щёлочь Соль + кислота Соль + соль
План работы. Мини-модуль 3
Видеоролик
Лабораторный опыт
На приёме у врача
Физпауза
Химический диктант
Высказывание мнения
Мини-модуль 3
Видеоролик
Лабораторный опыт
На приёме у врача
Физпауза
Химический диктант
Высказывание мнения
Гидролиз солей
Гидролиз солей Гидролиз-процесс взаимодействия соли с водой, приводящий к образованию малодиссоциирующего вещества. Среда раствора определяется наличием в ней катиона металла или аниона кислотного остатка сильного основания или сильной кислоты. NaCl — сильное основание +сильная кислота-гидролиз не идёт NaHCO3- сильное основание +слабая кислота-гидролиз идёт CuSO4- слабое основание + сильная кислота-гидролиз идёт
Нахождение солей в организме человека
Физпауза
Химический диктант
1.В состав солей входят атомы….
2.Кислая соль должна содержать в составе кислотного остатка атомы….
3.Основная соль содержит в составе кислотного остатка атомы…
4.Лакмус в кислой среде…. цвета
5.Среда раствора соли определяется наличием ионов, характеризующих …. (слабое или сильное) вещество .
6.Соли реагируют с …. с образованием новой соли и металла .
7. Карбонат кальция имеет несколько названий. Мрамор, известняк,…..
8.Соли реагируют с ….. с образованием новой соли и новой кислоты .
9.Название соединения, формула которого CaSO4*2 h3O .
10. Соли каких катионов могут иметь запах?
(слабое или сильное) вещество .
6.Соли реагируют с …. с образованием новой соли и металла .
7. Карбонат кальция имеет несколько названий. Мрамор, известняк,…..
8.Соли реагируют с ….. с образованием новой соли и новой кислоты .
9.Название соединения, формула которого CaSO4*2 h3O .
10. Соли каких катионов могут иметь запах?
Упоминание соли в устном народном творчестве «Без соли -нет застолья» «Без хлеба, без соли — худая беседа» «За хлебом-солью всякая шутка хороша» «Чтобы узнать человека -нужно с ним пуд соли съесть»
Продолжи фразу… Мне пригодятся…. Я узнал…. В жизни я могу применить…. Я повысил свой интеллектуальный запас…. Я не понял…. Я оцениваю свою работу на уроке….. Применю ли я материал данного урока на последующих занятиях…
Соли: химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.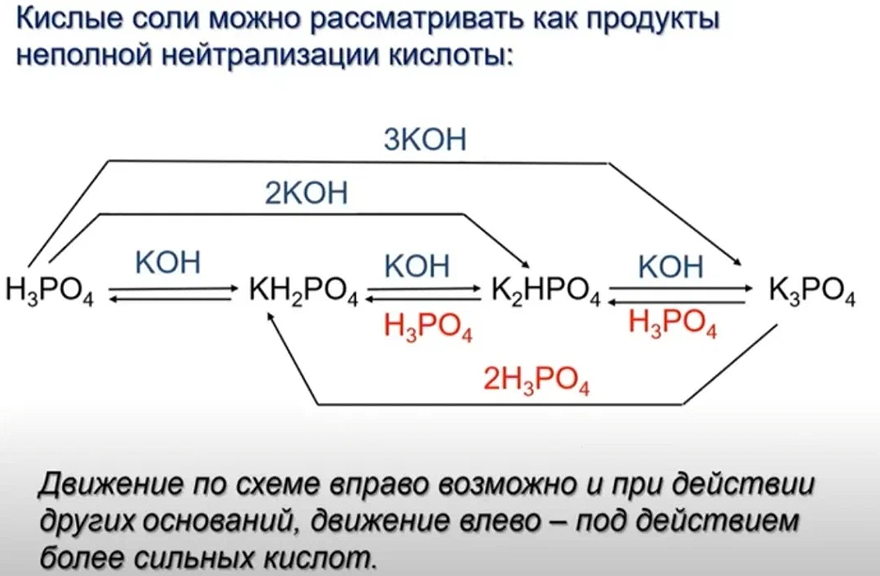
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например, оксид серы (VI)
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например, гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например, гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K 2HPO4 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.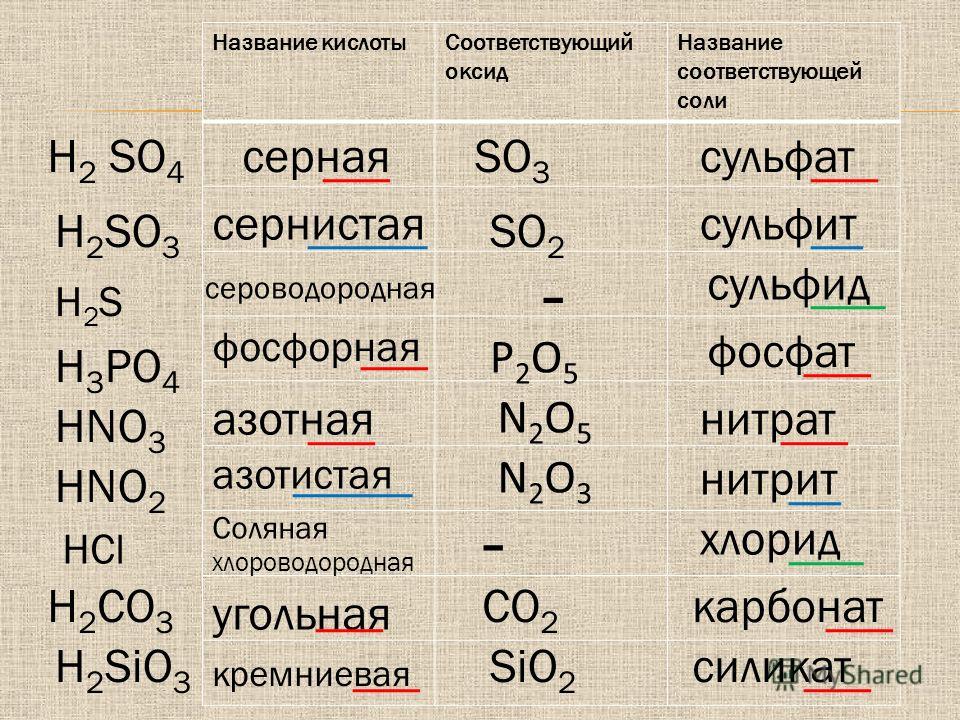
Нерастворимое основание + растворимая кислота = соль + вода
Например, гидроксид меди (II) реагирует с серной кислотой:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например, гидроксид цинка (II) реагирует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например, аммиак реагирует с соляной кислотой:
NH3 + HCl → NH4Cl
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например, соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например, гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
2NaOH + CO2 → Na2CO3 + H2O
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например, при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например, гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
Cu(OH)2 + CO2 ≠
Cu(OH)2 + SO3 → CuSO4 + H2O
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например, кислород окисляет сульфит натрия до сульфата натрия:
2Na2SO3 + O2 → 2Na2SO4
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
Таким способом можно получить только соли бескислородных кислот.
Например, сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например, железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например, хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например, хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca2+ + 2Cl–
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например, гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na+ + HCO3–
HCO3– → H+ + CO32–
Основные соли также диссоциируют ступенчато.
Например, гидроксокарбонат меди (II) диссоциирует в две ступени:
(CuOH)2CO3 → 2CuOH+ + CO32–
CuOH+ → Cu2+ + OH–
Двойные соли диссоциируют в одну ступень.
Например, сульфат алюминия-калия диссоциирует в одну ступень:
KAl(SO4)2 → K+ + Al3+ + 2SO42–
Смешанные соли диссоциируют также одноступенчато.
Например, хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca2+ + Cl— + ClO–
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например, тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
K[Al(OH)4] → K+ + [Al(OH)4]–
2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например, карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
K2CO3 + SiO2 → K2SiO3 + CO2↑
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
K2CO3 + Al2O3 → 2KAlO2 + CO2↑
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например, сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Хлорид аммония взаимодействует с гидроксидом натрия:
(NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например, гидрокарбонат калия взаимодействует с гидроксидом калия:
KHCO3 + KOH → K2CO3 + H2O
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например, сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например, гидрокарбонат калия взаимодействует с гидросульфатом калия:
KHSO4 + KHCO3 = H2O + CO2↑ + K2SO4
Некоторые кислые соли могут реагировать со своими средними солями.
Например, фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
K3PO4 + KH2PO4 = 2K2HPO4
6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например, железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Соль1 + металл1 = соль2 + металл2
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например, при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например, нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
Cu(NO3)2, (расплав) + Fe ≠
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
youtube.com/embed/CT2ApCIuvrI» frameborder=»0″ allowfullscreen=»allowfullscreen»>
7. Некоторые соли при нагревании разлагаются.
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2→ N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Все нитраты:
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3+ HCl
(NH4)2CO3 → 2NH3+ CO2 + H2O
(NH4)2SO4→ NH4HSO4+ NH3
7. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например, йодид калия окисляется хлоридом меди (II):
4KI— + 2Cu+2 Cl2 → 4KCl + 2Cu+l + I20
8. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Понравилось это:
Нравится Загрузка…
Соли в химии: свойства и способы получения (реакции, классификация и определение)
Автор Jeremiah На чтение 18 мин Просмотров 667 Опубликовано
Содержание
Что такое соли
В класс солей входит соединение, которое мы ежедневно употребляем с пищей, это соль
Вы знаете, что это сделано из ионов
Соль – это соединение, состоящее из катионов металлического элемента и анионов кислотного остатка.
Остаточный кислотный ион имеет отрицательный заряд; его значение соответствует значению валентности этого остатка:
- кислота
- кислотный остаток
- анион кислотного остатка
Солевые формулы
Для солей, как и для кислот, существуют две общие формулы — д
Первая формула соответствует солям, содержащим анионы из кислотных остатков бескислородных кислот, а вторая – солям, анионы которых происходят из кислородсодержащих кислот.
Cостав солей
Сравним формулы кислот HCl и h3SO4 с формулами солей ZnCl2 и FeSO4. Мы видим, что эти формулы содержат одни и те же кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они связаны с атомами водорода Н, а в формульных единицах солей с атомами цинка Zn и железа Fe. Это означает, что эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислоты металлом атомы. Такие вещества, как ZnCl2 и FeSO4, классифицируются как соли.
Это означает, что эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислоты металлом атомы. Такие вещества, как ZnCl2 и FeSO4, классифицируются как соли.
Соли представляют собой сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом используется то же правило, что и при составлении формул бинарных соединений. Для солей это правило таково: сумма валентных единиц всех атомов металла должна равняться сумме валентных единиц всех кислотных остатков.
Например, составим формулу соли, включающую атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций имеет постоянную валентность II, а валентность кислотного остатка PO4 — III.
Распространенность в природе
Земная кора содержит много солей (рис. 13). В основном, это силикаты. Среди них драгоценные камни: голубой топаз (силикат алюминия), золотой циркон (силикат циркония), бесцветный фенакит (силикат бериллия) и др.
13). В основном, это силикаты. Среди них драгоценные камни: голубой топаз (силикат алюминия), золотой циркон (силикат циркония), бесцветный фенакит (силикат бериллия) и др.
Много месторождений хлорида натрия NaCl (каменная соль), хлорида калия KC1, карбоната кальция CaCO3 (мел, мрамор, известняк). Последнее соединение составляет основу скорлупы, яичной скорлупы (рис. 14) сульфидов и другие минералы; из них получают металлы.
Различные соли находятся в растворенном состоянии в гидросфере. В морской воде преобладают хлориды натрия и магния, а в пресной — соли кальция и магния (главным образом карбонатные и сульфатные кислоты).
Рекомендации:
Соль представляет собой ионное соединение, состоящее из катионов металлического элемента и анионов кислотного остатка. Для солей существуют общие формулы
Каждая соль имеет химическое название, а некоторые соли также имеют тривиальные названия. Соли очень распространены в природе.
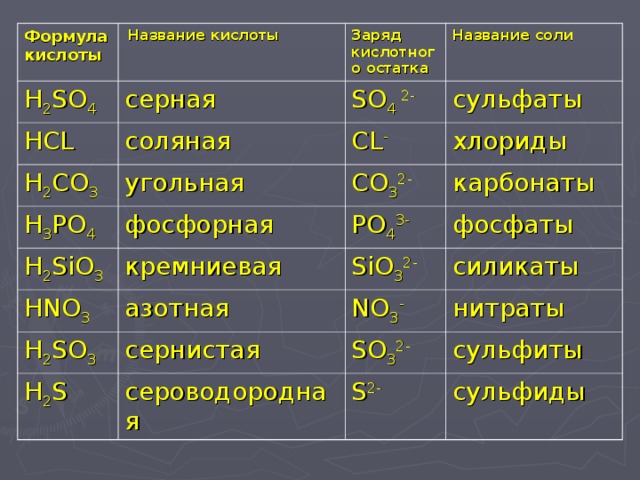
Классификация и номенклатура солей
Поскольку соли являются продуктом полного или частичного замещения атома водорода в кислоте металлом, их можно классифицировать по своему составу следующим образом.
Кислые соли
Они образуются при неполном замещении атомов водорода металлом в кислоте.
В названиях кислых солей количество водорода указывается приставками «гидро-» или «дигидро-», названием кислотного остатка и названием металла. Если металл имеет переменную валентность, то в скобках указывается валентность.
Примеры кислых солей и их названия:
- LiHCO3 — бикарбонат лития,
- NaHSO4 — гидросульфат натрия,
- Nah3PO4 – дигидрофосфат натрия.
Средние соли
Они образуются при полной замене атомов водорода кислоты металлом.
Названия промежуточных солей составлены из названий кислотного остатка и металла. При необходимости указать валентность.
Примеры средних солей с названиями:
- CuSO4 — сульфат меди (II),
- CaCl2 — это хлорид кальция.
Основные соли
Продукт неполного замещения гидроксигрупп кислотным остатком.
В названиях основных солей количество гидроксид-ионов указывается приставкой «гидрокси-» или «дигидроксо-», названием кислотного остатка и названием металла, которые указывают на валентность.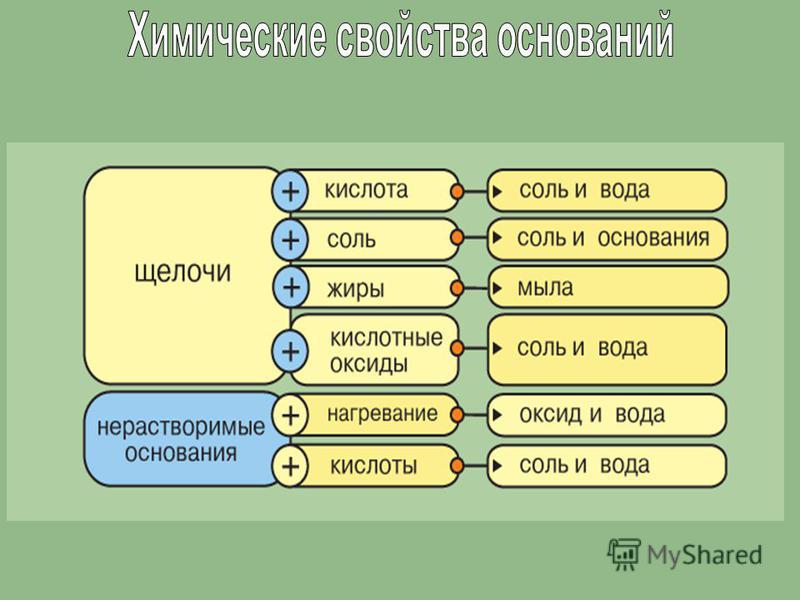
Пример: Mg(OH)Cl представляет собой гидрохлорид магния.
Двойные соли
В состав входят два разных металла и кислотный остаток.
Название состоит из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их названия:
- KNaSO4 — сульфат натрия-калия,
- KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
Они содержат металл и два разных кислотных остатка.
Названия смешанных солей составляются из названия кислотных остатков (по сложности) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с названиями:
- CaClOCl — хлорид кальция-гипольхорит,
- PbFCl — фторид-хлорид свинца(II).
Комплексные соли
Образован сложным катионом или анионом, связанным с несколькими лигандами.
Комплексные соли называют по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: KAl(OH)4 представляет собой тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Количество молекул воды указывается числовым префиксом к слову «гидрат» и добавляется название соли.
Пример: CuSO4 ∙ 5h3O – пентагидрат сульфата меди (II).
Физические свойства и строение солей
Как правило, соли представляют собой кристаллические вещества с ионной кристаллической решеткой. Например, кристаллы галогенидов щелочных и щелочноземельных металлов (NaCl, CsCl, 2CaF) построены из анионов, расположенных по принципу плотнейшей сферической упаковки, и катионов, занимающих пустоты в этой упаковке. Кристаллы ионных солей также могут быть построены из кислотных остатков, объединенных в бесконечные анионные фрагменты и трехмерные структуры с катионами в полостях (силикаты). Такая структура соответствующим образом отражается на их физических свойствах: они имеют высокие температуры плавления, в твердом состоянии являются диэлектриками.
Известны также соли (ковалентного) молекулярного строения (например, хлорид алюминия 3AlCl). Для многих солей характер химической связи является промежуточным между ионным и ковалентным.
Особый интерес представляют ионные жидкости: соли с температурой плавления ниже 100°С. Помимо аномальной температуры плавления, ионные жидкости имеют практически нулевое давление пара насыщения и высокую вязкость. Особые свойства этих солей объясняются низкой симметрией катиона, слабым взаимодействием между ионами и хорошим распределением заряда катиона.
Важным свойством солей является их растворимость в воде. По этому критерию различают растворимые, малорастворимые и нерастворимые соли.
Химические свойства солей
I. Средние соли
- Растворимые соли в водных растворах диссоциируют на ионы: катионы Ме и анионы Ас.Например, хлорид калия в водном растворе разлагается на катионы калия и хлорид-анионы.KCl ↔ K— + Cl—
- Соли могут взаимодействовать с металлами, при этом каждый Ме слева в ряду напряжений Ме способен вытеснять Ме справа из своих солей.
 Щелочные и щелочноземельные металлы не реагируют с солями, как с водой.Например, при взаимодействии сульфата меди с железом медь замещается железом, так как железо является более активным металлом, чем медь, и в электрохимическом ряду напряжений находится левее водорода.CuSO4 + Fe → FeSO4 + Cu↓
Щелочные и щелочноземельные металлы не реагируют с солями, как с водой.Например, при взаимодействии сульфата меди с железом медь замещается железом, так как железо является более активным металлом, чем медь, и в электрохимическом ряду напряжений находится левее водорода.CuSO4 + Fe → FeSO4 + Cu↓При взаимодействии сульфида железа с цинком происходит тот же процесс, но более активным металлом в этой реакции является цинк. Цинк вытесняет железо из соединения, в результате чего образуется чистое железо.
FeS + Zn → ZnS + Fe↓
- Возможна реакция растворов солей с растворами щелочей, когда образующееся основание или соль выпадают в осадок.Взаимодействие хлорида железа(III) с раствором гидроксида калия является качественной реакцией на ионы Fe3+. Продуктом реакции будет гидроксид железа (III), представляющий собой коричневый осадок с амфотерными свойствами.FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
- Когда соль реагирует с кислотой, для протекания реакции необходимо образование более слабой кислоты или нерастворимой соли.
 В следующей реакции происходит взаимодействие хлорида бария и серной кислоты. Продуктами реакции являются нерастворимая соль и сильная кислота. Эта реакция является качественной для сульфатов, так как образуется белый осадок сульфата бария.BaCl2 + h3SO4 → BaSO4↓ + 2HCl
В следующей реакции происходит взаимодействие хлорида бария и серной кислоты. Продуктами реакции являются нерастворимая соль и сильная кислота. Эта реакция является качественной для сульфатов, так как образуется белый осадок сульфата бария.BaCl2 + h3SO4 → BaSO4↓ + 2HCl - Соли взаимодействуют друг с другом. При этом одним из продуктов реакции должна быть нерастворимая соль.Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета — хлорида серебра. Эта реакция является качественной для ионов хлора.AgNO3 + KCl → AgCl↓ + KNO3
- При нагревании разлагаются соли слабых кислот, соли аммония и соли, образованные сильными окислителями или восстановителями.
II кислые соли
- Растворимые соли в водных растворах диссоциируют на ионы: катионы Ме и комплексный анион Ас. Диссоциация протекает в две стадии. Первая стадия всегда необратима, тогда как на второй стадии происходит обратимая диссоциация.KHSO4 → K— + HSO4—
HSO4— ↔ H+ + SO42—
- Растворимые соли в водных растворах диссоциируют на ионы: катионы Ме и комплексный анион Ас. Диссоциация протекает в две стадии. Первая стадия всегда необратима, тогда как на второй стадии происходит обратимая диссоциация.KHSO4 → K— + HSO4—
- Кислые соли могут взаимодействовать с металлами слева от водорода.
 Щелочные металлы не следует использовать в таких реакциях, так как они реагируют в основном с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, в таких условиях может произойти взрыв.В результате этой реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.2KHSO4 + Mg → h3↑ + MgSO4 + K2SO4
Щелочные металлы не следует использовать в таких реакциях, так как они реагируют в основном с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, в таких условиях может произойти взрыв.В результате этой реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.2KHSO4 + Mg → h3↑ + MgSO4 + K2SO4
- Кислые соли могут взаимодействовать с металлами слева от водорода.
- При взаимодействии кислой соли с щелочным раствором образуется средняя соль и вода. Бикарбонат натрия может реагировать с щелочным раствором, продуктами реакции будут сульфит натрия и вода.NaHCO3 + NaOH → Na2SO3 + h3O
- Когда соль реагирует с кислотой, для протекания реакции необходимо образование более слабой или более летучей кислоты. Этот процесс можно увидеть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции являются летучие кислоты – сероводород, а также сульфат калия.
 2KHS + h3SO4 → K2SO4 + 2h3S
2KHS + h3SO4 → K2SO4 + 2h3S
- Когда соль реагирует с кислотой, для протекания реакции необходимо образование более слабой или более летучей кислоты. Этот процесс можно увидеть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции являются летучие кислоты – сероводород, а также сульфат калия.
- Кислые соли характеризуются взаимодействием со средними солями. Однако при такой реакции должна образовываться вода, газ или осадок. В противном случае взаимодействия не произойдет. Это очень хорошо видно на примере взаимодействия гидросульфата калия и хлорида бария. Продуктами реакции будут сульфат бария, белый осадок, сульфат калия и соляная кислота.2KHSO4 + BaSO4↓ + K2SO4 + 2HCl
- При нагревании некоторые соли разрушаются. Ярким примером является разложение бикарбонатов. В результате реакции образуется вода, углекислый газ и карбонат натрия.Реакции разложения бикарбонатов кальция и магния являются причиной образования накипи в водонагревателях.
Третьи основные соли
- Способен разлагаться в водных растворах на комплексные катионы и анионы Ас. Диссоциация протекает в несколько стадий, причем на первой стадии распад протекает необратимо. Все последующие шаги обратимы.
 Al(OH)2Ch4COO → Al(OH)2+ + Ch4COO—
Al(OH)2Ch4COO → Al(OH)2+ + Ch4COO—
Al(OH)2+ ↔ AlOh3+ + OH—
Al(OH)2+ ↔ Al3+ + OH—
- Способен разлагаться в водных растворах на комплексные катионы и анионы Ас. Диссоциация протекает в несколько стадий, причем на первой стадии распад протекает необратимо. Все последующие шаги обратимы.
- Основные соли могут взаимодействовать с щелочными растворами с образованием нерастворимого основания и кислой соли. Гидроксонитрат железа (III) и раствор едкого калия при взаимодействии друг с другом образуют нитрат калия и гидроксид железа (II) — белый осадок.Fe(OH)NO3 + KOH → Fe(OH)2↓ + KNO3
- При взаимодействии основной соли с кислотой образуется средняя соль и вода. Взаимодействие гидрохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды.CuOHCl + HCl → CuCl2 + h3O
- Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди(II) образуются оксид меди(II), углекислый газ и вода.
IV комплексные соли
- Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, т е как сильные электролиты (первичная диссоциация).
 K4Fe(CN)6 → 4K+ + Fe(CN)64—Сложные ионы, в свою очередь, диссоциируют как слабые электролиты многоступенчато и обратимо. Это вторичная диссоциация сложных ионов.Fe(CN)63— ⟷ Fe(CN)52— + CN—
K4Fe(CN)6 → 4K+ + Fe(CN)64—Сложные ионы, в свою очередь, диссоциируют как слабые электролиты многоступенчато и обратимо. Это вторичная диссоциация сложных ионов.Fe(CN)63— ⟷ Fe(CN)52— + CN—
Fe(CN)52— ⟷ Fe(CN)4— + CN—
Fe(CN)4— ⟷ [Fe(CN)3] + CN—
[Fe(CN)3] ⟷ [Fe(CN)2]+ + CN—
[Fe(CN)2]+ ⟷ [Fe(CN)2]2+ + CN—
[Fe(CN)]2+ ⟷ Fe3+ + CN—Эту многостадийную диссоциацию можно резюмировать следующим уравнением:
Fe(CN)63— ⟷ Fe3+ + 6CN—
- Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, т е как сильные электролиты (первичная диссоциация).
- Комплексные соли способны вступать в реакции обмена со средними солями. В результате этой реакции образуются две другие соли: комплексная и средняя.FeCl3 + K4Fe(CN)6 = Fe4Fe(CN)6↓ + 3KClЭта реакция является качественной реакцией на ионы Fe3+. Нерастворимое соединение, образующееся в результате реакции, имеет ультрамариновый цвет и называется берлинской лазурью или гексацианоферратом железа (III)-калия (II.
- При нагревании комплексные соли разлагаются.Тетрагидроксоалюминат натрия разлагается на алюминат натрия и воду.
 NaAl(OH)4 → NaAlO2 + 2h3O
NaAl(OH)4 → NaAlO2 + 2h3O
- При нагревании комплексные соли разлагаются.Тетрагидроксоалюминат натрия разлагается на алюминат натрия и воду.
- При взаимодействии комплексной соли со средней солью происходит разрушение комплексов за счет образования малорастворимых соединений.2[Cu(Nh4)2]Cl + K2S → CuS↓ + 2KCl + 4Nh4↑
Взаимодействие с оксидами и кислотами
Соли реагируют путем сплавления с кислыми или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. Эта реакция не происходит с основными оксидами. Например, карбонат калия K2CO3 сплавляется с оксидом кремния(IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 также может взаимодействовать с оксидом алюминия с образованием алюмината калия KAlO2 и углекислого газа CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Реакция с кислотами может происходить только в том случае, если кислота и соль, образованная более слабой кислотой, реагируют. Показателем возможной совместной реакции солей с кислотами можно считать:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.

Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 реагирует с сильной серной кислотой: MgCO3 + h3SO4 → MgSO4 + 2h3O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, поскольку ожидается, что в результате реакции образуется нерастворимая кремниевая кислота: K2SiO3 + 2HCl → h3SiO3↓ + 2KC
Реакции с основаниями и другими солями
В основном со щелочами взаимодействуют только соли аммония и тяжелых металлов, если при этом они растворимы. В результате получается новое солевое вещество и новое основание. Например, сульфат меди(II) CuSO4 реагирует с гидроксидом калия KOH, в результате чего образуется сульфат калия K2SO4, и выпадает в осадок гидроксид меди Cu(OH): 2KOH + CuSO4 → K2SO4 + Cu(OH) 2.
Взаимодействие хлорида аммония с гидроксидом натрия описывается следующим уравнением (Nh5)2SO4 + 2KOH → 2h3O + K2SO4 + 2Nh4↑. Если воздействовать основанием на кислую соль, в результате получится средняя соль и вода. Например, бикарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + h3O.
Например, бикарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + h3O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, с образованием двух новых солей. С нерастворимым соединением взаимодействия не происходит. Некоторые кислые вещества реагируют со слабокислыми солями и их промежуточными соединениями.
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает, если свободный исходный металл более активен, чем тот, который входит в состав исходной соли. Узнать, какой металл более активен, можно с помощью электрохимического ряда напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, так как оно более активно, чем медь (слева в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, так как оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные металлы, при добавлении к водным растворам солей будут реагировать преимущественно не с солью, а с водой, содержащейся в растворах.
Взаимодействие средних солей с гидроксидами металлов
Сделаем оговорку, что в данном случае под гидроксидами металлов мы понимаем соединения типа Ме(ОН)х.
Для того чтобы промежуточная соль прореагировала с гидроксидом металла, необходимо одновременное выполнение двух условий:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, чтобы изучить это правило.
Определим, какая из следующих реакций протекает, и напишем уравнения предшествующих реакций:
- 1) PbS + КОН
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Напишем предполагаемую ионообменную реакцию и пометим слева и справа «шторками», обозначив ее так, чтобы еще не было известно, идет ли реакция на самом деле:
В предлагаемых продуктах мы видим гидроксид свинца (II), который, согласно таблице растворимости, нерастворим и должен оседать. Однако сделать вывод о том, что реакция продолжается, пока нельзя, так как мы не проверили выполнение еще одного обязательного требования: растворимости исходной соли и гидроксида. Сульфид свинца является нерастворимой солью, а это означает, что реакция не идет, так как не выполняется одно из обязательных условий реакции между солью и гидроксидом металла. Т.е.:
Однако сделать вывод о том, что реакция продолжается, пока нельзя, так как мы не проверили выполнение еще одного обязательного требования: растворимости исходной соли и гидроксида. Сульфид свинца является нерастворимой солью, а это означает, что реакция не идет, так как не выполняется одно из обязательных условий реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа(III) и гидроксидом калия. Запишем ожидаемую реакцию ионного обмена и обозначим ее слева и справа «занавесками», как и в первом случае:
В предлагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен оседать. Однако сделать вывод о ходе реакции еще нельзя. Для этого надо также проверить растворимость исходной соли и гидроксида. Оба исходных вещества растворимы, поэтому можно сделать вывод, что реакция продолжается.
Термическое разложение кислых солей
Все кислые соли разлагаются при нагревании. В рамках программы ЕГЭ по химии, начиная с реакций разложения кислых солей, вы должны узнать, как разлагаются углеводороды. Металлические бикарбонаты разлагаются уже при температуре выше 60 °C. При этом образуются карбонат металла, углекислый газ и вода.
Металлические бикарбонаты разлагаются уже при температуре выше 60 °C. При этом образуются карбонат металла, углекислый газ и вода.
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрочайниках, стиральных машинах и т.п.
Гидрокарбонат аммония разлагается, не оставляя твердых остатков, с образованием двух газов и паров воды:
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и при нагревании разлагаются. Карбонаты металлов разлагаются на оксид металла и диоксид углерода, а карбонат аммония дает три продукта: аммиак, диоксид углерода и воду.
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (обычно MnO2) реакция приводит к образованию хлорида калия и кислорода. Без катализатора реакция пойдет по типу сопропорционирования.
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, причем характер разложения зависит от положения металла в ряду активности.
Разложение солей аммония
Термическое разложение солей аммония часто сопровождается образованием аммиака:
Если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например молекулярный азот N2 или оксид азота (I).
Методы получения
Существует несколько способов получения солей:
- Реакция кислот с металлами, основными и амфотерными оксидами/гидроксидами
- Взаимодействие кислых оксидов со щелочами, основными и амфотерными оксидами/гидроксидами
- Взаимодействие солей с кислотами, другими солями (если образуется продукт, выходящий из сферы реакции)
- Взаимодействие простых веществ
Кристаллогидраты обычно получают кристаллизацией соли из водных растворов; однако известны также кристаллические сольваты солей, осажденные из неводных растворителей (например, CaBr2 3 C2H5OH).
Значение солей для человека
Наименование солей Состав продуктов Влияние на организм человека Болезни из-за нехватки солей
1.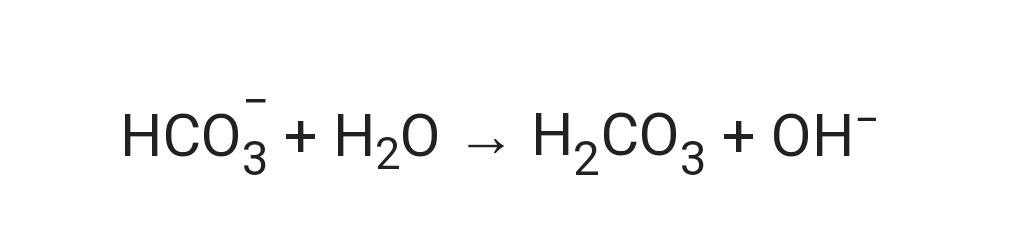 Соли кальция Соли кальция | Молоко, рыба, овощи | Увеличение роста и прочности костей | Плохой рост скелета, кариес зубов и т.д. |
| 2. Соли железа | Говяжья печень, Говядина | Они входят в состав гемоглобина | Анемия |
| 3. Соли магния | Горох, курага | Улучшить работу кишечника | Нарушенная пищеварительная система |
Применение солей
Соли широко используются как в производстве, так и в быту.
- Соли соляной кислоты. Из хлоридов наиболее часто используются хлорид натрия и хлорид калия.
Хлористый натрий (поваренная соль) выделяют из озерной и морской воды, а также добывают в соляных копях. Поваренная соль используется в пищу. В промышленности хлорид натрия служит сырьем для производства хлора, гидроксида натрия и соды.
Хлористый калий используется в сельском хозяйстве как калийное удобрение. - Соли серной кислоты. В строительстве и медицине широко применяют полуводный гипс, получаемый обжигом породы (дигидрат сульфата кальция).
 При смешивании с водой он быстро схватывается с образованием дигидрата сульфата кальция, то есть гипса.
При смешивании с водой он быстро схватывается с образованием дигидрата сульфата кальция, то есть гипса.
Декагидрат сульфата натрия используется в качестве сырья для производства безалкогольных напитков. - Соли азотной кислоты. Нитраты чаще всего используются в качестве удобрений в сельском хозяйстве. Наиболее важными из них являются нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрой.
- Из ортофосфатов наибольшее значение имеет ортофосфат кальция. Эта соль является основным компонентом полезных ископаемых: фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья при производстве фосфорных удобрений, таких как суперфосфат и осадок.
- Соли угольной кислоты. Карбонат кальция используется как сырье для производства извести.
Карбонат натрия (сода) используется в производстве стекла и мыла.
Карбонат кальция также встречается в природе в виде известняка, мела и мрамора.
Примеры формул солей
Для составления формулы соли необходимо знать заряды катиона и аниона, а также учитывать, что соединение электрически нейтрально. Чтобы узнать значения зарядов ионов, можно воспользоваться таблицей, размещенной на титульном листе 2 (так называемая таблица растворимости).
Чтобы узнать значения зарядов ионов, можно воспользоваться таблицей, размещенной на титульном листе 2 (так называемая таблица растворимости).
Составьте формулу соли, содержащей катионы и анионы
В состав соли входят ионы, значения зарядов которых неодинаковы: 2 и 3. Наименьшим числом, которое можно разделить без остатка между 2 и 3, является число 6. Разделите его на значения зарядов катиона (6:2 = 3) и аниона (6:3 = 2). Получаем количество этих ионов в формульной единице соединения, то есть соответствующие индексы в химической формуле соли:
Графических формул для солей, как и для других ионных соединений, не составляют.
Полоскание горла содой | ГЕКСОРАЛ®
25.08.2022 г.
97 332
13 минут
Автор, редактор и медицинский эксперт – Климович Элина Валерьевна.
Редактор и медицинский эксперт – Арутюнян Мариам Арутюновна.
Содержание:
- Общие принципы действия полоскания
- Правила проведения процедуры
- Показания к процедуре
- Помогает ли полоскание горла содой?
- Раствор ГЕКСОРАЛ® для полоскания
Несмотря на разнообразие препаратов общего действия, местная терапия при стоматологических и ЛОР-заболеваниях имеет большое значение. В частности, полоскание горла и полости рта растворами антисептиков врачи рекомендуют как один из важных компонентов комплексного лечения3,4.
В частности, полоскание горла и полости рта растворами антисептиков врачи рекомендуют как один из важных компонентов комплексного лечения3,4.
Поиск методов борьбы с инфекциями привел к созданию новых лекарств. Сегодня «подручные» средства, такие как соль и сода, при полоскании горла вытесняют высокоэффективные препараты, помогающие быстро справиться с воспалением, першением и болью в глотке, облегчают кашель, вызванный раздражением и воспалением внутренней оболочки этого отдела дыхательных путей.
Наверх к содержанию
Общие принципы действия полоскания
Несомненным его преимуществом является отсутствие системного действия. Компоненты растворов практически не всасываются, не проникают в общий кровоток, не влияют на работу органов и систем организма3,4. Это позволяет использовать процедуру не только в лечении взрослых, но и у детей, и у беременных женщин3.
Общепризнанная местная процедура оказывает разностороннее действие.
- Механическое очищение слизистой оболочки. Точнее, ее избавление от патогенных микроорганизмов, слизи и гноя, который содержит возбудителей заболевания и токсины, образующиеся в результате их жизнедеятельности3.4. К слову сказать, в основном этим ограничивается эффект при полоскании горла содой ребенку или взрослому.
- Антисептическое действие. В состав аптечных препаратов входят компоненты, губительно действующие на большинство бактерий, вирусов и грибов, которые чаще всего вызывают болезни глотки и полости рта4,5.
- Создание условий, неблагоприятных для размножения микробов. Нормальная кислотность тканей организма человека колеблется в диапазоне pH 7,32— 7,45, что соответствует щелочной среде. Воспаление, особенно гнойное, сопровождается закислением тканей и снижением pH до 6,5—5,39, что способствует дальнейшему развитию инфекции1. Многие средства для полоскания ощелачивают среду и создают условия, неблагоприятные для развития вирусов и бактерий1, но основная часть лекарств сдерживает размножение бактерий за счет действия своего антисептического компонента3.
 4.
4. - Облегчение боли. Конечно, при полоскании содой на облегчение боли в горле рассчитывать особо не приходится. А вот использование специально предназначенных для этого аптечных препаратов, содержащих анестетики местного действия, позволяет значительно облегчить страдания3,4.
- Уменьшение признаков воспаления. Действие лекарства приводит к уменьшению отека, боли и красноты воспаленной слизистой оболочки. Вместе с этим уменьшаются дискомфорт в полости рта, першение в глотке и кашель, вызванный раздражением рецепторов верхних дыхательных путей.
- Разжижение мокроты и облегчение ее отхаркивания4. Одни растворы разжижают мокроту за счет сдвига рН слизи в щелочную сторону, другие содержат в своем составе специальные компоненты, уменьшающие вязкость слизи и тем самым облегчающие ее выведение4.5.
Наверх к содержанию
Правила проведения процедуры
Чтобы полоскание приносило пользу, нужно придерживаться определенных правил3 в использовании готовых препаратов и приготовлении, и использовании растворов из них.
- Следует четко соблюдать пропорции компонентов. Вопрос «сколько соды развести для полоскания горла», пожалуй, один из самых популярных с сети. Он отпадает, если использовать готовые аптечные препараты, которые уже не нужно разводить водой – именно такие чаще всего рекомендуют врачи.
- Раствор не должен быть холодным или горячим – только теплым3,4. По этой причине не нужно держать лекарства в холодильнике.
- Соблюдать инструкцию по продолжительности проведения процедуры — это обеспечивает необходимый контакт действующих компонентов лекарства со слизистой оболочкой3.
- Соблюдать рекомендуемую производителем частоту проведения процедур для обеспечения непрерывности лечения. Компоненты лекарства сохраняют свою активность в очаге воспаления ограниченное количество времени.
- Стараться не глотать средство. Конечно, отравления в любом случае не будет, но все же препараты для полоскания не предназначены для приема внутрь.
- В течение получаса после проведения процедуры ничего пить и не принимать пищу3,4.
 Это важно, чтобы продлить контакт препарата с пораженной слизистой оболочкой.
Это важно, чтобы продлить контакт препарата с пораженной слизистой оболочкой.
Наверх к содержанию
Показания к процедуре
Врачи рекомендуют процедуру при следующих заболеваниях3,4,5.
1.Ангина (острый тонзиллит).
Острый тонзиллит — инфекционное заболевание, сопровождающееся воспалением миндалин. У детей в возрасте от 3 до 7 лет в 77% случаев его причиной становятся бактерии3,7. У взрослых большинство ангин вызывают вирусы4, но последующая активизация бактериальной микрофлоры приводит к развитию бактериального воспалительного процесса4.
В тяжелых случаях тонзиллита врачи сразу назначают антибиотики3,7, местная терапия дополняет общую и способствуют очищению миндалин. При легком течении заболевания, сопровождающемся умеренной интоксикацией, невысокой температурой, небольшим покраснением и отеком миндалин и их дужек, бывает достаточно только местной терапии3. Конечно, в таких случаях речь не идет о полоскании горла раствором соды – только о специально предназначенных для этого антисептических средствах.
2. Фарингит
Острый фарингит, или воспаление слизистой оболочки глотки, редко бывает изолированным4. В подавляющем большинстве случаев он развивается как часть клинической картины
назофарингита, то есть в дополнение к риниту при ОРВИ, или тонзиллофарингита – в совокупности с воспалением миндалин4.
Фарингиты вирусной природы встречаются чаще бактериальных4. При этом вызванное вирусами воспаление доминирует лишь в самом начале заболевания. Переохлаждение, употребление холодных напитков, вдыхание запыленного и загрязненного химикатами воздуха, курение и другие факторы, приводящие к раздражению слизистой оболочки дыхательных путей и снижению иммунитета, часто приводят к активизации условно-патогенных бактерий и развитию бактериального воспаления4. Изолированные фарингиты исключительно редко принимают тяжелое течение, поэтому системная терапия применяется только в исключительных случаях4.
Чаще врачи рекомендуют средства местной терапии – полоскания горла.
3. Кандидоз полости рта и глотки
Дрожжеподобные грибы рода Кандида можно обнаружить у большинства людей3. Этот микроорганизм относится к условно-патогенным представителям микрофлоры и активизируется только при снижении иммунитета3. Развитию кандидозного стоматита и фарингомикоза способствуют кишечный дисбиоз, такие тяжелые общие заболевания, как сахарный диабет, рак, ВИЧ-инфекция. Кроме того, кандидоз нередко развивается на фоне длительного приема антибиотиков, а также вследствие неправильного применения местных глюкокортикоидов (спреев) при бронхиальной астме3.
На слизистой оболочке появляются мелкие белые «островки», которые увеличиваются в размерах и, сливаясь, образуют пленки. Внешне пленки напоминают гной, но они не снимаются, при их отторжении на поверхности слизистой остаются красные пятна и эрозии3. Проглатывание жидкости и пищи вызывает появление боли, из-за чего у взрослых ухудшается аппетит, а маленькие дети вовсе отказываются от еды. Наряду с противогрибковыми средствами, восстанавливающими микрофлору пребиотиками и пробиотиками, укрепляющими иммунитет лекарствами, используется местная терапия3.
Наряду с противогрибковыми средствами, восстанавливающими микрофлору пребиотиками и пробиотиками, укрепляющими иммунитет лекарствами, используется местная терапия3.
Наверх к содержанию
Помогает ли полоскание горла содой?
Для проведения процедуры используют обычную пищевую соду, которая есть практически на каждой кухне. С точки зрения химии, это натриевая кислая соль угольной кислоты с формулой NaHCO3 (гидрокарбонат натрия)2.
Гидрокарбонат натрия, как действующее вещество, есть в реестре лекарственных средств2. В показаниях к его использованию прописаны острые инфекции верхних дыхательных путей и воспалительные заболевания полости рта2. Там же описано его действие и указано, сколько соды нужно для полоскания горла. Однако, тем не менее нужно признать, что как средство местной терапии при ангинах, фарингитах и стоматитах она безнадежно устарела. Ее упоминания единичны и встречающиеся во врачебных статьях, относящихся к прошлому веку. Идущие в ногу со временем специалисты исключили ее из своих рекомендаций. Гидрокарбонат натрия не только малоэффективен, но и не так безопасен, как может показаться на первый взгляд5.
Идущие в ногу со временем специалисты исключили ее из своих рекомендаций. Гидрокарбонат натрия не только малоэффективен, но и не так безопасен, как может показаться на первый взгляд5.
Почему не стоит использовать соду?
- Сомнительный эффект. Статистика показывает, что 90% больных, обращающихся к ЛОР-врачам с фарингитом самостоятельно и неоднократно полоскали горло и, тем не менее, им пришлось прибегнуть к медицинской помощи5.
- Нарушение естественных механизмов защиты. Слизь, вырабатываемая железами глотки, выполняет защитную функцию. Попадающие внутрь микробы «вязнут» в слизи, теряют свою активность и отчасти погибают под действием биологически активных веществ – интерферона, иммуноглобулинов, лизоцима и других. При полоскании слизь вымывается, в результате чего слизистая становится сухой, ранимой и уязвимой для вирусов бактерий5. С этой точки зрения, вероятно, лучше использовать для проведения процедуры антисептики, не только удаляющие слизь, но и убивающие патогенных микробов.

- Сухость слизистой глотки. Это особенно актуально при хроническом фарингите, сопровождающимся истончением внутренней оболочки глотки и снижением секреции слизи7. Гидрокарбонат натрия еще больше высушивает слизистую и тем самым открывает входные ворота бактериям, обитающим в верхних дыхательных путях и попадающим туда через нос и рот.
- Влияние на кислотность желудка. Этот механизм реализуется при попадании натриевой кислой соли угольной кислоты в желудок, что нередко случается у детей, не умеющих полоскать горло. Вступая в реакцию с соляной кислотой желудочного сока, гидрокарбонат натрия буквально сразу снижает кислотность желудка6. Однако вскоре она не только восстанавливается, но и становится выше, по сравнению с исходным уровнем. Это связано с раздражением и повышением активности кислотопродуцирующих клеток6. Именно из-за этого ее не используют в качестве антацидного средства, то есть средства для снижения кислотности желудка6.
 Сода может быть опасно для людей с гиперацидным гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, а также для детей с недостаточно развитыми защитными механизмами пищеварительной системы6.
Сода может быть опасно для людей с гиперацидным гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, а также для детей с недостаточно развитыми защитными механизмами пищеварительной системы6. - Во время беременности. Специфический привкус соды может провоцировать рвоту у беременных, что связано с физиологическим повышением рвотного рефлекса. Кроме того, на поздних сроках беременности, когда многие беременные страдают от изжоги, попадание натрия кислой соли угольной кислоты в желудок может вызывать усиление симптоматики6.
- Ацидоз. Конечно, для развития ацидоза, то есть нарушения кислотно-щелочного состояния организма, сопровождающегося его закислением, нужно принять внутрь гораздо больше соды, чем нужно для полоскания горла. Однако это осложнение мы не можем оставить без внимания. Даже кратковременный сдвиг кислотно-щелочного состояния у больных с почечной недостаточностью может значительно ухудшить состояние2.
 У больных с заболеваниями сердца он провоцирует появление отеков и развитие сердечной недостаточности2.
У больных с заболеваниями сердца он провоцирует появление отеков и развитие сердечной недостаточности2.
Самолечение в принципе опасно для здоровья, а с учетом всего вышеизложенного соду лучше убрать из аптечки и не использовать даже взрослым. Но особого внимания заслуживает вопрос: можно ли полоскать горло содой ребенку. Маленькие дети в силу своего возраста и отсутствия навыков проведения процедуры часто заглатывают растворы5. Риск развития побочных эффектов гиброкарбоната натрия у них выше, чем у взрослых5. Для малышей созданы специальные средства5 в виду спреев с антисептическими и противовоспалительными компонентами – такие есть в линейке препаратов ГЕКСОРАЛ®.
Наверх к содержанию
Раствор ГЕКСОРАЛ
® для полосканияГЕКСОРАЛ® — современный препарат, предназначенный для местного лечения фарингита, тонзиллита и стоматита, вирусной, бактериальной и грибковой природы8. Он выпускается в виде раствора для полоскания горла и спрея и рекомендуется к применению в качестве компонента комплексной терапии детей от 3 лет и взрослых8.
Основным действующим компонентом лекарства является гексэтидин – антисептик, который действует на большинство бактерий, в том числе на бета-гемолитический стрептококк, а также некоторые вызывающие ОРВИ вирусы и грибы рода Кандида8.
Помогая бороться с размножением болезнетворных микроорганизмов, ГЕКСОРАЛ® противостоит воспалению8. Воздействуя на причины боли, он уменьшает неприятные ощущения в полости рта и глотке8. Полоскание горла или полости рта в течение 30 секунд обеспечивает 12-часовое действие препарата, поэтому проводить процедуру рекомендуется дважды в день8. Приятный мятный привкус и аромат8 средства располагает к продолжению лечения.
Важно! Средства для местного лечения воспалительных заболеваний полости рта и глотки не заменяют общую терапию, назначаемую врачом. Поэтому всегда лучше обращаться к специалисту. В особенности это касается заболеваний у детей, пожилых людей и ослабленных больных, когда риск осложнений инфекции особенно высок.
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту.
Соли в химии — общая характеристика, классификация и примеры соединений с названиями » Kupuk.net
Самая распространенная группа соединений в химии — соли. В природе их можно встретить в виде залежей минералов или растворенными в водах Мирового океана. Без этих химических веществ невозможны многие процессы, происходящие в организме человека: они входят в состав костей и гемоглобина крови. Кроме того, соли широко применяются в разных отраслях промышленности и медицине.
Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
- являющиеся результатом взаимодействия оснований и кислот;
- соединения, образованные одним или несколькими кислотными остатками и ионом металла;
- при электролитической диссоциации — состоящие из катионов и анионов.

Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (Nh5)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония Nh5. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
- Na2CO3 — карбонат натрия.
- NaCl — хлорид натрия.
- KNO3 — нитрат калия.
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная h3SO4 (сульфаты) и сернистая h3SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
- NaHSO4 — гидросульфат натрия.
- CaHPO4 — гидрофостфат кальция.
- Kh3PO4 — дигидрофосфат калия.
Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
- Аl (OH)SO4 — гидроксосульфит алюминия.
- Cu (OH)Cl — гидроксохлорид меди.
- Fe (OH)2NO3 — дигидроксохлорид железа.
youtube.com/embed/vOZgxLroe1M»/>В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
- амиакаты, в которых с комплексообразователем связаны молекулы аммиака — [Co (Nh4)6]Cl3;
- аквакомплексы, образованные лигандами воды — [Al (h3O)6]Cl3;
- ацидокомплексы, включающие кислотные остатки — K2[PtCl4].
Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10h3O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2h3O — дигидрат сульфата кальция.
При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10h3O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2h3O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5h3O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства
Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
- Хлорид натрия: NaCl ↔ (Na+) + (Cl-).
- Сульфат калия-натрия: КNaSO4 ↔ (К+) + (Na+) + (SO42-).
- Хлорид-бромид кальция: CaClBr ↔ (Ca2+) + (Cl -)+ (Br-).
- Гидросульфат калия: КHSO4 ↔ (К+) + (НSO4-), а затем (HSO4-) ↔ (H+) + (SO42-).
- Гидроксохлорид железа: FeOHCl ↔ (FeOH+) + (Cl-), а затем (FeOH+) ↔ (Fe2+) + (OH-).
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами
Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + h3SO4 → MgSO4 + 2h3O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → h3SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.
Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (Nh5)2SO4 + 2KOH → 2h3O + K2SO4 + 2Nh4↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + h3O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:
- производство целлюлозы и бумаги;
- лакокрасочная промышленность;
- моющие средства;
- стекловарение;
- обработка кожи.
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
Является ли пищевая сода (NaHCO3) кислотой или основанием, или и тем, и другим?
Главная > Является ли (пищевая сода) NaHCO3 кислотой или основанием? — кислая или основная соль
Карбонат натрия состоит из катиона натрия и аниона бикарбоната и имеет химическую формулу NaHCO 3 . Он также известен как пищевая сода или бикарбонатная сода. Выглядит как белый кристаллический порошок без запаха. Он имеет слегка соленый или горький вкус и чаще всего используется в качестве буферного агента pH.
В этой статье мы обсудим Is NaHCO 3 кислота или основание? Это кислая или основная соль? и другие его важные свойства со всеми возможными объяснениями.
Итак, Является ли NaHCO 3 (пищевая сода) кислотой или основанием? Пищевая сода (NaHCO 3 ) является амфотерной, что означает, что она может действовать как кислота, так и как основание.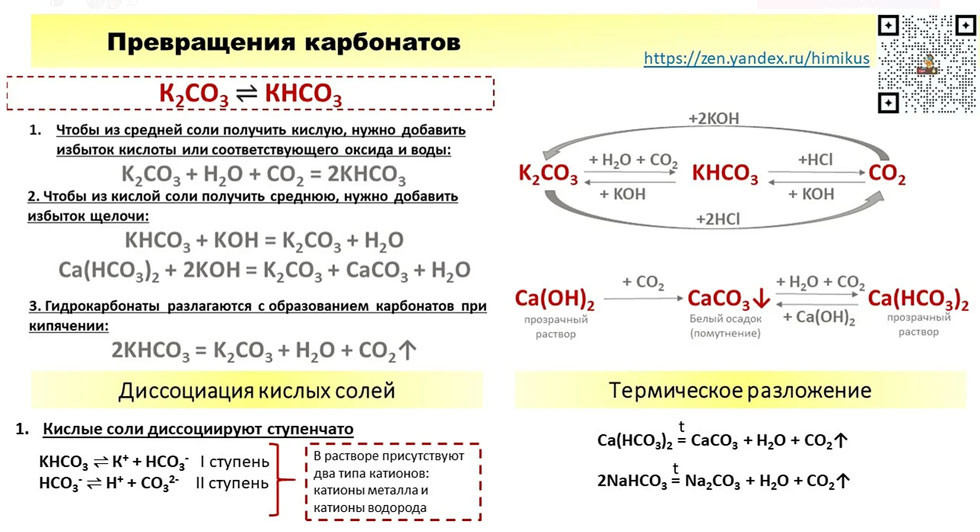 Значение pH пищевой соды составляет около 8, что показывает, что она является слабощелочной или щелочной по своей природе, поэтому, когда пищевая сода растворяется в воде, она образует щелочной раствор.
Значение pH пищевой соды составляет около 8, что показывает, что она является слабощелочной или щелочной по своей природе, поэтому, когда пищевая сода растворяется в воде, она образует щелочной раствор.
Короче говоря, пищевая сода или бикарбонат натрия (NaHCO 3 ) может действовать как как кислота, так и как основание, но его водный раствор имеет слабощелочную природу.
Поэтому щелочной раствор пищевой соды используется для нейтрализации уровня кислоты.
| Name of Molecule | Sodium bicarbonate or Baking soda |
| Chemical formula | NaHCO 3 |
| Nature | Acid as well as Base |
| pH | 8 – 9 |
| Acidity (pK a ) | 10.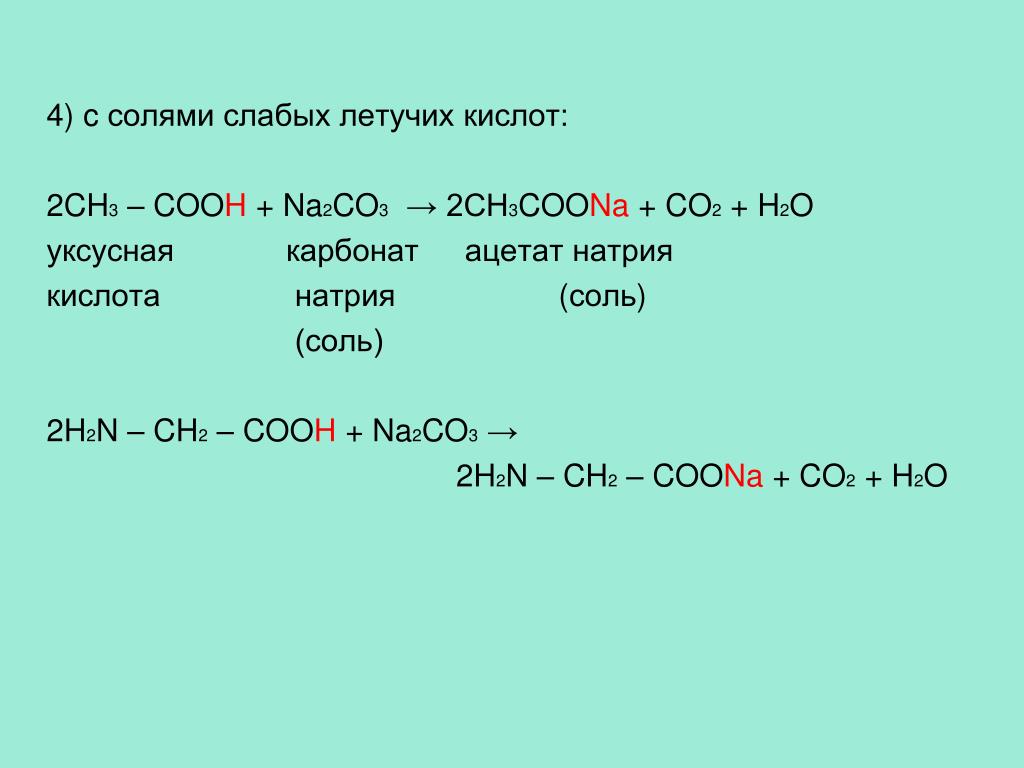 329 329 |
Изображение предоставлено: Шкала рН
Как мы знаем, кислота имеет уровень рН от 1 до 6, а основание имеет уровень рН от 8 до 14. Бикарбонат натрия имеет уровень рН около 8 -9что означает, что он находится в диапазоне основных значений по шкале рН. Итак, можно сказать, что пищевая сода (NaHCO 3 ) является слабощелочным веществом
Но, Как NaHCO 3 может выступать в качестве основания? При растворении NaHCO 3 в воде он диссоциирует на два иона Na + и HCO 3 – . Ион Na + является всего лишь ионом-спектатором, так как является катионом сильного основания (NaOH), следовательно, не принимает участия в химической реакции, тогда как HCO 3 – ион – анион слабой кислоты, который легко подвергается гидролизу.
Процесс гидролиза бикарбонат-иона (HCO 3 – ) отвечает за основную природу NaHCO 3 .
В соответствии с теорией оснований Бренстеда-Лоури соединение считается основанием, когда оно принимает протон от реагирующих частиц.
Согласно теории оснований Аррениуса, соединение называется основанием, если оно образует ОН – ионов в водном растворе.
Итак, анион (HCO 3 – ) гидрокарбоната натрия (NaHCO 3 ) при растворении в воде принимает протон от молекулы воды и образует ионы OH – . Следовательно, согласно приведенному выше определению, HCO 3 – действует как основание Аррениуса, а также как основание Бренстеда-Лоури при взаимодействии с молекулами воды.
Итак, вот как NaHCO 3 действует как основание из-за гидролиза его бикарбонат-иона (HCO 3 – ).
Теперь, Как NaHCO 3 действует как кислота? Когда его ион бикарбоната (HCO 3 – ) реагирует с сильным основанием, таким как OH-, он будет действовать как кислота. Это потому, что более сильное основание имеет больше возможностей «принимать протон».
Итак, когда HCO 3 – вступает в реакцию с соединением, содержащим ион OH – , тогда HCO 3 – будет действовать как кислота и, следовательно, должен отдавать протон. И все, что отдает протон, считается кислотой согласно теории Бренстеда-Лоури.
Теория Бренстеда-Лоури для кислоты гласит, что «кислота — это вещество, которое отдает протон реагирующим частицам».
Как видно из рисунка выше, HCO 3 – отдает протон OH – и образует H 2 O и карбонат-ион (CO 3 2- 2).
Итак, здесь HCO 3 – действует как кислота в присутствии сильных оснований.
∴ Вот и все, бикарбонат натрия или пищевая сода (NaHCO 3 ) действует как кислота, а также как основание из-за его бикарбонатного аниона (HCO 3 – ) амфотерной активности.
⇒ HCO 3 — + H 2 O → H 2 CO 3 + OH — [∴ HCO 3 — ACT AS BASE]
7777777777777777777777777777777777 — . 3 – + OH – → CO 3 2- + H 2 O [∴ HCO 3 – ] действует как кислота]0005
Читайте также:-
- Как Ch4OH действует как кислота и как основание?
- Каким образом HCO3- действует как кислота и как основание?
- Каким образом h3O действует не только как основание, но и как кислота?
Вы когда-нибудь слышали, что эти термины означают «кислая соль» или «основная соль»?
Кислотная соль: Когда происходит реакция нейтрализации между слабым основанием и сильной кислотой, образуется соль, называемая кислой солью. Примеры кислой соли – NH 4 Cl, NH 4 NO 3 , NH 4 Br и т. д.
Примеры кислой соли – NH 4 Cl, NH 4 NO 3 , NH 4 Br и т. д.
Читайте также: —
- Почему Nh5Cl является кислой солью?
- Почему Nh5NO3 является кислой солью?
- Почему Nh5Br является кислой солью?
Основная соль: Согласно концепции соли, при протекании реакции нейтрализации между сильным основанием и слабой кислотой образуется соль, называемая основной солью. Примеры основных солей – NaCN, Soap, Na 2 CO 3, и т.д.
Читайте также:-
- Почему NaCN является основной солью?
- Почему мыло является основной солью?
- Почему Na2CO3 является основной солью?
Хорошо, теперь перейдем к делу Является ли NaHCO 3 основной солью? Как мы знаем, бикарбонат натрия образуется, когда NaOH (сильное основание) реагирует с H 2 CO 3 (слабая кислота). Они реагируют друг с другом в молярном соотношении 1:1.
⇒ NaOH + H 2 CO 3 → NaHCO 3 + H 2 O
Согласно представлениям о солях, сочетание сильного основания и слабой кислоты приводит к образованию основной соли.
Природа соли (кислая или основная) зависит от силы компонента в кислотно-щелочной реакции.
- Водный раствор более сильной кислоты и слабого основания приобретет больше свойств кислоты, чем основания.
- Водный раствор более сильного основания и слабой кислоты приобретет больше свойств основания, чем кислоты.
Кислотная соль – это соль, которая имеет по крайней мере 1 замещаемый ион H + .
Итак, NaHCO 3 также может вести себя как кислая соль, потому что у него есть еще один заменяемый ион H + , когда он реагирует с основаниями.
⇒ NaHCO 3 + NaOH → H 2 O + Na 2 CO 3
При взаимодействии гидрокарбоната натрия с сильным основанием он подвергается полной нейтрализации с образованием воды и карбоната натрия. Поэтому в данном случае она действует как кислая соль из-за наличия одного заменимого H + ион.
Поэтому в данном случае она действует как кислая соль из-за наличия одного заменимого H + ион.
Наконец, мы можем сказать, что пищевая сода (NaHCO 3 ) является основной солью, потому что она образуется при нейтрализации сильного основания (NaOH) слабой кислотой (H 2 CO 3 ) и может действовать как кислая соль также из-за присутствия в ней ионизируемого иона водорода.
Почему водный раствор NaHCO3 становится основным?Водный раствор, имеющий значение pH более 7, называется основным водным раствором.
При растворении карбоната натрия в воде он диссоциирует на два иона Na + и HCO 3 – .
⇒ NaHCO 3 → Na + + HCO 3 –
Na + является катионом сильного основания (NaOH), следовательно, не подвергается гидролизу в воде. влияют на рН раствора. Но HCO 3 – – это анион слабой кислоты, который подвергается гидролизу в воде с образованием угольной кислоты (H 2 CO 3 ), оставляя свободные ионы OH – , которые делают раствор щелочным.
⇒ HCO 3 — + H 2 O → H 2 CO 3 + OH —
Слабая кислота, такая как H3CO3, остается в основном в растворе. раствор содержит больше ионов ОН – , чем ионов Н + .
Следовательно, при наличии в водном растворе дополнительных ионов OH – пищевая сода (NaHCO 3 ) раствор становится щелочным.
Примечание: Природа водного раствора зависит от ионов Н + и ОН – ионов. Когда в водном растворе присутствует больше ионов ОН – , раствор становится щелочным, а когда в водном растворе присутствует больше ионов Н + , раствор становится кислым.
Также, когда количество ионов H + и OH – одинаково в водном растворе, говорят, что раствор нейтрален.
Почему NaHCO3 используется для нейтрализации кислоты?Также проверьте:-
- Как определить, является ли вещество основанием, кислотой или солью?
- Как определить, является ли кислота или основание сильным или слабым?
Как мы знаем, гидрокарбонат натрия является основной солью по своей природе, и его значение pH лежит в пределах 8 – 9. Таким образом, когда NaHCO 3 добавляют к раствору сильной кислоты, он образует хлорид натрия и угольная кислота.
Таким образом, когда NaHCO 3 добавляют к раствору сильной кислоты, он образует хлорид натрия и угольная кислота.
⇒ NaHCO 3 + HCl → H 2 CO 3 + NaCl
Углекислота — двухосновная кислота, имеющая химическую формулу H 2 CO 3 9. Это нестабильная кислота, что означает, что она может легко разлагаться на воду и углекислый газ.
Так, при добавлении NaHCO 3 к раствору сильной кислоты выделяется углекислый газ, раствор остается полностью нейтральным.
⇒ NaHCO 3 + HCl → NaCl + H 2 O + CO 2 (g)
Бикарбонат натрия не образует токсичных газов, поэтому он используется в качестве ингредиента нейтрализатора желудочной кислоты.
Наконец, бикарбонат натрия представляет собой соль, которая при растворении в воде расщепляется на два иона (Na + + HCO 3 – ), а гидролиз бикарбонат-иона делает его раствор щелочным, который в дальнейшем используется для нейтрализации кислота.
- Пищевая сода используется в качестве антацида для нейтрализации желудочной кислоты, что помогает уменьшить боль при язве и изжогу.
- Используется для уменьшения боли при незначительных повреждениях кожи путем нейтрализации токсинов, обнаруженных на поверхности кожи.
- Применяется для тушения пожаров небольшой интенсивности путем перебрасывания над огнем.
- Пищевая сода используется для устранения запаха. Как правило, он используется для поглощения неприятного запаха в холодильнике путем размещения открытой коробки с пищевой содой.
- Используется для удаления краски и уменьшения коррозии.
- Пищевая сода обладает антикариесными и абразивными свойствами, поэтому она используется в качестве ингредиента в некоторых ополаскивателях для рта, которые помогают нейтрализовать образование кислоты во рту.
- Пищевая сода может быть смешана с водой для использования на теле или в качестве скраба для лица для удаления грязи и бактерий.

- NaHCO 3 используется для регулирования pH вещества благодаря его амфотерной природе.
- При растворении пищевой соды в воде образуется некоторое количество карбоновой кислоты, которую можно использовать в качестве очищающего средства.
- Пищевая сода используется для мытья пола, духовки, микроволновой печи, мебели и других необходимых предметов домашнего обихода.
РезюмеОсновное применение пищевой соды: В кулинарии пищевая сода в основном используется при выпечке в качестве разрыхлителя. Когда он вступает в реакцию с кислотой, высвобождается углекислый газ, который вызывает расширение теста и формирует характерную текстуру и зернистость в пирогах, быстром хлебе, содовом хлебе и других выпеченных и жареных продуктах.
Бикарбонат натрия представляет собой белое твердое кристаллическое химическое соединение, обычно в виде порошка. Ее также называют пищевой содой или бикарбонатной содой, имеющей значение pH около 8. Пищевая сода чаще всего используется в кулинарии в качестве разрыхлителя. Наконец, мы сделаем обзор этой статьи о том, является ли пищевая сода (NaHCO 3 ) кислотой или основанием?
Пищевая сода чаще всего используется в кулинарии в качестве разрыхлителя. Наконец, мы сделаем обзор этой статьи о том, является ли пищевая сода (NaHCO 3 ) кислотой или основанием?
- Является ли NaHCO 3 (пищевая сода) кислотой или основанием ? Пищевая сода является основанием с уровнем pH около 8, ее водный раствор слабо щелочной. Но пищевая сода (NaHCO 3 ) может действовать как кислота, так и как основание из-за его бикарбонат-аниона (HCO 3 – ) амфотерной активности.
- Пищевая сода (NaHCO 3 ) представляет собой основную соль. Он образуется при нейтрализации сильного основания, а именно гидроксида натрия (NaOH), и слабой кислоты, а именно угольной кислоты (H 2 CO 3 ). Он может действовать как кислая соль также из-за присутствия в нем ионизируемого иона водорода.
- Водный раствор пищевой соды (NaHCO 3 ) является щелочным или щелочным.
 Из-за присутствия дополнительных ионов OH – , образующихся при гидролизе его бикарбонат-иона (HCO 3 – ).
Из-за присутствия дополнительных ионов OH – , образующихся при гидролизе его бикарбонат-иона (HCO 3 – ).
Поделись…
Бикарбонат натрия представляет собой химическое соединение с формулой NaHCO 3 . Поскольку она давно известна и широко используется, у соли есть много других названий, включая гидрокарбонат натрия , бикарбонат натрия , пищевая сода , хлебная сода , пищевая сода , бикарбонат натрия или бикарбонат . соды . Слово saleratus , от латинского sal æratus , что означает «аэрированная соль», широко использовался в 19 веке как для бикарбоната натрия, так и для бикарбоната калия. Растворим в воде. Бикарбонат натрия представляет собой белое твердое вещество, которое является кристаллическим, но часто выглядит как мелкий порошок. Он имеет слегка щелочной вкус, напоминающий вкус карбоната натрия. Он входит в состав минерального натрона и растворяется во многих минеральных источниках. Природная минеральная форма известна как нахколит 9.0039 . Его также производят искусственным путем. Дополнительные рекомендуемые знания
Производство
NaHCO 3 в основном получают методом Сольве, который представляет собой реакцию карбоната кальция, хлорида натрия, аммиака и диоксида углерода в воде. Он производится в масштабе около 100 000 тонн в год (год: 2001). [1] Коммерческие количества пищевой соды также производятся этим методом: кальцинированная сода, добываемая в виде рудного трона, растворяется в воде и обрабатывается двуокисью углерода. Бикарбонат натрия осаждается в виде твердого вещества по этому методу:
ХимияКислотно-основные реакции NaHCO 3 представляет собой соль, состоящую из ионов Na + и аниона бикарбоната, HCO 3 — .
Реакция гидроксида натрия с диоксидом углеродаNaHCO 3 может быть получен реакцией диоксида углерода с водным раствором гидроксида натрия : Начальная реакция дает карбонат натрия:
Дальнейшее добавление диоксида углерода дает бикарбонат натрия, который при достаточно высокой концентрации выпадает из раствора в осадок:
РазложениеРеакция гидрокарбоната натрия и кислоты:
Затем разлагается на углекислый газ и воду:
Термическое разложение При температуре выше 60 °C постепенно разлагается на карбонат натрия, воду и углекислый газ.
Большинство бикарбонатов подвергаются этой реакции дегидратации. Дальнейшее нагревание превращает карбонат в оксид:
Эти преобразования относятся к использованию NaHCO 3 в качестве порошкового огнетушащего вещества («NaHCO 3 ») порошковые огнетушители. приложенийКулинария
Бикарбонат натрия в основном используется при приготовлении пищи (выпечке), где он вступает в реакцию с другими компонентами с выделением углекислого газа, который помогает тесту «подняться».
Для нейтрализации кислот и щелочейРеакция кислот с бикарбонатом натрия является распространенным методом нейтрализации разливов кислот и оснований. Преимущество бикарбоната натрия в том, что он амфотерный, поэтому реагирует с кислотами и основаниями. Например, с серной кислотой:
с натрием HydRexid:
Кроме того, поскольку в большинстве случаев он относительно безвреден, использование избыточного количества бикарбоната натрия не причинит вреда. Его нейтрализующие свойства позволяют использовать его в самых разных областях, включая ослабление действия белого фосфора в зажигательных пулях, а также его распространение в ранах пострадавшего солдата.
Разное и бытовое использованиеПищевая сода имеет множество применений. [1] Бутылочные ракеты: уксус и пищевая сода В качестве дезодоранта
Медицинское применение
Использование в косметике
В качестве чистящего средства
Другое использование
Дальнейшее чтение | |||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Sodium_bicarbonate». Список авторов есть в Википедии. |
14.5 Гидролиз растворов солей
Цели обучения
К концу этого модуля вы сможете:
- Предсказывать, будет ли раствор соли кислым, основным или нейтральным
- Расчет концентрации различных видов в солевом растворе
- Опишите процесс, в результате которого растворы некоторых ионов металлов становятся кислыми
Как мы видели в разделе о химических реакциях, когда кислота и основание смешиваются, они подвергаются реакции нейтрализации. Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это так, но соли, которые образуются в этих реакциях, могут иметь собственные кислотные или основные свойства, как мы сейчас увидим.
Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это так, но соли, которые образуются в этих реакциях, могут иметь собственные кислотные или основные свойства, как мы сейчас увидим.
Кислотно-основная нейтрализация
Раствор является нейтральным, если он содержит равные концентрации ионов гидроксония и гидроксида. Когда мы смешиваем растворы кислоты и основания, происходит кислотно-щелочная реакция нейтрализации. Однако, даже если мы смешаем стехиометрически эквивалентные количества, мы можем обнаружить, что полученный раствор не является нейтральным. Он может содержать либо избыток ионов гидроксония, либо избыток ионов гидроксида, потому что природа образующейся соли определяет, будет ли раствор кислым, нейтральным или основным. Следующие четыре ситуации иллюстрируют, как растворы с различными значениями pH могут образовываться после реакции нейтрализации с использованием стехиометрически эквивалентных количеств:
- Сильная кислота и сильное основание, такие как HCl ( вод.
 ) и NaOH ( вод. }\left(aq\right)+\text{NaOH}\left(aq\right)\rightleftharpoons \text{NaCl}\left(aq\right)+{\text{H}}_{2}\text{ О}\влево(л\вправо)[/латекс]
) и NaOH ( вод. }\left(aq\right)+\text{NaOH}\left(aq\right)\rightleftharpoons \text{NaCl}\left(aq\right)+{\text{H}}_{2}\text{ О}\влево(л\вправо)[/латекс] - Сильная кислота и слабое основание дают слабокислый раствор не из-за присутствия сильной кислоты, а из-за сопряженной кислоты слабого основания.
- Слабая кислота и сильное основание дают слабоосновный раствор. Раствор слабой кислоты реагирует с раствором сильного основания с образованием сопряженного основания слабой кислоты и сопряженной кислоты сильного основания. Сопряженная кислота сильного основания является более слабой кислотой, чем вода, и не влияет на кислотность полученного раствора. Однако сопряженное основание слабой кислоты является слабым основанием и слегка ионизируется в воде. Это увеличивает количество гидроксид-иона в растворе, образующемся в результате реакции, и делает его слегка щелочным.
- Слабая кислота плюс слабое основание могут дать кислый, основной или нейтральный раствор.
 Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и сопряженное основание имеют неравную силу, раствор может быть либо кислым, либо основным, в зависимости от относительной силы двух конъюгатов. Иногда слабая кислота и слабое основание будут иметь одинаковую силу , поэтому их соответствующие сопряженные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным. Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, в таблице 9Необходимо сравнить 1192 K значений сопряженных величин.
Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и сопряженное основание имеют неравную силу, раствор может быть либо кислым, либо основным, в зависимости от относительной силы двух конъюгатов. Иногда слабая кислота и слабое основание будут иметь одинаковую силу , поэтому их соответствующие сопряженные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным. Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, в таблице 9Необходимо сравнить 1192 K значений сопряженных величин.
Антациды для желудка
Наш желудок содержит примерно 0,03 М HCl, который помогает нам переваривать пищу, которую мы едим. Ощущение жжения, связанное с изжогой, является результатом утечки желудочной кислоты через мышечный клапан в верхней части желудка в нижние отделы пищевода. Слизистая оболочка пищевода не защищена от разъедающего воздействия желудочной кислоты, как слизистая оболочка желудка, и результаты могут быть очень болезненными. Когда у нас изжога, мы чувствуем себя лучше, если мы уменьшаем избыток кислоты в пищеводе, принимая антациды. Как вы уже догадались, антациды являются основаниями. Одним из наиболее распространенных антацидов является карбонат кальция CaCO 9 .0007 3 . Реакция,
Когда у нас изжога, мы чувствуем себя лучше, если мы уменьшаем избыток кислоты в пищеводе, принимая антациды. Как вы уже догадались, антациды являются основаниями. Одним из наиболее распространенных антацидов является карбонат кальция CaCO 9 .0007 3 . Реакция,
[латекс]{\текст{CaCO}}_{3}\left(s\right)+2\text{HCl}\left(aq\right)\rightleftharpoons {\text{aCl}}_ {2}\left(aq\right)+{\text{H}}_{2}\text{O}\left(l\right)+{\text{CO}}_{2}\left(g \right)[/latex]
не только нейтрализует желудочную кислоту, но и производит CO 2 ( г ), что может привести к удовлетворительной отрыжке.
Молоко магнезии представляет собой суспензию труднорастворимого основного гидроксида магния, Mg(OH) 2 . Работает по реакции: 9{\text{-}}\left(aq\right)\rightleftharpoons 2{\text{H}}_{2}\text{O}\left(l\right)[/latex]
Эта реакция не продуцируют углекислый газ, но магнийсодержащие антациды могут оказывать слабительное действие.
Некоторые антациды содержат гидроксид алюминия Al(OH) 3 в качестве активного ингредиента. Гидроксид алюминия имеет тенденцию вызывать запор, а в некоторых антацидах гидроксид алюминия используется вместе с гидроксидом магния, чтобы сбалансировать побочные эффекты двух веществ.
Гидроксид алюминия имеет тенденцию вызывать запор, а в некоторых антацидах гидроксид алюминия используется вместе с гидроксидом магния, чтобы сбалансировать побочные эффекты двух веществ.
Кулинарные аспекты химии
Кулинария — это, по сути, синтетическая химия, которую можно безопасно есть. В кулинарном мире существует множество примеров кислотно-щелочной химии. Одним из примеров является использование пищевой соды или бикарбоната натрия в выпечке. NaHCO 3 является основанием. Когда он вступает в реакцию с кислотой, такой как лимонный сок, пахта или сметана, в жидком тесте образуются пузырьки углекислого газа в результате разложения образующейся угольной кислоты, и жидкое тесто «поднимается». Разрыхлитель представляет собой комбинацию бикарбоната натрия и одной или нескольких кислых солей, которые реагируют, когда два химических вещества вступают в контакт с водой в жидком тесте.
Многие люди любят поливать приготовленную рыбу лимонным соком или уксусом, которые являются кислотами (рис.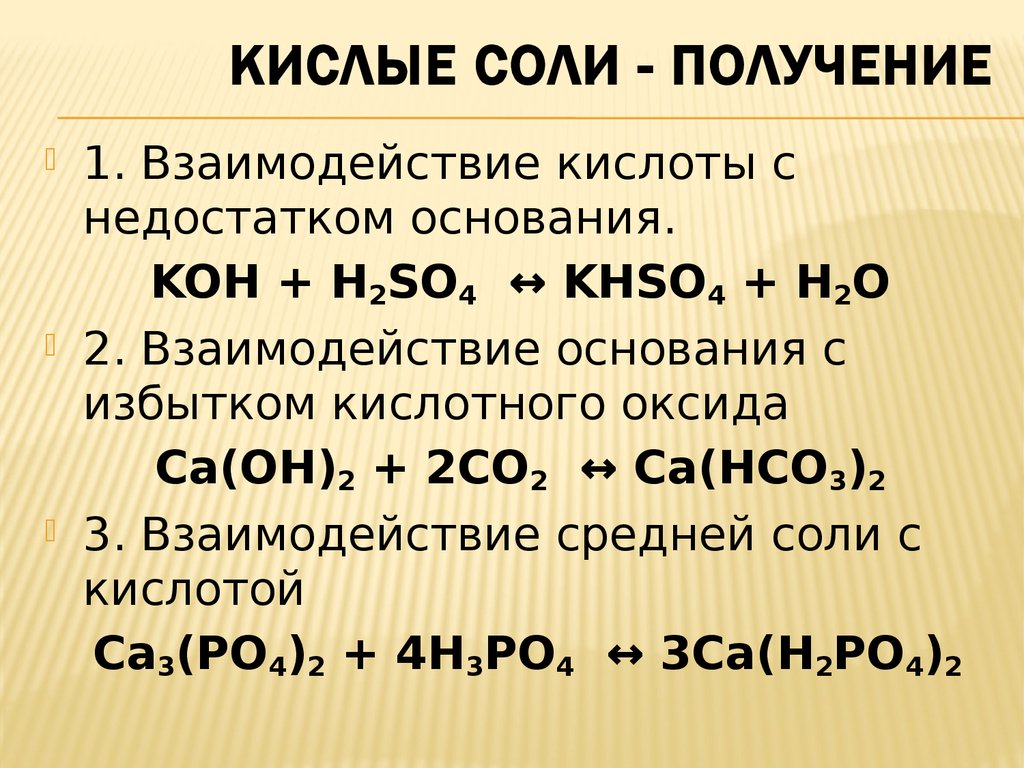 1). Оказывается, в организме рыб есть летучие амины (основания), которые нейтрализуются кислотами с образованием нелетучих солей аммония. Это уменьшает запах рыбы, а также добавляет «кисловатый» вкус, который нам, кажется, нравится.
1). Оказывается, в организме рыб есть летучие амины (основания), которые нейтрализуются кислотами с образованием нелетучих солей аммония. Это уменьшает запах рыбы, а также добавляет «кисловатый» вкус, который нам, кажется, нравится.
Рисунок 1. Реакция нейтрализации происходит между лимонной кислотой в лимонах или уксусной кислотой в уксусе и основаниями в мясе рыбы.
Маринование – это метод консервирования овощей в естественной кислой среде. Овощ, например огурец, помещают в герметичную банку, погруженную в рассол. Солевой раствор способствует росту полезных бактерий и подавляет рост вредных бактерий. Полезные бактерии питаются крахмалом в огурце и производят молочную кислоту в качестве побочного продукта в процессе, называемом ферментацией. Молочная кислота в конечном итоге повышает кислотность рассола до уровня, который убивает любые вредные бактерии, которым требуется щелочная среда. Без вредных бактерий, поедающих огурцы, они могут храниться намного дольше, чем если бы они были незащищенными. Побочный продукт процесса маринования изменяет вкус овощей, а кислота делает их кислыми.
Побочный продукт процесса маринования изменяет вкус овощей, а кислота делает их кислыми.
Соли слабых оснований и сильных кислот
При нейтрализации слабого основания сильной кислотой получается соль, содержащая сопряженную кислоту слабого основания. Эта сопряженная кислота является слабой кислотой. Например, хлорид аммония, NH 4 Cl, представляет собой соль, образованную реакцией слабого основания аммиака с сильной кислотой HCl:
[латекс] {\ text {NH}} _ {3} \ left (aq \right)+\text{HCl}\left(aq\right)\longrightarrow {\text{NH}}_{4}\text{Cl}\left(aq\right)[/latex]
9{\text{+}}[/latex] из значения константы ионизации воды, K w , и K b , константы ионизации ее сопряженного основания, NH 3 , используя следующее соотношение:[латекс] {K} _ {\ text {w}} = {K} _ {\ text {a}} \ times {K} _ {\ text {b}}[/latex]
Это соотношение выполняется для любого основания и сопряженной с ним кислоты или для любой кислоты и сопряженного с ней основания.
Пример 1: pH раствора соли слабого основания и сильной кислоты 9{\текст{+}}?[/латекс]
Показать ответ
Соли слабых кислот и сильных оснований
При нейтрализации слабой кислоты сильным основанием получается соль, содержащая сопряженное основание слабой кислоты. Это сопряженное основание обычно является слабым основанием. Например, ацетат натрия, NaCH 3 CO 2 , представляет собой соль, образованную реакцией слабокислой уксусной кислоты с сильным основанием гидроксида натрия:
[латекс] {\ text {CH}} _ {3 }{\text{CO}}_{2}\text{H}\left(aq\right)+\text{NaOH}\left(aq\right)\longrightarrow {\text{NaCH}}_{3} {\text{CO}}_{2}\left(aq\right)+{\text{H}}_{2}\text{O}\left(aq\right)[/latex] 9{\text{-}}[/латекс]. Значение K b можно рассчитать из значения константы ионизации воды, K w и K a константы ионизации сопряженной кислоты аниона по уравнению :
[латекс] {K}_{\text{w}}={K}_{\text{a}}\times {K}_{\text{b}}[/latex]
Для ион ацетата и его сопряженная кислота, мы имеем:
[латекс] {K} _ {\ text {b}} \left (\ text {for} {\ text {CH}} _ {3} {\ text {CO} }_{2}{}^{\text{-}}\right)=\frac{{K}_{\text{w}}}{{K}_{\text{a}}\left(\ text{for}{\text{CH}}_{3}{\text{CO}}_{2}\text{H}\right)}=\frac{1. {\text{-}}\right]=0,050M[/латекс] и [OH 9{\text{+}}\right][/latex] с использованием [OH − ] на заключительных этапах этой задачи.
{\text{-}}\right]=0,050M[/латекс] и [OH 9{\text{+}}\right][/latex] с использованием [OH − ] на заключительных этапах этой задачи.
Показать ответ
Равновесие в растворе соли слабой кислоты и слабого основания
a слабой кислоты и K b слабого основания. Если K a > K b , раствор кислый, а если K b > K a , раствор является основным.Пример 3: Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислыми, основными или нейтральными:
- KBr
- NaHCO 3
- NH 4 Класс
- Na 2 HPO 4
- НХ 4 F
Показать ответ
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислыми, основными или нейтральными:
- K 2 CO 3
- CaCl 2
- КН 2 Заказ на поставку 4
- (NH 4 ) 2 CO 3
- АлБр 3
Показать ответ
Ионизация гидратированных ионов металлов
Если мы измерим pH растворов различных ионов металлов, мы обнаружим, что эти ионы в растворе действуют как слабые кислоты. {3+}[/latex] также кластер: 9{\ text {+}} \ left (aq \ right) + \ text {Al} {\ left ({\ text {H}} _ {2} \ text {O} \ right)} _ {3} {\ left(\text{OH}\right)}_{3}\left(aq\right)[/latex]
{3+}[/latex] также кластер: 9{\ text {+}} \ left (aq \ right) + \ text {Al} {\ left ({\ text {H}} _ {2} \ text {O} \ right)} _ {3} {\ left(\text{OH}\right)}_{3}\left(aq\right)[/latex]
Обратите внимание, что некоторые из этих соединений алюминия проявляют амфипротное поведение, поскольку они действуют как кислоты, когда появляются на в правой части выражений равновесия и в качестве оснований, когда они появляются в левой части.
Рисунок 3. Когда ион алюминия реагирует с водой, гидратированный ион алюминия становится слабой кислотой.
Однако ионизация катиона, несущего более одного заряда, обычно не выходит за пределы первой стадии. Дополнительные примеры первой стадии ионизации гидратированных ионов металлов: 9{\text{+}}\right][/latex] до 0,10 M ?
Показать ответ
Константы различных стадий ионизации для многих ионов металлов неизвестны, поэтому мы не можем рассчитать степень их ионизации. Однако практически все гидратированные ионы металлов, кроме ионов щелочных металлов, ионизируются с образованием кислых растворов.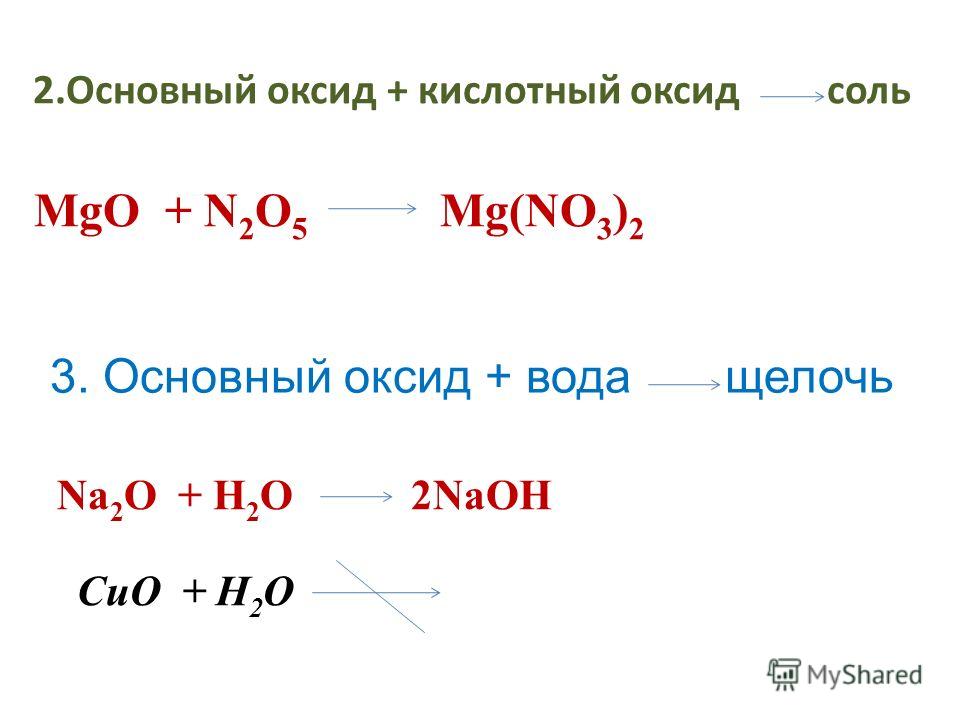 Ионизация увеличивается по мере увеличения заряда иона металла или уменьшения размера иона металла.
Ионизация увеличивается по мере увеличения заряда иона металла или уменьшения размера иона металла.
Ключевые понятия и резюме
Характерные свойства водных растворов кислот Бренстеда-Лоури обусловлены присутствием ионов гидроксония; водные растворы оснований Бренстеда-Лоури обусловлены присутствием гидроксид-ионов. Нейтрализация, происходящая при соединении водных растворов кислот и оснований, является результатом реакции ионов гидроксония и гидроксида с образованием воды. Некоторые соли, образующиеся в реакциях нейтрализации, могут сделать растворы продуктов слегка кислыми или слегка щелочными.
Растворы, содержащие соли или гидратированные ионы металлов, имеют рН, определяемый степенью гидролиза ионов в растворе. pH растворов может быть рассчитан с использованием известных методов равновесия или может быть качественно определен как кислый, основной или нейтральный в зависимости от относительных K a и K b вовлеченных ионов.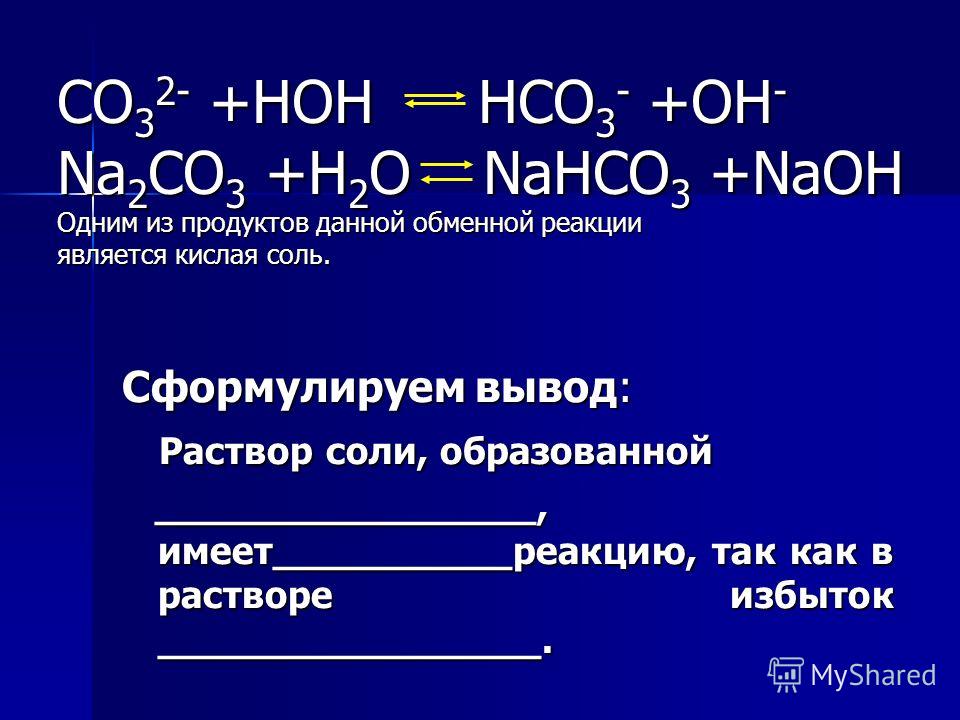
Упражнения
- Определите, являются ли водные растворы следующих солей кислыми, основными или нейтральными:
- Алюминий (№ 3 ) 3
- РбИ
- КНСО 2
- CH 3 NH 3 Br
- Определите, являются ли водные растворы следующих солей кислыми, основными или нейтральными:
- FeCl 3
- К 2 СО 3
- НХ 4 Бр
- KClO 4
- Новокаин, C 13 H 21 O 2 N 2 Cl, представляет собой соль основания прокаина и соляной кислоты. Константа ионизации прокаина составляет 7 [латекс]\раз [/латекс] 10 −6 . Раствор новокаина кислый или основной? Чему равны [H 3 O + ], [OH — ] и pH 2,0% раствора новокаина по массе, принимая плотность раствора 1,0 г/мл.
Показать выбранные ответы
Какая связь между бикарбонатом натрия и серной кислотой?
`;
Винсент Саммерс
Гидрокарбонат натрия и серная кислота являются, соответственно, кислой солью сильного основания и сильной кислоты. Взаимодействие между двумя веществами категорически называют «реакцией нейтрализации». Теоретически, объединение двух молекул бикарбоната натрия и одной молекулы серной кислоты даст одну молекулу сульфата натрия и две молекулы угольной кислоты. В действительности, однако, угольная кислота в этой среде неустойчива и поэтому не остается в растворе, а быстро диссоциирует на воду и углекислый газ, последний улетучивается в атмосферу. В целом реакция записывается 2 NaHCO 3 + H 2 SO 4 → Na 2 SO 4 + 2 H 2 O + 2 CO 2 ↑.
Серная кислота является одной из самых сильных неорганических или «минеральных» кислот. В отличие от многих других сильных кислот, таких как азотная (HNO 3 ) и соляная (HCl) кислоты, серная кислота содержит в своей структуре два атома водорода. В растворе они принимают форму ионов водорода. При замещении или нейтрализации обоих ионов водорода получается полноценная соль, как, например, сульфат калия (K 2 SO 4 ). Если, с другой стороны, замещается только один ион водорода, продукт представляет собой полусоль, иногда называемую кислой солью, в данном случае гидросульфат калия (KHSO 9).0007 4 ), возможно, более известный как бисульфат калия.
В отличие от многих других сильных кислот, таких как азотная (HNO 3 ) и соляная (HCl) кислоты, серная кислота содержит в своей структуре два атома водорода. В растворе они принимают форму ионов водорода. При замещении или нейтрализации обоих ионов водорода получается полноценная соль, как, например, сульфат калия (K 2 SO 4 ). Если, с другой стороны, замещается только один ион водорода, продукт представляет собой полусоль, иногда называемую кислой солью, в данном случае гидросульфат калия (KHSO 9).0007 4 ), возможно, более известный как бисульфат калия.
Теперь станет ясно, что бикарбонат натрия является именно такой кислой солью или полусолью и является результатом нейтрализации только одного доступного иона водорода, содержащегося в его родоначальнике, угольной кислоте (H 2 CO 3 ). Эта кислота вступает в реакцию частичной нейтрализации NaOH + H 2 CO 3 → NaHCO 3 + H 2 O, а не 2 NaOH + H 2 CO 3 → Na 7
Эта кислота вступает в реакцию частичной нейтрализации NaOH + H 2 CO 3 → NaHCO 3 + H 2 O, а не 2 NaOH + H 2 CO 3 → Na 7
80 CO
2 2 + 2 H 2 O, последний представляет собой полную нейтрализацию. Таким образом, связь между бикарбонатом натрия и серной кислотой представляет собой связь частичной нейтрализации кислой соли сильного основания сильной кислотой. Другой возможностью является частичная нейтрализация не серной кислоты, а бикарбоната натрия с получением бисульфата натрия по уравнению реакции NaHCO 3 + H 2 SO 4 → NaHSO 4 + H 2 O + CO 2 ↑. Два соединения, бикарбонат натрия и серная кислота, имеют большое промышленное значение. Серная кислота используется в производстве удобрений, стали, свинцово-кислотных аккумуляторов и для переработки нефти. Бикарбонат натрия, как правило, безопасен в обращении и полезен при ликвидации разливов кислоты, особенно разливов серной кислоты. Это также важно при приготовлении пищи, при тушении некоторых небольших пожаров, а также в гигиене и медицине. Продукт полной нейтрализации бикарбоната натрия и серной кислоты, сульфат натрия, является обильным побочным продуктом некоторых других промышленных процессов.
Серная кислота используется в производстве удобрений, стали, свинцово-кислотных аккумуляторов и для переработки нефти. Бикарбонат натрия, как правило, безопасен в обращении и полезен при ликвидации разливов кислоты, особенно разливов серной кислоты. Это также важно при приготовлении пищи, при тушении некоторых небольших пожаров, а также в гигиене и медицине. Продукт полной нейтрализации бикарбоната натрия и серной кислоты, сульфат натрия, является обильным побочным продуктом некоторых других промышленных процессов.
4.
 8: Кислотно-основная экстракция — Химия LibreTexts
8: Кислотно-основная экстракция — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 93535
- Лиза Николс
- Колледж Бьютт
Как они работают
Модификация экстракций, рассмотренных ранее в этой главе, заключается в проведении химической реакции в делительной воронке для изменения полярности и, следовательно, разделения соединения на водный и органический слои. Распространенным методом является проведение кислотно-щелочной реакции, которая может преобразовать некоторые соединения из нейтральной формы в ионную (или наоборот).
Например, представьте, что смесь бензойной кислоты и циклогексана растворяют в органическом растворителе, таком как этилацетат, в делительной воронке. +} \right) \\ \ text{Бензойная кислота} & & & & & & & \text{Бензоат натрия} & & \end{array}\]
+} \right) \\ \ text{Бензойная кислота} & & & & & & & \text{Бензоат натрия} & & \end{array}\]
Свойства растворимости карбоновых кислот существенно отличаются от их соответствующих солей карбоновых кислот. Салицилат натрия примерно в 350 раз более растворим в воде, чем салициловая кислота, из-за его ионного характера (рис. 4.55), и он довольно нерастворим в органических растворителях, таких как диэтиловый эфир.
Рисунок 4.55: Данные о растворимости в воде салициловой кислоты и салицилата натрия (ссылка 4). Таким образом, промывка \(\ce{NaOH}\) превращала бы бензойную кислоту в ее ионную карбоксилатную форму, которая затем была бы более растворимой в водном слое, позволяя экстрагировать бензоат натрия в водный слой. Циклогексан останется в органическом слое, так как он не имеет сродства к водной фазе и не может никак реагировать с \(\ce{NaOH}\). Таким способом можно разделить смесь бензойной кислоты и циклогексана (рис. 4.54б). Водный слой можно позже подкислить \(\ce{HCl} \left(aq \right)\), если это необходимо, чтобы преобразовать бензойную кислоту обратно в ее нейтральную форму.
Промывки бикарбонатом натрия
Кислотно-основная экстракция может быть использована для экстракции карбоновых кислот из органического слоя в водный слой. Как обсуждалось в предыдущем разделе, \(\ce{NaOH}\) можно использовать для превращения карбоновой кислоты в ее более водорастворимую ионную карбоксилатную форму. Однако, если смесь содержит желаемое соединение, которое может взаимодействовать с \(\ce{NaOH}\), следует использовать более мягкое основание, такое как бикарбонат натрия. Происходит аналогичная реакция:
\[\begin{array}{ccccccccccc} \ce{PhCO_2H} \left( aq \right) & + & \ce{NaHCO_3} \left( aq \right) & \rightarrow & \ce{PhCO_2Na} \left( aq \right) & + & \ce{H_2CO_3} \left( aq \right) & \rightleftharpoons & \ce{H_2O} \left( l \right) & + & \ce{CO_2} \left( g \right) \\ \text{Бензойная кислота} & & & & \text{Бензоат натрия} & & & & & & \end{array}\]
Одно отличие в использовании основания \(\ce{NaHCO_3}\) вместо \(\ce{NaOH}\) заключается в том, что побочный продукт — угольная кислота \(\left( \ce{H_2CO_3} \right)\) может разлагаться на воду и углекислый газ.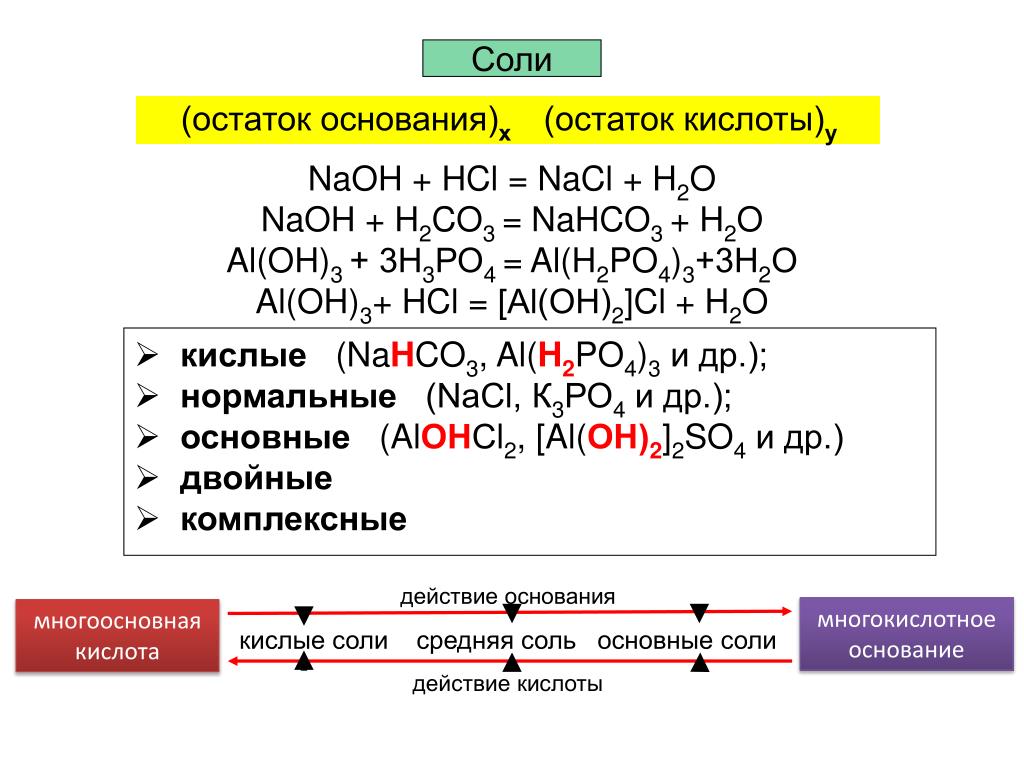 При встряхивании кислого раствора с бикарбонатом натрия в делительной воронке следует осторожно взбалтывать и чаще выпускайте воздух для сброса давления газа.
При встряхивании кислого раствора с бикарбонатом натрия в делительной воронке следует осторожно взбалтывать и чаще выпускайте воздух для сброса давления газа.
Примером реакции, в которой часто используется промывка бикарбонатом натрия при обработке, является реакция этерификации по Фишеру. Для демонстрации бензойную кислоту кипятили с обратным холодильником в этаноле вместе с концентрированной серной кислотой с образованием этилбензоата (рис. 4.56а+б). ТСХ пластины реакционной смеси при кипячении с обратным холодильником в течение 1 часа показала остаточную непрореагировавшую карбоновую кислоту (рис. 4.56c), что не редкость из-за энергетики реакции.
Рисунок 4.56: а) Реагенты кипячения с обратным холодильником, б) Схема реакции, в) ТСХ после 1 часа кипячения с обратным холодильником, где первая дорожка (ВА) представляет собой бензойную кислоту, вторая дорожка (Со) представляет собой совместное пятно и третья дорожка (Pr ) представляет собой реакционную смесь (прогоняли смесью гексан:этилацетат 1:1 и визуализировали в УФ-свете).
Остаточная карбоновая кислота может быть удалена из желаемого сложноэфирного продукта с помощью кислотно-щелочной экстракции в делительной воронке. Промывка бикарбонатом натрия превращает бензойную кислоту в ее более водорастворимую форму бензоата натрия, экстрагируя ее в водный слой (рис. 4.57). Кроме того, бикарбонат натрия нейтрализует каталитическую кислоту в этой реакции.
Рисунок 4.57: Промывка насыщенным бикарбонатом натрия для удаления остаточной карбоновой кислоты из реакционной смеси этерификации Фишера. Затем сложный эфир выделяют в органическом слое.Гидрокарбонат натрия предпочтительнее \(\ce{NaOH}\) в этом процессе, так как это гораздо более слабое основание; промывка \(\ce{NaOH}\) может вызвать гидролиз сложноэфирного продукта.
Смеси кислот и оснований
Как обсуждалось ранее, кислотно-основные свойства соединений можно использовать для селективного извлечения определенных соединений из смесей. Эту стратегию можно распространить на другие примеры 9-} \right) \\ \text{Основной амин} & & & & \text{Соль аммония} & & \end{array}\]
Извлечение карбоновых кислот по сравнению с фенолами
Как обсуждалось ранее, карбоновые кислоты могут быть экстрагируют из органического слоя в водный слой, встряхивая их с основными растворами, что превращает их в их более растворимые в воде соли. +} \right) \\ \ text{Карбоновая кислота} & & & & & & & \text{Карбоксилатная соль} & & \end{array}\]
+} \right) \\ \ text{Карбоновая кислота} & & & & & & & \text{Карбоксилатная соль} & & \end{array}\]
Аналогичная реакция происходит с фенолами \(\left( \ce{PhOH} \right)\), и они тоже могут экстрагироваться в водный слой \(\ce{NaOH}\) (рис. 4.58а).
Однако фенолы значительно менее кислые, чем карбоновые кислоты, и недостаточно кислые, чтобы полностью реагировать с \(\ce{NaHCO_3}\), более слабым основанием. Поэтому раствор бикарбоната можно использовать для разделения смесей фенолов и карбоновых кислот (рис. 4.58б).
Рис. 4.58: а) Экстракция как карбоновых кислот, так и фенолов в \(5\%\: \ce{NaOH} \left( aq \right)\), б) Экстракция только карбоновых кислот в \(5\%\ : \ce{NaHCO_3} \left( aq \right)\).Экстракция кислоты, основания и нейтральных соединений
Обсуждавшиеся ранее кислотно-основные свойства позволяют использовать смесь, содержащую кислые (например, \(\ce{RCO_2H}\)), основные (например, \(\ce{RNH_2}\)) , и нейтральные компоненты, подлежащие очистке с помощью серии экстракций, как показано на рис.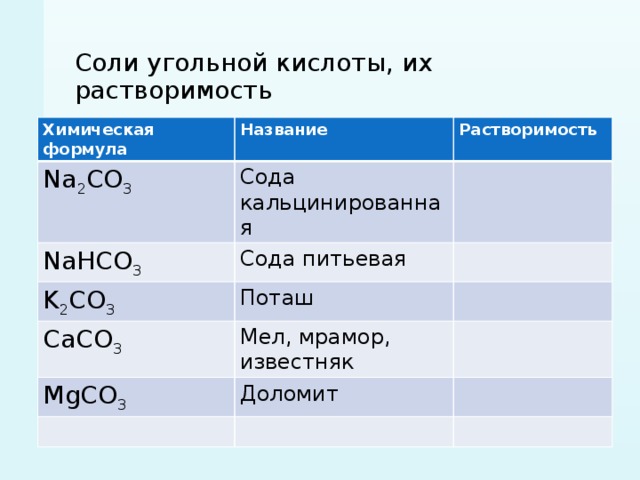 4.59 (где используется органический растворитель менее плотный, чем вода).
4.59 (где используется органический растворитель менее плотный, чем вода).
Предполагается, что читатели, проводящие эксперименты такого типа, знакомы с выполнением одиночной и многократной экстракции. В этом разделе описаны различия между общими процедурами экстракции и процессом, как показано на рис. 4.59..
- Выделение кислотного компонента:
- Когда кислый компонент находится в водном слое в колбе Эрленмейера, его можно превратить обратно в нейтральный компонент добавлением \(2 \: \text{M} \: \ce{HCl} \left( aq \ справа)\) до тех пор, пока рН раствора не станет равным 3-4 (по индикаторной бумаге). Если присутствуют большие количества кислоты, так что для подкисления потребуется слишком большой объем \(2 \: \text{M} \: \ce{HCl} \left( aq \right)\), концентрированный \(\ce{ HCl} \left( aq \right)\) вместо этого можно добавлять по каплям.
 Более низкие концентрации \(\ce{HCl} \left( aq \right)\) менее опасны, но значительное увеличение объема водного слоя повлияет на эффективность последующих этапов экстракции и фильтрации.
Более низкие концентрации \(\ce{HCl} \left( aq \right)\) менее опасны, но значительное увеличение объема водного слоя повлияет на эффективность последующих этапов экстракции и фильтрации. - После подкисления можно пойти двумя путями, в зависимости от того, является ли кислотный компонент твердым или жидким.
- Если при подкислении ионной соли образуется твердое вещество, его можно собрать с помощью вакуумной фильтрации. Этот метод следует использовать только в том случае, если видно большое количество крупных кристаллов. Если образуются мелкие кристаллы (что случается довольно часто), они забивают фильтровальную бумагу и мешают адекватному дренажу. Если наблюдается лишь небольшое количество твердого вещества по сравнению с теоретическим количеством, вероятно, соединение хорошо растворимо в воде, и фильтрация приведет к низкому извлечению.
- Если при подкислении не образуются твердые частицы (или если образуются мелкие кристаллы или небольшое количество твердых форм), экстрагируйте кислый компонент обратно в органический растворитель (\(\х3\)).
 Как правило, для экстрагирования используйте треть растворителя по сравнению с исходным слоем (например, при использовании \(100 \: \text{мл}\) водного раствора, экстрагируйте с \(33 \: \text{ мл}\) органического растворителя каждый раз). Обязательно сначала охладите водный раствор на бане со льдом перед экстракцией, если подкисление вызвало заметное нагревание. Затем промыть соляным раствором (\(\х1\)) при использовании диэтилового эфира или этилацетата, высушить осушителем и удалить растворитель с помощью роторного испарителя, чтобы оставить чистый кислый компонент.
Как правило, для экстрагирования используйте треть растворителя по сравнению с исходным слоем (например, при использовании \(100 \: \text{мл}\) водного раствора, экстрагируйте с \(33 \: \text{ мл}\) органического растворителя каждый раз). Обязательно сначала охладите водный раствор на бане со льдом перед экстракцией, если подкисление вызвало заметное нагревание. Затем промыть соляным раствором (\(\х1\)) при использовании диэтилового эфира или этилацетата, высушить осушителем и удалить растворитель с помощью роторного испарителя, чтобы оставить чистый кислый компонент.
- Когда кислый компонент находится в водном слое в колбе Эрленмейера, его можно превратить обратно в нейтральный компонент добавлением \(2 \: \text{M} \: \ce{HCl} \left( aq \ справа)\) до тех пор, пока рН раствора не станет равным 3-4 (по индикаторной бумаге). Если присутствуют большие количества кислоты, так что для подкисления потребуется слишком большой объем \(2 \: \text{M} \: \ce{HCl} \left( aq \right)\), концентрированный \(\ce{ HCl} \left( aq \right)\) вместо этого можно добавлять по каплям.
- Изоляция базового компонента:
- Используйте тот же процесс, что и при выделении кислотного компонента, за исключением того, что подщелачивайте раствор с помощью \(2 \: \text{M} \: \ce{NaOH} \left( aq \right)\) до тех пор, пока не будет получено значение pH 9-10, как определено индикаторной бумагой.
- Изоляция нейтрального компонента:
- Нейтральный компонент будет «остаточным» соединением в органическом слое.
 Чтобы изолировать, промойте соляным раствором (\(\х1\)) при использовании диэтилового эфира или этилацетата, высушите осушителем и удалите растворитель с помощью роторного испарителя, чтобы оставить чистый нейтральный компонент.
Чтобы изолировать, промойте соляным раствором (\(\х1\)) при использовании диэтилового эфира или этилацетата, высушите осушителем и удалите растворитель с помощью роторного испарителя, чтобы оставить чистый нейтральный компонент.
- Нейтральный компонент будет «остаточным» соединением в органическом слое.
Эта страница под названием 4.8: Acid-Base Extraction распространяется под лицензией CC BY-NC-ND 4.0 и была создана, изменена и/или курирована Лизой Николс с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами LibreTexts. Платформа; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Лиза Николс
- Лицензия
- CC BY-NC-ND
- Версия лицензии
- 4,0
- Показать страницу Оглавление
- нет на странице
- Теги
- источник@https://organiclabtechniques.
 weebly.com/
weebly.com/
- источник@https://organiclabtechniques.
НАТРИЯ БИКАРБОНАТ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора включают общие идентификационные номера, алмаз NFPA Знаки опасности Министерства транспорта США и общий описание хим. Информация в CAMEO Chemicals поступает из множества источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | USCG КРИС Код | г.
|---|---|---|---|
| никто | данные недоступны | никто |
| Карманный справочник NIOSH | Международная карточка химической безопасности | ||
| никто |
| ||
NFPA 704
данные недоступны
Общее описание
ФИЗИЧЕСКОЕ ОПИСАНИЕ: Белый кристаллический порошок или комки без запаха. Слабощелочной (горький) вкус. рН (свежеприготовленного 0,1 молярного водного раствора): 8,3 при 77°F. рН (насыщенного раствора): 8-9. Нетоксичный.
Слабощелочной (горький) вкус. рН (свежеприготовленного 0,1 молярного водного раствора): 8,3 при 77°F. рН (насыщенного раствора): 8-9. Нетоксичный.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
нет
Реакции с воздухом и водой
Стабилен в сухом воздухе, но медленно разлагается во влажном воздухе. Умеренно растворим в воде. Медленно разлагается в воде (ускоряется при перемешивании) (NTP, 1992).
Пожароопасность
В литературных источниках указано, что это химическое вещество является негорючим. (НТП, 1992)
Опасность для здоровья
СИМПТОМЫ: Симптомы воздействия этого соединения включают раздражение кожи, глаз, носа и горла, кашель, дискомфорт в груди и желудочно-кишечные расстройства. Это может вызвать вздутие или разрыв желудка, системный алкалоз, отек и увеличение объема внеклеточной жидкости. Тяжелый алкалоз может характеризоваться повышенной раздражительностью и тетанией. Это может вызвать отек головного мозга, ведущий к смерти. Это также может привести к повреждению почек.
Это может вызвать вздутие или разрыв желудка, системный алкалоз, отек и увеличение объема внеклеточной жидкости. Тяжелый алкалоз может характеризоваться повышенной раздражительностью и тетанией. Это может вызвать отек головного мозга, ведущий к смерти. Это также может привести к повреждению почек.
ОСТРАЯ/ХРОНИЧЕСКАЯ ОПАСНОСТЬ: При нагревании до разложения это соединение выделяет токсичные пары монооксида углерода, диоксида углерода и оксидов натрия. (НТП, 1992 г.)
Профиль реактивности
БИКАРБОНАТ НАТРИЯ экзотермически реагирует с кислотами с образованием нетоксичного газообразного диоксида углерода. Разлагается при нагревании. Несовместим с кислотами, кислыми солями (допамина гидрохлорид, пентазоцин лактат, многие соли алкалоидов), аспирином и салицилатом висмута.
Принадлежит к следующей реакционной группе(ам)
- Карбонатные соли
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа
включают в себя расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных
источники данных.
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Информация отсутствует.
Пожаротушение
Пожары, связанные с этим материалом, можно тушить с помощью сухих химикатов, двуокиси углерода или галоновых огнетушителей. Также можно использовать распылитель воды. (НТП, 1992)
Непожарное реагирование
НЕБОЛЬШИЕ РАЗЛИВЫ И УТЕЧКИ: Если вы пролили это химическое вещество, вам следует смочить твердый разлитый материал водой, а затем переместить смоченный материал в подходящий контейнер. Используйте впитывающую бумагу, смоченную водой, чтобы собрать оставшийся материал. Запечатайте загрязненную одежду и впитывающую бумагу в паронепроницаемый пластиковый пакет для возможной утилизации. Вымойте все загрязненные поверхности мыльным раствором. Не возвращайтесь в загрязненную зону до тех пор, пока сотрудник службы безопасности (или другое ответственное лицо) не убедится, что зона была должным образом очищена.
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ХРАНЕНИИ: Этот химикат следует хранить в холодильнике и защищать от влаги. Если возможно, было бы целесообразно хранить это соединение в инертной атмосфере. (НТП, 1992 г.)
Защитная одежда
РЕКОМЕНДУЕМЫЙ РЕСПИРАТОР: При хранении, взвешивании и разбавлении неразбавленного испытуемого химического вещества надевайте одобренный полулицевой респиратор, оснащенный картриджем с органическими парами/кислым газом (специально для органических паров, HCl, кислого газа и SO2) с пыле/туманный фильтр. (НТП, 1992)
DuPont Tychem® Suit Fabrics
Информация отсутствует.
Первая помощь
ГЛАЗА: Сначала проверьте наличие у пострадавшего контактных линз и снимите их, если они есть. Промывать глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно звоня в больницу или токсикологический центр. Не закапывайте в глаза пострадавшему какие-либо мази, масла или лекарства без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.
НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.
КОЖА: НЕМЕДЛЕННО промойте пораженные участки кожи водой, сняв и изолировав всю загрязненную одежду. Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
ПРИ ВДЫХАНИИ: НЕМЕДЛЕННО покинуть зараженную зону; сделать глубокий вдох свежего воздуха. При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы доставить пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, входящим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
ПРОГЛАТЫВАНИЕ: Если пострадавший находится в сознании и у него нет конвульсий, дайте 1 или 2 стакана воды, чтобы разбавить химическое вещество, и НЕМЕДЛЕННО позвоните в больницу или в токсикологический центр. Будьте готовы доставить пострадавшего в больницу, если это будет рекомендовано врачом. Если пострадавший находится в судорогах или без сознания, ничего не давать ртом, убедиться, что дыхательные пути пострадавшего открыты, и уложить пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992)
Физические свойства
Что это за информация?
Поля физических свойств включают в себя такие свойства, как давление пара и температура кипения, а также пределы взрываемости и пороги токсического воздействия Информация в CAMEO Chemicals поступает из различных источников. источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: Разлагается при 228°F (NTP, 1992)
Давление пара: данные отсутствуют
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес:
2. 159
(NTP, 1992)
159
(NTP, 1992)
Температура кипения: данные отсутствуют
Молекулярная масса: 84.01 (НТП, 1992)
Растворимость в воде: 1 из 10 % при 77°F (НТП, 1992)
Энергия/потенциал ионизации: данные недоступны
IDLH: данные недоступны
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитного действия)
| Химические вещества | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Бикарбонат натрия (144-55-8) | 13 мг/м3 | 140 мг/м3 | 840 мг/м3 |
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).

 Щелочные и щелочноземельные металлы не реагируют с солями, как с водой.Например, при взаимодействии сульфата меди с железом медь замещается железом, так как железо является более активным металлом, чем медь, и в электрохимическом ряду напряжений находится левее водорода.CuSO4 + Fe → FeSO4 + Cu↓
Щелочные и щелочноземельные металлы не реагируют с солями, как с водой.Например, при взаимодействии сульфата меди с железом медь замещается железом, так как железо является более активным металлом, чем медь, и в электрохимическом ряду напряжений находится левее водорода.CuSO4 + Fe → FeSO4 + Cu↓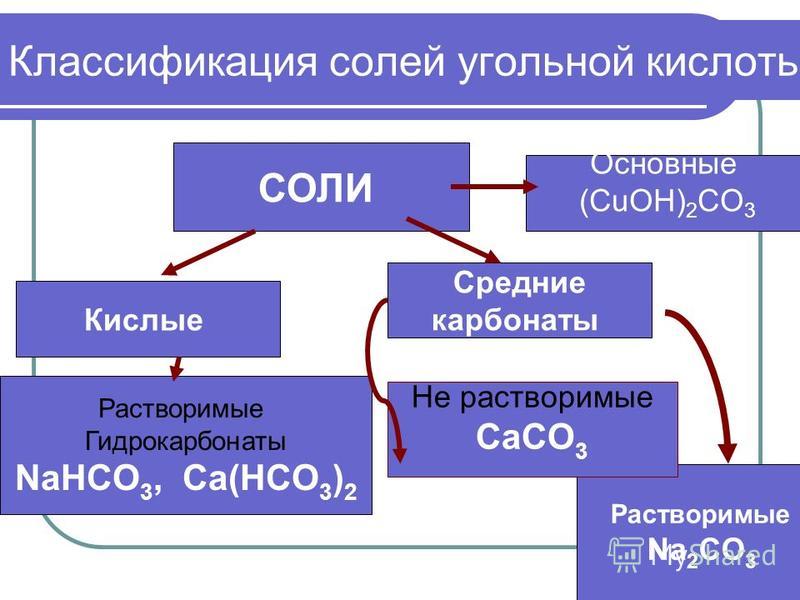 В следующей реакции происходит взаимодействие хлорида бария и серной кислоты. Продуктами реакции являются нерастворимая соль и сильная кислота. Эта реакция является качественной для сульфатов, так как образуется белый осадок сульфата бария.BaCl2 + h3SO4 → BaSO4↓ + 2HCl
В следующей реакции происходит взаимодействие хлорида бария и серной кислоты. Продуктами реакции являются нерастворимая соль и сильная кислота. Эта реакция является качественной для сульфатов, так как образуется белый осадок сульфата бария.BaCl2 + h3SO4 → BaSO4↓ + 2HCl Щелочные металлы не следует использовать в таких реакциях, так как они реагируют в основном с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, в таких условиях может произойти взрыв.В результате этой реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.2KHSO4 + Mg → h3↑ + MgSO4 + K2SO4
Щелочные металлы не следует использовать в таких реакциях, так как они реагируют в основном с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, в таких условиях может произойти взрыв.В результате этой реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.2KHSO4 + Mg → h3↑ + MgSO4 + K2SO4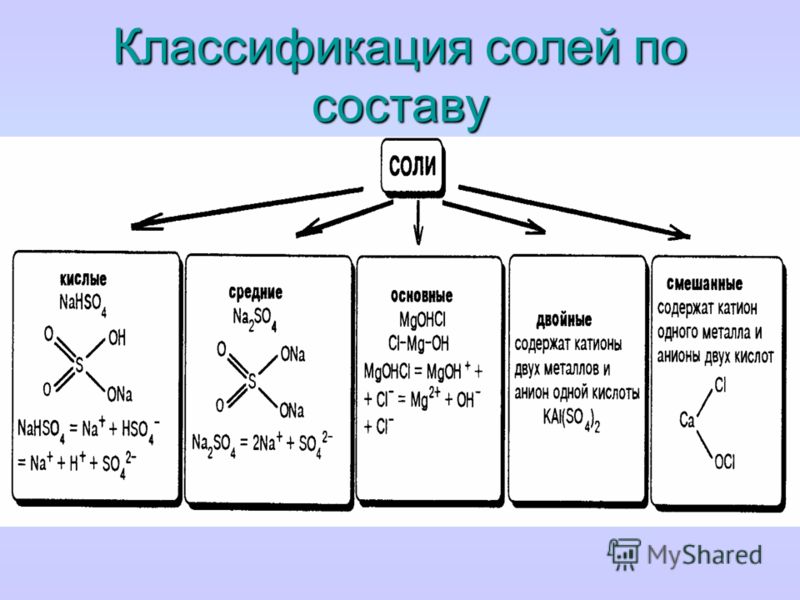 2KHS + h3SO4 → K2SO4 + 2h3S
2KHS + h3SO4 → K2SO4 + 2h3S Al(OH)2Ch4COO → Al(OH)2+ + Ch4COO—
Al(OH)2Ch4COO → Al(OH)2+ + Ch4COO— K4Fe(CN)6 → 4K+ + Fe(CN)64—Сложные ионы, в свою очередь, диссоциируют как слабые электролиты многоступенчато и обратимо. Это вторичная диссоциация сложных ионов.Fe(CN)63— ⟷ Fe(CN)52— + CN—
K4Fe(CN)6 → 4K+ + Fe(CN)64—Сложные ионы, в свою очередь, диссоциируют как слабые электролиты многоступенчато и обратимо. Это вторичная диссоциация сложных ионов.Fe(CN)63— ⟷ Fe(CN)52— + CN— NaAl(OH)4 → NaAlO2 + 2h3O
NaAl(OH)4 → NaAlO2 + 2h3O
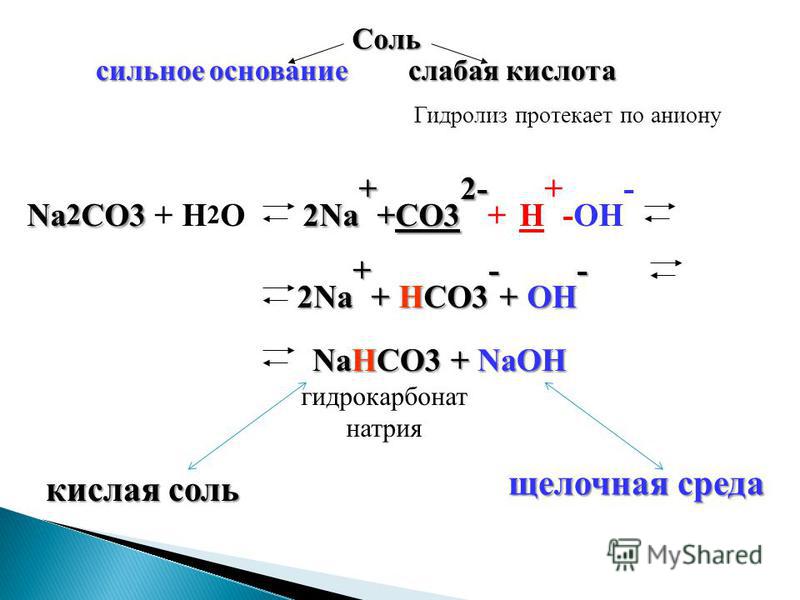 При смешивании с водой он быстро схватывается с образованием дигидрата сульфата кальция, то есть гипса.
При смешивании с водой он быстро схватывается с образованием дигидрата сульфата кальция, то есть гипса. 4.
4. Это важно, чтобы продлить контакт препарата с пораженной слизистой оболочкой.
Это важно, чтобы продлить контакт препарата с пораженной слизистой оболочкой. 
 Сода может быть опасно для людей с гиперацидным гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, а также для детей с недостаточно развитыми защитными механизмами пищеварительной системы6.
Сода может быть опасно для людей с гиперацидным гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, а также для детей с недостаточно развитыми защитными механизмами пищеварительной системы6.  У больных с заболеваниями сердца он провоцирует появление отеков и развитие сердечной недостаточности2.
У больных с заболеваниями сердца он провоцирует появление отеков и развитие сердечной недостаточности2. 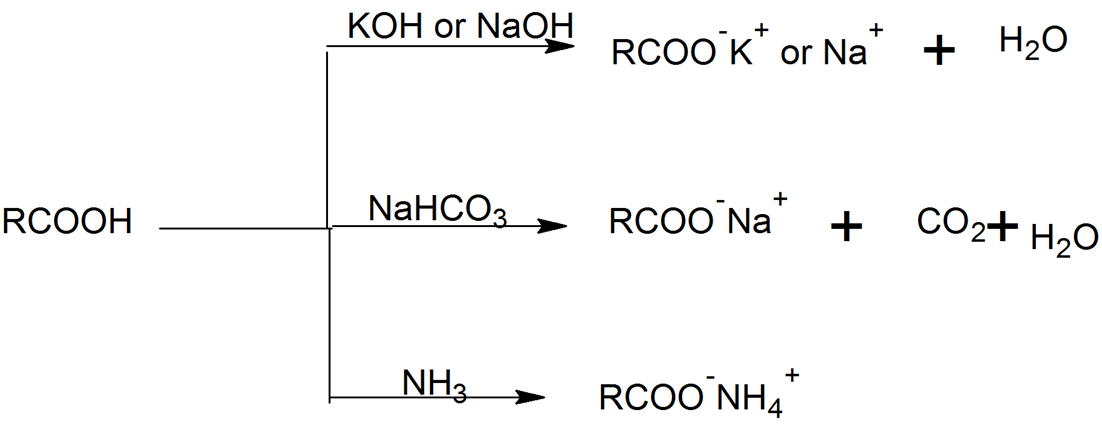

 Из-за присутствия дополнительных ионов OH – , образующихся при гидролизе его бикарбонат-иона (HCO 3 – ).
Из-за присутствия дополнительных ионов OH – , образующихся при гидролизе его бикарбонат-иона (HCO 3 – ). В настоящее время этот термин вышел из общего употребления.
В настоящее время этот термин вышел из общего употребления. 3.2 Медицинское применение
3.2 Медицинское применение Он имеет pK a 6,3 в воде, что делает водные растворы слабощелочными:
Он имеет pK a 6,3 в воде, что делает водные растворы слабощелочными: Преобразование происходит быстро при 200 °C:
Преобразование происходит быстро при 200 °C: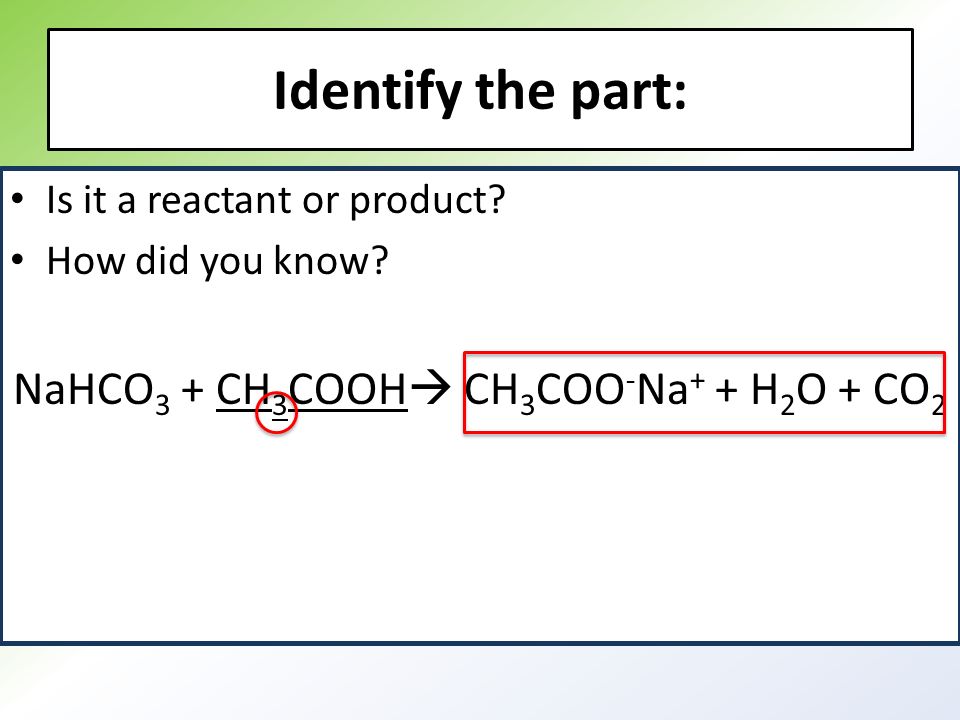 Кислотные соединения, вызывающие эту реакцию, включают винный камень, лимонный сок, йогурт и т. д., поэтому разрыхлитель можно заменить бикарбонатом натрия при условии, что в рецепт также добавлено достаточное количество кислотного реагента. [2] . Многие формы разрыхлителя содержат бикарбонат натрия в сочетании с винным камнем.
Кислотные соединения, вызывающие эту реакцию, включают винный камень, лимонный сок, йогурт и т. д., поэтому разрыхлитель можно заменить бикарбонатом натрия при условии, что в рецепт также добавлено достаточное количество кислотного реагента. [2] . Многие формы разрыхлителя содержат бикарбонат натрия в сочетании с винным камнем.
 [3]
[3] 


 [4]
[4]  9 Может ли пищевая сода остановить глобальное потепление?. Новости CNet (2007). Проверено 30 декабря 2007 г.
9 Может ли пищевая сода остановить глобальное потепление?. Новости CNet (2007). Проверено 30 декабря 2007 г.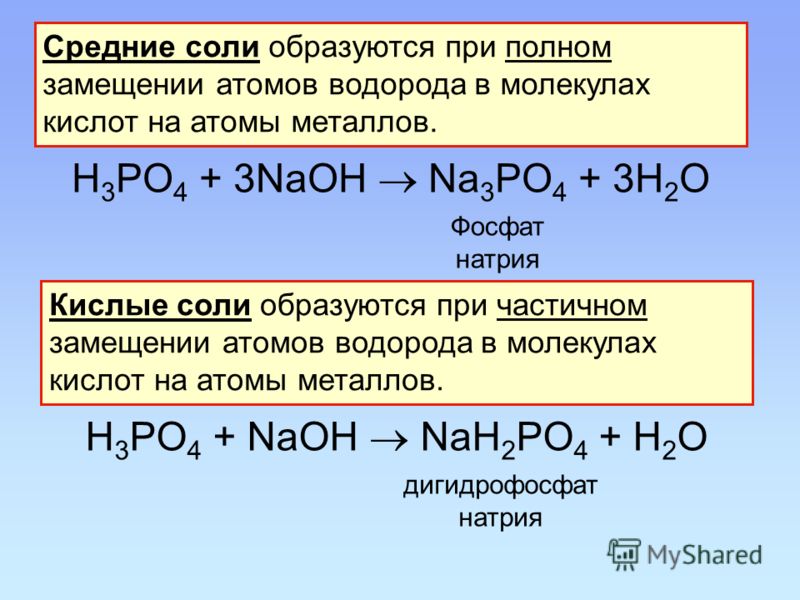 ) и NaOH ( вод. }\left(aq\right)+\text{NaOH}\left(aq\right)\rightleftharpoons \text{NaCl}\left(aq\right)+{\text{H}}_{2}\text{ О}\влево(л\вправо)[/латекс]
) и NaOH ( вод. }\left(aq\right)+\text{NaOH}\left(aq\right)\rightleftharpoons \text{NaCl}\left(aq\right)+{\text{H}}_{2}\text{ О}\влево(л\вправо)[/латекс] Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и сопряженное основание имеют неравную силу, раствор может быть либо кислым, либо основным, в зависимости от относительной силы двух конъюгатов. Иногда слабая кислота и слабое основание будут иметь одинаковую силу , поэтому их соответствующие сопряженные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным. Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, в таблице 9Необходимо сравнить 1192 K значений сопряженных величин.
Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и сопряженное основание имеют неравную силу, раствор может быть либо кислым, либо основным, в зависимости от относительной силы двух конъюгатов. Иногда слабая кислота и слабое основание будут иметь одинаковую силу , поэтому их соответствующие сопряженные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным. Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, в таблице 9Необходимо сравнить 1192 K значений сопряженных величин. Более низкие концентрации \(\ce{HCl} \left( aq \right)\) менее опасны, но значительное увеличение объема водного слоя повлияет на эффективность последующих этапов экстракции и фильтрации.
Более низкие концентрации \(\ce{HCl} \left( aq \right)\) менее опасны, но значительное увеличение объема водного слоя повлияет на эффективность последующих этапов экстракции и фильтрации.