Хлорид калия — Википедия
Материал из Википедии — свободной энциклопедии
Хлори́д ка́лия — химическое соединение, формула KCl, калиевая соль соляной кислоты.
Образует белое кристаллическое вещество без запаха. Относится к структурному типу NaCl. В природе встречается в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
Получение
Лабораторное
В лабораторных условиях хлорид калия можно получить взаимодействием гидроксида калия с соляной кислотой:
- K O H + H C l → K C l + H 2 O {\displaystyle {\mathsf {KOH+HCl\rightarrow KCl+H_{2}O}}}
Из сильвинита nNaCl + mKCl
Хлорид калия получают из сильвинита методами галургии и флотации.
Галургический метод основан на различной растворимости KCl и NaCl в воде при повышенных температурах. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовится насыщенный раствор обеих солей, затем он нагревается, и сильвинит обрабатывается полученным раствором. В процессе обработки раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Кристаллы отделятся на центрифугах и сушатся, а маточный раствор идет на обработку новой порции сильвинита.
Флотационный метод заключается в разделении минералов измельченной руды на основе различной их способности удерживаться на границе раздела фаз в жидкой среде.
Применение
Для медицинского воздействия на организм человека
Действие на организм человека. Калий — основной внутриклеточный ион, играющий важную роль в регулировании функций организма.
Показания. Нарушение сердечного ритма, интоксикация после введения сердечных гликозидов и диуретиков, недостаток калия в организме.
Фармакологическое действие хлорида калия. Нормализующее кислотно-щелочное состояние, восполняющее дефицит калия. Активирует многие цитоплазматические ферменты, регулирует внутриклеточное осмотическое давление, синтез белка, транспорт аминокислот, проведение нервных импульсов, сокращение скелетных мышц. Ионы калия понижают частоту сердечных сокращений, сократительную активность, проводимость, автоматизм и возбудимость миокарда. В малых дозах они расширяют коронарные сосуды, в больших — сужают. Калий способствует повышению содержания ацетилхолина и возбуждению симпатического отдела ЦНС. Оказывает умеренное диуретическое действие. Увеличение уровня калия снижает риск развития токсического действия сердечных гликозидов на сердце. Калия хлорид после приёма внутрь легко и практически в любом количестве пассивно абсорбируется. В подвздошной и толстой кишках калий выделяется в просвет кишок по принципу сопряженного обмена с ионами натрия и выводится с фекалиями (10 %). Распределение калия в организме продолжается около 8 часов с момента приёма: период полувыведения в фазе абсорбции — 1,31 часа; время высвобождения из таблеток (ретард) составляет 6 часов.
В сельском хозяйстве, технике и др.
Хлорид калия является наиболее распространённым калийным удобрением. Согласно ГОСТ 4568-95 содержание активного вещества в пересчёте на K2O в 1-м сорте — не менее 60 %, во 2-м — не менее 58 %, воды — не более 0,5 %.
Применяется для производства гидроксида калия методом электролиза. Иногда применяется в качестве добавки (E508) к поваренной соли (так называемая «соль с пониженным содержанием натрия»).
При строительстве и ремонте скважин, хлорид калия используют в качестве ингибирующего компонента бурового раствора[источник не указан 1233 дня]
.На кристаллах хлорида калия возможно формирование голограмм[1].
В ряде штатов США входит в состав инъекции при смертной казни[2].
Будучи наиболее доступной в быту (удобрение) солью калия, чей изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет, удобен для проверки работы бытовых дозиметров: даже небольшая навеска соли, расположенная непосредственно рядом с окошком счётчика Гейгера даёт радиоактивный фон на уровне около 30 микрорентген/час, т. е. вдвое выше обычного.
Примечания
Ссылки
| Температура | гр/100,00 гр воды | гр/100,00 гр этанола | гр/100,00 гр метанола | гр/100,00 гр глицерина | гр/100,00 гр фурфурола | гр/100,00 гр этиленгликоля | гр/100,00 гр муравьиной кислоты 95% | гр/100,00 гр уксусной кислоты | гр/100,00 гр пропанола | гр/100,00 гр гидразина | гр/100,00 гр ацетамида | гр/100,00 гр диметилформамида | гр/100,00 гр N-метилформамида | гр/100,00 гр формамида |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0°C 273,15 K | 27,78 | |||||||||||||
| 10°C 283,15 K | 30,91 | |||||||||||||
| 15°C 288,15 K | ~32,5 | 0,0265 | ||||||||||||
| 20°C 293,15 K | 34,03 | ~0,03 | 19,4 | 0,195 | 9 | |||||||||
| 25°C 298,15 K | 36,01 | 0,0288 | 0,54 | 6,7 | 0,073 | 5,18 | ~0,21 | 0,004 | 2,45 | 0,05 | 2,1 | 6,2 | ||
| 30°C 303,15 K | 37,47 | ~0,03 | 0,56 | ~0,22 | ||||||||||
| 40°C 313,15 K | 40,31 | 0,0325 | 0,60 | ~0,24 | ||||||||||
| 50°C 323,15 K | 43,05 | 0,039 | 0,63 | ~0,26 | ||||||||||
| 60°C 333,15 K | 45,64 | ~0,04 | 0,67 | 0,285 | ||||||||||
| 70°C 343,15 K | 48,33 | ~0,04 | ~0,34 | |||||||||||
| 80°C 353,15 K | 50,85 | 0,049 | ~0,40 | |||||||||||
| 90°C 363,15 K | 53,82 | 0,457 | ||||||||||||
| 100°C 373,15 K | 56,37 |
 |
 |
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Внешний вид:
бесцветн. кубические кристаллы |

|
Хлорид калия — Википедия. Что такое Хлорид калия
Хлори́д ка́лия — химическое соединение, формула KCl, калиевая соль соляной кислоты.
Образует белое кристаллическое вещество без запаха. Относится к структурному типу NaCl. В природе встречается в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
Получение
Лабораторное
В лабораторных условиях хлорид калия можно получить взаимодействием гидроксида калия с соляной кислотой:
- K O H + H C l → K C l + H 2 O {\displaystyle {\mathsf {KOH+HCl\rightarrow KCl+H_{2}O}}}
Из сильвинита nNaCl + mKCl
Хлорид калия получают из сильвинита методами галургии и флотации.
Галургический метод основан на различной растворимости KCl и NaCl в воде при повышенных температурах. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовится насыщенный раствор обеих солей, затем он нагревается, и сильвинит обрабатывается полученным раствором. В процессе обработки раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Кристаллы отделятся на центрифугах и сушатся, а маточный раствор идет на обработку новой порции сильвинита.
Флотационный метод заключается в разделении минералов измельченной руды на основе различной их способности удерживаться на границе раздела фаз в жидкой среде.
Применение
Для медицинского воздействия на организм человека
Действие на организм человека. Калий — основной внутриклеточный ион, играющий важную роль в регулировании функций организма.
Показания. Нарушение сердечного ритма, интоксикация после введения сердечных гликозидов и диуретиков, недостаток калия в организме.
Фармакологическое действие хлорида калия. Нормализующее кислотно-щелочное состояние, восполняющее дефицит калия. Активирует многие цитоплазматические ферменты, регулирует внутриклеточное осмотическое давление, синтез белка, транспорт аминокислот, проведение нервных импульсов, сокращение скелетных мышц. Ионы калия понижают частоту сердечных сокращений, сократительную активность, проводимость, автоматизм и возбудимость миокарда. В малых дозах они расширяют коронарные сосуды, в больших — сужают. Калий способствует повышению содержания ацетилхолина и возбуждению симпатического отдела ЦНС. Оказывает умеренное диуретическое действие. Увеличение уровня калия снижает риск развития токсического действия сердечных гликозидов на сердце. Калия хлорид после приёма внутрь легко и практически в любом количестве пассивно абсорбируется. В подвздошной и толстой кишках калий выделяется в просвет кишок по принципу сопряженного обмена с ионами натрия и выводится с фекалиями (10 %). Распределение калия в организме продолжается около 8 часов с момента приёма: период полувыведения в фазе абсорбции — 1,31 часа; время высвобождения из таблеток (ретард) составляет 6 часов.
В сельском хозяйстве, технике и др.
Хлорид калия является наиболее распространённым калийным удобрением. Согласно ГОСТ 4568-95 содержание активного вещества в пересчёте на K2O в 1-м сорте — не менее 60 %, во 2-м — не менее 58 %, воды — не более 0,5 %.
Применяется для производства гидроксида калия методом электролиза. Иногда применяется в качестве добавки (E508) к поваренной соли (так называемая «соль с пониженным содержанием натрия»).
При строительстве и ремонте скважин, хлорид калия используют в качестве ингибирующего компонента бурового раствора[источник не указан 1217 дней].
На кристаллах хлорида калия возможно формирование голограмм[1].
В ряде штатов США входит в состав инъекции при смертной казни[2].
Будучи наиболее доступной в быту (удобрение) солью калия, чей изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет, удобен для проверки работы бытовых дозиметров: даже небольшая навеска соли, расположенная непосредственно рядом с окошком счётчика Гейгера даёт радиоактивный фон на уровне около 30 микрорентген/час, т. е. вдвое выше обычного.
Примечания
Ссылки
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
В предыдущей главе, вы уже могли заметить, что атомы, группируясь друг с другом, не обязательно образуют двухатомные молекулы, т.е. соединяются в соотношении один к одному. В молекуле воды, например, к одному атома кислорода прикрепляется два атома водорода. Количество связей, которые атом химического элемента образует с другими атомами, называется его валентностью.
Обозначается валентность римскими цифрами — I,II, III и т.д. в соответствии со своим значением. Давайте в качестве примера рассмотрим такие соединения как хлороводород HCl, воду Н2О, аммиак NH3 и метан CH4. Смотри рисунок 7.
 Рисунок 7. Трехмерные модели молекул HCl (a), H2O (б), NH3 (в) и CH4 (г)
Рисунок 7. Трехмерные модели молекул HCl (a), H2O (б), NH3 (в) и CH4 (г)
Если схематично изобразить строение этих молекул, обозначая атомы химических элементов соответствующими им символами, а связь между ними отрезком,
получаются формулы следующего вида, называемые структурными:
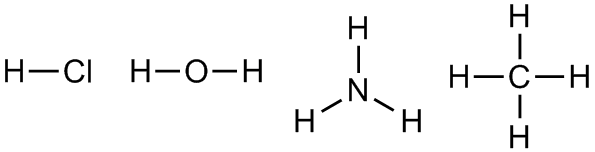 Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Из представленных на рисунке ХХ структурных формул можно сделать вывод о том, что валентность водорода и хлора равна I, кислорода II, азота — III, углерода -IV.
Валентность химических элементов в соединениях принято указывать надстрочным индексом справа от символа химического элемента, либо над ним, как, например, это сделано ниже:
Для некоторых элементов характерна постоянная валентность, то есть в соединениях их валентность равна всегда одному и тому же числу.
Так, например, постоянная валентность, равная единице, наблюдается для ряда металлов, называемых щелочными — лития, натрия, калия, рубидия и цезия, Постоянная валентность, равная двум, наблюдается у кислорода, магния, кальция, стронция, бария, цинка. Постоянная валентность равная трем наблюдается у алюминия Al.
Элементы с переменной валентностью — это элементы, которые в разных соединениях могут иметь различные значения валентности. Следовательно, атомы этих элементов в разных соединениях могут образовывать различное число химических связей (таблица 2).
Таблица 2. Наиболее характерные значения валентности некоторых элементов
Химические элементы | Их основные валентности |
Cl, Br, I | I, III, V, VII |
S, Se | II, IV, VI |
C, Si, Sn, Pb | II, IV |
P | III, V |
Cu | I, II |
Fe | II, III |
Cr | II, III, VI |
Часто в определении валентности таких элементов в каждом отдельном случае может помочь так называемое правило валентности, согласно которому, в соединениях, образованных только двумя химическими элементами практически всегда произведение валентности одного химического элемента на количество его атомов в молекуле равно произведению валентности на количество атомов в молекуле второго элемента. Другими словами для вещества формулу которого в общем виде можно записать как AxBy с валентностями элементов А и В равными n и m соответсвенно, справедливо выражение:
X*n = y*m
Давайте в качестве примера установим валентность серы в соединениях SO2 (диоксид серы) и Al2S3 (сульфид алюминия). Как уже было сказано выше, кислород и алюминий являются элементами с постоянными валентностями. Для кислорода валентность во всех его соединениях равна двум, а алюминия трем.
Рассчитаем валентность серы в диоксиде серы обозначив ее как «х»:
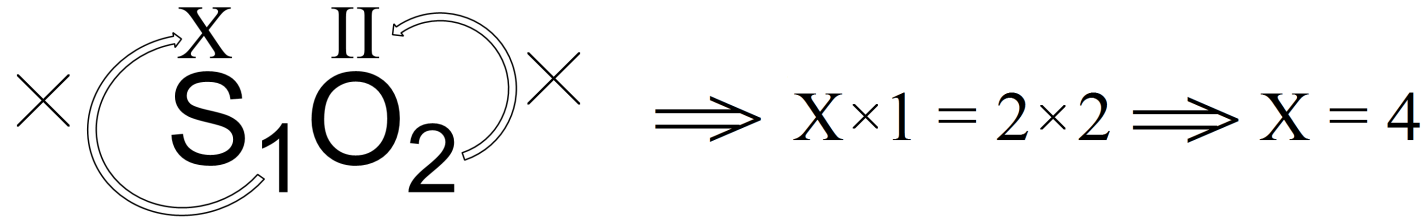
Аналогично рассчитаем валентность серы в сульфиде алюминия:
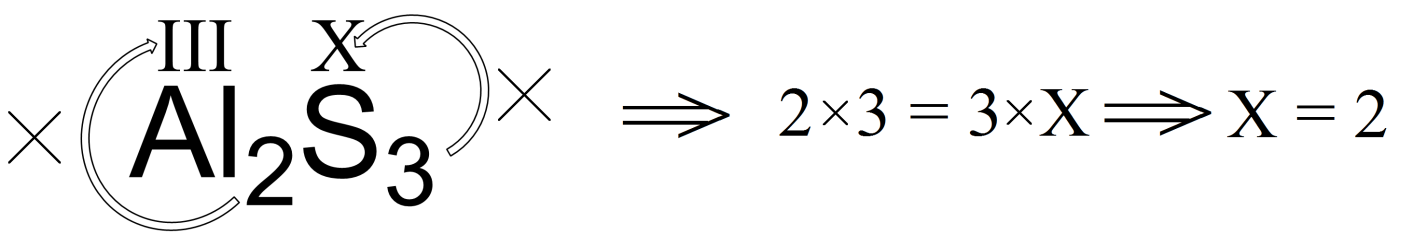
Следует отметить, что правило валентности не применимо для некоторых соединений, в которых есть связи между атомами одного химического элемента. В частности, нельзя использовать правило валентности в случе такого соединения как перекись водорода поскольку его структурную формулу можно записать как Н-О-О-Н, то есть в каждой молекуле данного соединения есть связь кислород-кислород.
Очевидно, что правило валентности может быть использовано не только для нахождения валентности какого-либо элемента, но также и для составления формулы соединения, если известны валентности образующих его элементов.
Рассмотрим в качестве примера следующую задачу:
«Определите формулу соединения образованного атомами хлора и кислорода, если валентность хлора в данном соединении VII »
Решение:
Кислород имеет только одно значение валентности, равное двум, соответственно можем записать:

Наименьшее общее кратное (НОК) чисел 7 и 2 равно 14.
Индекс, относящийся к хлору, будет равен х = 14:7 = 2,
Индекс, относящийся к кислороду, будет равен y = 14:2 = 7.
Т.е. искомая формула Cl2O7.
Следует отметить тот факт, что в большинстве сложных веществ атомы одного химического друг с другом не связаны, например:
 Рисунок 9. Структурные формулы молекул фосфорной кислоты, фосфина, серной кислоты и оксида хлора (VII)
Рисунок 9. Структурные формулы молекул фосфорной кислоты, фосфина, серной кислоты и оксида хлора (VII)
формула и структура. Химическая формула хлорида калия — KCl, а его молярная масса — 74,55 г / моль. Он имеет подобную кристаллическую структуру как хлорид натрия (NaCl). Его химическая структура показана ниже, в которой каждая молекула KCl состоит из одного катиона калия (K + ) и одного хлорид-аниона (Cl — ).
Происшествие: встречается в природе как минерал сильвит.Это также найдено естественно как смесь с хлоридом натрия в минерале, названном сильвинитом. Он также присутствует в морской воде.
Подготовка: KCl обычно получают добычей полезных ископаемых с последующей экстракцией. Это также извлечено из рассола (соленая вода). Он также может быть приготовлен в лаборатории в небольших масштабах путем взаимодействия гидроксида калия (KOH) с соляной кислотой (HCl).
KOH + HCl → KCl + H 2 O
Физические свойства: KCl — белое кристаллическое вещество без запаха, с плотностью 1.98 г / мл, температура плавления 770 ° С и температура кипения 1420 ° С.
Химические свойства: KCl хорошо растворяется в воде и различных полярных растворителях и нерастворим во многих органических растворителях. KCl растворяется в воде и полностью ионизируется в сольватированные ионы K + и Cl — . Таким образом, водные растворы KCl демонстрируют электропроводность, что делает KCl важным электролитом во многих областях применения. Другая важная реакция KCl используется для получения металлического калия путем восстановления KCl металлическим натрием при 850 ° C.
KCl + Na → NaCl + K
Использование: Основное использование KCl в электролитах, буферах pH и подготовке удобрений, взрывчатых веществ, калия и гидроксида калия. Калий необходим для различных функций организма, и KCl является ключевым источником этого питательного вещества. Он также используется в медицине, пищевой промышленности и как заменитель поваренной соли (хлорид натрия). Он имеет несколько других аналогичных применений, таких как хлорид натрия, в том числе обледенение дорог и домов, в нефтяной и газовой промышленности, а также в умягчении воды.
Воздействие на здоровье / опасности для здоровья: при низких концентрациях KCl нетоксичен и необходим для организма. Однако в высоких концентрациях хлорид калия токсичен и даже смертелен. Высокое количество KCl может повлиять на сердечные мышцы, вызывая сердечные приступы и даже смерть.
алкенов: молекулярные и структурные формулы
алкены: молекулярные и структурные формулы
Алкены содержат ряд соединений, которые состоят из атомов углерода и водорода, имеющих по меньшей мере одну двойную связь в углеродной цепи. Эта группа соединений содержит гомологичный ряд с общей молекулярной формулой C n H 2 n , где n равно любому целому числу больше единицы.
Самый простой алкен, этен, имеет два атома углерода и молекулярную формулу C 2 H 4 . Структурная формула для этена
В более длинных алкеновых цепях дополнительные атомы углерода присоединены друг к другу одинаковыми ковалентными связями. Каждый атом углерода также присоединен к достаточному количеству атомов водорода, чтобы образовать в общей сложности четыре одиночные ковалентные связи вокруг себя. В цепях с четырьмя или более атомами углерода двойная связь может быть расположена в разных положениях, что приводит к образованию структурных изомеров. Например, алкен молекулярной формулы C 4 H 8 имеет два изомера.
Стереоизомеры. В дополнение к структурным изомерам алкены также образуют стереоизомеров. Поскольку вращение вокруг множественной связи ограничено, группы, присоединенные к атомам углерода с двойной связью, всегда остаются в одинаковых относительных положениях. Эти «запертые» положения позволяют химикам идентифицировать различные изомеры из местоположений заместителей. Например, один структурный изомер C 5 H 10 имеет следующие стереоизомеры.
Изомер слева, в котором два заместителей (метильная и этильная группы) находятся на той же стороне двойной связи, называется изомером цис , в то время как изомер справа с двумя неводородные заместители на противоположных сторонах двойной связи называют транс-изомером .
Если более чем два заместителя присоединены к атомам углерода двойной связи, система цис и транс не может использоваться.С такими химикатами используется обозначение E-Z . В системе E-Z молекула сначала делится пополам вертикально через двойную связь. Во-вторых, два атома или группы на каждом атоме углерода ранжируются по атомному весу. Более высокий атомный вес присваивается приоритет. Например, на рисунке атомы углерода и хлора на левой стороне биссектрисы ранжированы. Хлор имеет приоритет, потому что он тяжелее. С правой стороны бром превосходит углерод. В-третьих, определяются позиции двух атомов более высокого ранга.Если два атома находятся в положении цис , расположение составляет Z (для немецкого zusammen , что означает «вместе»). Если атомы или группы находятся в положении и , расположение составляет E (для немецкого entgegen , что означает «противоположный»).
Название химического вещества на рисунке: ( E ) -2-бром-3-хлор-2-бутен.
,
алканов: молекулярные и структурные формулы
Алканы: Молекулярные и структурные формулы
Алканы включают ряд соединений, которые состоят из атомов углерода и водорода с одинарными ковалентными связями. Эта группа соединений содержит гомологичный ряд с общей молекулярной формулой C n H 2 n +2 , где равно любому целому числу.
Самый простой алкан, метан, имеет один атом углерода и молекулярную формулу CH 4 .Поскольку это соединение содержит только одинарные ковалентные связи, его структурная формула
В более длинных молекулах алкана дополнительные атомы углерода присоединены друг к другу одинаковыми ковалентными связями. Каждый атом углерода также присоединен к достаточному количеству атомов водорода, чтобы образовать в общей сложности четыре одиночные ковалентные связи вокруг себя. Таким образом, октан, восьмиуглеродный алкан, имеет молекулярную формулу C 8 H 18 и структурную формулу
Алкильные группы. Когда заместитель, такой как галоген или гидроксигруппа, связывается с молекулой алкана, одна из углерод-водородных связей молекулы превращается в углерод-заместительную связь. Например, когда метан реагирует с хлором, образуется новое соединение, называемое хлорметаном (или метилхлоридом). Это новое соединение содержит группу CH 3 , связанную с атомом хлора.
Алкан с водородом, удаленным из одной связи, называется алкильной группой. Алкильные группы часто представлены буквой R , так же, как галогены часто представлены буквой X. Метан-хлорная реакция может быть обобщена как
Часто химики-органики используют эти типы представлений для обсуждения обобщенных реакций.
Изомеры. Алкильные группы могут существовать в более чем одной изомерной форме. Например, пропан алкана имеет два алкильных изомера.
Эти изомеры отличаются друг от друга по типу углерода, который потерял водород, образуя алкильную группу. Атомы углерода классифицируются как первичные (1 °), вторичные (2 °) или третичные (3 °), в зависимости от количества атомов углерода, к которым они присоединены.Первичный углерод непосредственно присоединен только к одному другому атому углерода. Вторичный и третичный атомы углерода присоединены к двум и трем другим атомам углерода, соответственно.
На приведенной выше диаграмме изомера пропана группа слева представляет собой первичную (1 °) пропильную группу, тогда как группа справа представляет собой вторичную (2 °) пропильную группу. Бутилы (алканы с четырьмя атомами углерода) имеют три изомерные группы. Структуры и названия этих групп
Структурные формулы
Шестой элемент в периодической таблице, углерод, имеет электронную конфигурацию 1 с 2 2 с 2 2 р 2 и, таким образом, имеет четыре валентных электрона на незаполненных орбиталях своей второй электронной оболочки. Чтобы заполнить эти орбитали стабильным набором из восьми валентных электронов, один атом углерода может делить электроны с двумя, тремя или даже четырьмя другими атомами. Ни один другой элемент не образует таких прочных связей со многими другими атомами, как углерод.Более того, множество атомов углерода легко связываются вместе одинарными, двойными или тройными связями. Эти факторы делают элемент номер 6 уникальным во всей периодической таблице. Количество соединений на основе углерода во много раз превышает общее количество всех соединений, в которых отсутствует углерод.
Все виды жизни основаны на соединениях углерода, поэтому изучение химии углерода называется органическая химия. Однако вы должны понимать, что органические соединения не обязательно получены из растений и животных.Сотни тысяч из них были синтезированы (построены) в лаборатории из более простых веществ.
Рисунок 1 — иллюстрация пропана, одного из самых простых органических соединений:
Рисунок 1. Структурная формула пропана.

Это представление называется структурной формулой , в которой линии изображают две электронные связи между атомами. Посмотрите на структуру пропана и заметьте, что четыре связи с каждым углеродом дополняют его валентные орбитали восемью электронами.
На диаграмме пропана наиболее важной особенностью является цепь из трех атомов углерода. Такое углерод-углеродное соединение — это то, что порождает невероятное разнообразие органических соединений. Эта связь атомов углерода может продолжаться без ограничений. Так же, как пропан имеет 3 связанных углерода, вы можете представить органические соединения с 4, 5 или 500 атомами углерода в обширной цепи или сети.
Структурная формула для пропана показывает три осевых атома углерода и восемь периферийных атомов водорода. Композиция пропана может быть более компактно выражена как C 3 H 8 .Это представление является молекулярной формулой . Такая формула прямо не говорит о том, как различные атомы связаны между собой.
Сравните два разных соединения, которые имеют четыре связанных атома углерода. Обратитесь к рисунку 2.

Хотя эти два соединения имеют одинаковую молекулярную формулу (и, следовательно, имеют идентичный химический состав), их структурные формулы показывают различие в способе, которым собраны четыре атома углерода. Структура так же важна, как и состав в органической химии .
Две разновидности C 4 H 10 называются изомерами, что означает, что они имеют одинаковый состав, но различную структуру. Структура влияет как на физические свойства, так и на химическую реакционную способность изомеров. В примере С , 4 , Н , 10 , оба существуют в виде газов при комнатной температуре, но их можно легко конденсировать в жидкости путем охлаждения или сжатия. Две жидкости имеют разные температуры, при которых они кипят. Смотрите таблицу 1.
Режим кипения согласуется с их структурой.Самая длинная углеродная цепь в бутане — четыре атома, тогда как самая длинная такая цепь в изобутане — только три атома. Более компактные молекулы изобутана легче выходят из жидкости, поэтому более летучий изобутан имеет более низкую температуру кипения.
Химики часто пишут сжатые структурные формулы, в которых пропущены углерод-водородные связи, как показано на рисунке 3.
Рисунок 3. Конденсированные структурные формулы.

Обратите внимание, что эти конденсированные структурные формулы все еще отображают схему углерод-углеродных связей, необходимую для различения структурных изомеров.
,