Хлорид калия: свойства и все характеристики
Характеристики и физические свойства хлорида калия
Умеренно растворяется в воде (не гидролизуется). Кристаллогидратов не образует. Плохо растворяется в концентрированной хлороводородной кислоте, жидком аммиаке.

Рис. 1. Хлорид калия. Внешний вид.
Таблица 1. Физические свойства хлорида калия.
|
Молекулярная формула |
KCl |
|
Молярная масса |
1,984 |
|
Плотность (20oС), г/см3 |
2,15 |
|
Температура плавления, oС |
776 |
|
Температура кипения, oС |
1407 |
Растворимость в воде (20oС), г/100 мл |
34 |
Получение хлорида калия
Основным лабораторным способом получения хлорида калия является реакция нейтрализации соляной кислоты гидроксидом калия:
HCl + KOH = KCl + H2O.
Химические свойства хлорида калия
В водном растворе хлорид калия диссоциирует на ионы:
KCl↔K+ + Cl—.
Хлорид калия взаимодействует с концентрированными растворами сильных минеральных кислот:
2KCl + H2SO4 (conc) = K2SO4+ 2HCl↑;
10KClsolid + 8H2SO4 (conc, hot)+ 2KMnO4 (solid)= 6K2SO4+ 5Cl2↑ + 2MnSO4 + 8H2O.
Взаимодействие хлорида калия с насыщенным раствором перхлората натрия приводит к образованию перхлората калия, который выпадает в осадок и хлорида натрия:
KCl + NaClO4= KClO4↓ + NaCl (t = 10oC).
При электролизе расплава хлорида калия на катоде происходит образования калия, а на аноде – выделение пузырьков хлора:
2KCl = 2K + Cl2↑.
Электролиз водного раствора хлорида калия в зависимости от температуры может давать различные продукты:
2KCl + 2H2O = H2↑ + Cl2↑ + 2KOH;
KCl + 3H2O = 3H2↑ + KClO3 (t = 40 – 60oC).
Применение хлорида калия
Хлорид калия нашел широкое применение в медицине (составляющая препаратов, назначаемых при нарушениях сердечного ритма, недостатке калия в организме и пр.), пищевой промышленности (добавка Е508), сельском хозяйстве (компонент минеральных удобрений) и технике (строительство и ремонт скважин).
Примеры решения задач
Формула хлорида калия в химии
Определение и формула хлорида калия

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – белое кристаллическое вещество.
Плавится и кипит без разложения.
Умеренно растворяется в воде (не гидролизуется).
Химические свойства хлорида калия
- Хлорид калия вступает в реакции обмена с кислотами:
- Взаимодействует с солями. Необходимое условие протекания реакции: выпадение осадка нерастворимой соли:
- Проявляет слабые восстановительные свойства:
Получение
Хлорид калия можно получить реакцией обмена:
При взаимодействии карбоната калия и соляной кислоты:
При действии соляной кислоты на металлический калий:
Применение
Хлорид калия можно назвать одним из самых распространённых калийных удобрений.Он используется для производства гидроксида калия электролизом.
Известен как пищевая добавка E508.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Формула хлора в химии
Атомная масса: 35,453 а.е.м.
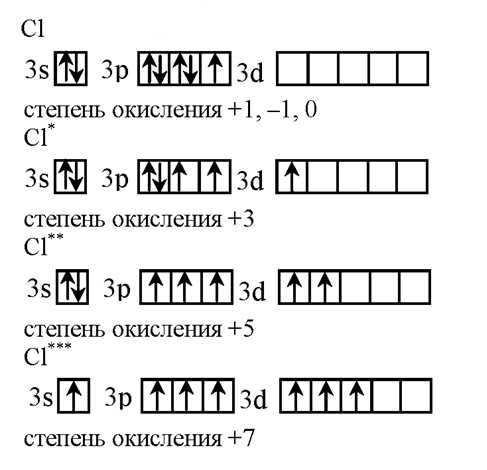
Электронная формула хлора
Электронная формула: 1s2 2s2 2p6 3s23p5
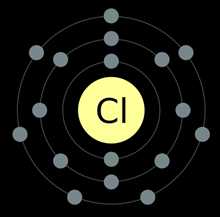
Электронно-графическая формула хлора
Электронно-графическая формула атома хлора в основном и возбужденных состояниях:
Хлор – простое вещество, состоящее из двух атомов хлора.
Формула: Cl2.
Структурная формула хлора
Структурная формула:
При нормальных условиях хлор – газ зеленовато-желтого цвета, с резким удушающим запахом, со сладковатым, «металлическим» вкусом. Тяжелее воздуха. Ядовит. Плохо растворяется в воде.
В природе встречаются 2 стабильных изотопа хлора: 35Cl и 37Cl. Их процентное содержание соответственно равно 75,78% и 24,22%. Из-за высокой химической активности хлор в природе встречается только в виде соединений: в составе минералов (NaCl, KCl, KCl • NaCl, MgCl2 • 6Н2О и др.) и растворимых хлоридов, содержащихся в морской воде.
Хлор является биогенным элементом, входит в состав живых организмов в основном в виде хлорид-иона Cl –.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Формула Хлорида натрия структурная химическая
Структурная формула
 |
Истинная, эмпирическая, или брутто-формула: ClNa
Химический состав Хлорида натрия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cl | Хлор | 35,453 | 1 | 60,7% |
| Na | Натрий | 22,99 | 1 | 39,3% |
Молекулярная масса: 58,443
Хлори́д на́трия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега. Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем».Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее. По условиям формирования месторождений каменную соль подразделяют на следующие виды:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали. На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы:
…на мори от чрена и от салгы по пузу…
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль. Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры. Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн).
Применение
В пищевой промышленности и кулинарии
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество. Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием.
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы. Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям: CaR2 + 2NaCl → 2NaR + CaCl2 MgR2 + 2NaCl → 2NaR +MgCl2
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия: NaCl + 3H2O → NaClO3 + 3H2
Физические и физико-химические свойства
Температура плавления +800,8 °С, кипения +1465 °С. Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2-4), и такая соль на воздухе сыреет. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C. Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
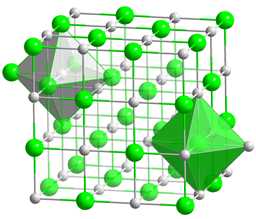
Структура
Хлорид натрия образует бесцветные кристаллы кубическая сингония, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl— окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl—, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
formula-info.ru
Формула Нитрата калия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: KNO3
Химический состав Нитрата калия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| K | Калий | 39,102 | 1 | 38,7% |
| N | Азот | 14,007 | 1 | 13,9% |
| O | Кислород | 15,999 | 2 | 47,5% |
Молекулярная масса: 101,106
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, индийская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч. Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O:
| Растворитель / Температура | 0 °С | 10 °С | 20 °С | 25 °С | 30 °С | 40 °С | 50 °С | 60 °С | 70 °С | 80 °С | 90 °С | 100 °С |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 | |||
| Жидкий аммиак | 10,52 | 10,4 | ||||||||||
| Гидразин | 14 | |||||||||||
| Диэтиловый эфир | ||||||||||||
| Этанол | ||||||||||||
| Метанол | ||||||||||||
| Глицерин |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
2KNO3 → 2KNO2 + O2 - Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная):
Zn + 2HCl → ZnCl2 + 2H0
KNO3 + 2H0 → KNO2 + H2O - Расплав нитрата калия может быть использован для получения калия электролизом, однако из-за высоких окислительных способностей нитрата калия в этом состоянии предпочтительнее гидроксид калия.
Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca (NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу. Реакция поташа с кальциевой селитрой (нитратом кальция).
Ca(NO3)2 + K2CO3 → 2KNO3 + CaCO3
является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Ca(NO3)2 + K2SO4 → KNO3 + CaSO4
Первый способ применялся до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия:
KCl + NaNO3 → KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
KCl + NH4NO3 → KNO3 + NH4Cl
KOH + HNO3 → KNO3 + H2O
21K + 26HNO3 → 21KNO3 + NO + N2O + N2+13H2 — тоже демонстративная реакция соответствующих кислоты и металла
K2O + 2HNO3 → 2KNO3 + H2O — демонстр. реакция соотв. щелочного оксида с соотв. кислотой
2KOH + N2O5 → 2KNO3 + H2O
NH4NO3 + KOH → NH3 + KNO3 + H2O
K2CO3 + 2HNO3 → 2KNO3 + H2O + CO2
Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Ост-Индии. Природный нитрат калия является результатом разложения азотистых веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Незаменим он при изготовлении дымного пороха и некоторых других составов (например, карамельного ракетного топлива), которые почти полностью сейчас идут на производство пиротехники.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав часто используется в лабораториях и у любителей для получения элементарного калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет хорошо выраженного антибактериального воздействия, но его оказывает образующийся в мясных продуктах (где нитрат калия и находит наиболее широкое применение) нитрит калия.
formula-info.ru
Формула Иодида калия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: KI
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| K | Калий | 26,092 | 1 | 76,4% |
| I | Йод | 126,905 | 3 | 23,6% |
Молекулярная масса: 166,007
Иодид калия иодистый калий, KI — калиевая соль иодоводородной кислоты. Бесцветная кристаллическая соль, широко используемая в качестве источника иодид-ионов. Менее гигроскопична чем иодид натрия. На свету или при нагревании на воздухе желтеет из-за окисления кислородом воздуха иодид-ионов до элементарного иода.
Строение
Кубическая кристаллическая решётка Fm3m
Свойства
Бесцветные кристаллы. Растворимость 144,5 г в 100 г H2O при 20 °C и 209 г при 100 °C. Иодид калия является мягким восстановителем и легко может быть окислен в растворе таким окислителем как бром:
2KI + Br2 → 2KBr + I2
Иодид калия реагирует с иодом, образуя раствор Люголя, содержащий трииодид-анион, который обладает лучшей растворимостью в воде, чем элементарный иод:
KI + I2 → KI3
Получение
Получают взаимодействием иода с гидроксидом калия или восстановлением иодата калия углём.
6KOH + 3I2 → 5KI + KIO3 + 3H2O
2KIO3 + 3C → 2KI + 3CO2
Применение
Используется для окислительно-восстановительного титрования в аналитической химии (иодометрия). В малых количествах наряду с иодатом калия добавляется в поваренную соль (иодированная соль). Также иодид калия применяют для приготовления светочувствительных фотоматериалов и в медицине.
Применяется как индикатор для обнаружения некоторых окислителей, например, хлора и озона. Для этого используют бумагу, смоченную раствором иодида калия и крахмала.
Cl2 + 2KI → 2KCl + I2
При этом крахмал образует окрашенный в синий цвет аддукт с иодом.
formula-info.ru
Формула Хлорида железа (ll) структурная химическая
Структурная формула
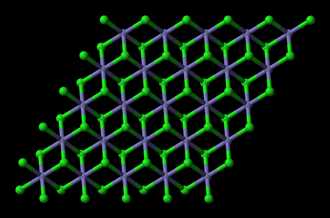 |
Истинная, эмпирическая, или брутто-формула: Cl2Fe
Химический состав Хлорида железа (ll)
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cl | Хлор | 35,453 | 2 | 55,9% |
| Fe | Железо | 55,849 | 1 | 44,1% |
Молекулярная масса: 126,755
Хлорид железа (ll), хлористое железо Cl2Fe — средняя соль двухвалентного железа и соляной кислоты.
Свойства
Бесцветные кристаллы плотностью 1,93 г/см3, желтеющие на воздухе. Плавится при 677 °C, кипит — при 1026 °C. Хорошо растворим в воде, этаноле, ацетоне. Не растворяется в диэтиловом эфире. При растворении в воде слабо гидролизуется. Из водных растворов при температуре ниже 12,3 °C выкристаллизовывается FeCl2·6H2O; от 12,3 °C до 76,5 °C — FeCl2·4H2O; выше 76,5 °C — FeCl2·2H2O, переходящий при температурах более 120 °C в FeCl2·H2O. Проявляет восстановительные свойства: 2FeCl2 + Cl2 → 2FeCl3
Получение
Получают растворением железа в соляной кислоте (в частности, при травлении стальных изделий).
Fe
+ 2HCl → FeCl2 + H2O
FeO + 2HCl → FeCl2 + H2O
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
2FeCl3 + SO2 + H2O → 2FeCl2 + H2SO4 + 2HCl
2FeCl3 + Fe → 3FeCl2
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
2FeCl3 + H2 → 2FeCl2 + 2HCl
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Применение
Хлорид железа(II) применяют для получения хлорида железа(III). Также применяется в ювелирном деле. В медицине используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговой маркой «Гемофер».
formula-info.ru
