Кислоты, содержащие хлор | Дистанционные уроки
11-Янв-2015 | Нет комментариев | Лолита Окольнова
Кислоты-окислители и их соли.

В ЕГЭ по этой теме не очень много спрашивают. Названия кислот и солей надо знать. И некоторые реакции. Я постарался написать в этой статье как можно больше каноничных ЕГЭ-шных реакций. Но на экзамене может попасться и то, чего здесь нет. Поэтому важно для ЕГЭ развить «химическую интуицию», чтобы предсказывать продукты реакций. Если посмотреть на ОВР очень внимательно, то можно вывести основные закономерности. То есть не все сводится к зубрежке, главное понять принцип. А чтобы у себя в голове вывести принцип, нужно прорешать много реакций. Ну и читать наши статьи.
Автор Статьи — Саид Лутфуллин
Вы, наверное, уже знаете, что у хлора очень много кислот. Все кислородсодержащие кислоты хлора и их соли –
Сила кислот возрастает со степенью окисления:
Степень окисления хлора | Формула кислоты | Название кислоты | Сила кислоты | Название соли |
+1 | HClO | Хлоноватистая | Слабая | Гипохлорит |
+3 | HClO2 | Хлористая | Средней силы | Хлорит |
+5 | HClO3 | Хлорноватая | Сильная | Хлорат |
+7 | HClO4 | Хлорная | Очень сильная | Перхлорат |
Хлорноватистая кислота образуется при пропускании хлора через воду.
При этом происходит диспропорционирование: хлор и окисляется (до +1) и восстанавливается (до +1), образуются хлороводородная (соляная) и хлорноватистая кислоты:
Cl2 + H2O → HCl + HClO
Если хлор пропускать не через воду, а через водный раствор щелочи, то образуются соли этих кислот: хлорид и гипохлорит:
Cl2 + 2KOH → KCl + KClO + H
А если хлор пропускать через ГОРЯЧИЙ раствор щелочи, то вместо гипохлорита, будет образовываться хлорат:
3Cl2 + 6KOH (t˚)→ 5KCl + KClO3 + 3H2O
Если полученный раствор остудить, то выпадут в осадок белые кристаллы хлората калия KClO3.
Запомните тривиальное название этой соли: бертолетова соль, а так же этот исторический способ ее получения. Именно этим способом был впервые получен хлорат калия французским ученым Клодом Луи Бертолле (отсюда и название соли).
Бертолетова соль – очень сильный окислитель.
При нагревании бертолетова соль разлагается, опять таки с диспропорционированием хлора. Он восстанавливается (до -1) и окисляется (до +7, дальше ему некуда):
4KClO3 (t˚)→ KCl + 3KClO4
Полученный перхлорат калия тоже не очень стабильный, и тоже разлагается:
KClO4 (t˚)→ KCl + 2O2↑
Хлорноватистая кислота окисляет галогеноводороды (иодоводороды и бромоводороды) до свободных галогенов:
2HI + HClO → I2↓ + HCl + H2O
2HBr + HClO → Br2 + HCl + H2O
Кислоты-окислители хлора окисляют серу в сернистом газе до высшей степени окисления +6 (образуется серная кислота), при этом, в зависимости от условий, хлор восстанавливается до простого вещества (0) или до хлороводорода (-1):
HClO3 + 3SO2 + 3H2O → 3H2SO4 + HCl
И имейте в виду, что некоторые из этих свойств так же могут подойти и для аналогичных кислот брома.
Еще на эту тему:
Обсуждение: «Кислоты, содержащие хлор»
(Правила комментирования)KCl + HNO3 = ? уравнение реакции
В результате взаимодействия хлорида калия с азотной кислотой (KCl + HNO3 = ?) химического превращения не происходит, поскольку предполагаемые продукты реакции – нитрат калия и соляная кислота являются растворимыми, т.е. не удовлетворяют нижеуказанным критериям протекания реакций обмена:
- если образуется осадок;
- если выделяется газ;
- если образуется малодиссоциирующее вещество, например вода.
К солям относятся вещества, диссоциирующие в растворах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид-ионов. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов (или группами атомов, например группой атомов ) или как продукты замещения гидроксогрупп в основном гидроксиде кислотными остатками. При полном замещении получаются средние (или нормальные) соли. При неполном замещении водорода кислоты получаются кислые соли, при неполном замещении гидроксогрупп основания – основные соли. Ясно, что кислые соли могут быть образованы только кислотами, основность которых равна двум или больше, а основные соли – гидроксидами, содержащими не менее двух гидроксогрупп.
(сульфат кальция) – нормальная соль;
(гидросульфат калия) – кислая соль;
(хлорид гидроксомагния) – основная соль.
ru.solverbook.com
Китай KCl Кислоты, Китай KCl Кислоты список товаров на ru.Made-in-China.com
Цена FOB для Справки:
US $ 40 / kg
MOQ:
1kg
- Порошок: да
- Индивидуальные: Индивидуальные
- Сертификация: GMP,HSE,ISO 9001,USP,ВР
- Подходит для: Пожилой,Взрослый
- состояние: Твердый
- Чистота: > 99%
-
Поставщики с проверенными бизнес-лицензиями
Поставщики, проверенные инспекционными службами
Shenzhen Simeiquan Biotechnology Co., Ltd. - провинция: Guangdong, China
ru.made-in-china.com
Китай KCl Кислоты, Китай KCl Кислоты список товаров на ru.Made-in-China.com-страница 2
Цена FOB для Справки:
US $ 500.0-580.0 / Тонн.
MOQ:
25Тонн.
- сертификация: ISO9001,ISO
- заявка: Овощи,Цветы,Фрукты
- Внешность: порошок
- Инфекция на почве: Физиологический Нейтральная
- Химическая Характер: Химическая кислота
- Тип релиза: Быстро
-
Поставщики с проверенными бизнес-лицензиями
Поставщики, проверенные инспекционными службами
Shijiazhuang Han Hao Trade Co., Ltd. - провинция: Hebei, China
ru.made-in-china.com
Китай KCl Кислоты, Китай KCl Кислоты список товаров на ru.Made-in-China.com-страница 5
Цена FOB для Справки:
US $ 7000 / шт.
MOQ:
1шт.
- Тип: Нажатие гранулятор
- Объект: Удобрение
- Материал: Нержавеющая сталь
- Размер: Малый
- Сертификация: GS,CE,ISO 9001
- Состояние: Новый
-
Поставщики с проверенными бизнес-лицензиями
Поставщики, проверенные инспекционными службами
Jiangsu Fuyi Machinery Technology Co., Ltd. - провинция: Jiangsu, China
ru.made-in-china.com
Ортофосфорная кислота, хлорид калия и глицерин — применение и свойства. — webagro.ru
Многие химические соединения имеют обширную область применения, и рассказ о них может быть интересен даже неспециалистам. Возьмем 4 химических соединения: глицерин, ортофосфорную кислоту, перекись водорода и хлористый калий и поведаем об их качествах и области использования.
Многие химические соединения имеют обширную область применения, и рассказ о них может быть интересен даже неспециалистам. Возьмем 4 химических соединения: глицерин, ортофосфорную кислоту, перекись водорода и хлористый калий и поведаем об их качествах и области использования.
Ортофосфорная кислота.
Итак, что же такое ортофосфорная кислота? Это кислота неорганического типа, имеющая формулу h4PO4, при обыкновенных условиях ортофосфорная кислота имеет вид бесцветных кристаллов, которые отлично впитывают влажность. Кислота растворяется в воде и обыкновенно ортофосфорной кислотой называют 85% водный раствор, похожий на сиропообразную жидкость, не имеющую запаха.
Это совмещение применяют при производстве калия, солей натрия, марганца, алюминия и аммония в химической индустрии. Также с её помощью ведут органический синтез, применяют для изготовления кинопленки и активированного угля. Кислота ортофосфорная также используется при производстве огнеупорных материалов или связующих веществ, керамики, стекла, моющих синтетических средств и удобрений. Она применяется ещё в медицине и для осуществления изучений в сферы молекулярной биологии.
С применением ортофосфорной кислоты изготавливается пайка металлов, их очистка от ржавчины. На поверхности металлов ортофосфорная кислота образует защитное покрытие, что разрешает избежать коррозии. Кроме того, ортофосфорную кислоту употребляют для создания ткани с пропиткой от воздействия огня. Это совмещение кислоты используется в пищевой индустрии, для производства солей, изготовления печенья, а также газированной воды, где она используется как кислотный регулятор.
Хлористый калий.
Это сочетание (формула KСl) именуют ещё хлоридом калия. Калий хлористый — вещество с кристаллическим строением без запаха, в естественных условиях имеется в составе натуральных минералов карналлита и сильвина. Как сырье хлористый кальций используют в химической промышленности для приобретения углекислого калия, едкого калия, бертолетовой соли и иных соединений, которые широко используют в лакокрасочной, парфюмерной, фармацевтической, стекольной и других областях. Производится несколько видов хлористого калия с различным процентным количеством калия, также с разным содержанием добавок.
В сельскохозяйстве хлористый калий используется, как концентрированное минеральное удобрение, чтобы обеспечить растения калием. Хлорид калия повышает стабильность культур к низким температурам, засухам или повреждению насекомыми-вредителями. Лучший эффект от применения хлористого калия добивается после обработки посадок овощных культур и картофеля. Хлористый калий хранится в закрытых помещениях, защищенных от грунтовых вод и осадков.
Глицерин.
Простейшее соединение 3-атомных спиртов — глицерин имеет химическую формулу C3H5(OH)3. По внешности глицерин — это прозрачная вязкая жидкость, образующаяся гидролизом жиров, масел, как животных, так и растительных. Впервые соединение было выработано в 1779 году. Глицерин приобрел собственное название за сладковатый вкус, от греческого слова \»гликос\» — сладкий. Глицерин хорошо растворяется в воде и сам растворяет другие составы. Область использования глицерина достаточно широка. Так, его применяют в производстве кожи, бумаги, некоторых видов клея, взрывчатых веществ. Глицерин входит в состав антифризов. Также глицерин оживлённо применяются в пищевой промышленности при изготовлении спиртных напитков и кондитерской продукции. В косметическом создании это соединение применяют для создания мыла и различных косметических средств. В сфере медицины глицерин используют, как дегидратирующее и смягчающее средство.
webagro.ru
Получение нитрата калия из хлорида калия и азотной кислоты или окислов азота
Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Этот способ, не нашедший пока широкого распространения в промышленности вследствие трудностей, связанных главным образом со значительной коррозией аппаратуры, представляет, однако, интерес, так как не требует затраты дефицитных щелочей и большого расхода пара 236-243.
Взаимодействие хлорида калия с азотной кислотой или окислами азота идет по следующим схемам:
KC1 +HNO3 = KNO3 + HCl 3HC1 + HNO3 = NOC1 + Cl2 + 2h30
2КС1 + 3N02 + Н20 = 2KN03 + 2НС1 + NO HCl + 2N02 = HN03 + NOC1
Реакция (1) идет слева направо при сравнительно низких температурах (25—60°). Реакция (2) легко обратима, начинается при низких температурах; при 100° равновесие сдвинуто почти нацело в сторону NOC1 и С12.
Образованию хлористого нитрозила способствует повышение концентрации кислот в растворе. При большой концентрации кислот и высокой температуре давление паров НС1 и HN03 над раствором увеличивается, что приводит к образованию больших количеств хлористого нитрозила и хлора. При применении 30—40%-ной азотной кислоты и температуре ниже 60° потери азота в виде хлористого нитрозила невелики, и хлор накапливается в растворе в виде НС1. При охлаждении раствора из него выделяется значительная доля KN03, а маточный раствор может быть возвращен в цикл. В дальнейшем, при накоплении значительных количеств соляной кислоты, перед возвратом раствора в процесс необходимо’ отгонять из него часть хлористого водорода. Отгоняемые пары конденсируются в виде соляной кислоты.
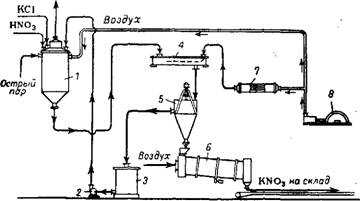
Нитрат калия можно получать из хлорида калия и азотной кислоты 224’251 и при повышенной температуре по схеме, изображенной на рис. 360. В стальной реактор 1, футерованный диабазовыми плитками, подают азотную кислоту, маточный раствор от предыдущей операции и загружают твердый хлорид калия. Реакционный раствор перемешивают сжатым воздухом и нагревают острым паром До 75—85°. Вначале реакция протекает бурно, затем замедляется. Образующиеся газы и водяные пары направляют воздушным
эжектором в абсорбер. С газами удаляется и часть хлористого водорода. По окончании реакции раствор, содержащий в среднем 520 г/л KN03, 35—65 г/л HN03 и 120—140 г/л HCI, поступает на кристаллизацию. Выделяющийся при охлаждении раствора до 25—30° нитрат калия отделяют на центрифуге 5, промывают и высушивают. Маточный раствор в смеси с промывными водами частично возвращают в реактор. Приблизительный состав возвращаемого раствора: 90—110 г/л KN03, 20—40 г/л HN03 и 70—80 г/л
Noc1 На переработку
Рис. 360. Схема получения нитрата калия из хлористого калия и азотной кислоты: / — реактор; 2 — центробежный насос; 3 —сборник маточных растворов; 4 — кристаллизатор; 5 — центрифуга; 6 — сушильный барабан; 7— холодильник для воздуха; 8 — компрессор. |
НС1. Часть маточного раствора нейтрализуют раствором едкого кали и направляют на выпаривание (на схеме не показано), из выпаренного раствора кристаллизуют нитрат калия, который может быть использован в качестве продукта 3-то сорта.
Выход нитрата калия по азотной кислоте при использовании части маточного раствора составляет ~70%. На производство 1 т Продукта расходуется только 4 т пара вместо 11 т по методу конверсии КС1 и NaN03.
Получение KN03 по реакции (1) можно осуществить с помощью жидких экстрагентов — бутилового, изоаминового спиртов и т. п. — с последующей их регенерацией 252.
Интересен метод получения KN03, основанный на осуществлении топохимической реакции между твердым хлоридом калия и газообразной или жидкой двуокисью азота:
KCl + 2N02 = KN03 + NOC!
Эта реакция каталитически ускоряется в присутствии ничтожных количеств воды и идет с большой скоростью при низких температурах (—10, —12°). Скорость реакции, лимитируемая скоростью диффузии, возрастает при применении тонкоизмельченного хлорида калия и при увеличении скорости жидкого или газового потока, омывающего твердые частицы.
Реакция с жидкой двуокисью азота может проводиться в автоклаве, а с газообразной — в шаровых или трубчатых мельницах.
Себестоимость калиевой селитры, полученной взаимодействием жидких окислов азота с хлоридом калия, должна быть приблизительно такой же, как при получении ее методом катионного обмена253’254. (Последний метод, однако, дает более чистый нитрат калия.)
Получение нитратов калия и натрия взаимодействием хлоридов с N02 или с азотной кислотой является одним из экономичных путей производства этих продуктов при условии использования хлора, выделяющегося в газовую фазу в виде С12, НС1 и NOC1. Особенно важно использование хлористого нитрозила, так как в противном случае потеря содержащегося в нем азота делает производство нерентабельным Хлористый нитрозил может быть окислен до N02 и С12 кислородом воздуха в присутствии концентрированной азотной кислоты или в присутствии катализаторов: МпОг, Fe203 и др. Хлористый нитрозил может быть использован также для хлорирования окислов и других веществ; освобождающаяся при этом N0 может быть переработана в азотную кислоту. Существуют и другие методы переработки хлористого нитрозила. В последнее время интерес к этому способу привлекает внимание еще и потому, что хлористый нитрозил, ранее не находивший применения, может быть использован для получения полупродуктов, применяемых в производстве полиамидных смол.
Разработаны также способы получения KN03 из КС1 и азотной кислоты без образования NOC1. Например, в среде расплавленного KN03 (или других солей) в отличие от водной среды, реакция идет согласно уравнению:
KCI — f 2HN03 = KNOs + V2C12 + N02 + h30
Вследствие того, что в систему с азотной кислотой вводится вода, точка плавления KN03 понижена и процесс осуществляется при 200—250° при давлении ~20 ат. Часть плава возвращают на растворение в нем КС! перед обработкой азотной кислотой, а другую (меньшую) продувают азотом для удаления газов, гранулируют и выпускают в качестве продукта. Из отходящего газа извлекают конденсацией и сорбцией хлор и двуокись азота, которую направляют на производство азотной кислоты 255.
Другой способ заключается в осуществлении реакции2И: 2КС1 + 2HN03 + у202 = 2KN03 + С12 + Н20
При взаимодействии хлорита натрия с хлором происходит образование хлористого натрия и выделяется двуокись хлора: 2NaC102 + С12 = 2NaCl + 2 СЮ2 Этот способ ранее был основным для получения двуокиси …
На рис. 404 представлена схема производства диаммонитро — фоски (типа TVA). Фосфорная кислота концентрацией 40—42,5% Р2О5 из сборника 1 насосом 2 подается в напорный бак 3, из которого она непрерывно …
Физико-химические свойства Сульфат аммония (Nh5)2S04 — бесцветные кристаллы ромбической формы с плотностью 1,769 г/см3. Технический сульфат аммония имеет серовато-желтоватый оттенок. При нагревании сульфат аммония разлагается с потерей аммиака, превращаясь в …
msd.com.ua