Карбонат натрия — Википедия. Что такое Карбонат натрия
| Карбонат натрия | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 242 дня] из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH 4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2416 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
wiki.sc
карбонат натрия
Карбонат натрия, 4%-ный раствор: 40 г 1 а2С03 ч.д. а. растворяют в дистиллированной воде и разбавляют до ‘1 л.[ …]
Карбонат натрия, 2 н. раствор. Растворяют 106 г безводного карбоната натрия ч. д. а. или 286 г кристаллической соли ч. д. а. в дистиллированной воде и дополняют до 1 л.[ …]
Карбонат натрия Ш2СОз • 10Н20, 5% раствор. Готовят и хранят в парафинированной или полиэтиленовой посуде.[ …]
Карбонат натрия Na2C03 • ЮН20, х. ч., 5 и 10% растворы, свежеприготовленные.[ …]
Карбонат натрия, 2% раствор, подкрашенный метиловым оранжевым.[ …]
Карбонат кадмия, суспензия. Смешивают 6 объемных частей 10%-ного водного раствора хлорида кадмия с 1 объемной частью 1 н. раствора карбоната натрия. Полученную суспензию перед заполнением ею склянок Дрекселя хорошо взбалтывают.[ …]
Карбонат цинка или карбонат кадмия, суспензия. Приготовляют отдельно раствор 40 г кристаллического сульфата цинка или 36 г кристаллического сульфата кадмия в 200 мл воды и раствор 20 г безводного карбоната натрия в 200 мл воды. Перед применением смешивают 10 мл раствора соли цинка или кадмия с 10 мл раствора карбоната натрия; смесь приготовляют при комнатной температуре, быстро перемешивая образующуюся суспензию.[ …]
Карбонат натрия, безводный; двуокись кремния, растертая в порошок.[ …]
Карбонат, натрия безводный; реактив надо проверить на полное отсутствие в нем хлоридов.[ …]
Карбонат натрия Ха2СОз, безводный, 5% раствор.[ …]
Растворяют 200 г ч. д. а. в 500 мл горя чей дистиллированной воды и разбавляют до 1 л.[ …]
Растворяют 20 г На .¿СО;; ч. д. а. в дистил лированной воде и доводят объем до 100 мл.[ …]
Карбонат натрия безводный (реактив надо проверить на полное отсут- ■ ствие в нем хлоридов).[ …]
Смесь безводного карбоната натрия и окиси магния в отношении 1 : 2.[ …]
Раствор ВаС12; 10%-ный раствор карбоната натрия; 2%-ный раствор карбоната натрия; эталонный раствор радия с содержанием п • 10 11 — п • 10 ? г радия; раствор соляной кислоты (1 : 1).[ …]
При взаимодействии гидроксида натрия с солями карбонатной жесткости и свободной угольной кислотой образуется карбонат натрия. Необходимое количество карбоната натрия образуется в процессе взаимодействия гидроксида натрия с солями карбонатной жесткости и свободной угольной кислотой. Если некарбонатная жесткость превышает величину карбонатной жесткости, то в воду дополнительно вводят карбонат натрия. При значительной карбонатной и малой некарбонатной жесткости в воде после умягчения образуется избыток карбоната натрия, что является нежелательным. При повышении температуры степень гидролиза карбоната натрия возрастает, что приводит к появлению в воде избытка гидроксида натрия и агрессивной угольной кислоты: Ма2С0з + Н20 =2Ыа0Н + С02.[ …]
Концентрацию едких щелочей или карбоната натрия вычисляют по формуле (1).[ …]
При добавлении свежих порций иона натрия карбонат натрия (сода) Или гидроксид натрия (каустик) реагирует о бисульфитом натрия, обеспечивая регенерацию абсорбента бо2 — сульфита натрия.[ …]
К 100 мл пробы прибавляют 5%-ный раствор карбоната натрия до слабой щелочной реакции, несколько капель спиртового раствора экстракта куркумы и смесь выпаривают досуха. Появление красновато-коричневой окраски является доказательством присутствия боратов. Чувствительность при анализе 100 мл пробы составляет примерно 0,02 мг ВОГ.[ …]
Зола состоит из окиси железа, сульфата и карбоната натрия и других инертных твердых веществ. Зола используется при планировке местности или на оледенелых дорогах вместо смеси песка и каменной соли.[ …]
Образующийся в циклонном реакторе расплав карбоната натрия выводился через плоский пережим совместно с продуктами горения. Расплав из газохода печи выпускался через водоохлаждаемую летку. Циклонная установка была оснащена системой защитных блокировок и контрольноизмерительных приборов.[ …]
Буферный раствор pH 10. Растворяют 24 г гидрокарбоната натрия ШаНСОз) и 27 г безводного карбоната натрия (ЫагСОз) в воде и разбавляют водой до 1 л.[ …]
В пробирку шкалы и в пробы вносят по 0,1 мл 8% раствора карбоната натрия и по 0,2 мл 5% раствора 2-4-динитрохлорбензола. Помещают в кипящую водяную баню на 5 минут. По истечении этого времени прибавляют по 0,5 мл 5% раствора соляной кислоты. Через 2—3 минуты сравнивают интенсивность окраски пробы со шкалой.[ …]
Бургундская жидкость. Готовится смешением растворов сульфата меди и карбоната .натрия. На 1 кг сульфата меди берут 1—1,4 кг карбоната натрия; кальцинированной (безводной) соды расходуется до 0,4—0,5 кг. Некоторый избыток соды увеличивает прилипаемость препарата к растениям. Действующим началом бургундской жидкости является основная углекислая медь. Препарат имеет зеленовато-голубой цвет и нейтральную или щелочную реакцию.[ …]
Разработан фирмой «Копперс» и основан на абсорбции Н28 разбавленным раствором карбоната натрия с последующей регенерацией этого раствора воздухом. Это первый регенеративный жидкостный процесс, нашедший широкое применение. Основные преимущества процесса — простота и экономичность. Степень извлечения достигает 95 %.[ …]
Анализ проб уноса, полученных в опытах по обезвреживанию водного раствора фенолята натрия и сточной воды производства капролактама, показал, что он состоит практически только из Ыа2С03. В опытах по обезвреживанию сточной воды производства фенола, содержавшей, кроме фенолята натрия, гидроокись натрия и сульфит натрия, унос состоял из Ыа2С03 и На2504. Это связано с тем, что при горении фенолята натрия образовывался карбонат натрия, гидроокись натрия подвергалась полной карбонизации, а сульфит натрия окислялся до сульфата.[ …]
Переведение всех соединений кремния в растворимое состояние путем сплавления с 4—6-кратным количеством карбоната натрия или смеси карбоната натрия и калия и определение в виде кремневой кислоты весовым методом.[ …]
Калибровка измерительного прибора состоит в измерении изменений электропроводности титрованного раствора едкого натра, протекающего через ячейку по мере частичного перехода едкого натра в карбонат натрия.[ …]
Экономически целесообразно проводить двухступенчатую обработку сточных вод, которая предусматривает обработку гидроокисдом натрия, карбонатом натрия или смесью этих реагентов, а после удаления образовавшегося осадка — сульфидом натрия. В этом случае достигается почти полная очистка сточнкх вод от цинка, что является необходимым при сбросе стоков в водоемы (ПДК цинка в воде рыбохозяйственных водоемов составляет 0,01 мг/л).[ …]
Стандартный раствор для определения общего неорганического углерода, с (неорг. С) = 1000 мг/л. В мерной колбе вместимостью 1 л растворяют 4,41 г карбоната натрия (№гСОз), высушенного при 285 °С в течение 1 ч в 500 мл воды. Добавляют 3,5 г кислого карбоната натрия ШаНСОз), высушенного над силикагелем, и разбавляют водой до метки.[ …]
В табл. 21 представлены результаты биотестирования пяти рецептур антисептика, содержащего алкил бензил аммонийхлорид (¿)), тринатрийфосфат (к2), карбонат натрия (к3) и борную кислоту (¿4).[ …]
Скважинная гидродобыча широко практикуется в промышленности, например, для получения рассолов №С1 — сырья для производства хлора, гидроксида натрия (каустической соды) и водорода, а также карбоната натрия (кальцинированой соды). В скважину, пробуренную до залежи каменной соли, нагнетают воду и через нее же отбирают получающийся рассол. Аналогичным путем можно проводить добычу калийных солей.[ …]
Проведение анализа, а) При наличии в исследуемом образце несиликатных соединений металлов (Мё, Са, Ее и т. д.), в особенности окислов, гидроокисей и карбонатов, навеску 0,05 г тщательно измельченного (пудра) исследуемого образца обрабатывают несколько раз в стакане (емкостью 25—50 мл) при кипячении в течение 2 минут 10 мл смеси из равных объемных частей разбавленных (1:1) растворов соляной и азотной кислот. Осадок (кварц) на фильтре промывают дважды по 10 мл кипящим раствором хлорида аммония. Затем фильтр промывают 20 мл кипящего 10% раствора карбоната натрия и, наконец, дважды по 10 мл кипящего раствора хлорида аммония.[ …]
В процессе огневого обезвреживания сточных вод, особенно при повышенных температурах, возможно термическое разложение минеральных веществ. Хлористый натрий является весьма стойким соединением и практически не подвергается диссоциации вплоть до 2000° С. Карбонат натрия — соединение менее стойкое. Однако при огневом обезвреживании сточных вод в продуктах горения углеводородного топлива, где парциальные давления С02 обычно составляют 6—10 кПа, при температурах не более 1200° С диссоциация Na2C03 полностью исключается [102]. Наоборот, возможна полная карбонизация окиси натрия Na20, образующейся в результате диссоциации NaOH или сгорания органических соединений натрия. Диссоциация сульфата натрия возможна лишь при температурах выше 1400° С [951.[ …]
Более высокая скорость нейтрализации оксидов серы при использовании ЫаОН объясняется тем, что при рабочих температурах процесса огневого обезвреживания гидроксид натрия в значительной мере испаряется и реагирует с оксидами серы в газовой фазе. Карбонат натрия является менее летучим соединением по сравнению с гидроксидом натрия, поэтому обладает меньшей эффективностью. Однако необходимый избыток Ма2С03, обеспечивающий полный переход серы в Ка2504, невелик и не превышает 20%. Следует отметить, что взаимодействие ЫаОН, Ма2СОз или других щелочей с органическими соединениями серы возможно и в самом растворе. Однако Ыа2504 при этом не образуется, а получаются лишь органические соединения, содержащие серу и натрий. Например, бензолсульфокислота превращается в натриевую соль по реакции С6Н5503Н + Х аОН — С6Н5503Ха + Н20.[ …]
Раствор переносят через бумажный фильтр синяя лента в мерную колбу вместимостью 100 мл. Тигель промывают горячей водой и сливают в ту же колбу. Охлажденный раствор доводят до метки водой и хранят в полиэтиленовом сосуде 1 месяц.[ …]
Ход определения. В фарфоровую чашку помещают 10— 100 мл анализируемой воды (в зависимости от содержания хлоридов), прибавляют несколько капель раствора фенолфталеина, насыпают безводный карбонат натрия (в небольшом избытке по сравнению с тем его количеством, какое требуется для нейтрализации воды по фенолфталеину) и выпаривают раствор на водяной бане досуха. Затем осторожно прокаливают сухой остаток в муфельной печи или на горелке до сгорания органических веществ, охлаждают чашку, наливают в нее около 50 мл дистиллированной воды и перемешивают.[ …]
Отгон переносят в мерную колбу емкостью 500 мл, доводят объем дистиллированной водой до метки, отбирают аликвотную часть (20—50 мл), переносят в мерный цилиндр емкостью 100 мл, прибавляют 30 мл 1 н. раствора карбоната натрия и оставляют стоять.[ …]
Выделение стронция-9 0. В 10 л пробы вносят по 50 мг/л (в пересчете на металл) нитратных растворов носителей стронция, бария, лантана и церия и добавляют раствор хлорида кальция 20 мг/л (по кальцию). Перемешивают, нагревают до 80° С, прибавляют 10%-ный раствор карбоната натрия из расчета 580 мг/л для осаждения карбоната кальция. Воду с осадком отстаивают 2—3 ч, сливают, осадок растворяют в нескольких миллилитрах концентрированной азотной кислоты и разбавляют дистиллированной водой до объема 50—100 мл. Раствор переносят в стакан вместимостью 200—300 мл, добавляют 10 мл 0,5%-ного раствора хлорида железа (III), нагревают до кипения и осаждают гидроксид железа (III) аммиаком, не содержащим С02. Осадок отделяют, промывают 2—3 раза слабым раствором аммиака и отбрасывают. Раствор и промывные воды нейтрализуют 6 н. раствором азотной кислоты, прибавляют 1 мл 6 н. раствора уксусной кислоты, 2 мл 6 н. раствора ацетата аммония, нагревают до 70—80° С и добавляют 1—2 мл 1,5 н. раствора хромата натрия. После осаждения хромата бария осадок отделяют, промывают разбавленным раствором ацетата аммония и отбрасывают. К оставшемуся раствору прибавляют хлорид железа (III) и повторяют осаждение гидроксида железа. После этого добавляют аммиак до пожелтения раствора и насыщенный раствор карбоната аммония до полноты осаждения карбоната стронция. Выпавший осадок отстаивают 2—3 ч, проверяют полноту осаждения, центрифугируют, промывают водой, растворяют в концентрированной азотной кислоте и разбавляют дистиллированной водой до объема 50 мл. Затем замеряют объем азотнокислого раствора н отбирают 1 мл для определения химического выхода носителя стронция. После этого вносят 50 мг в пересчете на металл раствора носителя иттрия и оставляют на 6 дней для 75%-ного накопления иттрия-90. Затем осаждают свободным от углекислоты аммиаком гидроксид иттрия и отмечают время отделения иттрия-90 от стронция-90. Осадок гидроксида иттрия 2—3 раза промывают слабым раствором аммиака, подсушивают на фильтре и во взвешенном тигле прокаливают при 900° С. Осадок взвешивают, наносят на мишень и на малофоновой установке измеряют радиоактивность.[ …]
Если препарат влажный, то необходимо установить истинное содержание нитрата хрома. Для этого 10,2 г нитрата растворяют в дестиллированной воде в мерной колбе емкостью 100 мл; 3 мл раствора вливают в стакан емкостью 100 мл, добавляют 50 мл воды и 0,2 г карбоната натрия Ма2С03. Вносят в стакан 15 мл 2%-ного раствора перманганата калия КМп04 и кипятят 10 мин. Для разложения избытка перманганата прибавляют 2 мл этилового спирта и кипятят до полного исчезновения запаха альдегида. Раствор фильтруют через бумажный фильтр; фильтр промывают водой. К фильтрату прибавляют 2 г иодида калия и 5 мл разбавленной (1 : 5) серной кислоты, и в присутствии крахмала оттитровывают выделившийся иод тиосульфатом натрия.[ …]
К 50 г хлбрной извести (не менее чем 25%-ной по содержанию активного хлора) приливают 85 мл безаммиачной воды и перемешивают; Затем постепенно, при непрерывном перемешивании стеклянной палочкой, в течение 15 мин прибавляют раствор карбоната натрия (35 г безводной соли в 85 мл безаммиачной воды). Полученная масса сначала загустевает, а потом, по мере добавления раствора карбона га. натрия, посте пенно разжижается. • Образующуюся суспензию фильтруют через воронку а стеклянной фильтрующей пластинкой (№ 2), применяя разрежение: с помощью водоструйного насоса. Полученный раствор гипохлорита натрия хранят в холодильнике в склянке из темного стекла с притертой пробкой. Перед использованием этот концентрированный раствор разбавляют безаммиачной водой в отношении 1:1.[ …]
Общая щелочность пластовой воды характеризуется суммарной концентрацией гидроксильных ОН“, карбонатных С03 “, бикарбонатных ЬС03“ и других анионов слабых кислот в I кг воды, выраженной в миллиграмм-эквивалентах. I мг-экв/кг щелочности соответствует содержанию 40 мг/кг едкого натра, 53 мг/кг карбоната натрия и 80,02 мг/кг бикарбоната натрия.[ …]
Повышения чувствительности /г-нитроанилинового метода можно достигнуть экстракцией получаемого окрашенного соединения бутиловым спиртом. Переливают 150 мл дистиллята в делительную воронку емкостью 250 мм добавляют 3 мл 5 % -ного раствора карбоната натрия и 6 мл диазотированного раствора п-нитроани-лина, через 15 мин приливают 30,0 мл, бутилового спирта. Смесь тщательно взбалтывают 1 мин. Приблизительно через 1 ч (слой бутилового спирта может быть не вполне прозрачным) сливают из делительной воронки водный слой. Для получения прозрачного экстракта в делительную воронку прибавляют 5,0 мл раствора карбоната натрия и полученную смесь взбалтывают 10 сек. После осветления бута-нольного слоя отсасывают осторожно пипеткой, снабженной шлангом, нужный объем экстракта в кювету, в которую предварительно наливают 1,0 мл изопропилового спирта, чтобы предотвратить прилипание воды к стенкам кюветы. Измеряют оптическую плотность пробы и вычитают из полученного значения оптическую плотность экстракта холостого определения, которое проводят с дистиллированной водой. Содержание фенола находят по калибровочной кривой.[ …]
Метод Сольвэ состоит в следующем: приготавливают насыщенный раствор поваренной соли, который после осаждения и удаления примесей ионов кальция и магния насыщают аммиаком и получают аммиачный рассол. При последующей карбонизации, т. е. обработке рассола двуокисью углерода, получаемой при термическом разложении известняка, в осадок выпадает бикарбонат натрия, который после фильтрации переводится в карбонат натрия—кальцинированную соду.[ …]
Кислый характер анализируемых веществ позволяет использовать щелочные растворы для селективного улавливания карбоновых кислот из загрязненного воздуха, что значительно облегчает последующую хроматографическую идентификацию компонентов пробы. Для этой цели применяют раствор щелочи, импрегниро-ванный щелочью фильтр из стекловолокна [247] или водный раствор карбоната натрия [246]. Собранную в ловушке кислоту регенерируют фосфорной или соляной кислотой и экстрагируют летучим органическим растворителем, а после концентрирования экстракта часть его анализируют методом газовой хроматографии. Основные потери анализируемых примесей кислот в этом случае связаны с экстракцией пробы, которая тем не менее достигает 90% [247] I.[ …]
Предложенная классификация позволяет разделить сточные воды на сравнительно ограниченное число типов, для каждого из которых может быть выбрана наиболее рациональная технологическая схема огневого обезвреживания. В ней содержатся как легколетучие (циклогексан), так и высококипящие органические вещества (натриевые соли органических кислот), т. е. по наличию легколетучих веществ эта сточная вода должна быть отнесена к группе Б. Экспериментальное исследование огневого обезвреживания показало, что температура отходящих газов, равная 980— 1000° С, является рабочей. При этом натриевые соли органических кислот превращаются в карбонат натрия, а едкий натр подвергается карбонизации, т. е. конечным минеральным продуктом процесса обезвреживания является карбонат натрия, имеющий температуру плавления 850° С, близкую к рабочей температуре процесса. В связи с этим сточная вода входит в подгруппу 1. Известно, что при температуре 980—1000°С карбонат натрия частично возгоняется, поэтому рассматриваемую сточную воду следует отнести к подгруппе в. Таким образом, в соответствии с предложенной классификацией щелочной сток производства капролактама представляет сточные воды типа ПБ1в. Предложенная классификация сточных вод распространяется и на жидкие горючие отходы, в составе которых могут быть минеральные вещества и органические соединения некоторых металлов.[ …]
Для построения калибровочной кривой готовят серию рабочих стандартных растворов.Для получения таких растворов из основного стандартного раствора берут пипеткой 10 мл и разбавляют в мерной колбе до I л дистиллированной водой. Из кандой колбы берут пипеткой по 25 мл раствора, переливают в коничесвие колбы на 50 мл; прибавляют 5 мл раствора карбоната натрия и 2 мл раствора пикриновой кислоты.Содержимое колб перемешивают и нагревают на водяной бане при 70°С в течение 5 минут. Затем колбы быстро охлаждают под краном и, по истечении 5 минут после окончания нагревания, определят! оптическую плотность растворов, применяя зеленый светофильтр и кювету с рабочей длиной 30 ым. В качестве холостой пробы применяют 25 ил дистиллированной воды,к которой прибавлены указанные реактивы в тех хе объемах. РабочЬе пробы при этом окрашиваются в оранжевый цвет, а холостая — в желгозелены й.[ …]
Большинство хроматографических детекторов (ГШД, ЭЗД, КУЛД) обладают достаточной чувствительностью для прямого анализа соединений серы в отходящих промышленных газах, но для определения микропримесей этих веществ в атмосфере и воздухе производственных помещений (10 5—10 7%) необходимо •предварительное обогащение пробы. Летучие соединения серы достаточно эффективно улавливаются из загрязненного воздуха в концентрационные трубки с силикагелем [281], активным углем [282], порапаком [ …]
Лигнин очень легко реагирует с азотной кислотой (даже разбавленной), которая часто применялась для выделения целлюлозного волокна [393, 394, 395, 396, 397]. В этом процессе лигнин полностью разрушается до водорастворимых продуктов. Рутала и Севон [398] изучали действие азотной кислоты на протолигнин в еловой древесине и нашли, что поглощалось около 30% кислоты (в расчете на древесину), причем 57,8% были органически связаны, а остаток регенерировался в виде 23,5% азота, 5,5% окиси азота, 9,35% аммиака и 2,92% цианистого водорода. Около 25% нитрованного лигнина растворилось, но из водного фильтрата было получено лишь небольшое количество желтого аморфного продукта. Экстракция оставшейся древесины щелочью дала темно-коричневый раствор, из которого после подкисления минеральной кислотой осаждался коричневый хлопьевидный продукт, напоминающий азотсодержащий щелочной лигнин. Он растворялся в карбонате натрия с выделением углекислого газа. Содержание азота в продукте определено не было.[ …]
Эти равновесия осложняются медленным превращением гипохлорита в хлорид и хлорат, с происходящим в результате этого уменьшением активного хлора для отбелки. Знание того [344], что константа гидролиза хлора в воде равна 4.5ХЮ-4, а константа диссоциации хлорноватистой кислоты [345, 346, 347] около 4ХЮ 8, создает возможность-путем вычисления определить, что составы разбавленных растворов, употребляемых на практике (содержащих больше или меньше 0,8 % активного хлора) меняются в зависимости от pH, как указано ранее. Свыше 95% активного хлора существует в виде недиссоциированной хлорноватистой кислоты в пределах рНотЗ до 6; при pH 9 около 97% присутствует в качестве иона гипохлорита, а в кислом растворе при pH 2 гидролиз дает около 32% активного хлора [82]. То, что скорость, при которой целлюлоза восстанавливает 0,04 н. гипохлорит натрия больше примерно в 10 раз при pH 7, чем при pH 4,6 или pH 9, говорит о том, что иедиссоциированная хлорноватистая кислота легче окисляет целлюлозу, чем ион гипохлорита или активный хлор [66, 84, 348]. Более медленная реакция в кислом растворе сильно катализируется ярким дневным светом [79], реакция при pH 7—ультрафиолетовыми линиями в ртутном спектре [341], а окисление в каустической соде мерсеризующей концентрации, также является быстрым [66]. В результате этих окислений из отбеливаемых примесей образуются слабые органические кислоты, а из слабой хлорноватистой кислоты — сильная соляная кислота. Следовательно, щелочная белильная жидкость во время использования имеет тенденцию приблизиться к опасным пределам pH от 6 до 8, где переокисление, ведущее к деградации целлюлозы, происходит быстро [345]. Вследствие этого было тщательно изучено [345] как с теоретической [82], так и с практической [83] точек зрения, буферное действие присутствующего натриевого или кальциевого основания вместе с эффективностью добавления карбоната натрия или кальция, бората натрия, фосфатов, ацетата, цинкового и алюминиевого буферов. Однако отбелка может быть безопасно и быстро выполнена вблизи нейтральной точки при соблюдении некоторых определенных условий [83].[ …]
ru-ecology.info
Натрия карбонат — Справочник химика 21
Приборы и реактивы. Водяная баыя. Ацетат натрия. Карбонат натрия. Карбонат аммоиия. Хлорид калия. Хлорид алюминия. Хлорид олова (II). Сульфит натрия. Ацетат аммония. Индикаторы универсальная индикаторная бумага, лакмус (нейтральный), фенолфталеин. Растворы ацетата натрия (0,5 и.) карбоната натрия (0,5 и.) хлорида алюминия (0,5 и.) хлорида магния (0,5 н,) хлорида сурьмы (III) (0,5 и.) сульфида аммония (0,5 и.) .хлорида олова (II) (0,5 н.)( хлорида аммония (0,1 н.) хлороводородной кислоты (2 н.). [c.86]Как при помощи одного реагента определить, в какой из склянок находятся сухие соли хлорид натрия, карбонат натрия, сульфид натрия Напишите уравнения соответствующих реакций. [c.62]
В трех пробирках имеются растворы силиката натрия, карбоната натрия и сульфида калия. С помощью какого одного реактива можно определить каждый из указанных растворов Приведите уравнения соответствующих реакций. [c.424]
Гидраты и кристаллогидраты. Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты. Однако при растворении в воде гидроксида натрия, карбоната калия, безводного сульфата меди и многих других веществ происходит заметное повышение температуры. Выделяется теплота также при растворении в воде некоторых жидкостей и всех газов. [c.219]
Нитрит калия, нитрат калия, сульфит натрия, сульфат натрия, карбонат калия, гидрокарбонат калия, гидрокарбонат кальция. [c.61]
Оборудование и реактивы. Штатив с пробирками. Горелка. Про-мыва.лка с дистиллированной водой. Три мерные колбы с пробками вместимостью 50 мл, три бюретки на 50 мл с исходными растворами н одна бюретка с дистиллированной водой. рН-метр. Растворы соляная кислота (2 н.), гидроксид натрия (2 и), сульфат алюминия, хлорвд железа (III), карбонат натрия, гидрокарбонат натрия, нитрат калия, ацетат натрия, гидрофосфат натрия, дигидрофосфат натрия,. фосфат натрия. Исходные растворы уксусной кислоты с точными концентрациями, близкими к 2 н., 1 н., и 0,2 н. Раствор метилового оранжевого, фенолфталеина. Раствор комбинированного индикатора (см. Приложение, табл. II). рН-индикаторная бумага. Сухие соли ацетат натрия, силикат натрия, карбонат натрия, сульфат алюминия, хлорид цинка, ацетат аммония, хлорид калия. Буферные растворы с pH от 2 до 10. [c.119]
Реже, чем кислые или основные, встречаются смешанные соли, примерами которых могут служить KNa Oa (калий-натрий-карбонат)-и PbF l (свинец-фторид-хлорид). Как видно из этих формул, смешанная соль содержит одновременно либо разные металлы при одном и том же кислотном остатке, либо разные кислотные остатки при одном и том же металле. [c.56]
В отдельных пробирках находятся растворы хлорида натрия, карбоната натрия, нитрата серебра и фосфорной кислоты. Идентифицируйте каждое вещество с помощью реакций между веществами, содержащимися в пробирках. [c.57]
Приборы и реактивы. (Полумикрометод.) Водяная баня. Ацетат натрия. Карбонат натрия. Хлорид калия. Хлорид алюминия. Сульфит натрия. Хлорид натрия. Ацегат аммония. Растворы ацетата натрия (0,5 и,), карбоната натрия (0,5 н.), силиката натрия (0,5 н.), хлорида алюминия (0,5 н.), хлорида магния (0,5 н.), хлорида сурьмы (0,5 н.), сульфата алюминия (0,5 н.), карбоната аммония (0,5 н.), сульфида аммония (0,5 и.), лакмуса, фенолфталеина, ацетата аммония (0,5 н.). Универсальная индикаторная бумага. [c.65]
В четырех пробирках без надписей находятся растворы следующих веществ сульфата натрия, карбоната натрия, нитрата натрия и иодида натрия. С помои ью каких реагентов можно определить, где какая соль находится Напишите уравнения реакций в молекулярной и сокращенной ионной формах. [c.74]
Даны хлорид натрия, карбонат кальция, кокс, вода, воздух. Как получить из них не менее 20 веществ (органических и неорганических), имеющих практическое применение [c.76]
Ацетат натрия Гидрофосфат натрия Карбонат натрия [c.318]
Изучение реакций катионов I аналитической группы представляет одну из возможностей научиться составлять уравнения и понимать их сущность. В связи с этим рекомендуется учащимся самостоятельно составить уравнения реакций на все катионы I аналитической группы со следующими реактивами едким натром, карбонатом, фосфатом, дигидроантимонатом, гидротартратом, гексанитро-кобальтатом (III) натрия, винной кислотой (и присутствии ацетата натрия), ацетатом уранила, фторидом аммония и оксихинолином. [c.98]
Приборы и реактивы. Микроскоп. Платиновая проволочка, впаянная в стеклянную палочку. Стеклянная призма с раствором синего индиго. Тигель. Пинцет. Треугольник фарфоровый. Натрий. Пероксид натрия. Карбонат натрия. Гидро-адрбонат ])атрия. Сульфат хрома. Хлорид калия. Лакмус (нейтральный). Фенолфталеин. Растворы перманганата калия (0,05 н.) гексагидроксостибата (V ) калия (насыщенный) хлорид калия (насыщенный) хлорида натрия (насыщенный) сульфата лития (насыщенный) карбоната натрия (насыщенный). Специальный реактив на ион К [приготовляют растворением 2 г NaNOj, 0,9 г, Сн(СНдС00)2, 1,7 г РЬ(СНзСОО)г, и 0,2 мл 30%-ного раствора уксусной киг-лоты в 1,5 мл воды]. [c.264]
К счастью (вы это уже видели при выполнении лабораторной работы), значительная часть ионов кальция, магния и железа(П1) может быть удалена и это делает воду мягче. Самый первый способ умягчения воды состоял в добавлении к ней карбоната натрия. Карбонат натрия, известный как кальцинированная сода, добавляется к воде при стирке вместе с мылом. Ионы жесткости осаждаются в виде карбонатов кальция и магния и смываются при прополаскивании. Другим часто используемым умягчитслем воды является гексаметафосфат натрия, который связывает ионы жесткости не в виде осадка, а в виде иона, не взаимодействующего с мылом. [c.86]
Определите экспериментально удельную теплоемкость какого-либо неорганического вещества, например хлорида натрия, карбоната кальция, оксидов алюминия, железа и т. п. Предложите способ определения теплоемкости, если вещество растворяется в воде или находится в порошкообразном состоянии. [c.445]
Выберите для системного описания, т. е. описания, включающего все доступные вам знания, расположенные в определенной последовательности, одну из следующих тем водород, кислород, азот, углерод, кремний, вода, аммиак, диоксид углерода, хлорид натрия, карбонат кальция. [c.163]
Предприятия с большим объемом производимой продукции и высоким потреблением сырья (гидроксид натрия, карбонат натрия, фосфорные и калийные минеральные удобрения, сульфат натрия, целлюлоза, кормовые дрожжи, пластмассы, синтетические каучуки, продукты основного органи- [c.20]
Хлорид натрия, карбонат натрия, нитрат калия — 6 [c.111]
Углерод (II). Угольная кислота и карбонаты-получение соды сульфатным способом (процесс Леблана)-кислые соли-гидрокарбонат
www.chem21.info
Безводный карбонат — натрий — Большая Энциклопедия Нефти и Газа, статья, страница 1
Безводный карбонат — натрий
Cтраница 1
Безводный карбонат натрия также часто применяется для установки титра кислоты. [1]
Безводный карбонат натрия Na2CO3 ( кальцинированная сода) — белый порошок, легко образующий комки. Он обладает в три раза большей, чем обычная стиральная сода, способностью устранять жесткость воды. [2]
Безводный карбонат натрия гигроскопичен, поэтому его следует прокалить в муфельной печи при температуре 250 — 300 до постоянного веса перед тем, как брать навеску для приготовления рабочего раствора. Химически чистый безводный карбонат натрия получается при прокаливании при 250 — 300 химически чистого бикарбоната натрия NaHCO3 в муфельной печи в платиновом тигле. [3]
Безводный карбонат натрия Na2CO3 ( кальцинированная сода) — белый порошок, легко образующий комки. Он обладает в три раза большей, чем обычная стиральная сода, способностью устранять жесткость воды. [4]
Безводный карбонат натрия хорошо растворим в воде. Водные растворы его имеют щелочную реакцию. Водные растворы карбоната натрия проявляют высокую фунгицидную активность по отношенио к спорам мучнисторосых грибков, но более низкую, чем соли меди. Ожигающим действием препарат не обладает, его можно использовать для опрыскивания не только вегетирующих растений, но также и плодов во время полной зрелости. Опрыскивать цветы не рекомендуется. [5]
Безводный карбонат натрия легко растворим и удобен в обращении: не ядовит для теплокровных, не засоряет аппаратуру и не корродирует металлов. Наряду с положительными качествами он имеет и недостатки: легко смывается атмосферными осадками с растений, не дает окрашенных следов для опознавания опрыснутых растений. Растворы его плохо смачивают листья и требуют добавления веществ, улучшающих прилипание. [6]
Безводный карбонат натрия используют как основной стандарт в титриметрическом анализе ( разд. Безводный карбонат калия не применяют из-за его гигроскопичности. Кристаллический карбонат натрия ( сода) служит для смягчения жесткой воды. Безводный карбонат натрия в больших количествах потребляют стекольная и бумажная промышленности, его применяют в производстве мыла и моющих средств. Схема производства карбоната натрия аммиачным способом ( процесс Сольве — 1861 г.) показана на рис. 18.7. При этом используют следующие вещества: кокс, известняк, хлорид натрия и аммиак. Цикличность процесса и регенерация веществ приводят к тому, что единственным побочным продуктом является хлорид кальция. Процесс Сольве начинается с обжига известняка в печах; необходимую энергию дает горящий кокс. [7]
Технический безводный карбонат натрия содержит помимо Na2CO3 примеси хлорида и сульфида натрия. По внешнему виду он представляет собой белый мелкокристаллический порошок. [8]
Навеска безводного карбоната натрия 10 600 г растворена в мерной колбе на 500 мл; вода долита до метки. Чему равны молярность и нормальность ( для полной и неполной нейтрализации) раствора. [9]
Навеску безводного карбоната натрия ( около 0 53 г) растворяют в таком количестве уксусной кислоты, чтобы получить 100 мл раствора. Для установки титра хлорной кислоты пригоден также кислый фталат калия. [10]
Навеску безводного карбоната натрия ( около 0 53 г) растворяют в таком количестве уксусной кислоты, чтобы получить 100 мл раствора. Для установки титра хлорной кислоты пригоден также кислый фталат калия. [11]
В техническом безводном карбонате натрия определяют: общую щелочность, содержание хлорида натрия и потерю в весе при прокаливании. [12]
Две части безводного карбоната натрия и одну часть нитрата калия смешивают и растирают в фарфоровой ступке. [13]
Сплавлением с безводным карбонатом натрия и карбонатом калия ( в платиновых тиглях) разлагают соединения алюминия, ванадия, цинка, хрома, марганца и некоторых других металлов. [14]
Получаемый в промышленности безводный карбонат натрия Na2CO3 называется кальцинированной содой. Гидрокарбонат натрия NaHCO3 под названием питьевой, или двууглекислой, соды применяется в медицине и в кондитерском производстве. [15]
Страницы: 1 2 3
www.ngpedia.ru
Карбонат натрия — Википедия
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda), из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды[править]
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе[править]
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана[править]
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)[править]
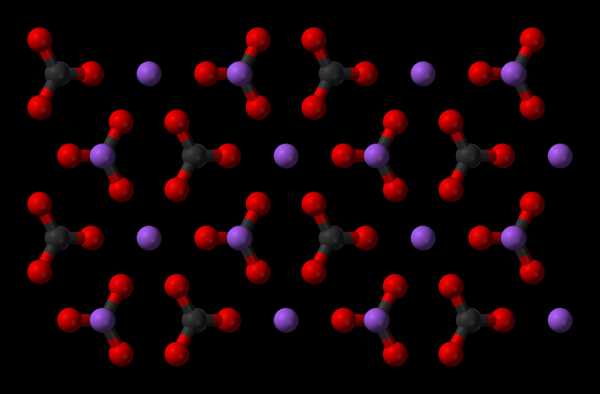 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2289 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу[править]
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов[править]
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Также используется для приготовления проявителя фотоматериалов.
www.wikiznanie.ru
Карбонат натрия — Википедия
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda), из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды[править]
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе[править]
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана[править]
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)[править]
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2289 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу[править]
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов[править]
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Также используется для приготовления проявителя фотоматериалов.
www.wiki-wiki.ru
Карбонат натрия — Википедия РУ
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода[1][2].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2599 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[4].
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[5].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
В фотографии используется в составе проявителей как ускоряющее средство[6].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
www.http-wikipediya.ru
