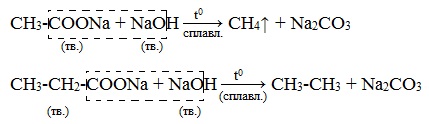Карбонатна кислота — Вікіпедія
Карбона́тна кислота́, також ву́гільна кислота́ — слабка двоосновна кислота з хімічною формулою H2CO3. У чистому вигляді нестійка[1]. Утворюється в малих кількостях при розчиненні вуглекислого газу у воді, в тому числі і вуглекислого газу з повітря. Утворює ряд стійких неорганічних та органічних похідних: солі (карбонати та гідрокарбонати), естери, аміди та ін
Молекула вугільної кислоти має плоску будову. Центральний вуглецевий атом має sp²-гібридизацію. У гідрокарбонат- карбонат-аніонів відбувається делокалізація π-зв’язку. Довжина зв’язку C—O в карбонат-іоні становить 129 пм.
Рівновага у водних розчинах та кислотність[ред. | ред. код]
Вугільна кислота існує у водних розчинах в стані рівноваги з гідратом діоксиду вуглецю:
- C O 2 ⋅ H 2 O ( p ) ⇄ H 2 C O 3 ( p ) {\displaystyle \ \mathrm {CO_{2}\ \cdot H_{2}O_{(p)}\ \rightleftarrows H_{2}CO_{3(p)}} } , константа рівноваги при 25 °C K p = [ H 2 C O 3 ] [ C O 2 ⋅ H 2 O ] = 1 , 70 ⋅ 10 − 3 {\displaystyle K_{p}=\ {\frac {\ \mathrm {[H_{2}CO_{3}]} }{\ \mathrm {[CO_{2}\ \cdot H_{2}O]} }}=1,70\ \cdot 10^{-3}}
Швидкість прямої реакції 0,039 з−1, зворотної — 23 з−1.
У свою чергу розчинений гідрат діоксиду вуглецю знаходиться в рівновазі з газоподібним діоксидом вуглецю:
- C O 2 ⋅ H 2 O ( p ) ⇄ C O 2 ↑ + H 2 O {\displaystyle \ \mathrm {CO_{2}\ \cdot H_{2}O_{(p)}\ \rightleftarrows CO_{2}\ \uparrow +\ \ H_{2}O} } ]
Дана рівновагу при підвищенні температури зсувається вправо, а при підвищенні тиску — вліво (докладніше див. Абсорбція газів).
Вугільна кислота піддається оборотньому гідролізу, створюючи при цьому кисле середовище:
- H 2 C O 3 + H 2 O ⇄ H C O 3 − + H 3 O + {\displaystyle \ \mathrm {H_{2}CO_{3}+\ \ H_{2}O\ \rightleftarrows HCO_{3}^{-}+\ \ H_{3}O^{+}} } , константа кислотної дисоціації при 25 °C K a 1 = [ H C O 3 − ] ⋅ [ H 3 O + ] [ H 2 C O 3 ] = 2 , 5 ⋅ 10 − 4 {\displaystyle K_{a1}=\ {\frac {\ \mathrm {[HCO_{3}^{-}]\ \cdot [H_{3}O^{+}]} }{\ \mathrm {[H_{2}CO_{3}]} }}=2,5\ \cdot 10^{-4}}
Однак, для практичних розрахунків частіше використовують уявну константу кислотності, що враховує рівновагу вугільної кислоти з гідратом діоксиду вуглецю:
- K a ′ = [ H C O 3 − ] ⋅ [ H 3 O + ] [ C O 2 ⋅ H 2 O ] = 4 , 27 ⋅ 10 − 7 {\displaystyle K_{a}’=\ {\frac {\ \mathrm {[HCO_{3}^{-}]\ \cdot [H_{3}O^{+}]} }{\ \mathrm {[CO_{2}\ \cdot H_{2}O]} }}=4,27\ \cdot 10^{-7}}
гідрокарбонат-іон піддається подальшому гідролізу по реакції
- H C O 3 − + H 2 O ⇄ C O 3 2 − + H 3 O + {\displaystyle \ \mathrm {HCO_{3}^{-}+\ \ H_{2}O\ \rightleftarrows CO_{3}^{2-}+\ \ H_{3}O^{+}} } , константа кислотності при 25 °C K a 2 = [ C O 3 2 − ] ⋅ [ H 3 O + ] [ H C O 3 − ] = 4 , 68 ⋅ 10 − 11 {\displaystyle K_{a2}=\ {\frac {\ \mathrm {[CO_{3}^{2-}]\ \cdot [H_{3}O^{+}]} }{\ \mathrm {[HCO_{3}^{-}]} }}=4,68\ \cdot 10^{-11}}
Таким чином, в розчинах, що містять вугільну кислоту, створюється складна рівноважна система, яку можна зобразити у загальному вигляді таким чином:
- C O 2 ↑ ⇄ H 2 O C O 2 ⋅ H 2 O ⇄ H 2 C O 3 ⇄ − H + H C O 3 − ⇄ − H + C O 3 2 − ( ∗ ) {\displaystyle \ \mathrm {CO_{2}\ \uparrow \ {\stackrel {H_{2}O}{\ \rightleftarrows }}CO_{2}\ \cdot H_{2}O\ \rightleftarrows H_{2}CO_{3}\ {\stackrel {-H^{+}}{\ \rightleftarrows }}HCO_{3}^{-}\ {\stackrel {-H^{+}}{\ \rightleftarrows }}CO_{3}^{2-}(*)} }
Значення pH в такій системі, яке відповідає насиченому розчину діоксиду вуглецю в воді при 25 °C і тиску 760 мм рт. ст., можна розрахувати по формулі:
- p H ≈ − 1 2 lg ( K a ′ ⋅ L ) = 3 , 9 {\displaystyle \mathrm {pH} \approx -{\frac {1}{2}}\lg(K_{a}’\cdot L)=3,9} , где L = 0,034 моль/л — розчинність CO2 в воді при вказаних умовах.
Розкладання[ред. | ред. код]
При підвищенні температури розчину і/або пониженні парціального тиску діоксиду вуглецю рівновагу в системі ( ∗ ) {\displaystyle \ \mathrm {(\ \ast )} } зміщується вліво, що призводить до розкладання частини вугільної кислоти на воду і діоксид вуглецю. При кипінні розчину вугільна кислота розкладається повністю:
- H 2 C O 3 ⟶ H 2 O + C O 2 ↑ {\displaystyle \ \mathrm {H_{2}CO_{3}\ \longrightarrow H_{2}O+\ \ CO_{2}\ \uparrow } }
Взаємодія з основами та солями[ред. | ред. код]
Вугільна кислота вступає в реакції нейтралізації з розчинами основ, утворюючи середні та кислі солі (хімія) — карбонати та гідрокарбонати відповідно:
- H 2 C O 3 + 2 N a O H {\displaystyle \ \mathrm {H_{2}CO_{3}+2\ \ NaOH} } (конц.) ⟶ N a 2 C O 3 + 2 H 2 O {\displaystyle \ \mathrm {\ \longrightarrow Na_{2}CO_{3}+2\ \ H_{2}O} } ]
-
H
2
C
O
3
+
N
a
O
H
{\displaystyle \ \mathrm {H_{2}CO_{3}+\ \ NaOH} }
- H 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 H 2 O {\displaystyle \ \mathrm {H_{2}CO_{3}+\ \ Ca(OH)_{2}\ \longrightarrow CaCO_{3}\ \downarrow +2\ \ H_{2}O} } ]
- H 2 C O 3 + N H 3 ⋅ H 2 O ⟶ N H 4 H C O 3 + H 2 O {\displaystyle \ \mathrm {H_{2}CO_{3}+\ \ NH_{3}\ \cdot H_{2}O\ \longrightarrow NH_{4}HCO_{3}+\ \ H_{2}O} } ]
При взаємодії вугільної кислоти з карбонатами утворюються гідрокарбонати:
- H 2 C O 3 + N a 2 C O 3 ⟶ 2 N a H C O 3 {\displaystyle \ \mathrm {H_{2}CO_{3}+\ \ Na_{2}CO_{3}\ \longrightarrow 2\ \ NaHCO_{3}} }
- H 2 C O 3 + C a C O 3 ⟶ C a ( H C O 3 ) 2 {\displaystyle \ \mathrm {H_{2}CO_{3}+\ \ CaCO_{3}\ \longrightarrow Ca(HCO_{3})_{2}} }
Вугільна кислота утворюється при розчиненні у воді діоксиду вуглецю:
- C O 2 + H 2 O ⇄ C O 2 ⋅ H 2 O ⇄ H 2 C O 3 {\displaystyle \ \mathrm {CO_{2}+H_{2}O\ \rightleftarrows CO_{2}\ \cdot H_{2}O\ \rightleftarrows H_{2}CO_{3}} }
Вміст вугільної кислоти в розчині збільшується при зниженні температури розчину та збільшенні тиску вуглекислого газу.
Також вугільна кислота утворюється при взаємодії її солей (карбонатів та гідрокарбонатів) з більш сильною кислотою. При цьому велика частина утворилася вугільної кислоти, як правило, розкладається на воду і діоксид вуглецю:
- N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 C O 3 {\displaystyle \ \mathrm {Na_{2}CO_{3}+2\ \ HCl\ \longrightarrow 2\ \ NaCl+\ \ H_{2}CO_{3}} }
- H 2 C O 3 ⟶ H 2 O + C O 2 ↑ {\displaystyle \ \mathrm {H_{2}CO_{3}\ \longrightarrow H_{2}O+\ \ CO_{2}\ \uparrow } }
Вугільна кислота завжди присутня у водних розчинах вуглекислого газу (див. Газована вода).
В біохімії використовується властивість рівноважної системи змінювати тиск газу пропорційно зміні змісту іонів оксонію (кислотності) при постійній температурі. Це дозволяє реєструвати в реальному часі хід ферментативних реакцій, що протікають із зміною pH розчину.
Вугільну кислоту формально можна розглядати як карбонову кислоту з гідроксильною групою замість вуглеводневої залишку. У цій якості вона може утворювати всі похідні, характерні для карбонових кислот [2].
Деякі представники подібних сполук перераховані в таблиці.
- Функціональні похідні карбонових та вугільної кислот : Навч. посіб. для студ. хім. спец. ун-тів / М. І. Ганущак, В. В. Карп’як; Львів. нац. ун-т ім. Івана Франка. — Л., 2002. — 292 c. — Бібліогр.: 25 назв.
- Лидин Р. А., Молочко В. А., Андрєєва Л. Л. Реакции неорганических соединений: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2. (рос.)
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических соединений: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5. (рос.)
Карбонатная кислота и ее соли — ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ IVA ГРУППЫ — НЕМЕТАЛЛИЧЕСКИЕ ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ — Химия 10 класс — Н.М. Буринская
РАЗДЕЛ 2 НЕМЕТАЛЛИЧЕСКИЕ ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
§ 48. Карбонатная кислота и ее соли
Осознание содержания этого пункта позволяет:
называть соли карбонатной кислоты по химической и тривиальной номенклатурам;
характеризовать физические и химические свойства, способы добывания, применение карбонатной кислоты и ее солей;
составлять уравнения соответствующих химических реакций.
Карбонатная кислота Н2СО3 соответствует кислотному карбон(ИV) оксида СО2. Принадлежит к двохосновних оксигеносодержащих кислот. Модель молекулы изображена на рис. 80.
— Составьте графическую и электронную формулы карбонатной кислоты.
Чем обусловлена ее двухосновність?
Вследствие незначительной полярности связей О—Н карбонатная кислота является слабым электролитом. Диссоциирует ступенчато:
Карбонатная кислота неустойчива, существует только в водном растворе. В случае попытки выделить ее из раствора, а также при нагревании и длительном хранении разлагается на воду и карбон(ИV) оксид, поэтому есть леткою:
Как оксигеновмісну карбонатную кислоту получают растворением карбон(ИV) оксида в воде:
Такая же реакция происходит во время изготовления газированной воды и образование минеральной воды в природных условиях.
Соли карбонатной кислоты. Как двохосновна карбонатная кислота образует два ряда солей — средние (карбонаты) и кислые (гідрогенкарбонати). Для некоторых солей этой кислоты применяют тривиальные названия:
Ма2СО3 — натрий карбонат, сода, стиральная сода, кальцинированная сода;
К2СО3 — калий карбонат, поташ;
МаНСО3 — натрий гідрогенкарбонат, питьевая сода;
Na2COg • 10Н20 — кристаллогидрат натрий карбоната, кристаллическая сода;
СаСО3 — кальций карбонат, кальцит, известняк, мел, мрамор.
Физические свойства. Все карбонаты — твердые вещества с ионной кристаллической решеткой, большинство, за исключением карбонатов щелочных элементов и аммония, — нерастворимые в воде. Большинство гидрогенкарбонатов, наоборот, хорошо растворяются в воде, малорастворим только натрий гідрогенкарбонат.
Рис. 80. Модель молекулы карбонатной кислоты
Химические свойства солей карбонатной кислоты обусловлены, с одной стороны, принадлежностью их к классу солей, с другой — связанные с особенностями карбонатной кислоты, а именно ее слабостью, неустойчивостью, леткістю, двохосновністю. Рассмотрим важнейшие из них.
Взаимодействие с кислотами. Под действием более сильных, чем карбонатная, кислот на карбонаты выделяется углекислый газ:
Сокращены йонни уравнения этих реакций имеют вид:
Из них видно, что ионы Водорода н обязуются карбонат-ионами так же, как при взаимодействии кислот с основаниями, поэтому для нейтрализации кислот можно использовать карбонаты. Это свойство карбонатов находит применение в сельском хозяйстве для снижения кислотности и улучшения структуры почв в них вносят размолотый известняк. Происходит реакция:
Этот процесс называется известкованием почв.
Реакцию солей карбонатной кислоты с сильными кислотами используют для их выявления.
Разложение при нагревании. В результате нагревании все карбонаты, кроме карбонатов щелочных элементов, разлагаются с выделением углекислого газа:
Гідрогенкарбонати щелочных элементов при нагревании превращаются в карбонаты:
Другие — на оксиды:
Взаимопревращения карбонатов и гидрогенкарбонатов. Если через водный раствор карбоната Натрия или Кальция пропустить углекислый газ, то карбонаты превращаются в гідрогенкарбонати:
Na2CO3 + CO2 + h3O = 2NaHCO3; СаСО3 + CO2 + h3O = Са(НС03)2 Нагреванием полученных растворов можно снова получить карбонаты.
ЛАБОРАТОРНЫЕ ОПЫТЫ
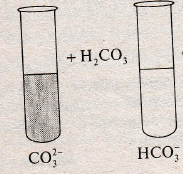
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КАРБОНАТ — И ГІДРОГЕНКАРБОНАТ-ИОНЫ
В одну пробирку насыпьте немного (покрыть только дно) мела, в другую налейте 2 мл раствора питьевой соды. В каждую добавьте по 1 мл соляной кислоты, сразу закройте пробками с газоотводящими трубками, которые опустите в пробирки со свежеприготовленной известковой водой. Наблюдайте образование в обеих пробирках с известковой водой белого кристаллического осадка кальций карбоната.
Продолжайте пропускать углекислый газ через раствор с осадком одной из пробирок. Наблюдайте растворение осадка кальций карбоната в результате преобразования его на кальций гідрогенкарбонат. Прокипятите этот раствор и наблюдайте образование осадка вновь кальций карбоната.
Сделайте вывод о том, какая реакция является качественной на карбонаты и гідрогенкарбонати и признаку она сопровождается; при каких условиях происходит взаимопревращения карбонатов и гідрогенкарбона — тов. Составьте уравнения соответствующих реакций в последовательности их протекания в молекулярной и ионных формах.
Гидролиз карбонатов. Карбонаты щелочных элементов как соли слабой двухосновной кислоты в водном растворе гидролизуют с образованием щелочной среды:
Карбонаты трехвалентных металлических элементов, например алюминий карбонат, феррум(III) карбонат и хром(III) карбонат, подвергаются полному гидролизу, в результате которого образуются соответствующие основы и углекислый газ. Поэтому при сливе, в частности, растворов алюминий хлорида и натрий карбоната образуются не продукты реакции обмена, а продукты полного гидролиза соли:
Именно поэтому в таблице растворимости в ячейках этих солей стоят черточки, которые указывают на невозможность их существования в водном растворе.
Добывания. Некоторые карбонаты в большом количестве существуют в природе в составе горных пород и минералов (см. рис. 68).
Другие карбонаты добывают в промышленности и в лаборатории, пользуясь известными вам свойствами солей карбонатной кислоты и углекислого газа.
— Составьте четыре уравнения реакций добывания средних и кислых солей карбонатной кислоты.
Применение важнейших карбонатов и гидрогенкарбонатов приведены в табл. 16.
Т а б л и ц а 16
Применение солей карбонатной кислот
Формула соли название | Области применения |
СаCО3 — мел, мрамор,известняк | Строительные материалы, производство извести, наполнитель бумаги и резины, основа зубных паст, известкования почв |
Na2CO3, кальцинированная сода | Производство стекла, мыла и других моющих средств, бумаги, добычи соединений Натрия |
NaHCO3, питьевая сода | В огнетушителях, в производстве искусственных минеральных вод, как разрыхлитель теста, лечебное средство |
К2СО3, поташ | Минеральное удобрение, в производстве жидкого мыла, тугоплавкого стекла |
Коротко о главном
Карбонатная кислота является слабой, неустойчивой двохосновною кислотой, которая существует только в растворе. Образует два ряда солей — карбонаты и гідрогенкарбонати. Добывают растворением углекислого газа в воде. Используется в газированных напитках.
Соли карбонатной кислоты — кристаллические вещества с ионной решеткой. Средние соли щелочных элементов и аммония хорошо растворимы в воде, остальные — мало или практически нерастворимы, кислые соли лучше растворимы, чем средние. Выявляют характерные для солей свойства: взаимодействуют с кислотами с выделением углекислого газа, разлагаются при нагревании (кроме карбонатов щелочных элементов). Карбонаты и гідрогенкарбонати при определенных условиях взаємоперетворюються. Добывают при помощи углекислого газа и природных карбонатов. Имеют широкое применение в производстве строительных материалов, стекла, моющих средств, бумаги, в сельском хозяйстве для известкования почв, а также в медицине, быту.
Для любознательных. В природной воде содержатся гідрогенкарбонати Кальция и Магния. Если такая вода просачивается сквозь своды пещеры и капает вниз, растворенные гідрогенкарбонати постепенно превращаются в карбонаты. С течением времени появляются минеральные образования в виде сосулек, трубочек и тому подобное — сталактиты. В то же время на дне пещеры аналогично образуются сталагмиты — конусообразные столбики, наплывы и прочее. Сталактиты и сталагмиты могут соединяться в колонны высотой до 30 м (рис. 81).
Рис. 81. Сталактиты и сталагмиты
Химические свойства карбоновых кислот | Химия онлайн
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Она определяется в основном наличием в их структуре карбоксильной группы.
Карбоксильная группа представляет собой сопряженную систему, в которой неподеленная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с π-электронами карбонильной группы (р,π-сопряжение). Вследствие +М-эффекта со стороны группы –ОН электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы 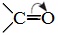 неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
Но в то же время за счет +М-эффекта со стороны группы –ОН в молекулах карбоновых кислот в некоторой степени уменьшается частичный положительный заряд (δ+) на атоме углерода карбонильной группы по сравнению с альдегидами и кетонами.
Кроме того, вследствие –I-эффекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности с углеводородного остатка, что приводит к появлению СН-кислотного центра у α-углеродного атома.
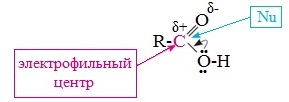
Исходя из строения, в молекулах карбоновых кислот можно выделить реакционные центры, определяющие возможные реакции с их участием. 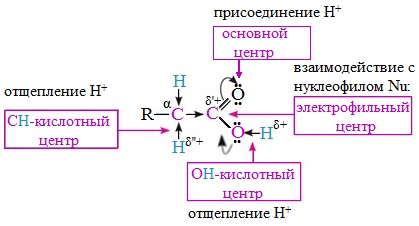
1. Кислотные свойства кабоновых кислот проявляются в реакциях с основаниями за счет ОН-кислотного центра.
2. С участием электрофильного центра (атома углерода карбоксильной группы) происходят реакции нуклеофильного замещения в карбоновых кислотах и их функциональных производных.
3. Основный центр – карбонильная группа (оксогруппа) со своей электронной парой – протонируется на стадии катализа в реакциях нуклеофильного замещения.
4. СН-кислотный центр определяет возможность замещения атома водорода в алкильном радикале и реакции конденсации.
Карбоновые кислоты вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.

Химические свойства карбоновых кислот (таблица)
Химические свойства карбоновых кислот (таблица)
Химические свойства карбоновых кислот на примере уксусной кислоты
I. Реакции с разрывом связи О-Н
(кислотные свойства карбоновых кислот обусловлены подвижностью атома водорода карбоксильной группы и их способностью отщеплять его в виде протона)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
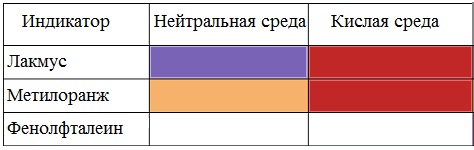
Карбоновые кислоты изменяют окраску индикаторов.
1. Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: они диссоциируют с образованием протона (Н+) и кислотного остатка (карбоксилат-иона):

Уравнение реакции, учитывающее участие молекулы воды:
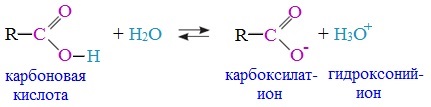
Растворы карбоновых кислот изменяют окраску индикаторов, имеют кислый вкус, проводят электрический ток.
В карбоксилат-ионе оба атома кислорода равноценны, а отрицательный заряд равномерно делокализован (рассредоточен) между ними.
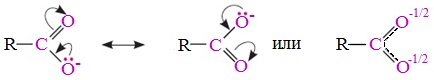
В результате делокализации отрицательного заряда карбоксилат-ион обладает высокой устойчивостью. Сила кислоты определяется устойчивостью образующегося аниона, поэтому карбоновые кислоты превосходят по кислотным свойствам спирты и фенолы, где возможность делокализации заряда в анионе меньшая.
Тем не менее, монокарбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа –СООН связана с атомом водорода.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индукционного эффекта.
Алкильные радикалы, связанные с карбоксильной группой, обладают положительным индукционным эффектом (+І). Они отталкивают от себя электронную плотность, тем самым уменьшая частичный положительный заряд (δ+) на атоме углерода карбоксильной группы. Положительный индукционный эффект возрастает по мере увеличения длины углеводородного радикала, что в свою очередь ослабляет полярность связи О-Н. Алкильные группы понижают кислотность.
В гомологическом ряду предельных монокарбоновых кислот кислотные свойства уменьшаются от муравьиной кислоты к высшим карбоновым кислотам.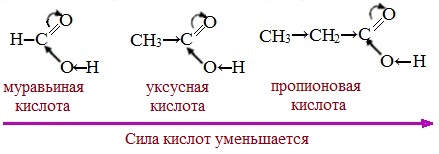
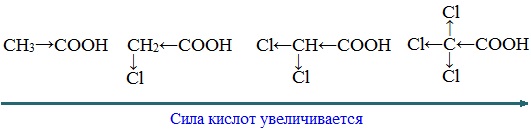
Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индукционный эффект (— I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты.
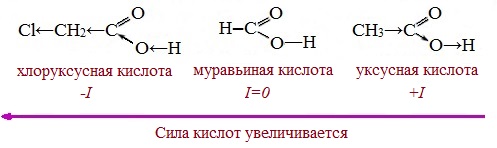
Карбоновые кислоты – слабые электролиты. Равновесие процесса диссоциации сильно смещено влево, об этом свидетельствует тот факт, что даже сильноразбавленные водные растворы кислот имеют резкий запах.
Видеоопыт «Растворимость в воде различных карбоновых кислот»
Видеоопыт «Карбоновые кислоты — слабые электролиты»
2. Образование солей
Карбоновые кислоты проявляют все свойства минеральных кислот. Карбоновые кислоты при взаимодействии с активными металлами, основными оксидами, основаниями и солями слабых кислот образую соли.
а) взаимодействие с активными металлами


Цинк и уксусная кислота
Карбоновые кислоты реагируют с металлами, стоящими в ряду напряжений до водорода.
Видеоопыт «Взаимодействие уксусной кислоты с металлами»
б) взаимодействие c основаниями (реакция нейтрализации)

Видеоопыт «Взаимодействие уксусной кислоты с раствором щелочи»
в) взаимодействие с основными и амофтерными оксидами


Оксид меди(II) и уксусная кислота
Видеоопыт «Взаимодействие уксусной кислоты с оксидом меди (II)»
г) взаимодействие с солями более слабых кислот
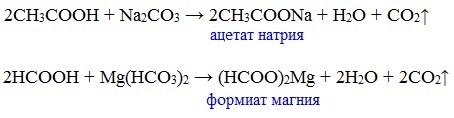

Сода (NaHCO3) и уксус
Видеоопыт «Взаимодействие уксусной кислоты с карбонатом натрия»
д) взаимодействие с аммиаком или гидроксидом аммония
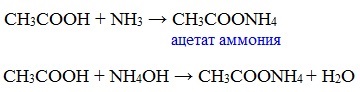
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
Видеоопыт «Свойства карбоновых кислот»
Свойства солей карбоновых кислот
1) Взаимодействие с сильными кислотами
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.

Из неорганических кислот лишь угольная кислота слабее рассматриваемых кислот и может вытесняться ими из её солей — карбонатов и гидрокарбонатов.
Качественная реакция на ацетат-ион СН3СОО— ! Запах уксусной кислоты.
2) Гидролиз по аниону
Натриевыс и калиевые соли карбоновых кислот в водных растворах находятся частично в гидролизованном состояния.


Этим объясняется щелочная реакция мыльного раствора.

Видеоопыт «Гидролиз ацетата натрия»
3) Электролиз солей активных металлов (реакция Кольбе)
Одним из применений солей карбоновых кислот является электролиз их водных растворов, в результате которого образуются насыщенные углеводороды:

Электролизом раствора соли карбоновой кислоты можно получить алкан с удлиненной цепью.
4) Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны:
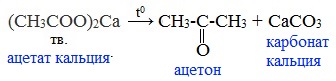
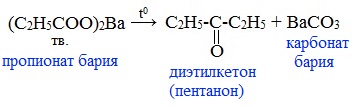
4) Декарбоксилирование солей щелочных металлов (реакция Дюма)
В процессе сплавления солей карбоновых кислот с твердой щелочью происходит расщепление углеродной связи и образуются алканы с числом атомов углерода на один меньше, чем у исходной кислоты:
II. Реакции с разрывом связи C-О
(замещение ОН-группы)
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН с образованием функциональных производных карбоновых кислот (сложных эфиров, амидов, ангидридов и галогенангидридов).
1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации)
Карбоновые кислоты при нагревании в присутствии кислотного катализатора реагируют со спиртами, образуя сложные эфиры:
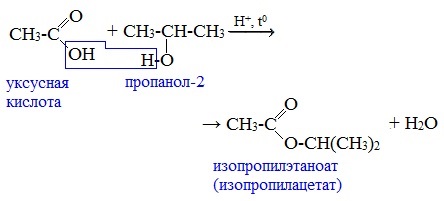
Механизм этой реакции был установлен методом меченых атомов. С этой целью использовали спирт, меченный изотопом кислорода 18О. После реакции изотоп кислорода был обнаружен в молекуле сложного эфира.

2. Взаимодействие с аммиаком с образованием амидов
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
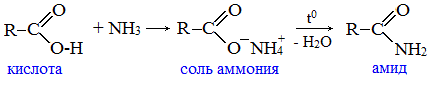

Вместо карбоновых кислот чаще используют их галогенангидриды:

Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
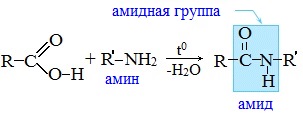
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп — пептидных связей.
3. Взаимодействие с галогенидами фосфора или тионилхлоридом с образованием галогенангидридов карбоновых кислот
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты –галогениды фосфора PCl3, PCl5, тионилхлорид SOCl2.
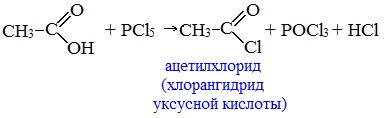

Для получения хлорангидридов чаще используют тионилхлорид, так как в этом случае образуются газообразные побочные продукты.
Галогенангидриды карбоновых кислот — весьма реакционноспособные вещества, широко применяемые в органическом синтезе.
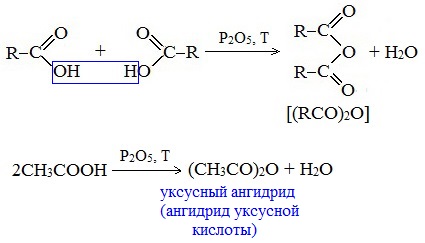
4. Образование ангидридов кислот (межмолекулярная дегидратация)
Ангидриды кислот образуются в результате межмолекулярной дегидратации кислот при их нагревании в присутствии оксида фосфора (V) в качестве водоотнимающего средства.
Вещества, которые образуются при отщеплении воды от органических кислот, называются ангидридами.
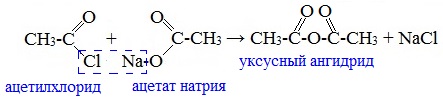
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты с безводной солью другой карбоновой кислоты: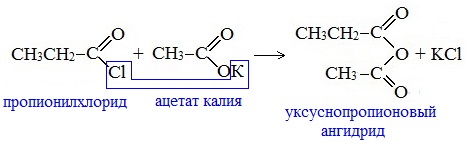
Муравьиная кислота не образует ангидрида. Дегидратация ее приводит к образованию оксида углерода (II).
Наиболее широкое применение находит уксусный ангидрид. Большое количество его расходуется для синтеза ацетилцеллюлозы, которая идет на изготовление искусственного шелка. Уксусный ангидрид используется также для получения аспирина.
III. Реакции с разрывом связи C-Н у ɑ-углеродного атома
(реакции с участием радикала)
1. Реакции замещения (с галогенами)
Атомы водорода у ɑ-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образование ɑ-галогенкарбоновых кислот.
Карбоновые кислоты взаимодействуют с галогенами в присутствии красного фосфора (реакция Геля-Фольгарда-Зелинского):


2-Хлорпропионовая кислота – промежуточный продукт для получения аминокислот. Действием на 2-хлорпропионовую кислоту аммиака получают 2-аминопропионовую кислоту (аланин):

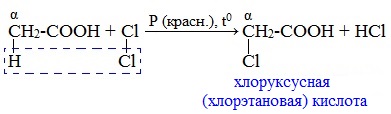
 При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:
При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:
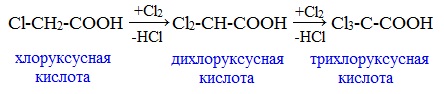
Дальнейшее хлорирование приводит к образованию дихлоруксусной и трихлоруксусной кислот:
IV. Реакции окисления (горение)
В атмосфере кислорода карбоновые кислоты сгорают с образованием оксида углерода (IV) СО2 и Н2О:
Видеоопыт «Горение уксусной кислоты на воздухе»
В отличие от альдегидов, карбоновые кислоты достаточно устойчивы к действию даже такого сильного окислителя, как перманганат калия. Исключение составляет муравьиная кислота, которая проявляет восстановительные свойства благодаря наличию альдегидной группы.
V. Реакции каталитического восстановления
Карбоновые кислоты с трудом восстанавливаются каталитическим гид-рированием, однако при взаимодействии с алюмогидридом лития (LiAlH4) или дибораном (В2Н6) восстановление осуществляется достаточно энергично:

Сравнение химических свойств органических и неорганических кислот
Особенности строения и свойства муравьиной кислоты
 Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа 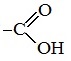
связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиная кислота является более сильной кислотой по сравнению с другими членами своего гомологического ряда.
Все предельные карбоновые кислоты устойчивы к действия концентрированной серной и азотной кислот. Но муравьиная кислота при нагревании с концентрированной серной кислотой разлагается на воду и монооксид углерода (угарный газ).
Специфические свойства муравьиной кислоты
1. Разложение при нагревании
При нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду:

Данную реакцию используют в лаборатории для получения чистого оксида углерода (II).
Видеоопыт «Разложение муравьиной кислоты»
Молекула муравьиной кислоты, в отличие от других карбоновых кислот, наряду с карбоксильной группой содержит в своей структуре и альдегидную группу.
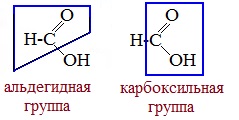
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Как и альдегиды, НСООН проявляет восстановительные свойства. Проявляя свойства альдегида, муравьиная кислота легко окисляется до угольной кислоты:

2. Окисление перманганатом калия

Видеоопыт «Окисление муравьиной кислоты раствором перманганата калия»
Муравьиная кислота окисляется аммиачным раствором Ag2О и гидроксидом меди (II) Cu (OH)2, т.е. дает качественные реакции на альдегидную группу!
3. Реакция «серебряного зеркала»
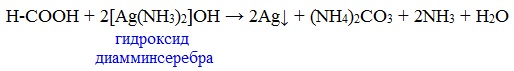
или в упрощенном виде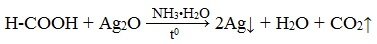

4. Окисление гидроксидом меди (II)

5. Окисление хлором, хлоридом ртути
Муравьиная кислота окисляется и другими окислителями (Сl2, HgCl2).
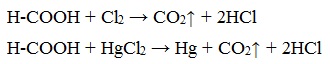
Формиаты щелочных металлов при сплавлении образуют соли щавелевой кислоты — оксалаты:

Видеоопыт «Взаимодействие бромной воды с олеиновой кислотой»
Карбоновые кислоты
§13. Карбонатна кислота і карбонати – Хімія – шкільний курс
Формула карбонатної (вугільної) кислоти – Н2СО3.
Солетворний оксид СО2 розчиняючись у воді утворює слабку кислоту, яка існує лише в момент її утворення. Кислота не стійка і відразу розкладається на вуглекислий газ і воду:
Н2СО3 ⇄ СО2↑+ Н2О.
Як двохосновна, вона дисоціює ступінчасто. Спочатку Н2СО3 ⇄ Н+ + НСО3–, а дальше у невеликій кількості НСО3– ⇄ Н+ + СО32–.
Ступінь дисоціації низький.
Внаслідок нестійкості молекул карбонатної кислоти її не можливо виділити в чистому вигляді. Якщо воду під тиском наситити вуглекислим газом, то добувають газовану воду. Газована вода – це і є водний розчин вугільної кислоти. Коли пляшку з газованою водою відкрити, тиск зменшується і вуглекислий газ у вигляді бульбашок виходить з води, тобто кислота розкладається. В момент її утворення вона взаємодіє з оксидами й гідроксидами лужних і лужноземельних металів.
Хімічні властивості карбонатної кислоти
Карбонатна кислота в момент її утворення взаємодіє з активними металами, основними оксидами, лугами. При надлишку кислоти з лугами утворюється кисла сіль.
Наприклад:
H2CO3 + Mg → MgCO3 + H2
H2CO3 + CaO → CaCO3 + H2O
H2CO3 + 2NaOH → Na2CO3 + 2H2O
H2CO3 + NaOH → NaHCO3 + H2O
У природних умовах розчинений вуглекислий газ входить до складу мінеральної води. Дощова вода з вмістом СО2 повільно розчиняє мармур, пам’ятники, прискорює корозію. Розчиняючи вапнякові породи до кислих солей сприяє утворенню печер.
Карбонати
Карбонатна кислота утворює два ряди солей: середні та кислі.
| Кислота | Кислотний залишок | Характер солі | Склад солі, назва | Приклад |
| Н2СО3 | − НСО3 | кисла | Me(HCO3)у гідрогенкарбонати | NaHCO3 – натрій гідрогенкабонат Ca(HCO3)2 – кальцій гідрогенкабонат |
| = СО3 | середня | Meх(CO3)у карбонати | Na2CO3 – натрій карбонат CaCO3 – кальцій карбонат |
Солі карбонатної кислоти – кристалічні речовини, сполуки стійкі, хоча сама кислота не стійка. Їх можна добути взаємодією вуглекислого газу з лугом. Реакцію можна зобразити такою схемою:
| MeOH + CO2 = Meх(CO3)у + Н2О MeOH + CO2 = MeНCO3 |
Наприклад:
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
Карбонати лужних металів і амонію, гідрокарбонати розчиняються у воді. Карбонати інших металів у воді не розчиняються. Карбонати хрому, феруму(ІІІ), купруму, меркурію не існують.
У природі найпоширеніший кальцій карбонат СаСО3 у вигляді вапняка, крейди та мармуру.
Хімічні властивості карбонатів
1. Відношення до нагрівання:
Карбонати лужних металів стійкі до нагрівання. Карбонат кальцію, магнію, малоактивних металів розкладаються при нагріванні: СаСО3 → СаО + СО2.
2. Взаємодія з кислотами:
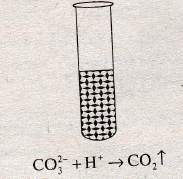
При взаємодії карбонатів із сильними кислотами спостерігається сильне спінювання розчину внаслідок виділення вуглекислого газу: СаСО3 + 2НCl = СаCl2 + Н2О + СО2. Цю реакцію використовують, щоб розпізнати карбонати серед інших речовин.
Лабораторний дослід 8. Дослідження властивостей карбонатів
Дослід 1. Взаємодія питної соди з оцтовою кислотою.
В пробірку налийте 1-2 мл оцтової кислоти і добавте трішки соди. Спостерігайте виділення газу. Напишіть рівняння реакції. Який газ виділяється?
Дослід 2. Якісна реакція на карбонати.
Налийте в пробірку натрій карбонат і долийте 1 мл розчину хлоридної кислоти. Що спостерігаєте? Напишіть повне та скорочене йонні рівняння.
3. Гідрокарбонати лужних металів перетворюються на карбонати:
2NаНСО3 → Nа2СО3 + СО2 + Н2О, інші – на оксиди: Mg(НСО3)2 → MgО + 2СО2 + Н2О.
4. Якщо через водний розчин натрій карбонату або кальцій карбонату пропустити вуглекислий газ, то карбонати перетворюються на гідрокарбонати: СаСО3 + СО2 + Н2О = Са(НСО3)2.
Застосування
- Деякі карбонати широко використовуються в промисловості.
- Na2CO3 (кальцинова сода) – у виробництві скла, мила, паперу, у побуті як миючий засіб, у нафтовій промисловості.
- CaCO3 – як будівельний матеріал і як вихідний продукт для добування вапна. Мелена крейда як наповнювач для ґумових сумішей, паперу, лінолеуму, зубного порошку. Мармур – для виготовлення скульптур, у будівництві.
- MgCO3 – для добування MgO і чистого CO2, який використовується для виробництва штучних мінеральних вод.
- K2CO3 (поташ) – виробництво мила, скла, як калійне добриво.
- NaHCO3 (питна сода) – у кондитерській справі, для виготовлення штучних мінеральних вод, у вогнегасниках, у медицині, у фотосправі.
- NH4HCO3 (амоніяк) – у кондитерській справі, для фарбування тканин, у медицині.
- PbCO3 – для виготовлення свинцевого білила. Фарба дає міцне покриття, зокрема для кораблів, але дуже отруйна.
- Cu2(OH)2CO3 (малахіт) – для виготовлення зелених фарб, ювелірних виробів, у піротехніці.
■ 157. Як дослідним шляхом можна довести наявність в окремих пробірках таких солей: натрій хлориду, натрій карбонату, натрій фосфату і натрій сульфату? Напишіть рівняння реакцій.
158. Яка сіль утвориться при взаємодії калій гідроксиду кількістю речовини 1 моль з карбонатною кислотою кількістю речовини 1 моль: кисла, основна чи середня. Відповідь підтвердіть рівняннями реакцій.
159. Серед переліку речовин виберіть формулу питної і кальцинованої соди:
Na2CO3, NaHCO3, Na2CO3•10H2O, CaCO3, K2CO3. Назвіть галузі їх застосування.
160. Як діють на карбонати розчини мінеральних кислот? Напишіть рівняння реакцій.
161. Дано: натрій хлорид, кальцій карбонат, кокс, вода, повітря. Як добути з них не менше 10 речовин, які мають практичне значення?
162. Складіть рівняння таких окисно-відновних реакцій:
KNO3 + S + C → K2SO4 + K2CO3 + CO2 + N2
KNO3 + S + C → K2S + CO2 + N2
163. Здійсніть такі перетворення:
а) CH4 → C → CO2;
б) Ca(HCO3)2 → CaCl2 → Cl2;
в) CO2 → Na2CO3 → NaHCO3 → NaNO3 → NaNO2.
164. Як практично здійснити реакції за такими схемами:
MgCO3 + H+ → Mg2+ + CO2 + H2O;
CO32– + H+ → H2O + CO2.
▲ ● 165. Вкажіть загальну назву солей карбонатної кислоти:
а) хлориди;
б) карбонати;
в) селітри;
г) силікати.
166. Виберіть формулу питної соди:
а) Na2CO3;
б) NaHCO3;
в) K2CO3;
г) CaCO3.
●● 167. Напишіть формули кислих і середніх солей карбонатів:
а) Магнію;
б) Калію;
в) Натрію.
Назвіть їх.
168. Серед переліку речовин виберіть формулу кальцинованої соди:
Na2CO3, NaHCO3, Na2CO3 • 10H2O, K2CO3, CaCO3.
●●● 169. Як діють на карбонати розчини мінеральних кислот? Поясніть на прикладі реакцій:
Na2CO3 + HCl →
K2CO3 + H2SO4 →
170. Складіть рівняння таких окисно-відновних реакцій:
ZnO + C → Zn + CO2;
H2SO4 + C → CO2 + SO2 + H2O.
171. Яку роль виконує сода при випіканні тіста?
●●●● 172. Здійсніть такі перетворення:
MgCO3 → CO2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CO2;
C → CO2 → MgCO3 → Mg(HCO3)2 → CO2.
173. Як практично здійснити реакції за такими схемами:
Ca2+ + CO32– → CaCO3;
Mg2+ + CO2 → MgCO3.
174. Складіть щонайменше три рівнянні реакцій добування кальцій карбонату різними способами.
Практична робота 1. Добування карбон(IV) оксиду. Взаємоперетворення карбонатів і гідрогенкарбонатів
Прилади і реактиви: прилад для добування газів, газовідвідна трубка з корком, штатив з пробірками, скіпка, сірники, мармур або крейда, розчин хлоридної кислоти, вапняна вода.
- Складіть прилад для добування газів і випробуйте його на герметичність. Замість колби можна взяти велику пробірку. У пробірку покладіть кілька шматочків мармуру або крейди і долийте трохи розбавленої хлоридної кислоти.
- Пробірку швидко закрийте корком з відвідною трубкою, кінець якої занурте у пробірку з вапняною водою. Що спостерігається?
- Продовжуйте пропускати газ у цю саму пробірку доти, доки не зникне каламуть і утвориться прозорий розчин. Чому розчин став прозорим?
- Кінець газовідвідної трубки опустіть у порожній стакан або пробірку. Час від часу запаленою скіпкою перевіряйте наявність вуглекислого газу. Що спостерігаєте?
Дайте відповідь на запитання:
- що відбувається при дії хлоридної кислоти на карбонати?
- як двома способами можна довести, що з пробірки виділяється саме вуглекислий газ?
- як пояснити появу каламуті в пробірці з вапняною водою, крізь яку пропускали цей газ і чому ця каламуть зникла? Напишіть рівняння реакцій у молекулярній, повній і скороченій йонних формах.
- як можна добути CO2 в лабораторії?
- при яких умовах карбонати перетворюються на гідрогенкарбонати?
- яка реакція якісна на карбонат-йон?
Конспект урока «Карбонатная кислота и ее соли» 9 класс
 Карбонатная кислота и ее соли
Карбонатная кислота и ее соли
Цели: изучить состав и свойства карбонатной кислоты, выяснить,
какие два ряда солей она образует, как практическим путем доказать наличие карбонат-ионов в растворе, раскрыть роль карбоната в природе и жизни человека; развить навыки самостоятельной работы, логическое мышление, умение делать выводы на основе наблюдения; формировать научное мировоззрение, коллективизм, умение слушать друг друга, придерживаться толерантности.
Тип урока: формирование новых знаний и умений.
Формы и методы работы: групповая, фронтальная, индивидуальная работа, опорный конспект, химический эксперимент, конкурс «Лотерея», игра «Третий лишний», сообщения, интерактивные упражнения «Мозговой штурм», «Мозговая атака», «Метод пресс», «Круг идей», метод мини-проектов.
Средства обучения: учебники, информационные листы для изучения нового материала, комплекты карточек «Формулы соединений», приборы и реактивы для опыта, иллюстрирующего получение карбон(IV) оксида, качественную реакцию на карбонат-ион; образцы карбонатов: мел, мрамор, известняк, раковины моллюсков, яичная скорлупа; коллекция «Карбонаты в природе».
ХОД УРОКА
I . Организация класса. Создание эмоционального настроя
Учитель. Добрый день, друзья!
В начале урока я хочу прочитать вам отрывок из произведения Л. Кэрролла «Алиса в Стране чудес»:
«За несколько шагов от нее сидел на ветке Чеширский кот.
“Скажите, пожалуйста, куда мне отсюда идти?” — “А куда ты хочешь попаcть?” — спросил в ответ кот — “Мне все равно…” — сказала Алиса.
«Тогда все равно куда идти”, — заметил кот».
Что хочет сказать этим кот Алисе и зачем я прочитала эти слова в самом начале урока?
Ваше мнение.
(Ответы учащихся)
Да, правильно, нужно знать цель своей работы. И сегодня на уроке мы будем учиться наблюдать и делать выводы. Эти умения необходимы в жизни каждому человеку. Для нас наблюдать — это не просто замечать, ведь наблюдение — первый этап человеческого познания.
Поэтому постарайтесь сегодня хотя бы мысленно, а иногда и вслух начинать свой ответ словами: «А вот я заметил…»
Поэтому к работе, друзья!
II. Актуализация опорных знаний
Конкурс «Лотерея»
Консультант от каждой группы тянет жребий — по две задачи под номерами, что подскажет очередь во время ответов. От каждой группы выступает один ученик и получает балл. Если ответ неточный, на этот вопрос может отвечать ученик из другой группы, за что получит 2 балла.
«Микрофон»
1. Дайте определение классу кислот с точки зрения теории электролитической диссоциации.
2. Как именно классифицируют кислоты?
3. Какие общие физические свойства кислот вам известны и как их объяснить?
4. Какие кислоты уже известны?
5. Как образуются кислоты?
6. Какие оксиды вам известны?
7. Что такое кислотные оксиды?
8. Какие оксиды Углерода вам известны? Какую степень окисления проявляет Карбон в этих соединениях?
9. Что такое солеобразующие, несолеобразующие оксиды?
10. Какой оксид Карбона есть солеобразующим?
Творческие задания
1. Как правильно ставить палатку в горах?
Сформируйте свою версию происхождения названия «Собачьей пещеры», «Долины смерти».
Игра «Третий лишний»
С каждой горизонтальной строке вычеркнуть формулу, что принадлежит к другому классу неорганических соединений
NaOH
Н2С03
Са(ОН),
С02
SiO;
Na2CO,
NaHCO,
H2S04
HNO,
• Какие вещества лишние?
• К какому классу соединений они принадлежат?
Итак, объектом нашего исследования является карбонатная кислота. Записываем тему урока в тетрадях (на доске).
III. Мотивация учебной деятельности
Сегодня мы продолжаем изучать тематический блок «Карбон — Силиция», Вы уже изучили простые соединения, образованные этими элементами, и самые простые среди сложных — оксиды.
А сейчас мы продолжим изучать сложные соединения на примере карбонатной кислоты.
Чтобы правильно обращаться и знать применение этой кислоты, нужно детально ее исследовать и изучить.
«Мозговая атака»
Что вы знаете о Н2С03?
Все идеи учащихся фиксируются в тетрадях.
А достаточно ли ваших знаний, чтобы быть образованным человеком, правильно использовать это соединение вести себя с ней? А что бы вы еще хотели знать о Н2С03?
(Возможные предложения учеников)
• Как образуется Н2С03?
• Какие свойства имеет?
• Какие соли образует?
• Как определить С03~ в растворе?
• Какое значение Н2С03 и ее солей?
Нам нужно определить проблему, над решением которой мы будем работать на уроке.
Вспомним (схема в информационном листе).
• От чего зависят свойства веществ?
• Что мы можем предсказать, зная свойства веществ?
Итак, мы изучаем свойства веществ зависят от строения и определяют области их применения.
Проблема нашего урока
Установление причинно-следственных связей между строением, свойствами и областями использования карбонатной кислоты и ее солей.
Девизом нашего урока будут слова Б. Шоу; «Единственный путь, ведущий к знанию, — это деятельность».
IV. Изучение нового материала
Для успешной работы над проблемой нам нужно составить план работы. Поэтому пусть предложенные вами вопросы станут задачей сегодняшнего урока/
1. Строение молекулы. Получения.
2 Химические свойства карбонатной 1 кислоты, характерные и для других кислот.
3 Специфические свойства Н2С03.
4. Соли карбонатной кислоты. Роль карбонатов в природе,
5 Обнаружения карбонат-ионов.
6. Применение Н2С03 и ее солей.
Поскольку учебный материал темы не является совершенно новым, ведь с некоторыми кислотами мы уже встречались неоднократно, то изучение нового материала будем осуществлять групповым методом.
Сегодня у нас работает пять групп. (Ученики тянут жребий.)
Группа 1. Строение молекул. Получения.
Группа 2. Химические свойства карбонатной кислоты, характерные и для других кислот.
Группа 3. Специфические свойства
и Н2С03.
Группа 4. Соли карбонатной кислоты. Роль карбонатов в природе.
Группа 5. Обнаружение карбонат-ионов.
Индивидуальные задания
(Сообщения учеников)
1.Использование Н2С03.
2. Применение карбонатов, гидро — генкарбонатов.
Работать вы будете пшр. ками Н. М. Буринської, § 22, с — т ф. Т. Фельдмана для 9 класса, § С*. ЗА с. 90; дополнительной литературой, информационным письмом.
Появляется опорный конспект по темам «Карбонатная кислота и соли». Сегодня мы с вами должны провести лабораторные опыты, поэтому перед началом работы предоставляем слово инженеру по технике безопасности.
Инструктаж по технике безопасности во время
работы с кислотами и щелочами
1 . Будьте максимально осторожны, выполняя работу.
2 . Выполняйте только те опыты, которые описаны в Инструкции.
3. Чрезвычайную осторожность следует проявить при работе с кислотами, особенно беречь глаза. В случае попадания кислоты на руки следует немедленно смыть п большим количеством воды и обработать пораженное место натрий пдроген — карбонатом.
4. Осторожно обращаться со щелочами.
В случае попадания щелочи на руки следует немедленно смыть ее большим количеством воды и обработать пораженное место 3%-М раствором уксусной кислоты.
5 .Не заглядывайте в пробирку, в которой находится жидкость, и не наклоняйтесь над сосудом, в который наливают какую-либо жидкость, потому что мелкие капли могут попасть в глаза.
Желаю вам настойчивости и весомых достижений в изучении темы.
Учитель. Как образуется Н2С03 (с которых оксидов)? Слово предоставляется членам первой группы (см. приложение 1).
Вывод. Н2СО, образованная двумя оксидами— С02 и Н20.
Учитель. Посмотрите внимательно на схему
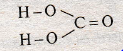
Какой элемент будет определять свойства Н2С03 ?
Об этом мы узнаем, прослушав членов второй группы (см. приложение 2).
Вывод.
В состав Н2С03 входит и атом Водорода (Н), следовательно, карбонатная кислота будет проявлять все свойства, характерные для кислот.
Учитель. А имеет Н2С03 свои особые свойства? Прослушаем членов третьей группы (см. приложение 3).
Вывод. Карбонатная кислота неустойчива. Является слабой кислотой, что подтверждает розовую окраску лакмусу, а не красную, как в растворах сильных кислот.
Учитель. Обратите внимание на количество атомов Водорода в молекуле карбонатной кислоты. Какова основность карбонатной кислоты? (См. приложение 2) Сколько видов солей она может образовывать? Какие свойства имеют соли. Слово предоставляется членам четвертой группы (см. приложение 4).
Вывод. Карбонатная кислота образует два типа солей — карбонаты и гидрогенкарбонаты. Соли карбонатной кислоты имеют свойства, характерные и для других солей; имеют щелочную реакцию, поэтому ими можно пользоваться для нейтрализации кислотной среды; в остатке карбоновой кислоты превращаются в карбонаты гидрогенкарбонаты.
Учитель. Существует способ, с помощью которого можно отличить карбонаты и гидрогенкарбонаты от других солей?
С результатами своих исследований ознакомят нас члены пятой группы (см. приложение 5).
Вывод. Соли карбонатной кислоты легко можно определить с помощью сильных кислот. Будучи одной из самых слабых кислот, она легко вытесняется из солей более сильными
кислотами (НСІ, H2S04).
У ч и те л ь. Какое же практическое значение имеют соли карбонатной кислоты?
(Сообщение учеников)
V. Рефлексия
Мы ознакомились с главными вопросами, которые должны были рассмотреть на уроке. Сделаем общий вывод, пользуясь опорным конспектом.
«Мозговой штурм»
1 . Из каких оксидов образуется Н2С03
2. Какие свойства имеет?
З. С чем реагирует?
4. Какие два ряда солей образует?
5. Что является качественной реакцией на CO3-2?
Общий вывод
Общие с другими кислотами свойства Н2С03 обусловленные наличием в ее составе ионов Н+, а особые — наличием ионов С03-2 . Качественной реакцией на карбонат-ион С03-2 и НСО3— являются его ионы Н+.
Карточка
Зарядка
Встаньте, друзья,
И улыбнитесь,
Земле нашей поклонитесь
За счастливый день вчерашний,
Вы к солнцу потянитесь,
Веретеном покрутитесь.
Раз присядьте,
Два присядьте
И за парты тихо сядьте.
Сообщение учащихся
VI Закрепление новых знаний
Интерактивное упражнение «Метод ПРЕСС»
Ученики выполняют задачи в составе групп. Затем обсуждают результаты.
1. Как очистить яйцо от скорлупы, не разбивая его?
2. Врач приписал больному полоскать горло раствором питьевой соды и предупредил, чтобы он не растворял и ее в кипящей воде. Почему? Ответ обосновать.
3. Незнайка знал, что предметы, которые горят, можно тушить водой или песком. Знайка посоветовал как более эффективное средство использовать питьевую соду. Соглашаетесь ли вы с ним? Ответ обосновать.
4. Ученик попросил лаборанта принести ему карбонатную кислоту для выполнения опыта. Или сможет-же лаборант выполнить просьбу ученика? Ответ обосновать.
Интерактивное упражнение «Круг идей»
(Ученики выполняют на листах.)
Закончить уравнение химических реакций:
• Са + Н2С03 —>
• С02 + Н20 + Ва(ОН)7 —»
• K2CO3+HNO3-> ’
• Mg(HCO2)2 —»
VII. Подведение итогов урока
Сегодня вы закрепили знания о кислотах. ознакомились со строением, свойствами, получением, применением карбонатной кислоты и ее солей. Еще раз убедились, что свойства веществ зависят от их строения и определяют области применения.
Консультанты подводят итоги работы учащихся в группах, заполняют таблицу оценивания.
№
Список учеников
Баллы
За работу в группе
Дополнительно набранные
всего
Учитель. Все плодотворно работали сегодня на уроке, поэтому я считаю, что эпиграф нашего урока мы полностью подтвердили. Спасибо всем за сотрудничество.
VIII. Домашнее задание
§ 21 (Буринская Н. М. Химия. 10 кл.), с. 86-88, № 131 (I—IVрівні), № 134 (III—IV уровни).
Творческие задания:
1. В чайнике много накипи. А почему накипь не образуется в кастрюлях? Как избавиться от накипи?
2. В стакан с раствором соляной кислоты опускаем яйцо, оно тонет, но через некоторое время всплывает на поверхность, а потом снова ныряет. Почему?
3 .Советуют белить потолок и стены на кухне известью, а в комнате мелом, и
Какая разница? Как вы думаете?
Приложение 1
Знакомая незнакомка
Открывая бутылку минеральной воды или любого газированного напитка, мы встречаемся с нашей «незнакомкой». Это она — карбонатная кислота.
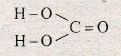
Итак, карбонатную кислоту образуют два оксиды — С02 и Н20.
Приложение 2
Химические свойства карбонатной кислоты
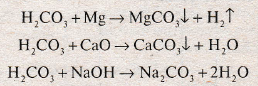
Следовательно, карбонатная кислота будет проявлять свойства, характерные и для других кислот за счет наличия и ионов Водорода.
Приложение 3
Н2СО3 — вещество, формулу которого принято считать условной, то есть такой молекулы в свободном состоянии не существует. Существует лишь в водном растворе Н2СО3, содержится в газированных напитках. часто вырывается из бутылки, разбрызгиваясь вокруг. Это происходит потому, что молекулы ее неустойчивы, а в бутылке они находятся под большим давлением. Когда мы открываем крышку, давление уменьшается, Н2С03 разлагается на С02 и Н20.
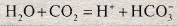
Н2СО3 является слабой кислотой, поэтому синий лакмусовая бумажка приобретает и розового, а не красного цвета как в растворах сильных кислот.
Приложение 4
Гидрогенкарбонаты растворимые
Na2CO3, (Nh5)2CO3, Ca(HCO3)2, Mg(HCO3)2, (NaHCO3-малорастворимый).
Карбонаты нерастворимые
CaCO3, MgCO3
Исключение: карбонаты — щелочные Me и (Nh5)2CO3.
CO3-2
Превращения
 Соли
Соли
Превращение карбонатов в природе
Почва и известняк – карбонаты
Гидрогенкарбонаты, которые попадают в реки, моря, океаны
Организмы строят свой скелет
В процессе жизнедеятельности выделяется CO2
Почвенные воды, попадает CO2
Почва и известняк – карбонаты/
Приложение 5
Качественная реакция
Гидролиз
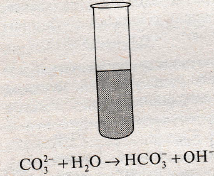
Итак, для распознания карбонатов и гидрогенкарбонатов используются сильные кислоты
Информационный лист для изучения нового материала по теме «Карбонатная кислота и ее соли»
Задание 1
Конкурс «Лотерея»
Интерактивное упражнение «Микрофон»
1 Дайте определение классу кислот с точки зрения электролитической диссоциации.
2. Как именно классифицируют кислоты?
3. Какие общие химические свойства кислот вам известны и как их объяснить?
4. Какие кислоты вам известны?
5. Как образуются кислоты?
6. Какие оксиды вам известны?
7. Что такое кислотные оксиды?
8. Какие оксиды Углерода вам известны? Какую степень окисления проявляет Карбон в этих соединениях?
9. Что такое солеобразующие и несолеобразующие оксиды?
10. Какой оксид Карбона является солеобразующим?
Игра «Третий лишний»
Из каждой горизонтальной строки вычеркните формулу, что принадлежит к другому классу органических соединений..
NaOH
h3CO3
Ca(OH)2
CO2
SiO2
Na2CO3
NaHCO3
h3SO4
NHO3
Строение молекул. Получение
• Как образуется Н2С03 (из которых оксидов)?
• Молекулярная, электронная, структурная формулы.
• Виды связи.
• Среди перечня формул: С02, Na20, КОН, Н20, MgCl2 выберите формулы оксидов, назовите их.
• Какие оксиды два из выбранных образуют Н2С03?
• Напишите уравнение реакции, которое приводит к образованию Н2С03.
Лабораторный опыт 1
В пробирку всыпьте немного Н2С03, добавьте 1 мл НСl и сразу же закройте пробирку пробкой с газопроводной трубкой, конец которой опустите в пробирку с дистиллированной водой и пропустите через нее газ. В воду добавьте несколько капель метилоранжа.
2. Химические свойства
Химические свойства характерны и для других кислот.
• 3 какими веществами реагирует?
• Напишите уравнения реакций, характерные действие Н2С03, используйте схему:
Лабораторный опыт 2
В пробирку всыпьте немного К2С03, добавьте 1 мл НСl, закройте пробирку пробкой с газопроводной трубкой, конец газопроводной трубки погрузите в пробирку с дистиллированной водой и пропустите через нее газ. Добавьте каплями NaOH.
3. Специфические свойства Н2С03
• Устойчивая или неустойчивая соединение.
• Сильный или слабый электролит.
• Как меняется лакмусовая бумажка?
Лабораторный опыт 4
В пробирку насыпьте немного К2С03, добавьте 1 мл НСl, закройте пробирку пробкой с газопроводной трубкой, конец которой опустите в пробирку с дистиллированной водой и пропустите через нее газ. В воду добавьте несколько капель лакмуса. Что наблюдаете?
3. Соли карбонатной кислоты
Превращение карбонатов в природе.
• Какие соли образует Н2С03?
• Цепочка понятий составьте в следующей последовательности: вид солей, название солей, который йон содержат, примеры.
Лабораторный опыт 4
5. Обнаружение карбонат — и гидрогенкарбонат-ионов
• Проведите опыт по определению СО32-, НСО3—: в растворе, воспользовавшись инструкцией.
• Что является реактивом на С032-, НС03—?
• Составьте соответствующие уравнения в молекулярном и ионном виде.
• Как же определить СО32- в растворе?
Лабораторный опыт 5
В одну пробирку налейте 1 мл раствора К2С03 и добавьте каплями НС1; во вторую — 2 мл раствора КНС03 и добавьте h3S04. Что наблюдаете?
6. Общий вывод
7. Интерактивное упражнение
«Метод ПРЕСС»
1. Как очистить яйцо от скорлупы, не разбивая его?
2. Врач прописал больному полоскать горло раствором питьевой соды и предупредил, чтобы не растворял ее в кипящей воде. Почему? Ответ обосновать.
3. Незнайка знал, что предметы, которые горят, можно тушить водой или песком. Знайка посоветовал как более эффективное средство использовать питьевую соду. Согласны ли вы с этим? Ответ обосновать.
4. Ученик попросил лаборанта принести ему Н2СО, для выполнения опыта. Сможет лаборант выполнить просьбу ученика? Ответ обосновать.
7. Интерактивное упражнение «Круг идей»
Закончить уравнение химических реакций:
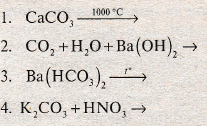
Карбонові кислоти — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
 Загальна формула
Загальна формула  Реакції карбонових кислот
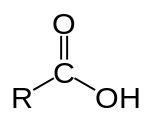
Реакції карбонових кислотКарбо́нові кисло́ти — органічні сполуки, що містять одну або декілька карбоксильних груп COOH. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавлева, малонова, фталева, азелаїнова кислота) та багатоосновні (лимонна кислота). Синонім — карбоксильні кислоти.
Карбонові кислоти — органічні сполуки RC(=O)OH, що мiстять карбоксильну групу (C=O)–OH (пишеться також –COOH, –СО2Н). Йонізуються у воді та інших полярних розчинниках. Переважно є слабкими кислотами (рКа4 — 5), кислотнiсть підсилюється зі збільшенням електроноакцепторності замiсника R, ароматичнi карбо-новi кислоти сильнiшi за насиченi алiфатичнi. При взаємодії з лужними металами, основними оксидами та основами утворюють солі. Внаслідок дегiдратацiї дають ангiдриди. Гiдроксильна група здатна замiнюватись на алкоксильну (естерифiкацiя), на амiногрупу або амiновмiснi групи(даючи амiди, гiдразиди), на атом галогену з утворенням галогенангідридів RCOCl (пр., з PCl5, SOCl2). Декарбоксилюються при нагріванні в присутності лугів, процес полегшується електроноакцепторними групами в α-положеннi. Можуть бути відновлені до спиртів (пр., NaBH4). За кількістю груп розрізняють одно-, дво- та багатоосновні кислоти.
До складу карбонових кислот ( далі К. к. ) можуть входити також інші функціональні групи, наприклад, –OH, –NH2, –C=O. К. к. значно слабші за мінеральні кислоти. Ароматичні К. к. сильніші за насичені аліфатичні. Утворюють солі та різні похідні речовини: галогенангідриди, аміди, естери. Мають різноманітне промислове застосування і велике біологічне значення.
У молекулах К. к., як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами. Але в кислотах гідроксильна група перебуває під впливом групи атомів карбоксилу, в той час як в спиртах на неї впливає вуглеводневий радикал. Вплив карбонільної групи на гідроксил проявляється, зокрема, в тому, що атом водню гідроксильної групи в кислотах значно більш «кислотний», ніж у спиртах: легше заміщується металом і може відщеплюватися у вигляді катіона, наприклад:
CH3COOH ⇄ CH3COO– + H+
З лугом ці кислоти утворюють солі:
CH3COOH + NaOH → CH3COONa + H2O
Карбонові кислоти є слабкими кислотами, тому їх солі зазнають гідролізу. Залежно від числа карбоксильних груп в молекулі, карбонові кислоти підрозділяються на одноосновні (суфікс -ова), двоосновні (суфікс -діова), триосновні (суфікс -тріова), тощо.
Назви карбонових кислот[ред. | ред. код]
- Функціональні похідні карбонових та вугільної кислот: Навч. посіб. для студ. хім. спец. ун-тів / М. І. Ганущак, В. В. Карп’як; Львів. нац. ун-т ім. Івана Франка. — Л., 2002. — 292 c. — Бібліогр.: 25 назв.
| ||||||||||||||||||||||||
Карбонаты — это… Что такое Карбонаты?
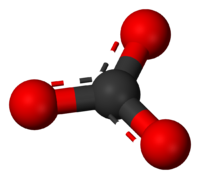 Модель карбоната иона
Модель карбоната ионаКарбона́ты и ги́дрокарбонаты — соли и эфиры угольной кислоты (H2CO3). Среди солей известны нормальные карбонаты (с анионом СО32−) и кислые или гидрокарбонаты (с анионом НСО3−).
Растворимость
Из нормальных карбонатов в воде растворимы только соли щелочных металлов, аммония и таллия. Вследствие гидролиза растворы их показывают щелочную реакцию. Малорастворимы нормальные карбонаты кальция, бария, стронция и свинца. Все кислые карбонаты хорошо растворимы в воде; кислые карбонаты сильных щелочей также имеют слабощелочную реакцию.
Химические свойства
- При нагревании кислые карбонаты переходят в нормальные карбонаты:
- При сильном нагревании нормальные карбонаты разлагаются на оксиды и углекислый газ:
Распространение в природе
Нормальные карбонаты широко распространены в природе, например: кальцит СаСО3, доломит CaMg(CO3)2, магнезит MgCO3, сидерит FeCO3, витерит ВаСО3, баритокальцит BaCa(CO3)2 и др. Существуют и минералы, представляющие собой основные карбонаты, например, малахит CuCO3·Cu(ОН)2.
Гидрокарбонаты натрия, кальция и магния встречаются в растворённом виде в минеральных водах, а также, в небольшой концентрации, во всех природных водах, кроме атмосферных осадков и ледников. Гидрокарбонаты кальция и магния обуславливают так называемую временную жёсткость воды. При сильном нагревании воды (выше 60 °C) гидрокарбонаты кальция и магния разлагаются на углекислый газ и малорастворимые карбонаты, которые выпадают в осадок на нагревательных элементах, дне и стенках посуды, внутренних поверхностях баков, бойлеров, труб, запорной арматуры и т. д., образуя накипь.
Применение
Карбонаты кальция, магния, бария и др. применяют в строительном деле, в химической промышленности, оптике и др. В технике, промышленности и быту широко применяется сода (Na2CO3 и NaHCO3): при производстве стекла, мыла, бумаги, как моющее средство, при заправке огнетушителей, в кондитерском деле. Кислые карбонаты выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови.
Карбонаты органические
Сложные эфиры угольной кислоты. Средние ациклические карбонаты — бесцветные жидкости с эфирным запахом; не растворимы или труднорастворимы в воде, этаноле, диэтиламине, аммиаке, растворяются в эфире, ацетоне, бутиламине, бензиламине; образуют азеотропные смеси с водой, спиртами, тетрахлорметаном, этиленхлоргидрином, гексаном, циклогексаном. Циклические — жидкие или легкоплавкие твёрдые вещества; растворяются в воде, смешиваются с ароматическими углеводородами, спиртами, карбоновыми кислотами, ацетоном, хлороформом; не растворимы в алифатических углеводородах, сероводороде; образуют азеотропные смеси с гликолями. Наиболее употребителен диметилкарбонат (см. Карбонилирование)[1].
Литература
- Химия 9. — М.: Вентана-Граф, 2010. — С. 287.
Примечания
- ↑ Химия 9. — М.: Вентана-Граф, 2010. — С. 287.
См. также
Угольная кислота (h3CO3) — структура, свойства, применение и часто задаваемые вопросы
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРСНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- BNAT 000 NC
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел для класса 12
- Классы
- CBSE Контрольный документ за предыдущий год
- CBSE Контрольный документ за предыдущий год Класс 10
- Контрольный документ за предыдущий год CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Примечания к редакции
- CBSE Class
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
Дополнительные вопросы по математике для класса 10
- CBSE Class
- Дополнительные вопросы по науке, класс 10 по CBSE
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия Решения для биологии класса 11
- Решения NCERT для математики класса 11 9 0003 NCERT Solutions Class 11 Accountancy
- NCERT Solutions For Класс 12 по физике
- Решения NCERT для химии класса 12
- Решения NCERT для класса 12 по биологии
- Решения NCERT для класса 12 по математике
- Решения NCERT Класс 12 Бухгалтерия
- Решения NCERT, класс 12, бизнес-исследования
- Решения NCERT, класс 12 Экономика
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для социальных наук класса 6
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для класса 7 Наука
- Решения NCERT для класса 7 по социальным наукам
- Решения NCERT для класса 7 Английский
- Решения NCERT для класса 8 Математика
- Решения NCERT для класса 8 Science
- Решения NCERT для социальных наук 8 класса
- Решение NCERT ns для класса 8 Английский
- Решения NCERT для социальных наук класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для Математика класса 9 Глава 2
- Решения NCERT для математики класса 9 Глава 3
- Решения NCERT для математики класса 9 Глава 4 Решения NCERT
- для математики класса 9 Глава 5
- Решения NCERT для математики класса 9 Глава 6
- Решения NCERT для Математика класса 9 Глава 7
- Решения NCERT для математики класса 9 Глава 8 Решения NCERT
- для математики класса 9 Глава 9 Решения NCERT
- для математики класса 9 Глава 10
- Решения NCERT для математики класса 9 Глава 11
- Решения NCERT для Математика класса 9 Глава 12
- Решения NCERT для математики класса 9 Глава 13 Решения
- NCERT для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для класса 9 Наука Глава 3
- Решения NCERT для Науки Класса 9 Глава 4
- Решения NCERT для Науки Класса 9 Глава 5
- Решения NCERT для Науки Класса 9 Глава 6
- Решения NCERT для Науки Класса 9 Глава 7
- Решения NCERT для Класса 9 Наука Глава 8
- Решения NCERT для Науки Класса 9 Глава 9
- Решения NCERT для Науки Класса 9 Глава 10
- Решения NCERT для Науки Класса 9 Глава 12
- Решения NCERT для Науки Класса 9 Глава 11
- Решения NCERT для Класса 9 Наука Глава 13
- Решения NCERT для класса 9 Наука Глава 14
- Решения NCERT для класса 9 по науке Глава 15
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для математики класса 10 Глава 1
- Решения NCERT для математики класса 10 Глава 2
- Решения NCERT для математики класса 10 Глава 3
- Решения NCERT для математики класса 10 Глава 4
- Решения NCERT для математики класса 10 Глава 5
- Решения NCERT для математики класса 10 Глава 6
- Решения NCERT для класса 10 по математике Глава 7
Угольная кислота — CreationWiki, энциклопедия науки о сотворении
Угольная кислота — неорганическая кислота, которая содержится в основном в жидкостях. Он может существовать только в виде раствора и имеет белый цвет в воде. Он состоит в основном из углекислого газа и не является очень сильной кислотой. Вы можете найти его в газировке и многом другом. Он разъедает известняк и кальций, что приводит к образованию многих пещер в течение определенного периода времени, поскольку он разъедает скалу. Это слабая кислота, которая используется в нескольких отраслях промышленности и входит в состав газа.Придает газированным напиткам острый вкус. Он нерастворим в воде, его химическая формула — H 2 CO 3 . Его систематическое название — диметилкарбонат, а другое название — раствор диоксида углерода. Древние названия угольной кислоты были «кислота воздуха» и «кислота воздуха».
История
Угольная кислота была впервые обнаружена в Пирмонтской воде доктором Браунриггом, а углекислый газ был впервые обнаружен доктором Блэком в 1757 году. Затем в 1785 году она была названа угольной кислотой.В 1867 году Джозеф Листер, хирург из Королевской больницы Глазго, обнаружил, что углекислый газ, нанесенный на открытую рану после операции, действует как антисептик, убивая бактерии, которые будут формироваться вокруг вскрытой области.
Недвижимость
Угольная кислота образуется, когда диоксид углерода растворяется в воде, и может существовать только в растворе. Это слабая, нестабильная двухосновная кислота, которая образует карбонатные и бикарбонатные соли. Угольная кислота может давать две серии солей: карбонатную и гидрокарбонатную.Углекислота растворяет горные породы, металлы, минералы и может образовывать пещеры. Кислотность угольной кислоты составляет 6,36 пК, ее точка кипения составляет -78 ° C, а температура плавления составляет 210 ° C. Ее молярная масса составляет 275,74 г, а ее номер CAS — 463-79-6.
Встречи
 Угольная кислота может быть найдена в пещерах.
Угольная кислота может быть найдена в пещерах.Угольная кислота содержится в крови, дождевой воде, кальците, ферментации, угле, грунтовых водах, метеоритах, вулканах, аминокислотах, белках, океанах, растениях, эритроцитах, отложениях серы, солях и пещерах.
Использует
Углекислота имеет множество применений, например, удобрение, газированная вода, в качестве газа в области медицины, фармацевтики, косметики, горючего сланца, пищевой добавки, медицины, анестетика, топлива, промышленности, солей, лазеров, розлива в бутылки, контактных линз. очиститель, двигатели, лечебный, гидролиз крахмала, лекарства и сварка.
Кислотный дождь и океан
 Кислотный дождь стирает статуи, такие как эта горгулья.
Кислотный дождь стирает статуи, такие как эта горгулья.Кислотный дождь или обычный дождь содержат растворенную угольную кислоту с pH 4.От 5 до 5,6. Углекислота в океане увеличивается, в результате чего многие животные, такие как планктон, умирают и разъедают раковины и кораллы. Кислотный дождь падает и стекает в океан, делая его более кислотным, чем было раньше. Уровень pH океана составляет 8,1, что примерно на 0,1 ниже, чем в начале промышленной революции. Кислотный дождь с угольной кислотой реагирует с карбонатом кальция в мраморных статуях и зданиях, образуя растворимый гидрокарбонат кальция, медленно разрушая их.Углекислый газ выходит из автомобилей или заводов в воздух, смешиваясь с дождевой водой с образованием углекислоты. Затем он стекает в океан, где наносит ущерб морской жизни.
Список литературы
- [1] Угольная кислота
- [2] Джозеф Листер
- [3] Повышение кислотности океана
- [4] Угольная кислота
- [5] Кислотный дождь
угольная кислота | Формула, применение и факты
Угольная кислота , (H 2 CO 3 ), соединение элементов водорода, углерода и кислорода. Он образуется в небольших количествах, когда его ангидрид, диоксид углерода (CO 2 ), растворяется в воде.
Подробнее по теме
Оксикислота: угольная кислота и карбонатные соли
Угольная кислота (h3CO3) образуется в небольших количествах, когда ее ангидрид, диоксид углерода (CO2) ,…
CO 2 + H 2 O ⇌ H 2 CO 3 Преобладающими видами являются просто слабогидратированные молекулы CO 2 . Угольная кислота может рассматриваться как дипротонная кислота, из которой могут быть образованы две серии солей, а именно гидрокарбонаты, содержащие HCO 3 —, и карбонаты, содержащие CO 3 2-. H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 —
HCO 3 — + H 2 O ⇌ H 3 O + + CO 3 2− Однако кислотно-основное поведение угольной кислоты зависит от различных скоростей некоторых участвующих реакций, а также от их зависимости от pH системы.Например, при pH менее 8 основные реакции и их относительная скорость следующие: CO 2 + H 2 O ⇌ H 2 CO 3 (медленный)
H 2 CO 3 + OH — ⇌ HCO 3 — + H 2 O (быстро) При pH выше 10 важны следующие реакции: CO 2 + OH — ⇌ HCO 3 — (медленный)
HCO 3 — + OH — ⇌ CO 3 2− + H 2 O (быстрый) Между значениями pH от 8 до 10 все вышеупомянутые равновесные реакции значимы .
Углекислота играет важную роль в образовании пещер и пещерных образований, таких как сталактиты и сталагмиты. Самые большие и самые распространенные пещеры — это пещеры, образованные растворением известняка или доломита под действием воды, богатой углекислотой, полученной в результате недавних дождей. Кальцит в сталактитах и сталагмитах происходит из вышележащего известняка вблизи границы между коренными породами и почвой. Дождевая вода, проникая через почву, поглощает углекислый газ из богатой углекислым газом почвы и образует разбавленный раствор углекислоты.Когда эта кислая вода достигает основания почвы, она вступает в реакцию с кальцитом в известняковой породе и переводит часть его в раствор. Вода продолжает свой нисходящий поток через узкие стыки и трещины в ненасыщенной зоне с минимальной химической реакцией. Когда вода выходит из крыши пещеры, углекислый газ теряется в атмосферу пещеры, и часть карбоната кальция выпадает в осадок. Проникающая вода действует как насос кальцита, удаляя его из верхней части коренных пород и повторно откладывая в пещере внизу.
Угольная кислота играет важную роль в переносе углекислого газа в кровь. Углекислый газ попадает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани. Когда углекислый газ попадает в кровь, он соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H + ) и ионы бикарбоната (HCO 3 — ). Высвобождающиеся ионы водорода минимально влияют на кислотность крови, поскольку белки крови, особенно гемоглобин, являются эффективными буферными агентами.(Буферный раствор сопротивляется изменению кислотности за счет объединения с добавленными ионами водорода и, по существу, их инактивации.) Естественное преобразование диоксида углерода в угольную кислоту — относительно медленный процесс; однако карбоангидраза, белковый фермент, присутствующий внутри красных кровяных телец, катализирует эту реакцию с достаточной скоростью, которая осуществляется всего за доли секунды. Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в эритроците в гораздо большей степени, чем в плазме.Способность крови переносить углекислый газ в виде бикарбоната усиливается системой переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлора. Одновременный обмен этими двумя ионами, известный как сдвиг хлоридов, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда плазмы или эритроцитов. Только 26 процентов от общего содержания углекислого газа в крови существует в виде бикарбоната внутри красных кровяных телец, в то время как 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала вырабатывается внутри ячейки, а затем переносится в плазму.Обратная последовательность реакций происходит, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчас .Что такое угольная кислота? (с изображением)
Угольная кислота — это слабая кислота, которая образуется при растворении диоксида углерода (CO 2 ) в воде (H 2 O), в результате чего получается химическая формула H 2 CO 3 . Когда кислота диссоциирует или отдает ион водорода, образующаяся молекула называется бикарбонатным ионом. Угольная кислота часто встречается в мире природы. Его можно найти в газированных напитках, шампанском и крови.Кислота появляется даже под дождем.
 Углекислота добавляется в напитки, например, в газировку, чтобы придать им газированный вкус.
Углекислота добавляется в напитки, например, в газировку, чтобы придать им газированный вкус.При производстве соды углекислый газ растворяется в воде.Как уже говорилось, в этом процессе также образуется угольная кислота. Эта кислота, наряду с фосфорной кислотой и другими кислотами, придает терпкий вкус многим газированным напиткам. Он также вызывает легкое жжение, которое человек испытывает при употреблении газированного напитка. Таким образом, именно кислота делает газированные напитки газированными.
Угольная кислота играет важную роль в поддержании стабильного уровня pH в организме.Нормальный pH жидкостей организма составляет около 7,4 и должен поддерживаться близким к этому значению, чтобы организм мог нормально функционировать. Если pH изменяется, повышается или понижается, ферменты могут перестать функционировать, мышцы и нервы могут начать ослабевать, а метаболическая активность нарушится. Бикарбонат-ион, выделяемый кислотой, служит буфером, который помогает противостоять изменениям pH. Это означает, что он может действовать как кислота или основание по мере необходимости.
Кислоты — это любые вещества, выделяющие ионы водорода в растворы.Основания — это вещества, которые принимают ионы водорода. Когда в организме накапливаются избыточные ионы водорода, т. Е. Жидкости становятся более кислыми, ионы бикарбоната принимают эти дополнительные ионы водорода и поддерживают рН организма на нормальном уровне. И наоборот, если уровень ионов водорода падает слишком сильно, т. Е. Жидкости становятся слишком щелочными, угольная кислота отдает ионы водорода, чтобы поддерживать нормальный pH крови. Этот процесс также наблюдается при переносе кислорода и углекислого газа.
Углекислота обычно встречается даже во время дождя.Когда дождевая вода попадает в воздух, она поглощает углекислый газ, образуя углекислоту. Таким образом, когда он достигает земли, его pH составляет около 5,5. Это не следует путать с кислотным дождем, который возникает, когда выбросы, такие как оксиды серы и оксиды азота, от сжигания ископаемого топлива, поднимаются в воздух. Когда идет дождь, дождь поглощает эти компоненты, производя кислоты, которые могут снизить pH дождя до двух.
.