Карбонат натрия: свойства, получение, применение
Карбонат натрия – это кальцинированная сода или же безводный карбонат натрия. Когда-то ею мыли посуду, а пищевую соду (гидрокарбонат натрия) добавляли в тесто. Школьники отмывали и той, и другой содой следы чернил с поверхности парт. Каждый узнает о химической формуле и происхождении этого мелкокристаллического порошка белого цвета в школе.
Получение вещества
Химическая формула карбоната натрия – Na2CO3 (натриевая соль слабой угольной кислоты). Содой пользовались еще со времен Древнего Египта. Тогда источником кальцинированной соды были естественные месторождения, такие пласты залегали в слоях земной коры. Теперь натрия карбонат выделяют из некоторых минералов. В природе источником соды служат содовые озера, которые расположены в Забайкалье, в США, а самое популярное озеро в Танзании.

Кальцинированная сода применяется только для бытовых целей, ни в коем случае не в пищу
Позже научились добывать соду из золы морских водорослей и некоторых прибрежных растений. Благодаря названию растения Salsola Soda (солянка содоносная) карбонат натрия получил свое название в быту. Его добыча из водорослей являлась основным способом производства вплоть до 19 века.
Возможно, вам будет интересно: Столовая сода: целебные свойства, применение и оздоровление
Химическая промышленность не стояла на месте. В 1791 году французский ученый химик Леблан запатентовал метод превращения глауберовой соли в натриевую соль. Так впервые в лабораторных условиях получили кальцинированную соду. Пищевая сода появилась позже. В 1861 году бельгийский инженер-химик Сольве запатентовал промышленный способ создания соды путем соединения хлорида натрия, аммиака и диоксида углерода. Этот метод получения карбоната натрия используют и сейчас.
Видео: получение карбоната натрия из пищевой соды
Применение кальцинированной соды
Карбонат натрия широко применяется в технической и химической промышленности. Его используют при производстве стиральных порошков и чистящих средств, стекла и чугуна. Соду применяют в мыловарении, для смягчения воды, либо для полного устранения ее жесткости. Также ее используют в текстильной и нефтепромышленности. Помогает кальцинированная сода и в быту.
Больше о кальцинированной соде: Кальцинированная (техническая) сода: применение, характеристики, достоинства и недостатки
Карбонат натрия в быту
- Удаление накипи
Натрия карбонат замечательно справляется с накипью на посуде. Достаточно в воду добавить 1-2 столовые ложки кальцинированной соды и прокипятить в течение 30 минут, и чайник засияет, как новый. Не забудьте после чистки сполоснуть чайник от содового порошка чистой водой.
- Сода от нагара
Сода избавит от нагара на посуде снаружи. Следует на губку насыпать немного нашего чудо-порошка и потереть поверхность, с которой нужно убрать загрязнение. Эмаль на кастрюлях и чайнике засияет, как новая, а жирные пятна и нагар исчезнут.

После обработки содой кастрюли будут как новые
- Чистка сантехники
Кальцинированная сода поможет чистить унитаз, ванну и умывальник. Убрать загрязнение, плесень, ржавчину и ужасный осадок с сантехники можно при помощи карбоната натрия. Для этого нужно ½ стакана соды всыпать в чашу унитаза, затем туда же влить столько же 9% уксуса, тщательно распределить смесь по внутренней части унитаза туалетным ершиком и дать постоять так от 15 до 30 минут. Время выдержки зависит от степени загрязнения и количества пятен. Затем хорошо промыть поверхность водой.
Чтоб вычистить внешнюю часть унитаза и другую керамику в ванной, смешайте карбонат натрия с водой до состояния мягкой кашицы. Ее следует нанести ее на обрабатываемую поверхность губкой, выдержать от 10 минут или более, а после смыть уксусным раствором. По окончании работ промойте все чистой водой. Помните о мерах предосторожности: проводите манипуляции в хорошо проветриваемом помещении (откройте двери, окно или включите вытяжку), а кожу рук защищайте резиновыми перчатками.
А тут можно прочесть о еще одном виде соды – каустической: Что такое каустическая сода: свойства и способы применения
- Отбеливание и удаление пятен
Натрия карбонат замечательно выполняет функции пятновыводителя и деликатного отбеливателя для тканей. Чтоб вывести пятно, следует смешать столовую ложку бельевой соды (она же кальцинированная сода) с водой и нанести на пятно. Через 15 минут смойте раствор. Если пятно не исчезло, процедуру требуется повторить. Желаете усилить эффект – вместо воды добавьте нашатырный спирт или перекись водорода. Чтобы отбелить одежду, замочите ее на 2-5 часов в таком растворе: пять ложек соды и две ложки нашатыря на пять литров чистой воды. Далее белье тщательно прополощите и постирайте, как обычно.
Обратите внимание: этот рецепт поможет устранить желтизну с тканей, если в этом растворе белье прокипятить не менее получаса.
Можно ли кальцинированной содой стирать в машинке? Конечно – загрузите в лоток для порошка полстакана соды и включайте привычную программу.
Бельевая сода используется и для ручной стирки. На пять литров чистой воды добавьте 5 столовых ложек содового порошка и раствор готов для стирки. Такие рецепты стирки, отбеливания не подойдут для деликатных тканей – шелка, шерсти, кашемира и др.

Помимо стирки белья, кальцинированная сода прочистит барабан стиральной машины
Ремонтные работы
Сода – превосходная помощница во время ремонта. Если требуется обновить покрытие пола, а тратить время на скобление от старой краски нет времени и сил, тогда заранее посыпьте карбонатом натрия поверхность, накройте влажной мешковиной, и через 12 часов снять старую краску не составит труда.
Если желаете избавиться от засора в трубах, то с этой задачей легко справится натрия карбонат. Достаточно полстакана соды залить 2-3 литрами кипятка, чтобы устранить проблему. Засыпаем соду в слив, заливаем кипяток, оставляем на тридцать минут, через полчаса смываем большим количеством воды.
Водный раствор кальцинированной соды легко отчистит бытовую технику от пыли, грязи, жира и других загрязнений. При въевшихся пятнах рекомендуется потереть влажной губкой с нанесенной на нее кашицей из соды и воды. Точно так можно проводить влажную уборку в доме добавляя немного карбоната натрия в воду.
Возможно, будет интересно о применении в быту соды пищевой с уксусом: Сода и уксус: как их использовать для поддержания чистоты и в кулинарии
Работая с карбонатом натрия, помните о безопасности. Предохраняйте от попадания вещества и раствора слизистую глаз, рта, открытую кожу, защищайте руки перчатками, избегайте отравления и аллергических реакций (возможны зуд, жжение и покраснение). Держите порошок подальше от детей. Все работы проводите в хорошо проветриваемых помещениях.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Использование соды в кулинарии
Карбонат натрия (кальцинированную соду) в кулинарии применять нельзя. Для пищевых продуктов используют только гидрокарбонат натрия (пищевая сода, NaHCO3), он входит в состав многих продуктов, разрыхлителей, применяется для улучшения вкуса мяса и рыбы, добавляет воздушности тесту. Многие рецепты не обходятся без пищевой соды.
Важно! В кулинарии применяют только пищевую соду – бикарбонат натрия.
Видео: отличия кальцинированной и пищевой соды
Польза и вред карбонатов натрия
Использование питьевой соды (пищевой, гидрокарбоната натрия, бикарбоната натрия, натрия двууглекислого) способно улучшить состояние здоровья. Доказано, что пищевая сода
- снижает артериальное давление;
- исключает дефицит натрия в организме;
- применяется для похудения;
- улучшает обмен веществ;
- способствует расщеплению жиров;
- выводит токсины из организма;
- оказывает положительный эффект на состояние кожи и волос;
- борется с грибковыми заболеваниями, простудой, ангиной, стоматологическими проблемами.

Для простуды сода пищевая – враг №1
Чрезмерное использование NaHCO3 (бикарбоната натрия, пищевой соды) может повысить кислотность желудка вследствие инверсных реакций. Перед использованием того или иного метода лечения натрием двууглекислым обязательно проконсультируйтесь со своим семейным доктором.
Что говорят врачи о пищевой соде, можно прочесть тут: Гидрокарбонат натрия для организма человека: больше пользы или вреда?
А вот карбонат натрия (соду кальцинированную) внутрь применять нельзя. При использовании этого вещества для уборки всегда помните о мерах предосторожности и дозировке. Кальцинированная сода не просто вызывает раздражение, а разъедает кожу, поэтому если она попала туда, необходимо как можно скорее смыть порошок или его раствор большим количеством воды.
Карбонат натрия (кальцинированная сода) обладает сильным разъедающим действием.
Упаковывается кальцинированная сода чаще всего в плотный полиэтилен, масса колеблется от 125 грамм в упаковке до мешков весом в 25 килограмм. Транспортировка не требует специальных условий, поэтому перевозят карбонат натрия обычным способом. Но помните о высокой гигроскопичности соды, поэтому нужно предупредить попадание влаги при хранении и транспортировке.

Пищевую и кальцинированную соду сложно отличить по внешнему виду
Не стоит путать кальцинированную соду с пищевой. Для стирки и уборки применяется и та, и другая разновидность соды. А вот в пищевых целях используют исключительно натрий двууглекислый, поэтому будьте внимательны!
свойства, получение, применение :: SYL.ru
Вы бродите по супермаркету, разыскивая стиральный порошок без фосфатов. Естественно, для того чтобы узнать, какое средство из целого арсенала бытовой химии вам подходит, берете в руки каждую упаковку с нужной классификацией и смотрите состав содержащегося в ней продукта. Наконец, выбрали подходящее средство, но в процессе изучения всех стиральных порошков магазина заметили странную закономерность: на каждой коробке или пачке было написано что-нибудь типа: «В состав продукта входит карбонат натрия». В каждом человеке присутствует малая толика любопытства, и вы не являетесь исключением. Захотелось узнать, что это за вещество, не так ли? Сегодняшняя статья пополнит объм ваших знаний некоторыми сведениями об этом соединении.
Определение
 Карбонат натрия (формула Na2CO3) является натриевой солью угольной кислоты. В разных источниках его могут называть по-разному: и углекислым натрием, и динатрия триоксокарбонатом, и кальцинированной содой. Кстати, о последнем названии. Обсуждаемое сейчас химическое соединение в чистом виде — это не та пищевая сода, которую добавляют в различные продукты. Ее название — гидрокарбонат натрия. Вещества с присутствием карбоната натрия (да и сам он тоже) зовутся содами. Исключение составляет каустическая сода, научное название которой — гидроксид одноименного металла. Однако гидрокарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные соды — сам карбонат с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.
Карбонат натрия (формула Na2CO3) является натриевой солью угольной кислоты. В разных источниках его могут называть по-разному: и углекислым натрием, и динатрия триоксокарбонатом, и кальцинированной содой. Кстати, о последнем названии. Обсуждаемое сейчас химическое соединение в чистом виде — это не та пищевая сода, которую добавляют в различные продукты. Ее название — гидрокарбонат натрия. Вещества с присутствием карбоната натрия (да и сам он тоже) зовутся содами. Исключение составляет каустическая сода, научное название которой — гидроксид одноименного металла. Однако гидрокарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные соды — сам карбонат с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.Карбонат натрия: физические свойства
Это вещество в безводном состоянии имеет вид бесцветного кристаллического порошка (фото выше). Строение его кристаллической рещетки зависит от температуры окружения: если последняя не меньше 350, но ниже 479оС, то она является моноклинной, если температура выше — гексагональной.
Карбонат натрия: химические свойства
Если опустить его в сильную кислоту, то угольная, получившаяся в ходе реакции и являющаяся крайне нестойкой, распадется на газообразный оксид четырехвалентного углерода и воду. Второй продукт реакции — натриевая соль соответствующей кислоты (например, при бросании кристаллов обсуждаемого сейчас карбоната в серную кислоту, получатся углекислый газ, вода, и сульфат натрия). В воде данное соединение будет гидролизоваться, благодаря этому нейтральная среда становится щелочной
Получение
 Его можно получить несколькими способами, все они разные, но в этой статье будет рассказано лишь об одном. Необходимо смешать мел и древесный уголь с сульфатом натрия, а потом запечь эту смесь при температуре около 1000оС. Уголь будет восстанавливать последний до сульфида, который при реакции с карбонатом кальция образует расплав сернистого кальция и искомого вещества. Его необходимо обработать водой, затем отфильтровать ненужный сульфид и упарить получившийся раствор. Образовавшийся сырой карбонат натрия очищается посредством перекристаллизации, а затем обезвоживается с помощью кальцинирования. Данный метод называется способом Леблана.
Его можно получить несколькими способами, все они разные, но в этой статье будет рассказано лишь об одном. Необходимо смешать мел и древесный уголь с сульфатом натрия, а потом запечь эту смесь при температуре около 1000оС. Уголь будет восстанавливать последний до сульфида, который при реакции с карбонатом кальция образует расплав сернистого кальция и искомого вещества. Его необходимо обработать водой, затем отфильтровать ненужный сульфид и упарить получившийся раствор. Образовавшийся сырой карбонат натрия очищается посредством перекристаллизации, а затем обезвоживается с помощью кальцинирования. Данный метод называется способом Леблана.Применение
 Отрасли, производящие стекло, стиральные порошки, мыло и эмали не обходятся без карбоната натрия, где его используют, чтобы получить ультрамарин. Также с помощью него устраняют жесткость воды, обезжиривают металлы и проводят десульфатизацию, объектом которой является доменный чугун. Карбонат натрия является хорошим окислителем и регулятором кислотности, его содержат моющие посуду средства, сигареты и пестициды. Также он известен как пищевая добавка E500, не дающая ингредиентам комковаться и слёживаться. Обсуждаемое сейчас вещество необходимо и для того, чтобы приготовить проявитель фотографий.
Отрасли, производящие стекло, стиральные порошки, мыло и эмали не обходятся без карбоната натрия, где его используют, чтобы получить ультрамарин. Также с помощью него устраняют жесткость воды, обезжиривают металлы и проводят десульфатизацию, объектом которой является доменный чугун. Карбонат натрия является хорошим окислителем и регулятором кислотности, его содержат моющие посуду средства, сигареты и пестициды. Также он известен как пищевая добавка E500, не дающая ингредиентам комковаться и слёживаться. Обсуждаемое сейчас вещество необходимо и для того, чтобы приготовить проявитель фотографий.Заключение
Вот для чего полезен карбонат натрия. В чистом виде он, может быть, многим никогда и не встречался, однако его кристаллогидраты (это все соды, кроме каустической) используются человеком почти везде. Это одно из веществ, соединения которых с водой применяются в промышленности гораздо чаще, чем они сами в чистом виде.
Вы бродите по супермаркету, разыскивая стиральный порошок без фосфатов. Естественно, для того чтобы узнать, какое средство из целого арсенала бытовой химии вам подходит, берете в руки каждую упаковку с нужной классификацией и смотрите состав содержащегося в ней продукта. Наконец, выбрали подходящее средство, но в процессе изучения всех стиральных порошков магазина заметили странную закономерность: на каждой коробке или пачке было написано что-нибудь типа: «В состав продукта входит карбонат натрия». В каждом человеке присутствует малая толика любопытства, и вы не являетесь исключением. Захотелось узнать, что это за вещество, не так ли? Сегодняшняя статья пополнит объм ваших знаний некоторыми сведениями об этом соединении.
Определение
Карбонат натрия (формула Na 2 CO 3) является натриевой солью угольной кислоты. В разных источниках его могут называть по-разному: и углекислым натрием, и динатрия триоксокарбонатом, и кальцинированной содой. Кстати, о последнем названии. Обсуждаемое сейчас химическое соединение в чистом виде — это не та пищевая сода, которую добавляют в различные продукты. Ее название — гидрокарбонат натрия. Вещества с присутствием карбоната натрия (да и сам он тоже) зовутся содами. Исключение составляет каустическая сода, научное название которой — гидроксид одноименного металла. Однако гидрокарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные соды — сам карбонат с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.
Карбонат натрия: физические свойства
Это вещество в безводном состоянии имеет вид бесцветного кристаллического порошка (фото выше). Строение его кристаллической рещетки зависит от температуры окружения: если последняя не меньше 350, но ниже 479 о С, то она является моноклинной, если температура выше — гексагональной.
Карбонат натрия: химические свойства
Если опустить его в сильную кислоту, то угольная, получившаяся в ходе реакции и являющаяся крайне нестойкой, распадется на газообразный оксид четырехвалентного углерода и воду. Второй продукт реакции — натриевая соль соответствующей кислоты (например, при бросании кристаллов обсуждаемого сейчас карбоната в серную кислоту, получатся углекислый газ, вода, и сульфат натрия). В воде данное соединение будет гидролизоваться, благодаря этому нейтральная среда становится щелочной
Получение
Его можно получить несколькими способами, все они разные, но в этой статье будет рассказано лишь об одном. Необходимо смешать мел и древесный уголь с сульфатом натрия, а потом запечь эту смесь при температуре около 1000 о С. Уголь будет восстанавливать последний до сульфида, который при реакции с карбонатом кальция образует расплав сернистого кальция и искомого вещества. Его необходимо обработать водой, затем отфильтровать ненужный сульфид и упарить получившийся раствор. Образовавшийся сырой карбонат натрия очищается посредством перекристаллизации, а затем обезвоживается с помощью кальцинирования. Данный метод называется способом Леблана.
Применение
Отрасли, производящие стекло, стиральные порошки, мыло и эмали не обходятся без карбоната натрия, где его используют, чтобы получить ультрамарин. Также с помощью него устраняют жесткость воды, обезжиривают металлы и проводят десульфатизацию, объектом которой является доменный чугун. Карбонат натрия является хорошим окислителем и регулятором кислотности, его содержат моющие посуду средства, сигареты и пестициды. Также он известен как пищевая добавка E500, не дающая ингредиентам комковаться и слёживаться. Обсуждаемое сейчас вещество необходимо и для того, чтобы приготовить проявитель фотографий.
Заключение
Вот для чего полезен карбонат натрия. В чистом виде он, может быть, многим никогда и не встречался, однако его кристаллогидраты (это все соды, кроме каустической) используются человеком почти везде. Это одно из веществ, соединения которых с водой применяются в промышленности гораздо чаще, чем они сами в чистом виде.
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положител
Карбонат натрия — Википедия
| Карбонат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
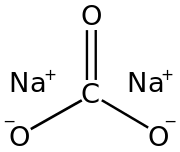
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 252 дня] из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- N a 2 S O 4 + 2 C → N a 2 S + 2 C O 2 {\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- N a 2 S + C a C O 3 → N a 2 C O 3 + C a S {\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 N a C l + H 2 S O 4 → N a 2 S O 4 + 2 H C l {\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- N H 3 + C O 2 + H 2 O + N a C l → N a H C O 3 + N H 4 C l {\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2 N a H C O 3 → o t N a 2 C O 3 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2 N H 4 C l + C a ( O H ) 2 → C a C l 2 + 2 N H 3 + 2 H 2 O {\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2426 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- C O 3 2 − + H 2 O ⇄ H C O 3 − + O H − {\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- N a 2 C O 3 + H 2 S O 4 → N a 2 S O 4 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
| Карбонат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 252 дня] из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- N a 2 S O 4 + 2 C → N a 2 S + 2 C O 2 {\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- N a 2 S + C a C O 3 → N a 2 C O 3 + C a S {\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 N a C l + H 2 S O 4 → N a 2 S O 4 + 2 H C l {\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- N H 3 + C O 2 + H 2 O + N a C l → N a H C O 3 + N H 4 C l {\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2 N a H C O 3 → o t N a 2 C O 3 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2 N H 4 C l + C a ( O H ) 2 → C a C l 2 + 2 N H 3 + 2 H 2 O {\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2426 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- C O 3 2 − + H 2 O ⇄ H C O 3 − + O H − {\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- N a 2 C O 3 + H 2 S O 4 → N a 2 S O 4 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
Карбонат натрия — Википедия
| Карбонат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 252 дня] из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- N a 2 S O 4 + 2 C → N a 2 S + 2 C O 2 {\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- N a 2 S + C a C O 3 → N a 2 C O 3 + C a S {\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 N a C l + H 2 S O 4 → N a 2 S O 4 + 2 H C l {\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- N H 3 + C O 2 + H 2 O + N a C l → N a H C O 3 + N H 4 C l {\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2 N a H C O 3 → o t N a 2 C O 3 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2 N H 4 C l + C a ( O H ) 2 → C a C l 2 + 2 N H 3 + 2 H 2 O {\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2426 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- C O 3 2 − + H 2 O ⇄ H C O 3 − + O H − {\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- N a 2 C O 3 + H 2 S O 4 → N a 2 S O 4 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
| Карбонат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 252 дня] из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- N a 2 S O 4 + 2 C → N a 2 S + 2 C O 2 {\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- N a 2 S + C a C O 3 → N a 2 C O 3 + C a S {\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 N a C l + H 2 S O 4 → N a 2 S O 4 + 2 H C l {\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- N H 3 + C O 2 + H 2 O + N a C l → N a H C O 3 + N H 4 C l {\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2 N a H C O 3 → o t N a 2 C O 3 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2 N H 4 C l + C a ( O H ) 2 → C a C l 2 + 2 N H 3 + 2 H 2 O {\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2426 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- C O 3 2 − + H 2 O ⇄ H C O 3 − + O H − {\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- N a 2 C O 3 + H 2 S O 4 → N a 2 S O 4 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
Лекарственная форма: для инъекций, раствор
Медицински рассмотрен Drugs.com. Последнее обновление: 1 марта 2020 г.
ДЛЯ ИСПРАВЛЕНИЯ МЕТАБОЛИЧЕСКОГО АЦИДОЗА И ДРУГИХ УСЛОВИЙ, ТРЕБУЮЩИХ СИСТЕМНОЙ АЛКАЛИНИЗАЦИИ.
ТолькоRx
ОПИСАНИЕ
Бикарбонат натрия для инъекций, USP — это стерильный, непирогенный, гипертонический раствор бикарбоната натрия (NaHCO3) в воде для инъекций для внутривенного введения в качестве наполнителя электролитов и системного алкализатора.
Растворпредлагается в концентрации 8,4%. Смотрите таблицу в разделе КАК ПОСТАВЛЯЕТСЯ содержание и характеристики.
Раствор не содержит бактериостат, антимикробный агент или добавленный буфер и предназначен только для использования в виде инъекций однократной дозы, приблизительный pH растворов составляет 8. Если требуются меньшие дозы, неиспользованную часть следует выбросить.
Бикарбонат натрия, 84 мг, равен одному миллиэквиваленту каждого из Na + и HCO3-. Бикарбонат натрия, USP, химически обозначен NaHCO3, белый кристаллический порошок, растворимый в воде.
Вода для инъекций, USP, обозначена химически как вода.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Внутривенная терапия бикарбонатом натрия увеличивает бикарбонат плазмы, буферизирует избыточную концентрацию ионов водорода, повышает рН крови и устраняет клинические проявления ацидоза.
Бикарбонат натрия в воде диссоциирует с образованием ионов натрия (Na +) и бикарбоната (HCO3-). Натрий (Na +) является основным катионом внеклеточной жидкости и играет большую роль в терапии нарушений жидкости и электролитов.Бикарбонат (HCO3-) является нормальным компонентом жидкостей организма, и нормальный уровень в плазме колеблется от 24 до 31 мг-экв / л. Концентрация в плазме регулируется почками за счет подкисления мочи при дефиците или подщелачивания мочи при избытке. Бикарбонат-анион считается «лабильным», поскольку при надлежащей концентрации иона водорода (Н +) он может превращаться в углекислоту (h3CO3) и, следовательно, в ее летучую форму — диоксид углерода (CO2), выделяемый легкими. Обычно соотношение внеклеточной жидкости составляет 1:20 (углекислота: бикарбонат).У здорового взрослого человека с нормальной функцией почек практически весь бикарбонат-ион клубочкового фильтра реабсорбируется; менее 1% выводится с мочой.
ПОКАЗАНИЯ И ИСПОЛЬЗОВАНИЕ
Инъекция бикарбоната натрия, USP показана при лечении метаболического ацидоза, который может возникать при тяжелой почечной недостаточности, неконтролируемом диабете, недостаточности кровообращения из-за шока или тяжелой дегидратации, экстракорпоральной циркуляции крови, остановке сердца и тяжелом первичном лактоацидозе.Бикарбонат натрия дополнительно показан при лечении некоторых наркотических интоксикаций, в том числе барбитуратов (где желательна диссоциация комплекса барбитурат-белок), при отравлении салицилатами или метиловым спиртом и при гемолитических реакциях, требующих подщелачивания мочи для уменьшения нефротоксичности гемоглобина и его продукты распада. Бикарбонат натрия также показан при тяжелой диарее, которая часто сопровождается значительной потерей бикарбоната.
Лечение метаболического ацидоза следует, по возможности, накладывать на меры, направленные на борьбу с основной причиной ацидоза — e.г., инсулин при неосложненном диабете, восстановление объема крови при шоке. Но поскольку значительный промежуток времени может пройти до того, как будут достигнуты все вспомогательные эффекты, показана бикарбонатная терапия, чтобы минимизировать риски, присущие самому ацидозу.
Энергичная бикарбонатная терапия необходима при любой форме метаболического ацидоза, где решающее значение имеет быстрое увеличение общего содержания CO2 в плазме, например, остановка сердца, недостаточность кровообращения из-за шока или тяжелой дегидратации, а также при тяжелом первичном лактоацидозе или тяжелом диабетическом ацидозе.
ПРОТИВОПОКАЗАНИЯ
Инъекция бикарбоната натрия, USP противопоказана пациентам, которые теряют хлорид из-за рвоты или из-за постоянного всасывания в желудочно-кишечном тракте, и пациентам, получающим диуретики, о которых известно, что они вызывают гипохлоремический алкалоз.
ПРЕДУПРЕЖДЕНИЯ
Растворы, содержащие ионы натрия, следует использовать с большой осторожностью, если вообще, у пациентов с застойной сердечной недостаточностью, тяжелой почечной недостаточностью и в клинических состояниях, при которых существует отек с задержкой натрия.
У пациентов с пониженной функцией почек, введение растворов, содержащих ионы натрия, может привести к задержке натрия.
Внутривенное введение этих растворов может вызвать перегрузку жидкости и / или растворенного вещества, что приведет к разбавлению концентраций электролита в сыворотке, чрезмерной гидратации, застойным состояниям или отеку легких.
Следует избегать внесосудистой инфильтрации, см. ПОБОЧНЫЕ РЕАКЦИИ.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Общие
Не используйте, если раствор не прозрачен и контейнер или уплотнение не повреждены.Откажитесь от неиспользованной части.
Потенциально большие дозы натрия, назначаемые с бикарбонатом, требуют осторожности при использовании бикарбоната натрия у пациентов с застойной сердечной недостаточностью или другими отечными или задерживающими натрий состояниями, а также у пациентов с олигурией или анурией. См. Таблицу в разделе «КАК ПОСТАВЛЯЕТСЯ» для количеств натрия, присутствующего в растворах.
Следует соблюдать осторожность при введении парентеральных жидкостей, особенно те, которые содержат ионы натрия, пациентам, получающим кортикостероиды или кортикотропин.
Истощение калия может предрасполагать к метаболическому алкалозу, а сопутствующая гипокальциемия может быть связана с карпопедальным спазмом при повышении рН в плазме. Эти опасности могут быть сведены к минимуму, если такие электролитные дисбалансы соответствующим образом обработать до или одновременно с инфузией бикарбоната.
Лабораторные испытания
Целью любой бикарбонатной терапии является существенная коррекция низкого общего содержания CO2 и pH крови, но следует избегать риска передозировки и алкалоза.Следовательно, повторные дробные дозы и периодический контроль с помощью соответствующих лабораторных тестов рекомендуется, чтобы минимизировать возможность передозировки.
Наркотиков взаимодействий
Добавки могут быть несовместимы; Норадреналин и добутамин несовместимы с раствором бикарбоната натрия.
Следует избегать добавления бикарбоната натрия в парентеральные растворы, содержащие кальций, за исключением случаев, когда совместимость была ранее установлена. Осаждение или помутнение могут быть результатом примесей бикарбоната натрия и кальция.ПРИМЕЧАНИЕ: не используйте инъекцию, если она содержит осадок.
Добавки могут быть несовместимы. При введении добавок проконсультируйтесь с фармацевтом. При введении добавок используйте асептическую технику, тщательно перемешайте и не храните.
Беременность: тератогенных эффектов
Беременность Категория CНе были проведены исследования животных репродукции с бикарбонатом натрия. Также неизвестно, может ли бикарбонат натрия причинять вред плоду при назначении беременной женщине или влиять на репродуктивную способность.Бикарбонат натрия следует назначать беременной женщине только при явной необходимости.
Детская
Быстрая инъекция (10 мл / мин) гипертонической инъекции бикарбоната натрия, раствора USP новорожденным и детям в возрасте до двух лет может вызывать гипернатриемию, снижение давления в спинномозговой жидкости и возможное внутричерепное кровоизлияние. Поэтому скорость введения у таких пациентов должна быть ограничена не более 8 мг-экв / кг / день. 4,2% раствор может быть предпочтительным для такого медленного введения.В чрезвычайных ситуациях, таких как остановка сердца, риск быстрой инфузии должен быть сопоставлен с вероятностью летального исхода из-за ацидоза.
Гериатрический
Клинические исследования инъекций бикарбоната натрия, USP не включали достаточное количество субъектов в возрасте 65 лет и старше, чтобы определить, реагируют ли они иначе, чем у более молодых субъектов. Другой зарегистрированный клинический опыт не выявил различий в ответах пожилых и молодых пациентов. В целом, выбор дозы для пожилого пациента должен быть осторожным, обычно начиная с нижнего предела диапазона дозирования, отражая большую частоту снижения функции печени, почек или сердца и сопутствующего заболевания или другой лекарственной терапии.
ПОБОЧНЫХ РЕАКЦИЙ
Чрезмерно агрессивная терапия с инъекцией бикарбоната натрия, USP может привести к метаболическому алкалозу (связанному с мышечными подергиваниями, раздражительностью и тетанией) и гипернатриемией.
Сообщалось, что непреднамеренная экстравазация внутривенно введенных гипертонических растворов бикарбоната натрия вызывает химический целлюлит из-за их щелочности, с некрозом ткани, изъязвлением или шелушением в месте инфильтрации. Рекомендуется быстрое увеличение части, тепло и местное введение лидокаина или гиалуронидазы, чтобы уменьшить вероятность расслоения ткани от экстравазированного I.В. Решения.
ПЕРЕДОЗИРОВКА
В случае возникновения алкалоза бикарбонат следует прекратить, а пациенту следует проводить лечение в соответствии со степенью присутствия алкалоза. 0,9% раствор хлорида натрия может быть введен внутривенно; хлорид калия также может быть показан при гипокалиемии. Тяжелый алкалоз может сопровождаться повышенной раздражительностью или тетанией, и эти симптомы могут контролироваться глюконатом кальция. Подкисляющий агент, такой как хлорид аммония, также может быть показан при тяжелом алкалозе.Смотрите ПРЕДУПРЕЖДЕНИЯ и МЕРЫ ПРЕДОСТОРОЖНОСТИ.
АДМИНИСТРАЦИЯ И ДОЗИРОВКА
Бикарбонат натрия для инъекций, USP вводится внутривенно.
При остановке сердца сначала может быть дана быстрая внутривенная доза от одного до двух флаконов по 50 мл (от 44,6 до 100 мг-экв) и продолжаться со скоростью 50 мл (от 44,6 до 50 мг-экв) каждые 5-10 минут, если необходимо (как указано) путем артериального рН и мониторинга газов крови), чтобы обратить вспять ацидоз. Следует соблюдать осторожность в чрезвычайных ситуациях, когда показано очень быстрое вливание больших количеств бикарбоната.Растворы бикарбоната являются гипертоническими и могут вызывать нежелательное повышение концентрации натрия в плазме в процессе коррекции метаболического ацидоза. Однако при остановке сердца риск ацидоза превышает риск гипернатриемии.
При менее острых формах метаболического ацидоза, инъекции бикарбоната натрия, USP могут добавляться к другим внутривенным жидкостям. Количество бикарбоната, которое следует давать детям старшего возраста и взрослым в течение периода от четырех до восьми часов, составляет примерно от 2 до 5 мг-экв / кг массы тела — в зависимости от тяжести ацидоза, что определяется по снижению общего содержания CO2 , рН крови и клиническое состояние больного.При метаболическом ацидозе, связанном с шоком, терапию следует контролировать путем измерения газов крови, осмолярности плазмы, лактата артериальной крови, гемодинамики и сердечного ритма. Бикарбонатную терапию всегда следует планировать поэтапно, поскольку степень ответа от данной дозы точно не предсказуема. Первоначально инфузия от 2 до 5 мг-экв / кг массы тела в течение периода от 4 до 8 часов приведет к заметному улучшению аномального кислотно-основного состояния крови. Следующий этап терапии зависит от клинического ответа пациента.Если выраженные симптомы уменьшились, то частота приема и размер дозы могут быть уменьшены.
В целом, нецелесообразно пытаться полностью скорректировать низкое общее содержание СО2 в течение первых 24 часов терапии, поскольку это может сопровождаться нераспознанным алкалозом из-за задержки приведения вентиляции в нормальное состояние. Из-за этой задержки достижение общего содержания CO2 около 20 мг-экв / л в конце первого дня терапии обычно связано с нормальным pH крови.Дальнейшее изменение ацидоза до полностью нормальных значений обычно происходит при наличии нормальной функции почек, когда и если можно устранить причину ацидоза. Значения общего CO2, которые доведены до нормального или выше нормального уровня в течение первого дня терапии, с большой вероятностью могут быть связаны с сильно щелочными значениями pH крови с последующими нежелательными побочными эффектами.
Парентеральные лекарственные препараты должны проверяться визуально для твердых частиц и обесцвечивания до администрации, когда позволяют решение и контейнер.Смотрите МЕРЫ ПРЕДОСТОРОЖНОСТИ.
КАК ПОСТАВЛЕНО
Бикарбонат натрия для инъекций, USP поставляется в следующих лекарственных формах:
НДЦ Код: | Conc% | мг / мл (NaHCO3) | мг-экв / мл (Na +) | мг-экв / мл (HCO3-) | мэкв / размер контейнера (мл) | мосмоль |
72572-740-20 | 8.4 | 84 | 1 | 1 | 50/50 | 2 / мл |
Флаконы для инъекций бикарбоната натрия объемом 50 мл поставляются в виде 20 флаконов на картонную коробку с одной упаковкой.
Воздействие фармацевтических продуктов на нагрев должно быть сведено к минимуму. Избегайте чрезмерной жары. Беречь от замерзания. Хранить при температуре от 20 до 25 ° C (от 68 до 77 ° F). См. USP Контролируемая комнатная температура.]
Пересмотрено: август 2019
Mfd для: Civica, Inc.
Леги, Юта 84043
Производитель: Exela Pharma Sciences, LLC
Ленуар, Северная Каролина 28645 3295-А
ПАКЕТ / ЭТИКЕТКА ОСНОВНАЯ ДИСПЛЕЙНАЯ ПАНЕЛЬ — 8,4% Vial Label
Rx Only NDC 72572-740-01
8,4% натрия
Бикарбонат
Инъекция, USP
50 мг-экв / 50 мл
(1 мг-экв / мл)
Только для внутривенного введения
50 мл флакон однократной дозы
ПАКЕТ / ЭТИКЕТКА ОСНОВНОЙ ДИСПЛЕЙ-ПАНЕЛЬ-8.Этикетка с 4% флаконом
NDC 72572-740-20 Rx Only
8,4% бикарбонат натрия
Инъекция, USP
50 мг-экв / 50 мл
(1 мг-экв / мл)
Только для внутривенного введения. Отменить неиспользованную часть.
флаконы с однократной дозой 20 x 50 мл
| Бикарбонат натрия Бикарбонат натрия для инъекций, раствор | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Labeler — Civica (081373942) |
| Регистрант — Exela Pharma Sciences, LLC (831274399) |
| Учреждение | |||
| Имя | Адрес | ID / FEI | Операции |
| Exela Pharma Sciences, LLC | 831274399 | ПРОИЗВОДСТВО (72572-740), УПАКОВКА (72572-740), АНАЛИЗ (72572-740) | |
Civica
Medical Disclaimer
Подробнее о бикарбонате натрия
Потребительские ресурсы
Профессиональные ресурсы
Другие марки: Neut
Руководства по лечению
,
Статьи по теме
|
|
кальцинированная сода плотная / легкая карбонат натрия 99,2% для стекольной промышленности
карбонат натрия Другие названия: стиральная сода
Применение: промышленная и пищевая марка
1. светлый кальцинированный светлый вид: белый кристаллический порошок
2. легкая кальцинированная сода спецификация :
| Общее содержание основания (в виде Na2CO3 на сухой основе)% | 99.2 мин |
| Хлорид (в виде NaCl, на сухой основе)% | 0,7 макс. |
| Железо (в виде Fe, на сухой основе)% | 0,0035max |
| Нерастворимые в воде вещества% | 0,03max |
| Потери при прокаливании% | 0,8 макс. |
| Сульфат (как SO4, на сухой основе)% | 0,03 макс |
3. Применение световой золы:
1). Строительные материалы: стекольная промышленность является крупнейшим потребительским сектором кальцинированной соды.2). Химическая промышленность, также используется в силикате натрия, дихромате натрия, нитрате натрия, фториде натрия, пищевой соде
,, буре, фосфате тринатрия и т. Д. 3). Металлургическая промышленность, используемая для плавки флюса, обогащения с помощью флотационного агента, сталь и сурьма.
Выплавкаиспользуется в качестве десульфуратора. 4) Полиграфическая и красящая промышленность, также используется в качестве умягчителя воды. 5) .Кожаная промышленность, также используется в качестве сырья кожа обезжиривающего жидкого хромового дубления и хрома.
дубленая кожа и щелочность.6). Ежедневные химикаты: для производства синтетической моющей присадки и натриевой соли фосфата натрия.
триполифосфат и др. 7). Пищевая промышленность, кальцинированная сода, используемая в производстве глутамата натрия, макаронных изделий и т. Д.
4. Упаковка:
40 кг50 кг / 1000 кг мешок или в соответствии с требованиями клиентов.
21MT будет загружено в каждый контейнер 20’FCL.
5. Наше преимущество:
A.Мы сотрудничаем с крупными заводами карбоната натрия более десяти лет.
B. Мы имеем собственный склад и выбираем высокое качество на экспорт.
C. У нас есть профессиональные условия проверки, которые проверяют сломанный мешок, спекаются груз и загружают контейнер в склад и порт погрузки.
6. Информация о компании:
Компания EL Chemicals Inc. со штаб-квартирой в Калифорнии, США, является компанией, занимающейся импортом, экспортом и распространением химических веществ, которая работает по всему миру, чтобы эффективно снабжать наших клиентов доступными химическими продуктами.
Являясь инновационным партнером, EL фокусируется на высококачественных продуктах, а также на специализированных решениях, стремится к долгосрочному развитию и сотрудничеству с нашими клиентами. В EL наш успех продолжится через продвижение продуктов и технологий; улучшение нашей операционной структуры, способности управления рисками и корпоративной конкурентоспособности. Наша цель — создать ведущего поставщика высококачественных специальных сырьевых товаров и поставщика интегрированных торговых услуг.
FAQ:
1.. Профессиональный производитель.
2. Высокое качество, разумные и конкурентоспособные цены, быстрое время выполнения.
3. Послепродажное обслуживание:
1) Все продукты будут строго проверены на качество перед упаковкой
2) Все продукты будут хорошо упакованы перед отправкой
4. Быстрая доставка:
Образец заказа на складе , а объем производства зависит от количества
5. Оплата:
Вы можете оплатить заказ через: T / T, L / C, западное соединение, PayPal
6.Shippping:
Мы тесно сотрудничаем с DHL.TNT.EMS. Вы также можете выбрать свой собственный экспедитор.
Вы можете связаться с нашим офисом в Китае по следующему адресу:
Веб: www.elechemicalinc.com
Телефон: 86-0538-6311818
,Высокое качество Китай
Карбонат натрия
| Описание продукта | , 30003 |
С точки зрения своих самых больших областей применения карбонат натрия используется в производстве стекла, бумаги, вискозы, мыла и моющих средств.[15]
Производство стекла
Карбонат натрия служит флюсом для диоксида кремния, понижая температуру плавления смеси до чего-то достижимого без специальных материалов. Это «натриевое стекло» слегка растворимо в воде, поэтому в расплавленную смесь добавляют немного карбоната кальция, чтобы сделать стекло нерастворимым. Бутылочное и оконное стекло (натриево-известковое стекло) изготавливается путем плавления таких смесей карбоната натрия, карбоната кальция и кварцевого песка (диоксид кремния (SiO2)). Когда эти материалы нагреваются, карбонаты выделяют углекислый газ.Таким образом, карбонат натрия является источником оксида натрия. Натриево-кальциевое стекло было самой распространенной формой стекла на протяжении веков. Умягчение воды
Карбонат натрия является недорогим и водорастворимым источником карбонат-ионов.
Пищевая добавка и приготовление пищи
Карбонат натрия — это пищевая добавка (E500), используемая в качестве регулятора кислотности, противозадирного агента, разрыхлителя и стабилизатора.
Недорогое слабое основание
Карбонат натрия также используется в качестве относительно прочного основания в различных областях.Как обычная щелочь, она предпочтительна во многих химических процессах, потому что она дешевле, чем NaOH, и намного безопаснее в обращении. Его мягкость особенно рекомендует его использование в домашних условиях.
Разное
Карбонат натрия используется в кирпичной промышленности в качестве смачивающего агента для уменьшения количества воды, необходимой для экструдирования глины. При литье его называют «связующим агентом» и используют, чтобы позволить влажному альгинату прилипать к гелеобразному альгинату. Карбонат натрия используется в зубных пастах, где он действует как пенообразователь и абразив, а также для временного повышения pH рта.
Информация о компании
Сертификаты
Упаковка и отгрузка
,


