взаимодействие растворов / Справочник :: Бингоскул
Реакция уксусной кислоты и карбоната натрия: взаимодействие растворовдобавить в закладки удалить из закладок
Содержание:
Карбоновые кислоты – углеводороды, в которых содержится одна или несколько карбоксильных групп – СООН. Существует множество представителей этого класса органических соединений.
n
|
Формула кислоты | Название кислоты |
Название кислотного остатка R-COO— | |
По международной номенклатуре | Тривиальное | |||
0 | Н-СООН | Метановая | Муравьиная | Формиат |
1 | CH3 — СOOH | Этановая | Уксусная | Ацетат |
2 | CH3 — СH2 — СOOH | Пропановая | Пропионовая | Пропионат |
3 | CH3 — (СH2)2 — СOOH | Бутановая | Масляная | Бутират |
4 | CH3 — (СH2)3 — СOOH | Пентановая | Валериановая | Валеринат |
5 | CH3 — (СH2)4 — СOOH | Гексановая | Капроновая | Капронат |
9 | CH3 — (СH2)8 — СOOH | Декановая | Каприновая | Капринат |
15* | CH3 — (СH2)14 — СOOH | Гексадеконовая | Пальмитиновая | Пальмитат |
17* | CH3 — (СH2)16 — СOOH | Октадекановая | Стеариновая | Стеарат |
Особенности уксусной кислоты
Уксусная кислота CH3COOH – это одна из главных органических молекул. Люди используют 3-5%-ные растворы или 70-80%-ные растворы в приготовлении пищи. Также это вещество применяется при крашении, в кожевенном и лакокрасочном производствах.
Люди используют 3-5%-ные растворы или 70-80%-ные растворы в приготовлении пищи. Также это вещество применяется при крашении, в кожевенном и лакокрасочном производствах.
Физические свойства
Уксусная кислота – прозрачная жидкость с необычным запахом и кисловатым привкусом. Она растворяется в воде, а также смешивается с другими органическими соединениями. Уксусная кислота – распространенный растворитель, который часто используется в промышленности.
Способы получения
Уксусную кислоту синтезируют несколькими способами.
- Взаимодействием ацетальдегида с кислородом воздуха под действием катализатора (Mn(CH3COO)2) и при нагревании до 60˚С.
- Реакция метилового спирта, оксида углерода (II) и молекулярного водорода под действием катализатора.
- Взаимодействие бутана с окислителем при нагревании до 200˚С, повышении давления до 50 атм. и под действием катализатора кобальта СО.
- Окисление этилового спирта при участии ферментов (например, дрожжей).

Химические свойства
- Электролитическая диссоциация.
- CH3COOH ⇌ H+ + CH3COO—
- Реакции с активными металлами.
- 2CH3 COOH + Mg ⟶ (CH3COO)2Mg + H2↑
- Присоединение атома галогена к α-углеродному атому.
- СН3 — СOOH + Cl2 ⟶ CH2Cl — COOH +HCl
Эта реакция будет протекать до получения трихлоруксусного альдегида (Cl3-C-COOH).
- СН3 — СOOH + Cl2 ⟶ CH2Cl — COOH +HCl
- Реакция с карбонатом натрия.
- Уксусная кислота реагирует с карбонатом натрия с активным выделением газа.
- 2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2
То есть, прошла реакция обмена, но в силу того, что угольная кислота Н2СО3 неустойчива, она быстро распадается на углекислый газ CO2 и воду H2O.
Применение уксусной кислоты
Пищевая добавка E260 изготавливается из уксусной кислоты. Ее применяют в пищевой промышленности, а в особенности при консервировании. Она используется при синтезе лекарств и парфюмерной продукции, а также в книгопечатании. Таким образом, уксусная кислота применяется практически во всех областях жизнедеятельности и без нее невозможно представить современную промышленность.
Поделитесь в социальных сетях:
26 ноября 2022, 13:25
Что такое этилацетат и где его применяют?
Этилацетат – это соединение органического происхождения, этиловый эфир уксусной кислоты. По виду это бесцветная жидкость с сильным запахом и сладковатым вкусом. Запах очень необычный: напоминает одновременно и что-то фруктовое, и ацетон. Механических примесей в составе нет.
Синонимы: уксусный эфир, уксусно-этиловый эфир, этиловый эфир этановой кислоты. В пищевой промышленности используется под названием «добавка Е1504».
Свойства этилацетата
Состав хорошо растворяется в воде, смешивается с диэтиловым эфиром, этилом, метилом, бензолом и другими органическими растворителями. А сам уксусный эфир хорошо растворяет эфиры целлюлозы, масляные лаки, воски и жиры. Вещество имеет плотность 0,902 г/см3. Температура кипения – 77 °C, температура плавления – 83 °C.
Применение
Рассмотрим, где еще используется этилацетат:
- В производстве целлюлозы, красок, клеевых составов, искусственной кожи – в качестве растворителя;
- В фармацевтике – для изготовления различных лекарств;
- В производстве тонколистового алюминия и фольги из этого сплава – применяется в качестве обезжиривателя;
- В электротехнике – для удаления жира и загрязнений с печатных плат и других поверхностей;
- В пищевой промышленности – производство напитков (смягчает вкус и запах спирта), кондитерских изделий, фруктовых эссенций, экстракция кофеина из кофе;
- В энтомологии – в средствах для обработки насекомых;
- В производстве взрывчатки – способствует приданию взрывчатым веществам нужной структуры;
- В качестве сырья для косметологии – в средствах для снятия лака.

Также возможно применение этилацетата не в производстве, а в быту. Он используется для очистки поверхностей от жира и загрязнений.
Как производится этилацетат
Получение этилового эфира этановой кислоты возможно разными методами:
- Этерификацией этилацетата – перегонкой смеси уксусной кислоты, этанола и серной кислоты;
- синтезом из этанола и кетена;
- синтезом из уксусной кислоты и этилового спирта;
- синтезом из уксусного альдегида с добавлением алкоголята алюминия.
В химии для лабораторного применения этилацетата его получают соединением этанола и хлористого ацетила или уксусного ангидрида.
Очистка этилацетата
В уксусном эфире может содержаться вода, спирт и уксусная кислота. Этилацетат, область применения которого довольно широка, иногда нужен с высоким качеством очистки. Для удаления из состава примесей используется 5%-ный карбонат натрия. Затем этилацетат сушат и перегоняют. Если необходимо очистить этилацетат от воды более качественно, вещество несколько раз дополняется фосфорным ангидридом, очищается и перегоняется.
Техника безопасности
Уксусный эфир может воспламеняться, а на воздухе является взрывоопасным. При высокой концентрации он вызывает раздражение слизистых и органов дыхания, приводит к сонливости. При работе в помещении с большим количеством этилацетата может закружиться голова. При контакте с кожей может возникнуть раздражение, сухость.
Поэтому при использовании состава необходимо применять перчатки и средства защиты органов дыхания и глаз. Хранить этилацетат необходимо в герметичной таре, на расстоянии от отопительных приборов и источников огня. Обычно используются металлические емкости.
Заказать этилацетат для применения в различных отраслях производства с гарантией качества и по низким ценам вы можете в нашем отделе продаж.
Пузырьковых вулканов | Ресурс | RSC Education
В этом эксперименте учащиеся описывают, что наблюдается при смешивании этановой кислоты и гидрокарбоната натрия, используя такие ключевые термины, как реакция, шипение или вскипание и газ.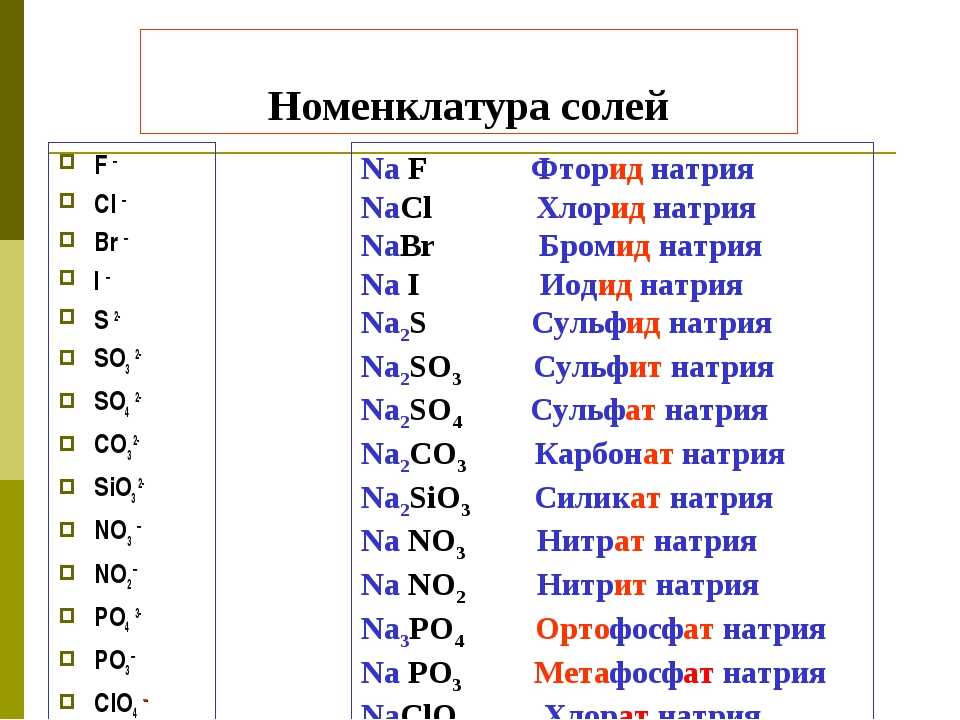
Учебный лист
На этом практическом занятии я буду:
- Экспериментировать, чтобы увидеть, что произойдет, если я смешаю этановую кислоту с гидрокарбонатом натрия.
- Описание наблюдаемого.
- Объясняя свои результаты, используя свои научные знания и понимание, используя такие ключевые слова, как реакция , шипение и газ .
Введение:
Вы древнеримский художник-ученый и только что услышали, как извержение вулкана Везувий покрыло большие территории, включая города Помпеи и Геркуланум, лавой и пеплом.
По общему мнению, извержение было ужасающим и очень захватывающим. Вы задаетесь вопросом, есть ли способ смоделировать собственное мини-извержение. Как и все хорошие ученые-художники, вы решаете продолжить расследование…
Оборудование:
Для группы из 2 учеников:
- 1 чайная ложка
- 1 форма для кексов
- 1стол
- 1 газета
- Гидрокарбонат натрия (бикарбонат соды или разрыхлитель) (50 г) Малоопасный
- Этановая кислота (белый уксус) (250 см 3 ) Малоопасный
- 4 различных пищевых красителя (например, синий, красный, зеленый и желтый), они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы
Для дальнейших действий:
- Дополнительные карбонаты (например, карбонат калия ( Вреден при проглатывании, вызывает раздражение
- Бутыль с узким горлышком или 100 см 3 коническая колба или 25 см 3 мерный цилиндр
- Воздушный шар
- Шпатель
- Баланс
- Лодка для взвешивания
Метод:
- Накройте стол газетой на случай проливания (это очень вероятно).

- Наполовину наполните четыре формочки для кексов этановой кислотой.
- В одну из этих формочек для маффинов налейте 3-4 капли первого пищевого красителя. Повторите то же самое с остальными формочками для маффинов, каждый раз используя другой цвет.
- Используйте чайную ложку, чтобы добавить одну ложку гидрокарбоната натрия с горкой в каждый окрашенный раствор.
- Запишите, что происходит.
Идем дальше:
Попробуйте сравнить изменение массы при использовании разных карбонатов
- Поместите этановую кислоту в бутылку с узким горлышком.
- Поместите карбонат в воздушный шар и закрепите его на крышке банки, не переливая карбонат в бутылку.
- Найдите массу, прежде чем смешать два химиката.
- Теперь поднимите шарик, чтобы карбонат попал в бутылку, и вращайте, чтобы смешать химикаты.
- Смотри, что происходит, и описывай, что происходит с массой.
- Повторите с другими карбонатами и сравните изменения массы.

- Объясните свой результат
Что это говорит вам о химической реакции?
Теория:
Этановая кислота реагирует с гидрокарбонатом натрия с образованием углекислого газа и воды.
ethanoic acid + sodium hydrogen carbonate ↓ sodium acetate + water + carbon dioxide
CH 3 COOH + NaHCO 3 ↓ NaCH 3 COO + H 2 O + CO 2
The carbon dioxide образовавшийся газ устремляется из раствора. Это видно как пузыри. Поскольку углекислый газ тяжелее воздуха, он не может легко уйти от реакции, поэтому кажется, что он стекает по краям вашей формы для кексов, немного напоминая лаву, вытекающую из вулкана.
Тот факт, что при реакции любого карбоната с кислотой не происходит потери массы, свидетельствует о сохранении массы. Это газообразная реакция, поэтому без баллона, прикрепленного к реакционному сосуду, газ выходит, и кажется, что масса уменьшается. Воздушный шар останавливается, захватывая газ, так что это реакция герметичного сосуда, и потери в массе нет.
Лист для учителя и техника
На этом практическом занятии студенты будут:
- Проведите эксперимент, чтобы увидеть, что происходит, когда этановая кислота реагирует с гидрокарбонатом натрия.
- Опишите наблюдаемое.
- Объясните свои результаты, используя свои научные знания и понимание, точно используя такие термины, как
Введение:
Простой кухонный эксперимент, который интересно проводить, но который можно использовать для изучения реакций между кислотами и карбонатами. Его также можно использовать для представления того, что происходит, когда смесь для кекса готовится с использованием карбоната. Реакция карбоната с кислотой вызывает бурную реакцию, а цвет только добавляет драматизма и очаровывает детей младшего возраста.
Этановая кислота химически реагирует с гидрокарбонатом натрия с образованием углекислого газа и воды.
ethanoic acid + sodium hydrogen carbonate ↓ sodium acetate + water + carbon dioxide
CH 3 COOH + NaHCO 3 ↓ NaCH 3 COO + H 2 O + CO 2
The carbon dioxide образовавшийся газ устремляется в сторону от воды. Это видно как пузыри. Поскольку углекислый газ тяжелее воздуха, он не может уйти от реакции, поэтому кажется, что он стекает по краям формы для кексов, немного напоминая лаву, вытекающую из вулкана.
Диапазон учебных программ:
Это практическое занятие предназначено для учащихся старших классов начальной школы или учащихся младших классов средней школы, чтобы познакомить их с простыми химическими реакциями, и цель состоит в том, чтобы получить некоторое представление о том, как материалы используются для создания реакций, таких как некоторые из самые простые в приготовлении. Он связан с:
- Создание простых практических запросов, сравнительных и объективных тестов;
- Сообщение о результатах расследований и наблюдений, включая устные и письменные объяснения, демонстрацию или представление результатов и выводов;
- Использование прямых научных данных для ответа на вопросы или подтверждения своих выводов;
- Получите более систематическое представление о химии кислоты и карбонатов, исследуя, как гидрокарбонат натрия реагирует с кислотой, что может быть использовано для получения полезного свойства;
- Задавайте вопросы и развивайте направление исследований, основанное на наблюдениях за реальным миром, а также на предшествующих знаниях и опыте;
- Использовать соответствующие методы, оборудование и материалы во время лабораторных работ, обращая внимание на здоровье и безопасность;
- Делать и записывать наблюдения, используя ряд методов для различных исследований; оценить надежность методов и предложить возможные улучшения;
- Представление наблюдений с использованием соответствующих методов;
- Интерпретировать наблюдения и определять закономерности, используя эти наблюдения, чтобы делать выводы;
- Представление аргументированных объяснений, включая пояснение данных в отношении прогнозов и гипотез;
- Узнайте о концепции химической реакции, вскипания, кислотных и карбонатных реакций.

Предупреждения об опасности:
Гидрокарбонат натрия – высвобождает углекислый газ при слабом нагревании (или с кислотами). Гидрокарбонат натрия является одобренной пищевой добавкой, Е500, и используется в качестве пищевой соды. «Бикарбонат» или «бикарбонат соды» являются альтернативными названиями. Низкая опасность .
Этановая кислота – если менее 1,7 М. Она все же может причинить вред глазам или порезам. В том числе уксус. Уксус, купленный в магазине, обычно представляет собой раствор от 5% до 6% (от 0,8 до 0,9 моль/л) и составляет Low Hazard при этих значениях прочности.
Оборудование:
Для группы из 2 учеников:
- 1 чайная ложка
- 1 форма для кексов
- 1стол
- 1 газета
- Гидрокарбонат натрия (бикарбонат соды или разрыхлитель (Na HCO 3 )) (50 г)
- 1M Этановая кислота (или белый уксус CH 3 COOH) (250 см 3 )
- 4 разных пищевых красителя (например, синий, красный, зеленый и желтый.
 Они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы
Они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы - Пипетка
Для дальнейшего использования:
- 1 бутыль с узким горлышком (или 25 см 3 мерный цилиндр)
- 1 баллон
- Весы для верхней чаши
- Лодка для взвешивания или аналогичная
Технические примечания:
Ученики должны соблюдать осторожность при использовании красителей, так как искусственные красители могут окрасить кожу при контакте. Они не опасны, но могут выглядеть неприглядно.
Использовать одноразовые перчатки.
При выполнении задания «Движение вперед» учащиеся должны будут хорошо герметизировать воздушный шар и крышку бутылки, а это может означать, что воздушный шар будет трудно надеть, поэтому может потребоваться помощь взрослых.
Результаты:
При смешивании гидрокарбоната натрия (бикарбоната соды) и этановой/уксусной кислоты (уксуса) будет хорошо заметна реакция шипения.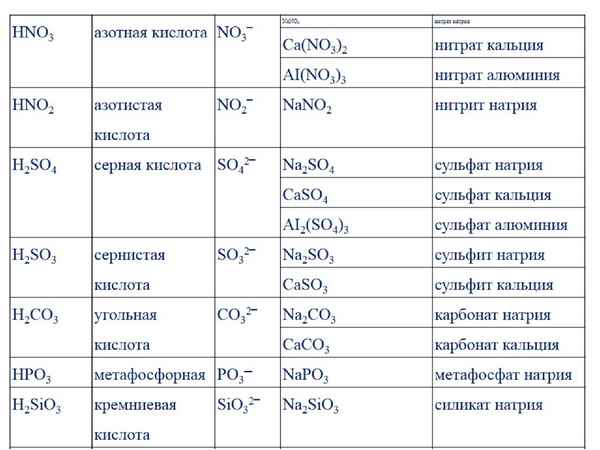 Пищевой краситель создает красочный дисплей, когда происходит реакция. Шипение стихает по мере израсходования реагентов. Реакцию можно повторить, добавив больше реагентов.
Пищевой краситель создает красочный дисплей, когда происходит реакция. Шипение стихает по мере израсходования реагентов. Реакцию можно повторить, добавив больше реагентов.
Учащиеся/дети могут понять, что шипение состоит из пузырьков CO 2 , подобных тем, которые наблюдаются в шипучих (газированных) напитках.
Этот эксперимент также можно провести с использованием одноразовых пластиковых стаканчиков, помещенных в миску или поднос. Конусы можно сделать из кругов, вырезанных из пластика или картона, с меньшим кругом, вырезанным в середине круга. Затем эти конусы можно было поместить над чашей, содержащей реагенты, которые затем «извергаются» через отверстие, подобное настоящему вулкану. Наиболее эффективен для этого красный пищевой краситель.
Использование различных карбонатов приведет к одинаковой реакции. Карбонат калия (вреден при проглатывании, вызывает раздражение) и карбонат кальция малоопасны. Одна чайная ложка или шпатель карбоната (примерно от 2,5 до 3,5 г, в зависимости от того, какой карбонат используется) помещают в баллон, который тщательно закрепляют над горлышком бутылки или мерного цилиндра, содержащего 15 см 3 этановой кислоты, затем взвешивают перед подъемом. воздушный шар в вертикальном положении, чтобы вылить его содержимое в мерный цилиндр, приведет к небольшому надуванию воздушного шара.
воздушный шар в вертикальном положении, чтобы вылить его содержимое в мерный цилиндр, приведет к небольшому надуванию воздушного шара.
Учащиеся могут заметить, что разные карбонаты имеют разный вес, но использование одинакового количества реагентов приводит к одной и той же реакции, и что общая масса реагентов будет равна общей массе продуктов. (Некоторые карбонаты могут быть более мелким порошком, чем другие, поэтому потребуется небольшое завихрение контейнера, чтобы смешать реагенты и начать реакцию). Это должно продемонстрировать сохранение массы, даже если это газообразная реакция, и если газ улетучится, масса, по-видимому, уменьшится — сильный источник заблуждений у некоторых более слабых студентов.
Идем дальше:
- Попробуйте использовать другие карбонаты, но измерьте массу химикатов до их смешивания и после смешивания химикатов.
- Поместите этановую кислоту в бутылку с узким горлышком.
- Поместите карбонат в воздушный шар и закрепите его на крышке банки, не переливая карбонат в бутылку.

- Найдите массу, прежде чем смешать два химиката.
- Теперь поднимите шарик, чтобы карбонат попал в бутылку, и вращайте, чтобы смешать химикаты.
- Смотри, что происходит, и описывай, что происходит с массой.
- Объясните свой результат
Уксусная кислота — Уточатка
04 Углерод и его соединение
Этановая кислота (или уксусная кислота)
- Этановая кислота (CH 3 COOH) — карбоболика, а кислота, а кислота, а кислота — 3 ) — акисовая акислока, а кислота — 3 ) — акисовая акислока, а окноичная кислота — 3 ) — акисовая акислотка 3 ) — акисовая кислота (CH 3 ) — акисовая кислота (CH 3 ) — акисовая кислота — 9012 кислота .

- Имеет плотность 1,05 г/см 3 , что делает его немного тяжелее воды.
ЧТО ТАКОЕ УКСУСНАЯ КИСЛОТА?
- Уксусная кислота является общим названием систематического названия этановой кислоты.
- Он в основном используется в качестве консерванта в соленьях путем добавления 5-8% уксусной кислоты в воду, превращая ее в уксус.
ФИЗИЧЕСКИЕ СВОЙСТВА ЭТАНОВОЙ КИСЛОТЫ
- Это бесцветная жидкость с кислым вкусом и запахом уксуса.
- Температура кипения этановой кислоты (391К).
- При охлаждении чистой этановой кислоты она замерзает, образуя бесцветное льдоподобное твердое вещество, похожее на ледник. В связи с этим чистая этановая кислота называется ледяной этановой кислотой или ледяной уксусной кислотой.).
- Этановая кислота смешивается с водой во всех соотношениях.
ХИМИЧЕСКИЕ СВОЙСТВА ЭТАНОВОЙ КИСЛОТЫ
ДЕЙСТВИЕ НА ЛИМУС
- Этановая кислота имеет кислую природу.
 Так, раствор синего лакмуса окрашивается в красный цвет.
Так, раствор синего лакмуса окрашивается в красный цвет.
РЕАКЦИЯ С КАРБОНАТОМ НАТРИЯ
- Этановая кислота реагирует с карбонатами и гидрокарбонатами с выделением газообразного диоксида углерода с образованием соли и воды.
- Пример:. Этановая кислота реагирует с карбонатом натрия с образованием этаноата натрия и углекислого газа:
РЕАКЦИЯ С ВОДОРОДАРБОНАТОМ НАТРИЯ.
- Этановая кислота вступает в реакцию с гидрокарбонатом натрия с выделением бурного вскипания углекислого газа:
РЕАКЦИЯ С ГИДРОКСИДОМ НАТРИЯ
- Этановая кислота реагирует с основаниями (или щелочами) с образованием солей и воды.
- Например, этановая кислота реагирует с гидроксидом натрия с образованием соли, называемой этаноатом натрия, и воды:
РЕАКЦИЯ СО СПИРТАМИ (ОБРАЗОВАНИЕ ЭФИРОВ)
- Этановая кислота реагирует со спиртами в присутствии небольшого количества концентрированной серной кислоты с образованием сложных эфиров.

- Например, при нагревании этановой кислоты с этанолом в присутствии нескольких капель концентрированной серной кислоты образуется компонент со сладким запахом, называемый этилэтаноатом:
- Сложные эфиры обычно представляют собой летучие жидкости со сладким или приятным запахом .
- Также говорят, что они имеют фруктовый запах.
- Сложные эфиры используются при изготовлении искусственных духов (искусственных ароматов).
- Сложные эфиры также используются в качестве ароматизаторов.
ИСПОЛЬЗОВАНИЕ ЭТАНОВОЙ КИСЛОТЫ (ИЛИ УКСУСНОЙ КИСЛОТЫ)
- Разбавленная этановая кислота (в форме уксуса) используется в качестве пищевого консерванта при приготовлении солений и соусов (таких как томатный соус). Как уксус, он также используется в качестве закуски для украшения пищевых блюд.
- Используется для производства ацетата целлюлозы, важного искусственного волокна.
- Используется в производстве ацетона (пропанона) и сложных эфиров, используемых в парфюмерии.







 Они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы
Они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы

 Так, раствор синего лакмуса окрашивается в красный цвет.
Так, раствор синего лакмуса окрашивается в красный цвет.
