Подписка на услугиРеклама на сайте Новости и события Уголовное дело завели из-за хлопка на химзаводе в Дзержинске Уголовное дело возбуждено из-за хлопка химической смеси на заводе в Дзержинске. Об этом информирует пресс-служба СУ СКР по Нижегородской области. Напомним, несчастный случай произошел … Эксперт: развитие малотоннажной химии может стать ответом на западные санкции Основой для конкурентного развития российской химической отрасли в условиях санкций может стать малотоннажная нефтегазохимия, в том числе за счет инновационных … В Германия из-за энергокризиса возник дефицит химикатов для очистных сооружений Из-за высоких расходов на электроэнергию и отопление многие жители Германии опасаются наступления зимы. Утечка 1,2 тысячи тонн соляной кислоты произошла на заводе в Японии Утечка около 1, 2 тысячи тонн соляной кислоты произошла на территории завода компании AGC на востоке Японии. Об этом говорится в заявлении на сайте AGC. Отмечается, что инцидент произошел … Томские химики создали замену импортному ингредиенту зубной пасты . При производстве косметики и зубной пасты силикагель выступает как регулятор вязкости, плюс к этому обеспечивает абразивный эффект пастам, то есть от него во многом зависит качество очищения эмали», — пояснил один из разработчиков, старший научный сотрудник лаборатории… Ученые нашли способ очистить окружающую среду от соединений фтора Американские исследователи разработали простой способ борьбы с фторсодержащими поверхностно-активными веществами. Об этом пишет Science. Науке известно 4500 соединений на основе фтора. Информация Карбонат натрия это сода Уголовное дело завели из-за хлопка на химзаводе в Дзержинске Карбонат натрия синоним Уголовное дело завели из-за хлопка на химзаводе в Дзержинске Соляная кислота с кислородом Уголовное дело завели из-за хлопка на химзаводе в Дзержинске Соляная кислота карбонат натрия Уголовное дело завели из-за хлопка на химзаводе в Дзержинске Каталог организаций и предприятий Химснаб железо хлорное кальций хлористый EcoPell кальций хлористый пищевой FUDIX кальций хлористый раствор водный кальций хлористый UNIPEL кислота соляная абгазная Кислота соляная чистая Кислота соляная ингиб. ТД Хим-Лига Торговая фирма, специализирующаяся на купле-продаже технической химии: 1. Кислота соляная 2. Кислота серная 3. Кислота ортофосфорная 4. Кислота азотная 5. Этиленгликоль 6. Натр едкий 7. Перекись водор… ПК Лантан элементов (по аттестованным в ТПУ методикам) -кобальт и его соединения (нитрат, хлорид, карбонат, сульфат, гидроокись) -никель и его соединения (нитрат, хлорид, сульфат, карбонат) -молибден, молибдаты аммония, натрия, оксид молибдена -вольфрам, вольфраматы… МСК Пищевые ингредиенты, специи . Отгрузка на Ваш склад. Из г. Подольск М.О. (Россия) г. Краснодар (Россия) , Китая , Индии , Египта. Контейнерные , вагонные , автомобильные поставки. Предлагаемая продук… СУМЗ Среднеуральский медеплавильный завод (СУМЗ), отметивший в 2000 году свое 60-летие, является крупнейшим на Урале предприятием по выплавке меди из первичного сырья, производству из отходящих металлургич… СТС . Предложения на покупку и продажу продукции Кислота азотная хч Предлагаем кислоту азотную хч со склада в г. Саратов. Фасовка-канистры по 20 л ( 28 кг) .Цена 53 руб/кг. Утилизация просроченных хим.реактивов. Утилизация, приобретение промышленной химии: ПЖРВ, углерод четырёххлористый чда, калий азотнокислый, натрий серокислый технический марки Б, тиосульфат кристалл натрия технического В.С., алюминий азотн… Покупаем Электролит калиево-литиевый Купим на постоянной основе: азотная кислота, кадмий хлористый, хромпик, тринатрий фосфат, хромин электролит калиево-литиевый, титановую губку ТГ-90, ТГ-100, олово четыреххлористое, церезин 75, 65, 100… Утилизируем остатки, излишки, неликвиды гальванических цехов Закупим излишки, избытки, неликвиды, лежалое сырье: с гос. резерва, предприятий, фабрик, цехов, тэц, грэс, котельных, частных лиц в неограниченном количестве. кислота борная марка А, соль углеаммоний… Утилизация промышленной химии Утилизируем, приобретём складские остатки, наши потребности: полиизоцианаты, диоксид титана осч 7-3, диоксид титана, оксиды, олово четыреххлористое, двуокись титана, алюминиевая пудра, окись титана, п… Закупаем натр едкий, гуаровая камедь, лимонную кислоту и другую химию, реагенты, сырье Купим натрий едкий технический ( чешуированный, гранулированный), бихромат натрия, бихромат калия, калий хлористый, калия гидрат окиси технической, кальций хлористый технический, карбамид, сода кальци… | |
  | |
Каталог продукции ОАО «Реактив»
Противоморозные добавки
- Аммиак водный технический (Аммиачная вода)
- Кальций хлористый технический
- Нитрит натрия технический (Натрий азотистокислый)
- Поташ (Карбонат калия (калий углекислый))
- Формиат натрия (Натрий муравьинокислый)
Кислоты
- Азотная кислота техническая неконцентрированная
- Азотная кислота ЧДА
- Алкилбензолсульфокислота (АБСК)
- Борная кислота техническая
- Гликолевая кислота
- Лимонная кислота (пищевая добавка Е330)
- Молочная кислота (пищевая добавка Е 270)
- Муравьиная кислота
- Ортофосфорная кислота
- Серная кислота аккумуляторная
- Соляная кислота (реактив)
- Соляная кислота ингибированная НАПОР-НСL
- Соляная кислота техническая
- Сульфаминовая кислота техническая
- Уксусная кислота синтетическая
- Щавелевая кислота техническая
Лакокрасочные материалы и сырье для их производства
- Двуокись титана пигментная (диоксид титана)
- Диэтиленгликоль
- Лак КО-85
- Окись хрома пигментная ОХП-1
- Полиэтиленполиамины (ПЭПА)
- Раствор коллоксилина НЦ-0218
- Смола 188
- Смола эпоксидная
- Спирт изопропиловый (Изопропанол)
Моющие, чистящие, дезинфицирующие средства
- Гипохлорит кальция
- Гипохлорит натрия
- Известь хлорная
- Натрий двууглекислый (бикарбонат натрия) (Сода пищевая)
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Перхлорэтилен
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сода каустическая (Натр едкий)
- Сульфаминовая кислота техническая
- Сульфонол порошок
- Тринатрийфосфат (Натрий фосфорнокислый трехзамещенный)
- Триполифосфат натрия технический
- Хлорамин Б
Растворители
- Ацетон технический
- Диэтиленгликоль
- Ксилол нефтяной
- Ортоксилол нефтяной
- Перхлорэтилен
- Растворитель 646
- Спирт изопропиловый (Изопропанол)
- Толуол нефтяной
- Трихлорэтилен
- Этилацетат
- Этиленгликоль
- Этилцеллозольв
Содопродукты
- Натрий двууглекислый (бикарбонат натрия) (Сода пищевая)
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сода каустическая (Натр едкий)
Соединения Хрома
- Бихромат натрия технический (Натрий двухромовокислый)
- Дубитель хромовый сухой (Сульфат хрома основной (хром сернокислый основной, ХРОМОТЕЛЬ XGS))
- Калий двухромовокислый (Бихромат калия)
- Окись хрома пигментная ОХП-1
- Хромовый ангидрид технический (Кислота хромовая)
Удобрения
- Аммиак водный технический (Аммиачная вода)
- Аммоний хлористый технический (Нашатырь)
- Аммофос (Моноаммонийфосфат)
- Борная кислота техническая
- Диаммонийфосфат
- Калий хлористый технический
- Карбамид (Мочевина)
- Медь сернокислая (Купорос медный)
- Поташ (Карбонат калия (калий углекислый))
- Селитра аммиачная (Азотнокислый аммоний)
- Селитра калиевая техническая (Азотнокислый калий (нитрат калия))
- Селитра натриевая техническая (Азотнокислый натрий)
- Сульфат аммония (аммоний сернокислый)
- Суперфосфат
Флотореагенты
- Бура десятиводная техническая (Тетраборат натрия декагидрат)
- Ксантогенат калия бутиловый
- Лигносульфонаты (ЛСТ)
- Медь сернокислая (Купорос медный)
- Метасиликат натрия
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сода каустическая (Натр едкий)
- Сульфат аммония (аммоний сернокислый)
- Уголь активный древесный марки БАУ-А
Химические продукты для бумажной промышленности
- Алюмоаммонийные квасцы (Аммоний-алюминий дисульфат,Квасцы алюмоаммонийные)
- Бура десятиводная техническая (Тетраборат натрия декагидрат)
- Квасцы алюмокалиевые
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Перекись водорода
- Сода каустическая (Натр едкий)
- Сульфат натрия (натрий сернокислый)
Химические продукты для водоочистки и водоподготовки
- Гипохлорит кальция
- Гипохлорит натрия
- Железо сернокислое (Купорос железный технический)
- Известь хлорная
- Катионит КУ-2-8
- Лимонная кислота (пищевая добавка Е330)
- Метасиликат натрия
- Натрий кремнефтористый
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Натрия тиосульфат (Гипосульфит натрия)
- Перекись водорода
- Полиакриламид-гель технический
- Силикагель технический
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сода каустическая (Натр едкий)
- Соль поваренная техническая (натрий хлористый)
- Сульфаминовая кислота техническая
- Сульфоуголь
- Тринатрийфосфат (Натрий фосфорнокислый трехзамещенный)
- Уголь активный древесный марки БАУ-А
- Хлорное железо (Хлорид железа 6-водный)
- Цеолит общего назначения
- Щавелевая кислота техническая
Химические продукты для металлообработки и гальваники
- Азотная кислота техническая неконцентрированная
- Аммоний хлористый технический (Нашатырь)
- Барий хлористый технический
- Борная кислота техническая
- Бура пятиводная техническая (Тетраборат натрия пентагидрат)
- Гидроксид калия (калия гидроокись, калия гидрат окиси) (Калий едкий)
- Калий двухромовокислый (Бихромат калия)
- Калий хлористый технический
- Лимонная кислота (пищевая добавка Е330)
- Медь сернокислая (Купорос медный)
- Монофосфат цинка (Цинк фосфорнокислый однозамещенный)
- Муравьиная кислота
- Натрий двууглекислый (бикарбонат натрия) (Сода пищевая)
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Никель сернокислый
- Нитрит натрия технический (Натрий азотистокислый)
- Ортофосфорная кислота
- Полиэтиленполиамины (ПЭПА)
- Поташ (Карбонат калия (калий углекислый))
- Серная кислота аккумуляторная
- Смола эпоксидная
- Сода каустическая (Натр едкий)
- Соль поваренная техническая (натрий хлористый)
- Соляная кислота (реактив)
- Соляная кислота ингибированная НАПОР-НСL
- Соляная кислота техническая
- Тринатрийфосфат (Натрий фосфорнокислый трехзамещенный)
- Уксусная кислота синтетическая
- Формалин технический (Формальдегид технический)
- Хромовый ангидрид технический (Кислота хромовая)
- Цинк хлористый технический
Химические продукты для меховой и кожевенной обработки
- Алюмоаммонийные квасцы (Аммоний-алюминий дисульфат,Квасцы алюмоаммонийные)
- Аммиак водный технический (Аммиачная вода)
- Бихромат натрия технический (Натрий двухромовокислый)
- Гликолевая кислота
- Дубитель хромовый сухой (Сульфат хрома основной (хром сернокислый основной, ХРОМОТЕЛЬ XGS))
- Железо сернокислое (Купорос железный технический)
- Калий двухромовокислый (Бихромат калия)
- Карбамид (Мочевина)
- Квасцы алюмокалиевые
- Лимонная кислота (пищевая добавка Е330)
- Молочная кислота (пищевая добавка Е 270)
- Муравьиная кислота
- Натрий двууглекислый (бикарбонат натрия) (Сода пищевая)
- Перекись водорода
- Перхлорэтилен
- Серная кислота аккумуляторная
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Соль поваренная техническая (натрий хлористый)
- Сульфат аммония (аммоний сернокислый)
- Сульфат натрия (натрий сернокислый)
- Формалин технический (Формальдегид технический)
- Формиат натрия (Натрий муравьинокислый)
Химические продукты для нефтедобычи
- Бихромат натрия технический (Натрий двухромовокислый)
- Борная кислота техническая
- Гидроксид калия (калия гидроокись, калия гидрат окиси) (Калий едкий))
- Калий двухромовокислый (Бихромат калия)
- Калий хлористый технический
- Кальций хлористый технический
- Карбамид (Мочевина)
- Лигносульфонаты (ЛСТ)
- Лимонная кислота (пищевая добавка Е330)
- Метасиликат натрия
- Натрия гидроокись ЧДА (Гидроксид натрия ЧДА)
- Полиакриламид-гель технический
- Силикагель технический
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сода каустическая (Натр едкий)
- Соль поваренная техническая (натрий хлористый)
- Сульфаминовая кислота техническая
- Сульфонол паста
- Сульфонол порошок
- Цеолит общего назначения
- Щавелевая кислота техническая
Химические продукты для обработки и защиты древесины
- Алюмоаммонийные квасцы (Аммоний-алюминий дисульфат,Квасцы алюмоаммонийные)
- Аммоний хлористый технический (Нашатырь)
- Аммофос (Моноаммонийфосфат)
- Бихромат натрия технический (Натрий двухромовокислый)
- Борная кислота техническая
- Бура десятиводная техническая (Тетраборат натрия декагидрат
- Диаммонийфосфат
- Калий двухромовокислый (Бихромат калия)
- Кальций хлористый технический
- Медь сернокислая (Купорос медный)
- Натрий кремнефтористый
- Поташ (Карбонат калия (калий углекислый))
Химические продукты для производства моющих средств
- Бура пятиводная техническая (Тетраборат натрия пентагидрат)
- Гидроксид калия (калия гидроокись, калия гидрат окиси) (Калий едкий)
- Лимонная кислота (пищевая добавка Е330)
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сульфат натрия (натрий сернокислый)
- Сульфонол паста
- Сульфонол порошок
- Тринатрийфосфат (Натрий фосфорнокислый трехзамещенный)
- Триполифосфат натрия технический
- Цеолит общего назначения
- Смола эпоксидная
- Щавелевая кислота техническая
Химические продукты для стекольной промышленности
- Борная кислота техническая
- Бура десятиводная техническая (Тетраборат натрия декагидрат)
- Бура пятиводная техническая (Тетраборат натрия пентагидрат)
- Поташ (Карбонат калия (калий углекислый))
- Селитра калиевая техническая (Азотнокислый калий (нитрат калия))
- Селитра натриевая техническая (Азотнокислый натрий)
- Сода кальцинированная техническая (Натрий углекислый (карбонат натрия технический))
- Сульфат натрия (натрий сернокислый)
- Триполифосфат натрия технический
Химические продукты для строительства
- Бихромат натрия технический (Натрий двухромовокислый)
- Бура десятиводная техническая (Тетраборат натрия декагидрат)
- Калий двухромовокислый (Бихромат калия)
- Кальций хлористый технический
- Карбамид (Мочевина)
- Карбид кальция
- Лигносульфонаты (ЛСТ)
- Метилцеллюлоза водорастворимая
- Модификатор бетона ПФМ-НЛК
- Монофосфат цинка (Цинк фосфорнокислый однозамещенный)
- Натрий кремнефтористый
- Нитрит натрия технический (Натрий азотистокислый)
- Окись хрома пигментная ОХП-1
- Поташ (Карбонат калия (калий углекислый))
- Пудра алюминиевая пигментная
- Смола древесная омыленная (СДО)
- Смола эпоксидная
- Соль поваренная техническая (натрий хлористый)
- Сульфат натрия (натрий сернокислый)
- Сульфонол паста
- Сульфонол порошок
- Тринатрийфосфат (Натрий фосфорнокислый трехзамещенный)
- Формиат натрия (Натрий муравьинокислый)
Прочие Химические продукты
- Диаммонийфосфат
- Динатрийфосфат (ДНФ) (Натрий фосфорнокислый)
- Кальций хлористый
- Пластификатор ДБФ (дибутилфталат)
- Уротропин технический
- Хлорное железо (Хлорид железа 6-водный)
- Электролит калиево-литиевый щелочной
- Электролит щелочной натриево-литиевый (жидкий)
ОАО «Реактив»
Новая версия задачи С2 в ЕГЭ по химии 2012.
 Особенности и подводные камни
Особенности и подводные камни В 2012 году предложена новая форма задания С2 — в виде текста, описывающего последовательность экспериментальных действий, которые нужно превратить в уравнения реакций.
Трудность такого задания состоит в том, что школьники очень плохо представляют себе экспериментальную, не бумажную химию, не всегда понимают используемые термины и протекающие процессы. Попробуем разобраться.
Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно, не так, как предполагалось. В словаре приведены примеры неправильного понимания.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). Она не имеет никакого отношения к навесу над крыльцом.
- Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом.
 Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!
Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются! - Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор.
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
- Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.

- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет.
- Осадок и остаток.
Очень часто путают эти термины. Хотя это совершенно разные понятия.
«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).
«Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком. - Насыщенный раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.
Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.
Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.
Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.
Рассмотрим несколько примеров подобных заданий.
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
- Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:
6Li + N2 = 2Li3N - При взаимодействии нитридов с водой образуется аммиак:
Li3N + 3H2O = 3LiOH + NH3 - Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония:
2NH3 + H2SO4 = (NH4)2SO4 - Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl - После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
NH4Cl + NaNO2 t° N2 + 2H2O + NaCl →
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество.
 К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
- Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот:
10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2OAl0 − 3e = Al3+ | 10 2N+5 + 10e = N20 3 - Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой).
 Образуется осадок гидроксида алюминия и выделяется углекислый газ:
Образуется осадок гидроксида алюминия и выделяется углекислый газ:
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3 - Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
2Al(OH)3 t° Al2O3 + 3H2O → - В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония):
NaNO3 + NH4Cl = N2O + 2H2O + NaCl - Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот:
3N2O + 2NH3 = 4N2 + 3H2O
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде.
 Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
- Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:
Al2O3 + Na2CO3 = 2NaAlO2 + CO2 - Алюминат натрия при растворении в воде образует гидроксокомплекс:
NaAlO2 + 2H2O = Na[Al(OH)4] - Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:
Na[Al(OH)4] + SO2 = NaHSO3 + Al(OH)3 - Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата:
NaHSO3 + Br2 + H2O = NaHSO4 + 2HBr - Полученный раствор содержит гидросульфат калия и бромоводородную кислоту.
 При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:NaHSO4 + NaOH = Na2SO4 + H2O
HBr + NaOH = NaBr + H2O
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
- Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород:
ZnS + HCl = ZnCl2 + H2S - Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия:
H2S + NaOH = Na2S + H2O - Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II):
Na2S + FeCl2 = FeS + NaCl - Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре.
 При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
FeS + O2 = Fe2O3 + SO2 - Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид:
SO2 + O2 = SO3
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
- При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
SiO2 + Mg = MgO + Si
Si + Mg = Mg2SiМожно записать при большом избытке магния суммарное уравнение реакции:
SiO2 + Mg = MgO + Mg2Si - При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении):
Mg2Si + H2O = Mg(OH)2 + SiH4 - Силан при сгорании образует оксид кремния:
SiH4 + O2 = SiO2 + H2O - Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:
SiO2 + CsOH = Cs2SiO3 + H2O - При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка:
Cs2SiO3 + HCl = CsCl + H2SiO3
Задания для самостоятельной работы.

- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
- На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия.
 Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой. - Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор.
 К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным. - (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
Ответы к заданиям для самостоятельного решения:
- Cu(NO3)2 → CuO → CuSO4 → CuS →СuO → Cu(NO3)2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + H2S = CuS + H2SO4
2CuS + 3O2 = 2CuO + 2SO2
CuO + 2HNO3 = Cu(NO3)2 + H2O - Ca3(PO4)2 → P → P2O5 →Na3PO4 → Ba3(PO4)2 → BaHPO4 или Ba(H2PO4)2
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
2Na3PO4 + 3BaCl2 = Ba3(PO4)2 + 6NaCl
Ba3(PO4)2 + 4H3PO4 = 3Ba(H2PO4)2 - Cu → NO2 → HNO3 → Zn(NO3)2 → Na2[Zn(OH)4]
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4NO2 + O2 + 2H2O = 4HNO3
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3 - NaCl → HCl →BaCl2 → BaSO4 → BaS → H2S
2NaCl + H2SO4 = 2HCl + Na2SO4
2HCl + Ba(OH)2 = BaCl2 + 2H2O
BaCl2 + K2SO4 = BaSO4 + 2KCl
BaSO4 + 4C = BaS + 4CO
BaS + 2HCl = BaCl2 + H2S Al2S3 → H2S → PbS →PbSO4 ↓ AlCl3 → Al(OH)3 Al2S3 + 6HCl = 3H2S + 2AlCl3
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
H2S + Pb(NO3)2 = PbS + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O- Al → Al2S3 → Al(OH)3 →K[Al(OH)4] → KAlO2 →AlCl3
2Al + 3S = Al2S3
Al2S3 + 6H2O = 3H2S + 2Al(OH)3
Al(OH)3 + KOH = K[Al(OH)4]
K[Al(OH)4] = KAlO2 + 2H2O
KAlO2 + 4HCl = KCl + AlCl3 + 2H2O KI → I2 → HI → AgI ↓ Na2SO4 → BaSO4 2KI + Cl2 = 2KCl + I2
I2 + Na2SO3 + H2O = 2HI + Na2SO4
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
HI + AgNO3 = AgI + HNO3- Cr2O3 → KCrO2 → K[Cr(OH)4] →K2CrO4 →K2Cr2O7 → Cr2(SO4)3
Cr2O3 + 2KOH = 2KCrO2 + H2O
2KCrO2 + 3H2O2 + 2KOH = 2K2CrO4 + 4H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O - Al → K[Al(OH)4] → Al(OH)3 → Al2O3 → NaAlO2
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
K[Al(OH)4] + CO2 = KHCO3 + Al(OH)32Al(OH)3 t° Al2O3 + 3H2O → Al2O3 + Na2CO3 = 2NaAlO2 + CO2
- Si → K2SiO3 → H2SiO3 → SiO2 → CaSiO3
Si + 2KOH + H2O = K2SiO3 + 2H2
K2SiO3 + 2HCl = H2SiO3 + 2KClH2SiO3 t° H2O + SiO2 → SiO2 + CaCO3 = CaSiO3 + CO2
Тренажер задания 28 ЕГЭ по химии
Тренировочные упражнения по теме «Расчёты по уравнениям химических реакций» в формате ЕГЭ по химии (тренажер задания 28 ЕГЭ по химии).
Теория по теме «Расчёты по уравнениям химических реакций» (теория для решения задания 28 ЕГЭ по химии):
Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ.
Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного.
Расчёты массовой доли (массы) химического соединения в смеси
Тренажер по теме «Расчетные задачи» — 10 вопросов, при каждом прохождении новые.
36 Создан на По Admin Тренажер задания 28 Тренажер задания 28 ЕГЭ по химии 1 / 10 На взаимодействие с 1,5 кг технического поташа потребовалась соляная кислота, содержащая 730 г хлороводорода. 2 / 10 Определите объём (в л при н.у.) оксида серы(IV), который может быть получен из 12 кг пирита с содержанием основного вещества 90%. (Запишите число с точностью до целых.) 3 / 10 Образец оксида меди(II), содержащий 15% примесей меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 352 г сульфата меди(II). Определите массу указанного образца (г.). (Запишите число с точностью до целых.) 4 / 10 На взаимодействие с 2,5 кг технического карбоната натрия потребовалась соляная кислота, содержащая 1,46 кг хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце технического карбоната натрия. (Запишите число с точностью до десятых.) 5 / 10 На растворение природного известняка был затрачен раствор, содержащий 289,8 г азотной кислоты. При этом осталось 34 г не растворившегося в кислоте осадка. 6 / 10 Образец сульфида алюминия массой 25 с содержанием примесей 10% поместили в раствор гидроксида калия, взятый в избытке. Определите массу тетрагидроксиалюмината калия (г.) , который образовался при этом (Выпишите число с точностью до десятых.) 7 / 10 Образец оксида меди(II), содержащий примесь меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 176 г сульфата меди(II). Определите массу (в г.) указанного образца, если массовая доля оксида в образце 88 %. (Запишите число с точностью до целых.) 8 / 10 В результате нитрования 468 г бензола было получено 616,5 г нитробензола. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.) 9 / 10 При взаимодействии дивинила с избытком раствора брома образовалось 296,2 г тетрабромпроизводного. Определите массу (в г.) вступившего в реакцию дивинила, если выход этой реакции составил 88 %. 10 / 10 При взаимодействии избытка этилового спирта с 18,4 г натрия с выходом 90 % был получен этилат натрия. Определите. массу полученного продукта. (Запишите число с точностью до целых.) Ваша оценка Средний балл 4% Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце указанного поташа. (Выпишите число с точностью до целых.)
Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце указанного поташа. (Выпишите число с точностью до целых.) Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до десятых.)
Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до десятых.) (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.)
Тренировочный тест по теме «Расчетные задачи» — полный тест из всех вопросов.
16
Создан на По Admin
Полный тематический тест Тренажер задания 28
Тренажер задания 28 ЕГЭ по химии
1 / 30
На взаимодействие с 1,5 кг технического поташа потребовалась соляная кислота, содержащая 730 г хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце указанного поташа. (Выпишите число с точностью до целых.)
(Выпишите число с точностью до целых.)
2 / 30
Образец сульфида алюминия массой 25 с содержанием примесей 10% поместили в раствор гидроксида калия, взятый в избытке. Определите массу тетрагидроксиалюмината калия (г.) , который образовался при этом (Выпишите число с точностью до десятых.)
3 / 30
В результате нитрования 468 г бензола было получено 616,5 г нитробензола. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
4 / 30
На взаимодействие с навеской технического сульфида натрия массой 130 г требуется соляная кислота, содержащая 102,2 г хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в указанном образце. (Запишите число с точностью до целых.)
5 / 30
Образец оксида меди(II), содержащий 15% примесей меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 352 г сульфата меди(II). Определите массу указанного образца (г.). (Запишите число с точностью до целых. )
)
6 / 30
Из 3,5 кг технического карбоната натрия получили 3510 г хлорида натрия. Вычислите массовую долю (%) карбоната натрия в указанном образце. (Запишите число с точностью до целых.)
7 / 30
На растворение природного известняка был затрачен раствор, содержащий 167,9 г хлороводорода. При этом осталось 24 г не растворившегося в кислоте осадка. Вычислите массовую долю (%) нерастворимых в кислоте примесей в указанном известняке. (Запишите число с точностью до десятых.)
8 / 30
При взаимодействии загрязненного образца гидрокарбоната натрия с гидроксидом натрия образовалось 286,2 г средней соли. Определите массу (в г.) указанного образца, если известно, что массовая доля посторонних примесей составляет 5 %. (Запишите. число с точностью до десятых.)
9 / 30
В результате взаимодействия бромида метиламмония массой 280 г с избытком гидроксида натрия был получен метиламин с выходом 80 %. Определите объём (в л.) (н.у.) выделившегося амина. (Запишите число с точностью до десятых. )
)
10 / 30
Образец оксида меди(II), содержащий в качестве примеси 5,7 % меди, поместили в соляную кислоту. На растворение оксида меди(II) из указанного образца потребовалось 146 г хлороводорода. Вычислите массу (в г.) нерастворившегося осадка меди. (Запишите число с точностью до десятых.)
11 / 30
При взаимодействии дивинила с избытком раствора брома образовалось 296,2 г тетрабромпроизводного. Определите массу (в г.) вступившего в реакцию дивинила, если выход этой реакции составил 88 %. (Запишите число с точностью до десятых.)
12 / 30
Определите объём (в л при н.у.) оксида серы(IV), который может быть теоретически получен из 1 кг пирита с содержанием основного вещества 93,6 %. (Запишите число с точностью до сотых.)
13 / 30
Определите массу оксида цинка (кг), который можно получить при обжиге 900 кг содержащего ZnS минерала сфалерита, если известно, что массовая доля примесей в сфалерите составляет 11 %. (Запишите число с точностью до целых. )
)
14 / 30
Определите массу (в г.) алюминия, который может быть получен из 2 кг технического оксида алюминия с содержанием основного вещества 90%. (Запишите число с точностью до целых.)
15 / 30
Определите массу (в г.) меди, которую можно получить при восстановлении алюминием образца оксида меди(II) массой 688 г, если в указанном образце содержится 6 % примеси оксида железа(III). (Запишите число с точностью до целых.)
16 / 30
На взаимодействие с 2,5 кг технического карбоната натрия потребовалась соляная кислота, содержащая 1,46 кг хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце технического карбоната натрия. (Запишите число с точностью до десятых.)
17 / 30
Образец сульфида алюминия массой 500 г с содержанием примесей 10 % растворили в избытке гидроксида натрия. Определите массу (в г.) сульфида натрия, который образовался при этом. (Запишите число с точностью до целых.)
18 / 30
Образец цинка массой 240 г содержит 2,5 % примесей хлорида цинка. Определите объём (в л.) газа (н.у.), который выделится при растворении указанного образца в соляной кислоте. (Запишите число с точностью до сотых.)
Определите объём (в л.) газа (н.у.), который выделится при растворении указанного образца в соляной кислоте. (Запишите число с точностью до сотых.)
19 / 30
При взаимодействии избытка этилового спирта с 18,4 г натрия с выходом 90 % был получен этилат натрия. Определите. массу полученного продукта. (Запишите число с точностью до целых.)
20 / 30
Образец оксида меди(II), содержащий примесь меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 176 г сульфата меди(II). Определите массу (в г.) указанного образца, если массовая доля оксида в образце 88 %. (Запишите число с точностью до целых.)
21 / 30
Из 3,5 кг технического карбоната натрия получили 6,18 кг бромида натрия. Вычислите массовую долю (%) карбоната натрия в указанном образце. (Запишите число с точностью до целых.)
22 / 30
На растворение природного известняка был затрачен раствор, содержащий 289,8 г азотной кислоты. При этом осталось 34 г не растворившегося в кислоте осадка. Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до десятых.)
Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до десятых.)
23 / 30
При взаимодействии загрязнённого образца гидрокарбоната калия с гидроксидом калия образовалось 372,6 г средней соли. Определите массу (в г.) указанного образца, если известно, что массовая доля посторонних примесей составляет 5 %. (Запишите число с точностью до целых.)
24 / 30
При обработке загрязнённого образца сульфида алюминия кислотой выделилось 6720 мл (н.у.) сероводорода и осталось 5 г нерастворившегося осадка. Вычислите массовую долю (%) примесей в указанном образце сульфида алюминия. (Запишите число с точностью до целых.)
25 / 30
При бромировании циклогексена массой 246 г было выделено 617,1 г продукта. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
26 / 30
Определите массу гидроксида натрия (кг), который может прореагировать с 2 кг кремнезёма. Содержание основного вещества в указанном кремнезёме составляет 12 %, примеси с гидроксидом натрия не реагируют. (Запишите число с точностью до сотых.)
(Запишите число с точностью до сотых.)
27 / 30
Определите объём (в л при н.у.) оксида серы(IV), который может быть получен из 12 кг пирита с содержанием основного вещества 90%. (Запишите число с точностью до целых.)
28 / 30
Определите массу оксида цинка (г), который можно получить при обжиге 970 г содержащего ZnS минерала сфалерита, если известно, что массовая доля примесей в сфалерите составляет 10 %. (Запишите число с точностью до целых.)
29 / 30
Определите массу алюминия (в г.), который может быть получен из 6 кг технического оксида алюминия с содержанием основного вещества 98%. (Запишите число с точностью до целых.)
30 / 30
Определите массу меди (кг), которую можно получить при восстановлении алюминием образца оксида меди(II) массой 312,5 кг, если в указанном образце содержится 4 % примеси оксида железа(III). (Запишите число с точностью до целых.)
Ваша оценка
Средний балл 0%
Задание 1. На взаимодействие с 1,5 кг технического поташа потребовалась соляная кислота, содержащая 730 г хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце указанного поташа. (Выпишите число с точностью до целых.)
Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце указанного поташа. (Выпишите число с точностью до целых.)
Задание 2. Образец сульфида алюминия массой 25 с содержанием примесей 10% поместили в раствор гидроксида калия, взятый в избытке. Определите массу тетрагидроксиалюмината калия (г.) , который образовался при этом (Выпишите число с точностью до десятых.)
Задание 3. В результате нитрования 468 г бензола было получено 616,5 г нитробензола. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
Задание 4. На взаимодействие с навеской технического сульфида натрия массой 130 г требуется соляная кислота, содержащая 102,2 г хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в указанном образце. (Запишите число с точностью до целых.)
Задание 5. Образец оксида меди(II), содержащий 15% примесей меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 352 г сульфата меди(II). Определите массу указанного образца (г.). (Запишите число с точностью до целых.)
При этом образовалось 352 г сульфата меди(II). Определите массу указанного образца (г.). (Запишите число с точностью до целых.)
Задание 6. Из 3,5 кг технического карбоната натрия получили 3510 г хлорида натрия. Вычислите массовую долю (%) карбоната натрия в указанном образце. (Запишите число с точностью до целых.)
Задание 7. На растворение природного известняка был затрачен раствор, содержащий 167,9 г хлороводорода. При этом осталось 24 г не растворившегося в кислоте осадка. Вычислите массовую долю (%) нерастворимых в кислоте примесей в указанном известняке. (Запишите число с точностью до десятых.)
Задание 8. При взаимодействии загрязненного образца гидрокарбоната натрия с гидроксидом натрия образовалось 286,2 г средней соли. Определите массу (в г.) указанного образца, если известно, что массовая доля посторонних примесей составляет 5 %. (Запишите. число с точностью до десятых.)
Задание 9. В результате взаимодействия бромида метиламмония массой 280 г с избытком гидроксида натрия был получен метиламин с выходом 80 %. Определите объём (в л.) (н.у.) выделившегося амина. (Запишите число с точностью до десятых.)
В результате взаимодействия бромида метиламмония массой 280 г с избытком гидроксида натрия был получен метиламин с выходом 80 %. Определите объём (в л.) (н.у.) выделившегося амина. (Запишите число с точностью до десятых.)
Задание 10. Образец оксида меди(II), содержащий в качестве примеси 5,7 % меди, поместили в соляную кислоту. На растворение оксида меди(II) из указанного образца потребовалось 146 г хлороводорода. Вычислите массу (в г.) нерастворившегося осадка меди. (Запишите число с точностью до десятых.)
Задание 11. При взаимодействии дивинила с избытком раствора брома образовалось 296,2 г тетрабромпроизводного. Определите массу (в г.) вступившего в реакцию дивинила, если выход этой реакции составил 88 %. (Запишите число с точностью до десятых.)
Задание 12. Определите объём (в л при н.у.) оксида серы(IV), который может быть теоретически получен из 1 кг пирита с содержанием основного вещества 93,6 %. (Запишите число с точностью до сотых.)
(Запишите число с точностью до сотых.)
Задание 13. Определите массу оксида цинка (кг), который можно получить при обжиге 900 кг содержащего ZnS минерала сфалерита, если известно, что массовая доля примесей в сфалерите составляет 11 %. (Запишите число с точностью до целых.)
Задание 14. Определите массу (в г.) алюминия, который может быть получен из 2 кг технического оксида алюминия с содержанием основного вещества 90%. (Запишите число с точностью до целых.)
Задание 15. Определите массу (в г.) меди, которую можно получить при восстановлении алюминием образца оксида меди(II) массой 688 г, если в указанном образце содержится 6 % примеси оксида железа(III). (Запишите число с точностью до целых.)
Задание 16. На взаимодействие с 2,5 кг технического карбоната натрия потребовалась соляная кислота, содержащая 1,46 кг хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце технического карбоната натрия. (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.)
Задание 17. Образец сульфида алюминия массой 500 г с содержанием примесей 10 % растворили в избытке гидроксида натрия. Определите массу (в г.) сульфида натрия, который образовался при этом. (Запишите число с точностью до целых.)
Задание 18. Образец цинка массой 240 г содержит 2,5 % примесей хлорида цинка. Определите объём (в л.) газа (н.у.), который выделится при растворении указанного образца в соляной кислоте. (Запишите число с точностью до сотых.)
Задание 19. При взаимодействии избытка этилового спирта с 18,4 г натрия с выходом 90 % был получен этилат натрия. Определите. массу полученного продукта. (Запишите число с точностью до целых.)
Задание 20. Образец оксида меди(II), содержащий примесь меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 176 г сульфата меди(II). Определите массу (в г.) указанного образца, если массовая доля оксида в образце 88 %. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
Задание 21. Из 3,5 кг технического карбоната натрия получили 6,18 кг бромида натрия. Вычислите массовую долю (%) карбоната натрия в указанном образце. (Запишите число с точностью до целых.)
Задание 22. На растворение природного известняка был затрачен раствор, содержащий 289,8 г азотной кислоты. При этом осталось 34 г не растворившегося в кислоте осадка. Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до десятых.)
Задание 23. При взаимодействии загрязнённого образца гидрокарбоната калия с гидроксидом калия образовалось 372,6 г средней соли. Определите массу (в г.) указанного образца, если известно, что массовая доля посторонних примесей составляет 5 %. (Запишите число с точностью до целых.)
Задание 24. При обработке загрязнённого образца сульфида алюминия кислотой выделилось 6720 мл (н. у.) сероводорода и осталось 5 г нерастворившегося осадка. Вычислите массовую долю (%) примесей в указанном образце сульфида алюминия. (Запишите число с точностью до целых.)
у.) сероводорода и осталось 5 г нерастворившегося осадка. Вычислите массовую долю (%) примесей в указанном образце сульфида алюминия. (Запишите число с точностью до целых.)
Задание 25. При бромировании циклогексена массой 246 г было выделено 617,1 г продукта. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
Задание 26. Определите массу гидроксида натрия (кг), который может прореагировать с 2 кг кремнезёма. Содержание основного вещества в указанном кремнезёме составляет 12 %, примеси с гидроксидом натрия не реагируют. (Запишите число с точностью до сотых.)
Задание 27. Определите объём (в л при н.у.) оксида серы(IV), который может быть получен из 12 кг пирита с содержанием основного вещества 90%. (Запишите число с точностью до целых.)
Задание 28. Определите массу оксида цинка (г), который можно получить при обжиге 970 г содержащего ZnS минерала сфалерита, если известно, что массовая доля примесей в сфалерите составляет 10 %. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
Задание 29. Определите массу алюминия (в г.), который может быть получен из 6 кг технического оксида алюминия с содержанием основного вещества 98%. (Запишите число с точностью до целых.)
Задание 30. Определите массу меди (кг), которую можно получить при восстановлении алюминием образца оксида меди(II) массой 312,5 кг, если в указанном образце содержится 4 % примеси оксида железа(III). (Запишите число с точностью до целых.)
Понравилось это:
Нравится Загрузка…
Масса продукта реакции
Дэвид Ликата | Ср, 29.10.2014 — 21:41
ЦЕЛЬ : Использовать принципы стехиометрии для определения теоретического выхода простой реакции, измерить фактический выход и рассчитать выход в процентах.
Эта лаборатория является частью целого подразделения по обучению стехиометрии. Вы можете получить доступ к полным планам уроков с информацией об их использовании и ссылками на другие рабочие листы, лабораторные работы и задания по адресу https://www. chemedx.org/article/stoichiometry-easy.
chemedx.org/article/stoichiometry-easy.
Концепции:
процент доходности
Stoichiometry
Теоретический доход
Концепции:
Stoichiometry, процент доходности, теоретический доход, фактический доход
Процедура:
50 минут
.
Необходимое время:
Один 50-минутный период для выполнения лабораторной работы. Один дополнительный период для выполнения расчетов (необязательно). Часто более способные студенты имеют время, чтобы начать некоторые расчеты в конце лабораторного эксперимента.
Материалы:
Apparatus
Сент -баланс
2 Тонкие Beral Pipets
1 — Кубок приправы
Пластинка
Goggles
1 — 100 мл. карбонат (Na2CO3)
3M Соляная кислота (HCl)
Справочная информация:
СПРАВОЧНАЯ ИНФОРМАЦИЯ : Сбалансированное химическое уравнение содержит много полезной информации. Он не только в сжатой форме сообщает вам, что представляют собой реагенты и продукты, но также сообщает об относительных количествах каждого вещества.
Коэффициенты в сбалансированном химическом уравнении дают математические отношения, которые существуют между молями каждого вовлеченного вещества. Когда коэффициенты выражены в виде отношений, вы можете предсказать количество продукта, которое образуется из заданного количества реагента (а также количество одного реагента для использования при заданном количестве другого и количество реагентов, необходимое для создания определенное количество товара). Использование коэффициентов сбалансированного уравнения таким образом является сутью стехиометрии.
В этом эксперименте вы прореагируете отмеренное количество карбоната натрия с избытком соляной кислоты (то есть более чем достаточным для использования). Продуктами реакции являются хлорид натрия, вода и углекислый газ (газ). Углекислый газ будет выделяться из раствора и исчезать. Измерение уменьшения массы дает количество произведенного углекислого газа. Используя принципы стехиометрии, вы можете затем рассчитать массу двуокиси углерода, которая должна была образоваться, и определить процент выхода эксперимента. Конечно, если все работает точно идеально, процент выхода должен быть 100%, то есть масса, которая по прогнозу должна образоваться, должна быть такой же, как и на самом деле.
Конечно, если все работает точно идеально, процент выхода должен быть 100%, то есть масса, которая по прогнозу должна образоваться, должна быть такой же, как и на самом деле.
Процедура:
1. Наденьте защитные очки. Будьте осторожны при использовании соляной кислоты 3M, так как она вызывает коррозию. Если вы пролили его на лабораторный стол, вы можете быстро нейтрализовать его разбавленным раствором бикарбоната натрия. Если вы пролили немного на руку, тщательно и быстро смойте водой в раковине.
2. С помощью весов в сантиграммах измерьте массу чашки для приправ. Если вы используете цифровые весы, используйте кнопку «тара», чтобы убедиться, что весы показывают «0,00 г» в начале, затем поместите чашку в центр чаши весов. Запишите массу пустой чашки в протокол.
3. Если вы используете трехрычажные весы, установите ползунки, чтобы добавить 0,50 г к текущей массе. Если вы используете цифровые весы, снова нажмите «тара», чтобы сбросить показания дисплея на 0,00 г. Добавьте около 0,50 г (от 0,45 г до 0,55 г) карбоната натрия в чашку для приправы. Запишите точную массу чашки с карбонатом натрия (если вы используете трехрычажные весы) или добавленного карбоната натрия (если вы используете цифровые весы). Будьте осторожны, чтобы не пролить карбонат натрия на чашу весов.
Добавьте около 0,50 г (от 0,45 г до 0,55 г) карбоната натрия в чашку для приправы. Запишите точную массу чашки с карбонатом натрия (если вы используете трехрычажные весы) или добавленного карбоната натрия (если вы используете цифровые весы). Будьте осторожны, чтобы не пролить карбонат натрия на чашу весов.
4. Оберните небольшой кусок полиэтиленовой пленки (4 или 5 дюймов) сверху чашки.
5. С помощью очень острого карандаша или кончика ножниц проткните три маленьких отверстия в пластиковой обертке, которые должны быть достаточно большими, чтобы в них вошел наконечник пипетки Beral. Распределите отверстия так, чтобы они были на одинаковом расстоянии вокруг пластика сверху чашки примерно на ¼ дюйма от края и примерно на ¼ дюйма друг от друга.
6. Подойдите к столу реагентов и возьмите две пипетки в один из маленьких стаканов (50 мл или 100 мл), которые вы там найдете. Полностью наполните обе пипетки раствором 3M HCl и поместите их в химический стакан колбой вниз (наконечником вверх). Соблюдайте особую осторожность при обращении и транспортировке соляной кислоты.
Соблюдайте особую осторожность при обращении и транспортировке соляной кислоты.
7. Обнулите весы (0,00 г) и найдите массу всего оборудования, которое вы использовали до сих пор: химический стакан с двумя наполненными пипетками и чашкой для приправы с карбонатом натрия и полиэтиленовой пленкой. Запишите эту массу.
8. Начните реакцию: осторожно вставьте верхнюю часть одной из пипеток Beral через одно из отверстий полиэтиленовой пленки и опустите ее примерно наполовину в чашку с карбонатом натрия. Добавляйте кислоту по одной капле к карбонату натрия. Медленно добавляйте кислоту и подождите, пока пузырьки не прекратятся, прежде чем добавлять больше кислоты. После добавления около 10 капель кислоты осторожно взболтайте раствор, чтобы перемешать его. Продолжайте добавлять кислоту и осторожно перемешивайте, пока реакция не прекратится. Возможно, вам придется использовать кислоту из второй пипетки. Убедитесь, что в чашке для приправы нет крошечных кусочков непрореагировавшего твердого вещества.
9. Запишите свои наблюдения в листе отчета.
10. Добавьте еще две капли кислоты, чтобы убедиться, что весь карбонат натрия прореагировал.
11. Обнулите весы (0,00 г) и снова найдите массу всех единиц оборудования, которые вы использовали (перечислены в шаге 7).
12. Поместите обе пипетки с оставшейся кислотой обратно в химический стакан и верните их на стол с реагентами, где вы их нашли.
13. Медленно слейте реакционный раствор в канализацию. Смойте водой. Тщательно промойте чашку для приправ, высушите ее и верните на место.
14. Тщательно вымойте руки. Начните расчеты в соответствии с инструкциями за своим столом.
Вопросы:
1. Каков фактический выход углекислого газа?
2. Уравнение реакции: твердый карбонат натрия реагирует с раствором соляной кислоты с образованием воды, хлорида натрия в растворе и углекислого газа. В строке ниже напишите и сбалансируйте химическое уравнение, используя химические символы.
3. С помощью таблицы Менделеева найдите и запишите молярную массу каждого из следующих двух реагентов как минимум с четырьмя значащими цифрами:
С помощью таблицы Менделеева найдите и запишите молярную массу каждого из следующих двух реагентов как минимум с четырьмя значащими цифрами:
a) карбонат натрия: 1 моль = _______ г b) двуокись углерода: 1 моль = _______ г
4. Используйте шаги стехиометрии, чтобы определить, сколько граммов двуокиси углерода вы бы произвели (если бы все в этом эксперименте работало отлично) учитывая массу карбоната натрия, которую вы добавили в чашку для приправы. Покажите свою работу на следующей странице и дайте ответ правильному количеству значащих цифр.
5. Каков теоретический выход углекислого газа? _______________ г
6. Определить процент выхода диоксида углерода. Покажите свою работу и используйте разумное количество значащих цифр.
7. Назовите и сформулируйте научный закон, который требует, чтобы ваш процентный выход был равен 100%, если вся реакция была идеальной и в вашей методике или измерениях не было ошибок.
8. Ваш учитель поможет вам рассчитать приблизительную неопределенность в процентах для всего эксперимента. Основываясь на рассчитанном вами процентном выходе и предполагаемой приемлемой неопределенности, данной вашим учителем, действителен ли закон, который вы изложили в седьмом вопросе, для этого эксперимента? Почему или почему нет?
Основываясь на рассчитанном вами процентном выходе и предполагаемой приемлемой неопределенности, данной вашим учителем, действителен ли закон, который вы изложили в седьмом вопросе, для этого эксперимента? Почему или почему нет?
Приготовление:
Карбонат натрия лучше всего иметь во флаконе или маленькой баночке на каждом лабораторном столе. Соляная кислота может находиться в стаканах в двух или трех местах в классе, чтобы учащиеся могли наполнить свои пипетки. Это очень быстро и просто, поэтому нет необходимости иметь HCl за каждым столом.
Разрежьте полиэтиленовую пленку на квадраты размером примерно 4 x 4 или 5 x 5 дюймов. Это проще всего сделать, если вы отрежете несколько кусков полиэтиленовой пленки размером примерно 11 x 8,5 дюймов, а затем поместите лист бумаги для заметок между листами, один лист бумаги сверху, а другой снизу. Затем разрежьте полиэтиленовую пленку «сэндвич» на четыре части. Таким образом, полиэтиленовая пленка легко распределяется и не прилипает сама к себе.
В качестве альтернативы пластиковой обертке можно использовать крышки, которые подходят к стаканчикам для приправ. Используйте маленькое шило или острие транспортира, чтобы проткнуть три отверстия в крышках.
Атрибуция:
Разработано совместно с Кортни Ланц из средней школы Пасифика (на пенсии).
Коллекция:
Стехиометрия
Безопасность
Общая безопасность
Для лабораторных работ: См. Руководство ACS по безопасности химических лабораторий в средних школах (2016 г.).
Для демонстраций: Пожалуйста, обратитесь к Руководству по безопасности химических демонстраций отдела химического образования ACS.
Прочие ресурсы по безопасности
RAMP: распознавать опасности; Оценить риски опасностей; Свести к минимуму риски опасностей; Подготовьтесь к чрезвычайным ситуациям
НГСС
Химические реакции HS-PS1-2
Учащиеся, демонстрирующие понимание, могут построить и пересмотреть объяснение результата простой химической реакции, основанное на самых удаленных электронных состояниях атомов, тенденциях в периодической таблице и знании закономерностей химических свойств.
*Более подробную информацию обо всех DCI для HS-PS1 можно найти на https://www.nextgenscience.org/dci-arrangement/hs-ps1-matter-and-its-interactions, а также дополнительные ресурсы на https://www. .nextgenscience.org.
Резюме:
Учащиеся, демонстрирующие понимание, могут построить и пересмотреть объяснение результата простой химической реакции, основанное на самых удаленных электронных состояниях атомов, тенденциях в периодической таблице и знании закономерностей химических свойств.
Граница оценки:
Оценка ограничена химическими реакциями с участием элементов основных групп и реакциями горения.
Пояснение:
Примеры химических реакций могут включать реакцию натрия и хлора, углерода и кислорода или углерода и водорода.
HS-PS1-7 Математические представления
Учащиеся, демонстрирующие понимание, могут использовать математические представления в поддержку утверждения о том, что атомы и, следовательно, масса сохраняются во время химической реакции.
*Более подробную информацию обо всех DCI для HS-PS1 можно найти на https://www.nextgenscience.org/dci-arrangement/hs-ps1-matter-and-its-interactions, а также дополнительные ресурсы на https://www. .nextgenscience.org.
Резюме:
Учащиеся, демонстрирующие понимание, могут использовать математические представления в поддержку утверждения о том, что атомы и, следовательно, масса сохраняются во время химической реакции.
Граница оценки:
Оценка не включает сложные химические реакции.
Пояснение:
Акцент делается на использовании математических идей для передачи пропорциональных соотношений между массами атомов в реагентах и продуктах, а также на переводе этих соотношений в макроскопический масштаб с использованием моля в качестве преобразования из атомного в макроскопический шкала. Акцент делается на оценке использования учащимися математического мышления, а не на запоминании и механическом применении методов решения задач.
Знать о титровании соляной кислоты стандартным карбонатом натрия
В этом эксперименте охарактеризованы методы кислотно-основного титрования, основанные на растворении пробы, превышающей нормальную кислоту, с последующим обратным титрованием стандартным основанием. Используя бромфеноловый синий в качестве индикатора, растворы соляной кислоты стандартизовали по чистому карбонату натрия. Здесь мы подробно изучим титрование HCl и карбоната натрия.
Цель
Определение концентрации разбавленного раствора соляной кислоты путем его титрования нормальным раствором карбоната натрия (М/10).
Теория
Раствор соляной кислоты можно титровать раствором карбоната натрия с использованием индикатора метилового оранжевого. Если слегка кислый раствор титруют слабым основанием, конечная точка будет слабокислой. Раствор является слабощелочным, если слабую кислоту титруют сильным основанием, так как образующаяся соль в определенной степени гидролизуется. Ниже приведена реакция карбоната натрия с HCl.
Ниже приведена реакция карбоната натрия с HCl.
Na 2 CO 3 (водн.) + 2HCl(водн.) → 2NaCl(водн.) + CO 2 (г) + H 2 O(ж)
CO 3 2-(водн.) + 2H+2H ) → CO 2 (г) + H 2 O(ж)
Это уравнения соляной кислоты и карбоната натрия.
При кислотно-основном титровании количество кислоты становится химически эквивалентным количеству присутствующего основания. Раствор становится нейтральным в случае титрования раствора сильной кислотой и сильным основанием.
Materials Required
Burette
Pipette
Conical flask
Burette stand
Funnel
Stirrer
White glazed tile
Measuring Колба
Соляная кислота
Карбонат натрия
Метилоранж
Watch glass
Procedure for Titration of HCl and Sodium Carbonate
A. Preparation of a Sodium Carbonate Standard Solution
Preparation of a Sodium Carbonate Standard Solution
Sodium carbonate has a molecular weight of 106.
The amount of sodium carbonate Для приготовления 250 мл раствора требуется 1,325 г.
Приготовьте стандартный раствор, растворив 1,325 г карбоната натрия в дистиллированной воде и добавив необходимое количество воды в мерную колбу на 250 мл.
B. Титрование раствора соляной кислоты и карбоната натрия. Обратите внимание на начальное чтение.
Возьмите 10 см 3 раствора HCl с помощью пипетки и перенесите в чистую промытую колбу для титрования.
Добавьте 2 капли метилового оранжевого в колбу для титрования.
Добавляйте раствор карбоната натрия M/10 в колбу для титрования, пока цвет не станет светло-розовым.
Запишите окончательные показания и определите объем раствора карбоната натрия, использованного для нейтрализации раствора HCl.
Повторяйте эксперимент, пока не получите согласованные показания.
Наблюдение
Объем раствора HCl = 10 см 3 .
Объем используемого раствора карбоната натрия = V см 3 .
С.№ | Начальное показание бюретки | Окончательное показание бюретки | Объем использованного раствора карбоната натрия. |
1 | a cm 3 | b cm 3 | (b-a) cm 3 |
2 | b cm 3 | в см 3 | (c-b) cm 3 |
3 | c cm 3 | d cm 3 | (d-c) cm 3 |
Расчет
(Карбонат натрия) A 1 M 1 V 1 = (HCL) A 2 M 2 2 2 3. 2 × 1/10 × V = 1 × x × 10 x = V/5 Прочность в г/л = молярность × молярная масса = V5 × 36,5. Концентрация раствора соляной кислоты ________ г/л. Не проливайте материал на чашу весов во время измерения. Аккуратно поверните ручку балансировки. После взвешивания поместите гири в ящик для гирь в правильном положении. Тщательно промойте часовое стекло, чтобы на нем не осталось ни одного кристалла. При перемещении взвешенного вещества поднесите часовое стекло к воронке и осторожно переместите его. Его следует несколько раз промыть дистиллированной водой. После титрования бюретку промыть водой. Во избежание нанесения дистиллированной воды выше отметки на горлышке мерного цилиндра последние несколько капель следует наносить пипеткой. Соляная кислота, также известная как соляная кислота, представляет собой водный раствор хлороводорода. Это бесцветная жидкость с сильным резким запахом. Считается сильной кислотой. В пищеварительной системе большинства видов животных, включая человека, он входит в состав желудочной кислоты. Соляная кислота является обычным лабораторным реагентом, а также обычным промышленным химикатом. На температуры кипения и плавления, плотность и pH соляной кислоты влияет концентрация или молярность HCl в водном растворе. Они варьируются от значений для воды при очень низких концентрациях около 0 процентов HCl до более 40 процентов HCl для дымящейся соляной кислоты. Соляная кислота производится путем растворения хлороводорода в воде в промышленных условиях. Этот учебный материал должен был дать вам общее представление о теме титрования HCl и карбоната натрия. Вы, должно быть, получили представление о теме и дали своему мозгу еще одну концепцию для хранения. Химия часто считается сложным предметом для большинства учащихся. Но при должном внимании и усилиях он может стать скорее экспериментальным объектом. Давайте познакомимся со звездным светом, чтобы изучить некоторые из проверенных приемов и приемов, которые упростят химию, а также повысят вашу способность к ее изучению. Лучший способ стать асом в химии — это прочитать учебный материал заранее, а затем, когда вы посещаете класс, вы начинаете понимать, но в процессе понимания вы можете обнаружить некоторые важные моменты, которые ваш разум уловит быстрее и запомнит. Еще одна хорошая вещь в том, что вы уже прочитали ее, поэтому у вас могут возникнуть вопросы, которые будут решены тут же. Благодаря этому методу время занятий используется более эффективно, а каждая лекция дает вам больше понимания, что в конечном итоге приводит к лучшим результатам. Делайте хорошие заметки Очень важно регулярно посещать занятия и делать все заметки. Заметки могут помочь вам в последние дни подготовки, а также очень удобны. Вы сможете делать хорошие заметки только в том случае, если будете уделять внимание классу и не будете отвлекаться. Убедитесь, что любые записи, которые вы делаете, должны быть организованы, так как это поможет вам просмотреть класс, который вы посетили, когда захотите. Химия — предмет, требующий полной концентрации. Если вы перенесете свое внимание с изучения и понимания концепций химии на получение более высоких оценок, это лишит вас всей концентрации, что, несомненно, повлияет на ваши окончательные результаты. Следовательно, учащимся рекомендуется всегда сосредотачиваться на обучении и понимать, что оценки всегда будут следовать. Использование учебных групп Использование учебных групп — очень хороший способ управлять изучением любого сложного предмета. Химия действительно сложный предмет, полный формул, символов и словарного запаса. Использование учебной группы поможет вам поделиться мыслями с другими, а также выслушать их. Вы также можете просмотреть их записи, развеять сомнения и обменяться идеями. Нет лучшего способа изучить химию, чем получить практический опыт. Химические лаборатории могут быть очень полезными, если вы пытаетесь извлечь из них максимальную пользу. Студенты никогда не должны упускать шанс побывать в лаборатории. Это поможет вам укрепить свои знания по химии, а также улучшить понимание концепций. те, которые, по вашему мнению, подойдут вам лучше всего. Бывают моменты, когда вы можете подумать, что какая-то стратегия так хорошо работает для вашего партнера, и вы также получите такие же результаты, но это не так. Студентам рекомендуется работать, основываясь на своих учебных привычках и моделях, а не под влиянием других. Успех не всегда приходит легко, но если вы решите не сдаваться и продолжать двигаться вперед, несмотря на трудности, он придет к вам рано или поздно. Это то, чего мы будем ждать, и пусть его видение постоянно подпитывается. Chemguide: Основная химия 14 — 16 Реакции между кислотами и карбонатами На этой странице рассматриваются реакции между кислотами и карбонатами с образованием соли, углекислого газа и воды. Итоговое уравнение кислота + карбонатная соль + CO 2 + вода Реакции с участием карбоната кальция Самая распространенная карбонатно-кислотная реакция, с которой вы столкнетесь, это реакция между карбонатом кальция и разбавленной соляной кислотой. Карбонат кальция встречается в природе в виде мела, известняка и мрамора. Сразу появляется шипение с выделением бесцветного газа — это углекислый газ. Мрамор вступает в реакцию с образованием бесцветного раствора хлорида кальция. CaCO 3 (т) + 2HCl(водн.) CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Реакция с разбавленной серной кислотой несколько сложнее, так как образующийся сульфат кальция очень мало растворим. Реакция начинается, но почти сразу снова останавливается, потому что мраморная крошка покрывается слоем сульфата кальция, который предотвращает попадание кислоты на мраморную крошку. На фото показано, как выглядит реакция вскоре после добавления кислоты. Ничего не происходит. Ионное уравнение реакции Все карбонаты реагируют одинаково, потому что в каждом случае происходит один и тот же химический процесс. Ионы карбоната из карбоната реагируют с ионами водорода из кислоты. CO 3 2- (т или водный) + 2H + (водный) CO 2 (г) + H 2 O(ж) «(s or aq)» означает, что некоторые карбонаты (карбонаты натрия, калия и аммония) растворимы в воде, поэтому вы можете использовать раствор одного из них. Итак, если вы добавите разбавленную соляную кислоту в раствор карбоната натрия, вы снова получите углекислый газ, но на этот раз все будет в растворе. Так что же происходит с другими ионами? Это ионы зрителей. В случае соляной кислоты/карбоната кальция ионы хлорида все время находятся в растворе. Ионы кальция первоначально присутствовали в твердом теле и в конечном итоге оказались в растворе, но они все еще являются ионами кальция. Так раствор содержит ионы кальция и ионы хлора — раствор хлористого кальция. Реакция между карбонатом меди(II) и разбавленной серной кислотой Карбонат меди(II) представляет собой нерастворимый зеленый порошок. Следующее видео показывает его реакцию с разбавленной серной кислотой и показывает, как можно проверить выделяющийся углекислый газ. CuCO 3 (т) + H 2 SO 4 (водн.) CuSO 4 (водн.) + CO 2 (г) + Н 2 О(л) Ионное уравнение, показывающее реакцию между карбонатом и ионами водорода, точно такое же, как и раньше, за исключением, конечно, того, что мы знаем, что карбонат меди (II) является твердым телом. CO 3 2- (т) + 2H + (водн.) CO 2 (г) + H 2 O(л) На этот раз ионы-зрители, которые у вас остались, представляют собой ионы меди (II) и ионы сульфата в растворе — голубой раствор сульфата меди (II). Анализ на диоксид углерода Вы тестируете углекислый газ, используя известковую воду — очень разбавленный раствор гидроксида кальция в воде. Известковая вода представляет собой бесцветный раствор и становится мутной («молочной») при пропускании через нее углекислого газа. Гидроксид кальция реагирует с углекислым газом с образованием нерастворимого карбоната кальция — вот что вызывает помутнение. Ca(OH) 2 (водн.) + CO 2 (г) CaCO 3 (т) + Н 2 О(л) Гидрокарбонаты Получение гидрокарбоната кальция Если через известковую воду длительное время пропускать углекислый газ, то она сначала мутнеет из-за образования осадка карбоната кальция, но затем осадок снова исчезает, давая бесцветный раствор. Следующий фрагмент видео показывает, как это происходит. Видео немного неуклюжее, но химически точное. Осадок карбоната кальция реагирует с большим количеством диоксида углерода с образованием гидрокарбоната кальция Ca(HCO 3 ) 2 . Гидрокарбонат кальция растворим в воде. CaCO 3 (т) + CO 2 (г) + H 2 O(ж) Ca(HCO 3 ) 2 (водн.) Это та же самая реакция, которая создает системы пещер в известняковых породах. Известняк представляет собой форму карбоната кальция. Углекислый газ, растворенный в дождевой воде, постепенно растворяет породу в течение очень длительного периода времени. Реакция гидрокарбонатов с кислотами Вы найдете такие соединения, как гидрокарбонат натрия, также называемые «гидрокарбонат натрия» (отдельные слова) или старое название «бикарбонат натрия». Я предпочитаю название «гидрокарбонат натрия», потому что оно показывает, что и водород, и карбонат являются частью одного и того же иона HCO 3 — . Твердых гидрокарбонатов очень мало — единственные, с которыми вы, вероятно, встретитесь, — это гидрокарбонаты натрия и калия. Гидрокарбонат кальция существует только в растворе. Если вы попытаетесь превратить его в твердое вещество, оно снова распадется на карбонат кальция, углекислый газ и воду. Гидрокарбонаты реагируют с кислотами так же, как и карбонаты. Так, например, если вы добавите разбавленную соляную кислоту к твердому гидрокарбонату натрия, она будет реагировать с выделением бесцветного газообразного диоксида углерода и образованием бесцветного раствора хлорида натрия. NaHCO 3 (т) + HCl (водн.) NaCl (водн.) + CO 2 (г) + Н 2 О(л) Ионное уравнение реакции HCO 3 — (т) + H + (водн.) CO 2 (г) + H 2 O(л) Вы также можете встретить гидрокарбонаты кальция или магния, если будете вести тему о жесткой воде. И это все, что вам нужно знать! Куда бы вы хотели отправиться сейчас? К меню кислот, оснований и солей. . . В меню Химия 14-16 . . . В главное меню Chemguide . . . © Джим Кларк 2020 Namrata Das Подготовка к экзаменам | Обновлено от 5 апреля 2022 г. Процедура кислотно-основного титрования основана на растворении образца в избытке стандартной кислоты с последующим обратным титрованием стандартным основанием. Целью титрования является определение неизвестной концентрации в образце с помощью аналитического метода. Таблица Содержания Ключевые такии: Титрирование, Hydrochloric Acidate, Sodik Carbonate, Solidator, Soladtoration, Soladtoration, Soladtoration, Saltoration, Solidator, Soladtoratation, Solidator, Solidator, Idmator. Подробнее: Количество молей Формула [Нажмите здесь, чтобы просмотреть примеры вопросов] Определение концентрации данного раствора разбавленной соляной кислоты путем его титрования стандартным раствором карбоната натрия (М/20). [Щелкните здесь, чтобы просмотреть примеры вопросов] Раствор соляной кислоты можно титровать раствором карбоната натрия с использованием индикатора метилового оранжевого. При титровании слабого основания раствором сильной кислоты в конце реакции получается слабокислая реакция. Раствор является слабощелочным, если слабую кислоту титруют сильным основанием, так как образующаяся соль в определенной степени гидролизуется. Химические реакции, участвующие в этом титровании, приведены ниже. Na 2 CO 2 (aq) + 2HCl(aq) → 2NaCl(aq) + CO 2 (g) + H 2 O(l) CO 3 2- (aq) + 2H + (aq) → CO 2 (g) + H 2 O(l) Это уравнения соляной кислоты и карбоната натрия . См. также: [Нажмите здесь, чтобы просмотреть примеры вопросов] [Нажмите здесь, чтобы просмотреть примеры вопросов] (a) Приготовление стандартного раствора карбоната натрия (b) Титрование раствора соляной кислоты и карбоната натрия Читайте также: Объем раствора HCl = 10см 3 . Объем используемого раствора карбоната натрия = V см 3 . Серийный № Начальное показание бюретки Окончательное показание бюретки 0003 1 acm 3 bcm 3 (b-a) cm 3 2 bcm 3 CCM 3 (C-B) CM 3 3 6768 DCM 3 (D-C) CM 3 (Carkandate Sod) A1M1V = HCL) A1023. (Carkandate) A1M1V13333339.9026 (Carkandate) A1M1V1333. (HODE Dararyat 2 × 1/10 × V = 1 × x × 10 x = V/5 Прочность в г/л = молярность × молярная масса = V/5 × 36,5. Концентрация раствора соляной кислоты ________ г/л. Подробнее: Атомная теория Дальтона [Нажмите здесь, чтобы просмотреть примеры вопросов] (a) Следует соблюдать осторожность при работе с кислотой и основанием. (b) Всегда промывайте бюретку и пипетку раствором, который нужно набрать в их. (c) Удалите воздушный зазор, если он есть, из бюретки перед титрованием. (d) Никогда не забывайте снимать воронку с бюретки, прежде чем записывать начальное показание бюретки и убедитесь, что с сопла не свисает ни одна капля. (e) Всегда считывайте показания нижнего мениска для всех прозрачных растворов и верхнего мениска для окрашенных растворов. (f) Никогда не используйте бюретку и пипетку со сломанным носиком. (g) Никогда не всасывайте с помощью пипетки сильные кислоты или щелочи, используйте грушу пипетки. (h) Всегда держите нижний конец пипетки погруженным в жидкость при всасывании жидкости . (i) При переносе раствора в колбу не выдувать последнюю каплю из раствор из жиклера пипетки. (j) Крепость раствора должна быть рассчитана до четвертого знака после запятой. Читайте также: Вопросы. Какой индикатор используется при титровании карбоната натрия соляной кислотой и какое изменение цвета наблюдается в конце? (2 балла) Ответ. Метиловый оранжевый используется при титровании карбоната натрия против соляной кислоты, и изменение цвета в конечной точке будет от желтого до розовато-красного. Вопросы. Как приготовить 250 мл 0,05 М раствора карбоната натрия? (3 балла) Ответ. Мы можем приготовить 0,05 М раствор, растворив 1,325 г карбоната натрия в 250 мл. Дано: Молярность = 0,05 Объем раствора, V = 250 мл Молярная масса карбоната натрия, M. Мы знаем, что молярность, M = (w × 1000)/(M.wt × V) ⇒ 0,05 = (w × 1000)/(106 × 250) w = 1,325 г Таким образом , смешивая 1,325 г карбоната натрия с 250 г, можно получить 0,05 М раствор. Вопрос. Хотя карбонат натрия является солью, его водный раствор имеет слабощелочную природу. Объяснить, почему? (2 балла) Ответ. Карбонат натрия при растворении в воде гидролизуется с образованием слабой кислоты, угольной кислоты и сильного основания гидроксида натрия. Следовательно, водный раствор карбоната натрия имеет щелочную природу. Вопросы. Как определить кислотность раствора карбоната натрия? (1 балл) Отв. Кислотность раствора карбоната натрия можно определить с помощью рН-метра или лакмусовой бумажки. Вопросы. Почему метиловый оранжевый не является основанием Аррениуса? (2 балла) Ответ. Метиловый оранжевый — это индикатор pH, часто используемый при титровании из-за его четкого и отчетливого изменения цвета. Вопрос. Как можно оттитровать раствор смеси Na 2 CO 3 и NaHCO 3 относительно HCl? (3 балла) Отв. Оценка содержания Na 2 CO 3 и NaHCO 3 в смеси: Точно взвесьте около 2,0 г смеси и приготовьте раствор в дистиллированной воде в стандартной колбе на 250 мл. Медленно титруют 25 мл этого раствора стандартной соляной кислотой, используя в качестве индикатора фенолфталеин. Повторять до согласования (Вп мл). Вопрос. В чем разница между конечной точкой и точкой эквивалентности? (2 балла) Ответ. Основное различие между эквивалентностью и конечной точкой заключается в том, что точка эквивалентности — это точка, в которой заканчивается химическая реакция, а конечная точка — это точка, в которой происходит изменение цвета в системе. Вопросы. Можно ли напрямую приготовить стандартные растворы HCl, HNO 3 и H 2 СО 4 ? (2 балла) Ответ. Соляная кислота, HCl и серная кислота H 2 SO 4 не подходят для использования в качестве первичного стандарта, поскольку, хотя оба они имеются в продаже в виде концентрированных растворов, которые легко разбавляются, концентрация «концентрированного» раствора НЕ точно известно. Химия Ссылки по теме: В этом эксперименте учащиеся тестируют этановую кислоту с раствором универсального индикатора, раствором магния, раствором гидроксида натрия и раствором карбоната натрия. Они сравнивают эти реакции с реакциями соляной кислоты той же концентрации, наблюдая некоторые типичные свойства этановой кислоты как слабой органической кислоты. Студенты могут выполнить это практическое задание примерно за 30 минут или 40 минут, если включено дополнительное задание. Задействовано много бесцветных растворов, поэтому учащиеся должны быть организованы. Может оказаться полезным наклеить этикетки, чтобы на пробирках можно было маркировать их содержимое. Расширение с карбонатом меди является красочной дополнительной реакцией, или его можно использовать в качестве альтернативы карбонату натрия. Учеников можно попросить написать уравнения протекающих реакций. Наиболее сложная область – это формулы солей двухвалентных ионов с этаноатом. Проиллюстрированные эксперименты представляют собой четыре классических теста на кислотность (pH, воздействие щелочей, карбонатов и реактивных металлов). Потребность в воде, чтобы кислоты могли проявлять кислотность, рассматривается в разделе Что делает вещество кислым? которые могли бы последовать за этим экспериментом. Другим расширением является получение солей, например сульфата меди, как в разделе «Реакция оксида меди (II) с серной кислотой». Соляная кислота покажет pH = 1, а этановая кислота покажет pH = 3. Для нейтрализации кислот потребуется всего несколько капель раствора карбоната натрия и раствора гидроксида натрия, так как щелочных растворов в восемь раз больше. концентрированнее кислот. Соляная кислота будет сильно шипеть с раствором карбоната натрия, тогда как для этановой кислоты шипение будет заметным, но менее сильным. Соляная кислота будет шипеть вместе с магнием. Водород выделяется. (Собрать в пробирку, перевернутую над реакционной трубкой, и быстро перенести открытый конец в пламя — должен быть слышен скрипучий хлопок.) С этановой кислотой водород выделяется медленнее. Обе кислоты будут шипеть с карбонатом меди, но реакция с соляной кислотой будет более бурной. Обсуждение слабых и сильных кислот, вероятно, больше подходит для продвинутых, а не средних учащихся. Этановая кислота является слабой кислотой, что означает, что она не полностью диссоциирует на ионы в воде. СН 3 COOH ⇌ H + + CH 3 COO — Соляная кислота является сильной кислотой и полностью диссоциирует. HCl → H + + Cl — Это означает, что концентрация ионов H + в 0,4 М HCl выше, чем в 0,4 М этановой кислоте, поэтому ее рН ниже, а кислотные реакции Быстрее. Однако при добавлении щелочи положение равновесия этановой кислоты смещается вправо, поэтому в конечном итоге вся кислота вступает в реакцию, как показано в уравнениях ниже: NaOH + HCl → NaCl + H 2 O Na 2 CO 3 + 2HCl → 2NaCl + CO 2 + H 2 O CuCO 3 + 2HCl → CuCl 2 + CO 2 + H 2 O Дополнительную информацию об этих и других свойствах этановой кислоты можно найти в Chemguide. Чтобы узнать простые факты о кислоте и щелочи для студентов GCSE, попробуйте S-cool. Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии. © Nuffield Foundation и Королевское химическое общество Проверка здоровья и безопасности, 2016 г. Вопрос задан: Кэтрин Трейтель мл. Оценка: 4,2/5
(52 голоса) Поскольку соляная кислота вряд ли будет у вас дома, вы редко будете смешивать карбонат натрия и HCl самостоятельно. Однако эта реакция имеет некоторое применение в промышленных масштабах, поскольку 9Карбонат натрия 0581 можно использовать для удаления избытка HCl из раствора . Что происходит, когда карбонат натрия реагирует с соляной кислотой? Ответ: При взаимодействии разбавленной соляной кислоты с карбонатом натрия образуется хлорида натрия, углекислого газа и воды. Наблюдается бурное вскипание при выделении углекислого газа. Карбонат натрия представляет собой динатриевую соль угольной кислоты с подщелачивающим свойством. Ответ: Объяснение: Ну, HCl — это кислота, и она реагирует с карбонатом металла Na2CO3 с образованием CO2 (двуокиси углерода), h3O и NaCl (хлорида натрия) . Поскольку это связано с выделением углекислого газа, наблюдается быстрое вскипание. При смешивании растворов карбоната натрия и соляной кислоты уравнение гипотетической реакции двойного замещения имеет вид: Na2CO3 + 2 HCl → 2 NaCl + h3CO3 При смешивании этих растворов выделяются пузырьки бесцветного газа . 39 связанных вопросов найдено N a2CO3(s)+2HCl(aq)→2NaCl(aq)+CO2(g)+h3O(I) Добавление HCl к NaHCO3 представляет собой экзотермическую реакцию (с выделением энергии), в результате которой раствор нагревается. Сульфит натрия (NaSO3) и соляная кислота (HCl) смешиваются с образованием газообразного диоксида серы (SO2) , который является обычным побочным продуктом промышленных процессов. В воздухе этот газ смешивается с дождевой водой (h3O), а затем с кислородом (O2) с образованием серной кислоты (h3SO4). Выберите наиболее близкий вам ответ. Что вы наблюдали после добавления карбоната натрия к соляной кислоте? В колбе Эрленмейера пузырилось. … В результате реакции между соляной кислотой и карбонатом натрия образовался газ, который попал в закрытую колбу. — Следовательно, карбонат натрия является основной солью , потому что это соль, полученная из слабой кислоты и сильного основания. Поэтому правильный ответ — вариант (С) слабая кислота и сильное основание. Эндотермический Реакция бикарбоната натрия с соляной кислотой. Сульфит натрия представляет собой неорганическую натриевую соль, содержащую сульфит в качестве противоиона. Он играет роль пищевого консерванта и восстановителя . Сульфит натрия реагирует с серной кислотой с образованием натрия гидросульфат, диоксид серы и вода . При помещении растворов соляной кислоты и сульфита натрия в химический стакан образуются продукты: соль, вода и диоксид серы (реакция приведена ниже). Смешивание гидрокарбоната натрия и HCl является химическое изменение , потому что были пузырьки и изменение температуры. Углекислый газ выделяется при реакции гидрокарбоната натрия с разб. Соляная кислота. Карбонат натрия представляет собой динатриевую соль угольной кислоты с подщелачивающим свойством. Молекулы карбоната натрия перестраиваются в воде, высвобождая энергию в виде тепла. Этот перенос тепла из химической системы называется экзотермическим процессом . Объяснить. Реакция между металлическим магнием и соляной кислотой является экзотермической , поскольку при ней выделяется энергия в виде тепла (повышение температуры). Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов. Из результатов наших исследований мы делаем вывод, что хотя соляная кислота и бикарбонат натрия реагируют мгновенно, образование газа в результате происходит медленно , главным образом потому, что CO2, образующийся при дегидратации угольной кислоты, растворяется в воде и лишь медленно высвобождается в газовая фаза. При добавлении карбоната натрия к гидроксиду натрия характерной реакции не происходит, так как они оба являются основаниями. Соль карбонат натрия содержит ионы Na + и CO3 2 — в растворе , из которых Na + соединяется с OH – воды с образованием NaOH. В этом типе реакции кислота взаимодействует с карбонатом с образованием соли, воды и двуокиси углерода. Поскольку реагирующей щелочью является карбонат цинка, продуктом будет соль цинка. Поскольку в качестве кислоты используется азотная кислота, получаемая соль будет равна нитрат . Смести разлив и поместить в герметичный пакет или контейнер для утилизации. Вымойте место разлива после завершения сбора. Информацию об утилизации см. Результат

Меры предосторожности

Знаете ли вы?
 Хлористый водород можно получить несколькими способами, но есть некоторые предшественники соляной кислоты. В хлорно-щелочном процессе, в ходе которого образуются гидроксид, водород и хлор, последний из которых можно комбинировать для получения HCl, крупномасштабное производство соляной кислоты почти всегда сочетается с промышленным производством других химических веществ.
Хлористый водород можно получить несколькими способами, но есть некоторые предшественники соляной кислоты. В хлорно-щелочном процессе, в ходе которого образуются гидроксид, водород и хлор, последний из которых можно комбинировать для получения HCl, крупномасштабное производство соляной кислоты почти всегда сочетается с промышленным производством других химических веществ.
 Кроме того, еще одним важным преимуществом является то, что он заставляет вас записывать все пункты, что, в свою очередь, поможет вам легко запомнить концепции.
Кроме того, еще одним важным преимуществом является то, что он заставляет вас записывать все пункты, что, в свою очередь, поможет вам легко запомнить концепции. Однако создание большой группы также может привести к путанице, поэтому учащимся рекомендуется создать небольшую группу и извлечь из этого максимальную пользу. Ваши учебные сессии не должны быть очень длинными, только до тех пор, пока вы не сочтете их продуктивными, а позже вы должны уделять время самостоятельным занятиям.
Однако создание большой группы также может привести к путанице, поэтому учащимся рекомендуется создать небольшую группу и извлечь из этого максимальную пользу. Ваши учебные сессии не должны быть очень длинными, только до тех пор, пока вы не сочтете их продуктивными, а позже вы должны уделять время самостоятельным занятиям.
кислоты и карбонаты
 На фото показана реакция с мраморной крошкой.
На фото показана реакция с мраморной крошкой.

 Это фото взято из Википедии.
Это фото взято из Википедии.


Примечание: Честно говоря, на этом уровне вы можете столкнуться с гидрокарбонатом кальция, образующимся в реакции с известковой водой, и гидрокарбонатом натрия, используемым для проверки на наличие кислоты.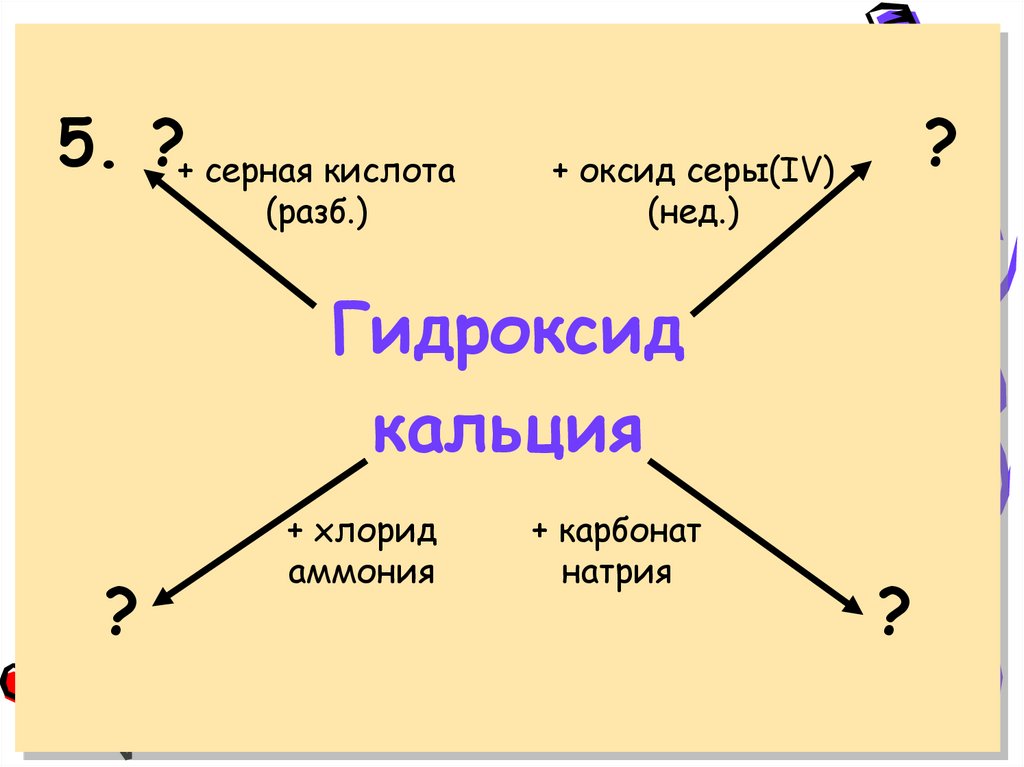 Если вы добавите твердый гидрокарбонат натрия в жидкость и получите углекислый газ, то жидкость должна быть кислой.
Если вы добавите твердый гидрокарбонат натрия в жидкость и получите углекислый газ, то жидкость должна быть кислой.
Титрование соляной кислоты стандартным карбонатом натрия
 Раствор с точно известной концентрацией, молярность или нормальность которого известны, называется стандартным раствором или титрантом. Процесс добавления стандартного раствора к раствору неизвестной концентрации до полного завершения реакции называется 9.0005 титрование . Точка, в которой реакция завершается, называется точкой эквивалентности или теоретической или стехиометрической конечной точкой. Рассмотрим подробнее опыт титрования соляной кислоты стандартным раствором карбоната натрия.
Раствор с точно известной концентрацией, молярность или нормальность которого известны, называется стандартным раствором или титрантом. Процесс добавления стандартного раствора к раствору неизвестной концентрации до полного завершения реакции называется 9.0005 титрование . Точка, в которой реакция завершается, называется точкой эквивалентности или теоретической или стехиометрической конечной точкой. Рассмотрим подробнее опыт титрования соляной кислоты стандартным раствором карбоната натрия.
Цель
Теория
 При кислотно-основном титровании в конечной точке количество кислоты становится химически эквивалентным количеству присутствующего основания. Раствор становится нейтральным в случае титрования раствора сильной кислотой и сильным основанием.
При кислотно-основном титровании в конечной точке количество кислоты становится химически эквивалентным количеству присутствующего основания. Раствор становится нейтральным в случае титрования раствора сильной кислотой и сильным основанием. Необходимые материалы
Materials Required Процедура
 в мерную колбу на 250 мл.
в мерную колбу на 250 мл. Наблюдение

9 Объем использованного раствора карбоната натрия 3 3 3 .0368 Расчет
 9026
9026 Результат и обсуждение
Меры предосторожности

Что следует помнить

Примеры вопросов
 w. = 106 г
w. = 106 г Поскольку он меняет цвет при рН кислоты средней силы, его обычно используют при титровании кислот. Метиловый оранжевый окрашивается в красный цвет в кислой среде и в желтый цвет в щелочной среде.
Поскольку он меняет цвет при рН кислоты средней силы, его обычно используют при титровании кислот. Метиловый оранжевый окрашивается в красный цвет в кислой среде и в желтый цвет в щелочной среде.
Кислотные реакции этановой кислоты | Эксперимент
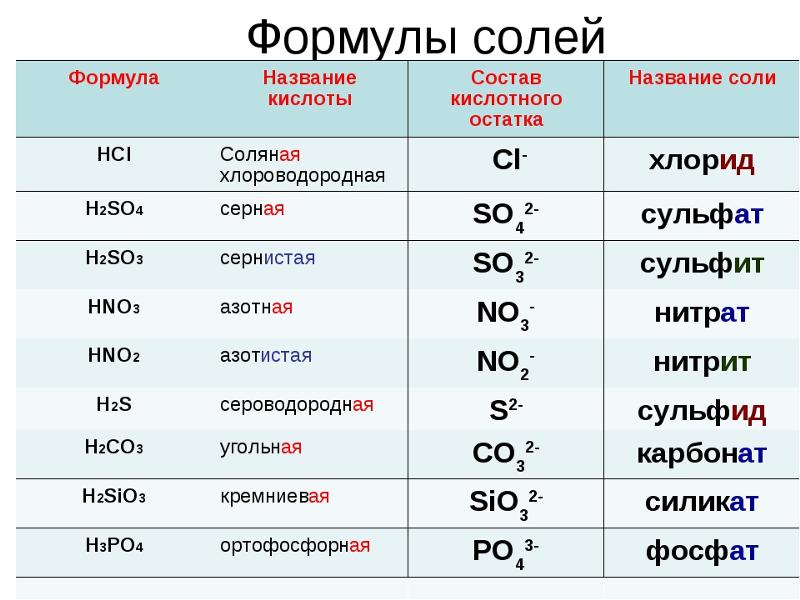

Оборудование
Аппаратура
Для удлинителя:
Химикаты
Для расширения:
Примечания по охране труда и технике безопасности

 ) – см. карточку опасности CLEAPSS HC095A и книгу рецептов CLEAPSS RB080.
) – см. карточку опасности CLEAPSS HC095A и книгу рецептов CLEAPSS RB080. Для расширения:
Процедура
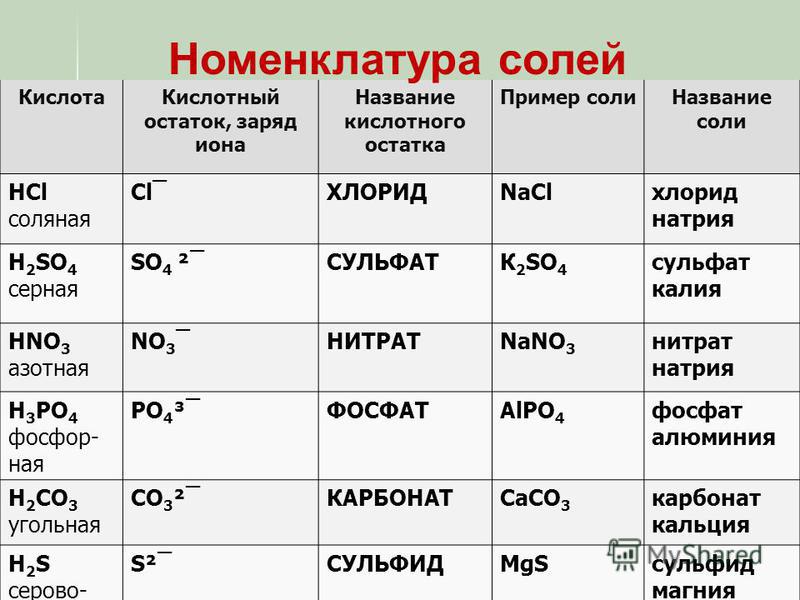
Удлинитель или вместо использования раствора карбоната натрия:

Учебные заметки
 Когда любой избыток карбоната меди осядет, будут видны цвета хлорида меди (зеленый) и этаноата меди (синий).
Когда любой избыток карбоната меди осядет, будут видны цвета хлорида меди (зеленый) и этаноата меди (синий).
NaOH + CH 3 COOH → CH 3 COONa + H 2 O
NA 2 CO 3 + 2CH 3 COOH → 2CH 3 COONA + CO 2 + H 2 . + H 2
+ H 2
Mg + 2CH 3 COOH → (CH 3 COO) 2 Mg + H 2
CuCO 3 + 2CH 3 COOH → (CH 3 COO) 2 Cu + CO 2 + H 2 O Дополнительная информация

Будет ли карбонат натрия нейтрализовать соляную кислоту?
Что делает карбонат натрия с соляной кислотой?
Нейтрализует ли карбонат натрия кислоты?
 При растворении в воде карбонат натрия образует угольную кислоту и гидроксид натрия. Как сильная база, гидроксид натрия нейтрализует желудочную кислоту , тем самым действуя как антацид.
При растворении в воде карбонат натрия образует угольную кислоту и гидроксид натрия. Как сильная база, гидроксид натрия нейтрализует желудочную кислоту , тем самым действуя как антацид. Что происходит, когда Na2CO3 добавляют к HCl?
Реагирует ли Na2CO3 с HCl?
Na2CO3 + HCl — карбонат натрия + соляная кислота
com/embed/ciEpkUklLfY?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»> Что происходит, когда карбонат натрия реагирует с соляной кислотой, что дает сбалансированное химическое уравнение?
Является ли NaHCO3 HCl эндотермической?
Что происходит, когда сульфит натрия реагирует с соляной кислотой?

Что вы наблюдали после добавления карбоната натрия к соляной кислоте?
Является ли карбонат натрия кислотой?
Является ли реакция бикарбоната натрия с соляной кислотой эндотермической или экзотермической?
Является ли сульфит натрия восстановителем?

Что выделяется при обработке сульфита натрия разбавленной серной кислотой?
Какие продукты получают при смешивании соляной кислоты с водным раствором сульфита натрия?
Является ли смешивание гидрокарбоната натрия и соляной кислоты физическим или химическим изменением?
При реакции карбоната натрия с соляной кислотой выделяется газ?
Является ли карбонат натрия сильным основанием?
 … В качестве сильного основания гидроксид натрия нейтрализует желудочную кислоту, тем самым действуя как антацид.
… В качестве сильного основания гидроксид натрия нейтрализует желудочную кислоту, тем самым действуя как антацид. Является ли карбонат натрия экзотермическим или эндотермическим?
Является ли соляная кислота эндотермической?
Медленно ли реагирует HCL с nahco3?

Что происходит, когда гидроксид натрия реагирует с карбонатом натрия?
Какая соль образуется при взаимодействии карбоната натрия с разбавленной азотной кислотой?
Как утилизировать сульфит натрия?



 Их…
Их… ..
.. ..
..
 Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!
Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!

 К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Образуется осадок гидроксида алюминия и выделяется углекислый газ:
Образуется осадок гидроксида алюминия и выделяется углекислый газ: Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ: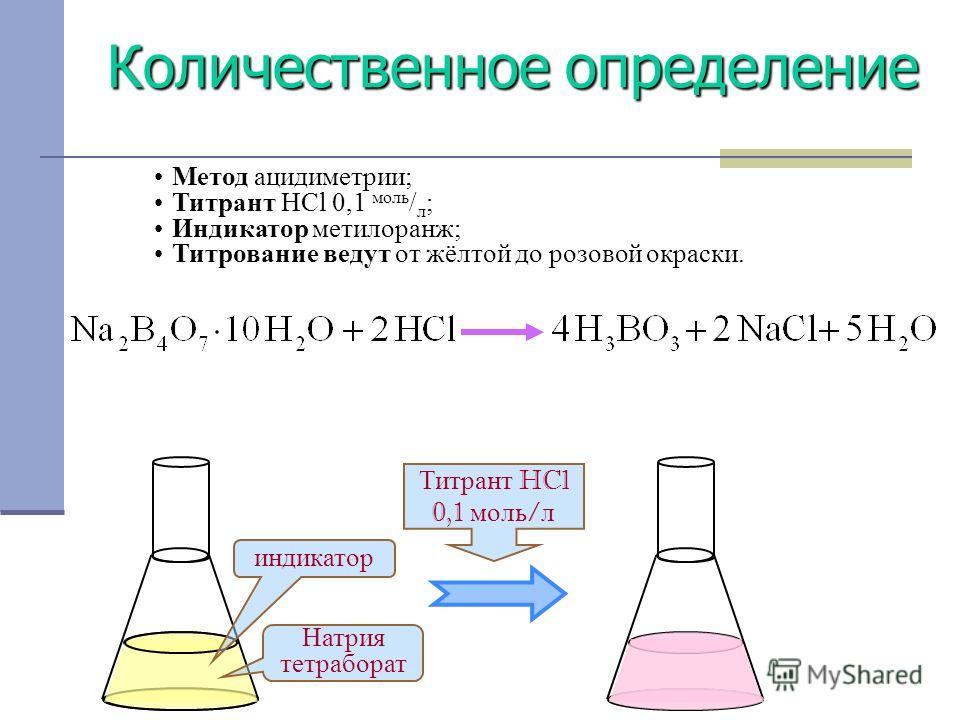 При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III): Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.