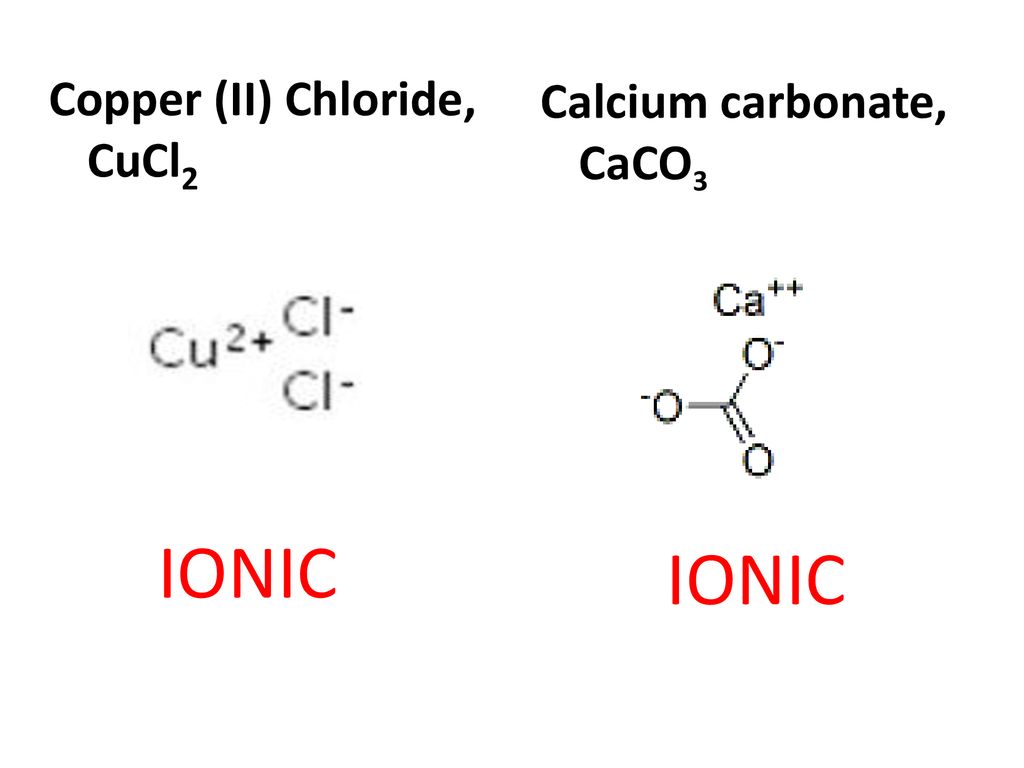
Реакция карбоната натрия и хлорида кальция
Химические реакции
Виктор Потехин
Реакция взаимодействия карбоната натрия и хлорида кальция.
Уравнение реакции взаимодействия карбоната натрия и хлорида кальция:
Карбонат натрия и хлорид кальция взаимодействуют друг с другом. Данная реакция используется для получения карбоната кальция в пищевой промышленности.
CaCl2 + Na2CO3 → CaCO3 + 2NaCl.
Реакция карбоната натрия и хлорида кальция протекает при обычных условиях.
Для проведения реакции используются водные растворы карбоната натрия и хлорида кальция.
В результате реакции карбоната натрия и хлорида кальция образуются карбонат кальция и хлорид натрия.
Все химические реакции.
Коэффициент востребованности 415
- ← Реакция оксида железа и углерода
- Переработка шин →
Мировая экономика
Нефть Brent и WTI
USD/JPY
USD/AUD
USD/CHF
USD/GBP
USD/CAD
Серебро
Палладий
Золото
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 294)
- Экономика Второй индустриализации России (103 767)
- Этилен (этен), получение, свойства, химические реакции (30 571)
- Программа искусственного интеллекта ЭЛИС (30 436)
- Метан, получение, свойства, химические реакции (27 387)
- Крахмал, свойства, получение и применение (27 091)
- Природный газ, свойства, химический состав, добыча и применение (26 004)
- Целлюлоза, свойства, получение и применение (25 708)
- Пропилен (пропен), получение, свойства, химические реакции (24 405)
- Прямоугольный треугольник, свойства, признаки и формулы (24 365)
Еще технологии
Поиск технологий
Выберите отрасль экономики или все отраслиПоиск по всем отраслямБиотехнологииВодоснабжение и водоотведениеДобыча, обработка и переработка полезных ископаемыхЗдравоохранениеИнформация и связьЛегкая промышленностьЛесная и деревообрабатывающая промышленностьНаноиндустрияНефтехимическая промышленностьОбразование. Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия
Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия
Поиск технологий
Финансирование:Технологии ожидают финансирования
В процессе разработки:Технологии в процессе разработки
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Может быть интересно:
1 задание ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 2 балла.
Ответ:
Показать решение
Полный курс
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк — это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить уведомления.
Включить уведомления
Готовим к ЕГЭ на 85+ баллов и побеждаем лень
Каждый месяц 12 онлайн-занятий в дружелюбной атмосфере + 16 домашних работ с жесткими сроками.
Не готовишься — вылетаешь. Подробнее о курсе
Кальция хлорид инструкция по применению: показания, противопоказания, побочное действие – описание Calcium chloride р-р д/в/в введения 1 г/10 мл: амп.
 10 шт. (8953)
10 шт. (8953)💊 Состав препарата Кальция хлорид ✅ Применение препарата Кальция хлорид Сохраните у себя Поиск аналогов Взаимодействие Описание активных компонентов препарата Кальция хлорид (Calcium chloride) Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата. Дата обновления: 2020. Владелец регистрационного удостоверения:МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко, ОАО (Россия) Код ATX: B05XA07 (Calcium chloride) Активное вещество: кальция хлорид (calcium chloride) Ph.Eur. Европейская Фармакопея Лекарственная форма
Форма выпуска, упаковка и состав препарата Кальция хлорид
10 мл — ампулы (10) — пачки картонные. Клинико-фармакологическая группа: Препарат, восполняющий дефицит кальция в организме Фармако-терапевтическая группа: Кальциево-фосфорного обмена регулятор Фармакологическое действиеКальций — макроэлемент, участвующий в формировании костной ткани, процессе свертывания крови, необходим для поддержания стабильной сердечной деятельности, процессов передачи нервных импульсов. Улучшает сокращение мышц при мышечной дистрофии, миастении, уменьшает проницаемость сосудов, оказывает противоаллергическое действие. При в/в введении кальций вызывает возбуждение симпатической нервной системы и усиление выделения надпочечниками адреналина; оказывает умеренное диуретическое действие. При взаимодействии раствора кальция хлорида с солями магния, щавелевой и фтористой кислотами образуются нерастворимые соединения, что позволяет применять раствор кальция хлорида в качестве антидота. ФармакокинетикаВ крови кальций находится в ионизированном и в связанном состоянии. В плазме около 45% кальция находится в комплексе с белками. Физиологической активностью обладает ионизированный кальций. Депонируется в костной ткани. Около 20% выводится почками, остальное количество (80%) — кишечником. 95% кальция, выводящегося путем гломерулярной фильтрации, подвергается резорбции в восходящем сегменте петли Генле, а также в проксимальных и дистальных почечных канальцах. Показания активных веществ препарата Кальция хлоридАллергические заболевания (крапивница, ангионевротический отек, аллергодерматозы, сывороточная болезнь), гипокальциемия (в т.ч. гипокальциемическая тетания, при гипопаратиреозе), свинцовая колика, гиперкалиемия, передозировка солями магния (в составе комплексной терапии). Открыть список кодов МКБ-10
Режим дозированияСпособ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования. Применяют внутрь, в/в струйно или капельно. Дозу, способ и схему применения, длительность терапии определяют индивидуально, в зависимости от показаний, клинической ситуации и возраста пациента. Дозу для детей устанавливают из расчета на массу тела. Побочное действиеВозможно: ощущение жара сначала в полости рта, а затем по всему телу, привкус мела во рту, периферическая вазодилатация, снижение АД, аритмия (в т. Местные реакции: раздражение по ходу вены; гиперемия кожи, боль, сыпь, кальцификация могут свидетельствовать об экстравазации, которая может приводить к некрозу окружающих тканей. Противопоказания к применениюПовышенная чувствительность к кальция хлориду, гиперкальциемия, тяжелая хроническая почечная недостаточность, фибрилляция желудочков, мочекаменная болезнь, саркоидоз, выраженный атеросклероз, склонность к тромбообразованию, одновременный прием с сердечными гликозидами; беременность; период грудного вскармливания. С осторожностью: хроническая почечная недостаточность легкой и средней степени тяжести, дегидратация, нарушение электролитного баланса (риск гиперкальциемии), заболевания сердца (риск аритмии), заболевания почек, «легочное» сердце, респираторный ацидоз, дыхательная недостаточность (риск токсических реакций вследствие окисления кальция), детский возраст. Применение при беременности и кормлении грудьюПротивопоказан к применению при беременности и в период лактации (грудного вскармливания). При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания. Применение при нарушениях функции почекПротивопоказано применение при тяжелой хронической почечной недостаточности. С осторожностью применять при хронической почечной недостаточности легкой и средней степени тяжести, заболеваниях почек. Применение у детейКальция хлорид следует с осторожностью применять у детей. Особые указанияНе вводить п/к и в/м. При попадании кальция хлорида под кожу или в мышечные ткани развивается сильное раздражение с образованием очагов некроза. При возникновении боли или гиперемии в месте введения следует прекратить введение и исключить экстравазацию средства. Лечение проводят под контролем концентрации кальция в крови. При аллергических заболеваниях рекомендуется совместное применение кальция хлорида и антигистаминных препаратов. Влияние на способность к управлению транспортными средствами и механизмами В период лечения в связи с возможным развитием побочных эффектов необходимо соблюдать осторожность при вождении автотранспорта и занятиях другой деятельностью, требующей высокой концентрации внимания и скорости психомоторных реакций. Лекарственное взаимодействиеПри одновременном применении уменьшает действие блокаторов «медленных» кальциевых каналов; с другими кальций- и магнийсодержащими препаратами повышается риск гиперкальциемии или гипермагниемии соответственно, особенно у пациентов с хронической почечной недостаточностью; с хинидином — возможно замедление внутрижелудочковой проводимости и повышение токсичности хинидина. Снижает эффективность недеполяризующих миорелаксантов. Может увеличивать продолжительность действия тубокурарина хлорида. Фармацевтически несовместим с тетрациклинами, магния сульфатом, лекарственными препаратами, содержащими фосфаты, карбонаты или тартраты. Кальция хлорид несовместим с солями свинца, серебра, одновалентной ртути вследствие образования нерастворимых хлоридов тяжелых металлов и с барбиталом натрия, т.к. при этом образуется малорастворимая кальциевая соль барбитала. Во время лечения сердечными гликозидами парентеральное применение кальция хлорида не рекомендуется в связи с усилением кардиотоксического действия. Сохраните у себя |
Карбонат кальция, фомула, получение, применение, температурные показатели
Характеристика карбонат кальция
Кальция карбонат представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа. Это неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов, различающиеся кристаллической структурой — широко распространённый кальцит, арагонит и ватерит, является главной составной частью известняка, мела и мрамора, одно из самых распространенных на Земле соединений.
Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Формула карбоната кальция
Химическая формула: CaCO3.
Получение карбоната кальция
Кальция карбонат получают взаимодействием известкового молока с углекислотой или хлоридом кальция (СаСl2) с карбонатом натрия (Na2CO3) в водном растворе.
Применение карбоната кальция
Кальция карбонат (углекислый кальций, мел, кальциевая соль угольной кислоты) применяется:
- в лакокрасочной промышленности, в производстве красок и отделочных материалов;
- в химической промышленности при производстве карбида кальция;
- в стекольной промышленности при изготовлении стекла;
- в строительстве при производстве шпатлевок, различных герметиков и др.
 ;
; - в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей;
- в качестве наполнителя для резиновых смесей, бумаги, линолеума;
- в медицине как антацидное, противоязвенное, восполняющее дефицит кальция средство;
- в косметической промышленности при производстве зубного порошка, как наполнитель косметических средств;
- в пишевой промышленности, как пищевая добавка краситель E170.
Таблица 1. Физико-химические показатели карбоната кальция
| Наименование показателя | Норма |
|---|---|
| Содержание хлоридов, %, не более | 0,033 |
| Содержание cульфатов, %, не более | 0,25 |
| Содержание мышьяка (As), %, не более | 0,0001 |
| Содержание бария (Ba), %, не более | 0,0001 |
| Содержание железа (Fe), %, не более | 0,01 |
| Содержание фтора (F), %, не более | 0,005 |
| Содержание ртути (Hg), %, не более | 0,00005 |
| Содержание свинца (Pb), %, не более | 0,0003 |
| Содержание тяжелых металлов, %, не более | 0,002 |
Электрические свойства наполнителей на основе карбоната кальция (2 таблицы):
Таблица 2.
| Диэлектрическая проницаемость (при 17-22°C) при 104 Гц: | |
|---|---|
| кальцит в направлении, перпендикулярном оптической оси | 8,5 |
| кальцит в направлении параллельном оптической оси | 8,0 |
| Диэлектрическая проницаемость (при 17-22°C) при 108 Гц: | |
| доломит, в направлении, перпендикулярном оптической оси | 8,0 |
| доломит, в направлении параллельном оптической оси | 6,8 |
Таблица 3.
| Удельное электрическое сопротивление мрамора при 20°C: | |
|---|---|
| объемное, Ом·см | 109-1011 |
| поверхностное при 50%-ной отн. влажности, Ом | (3-8)·109 |
| поверхностное при 90%-ной отн. влажности, Ом | (1-3)·107 |
| Удельное электрическое сопротивление дисперсии 5г CaCO3 в 100 мл воды при 23 °C, Ом: | |
| кальцит (CaCO3) | 17 000-25 000 |
| доломит (CaCO3·MgCO3) | 3 000-5 000 |
| pH кальцита | 9,0-9,5 |
| pH доломита | 9-10 |
| Удельное объемное электрическое сопротивление ПВХ композиции электроизоляционного назначения при 50°C, Ом·см | >4·1014 |
Таблица 4.
 Физические свойства различных типов карбонатов.
Физические свойства различных типов карбонатов.| Показатели | Кальцит CaCO3 (наиболее устойчивая модификация) | Арагонит CaCO3 (метастабильная модификация, переходит в кальцит) | Доломит CaCO3-MgCO3 (45% масс. MgCO3) | Магнезит MgCO3 |
|---|---|---|---|---|
| Плотность, кг/м3 | 2600 — 2750 | 2920 — 2940 | 2800 — 2900 | 3000 — 3100 |
| Твердость по Мосу | 3,0 | 3,5 — 4,0 | 3,5 — 4,0 | 3,5 — 4,5 |
| Содержание растворимых фракций | 0,99·10-8 (при 15°C)0,87·10-8 (при 25°C) | — | — | 2,6·10-5 (при 12°C) |
| Растворимость при 18°С | ||||
| г/100 г воды | 0,0013 | 0,0019 | 0,032 | 0,0106 |
| г/100 г водного раствора СО2 | 0,13 | 0,19 | 3,2 | 1,06 |
| Температура разложения, °C | 900 | 825, переходит в кальцит при Т>400°C | 730-760 | 350 |
| Природные источники | Известняк, мрамор, известковый шпат, яичная скорлупа, кости (с примесью фосфата кальция), горные породы (в сочетании с доломитом) | Панцири моллюсков, кораллы. Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т<30°C Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т<30°C |
— | — |
28.5: Реакции также могут быть обратимыми
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 14547
В природе преобладают обратимые и необратимые реакции, ответственные за такие реакции, как разложение аммиака.
Введение
Считалось, что все химические реакции необратимы до 1803 года, когда французский химик Клод Луи Бертолле ввел понятие обратимых реакций. Первоначально он заметил, что карбонат натрия и хлорид кальция реагируют с образованием карбоната кальция и хлорида натрия; однако, наблюдая за образованием карбоната натрия по краям соленых озер, он понял, что большое количество солей в испаряющейся воде реагировало с карбонатом кальция с образованием карбоната натрия, что указывает на то, что происходила обратная реакция.
Химические реакции представлены химическими уравнениями. Эти уравнения обычно имеют однонаправленную стрелку (\(\стрелка вправо\)) для обозначения необратимых реакций. Другие химические уравнения могут иметь двунаправленные гарпуны (\(\rightleftharpoons\)), которые представляют обратимые реакции (не путать с двойными стрелками \(\leftrightarrow\), используемыми для обозначения резонансных структур). Чтобы ознакомиться с основами химических реакций, щелкните здесь: Химические реакции
Необратимые реакции
Фундаментальная концепция химии заключается в том, что химические реакции происходят, когда реагенты реагируют друг с другом с образованием продуктов. Эти однонаправленные реакции известны как необратимые реакции, реакции, в которых реагенты превращаются в продукты, а продукты не могут превращаться обратно в реагенты. Эти реакции по существу аналогичны выпечке. Ингредиенты, выступающие в качестве реагентов, смешиваются и выпекаются вместе, чтобы сформировать пирог, который действует как продукт. Этот пирог нельзя превратить обратно в реагенты (яйца, муку и т. д.), точно так же, как продукты необратимой реакции не могут снова превратиться в реагенты.
Этот пирог нельзя превратить обратно в реагенты (яйца, муку и т. д.), точно так же, как продукты необратимой реакции не могут снова превратиться в реагенты.
Примером необратимой реакции является горение. Горение включает сжигание органического соединения, такого как углеводород, и кислорода с образованием углекислого газа и воды. Поскольку вода и углекислый газ стабильны, они не реагируют друг с другом с образованием реагентов. Реакции горения имеют следующую форму:
\[ C_xH_y + O_2 \rightarrow CO_2 + H_2O \]
Обратимые реакции
В обратимых реакциях реагенты и продукты никогда не расходуются полностью; каждый из них постоянно реагирует и производится. Обратимая реакция может иметь следующий обобщенный вид:
\[ A + B \underset{k_{-1}} {\overset{k_1} {\rightleftharpoons}} C + D \]
Эту обратимую реакцию можно разбить на две реакции.
Реакция 1: \[ A + B \xrightarrow{k_1}C+D \]
Реакция 2: \[ C + D \xrightarrow{k_{-1}}A+B \]
Эти две реакции происходящие одновременно , что означает, что реагенты реагируют с образованием продуктов, а продукты реагируют с образованием реагентов. Столкновения реагирующих молекул вызывают химические реакции в замкнутой системе. После образования продуктов связи между этими продуктами разрываются, когда молекулы сталкиваются друг с другом, производя достаточно энергии, необходимой для разрыва связей продукта и молекул реагентов.
Столкновения реагирующих молекул вызывают химические реакции в замкнутой системе. После образования продуктов связи между этими продуктами разрываются, когда молекулы сталкиваются друг с другом, производя достаточно энергии, необходимой для разрыва связей продукта и молекул реагентов.
Ниже приведен пример обобщенной формы обратимой реакции и разбивка обратимой реакции N 2 O 4 ↔ 2NO 2
Реакция 1 и Реакция 2 происходят одновременно, потому что они находятся в закрытая система.
Синий: Азот Красный: Кислород
Реакция 1 Реакция 2
Представьте бальный зал. Пусть реагент А — 10 девочек, а реагент В — 10 мальчиков. Когда каждая девочка и мальчик выходят на танцпол, они объединяются в пары, чтобы стать продуктом. Как только пять девочек и пять мальчиков оказываются на танцполе, одна из пяти пар распадается и уходит в сторонку, снова становясь реагентами. Когда эта пара покидает танцпол, другие мальчик и девочка в кулуарах объединяются, чтобы снова сформировать продукт. Этот процесс продолжается снова и снова, представляя собой обратимую реакцию.
Этот процесс продолжается снова и снова, представляя собой обратимую реакцию.
В отличие от необратимых реакций обратимые реакции приводят к равновесию: в обратимых реакциях реакция протекает в обоих направлениях, тогда как в необратимых реакциях реакция протекает только в одном направлении. Чтобы узнать больше об этом явлении, щелкните здесь: Химическое равновесие
Если реагенты образуются с той же скоростью, что и продукты, то существует динамическое равновесие. Например, если резервуар для воды наполняется водой с той же скоростью, с которой вода покидает резервуар (через гипотетическое отверстие), количество воды, оставшейся в резервуаре, остается постоянным.
Связь с биологией
Белок гемоглобина имеет четыре сайта связывания. Молекулы гемоглобина могут связываться либо с углекислым газом, либо с кислородом. Когда кровь проходит через альвеолы легких, молекулы гемоглобина захватывают молекулы, богатые кислородом, и связываются с кислородом. По мере того, как гемоглобин проходит через остальную часть тела, он высвобождает кислород в капиллярах, чтобы система органов могла использовать кислород. Выделив кислород, он поглощает углекислый газ. Поскольку этот процесс постоянно осуществляется в организме, всегда есть молекулы гемоглобина, которые захватывают или выделяют кислород, и другие молекулы гемоглобина, которые захватывают или выделяют углекислый газ. Таким образом, молекулы гемоглобина, кислород и углекислый газ являются реагентами, а молекулы гемоглобина со связанными с ними кислородом или углекислым газом являются продуктами. В этой закрытой системе некоторые реагенты превращаются в продукты, а некоторые продукты превращаются в реагенты, что делает ее похожей на обратимую реакцию.
Выделив кислород, он поглощает углекислый газ. Поскольку этот процесс постоянно осуществляется в организме, всегда есть молекулы гемоглобина, которые захватывают или выделяют кислород, и другие молекулы гемоглобина, которые захватывают или выделяют углекислый газ. Таким образом, молекулы гемоглобина, кислород и углекислый газ являются реагентами, а молекулы гемоглобина со связанными с ними кислородом или углекислым газом являются продуктами. В этой закрытой системе некоторые реагенты превращаются в продукты, а некоторые продукты превращаются в реагенты, что делает ее похожей на обратимую реакцию.
Авторы и ссылки
- Хизер Йи (UCD), Мандип Сохал (UCD)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- обратимая реакция
Что происходит, когда карбонат натрия реагирует с хлоридом кальция? – WisdomAnswer
Админ Популярные лайфхаки
Содержание
- 1 Что происходит, когда карбонат натрия реагирует с хлоридом кальция?
- 2 При смешивании водных растворов карбоната натрия и хлорида кальция получаются продукты в сбалансированном чистом ионном уравнении?
- 3 Какой осадок образуется при смешивании растворов карбоната натрия и нитрата кальция?
- 4 Каково итоговое ионное уравнение реакции водного раствора хлорида кальция с водным раствором карбоната натрия?
- 5 Какой раствор образует осадок при смешивании с водным раствором Na2CO3 Na 2 CO 3 ?
- 6 Происходит ли реакция при соединении водных растворов нитрата кальция и карбоната натрия?
- 7 Что происходит при смешивании хлорида кальция и карбоната натрия?
- 8 Что происходит при добавлении соляной кислоты к карбонату натрия?
- 9 Каково соотношение HCl и карбоната натрия?
Что происходит, когда карбонат натрия реагирует с хлоридом кальция?
Объяснение: Хлорид кальция, CaCl2, растворимое ионное соединение, и карбонат натрия, Na2CO3, также растворимое ионное соединение, будут реагировать с образованием карбоната кальция, CaCO3, нерастворимого твердого вещества, которое осаждается из раствора, и хлорида натрия, другого растворимого вещества. ионное соединение.
ионное соединение.
При смешивании водных растворов карбоната натрия и хлорида кальция продукты в сбалансированном чистом ионном уравнении равны?
Пояснение: Продуктом этой реакции является осадок, карбонат кальция. Nam D. Вы можете производить карбонат кальция (CaCO3) и поваренную соль (NaCl).
Какой осадок образуется при смешивании водных растворов карбоната натрия Na2CO3 и хлорида кальция CaCl2?
Введение. Простая демонстрация того, как осадок свидетельствует о протекании химической реакции, проводится путем смешивания растворов хлорида кальция и карбоната натрия с образованием осадка карбоната кальция (CaCO3).
Какой осадок образуется при смешивании растворов карбоната натрия и нитрата кальция?
Карбонат натрия и нитрат кальция реагируют вместе в реакции двойного замещения с образованием двух новых солей – нитрата натрия и карбоната кальция. Карбонат кальция выпадает в осадок, так как не растворяется.
Каково итоговое ионное уравнение реакции водного раствора хлорида кальция с водным раствором карбоната натрия?
Полное (общее) ионное уравнение, показывающее смесь водного раствора хлорида кальция и водного раствора карбоната натрия: {экв}2Na^{+}(водн. {2-}(водн.)…
{2-}(водн.)…
Какой раствор образует осадок при смешивании с водным раствором Na2CO3?
Раствор, содержащий ионы меди(II), образует осадок при смешивании с водным раствором карбоната натрия.
Какой раствор образует осадок при смешивании с водным раствором Na2CO3 Na 2 CO 3 ?
Какой раствор образует осадок при смешивании с водным раствором Na2CO3? * Ответ CuCl2, однако я не понимаю, как это было получено. Использование CuCl2 приводит к образованию CucO3, нерастворимого в воде. По правилам растворимости все карбонаты, кроме аммония и щелочных металлов, нерастворимы.
Происходит ли реакция при соединении водных растворов нитрата кальция и карбоната натрия?
Реакции осаждения происходят между ионными соединениями в растворе. Например, при смешивании водных растворов нитрата кальция и карбоната натрия карбонат кальция выпадает из раствора в осадок, а другой продукт, нитрат натрия, остается растворенным.
Что образует осадок с карбонатом натрия?
При растворении карбоната натрия в воду высвобождается ион карбоната (CO3 2-), который имеет два отрицательных заряда. Ион кальция в жесткой воде и ион карбоната будут связываться с образованием нерастворимого осадка карбоната кальция (CaCO3), который можно отфильтровать из воды.
Ион кальция в жесткой воде и ион карбоната будут связываться с образованием нерастворимого осадка карбоната кальция (CaCO3), который можно отфильтровать из воды.
Что происходит при смешивании хлорида кальция и карбоната натрия?
Что происходит при смешивании водных растворов хлорида кальция и карбоната натрия? Происходит двойная реакция замещения.
Что происходит при добавлении соляной кислоты к карбонату натрия?
Реакция карбоната натрия и соляной кислоты | Na 2 CO 3 + HCl При добавлении водного раствора соляной кислоты к водному раствору карбоната натрия (Na 2 CO 3 ) в качестве продуктов образуются газообразный диоксид углерода (CO 2 ), хлорид натрия (NaCl) и вода. Также к твердому Na 2 CO 3 можно добавить HCl.
Является ли соединение карбонат натрия твердым при комнатной температуре?
Карбонат натрия представляет собой твердое вещество при комнатной температуре. Но это растворимое неорганическое соединение в воде и образует слабый основной раствор. Даст ли карбонат натрия + соляная кислота кислый газ?
Даст ли карбонат натрия + соляная кислота кислый газ?
Каково соотношение HCl и карбоната натрия?
Согласно стехиометрии реакции, HCl и Na 2 CO 3 реагируют друг с другом в мольном соотношении 2:1. Следовательно, весь карбонат натрия будет реагировать с HCl. Количество прореагировавшей HCl = 0,04*2
Хлорид кальция + карбонат натрия/калия в воде?
Опубликовать ответ
Расширенный поиск
- нукетопия
- Опубликовать ответ
- Цитата
№1: Пост by nuketopia »
Итак, если начать с дистиллированной воды и получить хорошую минерализацию воды для эспрессо, используя хлорид кальция, карбонат калия и карбонат натрия (водные растворы) , что в итоге?
Я думаю, что это процесс, используемый в имеющейся в продаже системе очистки воды, специально предназначенной для производства напитков и пищевой промышленности, для получения специфически минерализованной воды из водопроводной воды обратного осмоса для приготовления кофе, эспрессо, пиццы, теста для хлеба и так далее.
Предпосылка (насколько я понимаю) такова:
Хлористый кальций добавляют в воду для создания концентрированного раствора, называемого компонентом «А».
Смесь бикарбоната калия и бикарбоната натрия добавляют в воду для получения концентрированного раствора, называемого компонентом «В». При добавлении бикарбонатов к воде выделяется некоторое количество СО2, которое образует водный раствор карбоната натрия и карбоната калия.
Следующим шагом является добавление небольшого количества «компонента А» в большой объем дистиллированной воды и тщательное перемешивание.
Затем к разбавленному раствору компонента А добавляют «компонент В». Хлорид кальция реагирует с водным раствором карбоната натрия и карбоната калия.
Реакции:
CaCl2 + K2CO3 —> CaCO3 + 2KCl
CaCl2 + Na2CO3 —> CaCO3 + 2NaCl
Полученный карбонат кальция останется в растворе из-за большого объема воды.
Поскольку я не был на уроках химии уже 30 лет, у меня есть вопросы:
Какая карбонатная жесткость и сколько хлоридов образуется в очищенной воде после этой реакции?
На литр дистиллированной воды, сколько концентрата каждого реагента необходимо, чтобы получить что-то в желаемом диапазоне воды эспрессо?
верхний
- хоумбурреро
- Команда HB
- Опубликовать ответ
- Цитата
№2: Пост by homeburrero »
nuketopia написал: Поскольку я не был на уроке химии уже 30 лет, мои вопросы:
Сколько карбонатной жесткости и сколько карбонатной жесткости сколько хлоридов попадает в очищенную воду после этой реакции?
На литр дистиллированной воды, сколько концентрата каждого реагента необходимо, чтобы получить что-то в желаемом диапазоне воды эспрессо?
Мой последний урок химии был более 30 лет назад, но, к счастью, химия очень проста. В основном это просто жонглирование некоторыми очень утомительными преобразованиями.
В основном это просто жонглирование некоторыми очень утомительными преобразованиями.
Предположим, что вам требуется целевое значение кальциевой жесткости SCAA, равное 68 мг/л. Поскольку молярная масса CaCO3 обычно составляет 100 г/моль, это будет равно 0,68 ммоль/л Ca, для чего потребуется добавить 75,5 мг безводного 1 CaCl2 на каждый литр вашего дистиллята. (молярная масса CaCl2 ~ 111 г/моль.)
У вас есть два хлора на каждый кальций, так что это будет 1,36 ммоль/л иона хлора — , поэтому ваша концентрация ионов хлора будет 48,3 мг/л (молярная масса хлора 35,5 г/моль.)
Для карбонатной жесткости предположим, что вы добавляете KHCO3 и NaHCO3, чтобы достичь целевой щелочности SCAA 40 мг/л (как CaCO3). Для этого потребуется 0,40 ммоль/л CO3 — , что эквивалентно 0,80 ммоль/л. л HCO3 — ion 2 , что можно получить добавлением 0,40 ммоль/л KHCO3 плюс 0,40 ммоль/л NaHCO3, что составит 24,4 мг KHC03 (молярная масса KHCO3 61,0 г/моль ) и 33,6 мг NaHCO3 (молярная масса NaHCO3 составляет 84 г/моль) добавляют на каждый литр вашего дистиллята.
[1] Для дигидрата (CaCl2 * 2h30) молярная масса составляет около 147 г/моль, поэтому вам потребуется 100 мг/л. Я почти уверен, что маринованные чипсы — это дигидрат.
[2] Для измерения KH, щелочности и химических эквивалентов один моль CO3 — эквивалентен 2 молям HCO3 — .
Пат
nínádiishʼnahgo gohwééh náshdlį́įh
верхний
При поддержке Artisan+ — комплексная услуга по управлению запасами кофейной зелени
- кено
- Опубликовать ответ
- Цитата
№3: Пост by keno »
Просто наблюдение, что 48 мг/литр кажется большим количеством хлорида, который может вызвать коррозию нержавеющей стали.
верхний
- хоумбурреро
- Команда HB
- Опубликовать ответ
- Цитата
№4: Пост by homeburrero отвечает кено »
Да, и коррозионное воздействие на медь и латунь. Некоторые могут сказать, что вы должны быть в порядке при таком уровне хлоридов, если у вас также есть щелочность 40 мг/л или выше.
Пат
nínádiishʼnahgo gohwééh náshdlį́įh
верхний
- nuketopia (оригинальный постер)
- Опубликовать ответ
- Цитата
№ 5: Пост by nuketopia (оригинальный постер) »
Да, вот о чем я подумал, что общее содержание хлоридов в этом методе немного завышено. Вы получаете довольно большое количество соли в воде, либо соли натрия, либо соли калия.
Спецификация воды La Marzocco требует содержания хлоридов ниже 30 частей на миллион.
Размышляя об этом, я задумался об использовании гидроксида кальция в качестве донора кальция? Гидроксид кальция пищевого качества легко доступен. Дистиллированная вода и вода обратного осмоса быстро становятся кислыми от углекислого газа в воздухе, образуя угольную кислоту в растворе. Реакция гидроксида кальция и угольной кислоты:
h3CO3+CA(OH)2= CaCO3+2h3O
Гидроксид кальция плохо растворим в воде, но его называют «известковой водой» и используют для некоторых пищевых продуктов, таких как кукурузные лепешки и так далее. Пропускание CO2 через него сделает его молочным, а затем прозрачным, так как он превращается в карбонат, а затем в бикарбонат кальция.
Затем можно легко приготовить бикарбонат кальция с газированной водой и карбонатом кальция.
http://www.inkcorrosion.org/images/file … ate_ok.pdf
Тот же принцип, что и в аквариумных «кальциевых реакторах», когда CO2 пропускают через воду и циркулируют над слоем карбоната кальция.
Примерно такой же природный процесс, в результате которого вода приобретает кальциевую жесткость.
Двухкомпонентный раствор хлорида кальция в части А и карбонатов натрия/калия в части В создает желаемую жесткость, но с избытком хлорида. Удобные материалы для инлайн-впрыска в систему водоподготовки, поскольку растворы растворимы в воде и, следовательно, их легко вводить в поток воды из системы обратного осмоса в системе стеллажной машины.
Думаю, простого решения не существует, если только вы не живете в месте, где вода просачивается через идеальное количество известняка в течение идеального времени и температуры и дает идеальную воду.
верхний
- Билл33525
- Опубликовать ответ
- Цитата
№ 6: Пост от Bill33525 »
http://grindscience.com/2015/08/making-…pe-so-far/
верхний
- дилин
- Опубликовать ответ
- Цитата
№ 7: Пост по dilin »
Или вы можете попробовать
https://s3-ap-southeast-2.amazonaws.com … recipe.pdf
для получения воды то есть:
70 ppm NaHCO3 и 30 ppm MgSO4
42 ppm общая щелочность
25 частей на миллион жесткости по карбонату кальция
50 частей на миллион ионов бикарбоната
6 частей на миллион ионов Mg2+
верхний
При поддержке Made by Knock — качество кафе повсюду
- хоумбурреро
- Команда HB
- Опубликовать ответ
- Цитата
#8: Пост homeburrero »
dilin написал: Или вы можете попробовать
https://s3-ap-southeast-2.amazonaws.com … recipe.pdf
, чтобы получить воду, которая:
70 частей на миллион NaHCO3 и 30 частей на миллион MgSO4
42 ppm общей щелочности
25 ppm жесткости в пересчете на карбонат кальция
50 ppm иона бикарбоната
6 ppm иона Mg2+
+1
Здесь есть тема для обсуждения этой воды: 70/30 Water
Pat
nínádiishʼnahgo gohwééh náshdlįįh
верхний
Рекламное объявление
Химические реакции — эксперимент
Химические реакции — Эксперимент Ниже приведены десять возможных реакций. Для каждого прочитайте, как выполнить реакцию, а затем изучите результаты. Запишите все свои наблюдения (ваши наблюдения должны включать описания как реагентов, так и продуктов). Затем ответьте на вопросы, основанные на ваших наблюдениях и информации, предоставленной в фоновом режиме. Если ваш инструктор сказал сделать это, вы должны прочитать о написании ионных уравнений, а затем написать суммарные ионные уравнения только для реакций A, B, D, E, G и H.
Затем ответьте на вопросы, основанные на ваших наблюдениях и информации, предоставленной в фоновом режиме. Если ваш инструктор сказал сделать это, вы должны прочитать о написании ионных уравнений, а затем написать суммарные ионные уравнения только для реакций A, B, D, E, G и H.
При нажатии на «Посмотреть результаты» будут показаны реагенты и продукты реакции. Если вы хотите увидеть увеличенное изображение реагента, нажмите на его название в описании процедуры. Чтобы получить более полное представление о продуктах, нажмите на слово «продукты» в конце описания процедуры. Обратите внимание, что одна и та же картинка используется для представления всех бесцветных растворов.
| А. | цинк + соляная кислота см. результаты Поместите небольшой кусочек цинка в пробирку, содержащую 1–2 мл 1,0 М раствора соляной кислоты. (товары)
2. Классифицировать реакцию. 3. Какой газ образовался? |
Б. | железо + сульфат меди (II) см. результаты Поместите небольшой кусочек железа в пробирку, содержащую 1–2 мл 1,0 М раствора сульфата меди (II). (товары)
2. Классифицировать реакцию. 3. Синий цвет раствора сульфата меди обусловлен присутствием какого иона? 4. Предсказать цвет раствора нитрата меди. |
| С. | газообразный аммиак + газообразный хлористый водород см. результаты В одну пробирку наливают 1-2 мл концентрированного раствора аммиака, во вторую — 1-2 мл концентрированного раствора соляной кислоты. Поднесите устья трубок друг к другу. (товары)
2. Классифицировать реакцию. 3. В чем разница между соляной кислотой и хлористым водородом? 4. Продукт этой реакции – твердое вещество. Почему это похоже на дым? |
| Д. | карбонат натрия + хлорид кальция см. результаты результатыДобавьте 1–2 мл 0,1 М раствора карбоната натрия в пробирку, содержащую 1–2 мл 0,1 М раствора хлорида кальция. (товары)
2. Классифицировать реакцию. 3. Какое соединение образуется в результате этой реакции? |
| Э. | медь + соляная кислота см. результаты Поместите небольшой кусочек меди в пробирку, содержащую 1–2 мл 1,0 М раствора соляной кислоты. (товары)
2. Классифицировать реакцию. |
| Ф. | пентагидрат сульфата меди см. результаты Поместите небольшое количество пентагидрата сульфата меди в тигель и осторожно нагрейте его с помощью горелки Бунзена. Когда реакция завершится, дайте тиглю остыть (продукты), а затем добавьте к продукту каплю воды. (товары)
2. Классифицировать реакцию.  3. Напишите уравнение реакции, происходящей при добавлении к продуктам капли воды. |
| Г. | хлорид калия + карбонат натрия см. результаты Добавьте 1–2 мл 0,1 М раствора хлорида калия в пробирку, содержащую 1–2 мл 0,1 М раствора карбоната натрия. (товары)
2. Классифицировать реакцию. |
| Х. | нитрат свинца (II) + йодид калия см. результаты Добавьте 1–2 мл 0,1 М раствора нитрата свинца (II) в пробирку, содержащую 1–2 мл 0,1 М раствора йодида калия. (товары)
2. Классифицировать реакцию. 3. Какое твердое вещество образуется в этой реакции? |
| И. | металлический магний + кислород см. результаты Поместите небольшое количество металлического магния в тигель и осторожно нагрейте его с помощью горелки Бунзена.
2. Классифицировать реакцию. |
| Дж. | гидрокарбонат калия + соляная кислота см. результаты Добавьте 1-2 мл 0,1 М раствора соляной кислоты в пробирку, содержащую небольшое количество гидрокарбоната калия. (товары)
2. Классифицировать реакцию. 3. Какой газ образуется? |
| К. | карбонат аммония см. результаты Поместите небольшое количество карбоната аммония в пробирку. Прикрепите кусок резиновой трубки к пробирке и осторожно нагрейте пробирку. Образующиеся газы барботируют через насыщенный раствор гидроксида кальция, а затем через индикаторный раствор фенолфталеина. Твердое вещество, образующееся при пропускании продуктов реакции через раствор гидроксида кальция, представляет собой карбонат кальция.
2. Классифицировать реакцию. |
| введение | химические реакции | признаки реакции | эксперимент | дополнительная практика |
Как добавить хлорид кальция в бассейн
Оренда Технологии
Как добавить хлорид кальция в бассейн? Как мы можем убедиться, что обращаемся с ним безопасно и правильно, чтобы избежать непредвиденных последствий? Добавить кальций не так просто, как кажется. .. его нельзя просто выбросить в бассейн. Хлорид кальция не растворяется так же, как сухая кислота, бикарбонат натрия или нехлорный шок; хлористый кальций выделяет много тепла. Однако, как и любой другой сухой химикат, хлорид кальция следует предварительно растворить в ведре перед добавлением в бассейн. Давайте объясним.
.. его нельзя просто выбросить в бассейн. Хлорид кальция не растворяется так же, как сухая кислота, бикарбонат натрия или нехлорный шок; хлористый кальций выделяет много тепла. Однако, как и любой другой сухой химикат, хлорид кальция следует предварительно растворить в ведре перед добавлением в бассейн. Давайте объясним.
Зачем добавлять хлорид кальция?
До недавнего времени кальциевая жесткость и ее значение для химического состава воды недооценивались. Хорошие уровни кальциевой жесткости могут сделать управление химией в бассейне намного проще и экономичнее. Кальций обеспечивает стабильность. Он удивительно постоянен, если оставить его в покое, а в сочетании с хорошим управлением LSI кальциевая жесткость помогает химическому составу воды вести себя более предсказуемо. Мы предлагаем проверять кальций из-под крана, во время первых заправок и примерно раз в месяц после этого.
Связано: LSI Balance & Calcium Management (столп 1)
Независимо от того, где вы живете, зимой вода становится холоднее. В большей части страны бассейны замерзают… и даже в теплых местах, таких как Южная Калифорния, Аризона и Флорида, температура воды может опускаться ниже 50 градусов на несколько недель. Понижение температуры воды серьезно влияет на баланс и делает воду в бассейне более агрессивной. Вода в бассейне с дефицитом кальция становится агрессивной и крадет кальций из любого места, где его можно найти. Если источник недоступен, вода будет разъедать все виды оборудования (например, нагреватели и соляные ячейки) в поисках кальция.
В большей части страны бассейны замерзают… и даже в теплых местах, таких как Южная Калифорния, Аризона и Флорида, температура воды может опускаться ниже 50 градусов на несколько недель. Понижение температуры воды серьезно влияет на баланс и делает воду в бассейне более агрессивной. Вода в бассейне с дефицитом кальция становится агрессивной и крадет кальций из любого места, где его можно найти. Если источник недоступен, вода будет разъедать все виды оборудования (например, нагреватели и соляные ячейки) в поисках кальция.
Мы определили (по нашему мнению), что кальциевая жесткость является наиболее неправильно понимаемым химическим веществом в бассейновом бизнесе. Но правда в том, что химический состав кальция в бассейне очень стабильный; он не колеблется, как pH или щелочность. Это прочная основа для балансировки воды вокруг. Приложение Orenda LSI рассказало нам о важности кальция и о том, почему его стабильность является таким преимуществом в химическом составе воды.
Каков идеальный уровень кальциевой жесткости?
В Оренде мы постоянно слышим этот вопрос. Вот наш ответ всем: идеальный уровень кальциевой жесткости – это тот, который позволяет вам комфортно поддерживать баланс LSI круглый год.
Вот наш ответ всем: идеальный уровень кальциевой жесткости – это тот, который позволяет вам комфортно поддерживать баланс LSI круглый год.
Чем холоднее климат, тем выше должна быть кальциевая жесткость воды. Мы отличаемся от многих учебников по этому вопросу, и мы делаем это на основе нашего собственного изучения LSI и практических данных. Мы рекомендуем как минимум 300 ppm кальциевой жесткости, даже если вы находитесь в жарком климате. Если вы находитесь в климате, где ваш бассейн может замерзнуть, 400 частей на миллион — это для вас самый минимум… хотя еще лучше, если у вас есть 450-500 частей на миллион. На самом деле, многие коммерческие бассейны, в которых используется гипохлорит кальция (cal hypo) хлор, обычно поддерживают уровень кальция выше 700 частей на миллион без проблем с накипью. Накипь является функцией не только кальциевой жесткости, но и карбоната кальция (CaCO 3 ) насыщенность, измеренная на LSI.
Избыток кальция может быть плохим и вызывать образование накипи. Масштаб раздражает, но знаете что? Это не портит бассейн. Масштаб поддается лечению; обратная проблема недостаточного насыщения кальцием (что вызывает коррозию и травление) — нет. Добавьте кальций, чтобы вода насыщалась им, и проблемы с травлением/коррозией можно предотвратить.
Масштаб раздражает, но знаете что? Это не портит бассейн. Масштаб поддается лечению; обратная проблема недостаточного насыщения кальцием (что вызывает коррозию и травление) — нет. Добавьте кальций, чтобы вода насыщалась им, и проблемы с травлением/коррозией можно предотвратить.
Как добавить хлорид кальция в бассейн
Вам понадобится:
- Надежный набор для измерения кальциевой жесткости
- Пластиковое ведро на 5 галлонов
- Защитное оборудование — очки и перчатки
- Что-то, чем можно помешивать, например, деревянная палочка для размешивания краски
- Хлорид кальция — приложение Orenda показывает 77-80% чешуек, но вы также можете использовать гранулы/гранулы.
- Дополнительно: SC-1000 для хелатирования кальция перед заливкой в бассейн
- Сухая мерная чашка или ведро – правильная дозировка. Не срезайте углы.
Сопутствующая процедура: повышение кальциевой жесткости
Шаг 1
Проверьте воду в бассейне и воду для заполнения на кальциевую жесткость. Запись результатов. Приложение Orenda точно скажет вам, сколько хлорида кальция вам нужно. Принесите кальций и вышеперечисленные предметы в бассейн и наденьте защитные очки и перчатки.
Запись результатов. Приложение Orenda точно скажет вам, сколько хлорида кальция вам нужно. Принесите кальций и вышеперечисленные предметы в бассейн и наденьте защитные очки и перчатки.
Этап 2
Опустите ведро в бассейн , пока оно не наполнится водой примерно на 3/4. Медленно вылейте отмеренное количество хлорида кальция в ведро. Если ваша доза больше, чем может выдержать ведро, вам нужно будет повторить эти шаги или использовать несколько ведер. Мы настоятельно рекомендуем вам здраво оценивать, сколько кальция может содержать ведро. Не превышайте 10 фунтов на ведро, так как он будет трудно растворяться и может стать слишком горячим для ведра. Мы видели плавление пластика!
Будьте очень осторожны с жаром. Защитные очки и перчатки важны для предотвращения случайных ожогов. Может помочь поставить ведро в воду, чтобы охладить его.
Этап 3
Перемешивать до полного растворения хлорида кальция . Налив нерастворенного кальция в бассейн может попасть на дно и обжечь поверхность бассейна, оставив след.
Налив нерастворенного кальция в бассейн может попасть на дно и обжечь поверхность бассейна, оставив след.
На этом этапе часто бывает полезно добавить в ведро около унции SC-1000. SC-1000 — это хелатирующий агент, который связывается с кальцием и помогает удерживать его в растворе, а также снижает риск обратного осаждения кальция из раствора в воде. Кроме того, если pH воды в ведре выше 8,0 (что должно быть, если вы делаете это еженедельно, благодаря закону физики Генри), добавьте в ведро также унцию соляной кислоты.
Этап 4
Медленно влейте полностью растворенный хлорид кальция в бассейн. Может быть, сделать примерно половину ведра, затем налить в ведро свежей воды из бассейна, снова перемешать и снова медленно вылить. Это помогает регулировать температуру горячей воды, а также дает вам больше времени, чтобы убедиться, что все растворилось. Добавляйте кальций правильно, и это пойдет вам на пользу.
Чего не делать
Не бросайте хлористый кальций в бассейн. Нужно время, чтобы раствориться. Никогда не выливайте кальций прямо в скиммер или желоб. Это действительно плохая идея, которая может нанести ущерб оборудованию и фильтру вашего бассейна. Кальций является щелочноземельным металлом, и его труднее растворить, чем некоторые другие химические вещества для бассейнов. Если вы добавляете кальций правильно, у вас не должно быть проблем.
Нужно время, чтобы раствориться. Никогда не выливайте кальций прямо в скиммер или желоб. Это действительно плохая идея, которая может нанести ущерб оборудованию и фильтру вашего бассейна. Кальций является щелочноземельным металлом, и его труднее растворить, чем некоторые другие химические вещества для бассейнов. Если вы добавляете кальций правильно, у вас не должно быть проблем.
Чего нельзя делать: никогда не добавляйте в воду нерастворенный кальций! Он опустится на дно и станет очень горячим. Он может обжечь и повредить поверхность вашего бассейна. Всегда предварительно растворяйте кальций в ведре, прежде чем наливать его в воду.
Рекомендуемые методы защиты от обледенения. Руководство по эффективной программе защиты от обледенения, июнь 1996 г.
В этом приложении представлена информация о свойствах пяти химикатов, используемых для обработки против обледенения, и инструкции по приготовлению жидкостей различных концентраций. Пять химических веществ: хлорид кальция, хлорид натрия, хлорид магния, ацетат кальция, магния и ацетат калия. Они перечислены здесь с их эвтектической температурой и концентрацией:
Пять химических веществ: хлорид кальция, хлорид натрия, хлорид магния, ацетат кальция, магния и ацетат калия. Они перечислены здесь с их эвтектической температурой и концентрацией:
| Химическая промышленность | Температура эвтектики °С (°F) | Эвтектическая концентрация % |
|---|---|---|
| хлорид кальция (CaCl 2 ) | -51 (-60) | 29,8 |
| хлорид натрия (NaCl) | -21 (-5,8) | 23,3 |
| хлорид магния (MgCl 2 ) | -33 (-28) | 21,6 |
| ацетат магния кальция (CMA) | -27,5 (-17,5) | 32,5 |
| ацетат калия (KAc) | -60 (-76) | 49 |
Информация о коррозионных свойствах или экологических аспектах химических веществ не предоставляется. Обсуждение этих вопросов можно найти в литературе. Точно так же не приводится данных о затратах на химикаты. Эти данные можно легко получить у дистрибьюторов.
Обсуждение этих вопросов можно найти в литературе. Точно так же не приводится данных о затратах на химикаты. Эти данные можно легко получить у дистрибьюторов.
A.1 ХЛОРИД КАЛЬЦИЯ, CaCl
2A.1.1 Введение
Для производства коммерческого CaCl2 используются два метода: экстракция из природных соляных растворов, добываемых из глубоких скважин, в основном в Мичигане; и с помощью химического процесса, процесса Сольве, в котором хлорид натрия реагирует с карбонатом кальция с образованием карбоната натрия (кальцинированной соды) и хлорида кальция.
Американское общество по испытаниям и материалам (ASTM) подготовило два стандарта для хлорида кальция: D 98 Спецификация для хлорида кальция, и E 449 Стандартный метод анализа хлорида кальция.
A.1.2 Приготовление жидкого CaCl 2
Твердый хлорид кальция легко растворяется в воде при небольшом перемешивании. При растворении выделяется значительное количество тепла. Для получения определенной концентрации жидкого CaCl 2 можно использовать два метода смешивания. Метод 1 используется, если известен объем емкости для смешивания. Используйте метод 2, если объем емкости для смешивания неизвестен. Каждый из этих методов описан ниже. В обоих случаях температура воды должна быть ниже 20°C (68°F).
Для получения определенной концентрации жидкого CaCl 2 можно использовать два метода смешивания. Метод 1 используется, если известен объем емкости для смешивания. Используйте метод 2, если объем емкости для смешивания неизвестен. Каждый из этих методов описан ниже. В обоих случаях температура воды должна быть ниже 20°C (68°F).
A.1.2.1 Метод 1 (известный объем емкости для смешивания)
- Из столбца «объем раствора» таблицы 2 определите вес в кг (или фунтах) твердого хлорида кальция, необходимый для приготовления 1 м 3 (или 1 галлон) раствора нужной концентрации. Это значение, умноженное на объем контейнера в м 3 (или галлонах), дает общий вес требуемого хлорида кальция.
- Заполните контейнер примерно на 2/3 водой, затем постепенно добавляйте требуемое количество хлорида кальция, тщательно перемешивая лопаткой вручную, механической мешалкой или воздушным барботером.
- После того, как хлорид кальция полностью растворится, добавьте в контейнер воду, чтобы довести уровень до рабочего объема, а затем медленно перемешайте раствор до получения однородной смеси.

| %CaCl 2 фактический | Вес CaCl 2 77% хлопьев | Кристаллизация | Вес на единицу | |
|---|---|---|---|---|
| по объему раствора кг/м 3 (фунт/галлон) | на объем воды кг/м 3 (фунт/галлон) | температура °С (°F) | объем раствора кг/м 3 (фунт/галлон) | |
| 10 | 139 (1,16) | 146 (1,22) | -5,4 (22,3) | 1085 (9.06) |
| 15 | 218 (1,82) | 238 (1,99) | -10,3 (13,5) | 1133 (9,46) |
| 20 | 303 (2,53) | 344 (2,87) | -18,0 (-0,4) | 1185 (9,89) |
| 25 | 397 (3. 31) 31) | 471 (3,93) | -29.4 (-21) | 1234 (10.3) |
| 29,8* | 491 (4.1) | 621 (5.18) | -55,0 (-67) | 1288 (10,75) |
| 30 | 498 (4.16) | 627 (5.23) | -46,0 (-50,8) | 1294 (10,8) |
*Примечание: это «эвтектическая» точка, т. е. концентрация, при которой достигается самая низкая температура. (-55°C (-67°F)), при которой раствор может существовать, оставаясь полностью жидким.
A.1.2.2 Метод 2 (Неизвестный объем контейнера для смешивания)
- Налейте в контейнер отмеренный объем воды, не превышающий 2/3 вместимости контейнера.

- Растворите в нем необходимое количество хлорида кальция, указанное в колонке «на объем воды» таблицы 2, на каждый кубический метр (или галлон) использованной воды. Медленно добавляйте хлорид кальция в воду при перемешивании.
- При полном растворении раствор будет иметь желаемую концентрацию.
А.1.2.3. Дополнительные комментарии
Для тех, кто склонен к математике, можно использовать следующую формулу для определения объема воды, необходимого для данного уровня концентрации.
| m 3 воды, необходимой для приготовления раствора требуемой концентрации | = | кг сухого CaCl 2 x %CaCl 2 желаемый % раствор | — кг сухой CaCl 2 | ÷ 1000 кг/м 3 вода |
Пример: для приготовления 20-процентного раствора из 500 кг хлопьев CaCl 2 (обычно это 78-процентная концентрация),
| 500 х 78 20 | — 500 | ÷ 1000 = 1,45 м 3 вода |
(в английских единицах:
| галлон воды, необходимый для приготовления раствора желаемой концентрации | = | фунт сухой CaCl 2 x %CaCl 2 желаемый % раствор | фунта сухого CaCl 2 | ÷ 8,34 фунта/галлон воды |
Пример: для приготовления 20-процентного раствора из 1000 фунтов чешуйчатого CaCl2 (обычно это 78-процентная концентрация),
| 1000 x 78 20 | — 1000 | ÷ 8,34 = 348 галлонов воды |
Предостережение. Хлорид кальция при растворении выделяет тепло. Эта теплота раствора заставляет рассол расширяться и занимать больше места, чем после охлаждения. Вот почему контейнер в методе 2 заполняется не более чем на 2/3 емкости. Например, дополнительный бак вместимостью около 9Требуется 0 л (23 галлона) на каждые
Хлорид кальция при растворении выделяет тепло. Эта теплота раствора заставляет рассол расширяться и занимать больше места, чем после охлаждения. Вот почему контейнер в методе 2 заполняется не более чем на 2/3 емкости. Например, дополнительный бак вместимостью около 9Требуется 0 л (23 галлона) на каждые
4 м 3 (1000 галлонов) 20-процентного раствора. Это немного увеличится до 100 л (26 галлонов) на каждые
4 м 3 (1000 галлонов) 34-процентного раствора.
Всегда добавляйте в воду хлорид кальция. Если вы сначала поместите хлорид кальция в контейнер, а затем добавите воду, химическое вещество может образовать твердую массу, которую трудно полностью растворить.
A.2 НАТРИЯ ХЛОРИД, NaCl
A.2.1 Твердый NaCl
Хлорид натрия использовался в качестве антиобледенителя на дорогах с начала этого века. Она производится тремя способами: каменная соль добывается с помощью обычного оборудования и методов добычи твердых пород; Солнечная соль производится путем выпаривания морской воды и может содержать лишь небольшое количество примесей; и выпаренный или раствор или вакуумная соль , очень чистая форма, полученная путем высушивания под вакуумом раствора, полученного в результате закачки воды в глубокие подземные отложения. Большая часть соли, используемой для дорожного строительства в Соединенных Штатах, представляет собой каменную соль, хотя некоторое количество солнечной соли производится в нескольких западных штатах, а часть импортируется в восточные штаты США. Встречающаяся в природе каменная соль представляет собой минерал галит и обычно содержит от 1 до 4 процентов примесей, в основном гипса, сланца, доломита и кварца.
Большая часть соли, используемой для дорожного строительства в Соединенных Штатах, представляет собой каменную соль, хотя некоторое количество солнечной соли производится в нескольких западных штатах, а часть импортируется в восточные штаты США. Встречающаяся в природе каменная соль представляет собой минерал галит и обычно содержит от 1 до 4 процентов примесей, в основном гипса, сланца, доломита и кварца.
Обозначение ASTM для соли, используемой для борьбы с обледенением на автомагистралях: D 632 Стандартная спецификация для хлорида натрия .
Две градации соли обозначены стандартом ASTM, как показано в Таблице 3. Аналогичные, но немного отличающиеся градации используются британцами. Они вместе со шведской и финской градациями показаны ниже в таблицах 4, 5 и 6 соответственно.
| Размер сита | Весовой % прохождения | |
|---|---|---|
| 1 класс | 2 класс | |
| 19,0 мм (3/4 дюйма) 12,5 мм (1/2 дюйма) 9,5 мм (3/8 дюйма) 4,75 мм (№ 4) 2,36 мм (№ 8) 600 мкм (№ 30) | . … … 100 от 95 до 100 от 20 до 90 от 10 до 60 от 0 до 15 | 100 … … от 20 до 100 от 10 до 60 от 0 до 15 |
Примечание: степень 1 является наиболее часто используемой градацией в США
| Тип и сорт соли | Испытательное сито BS 410 | Процент прохождение тестовое сито | |
|---|---|---|---|
| Каменная соль | Грубый | 10 мм 6,3 мм 2,36 мм 300 мкм | 100 от 75 до 95 от 30 до 70 от 0 до 20 |
| Штраф | 6,3 мм 2,36 мм 300 мкм | 100 от 30 до 80 от 0 до 20 | |
| Вакуумная соль и морская соль | Грубый | 10 мм 1,18 мм 150 мкм | 100 от 0 до 80 от 0 до 10 |
| Штраф | 1,18 мм 150 мкм | 100 от 0 до 30 | |
Таблица 5. Шведская градация соли.
Шведская градация соли.
| Размер сита, мм | Весовой % прохождения |
|---|---|
| 3 2 1 0,5 0,16 | 95-100 65-100 26-50 5-26 0-5 |
Таблица 6. Финская градация соли.
| Размер сита, мм | Весовой % прохождения |
|---|---|
| 5 4 3 2 1 0,5 | 100 90-100 70-100 40-90 15-55 3-25 |
A.2.2 Приготовление жидкого NaCl
Для получения определенной концентрации жидкого NaCl можно использовать два метода смешивания. Метод 1 используется, если известен объем емкости для смешивания и необходимо получить требуемый объем солевого раствора. Используйте метод 2, если объем емкости для смешивания неизвестен. Каждый из этих методов описан ниже.
Метод 1 используется, если известен объем емкости для смешивания и необходимо получить требуемый объем солевого раствора. Используйте метод 2, если объем емкости для смешивания неизвестен. Каждый из этих методов описан ниже.
A.2.2.1 Метод 1 (известный объем емкости для смешивания)
- Из столбца «объем раствора» таблицы 7 определите массу сухой соли в кг (или фунтах), необходимую для приготовить 1 м 3 (или 1 галлон) раствора с желаемой концентрацией. Это значение, умноженное на объем контейнера, дает общий вес требуемой сухой соли.
- Наполните контейнер примерно на 2/3 водой, затем постепенно добавляйте требуемую сухую соль, перемешивая вручную лопаткой, механической мешалкой или воздушным барботером.
- После того, как соль растворится, долейте в контейнер воду, чтобы довести уровень до рабочего объема, а затем медленно перемешайте раствор до получения однородной смеси. Некоторый нерастворимый осадок от примесей будет оставаться на дне резервуара до тех пор, пока он не будет физически удален.

- Наконец, соляной раствор следует проверить с помощью ареометра, чтобы определить процент полученной концентрации. Для противообледенительных работ концентрация солевого раствора должна быть максимально приближена к 23,3%, но не более 25%. Если концентрация превышает 25 процентов, в смесь следует добавить немного воды, чтобы снизить концентрацию до желаемого уровня. Если концентрация составляет менее 23 процентов, в смесь следует добавить немного соли, чтобы поднять концентрацию до желаемого уровня. Для этих испытаний можно использовать таблицу показаний ареометра в зависимости от процентной концентрации соли, приведенную в разделе 3.1.2.2.
| % NaCl факт. | Масса NaCl | Кристаллизация | Вес на единицу | |
|---|---|---|---|---|
| по объему раствора кг/м 3 (фунт/галлон) | на объем воды кг/м 3 (фунт/галлон) | температура °С (°F) | объем раствора кг/м 3 (фунт/галлон) | |
| 10 | 108 (0,9) | 96 (0,8) | -6,7 (20) | 1072 (8,95) |
| 15 | 168 (1,4) | 156 (1,3) | -11,1 (12) | 1112 (9. 28) 28) |
| 20 | 228 (1,9) | 204 (1,7) | -17,8 (0) | 1150 (9,6) |
| 23* | 276 (2,3) | 228 (1,9) | -21,1 (-6) | 1169 (9,76) |
| 25 | 300 (2,5) | 252 (2.1) | -8,9(16) | 1234 (10.3) |
*Примечание. Это приблизительный эвтектический состав (см. объяснение в статье о хлориде кальция выше).
A.2.2.2 Способ 2 (объем емкости для смешивания неизвестен)
- Заполните бак сухой солью и дайте воде медленно стечь через соль под действием силы тяжести на дно бака.

- Слейте рассол со дна бункера в сборный бак под бункером. Перекачайте рассол из накопительного бака в больший накопительный бак. Перемешайте смесь в большом резервуаре для хранения с помощью механической мешалки или воздушного барботера.
- Продолжайте добавлять соль и воду в воронку до тех пор, пока большой накопительный бак не будет почти заполнен.
- Определите процент концентрации солевого раствора с помощью ареометра и таблицы в разделе 3.1.2.2. Метод 2 позволяет получить до 100% насыщенного солевого раствора в зависимости от скорости потока воды через соль. 100-процентный насыщенный солевой раствор соответствует 27-процентному уровню концентрации. Теперь следует добавить воду в резервуар для хранения, чтобы снизить концентрацию смеси до уровня 23–25 процентов.
- Наконец, требуемое количество фунтов соли, используемое в Методе 2, можно примерно рассчитать, умножив общий объем воды на вес хлорида натрия на объем воды, указанный в столбце «на объем воды» в Таблице 7, что соответствует достигнутый процентный уровень концентрации.
 Эта оценка количества использованной соли может быть использована для создания последующих объемов смеси для заполнения резервуара для хранения, когда он будет полностью пуст.
Эта оценка количества использованной соли может быть использована для создания последующих объемов смеси для заполнения резервуара для хранения, когда он будет полностью пуст.
A.2.2.3 Дополнительные комментарии
Приведенный выше метод 2 успешно использовался несколькими государствами для получения соляного раствора для противообледенительных операций. На практике процесс образования рассола работает непрерывно во время шторма. Это связано с тем, что жидкий рассол забирается из резервуара для хранения во время шторма для заполнения резервуаров на разбрасывателях. В этой ситуации важно часто контролировать уровень процентной концентрации смеси в накопительном баке. При необходимости в смесь следует вносить коррективы для достижения желаемого уровня концентрации.
A.3 ХЛОРИД МАГНИЯ, MgCl
2 Основным источником этого химического вещества для борьбы со льдом являются рассолы Большого Соленого озера. Хотя он доступен в твердой (чешуйчатой) форме, он используется в жидкой форме для борьбы со льдом. Температура эвтектики составляет около -33°C (-28°F) при концентрации 21,6%. Его способность плавить лед примерно на 40 процентов выше, чем у CaCl 2 . Доступны запатентованные смеси, содержащие от 20 до 25 процентов MgCl 2 с различными добавками ингибиторов коррозии. Сообщается, что одно запатентованное соединение имеет температуру эвтектики -20°C (-4°F). Эти растворы являются эффективными реагентами для таяния льда при температурах выше -7°C (19°F).
Температура эвтектики составляет около -33°C (-28°F) при концентрации 21,6%. Его способность плавить лед примерно на 40 процентов выше, чем у CaCl 2 . Доступны запатентованные смеси, содержащие от 20 до 25 процентов MgCl 2 с различными добавками ингибиторов коррозии. Сообщается, что одно запатентованное соединение имеет температуру эвтектики -20°C (-4°F). Эти растворы являются эффективными реагентами для таяния льда при температурах выше -7°C (19°F).
A.4 КАЛЬЦИЯ МАГНИЯ АЦЕТАТ, [CaMg
2 (Ch4COO) 2]6A.4.1 Введение
известняк для производства. Уксусная кислота, дорогостоящий компонент соединения, производится из природного газа или нефти, хотя небольшие количества производятся путем биоразложения сельскохозяйственных отходов. Соединение доступно в виде гранул. Хотя и не так растворим в воде, как NaCl и CaCl9.0060 2 , растворы могут быть приготовлены на месте использования для использования в качестве предварительного смачивающего агента или прямого химического применения. Это не очень эффективное средство против обледенения в твердой форме из-за его сродства к воде и легкой массы частиц. Его преимущество в том, что снег делается рыхлым и не уплотняется. CMA представляет собой в первую очередь смесь ацетатов кальция и магния, полученную с соотношением Ca/Mg 3/7, которое было признано оптимальным в предыдущих исследованиях FHWA. Температура эвтектики составляет около -28°C (-18°F) при концентрации 32,5%.
Это не очень эффективное средство против обледенения в твердой форме из-за его сродства к воде и легкой массы частиц. Его преимущество в том, что снег делается рыхлым и не уплотняется. CMA представляет собой в первую очередь смесь ацетатов кальция и магния, полученную с соотношением Ca/Mg 3/7, которое было признано оптимальным в предыдущих исследованиях FHWA. Температура эвтектики составляет около -28°C (-18°F) при концентрации 32,5%.
A.4.2 Приготовление жидкого CMA
Жидкий CMA готовят путем растворения гранулированного CMA в воде. В результате этого процесса образуется мутный раствор, который со временем оседает, образуя прозрачную жидкую СМА сверху и выбрасываемые нерастворимые вещества снизу. Для противообледенительных операций рекомендуется 25-процентная концентрация жидкого CMA. Особенности производства жидкого КМА приведены в разделе 3.1.2.2.
A.5 АЦЕТАТ КАЛИЯ, KC
2 H 3 O 2 Ацетат калия, или KAc, как его обычно называют, получают реакцией уксусной кислоты с карбонатом калия.

 11.08
11.08

 5
5 8
8 ч. брадикардия), тошнота, обморок. При попадании в подкожную клетчатку и в мышцу вызывает сильное раздражение и некроз окружающих тканей. При быстром в/в введении возможны фибрилляция желудочков сердца, сердечно-сосудистая недостаточность, вплоть до остановки сердца.
ч. брадикардия), тошнота, обморок. При попадании в подкожную клетчатку и в мышцу вызывает сильное раздражение и некроз окружающих тканей. При быстром в/в введении возможны фибрилляция желудочков сердца, сердечно-сосудистая недостаточность, вплоть до остановки сердца.
 ;
;
 Будьте осторожны при нагревании, так как горящий магний дает ослепляющий свет. Если магний воспламеняется, на тигель быстро накрывают крышкой, чтобы погасить пламя. (товары)
Будьте осторожны при нагревании, так как горящий магний дает ослепляющий свет. Если магний воспламеняется, на тигель быстро накрывают крышкой, чтобы погасить пламя. (товары) Фенолфталеин — кислотно-щелочной индикатор, имеющий ярко-розовый или пурпурный цвет в щелочном растворе.
Фенолфталеин — кислотно-щелочной индикатор, имеющий ярко-розовый или пурпурный цвет в щелочном растворе.



 Эта оценка количества использованной соли может быть использована для создания последующих объемов смеси для заполнения резервуара для хранения, когда он будет полностью пуст.
Эта оценка количества использованной соли может быть использована для создания последующих объемов смеси для заполнения резервуара для хранения, когда он будет полностью пуст.