Карбонат натрия. Задачи 978 — 980
Задача 978.
Написать уравнения реакций получения из карбоната натрия: а) силиката натрия; б) ацетата натрия; в) нитрата натрия; г) гидросульфата натрия; д) сульфита натрия.
Решение:
Уравнения реакций получения:
а) получение силиката натрия
Na2CO3 +SiO2 = Na2SiO3 + CO2↑;
б) получение ацетата натрия
Na2CO3 + 2СН3СООН = 2СН3СООNa + H2O + CO2↑;
в) получение нитрата натрия
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑;
г) получение гидросульфата натрия
Na2CO3 + 2H2SO4 = 2NaHSO4 + H2O + CO2↑;
д) получение сульфита натрия
Na2CO3 + SO2 = Na2SO3 + CO2↑.
Задача 979.
При разложении КС1О3 получили 3,36 л кислорода (условия нормальные). Какое количество теплоты при этом выделилось?
Решение:
ΔН0(KCl) = -439,5 кДж/моль; ΔН0 (KClO3) = -391,2 кДж/моль
Уравнение реакции:
Находим ΔН0х.р., используя следствие из закона Гесса, получим:
ΔН0х.р. = 2 (KCl) — 2 (KClO3) = 2(-439,5) – 2(-391,2) = -96,6 кДж.
Рассчитаем количество теплоты, выделившееся при реакции из пропорции:
(3 . 22,4) : -96,6 = 3,36 : х; х = 3,36(-96,6)/ (3 . 22,4) = -4,83 кДЖж.
Ответ: -4,83 кДж.
Задача 980.
Какой объем водорода, измеренного при 25 °С и давлении 755 мм рт. ст. (100,7 кПа), выделится при взаимодействии с водой 1 г сплава, состоящего из 30% (масс.
Решение:
Находим массу кальция и калия:
m(Nа) = 1 . 0,7 = 0,7 г;
m(K) = 1 . 0,3 = 0,3 г
Уравнения реакций:
Рассчитаем объёмы водорода, выделившегося при взаимодействии калия и натрия с водой:
V(а) (2 . 39) : 22,4 = 0,3 : х; х = (22,4 . 0,3)/ (2 . 39) = 0,086 л;
V(б) 2 . 23) : 22,4 = 0,7 : х; х = (22,4 . 0,7)/ (2 . 23) = 0,34 л;
V(Н2) = V(a) + V(б) = 0,086 + 0,34 = 0,426 л или 426 мл.
Приведем объём водорода к нормальным условиям, используя объединенный закон Гей-Люссака и Бойля — Мариотта:
где V – объём газа, измеренный при давлении р и температуре Т по Кельвину; V0 – объём, измеренный при нормальных условиях.
Произведём пересчёт объёма водорода, взятого при данных условиях, на объём при нормальных условиях:
Ответ: 388 мл.
Применение реагента и правила использования
Карбонат лития или литий углекислый представляет собой соль, полученную в ходе неорганического соединения, реакции между щелочным металлом литием и угольной кислотой. Сегодня этот реактив пользуется высоким спросом в различных промышленных производствах, в том числе и в медицинской индустрии. В медсфере карбонат лития входит в список самых необходимых препаратов, без которых невозможно проведение медицинских процедур.
Свойства углекислого лития
Физические свойства карбоната лития в его агрегатном состоянии характеризуют вещество, как порошок без цвета или ярко выраженного запаха. Для такого реактива характерно хорошая растворимость в холодной воде, в горячей растворение реагента происходит в разы хуже. Плавление и разложение карбоната лития происходит при высокой температуре, более 1310° C.
При нагревании до температуры плавления, карбонат лития неустойчив, начинает разлагаться.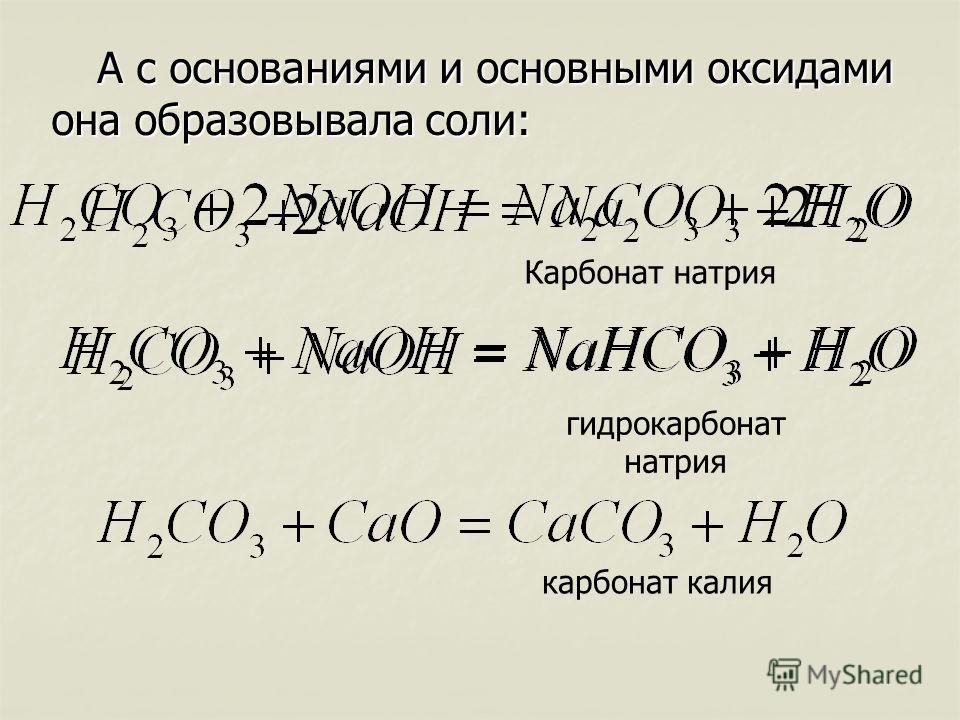 Разложение также происходит и при взаимодействии с разбавленными кислотами. При реакции с более активными металлами, карбонат лития вытесняется из соли.
Разложение также происходит и при взаимодействии с разбавленными кислотами. При реакции с более активными металлами, карбонат лития вытесняется из соли.
Получение карбоната лития происходит из оксидов (реакция происходит при нагревании свыше 500° C) или из щелочей. Также получить вещество можно путем обменных реакций.
Меры безопасности при хранении и транспортировке
Карбонату лития не присвоен какой-либо класс опасности. Несмотря не это, вещество может навредить человеку при неосторожном использовании, хранении или транспортировке. При взаимодействии с химическим реактивом, важно избегать попадания порошка на слизистые оболочки, одежду и открытые участки кожи. Важно использовать средства индивидуальной защиты, чтобы минимизировать повреждения и работать в помещениях с адекватной вентиляционной системой.
Хранение лития карбоната происходит на сухих складах, вдали от кислот. Вещество складируют в производственной таре с герметично закрывающейся крышкой.
Сфера применения карбоната лития
Области использования карбоната лития и для чего применяется химическое вещество в каждой из них не ограничивается одним или двумя направлениями деятельности. Реактив нашел широкие применение практически во всех областях, среди которых:
- Промышленное производство батарей и комплексов, нацеленных на хранение энергии. Благодаря новым технологическим процессам в обработке продукта, карбонат лития используется в получении литиевых батарей в аэрокосмической индустрии.
- Фармацевтическая промышленность, в которой реагент включен в список самых необходимых веществ. Применение карбоната лития в медицине в основном локализовано в сфере лечения психических нарушений. Показаниями к применению карбоната лития выступают биополярное расстройство, депрессии и другие нарушения.
- Производство смазочных растворов и материалов, которые используются для увеличения производительности и срока эксплуатации оборудования, механизмов, инструментов.

- Изготовление веществ для фильтрации и очищения воздуха.
- Получение плотного и легко обрабатываемого стекла.
- Керамическая промышленность, где карбонат лития используется на каждом этапе обжига получаемой продукции. Усиление цвета, плотности и износостойкости – то, для чего он, карбонат лития, нужен в керамической индустрии.
- Аэрокосмическая промышленность, в которой химическое вещество используется для получения обшивочного материала для кораблей, изготавливаемых для выхода в открытый космос.
- Автомобильная индустрия, где химическое вещество является неотъемлемой составляющей производства умных авто.
- Строительная промышленность, в которой карбонат лития добавляют в цементные растворы для быстрого высыхания готового продукта.
-
Уникальные свойства карбоната лития позволяют увеличивать начальные свойства изготавливаемых материалов и способствуют скорейшему восстановлению пациентов, принимающих лекарства с содержанием этого химического вещества.

Карбонат натрия — Sciencemadness Wiki
Карбонат натрия , иногда называемый стиральная сода или кальцинированная сода , представляет собой неорганическое слабое основание с химической формулой Na 2 CO 3 4. Один из немногих водорастворимых карбонатов, карбонат натрия находит широкое применение в качестве дешевого источника ионов карбоната, а также в качестве предшественника других солей натрия. Карбонат натрия встречается в природе в виде минерала Natrite .
Содержание
- 1 Свойства
- 1.1 Химическая промышленность
- 1.2 Физический
- 2 Подготовка и приобретение
- 3 варианта использования
- 4 Обращение
- 4.1 Безопасность
- 4.2 Хранение
- 4.3 Утилизация
- 5 Галерея
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Карбонат натрия реагирует с кислотами с образованием солей натрия и двуокиси углерода.
- Na 2 CO 3 + 2 HCl → 2 NaCl + H 2 O + CO 2
- Na 2 CO 3 + 2 HCOOH → 2 HCOONa + H 2 O + CO 2
При очень высоких температурах разлагается с образованием оксида натрия и углекислого газа.
- Na 2 CO 3 → Na 2 O + CO 2
Однако, в отличие от других карбонатов, разложение щелочных карбонатов затруднено.
Барботирование двуокиси углерода в водном растворе карбоната натрия дает бикарбонат натрия.
- Na 2 CO 3 + H 2 O + CO 2 → 2 NaHCO 3
При производстве диоксида серы используют сульфит натрия. Избыток SO 2 дает бисульфит натрия.
- Na 2 CO 3 + H 2 O + SO 2 → Na 2 SO 3 + H 2 О + СО 2
- Na 2 CO 3 + H 2 O + 2 SO 2 → 2 NaHSO 3 + CO 2
Для удаления диоксида серы можно использовать различные реакции.
Карбонат натрия часто используется при переработке руды, при которой он сплавляется с оксидами металлов при высоких температурах с образованием водорастворимых соединений металла. Примером этого является обжиг оксида хрома (III) с карбонатом натрия в присутствии кислорода с образованием дихромата натрия.
- Na 2 CO 3 + Cr 2 O 3 + O 2 → Na 2 Cr 2 O 7
Physical
Sodium карбонат представляет собой белое гигроскопичное соединение, растворимое в воде, но нерастворимое в органических растворителях. Реагирует с кислотами, оксидами серы и азота, а также галогенами, причем реакция протекает быстрее в присутствии воды. Карбонат натрия кристаллизуется из воды с образованием трех различных гидратов: моногидрата, гептагидрата и декагидрата.
Подготовка и приобретение
Исторически карбонат натрия можно было получить путем выщелачивания золы сожженных морских водорослей или стекловорта, но это приводит к нечистому продукту. Сегодня карбонат натрия можно легко и дешево получить путем термического разложения приобретенного в магазине бикарбоната натрия (пищевой соды), которое начинается при 50 ° C, но более быстро и полностью завершается при температуре выше 200 ° C. Кроме того, его можно приобрести в виде стиральной соды или формул, повышающих pH, в продуктовых или универмагах, которые иногда стоят всего 1 доллар за фунт, или в виде кальцинированной соды, которая используется в качестве протравы для окрашивания текстиля.
Сегодня карбонат натрия можно легко и дешево получить путем термического разложения приобретенного в магазине бикарбоната натрия (пищевой соды), которое начинается при 50 ° C, но более быстро и полностью завершается при температуре выше 200 ° C. Кроме того, его можно приобрести в виде стиральной соды или формул, повышающих pH, в продуктовых или универмагах, которые иногда стоят всего 1 доллар за фунт, или в виде кальцинированной соды, которая используется в качестве протравы для окрашивания текстиля.
Другой удобный способ — добавить гидроксид натрия к карбонату или бикарбонату аммония, затем кипятить раствор до полного высыхания. При этом образуется карбонат натрия, а в качестве побочного продукта образуется аммиак. Этот маршрут привлекателен, если у вас есть старый или загрязненный гидроксид натрия, который необходимо утилизировать.
Наконец, если оставить раствор гидроксида натрия на открытом воздухе, медленно образуется карбонат натрия. Убедитесь, что делаете это в зоне с чистым воздухом, так как загрязненный воздух также содержит оксиды серы и азота, которые загрязнят ваш карбонат натрия сульфатом натрия и нитратом натрия. Другая проблема заключается в том, что образовавшийся карбонат натрия будет «расти» по бокам вашего контейнера и может даже полностью покрыть его, если вы оставите его достаточно надолго. Обязательно периодически проверяйте выделение карбоната натрия.
Другая проблема заключается в том, что образовавшийся карбонат натрия будет «расти» по бокам вашего контейнера и может даже полностью покрыть его, если вы оставите его достаточно надолго. Обязательно периодически проверяйте выделение карбоната натрия.
Применение
В качестве основного соединения натрия добавление большинства неорганических и некоторых органических кислот дает натриевую соль этой кислоты, и благодаря почти универсальной растворимости соединений натрия эти соли могут быть использованы для получения других солей металлов тот же анион (например, получение менее известного аспирината меди с использованием аспирината натрия и растворимой соли меди). Обратите внимание, что нейтрализация карбоната кислотой приводит к выделению большого количества углекислого газа и образованию большого количества пузырьков. По этой причине для титрования чаще всего используют гидроксид натрия.
Поскольку многие нерастворимые карбонаты переходных металлов используются в качестве предшественников солей этих металлов, карбонат натрия является бесценным реагентом при образовании большого количества соединений, сначала путем осаждения нерастворимого карбоната в реакции двойного замещения.
Барботирование углекислого газа через раствор карбоната натрия дает бикарбонат натрия.
Обращение
Безопасность
Карбонат натрия нетоксичен, хотя из-за своих влагопоглотительных свойств он может вызывать раздражение кожи.
Хранение
Карбонат натрия следует хранить в закрытых бутылках, вдали от влаги и кислотных паров.
Утилизация
Карбонат натрия можно безопасно выливать в канализацию или выбрасывать в мусор. Не выбрасывайте его в землю, так как избыток натрия вреден для растений.
Галерея
Ссылки
Соответствующие темы Sciencemadness
- карбонат натрия — википедия — что?
- Реакция карбоната натрия и алюминия
- получение карбоната натрия
- карбонат натрия: где его купить?
- Карбонат натрия
- Карбонат натрия?
- Дегидратация карбоната натрия Уравнение
- для получения карбоната натрия из ацетона и гидроксида натрия
- Электролиз карбоната натрия с медными электродами
Отравление карбонатом натрия: Медицинская энциклопедия MedlinePlus
URL этой страницы: //medlineplus. gov/ency/article/002486.htm
gov/ency/article/002486.htm
Чтобы использовать функции обмена на этой странице, включите JavaScript.
Карбонат натрия (известный как стиральная сода или кальцинированная сода) представляет собой химическое вещество, содержащееся во многих бытовых и промышленных продуктах. Эта статья посвящена отравлению из-за карбоната натрия.
Эта статья предназначена только для информации. НЕ используйте его для лечения или лечения фактического отравления. Если вы или кто-то, с кем вы находитесь, заразились, позвоните по местному номеру службы экстренной помощи (например, 9).11), или с местным токсикологическим центром можно связаться напрямую, позвонив на национальную бесплатную горячую линию Poison Help (1-800-222-1222) из любой точки США.
Карбонат натрия
Карбонат натрия обнаружен в:
- Автоматические мытья посуды
- Clinitest (тестирование диабета) Таблетки
- Стеклянные продукты
- Pulp Product очистители железа
Примечание. Этот список не является исчерпывающим.
Этот список не является исчерпывающим.
Симптомы от глотания карбоната натрия могут включать в себя:
- Проблемы с дыханием из -за отека в горле
- Корупс
- Diarhea
- Dlooling
- Об раздражение глаз, красное давление и боль
- HOARSENTION
- .
- Сильная боль во рту, горле, груди или животе
- Шок
- Затруднение глотания
- Рвота
Симптомы при попадании на кожу или в глаза могут включать:
- Жжение кожи, выделения и боль
- Жжение в глазах, выделения и боль
- Потеря зрения
Немедленно обратиться за медицинской помощью. ЗАПРЕЩАЕТСЯ вызывать у человека рвоту, если это не рекомендовано токсикологическим центром или медицинским работником.
Если химическое вещество попало на кожу или в глаза, промойте их большим количеством воды в течение не менее 15 минут.
Если химическое вещество было проглочено, немедленно дайте пострадавшему один стакан воды, если только медицинский работник не дал иных указаний. НЕ давайте воду, если у человека есть симптомы (рвота, судороги или снижение уровня бдительности), которые затрудняют глотание.
НЕ давайте воду, если у человека есть симптомы (рвота, судороги или снижение уровня бдительности), которые затрудняют глотание.
Если человек надышался ядом, немедленно вывести его на свежий воздух.
Если доступно, определите следующую информацию:
- Возраст, вес и состояние человека
- Название продукта (состав и сила действия, если известны)
- Время проглатывания
- Проглоченное количество
В местный токсикологический центр можно напрямую позвонить, позвонив по бесплатной национальной горячей линии Poison Help (1-800-222-1222) из любой точки США. Этот национальный номер горячей линии позволит вам поговорить со специалистами по отравлениям. Они дадут вам дальнейшие инструкции.
Это бесплатная и конфиденциальная услуга. Все местные токсикологические центры в США используют этот национальный номер. Вам следует позвонить, если у вас есть какие-либо вопросы об отравлении или профилактике отравления. Это НЕ должно быть чрезвычайной ситуацией. Звонить можно по любому поводу, 24 часа в сутки, 7 дней в неделю.
Звонить можно по любому поводу, 24 часа в сутки, 7 дней в неделю.
Возьмите контейнер с собой в больницу, если это возможно.
Поставщик будет измерять и контролировать основные показатели жизнедеятельности человека, в том числе:
- Насыщение кислородом
- Температура
- Пульс
- Частота дыхания
- Кровяное давление
Симптомы будут лечиться соответствующим образом. Человеку могут быть назначены:
- Анализы крови
- Поддержка дыхательных путей и/или поддержка дыхания, включая кислород через внешнее устройство доставки или эндотрахеальную интубацию (помещение дыхательной трубки через рот или нос в дыхательные пути) с подключением к аппарату искусственной вентиляции легких ( дыхательный аппарат жизнеобеспечения)
- Электрокардиограмма (ЭКГ)
- Эндоскопия — камера используется для осмотра горла с целью выявления ожогов в пищеводе и желудке
- Ларингоскопия или бронхоскопия — устройство (ларингоскоп) или камера (бронхоскоп) используется для осмотра горла с целью выявления ожогов в дыхательных путях
- Промывание глаз и кожи
- Введение жидкостей через вену (в/в)
- Лекарства для снятия симптомов
- Рентген грудной клетки и брюшной полости
Карбонат натрия обычно не очень токсичен в небольших количествах.
