Взаимодействие карбоната натрия с хлоридом кальция. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 4. – Рамблер/класс
Взаимодействие карбоната натрия с хлоридом кальция. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 4. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Проведите следующий опыт.
с хлоридом кальция.
В пробирку налейте 2 мл раствора карбоната натрия.
Затем добавьте несколько капель раствора хлорида кальция. Что наблюдаете? Запишите уравнение химической реакции и укажите её тип по признаку числа и состава исходных веществ и продуктов реакции.
ответы
Выполнение работы:
В пробирку налили 2 мл раствора сульфата натрия, затем добавили
несколько капель хлорида бария. Наблюдаем выделение белого металлокристаллического осадка:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Влияние воздуха на горение свечи. Химия. 8 класс. Габриелян.
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
9. Определите ряд, в котором в обоих словах пропущена одна и та же буква. ЕГЭ-2017 Русский язык Цыбулько И. П. ГДЗ. Вариант 12.
ЕГЭ-2017 Русский язык Цыбулько И. П. ГДЗ. Вариант 12.
9.
Определите ряд, в котором в обоих словах пропущена одна и та же буква. Выпишите
эти слова, вставив пропущенную букву. (Подробнее…)
ГДЗРусский языкЕГЭЦыбулько И.П.
9 класс. Химия. Реакции ионного обмена — Реакция ионного обмена
Комментарии преподавателяРеакции ионного обмена, протекающие между растворами солей
I. Запишем уравнение реакции между растворами карбоната натрия и хлорида кальция.
В результате этого взаимодействия образуется осадок карбоната кальция и хлорид натрия.
Рис. 1. Осадок карбоната кальция
Na2CO3 +CaCl2 = CaCO3 ↓ + 2NaCl — молекулярное уравнение
Рассмотрим сущность данной реакции обмена. Вы знаете, что карбонат натрия в воде диссоциирует на два катиона натрия и карбонат-анион.
Na2CO3 = 2Na+ + CO32-
Хлорид кальция в воде также диссоциирует на катион кальция и хлорид — анионы.
CaCl2 = Ca2+ + 2Cl-
В ходе реакции осуществляется обмен ионами, приводящий к образованию осадка карбоната кальция.
2Na+ + CO32- + Ca2+ + 2Cl- = CaCO3 ↓ + 2Na+ + 2Cl- — полное ионное уравнение.
Ca2+ + CO32- = CaCO3 ↓ – сокращённое ионное уравнение
Химические реакции, протекающие в растворах с участием свободных ионов, называются ионными реакциями.
Запись уравнения реакции с участием ионов называют уравнением в ионной форме (ионное уравнение)
Второй пример образования осадка карбоната кальция
II. Запишем ещё одно уравнение химической реакции, приводящей к образованию осадка карбоната кальция.
При взаимодействии карбоната натрия с нитратом кальция образуется осадок карбоната кальция и нитрат натрия. Запишем уравнение в молекулярной форме:
Na2CO3 +Ca(NO3)2 = CaCO3 ↓ + 2NaNO3 — молекулярное уравнение
Запишем уравнение в ионной форме:
2Na+ + CO32- + Ca2+ + 2NO3- = CaCO3 ↓ + 2Na+ + 2 NO3-– полное ионное уравнение
Ca2+ + CO32- = CaCO3 ↓ – сокращённое ионное уравнение
Обратите внимание: суть обеих реакций взаимодействия карбоната натрия с нитратом кальция и с хлоридом кальциям сводится к тому, что из катиона кальция и карбонат — аниона образуется нерастворимый карбонат кальция.
Теперь мы видим, что для получения карбоната кальция надо взять такие вещества, чтобы в состав одного вещества входили катионы кальция, а в состав другого – карбонат — ионы.
Сущность реакции ионного обмена отражают с помощью сокращённого ионного уравнения.
Образование осадка сульфата бария
Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
Запишем уравнение реакции между сульфатом калия и хлоридом бария в молекулярном виде, в сокращённом ионном виде и в полном ионном виде.
K2SO4 +BaCl2 = BaSO4 ↓ + 2KCl –молекулярное уравнение
При взаимодействии сульфата калия и хлоридом бария образуется осадок сульфата бария и хлорид калия. Это молекулярная форма уравнения.
Ниже записана полная ионная форма.
2K+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓ + 2K+ + 2Cl- – полное ионное уравнение
Если мы зачеркнём слева и справа одинаковые ионы, то получим сокращённое ионное уравнение.
Ba2+ + SO42- = BaSO4 ↓ – сокращённое ионное уравнение
Таким образом, для получения сульфата бария необходимо, чтобы в состав одного вещества входили катионы бария, а в состав другого – сульфат – анионы.
Источники
http://www.youtube.com/watch?v=LaIeGmfgLzI
http://www.youtube.com/watch?t=2&v=-sm3RCNAjG8
http://www.youtube.com/watch?t=2&v=HToh5SytenA
заставка http://www.youtube.com/watch?t=6&v=TdlMOBnKGPw
источник презентации — http://ppt4web.ru/khimija/reakcii-ionnogo-obmena.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
Что происходит, когда вы смешиваете хлорид кальция и карбонат натрия?
Что такое хлорид кальция?
Хлорид кальция является одним из неорганических соединений, обозначающих CaCl2. Он растворим и имеет белый цвет при комнатной температуре. Хлорид кальция имеет другое название, такое как дихлорид кальция, хлорид кальция (II) и E509.
Он растворим и имеет белый цвет при комнатной температуре. Хлорид кальция имеет другое название, такое как дихлорид кальция, хлорид кальция (II) и E509.
Кальций хлористый на вид гигроскопичен, имеет 110,98·моль−1. Он имеет пять уровней плотности: безводный (2,15 г/см3), моногидрат (2,24 г/см3), дигидрат (1,85 г/см3), тетрагидрат (1,83 г/см3) и гексагидрат (1,71 г/см3). г/см3). Хлористый кальций кипит при 1,935°С.
Можно ли смешивать хлорид кальция с другими химическими соединениями?
Ответ на вопрос выше абсолютно да. Хлорид кальция можно смешивать с карбонатом натрия. Он имеет несколько названий, таких как стиральная сода, кальцинированная сода и кристаллическая сода.
Что такое карбонат натрия?
Карбонат натрия – одно из химических соединений, которое обозначает Na2CO3. Цвет белый и растворимый. Раньше карбонат натрия извлекали из пепла растений, произрастающих на натриевых почвах.
Карбонат натрия структурирован по молекулярной массе, плотности и температуре плавления.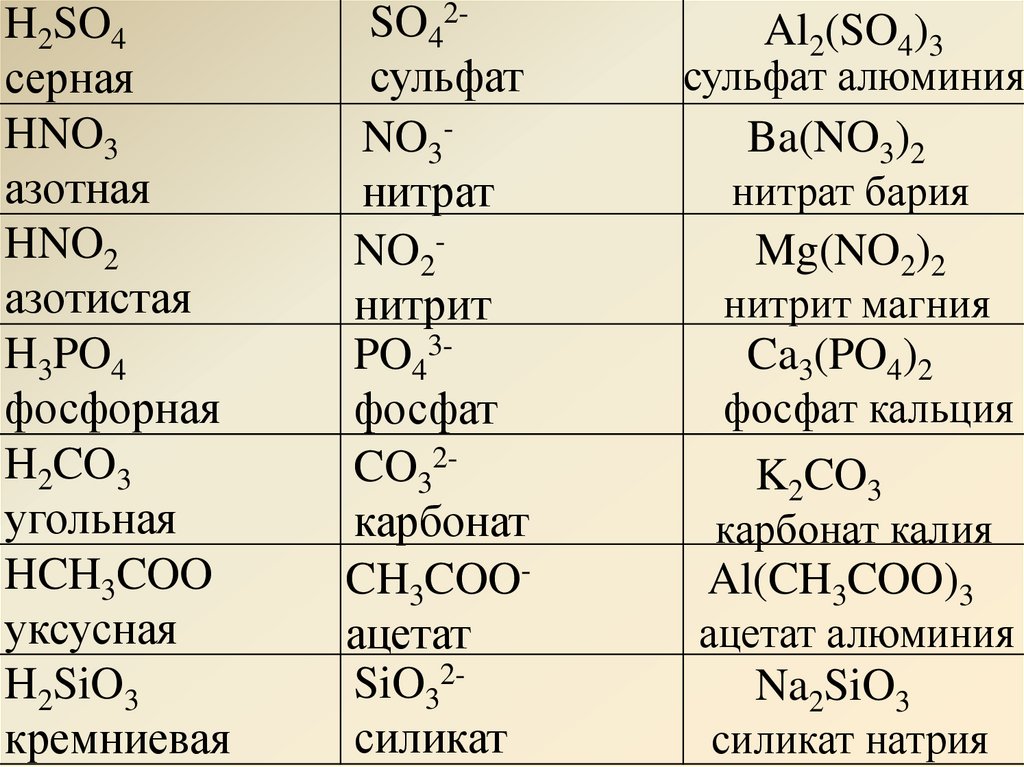
Плотность карбоната натрия делится на пять уровней, таких как безводный (2,54 г/см3), 856 °C, моногидрат (2,25 г/см3), гептагидрат (1,51 г/см3) и декагидрат (1,46 г/см3).
Точки плавления карбоната натрия составляют 851 °C, 100 °C, 33,5 °C и 34 °C.
Вы также можете прочитать о:
- Использование оксида кальция в повседневной жизни
- Использование альгината натрия во многих областях
Что произойдет, если смешать хлорид кальция и карбонат натрия?
Существует формула для смешивания хлорида кальция. Основываясь на этой формуле, вы можете уловить реакцию, например:
CaCl2(водн.) + Na2CO3(водн.) → CaCO3(тв.) + 2NaCl(водн.)
Во-первых, вы должны написать формулу этих соединений. Есть CaCl2 для хлорида кальция и Na2CO3 для карбоната натрия. Вы получите твердый карбонат кальция, и он выпадет в осадок.
Эту реакцию можно назвать реакцией осаждения, даже если эти соединения являются жидкими. Когда они смешаны, их разделяют в процессе фильтрации.
Вы также можете прочитать о:
- Использование хлорида ртути и потенциальное вредное воздействие
- Свойства кальция и его использование в повседневной жизни
Использование продуктов; карбонат кальция и поваренная соль
Продукты этой реакции могут быть использованы для получения многих преимуществ, а именно:
Карбонат кальция
Карбонат кальция означает CaCO3, который содержится в сельскохозяйственной извести. Есть так много преимуществ карбоната кальция, таких как:
- Карбонат кальция можно использовать в качестве антацида.
- Подходит в качестве вспомогательного средства при лечении остеопороза.
- Процесс очистки для горнодобывающих нужд.
- Бумажная промышленность и потребности в покрытиях.

- Карбонат кальция можно использовать для увеличения процесса усвоения питательных веществ растениями в сельскохозяйственных целях.
Поваренная соль
Поваренная соль или хлорид натрия имеет так много преимуществ для различных медицинских целей. Лучшие преимущества поваренной соли улучшают содержание в организме таких веществ, как натрий, кальций и калий.
Что делают хлорид кальция и пищевая сода?
Обновлено 11 апреля 2018 г.
Автор Chris Deziel
Смешивание хлорида кальция и пищевой соды — бикарбоната натрия — в герметичном пластиковом пакете — любимый химический эксперимент средней школы. Он производит газ, поэтому, если вы запечатаете пакет после объединения химикатов, пакет взорвется, как воздушный шар. Еще одна причина, по которой учителям химии в старших классах нравится этот эксперимент, заключается в том, что комбинация выделяет тепло, так что это отличный пример экзотермической реакции. Надевайте защитные очки и резиновые перчатки при смешивании этих двух соединений, потому что одним из побочных продуктов реакции является соляная кислота, которая достаточно агрессивна, чтобы обжечь вашу кожу.
TL;DR (слишком длинный; не читал)
Объедините бикарбонат натрия (пищевую соду), хлорид кальция и воду, и вы получите карбонат кальция (меловой осадок) плюс углекислый газ, хлорид натрия (поваренная соль), соляной кислоты и изрядное количество тепла.
Что такое реагенты?
Практически все знакомы с бикарбонатом натрия (NaHCO 3 ), потому что это пищевая сода, которую вы используете для дезодорации холодильника. Меньше людей знакомы с хлоридом кальция (CaCl 2 ), но они должны быть. Как и хлорид натрия, это соль, и она гигроскопична, что означает, что она поглощает влагу из воздуха. Поместите тарелку с хлоридом кальция в шкаф — это хороший способ защитить одежду от плесени. Хлорид кальция помогает бороться с пылью и работает как пищевая добавка, потому что он может сделать такие продукты, как соленые огурцы, солеными, без фактического добавления хлорида натрия.
Реакция, состоящая из двух частей
Реакция между бикарбонатом натрия и хлоридом кальция должна происходить в растворе, поэтому в реакции всегда участвует вода. Оба реагента легко растворяются в воде, так что это не проблема. Вы можете растворить один в воде, а затем добавить другой, или вы можете держать оба в противоположных углах пластикового пакета и поместить пузырек с водой между ними, чтобы, когда вы встряхиваете пакет, они смешивались с водой и друг с другом.
Оба реагента легко растворяются в воде, так что это не проблема. Вы можете растворить один в воде, а затем добавить другой, или вы можете держать оба в противоположных углах пластикового пакета и поместить пузырек с водой между ними, чтобы, когда вы встряхиваете пакет, они смешивались с водой и друг с другом.
При объединении реагентов происходят две вещи. Во-первых, они объединяются, образуя карбонат кальция — соединение, содержащееся в известняке, меле, мраморе, раковинах улиток и морских существ — вместе с хлоридом натрия и ионами водорода. Ионы водорода делают раствор кислым и соединяются с остатками бикарбоната натрия, образуя углекислый газ, воду и ионы натрия. Они также соединяются с хлором, образуя хлористый водород.
Высвобождение углекислого газа взрывает мешок, и поскольку газ образуется в результате экзотермической реакции, температура раствора повышается.
Химические уравнения
В первой реакции реагенты объединяются с образованием карбоната кальция, хлорида натрия и ионов водорода.

