Взаимодействие раствора карбоната натрия с хлоридом бария
В 4 пробирках без подписей находятся водные растворы хлорида бария, серной кислоты сульфат натрия карбонат натрия.
Как получить карбонат бария, если нам даны вещества (Вода, барий, натрий, хлорид бария и кристаллическая решетка ) ?
Что образуется при реакции соляной кислоты: 1) хлоридом бария,2)сульфатом калия,3)карбонатом натрия???
Дядя Слава шутит: в последней р-ции сульфат не получится.
Реакция взаимодействия растворов хлорида бария и карбоната натрия описывается уравнениемВзаимодействие карбоната и гидрокарбоната натрия с соляной кислотой протекает по реакциям Na2CO3 2HCl 2NaCl CO2 h3O I .
Напишите уравнения реакций в растворе между карбонатом натрия и а) хлоридом бария; ,)хлороводородной кислотой
К раствору содержащему 10,6 гр. карбоната натрия прилили раствор хлорида бария. Какова масса образовавшегося осадка?
Можно ли получить: а) BaCO3 при сливании хлорида бария и карбоната натрия б) ZnCO3 при сливании растворов хлорида
Карбонат бария, как и карбонат кальция, нерастворим в воде, и при сливании этих растворов выпадет в осадок. Карбонат цинка, по идее, тоже.
Карбонат цинка, по идее, тоже.
4 карбоната натрия и гидроксида бария. 2. Нерастворимая соль образуется при взаимодействии.16. Хлорид натрия может быть получен в реакции ионного обмена в растворе между. 1 гидроксидом натрия и хлоридом калия.
Даны вещества:сульфат натрия,соляная кислота,гидроксид магния,хлорид бария.с чем будет реагировать карбонат калия?напиши
Какая проблема? Идёшь в магазин «Химреактивы»,все эти вещества покупаешь и пробуешь! На всю жизнь запомнишь, двоечник!
Карбонат натрия обнаружим по карбонат-иону с помощью раствора соляной кислоты. Хлорид натрия определяем реакцией на ион хлора — реакцей с нитратом серебра. Реакция с хлоридом бария — реакция на сульфат натрия.
С соляной кислотой, все остальные перечисленные вещества-соли различных кислот, и между собой реагировать не будут.
Как определить вещества: Хлорид натрия, Хлорид Бария, сульфат натрия, карбонат натрия, хлорид алюминия, соляная кислота.
Сделать анологично как тут описывается http://www. chem.msu.su/rus/school/sorokin/170-183.html
chem.msu.su/rus/school/sorokin/170-183.html
Уравнения реакций между растворами а серной кислоты и хлорида бария б гидроксида калия и фосфорной кислоты в карбоната натрия иНапишите полные и сокращ нные ионные уравнения реакций между растворами а Сульфата алюминия и гидроксида калия б …
Соляная кислота: Используйте реакцию с нитратом серебра. В пробирку с неизвестной кислотой добавьте 2-3 капли нитрата серебра (AgNO3 оставляет на коже черные пятна, поэтому работать лучше в перчатках) . Появление белого осадка, напоминающего творог, будет явно свидетельствовать о наличии хлорид-иона. Реакция протекает следующим образом: AgNO3 + HCl = AgCl ↓ (творожистый белый осадок) + HNO3. Через некоторое время осадок застынет, образуя налет на стенках пробирки.
Как отличить карбонат калия от гидроксида натрия и хлорида бария. в пробирках
Добавить серную кислоту — выпадет сульфат бария (определишь хлорид бария)
добавить серную кислоту — полетит углекислый газ (определишь карбонат калия)
что осталось — то и гидроксид
Из уравнения реакции взаимодействия раствора хлорида бария BaCl2 с сульфатом натрия Na2SO4 найдем массу осадка сульфата барияРаствор карбоната калия. Гидроксид натрия сульфат натрия. Категории Растворы, Уравнения реакций в растворах.
Гидроксид натрия сульфат натрия. Категории Растворы, Уравнения реакций в растворах.
В 4 пробирках находятся растворы хлорида бария,карбоната натрия,сульфата калия, хлористоводородной кислоты.определить их
1. При смешивании хлорида бария с сульфатом калия образуется белый нерастворимый осадок сульфата бария;
2. Взаимодействие карбоната натрия с кислотой приведёт к выделению углекислого газа;
3. Карбонат натрия не будет реагировать с сульфатом калия;
Так ты разобьёшь на пары, а потом найдёшь одного из каждой пары. Логически, второй из пары — методом исключения.
50 г карбоната бария и натрия растворили в избытке соляной кислоты. Добавление к полученному в результате раствору избытка раствора сульфата натрия приводит к выпадению 46,6 осадка.
Химия!!! Доведите какое из веществ-барий хлорид или натрий карбонат- взаимодействует с нитратной кислотой
Ууууууууууууу палец на репе, который взаимодействует
Мрамор, лучинка, раствор соляной кислоты, хлорид бария, сульфат. натрия, карбонат натрия, хлорид кальция. Ход работыОпыт 4 Взаимодействие карбоната натрия с хлоридом кальция.
натрия, карбонат натрия, хлорид кальция. Ход работыОпыт 4 Взаимодействие карбоната натрия с хлоридом кальция.
К 50 мл раствора серной кислоты с массовой долей h3so4 12% (плотность 1,08 г/мл) добавили раствор карбоната натрия.
ЭТО ДЛЯ РЕШЕНИЯ ХЛОРИДА БАРИЯ
1 моль h3SO4 + BaCl2 = 2HCl + 1 моль BaSO4
в данном случае, проценты берутся по массе.. .
т. е. 12 г кислоты содержится в 100 ГРАММАХ раствора.
тебе надо мл перевести в г
50 мл х 1,08 г/мл = 54 г
12 г в 100 г раствора, а Х г кислоты — в 54 г раствора
Х = 12 х 54 / 100 = 6,48 г
молярная масса серной кислоты 98 г/моль
молярная масса сульфата бария 233 г/моль
пропорция 6,48/98=Х/233
Х = 15,4 г
Реактивы разбавленная серная кислота, концентрированная серная кислота, цинк гранулы , магний стружка , раствор фенолфталеина, раствор гидроксида натрия, раствор карбоната натрия, раствор хлорида бария, оксид меди II , сахарная пудра.
Карбонат натрия, карбонат кальция, сульфат бария, хлорид натрия и сульфат натрия.
 Как определить соли,если не знать их?
Как определить соли,если не знать их?По формуле…
Взаимодействие раствора гидроксида натрия с фосфорной кислотой относится к реакциям.б цинком и хлоридом железа II в карбонатом натрия и хлоридом бария реакция обмена .
В четырех пронумерованных пробирках находятся растворы хлорида бария,карбоната калия,сульфата натрия и хлороводородная к
Проще всего сперва индикатором: лакмус в пробирках КСО3 и НСl станет красным и в них теперь прилить соляной кислоты — в пробирке КСО3 бурно выделится СО2.
В остальные две пробирки прилить Н2SO4 — в пробирке ВаСl2 выпадет осадок
1. Напишите молекулярные и сокращенные ионные уравнения реакций между растворамибария б гидроксида калия и фосфорной кислоты в карбоната натрия и нитрата свинца II 2. При взаимодействии растворов каких веществ образуются осадки а хлорид железа III и…
Напишите уравнения реакций в растворе между карбонатом натрия и а)хлоридом бария; б)хлороводородной кислотой.
Палишься =D (марс)
Операцию обработки осадка раствором карбоната натрия и отделения осадка центрифугированием повторяют еще 2 раза, после чего промывают осадок дистиллированной водой до отрицательной реакции на сульфат-ион с хлоридом бария.
С какими из веществ будет взаимодействовать раствор серной кислоты:…
Натрий, оксиды, гидрооксиды, натрий, карбонат
Осадок хлорида серебра растворяется в аммиаке с образованием комплекса, а осадок хлорида ртути при взаимодействии с растворомОборудование сульфат натрия, хлорид бария, нитрат серебра, карбонат натрия, соляная кислота, фосфат натрия, хлорид натрия…
С хлоридом бария
с натрием
карбонат натрия
В четырех пронумерованных пробирках нахдятся растворы хлорида бария, карбоната натрия,сульфата калия и хлороводородной
Задание 6.В шести пронумерованных пробирках растворы гидроксида натрия, серной кислоты, хлорида бария, карбоната натрия,
По таблице растворимости посмотри нерастворимые или малорастворимые соли с данными веществами (например BaSO4) и так к каждому подобрать
Реакции ионного обмена Опыт 1 К раствору хлорида натрия приливают раствор нитрата свинца. В результате выпадает осадок. NACL Ag NO 3 2 22 AgCL 2 .
Проведите возможные реакции между растворами: серной кислоты, карбоната натрия, хлорида бария.

Подберите по три молекулярных уравнения для реакций, которые выражаются следующими ионно — молекулярными уравнениями:…
[ссылка заблокирована по решению администрации проекта] не за что
Вопросы Учеба и наука Химия К раствору карбоната натрия массой 273 Помогите написать уравнения реакций с помощью которых можно осуществить следующие превращения SiO2-Si-Ca2Si-Sih5-SiO2-Si б …
Как определить в какой из выданной пробирке с раствором находится:хлорид натрия, сульфат натрия,карбонат натрия
1. Во все пробирки добавить раствор хлорида бария (BaCl2 ). В двух пробирках появится осадок; в той, где осадка нет — хлорид натрия.
2. К осадкам прилить раствор соляной кислоты (можно азотной) . В одной из двух осадок растворится с выделением газа — здесь был карбонат натрия.
Реакции карбонат-иона. Реакция с хлоридом бария. К 3 4 каплям раствора Nа2С03 прибавьте несколько капель раствора ВаС12.Взаимодействие расплавленного фенола с натрием, раствором щелочи, вытеснение фенола из фенолята натрия угольной кислотой.
Как можно больше способов получения купрум 2 сульфата , барий карбоната .Как получить из натрий сульфата натрий хлорид?
Чтобы получить натрий хлорид смешай с кислотой с соляной свой сульфат
245. Напишите молекулярные и ионные уравнения реакций между растворами а хлорида бария и силиката калия б сульфита натрия и серной268. Какая из двух солей при равных условиях в большей степени подвергается гидролизу карбонат натрия или сульфит натрия?
«Решение экспериментальных задач по неорганической химии»
Элементы содержания: качественные реакции на растворы хлорида бария, карбоната натрия, сульфата калия, соляной кислоты в пробирках под номерами 1, 2, 3, 4, проведение химических реакций в растворах, реакции ионного обмена.
Требования: уметь составлять уравнения реакций ионного обмена, обращаться с химической посудой и лабораторным оборудованием.
Оборудование: растворы хлорида бария,
карбоната натрия, сульфата калия, соляной
кислоты в пробирках под номерами 1, 2, 3, 4, пробирки
для анализа, таблица “Определение ионов”
(учебник О. С.Габриеляна, М. “Дрофа”, 2009, 8 класс,
с.238-239).
С.Габриеляна, М. “Дрофа”, 2009, 8 класс,
с.238-239).
Уметь: обращаться с химической посудой, использовать приобретённые знания и умения для безопасного обращения с веществами, составлять уравнения реакций с используемыми в практической работе веществами.
Цель: в процессе проверки усвоения качественных реакций на хлорид — ион, карбонат - ион, сульфат — ион и проведения химических реакций в растворах развивать у обучающихся навыки работы с химическими веществами и оборудованием.
Оборудование: наборы для практического занятия на каждом ученическом столе (растворы хлорида бария, карбоната натрия, сульфата калия, соляной кислоты в пробирках под номерами 1, 2, 3, 4, пробирки для анализа).
Ход урока
Даю краткую инструкцию к работе, инструкцию по
правилам техники безопасности, распределяю
варианты (на стадии вызова мотивирую
(побуждаю к работе с новой информацией, пробуждаю
интерес к ней), вызываю “на поверхность”
имеющиеся знания по теме (информационная
функция), идёт бесконфликтный обмен мнениями
(коммуникационная функция).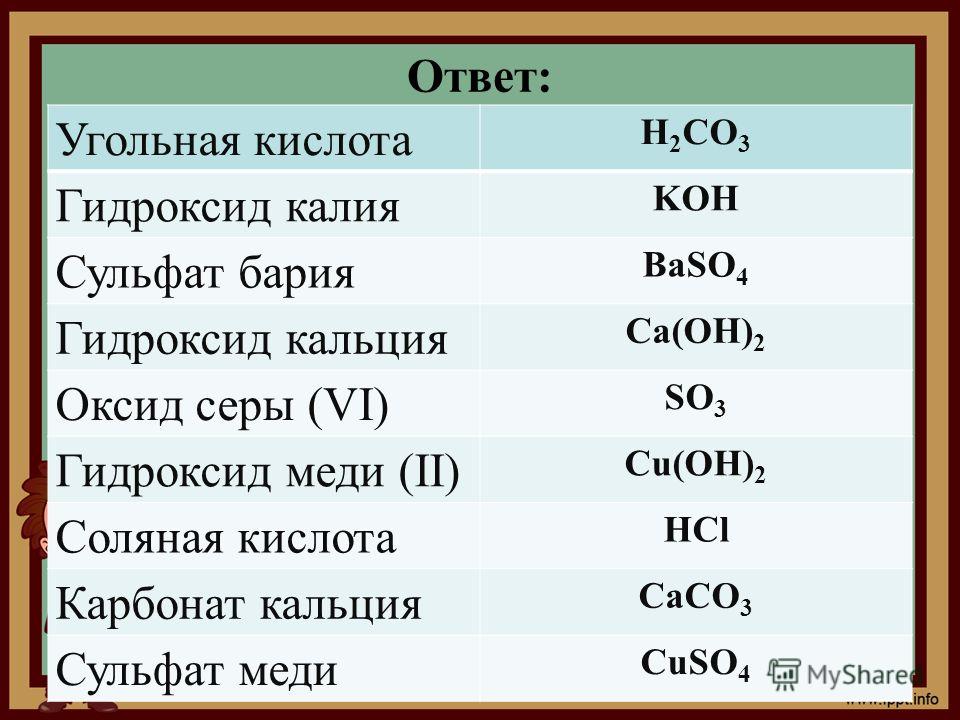
Содержание мысленного эксперимента, сопровождающего практическую часть работы обучающихся:
В четырёх пронумерованных пробирках находятся растворы хлорида бария, карбоната натрия, сульфата калия и хлороводородной кислоты. В распоряжении обучающихся имеется необходимое число пустых пробирок. Не пользуясь никакими другими реактивами, определить содержимое каждой из пробирок.
Вариант №1: №1 — BaCl2, №2 — Na2CO3, №3 — K2SO4, №4 – HCl;
Вариант №2: №1 — Na2CO3, №2 — K2SO4, №3 — HCl, №4 – BaCl2;
Вариант №3: №1- K2SO4, №2 — HCl , №3 – BaCl2, №4 — Na2CO3;
Вариант №4: №1- HCl , №2 – BaCl2, №3 — Na2CO
Задание: распознать растворы хлорида бария,
карбоната натрия, сульфата калия,
хлороводородной (соляной) кислоты в пробирках
под номерами 1, 2, 3, 4 (последовательность в каждом
варианте своя), используя качественные реакции
на хлорид-ион, карбонат-ион, сульфат-ион. Записать
уравнения реакций в молекулярном виде (на
стадии осмысления содержания реализуется
информационная функция (получена новая
информация по теме), систематизационная функция
(классификация полученной информации по
категориям знания), мотивационная функция
(сохранение интереса к изучаемой теме).
Записать
уравнения реакций в молекулярном виде (на
стадии осмысления содержания реализуется
информационная функция (получена новая
информация по теме), систематизационная функция
(классификация полученной информации по
категориям знания), мотивационная функция
(сохранение интереса к изучаемой теме).
Ход мысленного эксперимента
Проводим мысленный эксперимент. Рассмотрим содержимое пробирок. Вещества визуально неразличимы – это бесцветные прозрачные растворы.
Составим таблицу возможных парных взаимодействий веществ (табл. 1), в результате которых мы будем (или не будем) наблюдать определённые признаки реакций.
Таблица №1
| BaCl2 | Na2CO3 | K2SO4 | HCl | |
| BaCl2 | выпадает осадок белого цвета | выпадает осадок белого цвета | без изменений | |
| выпадает осадок белого цвета | без изменений | выделяется газ без цвета и запаха | ||
| K2SO4 | выпадает осадок белого цвета | без изменений | без изменений | |
| HCl | без изменений | выделяется газ без цвета и запаха | без изменений |
Уравнения реакций:
Практическая часть работы
Возьмём пробирку №1. Из остальных пробирок
отольём примерно по 2 мл растворов в три пустые
пробирки и добавим в каждую из них по 5–6 капель
раствора из пробирки №1.
Из остальных пробирок
отольём примерно по 2 мл растворов в три пустые
пробирки и добавим в каждую из них по 5–6 капель
раствора из пробирки №1.
Рассмотрим 4 возможных варианта (см. табл.№1). Для наглядности в каждом случае приведены схемы распознавания веществ. В решении изображать схему не обязательно.
Вариант №1
В двух пробирках выпали белые осадки, в третьей
признаков реакции не наблюдается (первая строка
табл.№1). Это означает, что в пробирке №1
находится хлорид бария. В этом случае в той из
пробирок, где нет признаков химической реакции,
находится соляная кислота. Осадки в двух других
пробирках представляют собой карбонат и сульфат
бария. Прильём в пробирки с осадками по несколько
капель кислоты. Там, где осадок растворяется с
выделение газа, изначально находился раствор
карбоната натрия, там имели место реакции (1) и (3).
В пробирке, где при добавлении соляной кислоты
осадок не растворяется (BaSO
Вариант №2
При добавлении нескольких капель из пробирки №1 в одной из трёх пробирок выпал белый осадок, в другой выделился газ, в третьей нет признаков реакции (вторая строка табл.№1). В этом случае в пробирке №1 находился карбонат натрия. Там, где выпал белый осадок, находился хлорид бария, где выделился газ – соляная кислота, где не было признаков реакции – сульфат калия.
Вариант №3
При добавлении нескольких капель из пробирки
№1 в одной из трёх пробирок выпал белый осадок, в
двух других признаков реакции нет (третья строка
табл.№1). В этом случае в пробирке №1 находится
сульфат калия. Там, где выпал белый осадок,
находился хлорид бария. В две пробирки с
исходными растворами, которые не прореагировали
с сульфатом калия, добавляем хлорид бария.
Выпадение белого осадка (BaCO 3) указывает, что
первоначально в этой пробирке находился
карбонат натрия. В пробирке, где вновь нет
признаков реакции, находился раствор соляной
кислоты.
В пробирке, где вновь нет
признаков реакции, находился раствор соляной
кислоты.
Вариант №4
При добавлении нескольких капель из пробирки
№1 в одной из трёх пробирок выделяется газ, в двух
других нет признаков реакции (четвёртая строка
табл.№1). В этом случае в пробирке №1 находилась
хлороводородная кислота. Там, где выделился газ,
находился карбонат натрия. В две пробирки с
исходными растворами, которые не прореагировали
с кислотой, добавляем карбонат натрия. Выпадение
белого осадка (BaCO
Итоги мысленного эксперимента
Таблица №2
| Пробирка №1 | Пробирка №2 | Пробирка №3 | Пробирка №4 | |
| Вариант №1 | BaCl2 | Na2CO3 | K2SO4 | HCl |
| Вариант №2 | Na2CO3 | K2SO4 | HCl | BaCl2 |
| Вариант №3 | BaCl2 | HCl | BaCl2 | Na2CO3 |
| Вариант №4 | BaCl2 | Na2CO3 | K2SO4 |
Подведение итогов эксперимента (на стадии
рефлексии реализую коммуникационную функцию
(обмен мнениями о полученных результатах),
информационную функция (приобретение нового
знания), мотивационную (побуждаю к дальнейшему
расширению информационного поля), оценочную
(соотносят новую информацию и имеющиеся знания,
вырабатывают собственную позицию, оценивают
процесс).
При смешивании хлорида бария и карбоната натрия образуется белый осадок
При смешивании хлорида бария и карбоната натрия образуется белый осадок карбоната бария. Это связано с тем, что хлорид бария реагирует с карбонатом натрия с образованием карбоната бария. Карбонат бария не растворяется в воде, поэтому выпадает из раствора в осадок.
Когда хлорид бария растворяется в воде, он довольно хорошо реагирует (как и с большинством ионные соли ).
Твердое вещество состоит из белого неорганического вещества. Это минерал витерит, встречающийся в природе. Водорастворимый при 24 мг/л, кислотах (кроме серной) при 25°C и этаноле при 20°C — это лишь некоторые из способов его присутствия.
Карбонат бария чрезвычайно стабилен и нерастворим в воде. Это пример рассуждений. Увеличение размера катионного соединения приводит к значительному увеличению термической стабильности карбонатов.
Это неорганическое соединение с формулой BaCl2, которое можно найти в различных формах. Это наиболее часто используемая водорастворимая соль соединения бария.
Это наиболее часто используемая водорастворимая соль соединения бария.
Почему карбонат натрия не растворяется в воде?
Источник изображения: tutormate.inПоскольку натрий является металлом группы I, он не образует осадка, поскольку растворим.
Кристаллы Na2CO3 склонны к кристаллизации при более высоких температурах, в результате чего кривая менее гладкая, чем у большинства солей. При 0 С, декагидрат карбоната натрия растворяется в 0,245 моль, а бикарбонат натрия растворяется в 0,633 моль. Химик все еще может ответить на такой вопрос, если вопрос содержит опечатку.
Карбонат натрия часто используется для очистки и регулирования pH в бытовых чистящих средствах. Углекислый газ и вода вступают в реакцию, чтобы произвести его. Карбонат натрия также используется в различных пищевых продуктах в качестве консерванта и наполнителя. По сравнению с бикарбонатом натрия карбонат натрия менее растворим в воде. Из-за этого размер иона бикарбоната больше, чем у карбонат-ион . Карбонат натрия более эффективен с точки зрения эффективности упаковки, чем бикарбонат натрия, в результате чего больше углекислого газа упаковывается в кристаллы. Раствор будет чище и более щелочным.
Карбонат натрия более эффективен с точки зрения эффективности упаковки, чем бикарбонат натрия, в результате чего больше углекислого газа упаковывается в кристаллы. Раствор будет чище и более щелочным.
Важность карбоната натрия
Из-за своей растворимости карбонат натрия не имеет давления паров. При 20 градусах Цельсия растворимость в воде составляет 215 г/л. Поскольку карбонаты магния и кальция имеют гораздо более высокую энергию решетки, чем карбонаты натрия и калия, они нерастворимы в воде. Нитрофенол является более слабой кислотой, чем h3CO3, поэтому он не реагирует с гидрокарбонатом натрия.
Что происходит, когда вы смешиваете хлорид бария и карбонат натрия?
Карбонат натрия (Na2CO3) в этом рецепте добавляется к хлориду натрия (BaCl2). В результате осаждения образуется белый осадок.
Во время этой реакции ионы бария и натрия соединяются с образованием карбоната, который затем осаждается осадком сульфата бария . Реакции этих двух элементов необратимы, и мы видим, что два элемента вытесняют друг друга. Эта реакция часто используется для получения химических веществ, которые трудно очистить, поскольку осадок блокирует реакцию.
Реакции этих двух элементов необратимы, и мы видим, что два элемента вытесняют друг друга. Эта реакция часто используется для получения химических веществ, которые трудно очистить, поскольку осадок блокирует реакцию.
Реакция бария и сульфата
При смешивании этих двух веществ образуется осадок, известный как сульфат бария . Материал не может быть растворен в воде, потому что он нерастворим. В результате необратимой реакции вещества больше не смешиваются.
Растворяется ли хлорид бария в воде?
При добавлении в воду хлорид бария (BaCl2) диссоциирует на катионы бария (Ba2+) и хлорид-анионы (Cl-). Поскольку катионы бария больше, чем анионы хлорида, силы притяжения между катионами и анионами слабее, чем силы притяжения между анионами хлорида и молекулами воды. В результате молекулы хлорида бария разрываются, а ионы Ba2+ и Cl- оказываются в окружении молекул воды.
Поскольку сульфат нерастворим, его необходимо осадить. Два атома аргона и ион сульфата составляют молекулу сульфата бария. Ион сульфата удерживается вместе одинарной ковалентной связью, образованной между атомом аргона и ионом сульфата. Соединение атома аргона и сульфат-иона происходит при растворении сульфата бария в воде. Процесс осаждения называется им. Ион в сульфате заменен двумя атомами водорода и атомом аргона. Растворение — это процесс, который используется в этом случае. При осаждении и растворении образуется сульфат бария. Что это говорит нам о сульфаты бария ? Это точка, в которой появляется осадок сульфата бария после растворения и осаждения следующих металлов: хлорида бария, цианида бария, гидроксида бария и оксида бария. Два атома водорода заменяют ионы сульфата, что указывает на то, что сульфат представляет собой гидрат, состоящий из водорода.
Два атома аргона и ион сульфата составляют молекулу сульфата бария. Ион сульфата удерживается вместе одинарной ковалентной связью, образованной между атомом аргона и ионом сульфата. Соединение атома аргона и сульфат-иона происходит при растворении сульфата бария в воде. Процесс осаждения называется им. Ион в сульфате заменен двумя атомами водорода и атомом аргона. Растворение — это процесс, который используется в этом случае. При осаждении и растворении образуется сульфат бария. Что это говорит нам о сульфаты бария ? Это точка, в которой появляется осадок сульфата бария после растворения и осаждения следующих металлов: хлорида бария, цианида бария, гидроксида бария и оксида бария. Два атома водорода заменяют ионы сульфата, что указывает на то, что сульфат представляет собой гидрат, состоящий из водорода.


 или р.) + 2H + (водн.) CO 2 (г) + H 2 O(л)
или р.) + 2H + (водн.) CO 2 (г) + H 2 O(л) Если вы не будете тщательно очищать капельницы, вы рискуете загрязнить то, что находится во флаконах. Это то, что я очень очень обескураживал, когда преподавал!
Если вы не будете тщательно очищать капельницы, вы рискуете загрязнить то, что находится во флаконах. Это то, что я очень очень обескураживал, когда преподавал!  Карбонат бария также нерастворим. Итак, если бы у вас был раствор, скажем, карбоната натрия, он также дал бы белый осадок, если бы вы добавили раствор хлорида бария.
Карбонат бария также нерастворим. Итак, если бы у вас был раствор, скажем, карбоната натрия, он также дал бы белый осадок, если бы вы добавили раствор хлорида бария.
