Карбонат натрия
Государственное образовательное учреждение
Высшего профессионального образования
«Пермская государственная фармацевтическая академия
Федерального агентства по здравоохранению и социальному развитию
Российской Федерации»
кафедра аналитической химии
Курсовая работа:
Карбонат натрия.
Выполнила:
студентка 26 группы
Лекомцева Вероника
Проверила:
Шурова
Лидия Андреевна
Пермь, 2010
Содержание.
Карбонат натрия (описание вещества) 3
Способы получения 4
Качественный анализ 5
Аналитические реакции катиона натрия 5
-
Аналитические реакции карбонат иона 6
Количественный анализ 8
Кислотно-основное титрование в водных растворах 8
Инструментальный анализ 9
Потенциометрический метод 9
Практическое применение карбоната натрия 10
Список использованной литературы 11
2
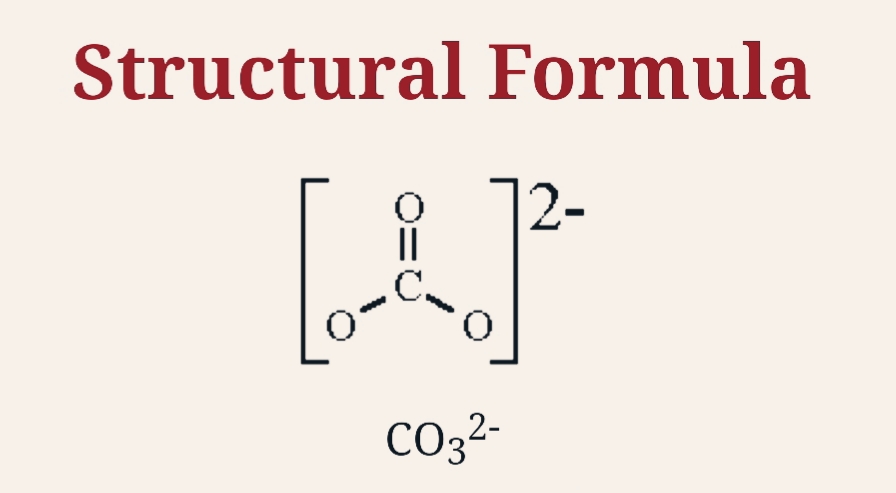
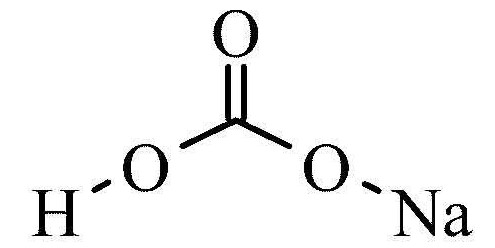
Карбонат натрия.

Формула соединения:
Na2CO3.
Химическое название:
Карбонат натрия. Кальцинированная сода.
СОДА – техническое название карбонатов натрия. Na2CO3 – это нормальный карбонат или кальцинированная (безводная) сода.
Na2CO3 – бесцветные кристаллы, с растворимостью в 100 г. воды, при температуре 20ºС равна – 14,9 г. Водные растворы имеют щелочную реакцию.
Природные источники незначительны (минералы: натрон, термонатрит, трона).
3
Получение:
Карбонат натрия получают главным образом насыщением аммиаком и углекислым газом раствора хлорида натрия и дальнейшим нагреванием до 140º – 160º С , а также из нефелина.
4
Качественный анализ.

Качественный анализ – это установление подлинности неорганических веществ, основанное на обнаружении с помощью аналитических реакций катионов и анионов, образующих молекулу вещества.
3.1. Реакции на определение катиона натрия.
Реакция с ацетатом диксоуран (VI) цинка Zn(UO2)3(CH3COO)3 c образованием жёлтого кристаллического осадка или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте. Для повышения чувствительности реакции, следует нагреть исследуемую смесь на предметном стекле:
NaNO2 + Zn(UO2)3(CH3COO)3 +CH3COOH + 9H2O →
→NaZn(UO2)3(CH3COO)9 x 9H2O↓ + HNO2
Избыток
ионов калия, катионы тяжёлых металлов
(Hg2+,
Sn2+,
Bi3+,
Fe3+ и др. ). Реакция используется как дробная,
после удаления мешающих ионов.
). Реакция используется как дробная,
после удаления мешающих ионов.
Окрашивание бесцветного пламени горелки в жёлтый цвет.
Реакция с пикриновой кислотой, с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящие из одной точки:
Реакция используется как дробная только в отсутствии мешающих ионов (K+, NH4+, Ag +).
5
Реакция с гексагидроксостибатом (V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах:
NaNO2 + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KNO2
Условия проведения реакции:
Достаточная концентрация Na+;
Нейтральная реакция раствора;
Проведение реакции на холоде;
Потирание стеклянной палочкой о стенку пробирки.

Мешающие ионы: NH4+, Mg2+ и др.
В
кислой среде реагент разрушается с
образованием белого аморфного осадка
метасурьмяной кислоты HSbO
K[Sb(OH)6] + HCl → KCl + H3SbO4 + 2H2O
H3SbO4 → HSbO3↓ + H2O.
Реакции на определение карбонат иона.
Количественный анализ.
4.1. Кислотно-основное титрование в водных растворах.
Стандартизация 0,1 М раствора серной кислоты
по точной навеске карбоната натрия (способ отдельных навесок).
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
М (Na2CO3) = 105,99 г/моль
Методика: 0,05-0,07 г (точная навеска) карбоната натрия
количественно переносят в колбу для
титрования, растворяют в 25 см 3 дистиллированной воды, прибавляют 2-3
капли раствора метилового оранжевого
и титруют 0,1 М раствором серной кислоты
до перехода жёлтой окраски в
розовато-оранжевую.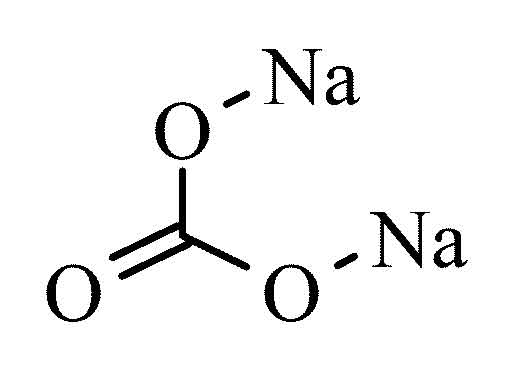
Поправочный коэффициент раствора серной кислоты рассчитывают по формуле:
Инструментальный анализ.
5.1. Потенциометрический метод.
Потенциометрический метод анализа основан на использовании зависимости электродвижущей силы (ЭДС) электрохимической ячейки от концентрации анализируемого вещества в растворе.
Потенциометрическое определение гидроксида и карбоната натрия
при совместном присутствии.
NaOH → Na+ + OH—
Na2CO3 → 2 Na+ + CO32-
CO32- + H2O ↔ HCO3— + OH—
HCO3— + H2O ↔ H2CO3 + OH—
В
присутствии гидроксида натрия подавляется
гидролиз карбоната натрия, поэтому при
титровании смеси этих соединений
кислотой сначала оттитровывается
гидроксид натрия.
При этом гидролиз карбоната натрия на второй ступени и титрование продуктов гидролиза не происходят, так как константы ионизации соответствующих оснований отличаются на четыре порядка:
При этом наблюдается первый скачок титрования (рН 8,3):
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaCl + NaHCO3
Затем титруется гидрокарбонат натрия, наблюдается второй скачок титрования (рН 3,8):
NaHCO3 + HCl → NaCl + СО2 + H2O
М NaOH = 40,00 г/моль
М
Na
Методика: 2-4
см3 анализируемого раствора помещают в
стакан, вместимостью 50 см3 с магнитным стержнем, добавляют
дистиллированную воду до объёма.
Бюретку заполняют 0,1 моль/дм3 раствором хлороводородной кислоты, закрепляют штатив. Стакан с анализируемым раствором устанавливают на столик электромагнитной мешалки, погружают в раствор электроды и приступают к титрованию. Проводят ориентировочное и точное титрования согласно общим указаниям, фиксируя два скачка титрования по резкому изменению потенциала. Результаты измерений заносят в таблицы.
По интегральному или дифференциальным графикам находят:
V1 – объём титранта, соответствующий первому скачку титрования, прореагирующий со всей щёлочью и ½ количества карбоната натрия до NaHCO3;
Vобщ – объём титранта, соответствующий второму скачку титрования, прореагировавший со щёлочью и карбонатом натрия.
По результатам титрования рассчитывают:
V2 = Vобщ — V1 – объём титранта, израсходованный на титрование
½ Na2CO3 до NaHCO3;
V3 = 2 V2 = 2(Vобщ — V1) – объём титранта, израсходованный
на титрование всего Na2CO3;
V4 = (V1 — V2)
– объём титранта, израсходованный на
титрование NaOH.
Затем рассчитывают Q и ω%.
Практическое применение.
Применяют в стекольной, мыловаренной, текстильной, целлюлозно-бумажной промышленности; для очистки нефти и др.
Список литературы.
Лурье Ю.Ю. «Справочник по аналитической химии», Москва, 1979;
Методическое пособие по аналитической химии. «Инструментальные методы анализа», Пермь, 2004;
Методическое пособие по аналитической химии. «Качественный химический анализ», Пермь, 2003;
Методическое пособие по аналитической химии. «Количественный химический анализ», Пермь, 2004;
«Новая иллюстрированная энциклопедия», том № 8, 12, 17. Москва,
ООО «Мир книги», 2001;
Рабинович В.
 А., Хавин З.Я. «Краткий химический
справочник», Ленинград, Химия, 1977;
А., Хавин З.Я. «Краткий химический
справочник», Ленинград, Химия, 1977;Харитонов Ю.Я. «Аналитическая химия», в 2х книгах, Москва, 2001.
Карбонат натрия — свойства, получение и применение
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Сульфид натрия реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата , поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.
Безопасность
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Формула стиральной соды, химическое название и применение
Содержание
Химическое название и формула стиральной соды
Карбонат натрия — это химическое название стиральной соды. Чистый карбонат натрия представляет собой гигроскопичный (то есть он поглощает влагу из воздуха) белый порошок без запаха. Карбонат натрия имеет химическую формулу Na2CO3 и молярную массу 106 г/моль. Это ионное соединение, состоящее из двух ионов натрия и одного карбонатного иона, натриевая соль угольной кислоты. Формула стиральной соды: Na2CO3.10h3O. Стиральная сода представляет собой гидратированную форму карбоната натрия. Стиральная сода хорошо растворяется в воде и образует сильнощелочной водный раствор. В этой статье мы узнаем о стиральной соде и способе приготовления стиральной соды, а также об использовании стиральной соды.
Формула стиральной соды и процедура изготовления
Процесс Solvay используется для синтеза стиральной соды. В методе Сольвея хлорид натрия, аммиак и углекислый газ реагируют в воде. Карбонат кальция используется для получения диоксида углерода, а оставшийся оксид кальция используется для извлечения аммиака из хлорида аммония. Сначала получают бикарбонат натрия, который затем нагревают для получения карбоната натрия. Наконец, карбонат натрия перекристаллизовывают, чтобы получить стиральную соду.
Читать: Трасса Formula
Очистка рассола
Первым шагом является очистка рассола. Первым делом необходимо приготовить рассол, представляющий собой насыщенный раствор хлорида натрия. Выпаривание используется для концентрирования рассола. Осаждение используется для удаления примесей. Исходное чистое окалинообразование последующего технологического оборудования и предотвращение загрязнения конечного продукта представляет собой рассол хлорида натрия. Затем солевой раствор фильтруют и подают через аммиачную колонну для растворения аммиака после удаления загрязняющих веществ. Затем рассол подвергается воздействию газообразного аммиака после его очистки.
Затем рассол подвергается воздействию газообразного аммиака после его очистки.
Читать: LPG Formula
Образование гидрокарбоната натрия
После очистки рассола аммонизированный рассол переносится в колонны карбонизации, где карбонат натрия осаждается путем воздействия на рассол углекислым газом.
NaCl + Nh4 + CO2 + h3O → NaHCO3 + Nh5Cl
Образование карбоната натрия
Гидрокарбонат натрия, плавающий в колонне сатурации, экстрагируется и перерабатывается при температуре 300 градусов Цельсия для получения карбоната натрия. Этот углекислый газ возвращается в колонну карбонизации для повторного использования.
2 NaHCO3 → Na2CO3 + h3O + CO2
Извлечение аммиака
Гидроксид кальция образуется, когда оксид кальция, побочный продукт термического разложения известняка в печи для обжига извести, соединяется с водой. Гидроксид кальция реагирует с хлоридом аммония, отфильтрованным из колонны сатурации.
Na2CO3 + 10h3O → Na2CO3. 10h3O
10h3O
Следовательно, аммиак повторно используется в процессе, в результате чего получается аммонизированный рассол. Метод Solvay производит хлорид кальция в качестве побочного продукта.
Читать: Рабочая формула
Химическое название и формула стиральной соды – карбонат натрия
Химические свойства стиральной соды сильное основание гидроксид натрия. Карбонат натрия в водном растворе является сильным основанием. Он сильно взаимодействует с различными кислотами, разлагаясь с выделением ядовитых паров оксида натрия.
Физические свойства стиральной соды
- Плотность стиральной соды 2,54
- Температура кипения — разлагается
- Температура плавления карбоната натрия 851
- Моногидратные соли (Na2CO3·10h3O), безводные соли (Na2CO3), гептаводные соли (Na2CO3·7h3O) и декаводные соли являются примерами стиральной соды.
- Цвет стиральной соды серый, это серовато-белый порошок.
- Вкус- щелочной вкус
- Стабильность — стабилен при обычной температуре и атмосферных условиях, высыхает в тепле.

Использование соды для стирки
Здесь мы привели некоторые способы использования соды для стирки. Ознакомьтесь с перечисленными ниже способами использования соды для стирки:
- Сода для стирки используется как одно из наиболее важных моющих средств для стирки.
- Стиральная сода используется для умягчения воды.
- Стиральная сода используется в производстве стекла.
- Стиральная сода используется в бумажной, мыловаренной, моющей и текстильной промышленности.
- В бытовой химии сода используется как чистящее средство.
Формула стиральной соды, химическое название и применение – часто задаваемые вопросы
В. Какова химическая формула стиральной соды?
Химическая формула соды для стирки: Na2CO3.
В. Каково химическое название стиральной соды?
Химическое название соды для стирки – карбонат натрия.
В. Какова молярная масса стиральной соды?
Молярная масса стиральной соды составляет 106 г/моль.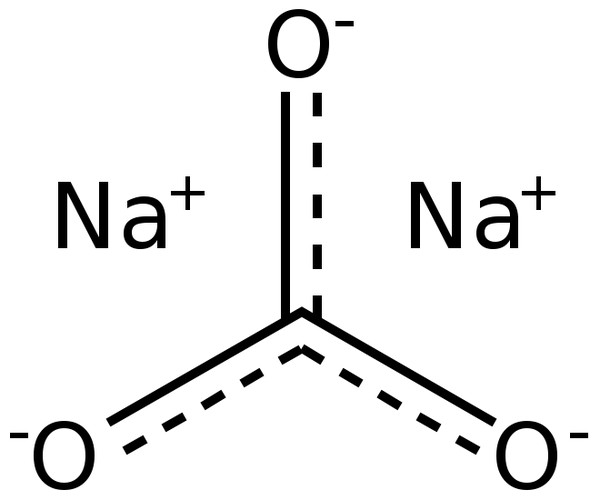
В. Для чего используется стиральная сода?
Стиральная сода используется в качестве чистящего средства, а также в производстве стекла.
Делиться заботой!
15
акции
Получение и свойства карбоната натрия
по
Карбонат натрия также известен как стиральная сода. Его химическая формула: $Na_{2}CO_{3}.10H_{2}O$.
Получение карбоната натрия: карбонат натрия в основном получают в промышленных масштабах с помощью процесса Сольве или аммиачно-содового процесса. Простой процесс приготовления карбоната натрия показан ниже:
$2NaCl+CaCO_{3} \to Na_{2}CO_{3}+ CaCl_{2}$
Показанная выше реакция является обратимой и создает другие проблемы в системе. Следовательно, для получения желаемого продукта требуются другие химические вещества. Поэтому в настоящее время его готовят на основе принципа, описанного ниже:
Принцип процесса : когда газообразный диоксид углерода пропускают через солевой раствор, насыщенный аммиаком, он дает бикарбонат натрия. Осажденный бикарбонат натрия фильтруют, сушат и прокаливают, получая конечный продукт карбонат натрия, как показано ниже:
Осажденный бикарбонат натрия фильтруют, сушат и прокаливают, получая конечный продукт карбонат натрия, как показано ниже:
$2NH_{3}+ H_{2}O+CO_{2} \to (NH_{4})_{2}CO_{3} Карбонат аммония$
$(NH_{4})_{2} CO_{3}+H_{2}O+ CO_{2} \to 2NH_{4}HCO_{3} Бикарбонат аммония$
$NH_{4}HCO_{3}+ NaCl \to NaHCO_{3}+ NH_{4 }Cl гидрокарбонат натрия (ppt.)$
$2NaHCO_{3}\to Na_{2}CO_{3}+ CO_{2}+ H_{2}O Карбонат натрия$
Сырье для процесса:
- Хлорид натрия (NaCl)
- Известняк для диоксида углерода $(CaCO_{3})$
- Газообразный аммиак $(NH_{3})$
Позвольте мне немного рассказать вам об этом процессе производства карбоната натрия. Завод показан на рисунке ниже. Установка включает следующие этапы:
- Абсорбер аммиака: Около 30% рассола закачивается в абсорбер аммиака. Через солевой раствор барботируют смесь аммиака и небольшого количества углекислого газа, чтобы он насыщался аммиаком.

- Колонна карбонизации: Раствор аммонизированного соляного раствора, который мы получили на первом этапе, вводится из верхней части колонны, известной как колонна карбонизации. В эту башню углекислый газ поступает из основания, которое поднимается через небольшие отверстия в башне. Солевой раствор стекает вниз и встречается с восходящими парами углекислого газа, образуя нерастворимый бикарбонат натрия.
- Фильтрация: На этом этапе молочный раствор из башни сатурации фильтруется с помощью роторного вакуумного насоса для отделения бикарбоната натрия.
- Прокаливание бикарбоната натрия: бикарбонат натрия, который мы получили из колонны карбонизации, нагревают в печи для образования карбоната натрия.
- Башня регенерации аммиака: Фильтрация со ступени-3 смешивается с гидроксидом кальция и нагревается паром в колонне регенерации аммиака с гидроксидом кальция. Аммиак вместе с небольшим количеством углекислого газа подается наверх колонны насыщения рассола.




 А., Хавин З.Я. «Краткий химический
справочник», Ленинград, Химия, 1977;
А., Хавин З.Я. «Краткий химический
справочник», Ленинград, Химия, 1977;

