ICSC 1044 — КАРБОНАТ НАТРИЯ
ICSC 1044 — КАРБОНАТ НАТРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| КАРБОНАТ НАТРИЯ | ICSC: 1044 (Апрель 2004) |
| КАЛЬЦИНИРОВАННАЯ СОДА | |
| CAS #: 144-55-8 |
| EINECS #: 205-633-8 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | |||
| Кожа | |||
| Глаза | Покраснение. | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | |||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Смыть остаток большим количеством воды. При необходимости, сначала намочить, чтобы избежать появления пыли. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от кислот. | |
| УПАКОВКА | |
| КАРБОНАТ НАТРИЯ | ICSC: 1044 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: NaHCO3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
СОДА | Энциклопедия Кругосвет
СОДА – карбонат натрия Na2CO3, бесцветное кристаллическое вещество, очень гигроскопичное, плавящееся при 858° С и хорошо растворимое в воде. При охлаждении насыщенных водных растворов соды ниже 32–35° С из них выделяются кристаллы десятиводного карбоната натрия Na2CO3·10H2O – декагидрата карбоната натрия. Если упаривать водный раствор соды, то при температуре выше 113° С будет кристаллизоваться безводный карбонат натрия Na2CO3. Безводный карбонат натрия в технике и быту называют кальцинированной содой, а десятиводный – кристаллической содой. Есть еще гидрокарбонат натрия NaHCO3, более известный в быту и в медицине как питьевая, или пищевая, сода.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов натрона Na2CO3·10H2O, термонатрита Na2CO3·H2O и троны Na2CO3·NaHCO3·2H2O.
Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 и приведены в сочинении римского врача Диоскорида Педания о лекарственных веществах. И ему, и алхимикам всех стран вплоть до 18 в. сода представлялась неким веществом, которое шипело с выделением какого-то газа при действии на него известных к тому времени кислот – уксусной CH3COOH и серной H2SO4.
Теперь известно, что шипение – это результат выделения газообразного диоксида углерода (углекислого газа) CO2 в результате реакций
Na2CO3 + 2 CH3COOH = Na(CH3COO) + CO2 + Н2О,
Na2CO3 + 2 H2SO4 = 2 NaHSO4 + CO2 + Н2О,
где образуются еще ацетат натрия Na(CH3COO) и гидросульфат натрия NaHSO4.
Во времена Диоскорида Педания о составе соды никто не имел понятия, ведь и диоксид углерода открыл голландский химик Ян ван Гельмонт (назвавший его «лесным газом»). только через шестьсот лет
только через шестьсот лет
Искусственную соду научились получать после долгих и мучительных поисков только в 18 в. Но сначала следовало определить состав этого вещества, выделив его в достаточно чистом виде. В 1736 французский химик, врач и ботаник Анри Луи Дюамель де Монсо, пользуясь водой содовых озер и применив метод перекристаллизации, впервые выделил чистую соду. Ему удалось установить, что сода содержит химический элемент «натр». Годом позже Дюамель и немецкий химик Андреас Сигизмунд Маргграф пришли к выводу, что сода Na2CO3 и поташ (карбонат калия K2CO3) – разные вещества, а не одно и то же, как считалось ранее.
Дюамель пытался получить соду, действуя уксусной кислотой CH3COOH на сульфат натрия Na2SO4. С точки зрения современного химика, это совершенно бессмысленно, но Дюамель не знал состава ни того, ни другого из взятых им исходных веществ. Ему было также неизвестно, что сильную кислоту (серную) нельзя вытеснить из солей слабой кислотой (уксусной). Тем не менее, Дюамель сделал интересное наблюдение: при нагревании смеси сульфата натрия с уксусной кислотой начали выделяться пары, которые загорелись от пламени свечи. Это была довольно летучая и горючая уксусная кислота…
Тем не менее, Дюамель сделал интересное наблюдение: при нагревании смеси сульфата натрия с уксусной кислотой начали выделяться пары, которые загорелись от пламени свечи. Это была довольно летучая и горючая уксусная кислота…
История знает немало других, иногда и опасных попыток получить соду. Так, Маргграф с этой целью смешивал нитрат натрия с углем, а потом нагревал смесь. Опыт завершился вспышкой смеси, которая обожгла ему лицо и руки. Маргграф не учел, что достаточно к смеси нитрата натрия (натриевой селитры) и угля добавить серу, как получится один из видов пороха.
Правда, при проведении реакции
4NaNO3 + 5C = 2Na2CO3 + 3CO2 + 2N2
удалось получить немного соды, но какой ценой!
Первый промышленный способ получения соды зародился в России. В 1764 российский химик, швед по происхождению академик Эрик Густав Лаксман сообщил, что соду можно получить спеканием природного сульфата натрия с древесным углем.
При этом протекает реакция:
2Na2SO4 + 3C + 2O2 = 2Na2CO3 + CO2 + 2SO2
Здесь помимо карбоната натрия Na2CO3 образуются два газообразныx вещества – диоксид углерода CO2 и диоксид серы SO2.
Поскольку природный сульфат натрия часто содержит примесь карбоната кальция CaCO3 (известняка), то этой реакции сопутствует вторая:
CaCO3 + C + Na2SO4 = Na2CO3 + 4CO + CaS,
где выделяется газообразный монооксид углерода СО и получается малорастворимый сульфид кальция CaS, который при обработке смеси водой отделяется от карбоната натрия. Последняя стадия процесса – выпаривание раствора, отфильтрованного от осадка, и кристаллизация карбоната натрия.
Лаксман осуществил получение соды по своему способу в 1784 на собственном стекольном заводе в Тальцинске недалеко от Иркутска. К сожалению, дальнейшего развития этот способ не получил и вскоре был забыт. А ведь еще Петр I в 1720, отвечая на вопрос князя Голицына, зачем нужна «зода», писал: «Зодою умягчают шерсть». В 1780 российский академик Гильденштедт отмечал, что «зуду можно почесть важным товаром в российской торговле. Стекольщики и красильщики много ее издерживают, а впредь еще и больше оной расходиться будет, когда больше станут делать белых стекол».
А ведь еще Петр I в 1720, отвечая на вопрос князя Голицына, зачем нужна «зода», писал: «Зодою умягчают шерсть». В 1780 российский академик Гильденштедт отмечал, что «зуду можно почесть важным товаром в российской торговле. Стекольщики и красильщики много ее издерживают, а впредь еще и больше оной расходиться будет, когда больше станут делать белых стекол».
«Зодой» или «зудой» называли в России соду. Несмотря на обилие собственного сырья для производства соды ее ввозили в Россию из-за границы вплоть до 1860.
В 1791 французский врач и химик-технолог Никола Леблан, ничего не зная о способе Лаксмана, получил патент на «Способ превращения глауберовой соли в соду» (глауберова соль – декагидрат сульфата натрия Na2SO4·10H2O). Леблан предложил для получения соды сплавлять смесь сульфата натрия, мела (карбоната кальция) и древесного угля. В описании изобретения он указывал: «Над поверхностью плавящейся массы вспыхивает множество огоньков, похожих на огни свечей. Получение соды завершается, когда эти огоньки исчезают».
Получение соды завершается, когда эти огоньки исчезают».
При сплавлении смеси протекает восстановление сульфата натрия углем:
Na2SO4 + 4C = Na2S + 4CO
Образовавшийся сульфид натрия Na2S взаимодействует с карбонатом кальция CaCO3:
Na2S + CaCO3 = Na2CO3+ CaS
После полного выгорания угля и монооксида углерода CO («огоньки исчезают») расплав охлаждают и обрабатывают водой. В раствор переходит карбонат натрия, а сульфид кальция остается в осадке. Соду можно выделить упариванием раствора.
Свою технологию получения соды Леблан предложил герцогу Филиппу Орлеанскому, личным врачом которого он был. В 1789 герцог подписал с Лебланом соглашение и выделил ему двести тысяч серебряных ливров на строительство завода. Содовый завод в пригороде Парижа Сен-Жени назывался «Франсиада – Сода Леблана» и ежедневно давал 100–120 кг соды. Во время Французской революции в 1793 герцог Орлеанский был казнен, собственность его конфискована, а содовый завод и сам патент Леблана – национализированы. Лишь через семь лет Леблану вернули разоренный завод, восстановить который ему уже не удалось. Последние годы Леблана прошли в нищете, а в 1806 он покончил жизнь самоубийством.
Лишь через семь лет Леблану вернули разоренный завод, восстановить который ему уже не удалось. Последние годы Леблана прошли в нищете, а в 1806 он покончил жизнь самоубийством.
Технологию производства соды по Леблану стали использовать во многих странах Европы. Первый содовый завод такого типа в России был основан промышленником М.Прангом и появился в Барнауле в 1864. Но уже через несколько лет в районе теперешнего города Березники был построен крупный содовый завод фирмы «Любимов, Сольве и К°», где выпускалось 20 тысяч тонн соды в год. Этот завод использовал новую технологию производства соды – аммиачный способ, изобретенный бельгийским инженером-химиком Эрнестом Сольве. С этого времени заводы в России и в других странах, использовавшие метод Леблана, не выдержав конкуренции, стали постепенно закрываться: технология Сольве оказалась более экономичной.
Аммиачный способ получения соды был предложен еще в 1838–1840 английскими инженерами-химиками Г.Грей-Дьюаром и Д.Хеммингом. Они пропускали через воду газообразные аммиак NH3 и диоксид углерода CO2, которые при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
Они пропускали через воду газообразные аммиак NH3 и диоксид углерода CO2, которые при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
NH3 + CO2 + H2O = NH4HCO3,
а затем добавляли к этому раствору хлорид натрия NaCl, чтобы выделить малорастворимый на холоде гидрокарбонат натрия NaHCO3:
NH4HCO3 + NaCl = NaHCO3Ї + NH4Cl
Гидрокарбонат натрия отфильтровывали и нагреванием превращали в соду:
2 NaHCO3 = Na2CO3 + CO2 + H2O
Диоксид углерода CO2, необходимый для проведения процесса, получали из карбоната кальция СаСО3 – мела или известняка – при прокаливании:
CaCO3 = CaO + CO2,
а оксид кальция CaO, который при этом получался, после обработки водой давал гидроксид кальция Ca(OH)2:
CaO + H2O = Ca(OH)2,
необходимый для получения аммиака NH3 из хлорида аммония NH4Cl:
2 NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 + 2 H2O
Таким образом, аммиак все время находился в обращении и не расходовался, отходом производства оставался только хлорид кальция CaCl2.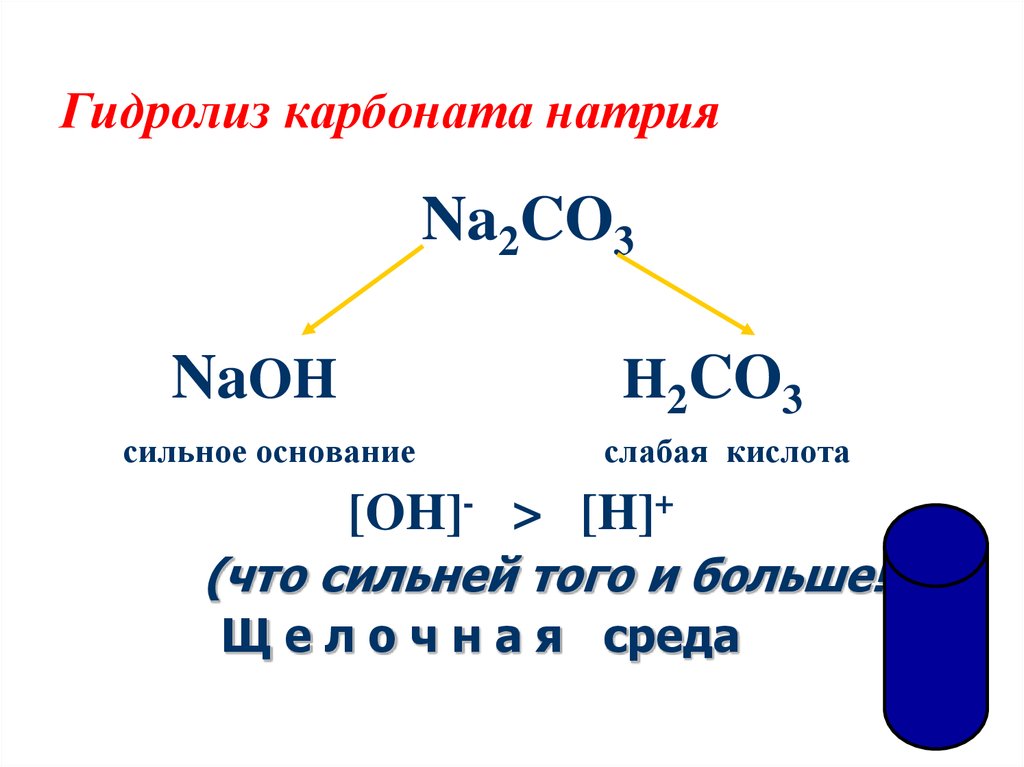
Эрнест Сольве не внес принципиальных новшеств в химическую основу содового процесса английских инженеров, он только технологически оформил производство, однако, это тоже непросто. В частности, он применил здесь аппараты колонного типа, которые позволили вести процесс непрерывно и достичь высокого выхода продукта.
Преимущества аммиачного метода над способом Леблана состояли в получении более чистой соды, меньшем загрязнении окружающей среды и экономии топлива (поскольку температура здесь ниже). Все вместе это привело к тому, что в 1916–1920-х закрылись почти все заводы, работавшие по методу Леблана.
Первыми в мире заводами, использующими аммиачный способ получения соды, стали бельгийский завод в Куйе, построенный по проекту самого Сольве в 1865, и Камско-Содовый завод Лихачева в России, который начал работать в 1868. Российский завод был создан полковником Иваном Лихачевым в его имении на берегу реки Камы в Казанской губернии. Лихачев добывал аммиак NH3 путем сухой перегонки отходов, которые ему поставляли почти двести кожевенных мастерских со всей округи. Диоксид углерода СО2 получали прокаливанием известняка, найденного поблизости. Завод просуществовал недолго и уже через четыре года был закрыт из-за нерентабельности: сильно подорожали и кожевенные отходы, и поваренная соль NaCl.
Диоксид углерода СО2 получали прокаливанием известняка, найденного поблизости. Завод просуществовал недолго и уже через четыре года был закрыт из-за нерентабельности: сильно подорожали и кожевенные отходы, и поваренная соль NaCl.
Сейчас в мире производится несколько млн тонн соды в год.
Карбонат натрия применяется в стеклоделии (это составная часть шихты – смеси исходных веществ, из которой выплавляется стекло), для получения мыла и других моющих средств, в целлюлозо-бумажной промышленности (для варки целлюлозы). Много соды потребляется в технологическом процессе получения алюминия, именно сода идет на обработку исходного сырья алюминиевой промышленности – бокситов. Карбонатом натрия нейтрализуют кислоты в промышленных стоках, в том числе – при очистке нефтепродуктов, осаждают из растворов солей нерастворимые карбонаты и гидроксиды, которые после прокаливания используются как пигменты:
Гидрокарбонат натрия тоже не остается без применения – он служит источником углекислого газа при выпечке хлеба и кондитерских изделий, газированных напитков, а также в огнетушителях. Кроме того, питьевая сода по-прежнему занимает свое законное место в домашней аптечке как одно из самых простых и дешевых, но очень нужных лекарственных средств.
Кроме того, питьевая сода по-прежнему занимает свое законное место в домашней аптечке как одно из самых простых и дешевых, но очень нужных лекарственных средств.
Людмила Аликберова
Отравление карбонатом натрия | UF Health, University of Florida Health
Определение
Карбонат натрия (известный как стиральная сода или кальцинированная сода) — это химическое вещество, содержащееся во многих бытовых и промышленных продуктах. Эта статья посвящена отравлению из-за карбоната натрия.
Эта статья предназначена только для информации. НЕ используйте его для лечения или лечения фактического отравления. Если вы или кто-то, с кем вы находитесь, заразились, позвоните по местному номеру службы экстренной помощи (например, 911) или напрямую в местный токсикологический центр, позвонив на национальную бесплатную горячую линию Poison Help (1-800-222-1222). ) из любой точки США.
Альтернативные названия
Отравление содой; отравление кальцинированной содой; Отравление динатриевой солью; Отравление углекислотой; Отражение промывкой соды
Ядовитый ингредиент
Карбонат натрия
, где обнаружено
Карбонат натрия обнаружен в:
- Автоматическое мытья посудоиз.
 отбеливатели
отбеливатели - Некоторые растворы для пены для ванн
- Некоторые паровые чистящие средства для утюга
Примечание. Этот список не является исчерпывающим.
Symptoms
Symptoms from swallowing sodium carbonate may include:
- Breathing problems due to throat swelling
- Collapse
- Diarrhea
- Drooling
- Eye irritation, redness, and pain
- Hoarseness
- Low blood pressure (may развиваются быстро)
- Сильная боль во рту, горле, грудной клетке или области живота
- Shock
- Сложность глотания
- Рвота
Симптомы из кожи или зрительного контакта могут включать в себя:
- Сжигание кожи, дренаж и боль
- Горит глаз, дренаж и боль
- Позрение
- .
Немедленно обратитесь за медицинской помощью. ЗАПРЕЩАЕТСЯ вызывать у человека рвоту, если это не рекомендовано токсикологическим центром или медицинским работником.

Если химическое вещество попало на кожу или в глаза, промойте их большим количеством воды в течение не менее 15 минут.
Если химическое вещество было проглочено, немедленно дайте пострадавшему один стакан воды, если только медицинский работник не дал иных указаний. НЕ давайте воду, если у человека есть симптомы (рвота, судороги или снижение уровня бдительности), которые затрудняют глотание.
Если человек вдохнул яд, немедленно вывести его на свежий воздух.
Прежде чем звонить в службу экстренной помощи
Если имеется, определите следующую информацию:
- Возраст, вес и состояние человека
- Название продукта (состав и сила действия, если известны)
- Время проглатывания
- Количество проглоченного продукта
Контроль отравлений
В местный токсикологический центр можно напрямую позвонить по бесплатному телефону Горячая линия Poison Help (1-800-222-1222) из любой точки США. Этот национальный номер горячей линии позволит вам поговорить со специалистами по отравлениям.
 Они дадут вам дальнейшие инструкции.
Они дадут вам дальнейшие инструкции.Это бесплатная и конфиденциальная услуга. Все местные токсикологические центры в США используют этот национальный номер. Вам следует позвонить, если у вас есть какие-либо вопросы об отравлении или профилактике отравления. Это НЕ должно быть чрезвычайной ситуацией. Звонить можно по любому поводу, 24 часа в сутки, 7 дней в неделю.
Возьмите контейнер с собой в больницу, если это возможно.
Что ожидать в отделении неотложной помощи
. Поставщик будет измерять и следить за жизненно важными признаками человека, в том числе:
- Насыщение кислородом
- Температура
- Пульс
- Скорость дыхания
- ГРУЗОВЫ по мере необходимости. Человеку могут быть назначены:
- Анализы крови
- Поддержка дыхательных путей и/или поддержка дыхания, включая кислород через внешнее устройство доставки или эндотрахеальную интубацию (помещение дыхательной трубки через рот или нос в дыхательные пути) с подключением к аппарату искусственной вентиляции легких ( дыхательный аппарат жизнеобеспечения)
- Электрокардиограмма (ЭКГ)
- Эндоскопия – камера используется для осмотра горла, чтобы увидеть ожоги в пищеводе и желудке
- Ларингоскопия или бронхоскопия – прибор (ларингоскоп) или камера (бронхоскоп) используется для обследования в горло, чтобы увидеть ожоги в дыхательных путях
- Промывание глаз и кожи
- Введение жидкостей через вену (IV)
- Лекарства для лечения симптомов
- Рентген грудной клетки и брюшной полости
Прогноз (прогноз)
Карбонат натрия в небольших количествах обычно не очень токсичен.
 Однако, если вы проглотите большое количество, у вас могут возникнуть симптомы. В этой редкой ситуации возможны долгосрочные последствия, вплоть до смерти, если вы не получите быстрого и агрессивного лечения.
Однако, если вы проглотите большое количество, у вас могут возникнуть симптомы. В этой редкой ситуации возможны долгосрочные последствия, вплоть до смерти, если вы не получите быстрого и агрессивного лечения.Ссылки
Hoyte C. Caustics. В: Walls RM, Hockberger RS, Gausche-Hill M, eds. Неотложная медицина Розена: концепции и клиническая практика . 9-е изд. Филадельфия, Пенсильвания: Elsevier; 2018: глава 148.
Вульф AD. Принципы оценки и скрининга токсинов. В: Фурман Б.П., Циммерман Дж.Дж., ред. Педиатрическая реанимация . 5-е изд. Филадельфия, Пенсильвания: Elsevier; 2017: глава 127.
Отзыв:
Джесси Борке, доктор медицинских наук, FACEP, FAAEM, лечащий врач FDR Medical Services/Millard Fillmore Suburban Hospital, Буффало, штат Нью-Йорк. Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия.
Карбонат натрия безводный | КАС 497-19-8 | SCBT
Карбонат натрия безводный представляет собой натриевую соль угольной кислоты.
 Широко используемый реагент в исследованиях биохимии и молекулярной биологии; чаще всего в качестве буферного компонента в таких приложениях, как хроматография, капиллярный электрофорез и ферментативный катализ. Идеально подходит для выделения клеточных мембран, мембранных белков и гидрофобных белков. В химии используется как электролит, выступая в качестве хорошего проводника при электролизе. Поскольку карбонат натрия твердый, стабильный на воздухе и его легко взвешивать, его можно использовать в качестве основного стандарта для кислотно-щелочного титрования.
Широко используемый реагент в исследованиях биохимии и молекулярной биологии; чаще всего в качестве буферного компонента в таких приложениях, как хроматография, капиллярный электрофорез и ферментативный катализ. Идеально подходит для выделения клеточных мембран, мембранных белков и гидрофобных белков. В химии используется как электролит, выступая в качестве хорошего проводника при электролизе. Поскольку карбонат натрия твердый, стабильный на воздухе и его легко взвешивать, его можно использовать в качестве основного стандарта для кислотно-щелочного титрования.Literaturhinweise
1. Fujiki, Y., et al. 1982. J. Cell Biol. 93: 97-102. PMID: 7068762
2. Davidson, A.F., et al. 1996. J Pharm Biomed Anal. 14: 1717-1725. PMID: 8887719
3. Santoni, V., et al. 1999. Биохимия. 81: 655-661. PMID: 10433119
4. Santoni, V., et al. 1999. Электрофорез. 20: 705-711. PMID: 10344236
5. Фарина А. и соавт. 1999. J Pharm Biomed Anal. 20: 521-530. PMID: 10701968
6.
 Santoni, V., et al. 2000. Электрофорез. 21:3329-3344. PMID: 11079553
Santoni, V., et al. 2000. Электрофорез. 21:3329-3344. PMID: 110795537. Сантони В. и соавт. 2000. Электрофорез. 21: 1054-1070. PMID: 10786880
8. Molloy, M.P., et al. 2000. Евро. Дж. Биохим. 267: 2871-2881. PMID: 10806384
9. Ru, M.T., et al. 2001. Биотехнология. биоинж. 75: 187-196. PMID: 11536141
10. Hawel, L., et al. 2002. Анал. Биохим. 311: 127-132. PMID: 12470671
Паспорт безопасности (MSDS)
Регион
ОБРАЗЕЦ сертификата анализа (COA)
Карбонат натрия безводный | CAS 497-19-8 ОБРАЗЕЦ сертификата анализаАнализэнзертификат
Каталожный номер СК-203382СК-203382АСК-203382B
Номер лота
Каталожный номер:sc-203382
Номер партии:ОБРАЗЕЦ
Product Name:Sodium carbonate, anhydrous
Molecular Formula:Na 2 CO 3
Molecular Weight:105.
 99
99



 отбеливатели
отбеливатели
 Они дадут вам дальнейшие инструкции.
Они дадут вам дальнейшие инструкции. Однако, если вы проглотите большое количество, у вас могут возникнуть симптомы. В этой редкой ситуации возможны долгосрочные последствия, вплоть до смерти, если вы не получите быстрого и агрессивного лечения.
Однако, если вы проглотите большое количество, у вас могут возникнуть симптомы. В этой редкой ситуации возможны долгосрочные последствия, вплоть до смерти, если вы не получите быстрого и агрессивного лечения.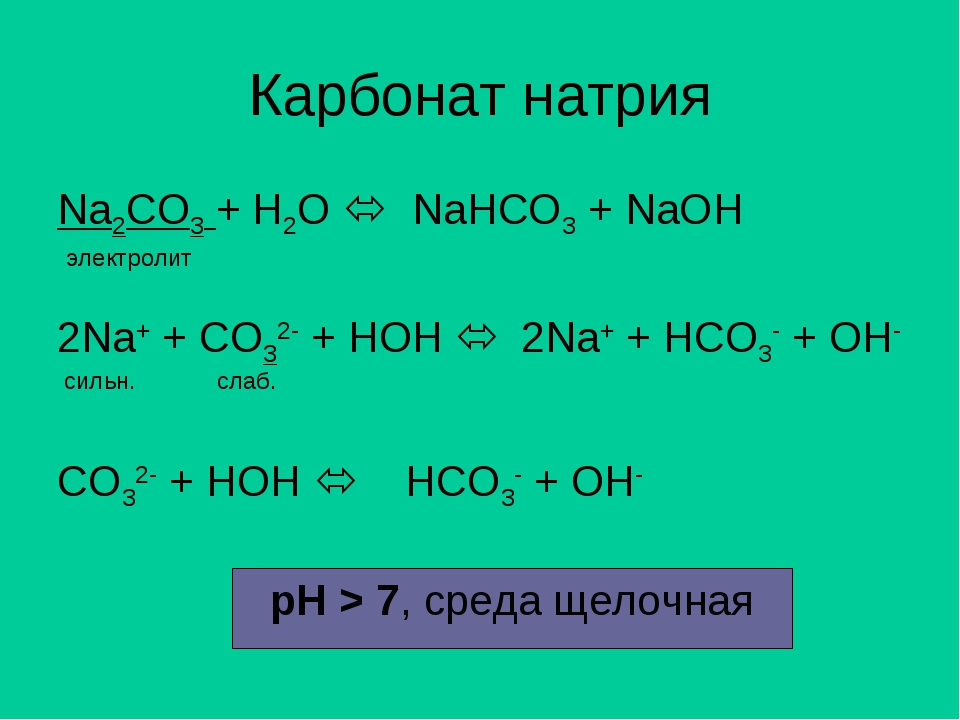 Широко используемый реагент в исследованиях биохимии и молекулярной биологии; чаще всего в качестве буферного компонента в таких приложениях, как хроматография, капиллярный электрофорез и ферментативный катализ. Идеально подходит для выделения клеточных мембран, мембранных белков и гидрофобных белков. В химии используется как электролит, выступая в качестве хорошего проводника при электролизе. Поскольку карбонат натрия твердый, стабильный на воздухе и его легко взвешивать, его можно использовать в качестве основного стандарта для кислотно-щелочного титрования.
Широко используемый реагент в исследованиях биохимии и молекулярной биологии; чаще всего в качестве буферного компонента в таких приложениях, как хроматография, капиллярный электрофорез и ферментативный катализ. Идеально подходит для выделения клеточных мембран, мембранных белков и гидрофобных белков. В химии используется как электролит, выступая в качестве хорошего проводника при электролизе. Поскольку карбонат натрия твердый, стабильный на воздухе и его легко взвешивать, его можно использовать в качестве основного стандарта для кислотно-щелочного титрования. Santoni, V., et al. 2000. Электрофорез. 21:3329-3344. PMID: 11079553
Santoni, V., et al. 2000. Электрофорез. 21:3329-3344. PMID: 11079553 99
99