что, как сбалансировать и часто задаваемые вопросы —
By Арунима Чакраборти
Соляная кислота и карбонат калия являются неорганическими соединениями. Давайте рассмотрим химические реакции, происходящие при обработке карбоната калия кислотой, такой как HCl.
Соляная кислота представляет собой бесцветную жидкость, широко известную как соляная кислота. Различные физические свойства, такие как температура плавления, температура кипения и плотность, зависят от концентрации этой кислоты. Карбонат калия представляет собой белое твердое вещество, широко известное как жемчужный пепел. Он хорошо растворяется в воде.
В этом разделе мы узнаем много фактов о реакции HCl+K.2CO3 например, тип реакции, как сбалансировать химическую реакцию, сопряженные пары и т. д.
Что является продуктом HCl и K2CO3Водный раствор хлорида калия, т. е. KCl, с сильным выделением углекислого газа, т. е. CO.2 образуется, когда пкарбонат калия взаимодействует с соляной кислотой.
е. KCl, с сильным выделением углекислого газа, т. е. CO.2 образуется, когда пкарбонат калия взаимодействует с соляной кислотой.
HCl (л) + К2CO3 (т) = KCl (водн.) + CO2(г)+ Н2О (л)
Какой тип реакции HCl + K2CO3Реакция между HCl и K2CO3 — это реакция двойного вытеснения за счет образования H2CO3 в 1st шаг, когда HCl реагирует с K2CO3 с последующей реакцией разложения, в которой угольная кислота, т.е. H2CO3 разлагается с выделением CO2.
Как сбалансировать HCl + K2CO3Следуйте данным шагам, чтобы сбалансировать химическое уравнение.
Шаг 1: напишите элементарное уравнениеЭлементарное уравнение реакции между HCl и K2CO3 is
- HCl (л) + К2CO3 (с) = KCl (водн.
 ) + CO2 (г) + Н2О (л)
) + CO2 (г) + Н2О (л)
| Символ атомов, присутствующих в LHS | Количество атомов в LHS | Символ атомов, присутствующих в RHS | Количество атомов в RHS |
|---|---|---|---|
| H | 1 | H | 2 |
| Cl | 1 | Cl | 1 |
| K | 2 | K | 1 |
| C | 1 | C | 1 |
| O | 3 | O | 3 |
Чтобы написать сбалансированное химическое уравнение, нам нужно умножить 2 на атом калия в правой части, умножить 2 на атом водорода в левой части и умножить 2 на атом хлора в левой и правой частях.
Шаг 4: Напишите сбалансированное химическое уравнениеКоличество атомов в реагентах и продуктах теперь сбалансировано. Включите то же самое в химическое уравнение, напишите коэффициент 2 перед HCl в реагенте уравнения элемента и также напишите 2 вместе с KCl в продукте. Таким образом, окончательное сбалансированное уравнение будет:
Включите то же самое в химическое уравнение, напишите коэффициент 2 перед HCl в реагенте уравнения элемента и также напишите 2 вместе с KCl в продукте. Таким образом, окончательное сбалансированное уравнение будет:
- 2HCl (л) + К2CO3 (т) = 2 KCl (водн.) + CO2 (г) + Н2О (л)
- бюретка
- пипетка
- стакан 250 мл
- Мерная колба
- Коническая колба
- раструб
- Фильтровальная бумага
- Часы стекло
- Дистиллированная вода
- соляная кислота
- Карбонат калия
Индикатор метиловый оранжевый используется для отображения конечной точки при титровании HCl с помощью K2CO3.
- Промойте весь аппарат перед началом процедуры.
- Отмерьте и наполните бюретку K2CO3 неизвестной силы.
- С помощью пипетки отмеряют необходимое количество раствора HCl известной концентрации и помещают его в чистую коническую колбу.
- В колбу добавляют две капли индикатора метилового оранжевого.
- Установите бюретку на подставку для бюретки и добавьте K2CO3 раствора в коническую колбу при постоянном взгляде по каплям до изменения окраски кислого раствора на светло-розовую.
- Повторите тот же процесс, чтобы найти три согласующихся чтения.
- Показания можно записать в следующую таблицу
| Sl нет. | Начальное чтение бюретки | Окончательное чтение бюретки | Изменение объема K2CO3 |
|---|---|---|---|
| 1 | х см3 | у см3 | (ух)см3 |
| 2 | см3 | б см3 | (ба)см3 |
| 3 | р см3 | д см3 | (кв) см3 |
- Рассчитайте средний объем, т.
 е. V мл, гидроксида кальция, использованного во время реакции, и используйте это значение, чтобы узнать силу соляной кислоты.
е. V мл, гидроксида кальция, использованного во время реакции, и используйте это значение, чтобы узнать силу соляной кислоты.
- Концентрация K2CO3 можно рассчитать с помощью объемного анализа, т.е. [K2CO3]M1V1 = [HCl] М2V2. где M — крепость раствора, V — объем.
- Во-первых, нам нужно написать сбалансированное химическое уравнение, т.е.
2HCl (л) + К2CO3 (с) = 2 KCl (водн.) + CO2 (г) + Н2О (л)
- Затем разбейте сбалансированное уравнение на ионную форму, т.е.
2H+(водн.)+ 2Cl– (водн.) + К2CO3 (с) = 2К+водн.)+ 2Cl– (водн. ) + CO2 (г) +Н2О (л)
) + CO2 (г) +Н2О (л)
- На последнем этапе отмените все ионы-наблюдатели, и итоговое ионное уравнение можно записать как
2H+(водн.)+ К2CO3 (с) = 2К+(водн.)+ CO2 (г)+ Н2О (л)
HCl + К2CO3 Сопряженные пары- Сопряженным основанием сильной кислоты Соляная кислота является Cl– ион.
- Сопряженная кислота Карбонат калия представляет собой KHCO.3.
Компания межмолекулярная сила что существует в молекуле HCl есть диполь-дипольное взаимодействие и сила притяжения Вандер-Ваальса, обусловленная ее полярной природой. Сила межмолекулярного притяжения, которая существует в других реагентах и продуктах, когда HCl реагирует с K2CO3 приведены ниже.
| молекула | Межмолекулярная сила притяжения |
|---|---|
| HCl | Диполь-дипольное взаимодействие Сила Вандер-Вааля |
| K2CO3 | ионный |
| KCI | ионный |
| CO2 | Ковалентная |
| H2O | Н-связь |
Энтальпия реакции или изменение теплоты между реагентами и продуктами, когда HCl реагирует с K2CO3 составляет -33.96 кДж/моль.
HCl + K2CO3 Буферный растворHCl и К2CO3 Не буферный раствор потому что HCl — сильная кислота, а K2CO3 является слабым основанием.
Реакция HCl и K2CO3 представляет собой полную реакцию за счет образования нейтральной соли KCl с высокостабильным CO2 и Н2O.
HCl + K2CO3 Экзотермическая и эндотермическая реакцияРеакция между HCl и K2CO3 есть экзотермическая реакция как изменение энтальпии в ходе химической реакции отрицательно.
HCl + K2CO3 Окислительно-восстановительная реакцияРеакция HCl с K2CO3 не является окислительно-восстановительной реакцией, так как здесь одновременно не происходит повышения и понижения степени окисления.
HCl + K2CO3 Реакция на осаждениеРеакция HCl и K2CO3 не является реакцией осаждения, так как продукт образуется в ходе химической реакции, т. е. KCl является легкорастворимой солью.
е. KCl является легкорастворимой солью.
Реакция между HCl и K2CO3 является необратимой реакцией, потому что это реакция разложения, в которой CO2 и Н2О форма. Как CO2 и Н2O оба очень стабильны, они не будут в дальнейшем реагировать как реагенты.
HCl + K2CO3 Реакция смещенияРеакция, происходящая между HCl и K2CO3 не является реакцией замещения, поскольку здесь во время реакции происходит обмен двумя ионными частицами, тогда как в реакции замещения происходит замена только одного химического элемента.
ЗаключениеСоляная кислота и оксид кальция широко используются в качестве лабораторных реагентов. Продукт, образующийся в результате этой реакции, т.е. хлорид калия, используется в качестве лекарства для лечения низкого уровня калия в организме, а также используется в качестве удобрения.
Продукт, образующийся в результате этой реакции, т.е. хлорид калия, используется в качестве лекарства для лечения низкого уровня калия в организме, а также используется в качестве удобрения.
Контрольная работа по химии 8 класс по теме: «Основные классы неорганических соединений»
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 1 1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
К2О Аl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений.
Составьте уравнения реакций.
Дана схема превращений.
Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 2
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
H2S Al(NO3)3 H2СО3 Ca(OH) 2 Fe(OH)3 NaCl Fe2O3 H2SiO3 CO CaCO3 H2O Mg(OH)2 P2O5
2. Дана схема превращений.
Составьте уравнения реакций.
Дана схема превращений.
Составьте уравнения реакций.
Ba ® BaO → Ba(OH)2 ® BaCl2
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: Mg(OH)2, H2O, Fe, Ba(NO3)2
Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих соединений: хлорида бария, оксида меди (II), гидрофосфата натрия, оксида свинца (II), сульфата цинка, кремневой кислоты, нитрата серебра, карбоната магния, нитрита бария, гидрокарбоната бария, сульфида железа (III), оксида алюминия, фосфорной кислоты.
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 3
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
N2O5 H2SO3 CuOH Ca(OH)2 SO3 H3PO4 Mg(NO3)2 NaOH Na3PO4 FeCl3 Na2O H2SO4 H2S
2. Дана схема превращений.
Составьте уравнения реакций.
Дана схема превращений.
Составьте уравнения реакций.
Zn ® ZnO → ZnCl2 ®Zn(OH)2
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать азотная кислота: NaOH, CO2, CaO, Na2СO3, H2O. Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих веществ: сульфата меди, силиката натрия, гидроксида кальция, оксида алюминия, нитрата свинца (II), хлорида алюминия, гидрокарбоната бария, иодида калия, нитрита железа (III), фосфата лития, азотной кислоты.
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 4
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
FeO Ba(OH)2 SO2 Ca(OH)2 HCl Cu(OH)2 H2S Na2SO4 H2CO3 Cu Cl2 NaNO3 K3PO4 P2O3
2. Дана схема превращений.
Составьте уравнения реакций.
Дана схема превращений.
Составьте уравнения реакций.
Fe ®
Fe2O3 ®
Fe(NO3)3 → Fe (OH)3
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать серная кислота : H2SO4, Na2СО3, AgNO3, Ag , NaOH. Напишите уравнения осуществимых реакций
4. Напишите формулы следующих веществ: хлорид железа (III), гидрокарбонат лития, гидроксид меди (II), оксид алюминия, нитрат олова, сульфит калия, силикат бария, бромид калия, хлорная кислота, оксид марганца (IV), перманганат калия, нитрат алюминия, соляная кислота.
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 5
Из перечня
формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им
названия: Ca(OH)2, Na2O, HNO 3, ZnS, SiO2, MgCO3, CO2,
LiOH, BaSO4, Na2HPO4 , H2CO3, NаNO3,
KCl, AlPO4.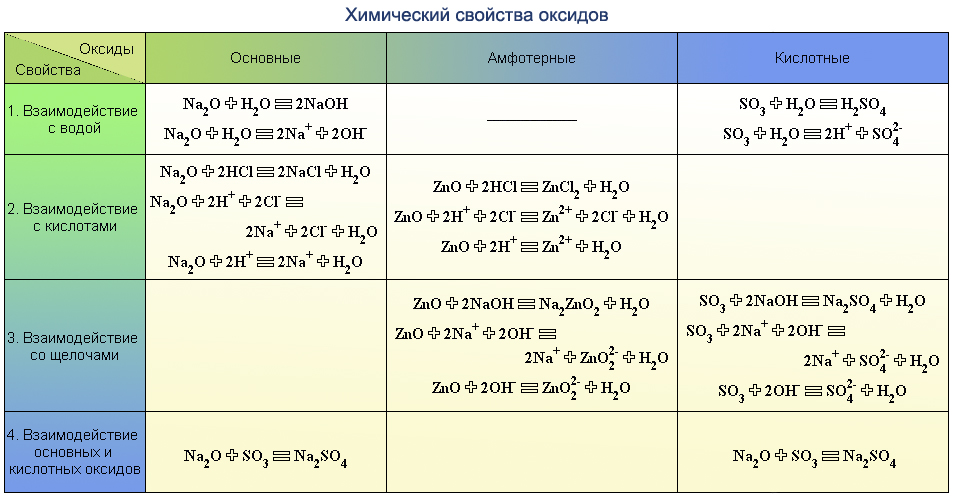
2. Дана схема превращений.
Составьте уравнения реакций.
Mg® MgО ®
Mg(NO3)2 → Mg (OH)2
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать серная кислота : H2О, НCl, NaOH, CuO, MgCO3
Напишите уравнения осуществимых реакций
4. Напишите формулы следующих веществ: хлорид железа (III), карбонат калия, гидроксид меди (II), оксид серебра, нитрат кальция, сульфит калия, силикат бария, бромид калия, сероводородная кислота, оксид марганца (IV), сульфат натрия, нитрат алюминия, соляная кислота.
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 6
1. Из перечня формул выпишите
отдельно формулы оксидов, оснований, кислот и солей и дайте им названия: CaSO4,
MgCl2, NаNO2,
H3PO4,
CO, Al2(SO4)3,
NaNO3, Cu(OH)2,
NаOH, ZnS, HI, Fe3O4,
Ba(OH)2.
2. Дана схема превращений.
Составьте уравнения реакций.
Al® Al2О3 ®
Al(NO3)3 → Al (OH)3
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать азотная кислота : H2О, НCl, NaOH, CuO, MgCO3
Напишите уравнения осуществимых реакций
4. Напишите формулы следующих веществ: хлорид бария, оксид меди (II), фосфат натрия, оксид свинца (II), сульфид цинка, кремневая кислота, сульфат серебра, карбонат магния, нитрит калия, гидрокарбоната бария, сульфида железа (III), оксида алюминия, фосфорной кислоты.
Контрольная
работа №3 «Основные классы неорганических веществ» (8 класс) Вариант №
7 1. Из
перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и
дайте им названия: Cl2O7, Fe(OH)3, CuS, CO2, K3PO4, Mg(HCO3)2, Na2SO
Из
перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и
дайте им названия: Cl2O7, Fe(OH)3, CuS, CO2, K3PO4, Mg(HCO3)2, Na2SO
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuSO4 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать серная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих веществ: сульфата калия,
гидроксида бария, оксида натрия, фосфата кальция, сульфата цинка, сульфида
железа (II), соляной кислоты, силиката калия, гидроксида натрия, бромида
алюминия, иодида калия, оксида магния, фосфата калия.
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 8
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
H2S Al(NO3)3 H2СО3 Ca(OH)2 Fe(OH)3 NaCl Fe2O3 H2SiO3 CO CaCO3 H2O Mg(OH)2 P2O5
2. Дана схема превращений. Составьте уравнения реакций.
Na ® Na2O → NaOH ® NaCl
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать азотная кислота: Mg(OH)2, H2O, FeО, BaСO3
Напишите уравнения осуществимых реакций.
4.
Напишите формулы следующих соединений: хлорида алюминия, оксида меди (II),
фосфата натрия, оксида меди (II), сульфата цинка, кремневой кислоты, нитрата
серебра, карбоната магния, нитрита натрия, гидрокарбоната бария, сульфида
железа (III), оксида алюминия, фосфорной кислоты.
Четкое объяснение химической реакции карбоната калия с водородом
Карбонат калия (K2CO3) представляет собой белую соль, растворимую в воде (нерастворимую в этаноле) и образующую сильнощелочной раствор. Его можно получить как продукт эндотермической реакции гидроксида калия и диоксида углерода. Он обеспечивает отличную способность впитывать влагу.
Водород — самый легкий элемент. При стандартных условиях водород представляет собой газ, состоящий из двухатомных молекул формулы h3. Он бесцветный, без запаха, без вкуса, нетоксичен и легко воспламеняется. Водород — самое распространенное химическое вещество во Вселенной, составляющее примерно 75% всех обычных соединений.
Карбонат калия:
Карбонат калия представляет собой неорганическое соединение с химической формулой K2CO3. Это белая соль, которая растворяется в воде. Он расплывается и часто появляется в виде влажного или влажного твердого вещества. Мыло и очки являются наиболее распространенным применением карбоната калия.
Карбонат калия является основным компонентом поташа и более очищенной жемчужной золы или соли битартрата калия. Жемчужная зола была получена путем сжигания поташа в печи для удаления примесей. Жемчужный пепел был мелким белым порошком, который остался. Первый патент, выданный Патентным ведомством США, был выдан Сэмюэлю Хопкинсу в 179 г.0 за усовершенствованный процесс производства поташа и жемчужной золы.
В Северной Америке в конце 18 века жемчужная зола использовалась в качестве разрыхлителя для быстрого хлеба до того, как был разработан разрыхлитель.
Водород:
Водород (H) представляет собой бесцветное, не имеющее запаха и вкуса, легковоспламеняющееся газообразное вещество и является простейшим членом семейства химических элементов. Атом водорода имеет ядро, состоящее из протонов, несущих единицу положительного заряда. Также это ядро связано с электроном, который несет единичный отрицательный заряд. При нормальных условиях газообразный водород представляет собой рыхлую сборку молекул водорода, каждая из которых состоит из пары атомов, двухатомной молекулы и h3. Самая ранняя известная и важная химия водорода заключается в том, что он сгорает с кислородом с образованием воды, h3O. Фактически, название «водород» происходит от греческого слова «создатель воды».
Самая ранняя известная и важная химия водорода заключается в том, что он сгорает с кислородом с образованием воды, h3O. Фактически, название «водород» происходит от греческого слова «создатель воды».
Водород является самым распространенным элементом во Вселенной (в три раза более распространенным, чем гелий, второй по распространенности элемент), но он составляет всего около 0,14 процента веса земной коры. Однако он был обнаружен в больших количествах в составе океанов, паковых льдов, рек, озер и воды в атмосфере. Водород присутствует во всех животных и растительных тканях, а не только в нефти, как компонент бесчисленных соединений углерода. Часто говорят, что соединений углерода известно больше, чем любого другого элемента, но на самом деле водород присутствует почти во всех соединениях углерода и всех других элементах (кроме некоторых благородных газов). увеличивать. Может быть большое количество соединений водорода.
Химическая реактивность карбоната калия с водородом:
Для определения объективной скорости разложения KHCO3 был использован метод ТГА с медленно возрастающей постоянной температурой на небольших тонко измельченных образцах. Такие реакции обеспечивают новый пористый и реактивный адсорбент для вредных и/или зловонных газов. Бикарбонат начинает разлагаться при 364К и достигает максимальной скорости реакции 5,73×10-41/с при 421,9К. Зависимость типа Аррениуса создается интегральным методом с использованием функции Шромильха. Энергия активации достигает 141,3 кДж/моль, а порядок реакции равен 1,145. Объем пор (0,2309см3/г), полученного прокаливанием, колеблется от 403 до 503 К и не зависит от температуры, но средний размер пор и размер частиц увеличиваются с повышением температуры. Представленные графики позволяют удобно прогнозировать условия достижения почти полной конверсии бикарбоната и минимизации нежелательного спекания образующегося карбоната.
Такие реакции обеспечивают новый пористый и реактивный адсорбент для вредных и/или зловонных газов. Бикарбонат начинает разлагаться при 364К и достигает максимальной скорости реакции 5,73×10-41/с при 421,9К. Зависимость типа Аррениуса создается интегральным методом с использованием функции Шромильха. Энергия активации достигает 141,3 кДж/моль, а порядок реакции равен 1,145. Объем пор (0,2309см3/г), полученного прокаливанием, колеблется от 403 до 503 К и не зависит от температуры, но средний размер пор и размер частиц увеличиваются с повышением температуры. Представленные графики позволяют удобно прогнозировать условия достижения почти полной конверсии бикарбоната и минимизации нежелательного спекания образующегося карбоната.
Неорганическое соединение бикарбонат калия (название IUPAC: гидрокарбонат калия, часто известное как карбонат калия) имеет химическую формулу KHCO3. Это сплошной белый цвет.
Структура карбоната калия:
Калиевая соль, представляющая собой двухкалиевую соль угольной кислоты.
Заключение:
Карбонат калия реагирует с соляной кислотой. Эта серия показывает добавление твердого карбоната калия (K2CO3) в химический стакан, содержащий 0,5 М соляную кислоту. Реакция HCl + K2CO3→ KCl + CO2 + h3O приводит к образованию пузырьков углекислого газа. Это пример реакции карбоновой кислоты, которая сама по себе является реакцией двойного обмена, за которой следует реакция разложения.
Соляная кислота и карбонат калия реагируют в соответствии со следующими сбалансированными химическими уравнениями с образованием жидкой воды, газообразного диоксида углерода и водного раствора хлорида калия. 2 HCl (водн.) + K2CO3 (водн.) → h3O (ж) + CO2 (г) + 2 KCl (водн.) Всего на воде собирается 15,3 мл газа. Атмосферное давление 776 мм рт.ст., температура воды 30,0 °С. Давление паров воды при 30,0 °С равно 31,86 мм рт.ст.
Фотография | Карбонат калия и HCl
{{ Элемент.Сообщение об ошибке }} Этот предмет сейчас недоступен. Товар не найден.ВЫБЕРИТЕ ВИДЕОЛИЦЕНЗИЮ
{{ item. PlusItemLicenseSmall }}
PlusItemLicenseSmall }}
TIMESLICES
Создать квант времени
Просмотр временных интервалов (поставляется с 1-секундными дескрипторами)
Просмотр интервалов времени
ТЕГИ
{{Ключевое слово}} {{Ключевое слово}}
ПОДЕЛИТЬСЯ ЭТОЙ СТРАНИЦЕЙ
Описание:
Описание:
Узнать больше
Кредит:
{{ item.ImgCredit }} Нет в наличии
Уникальный идентификатор:
{{ item.ItemID }}
Устаревший идентификатор:
{{ item.ItemDisplaySource }}
Тип:
{{item.MediaType}}
Лицензия:
{{item.LicenseModel}}
ЦЕНЫ РФ
{{item.aText[i]}}
{{ item.aPrice[i] }}
Скопировать URL
Скачать Комп
LabelPB.toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Удалить с доски
Добавить на доску
Заказать печать
Заказать печать
Скачать в высоком разрешении
Скачать в высоком разрешении

Скачать в высоком разрешении
Скачать в высоком разрешении
Размер без сжатия:
ЛИЦЕНЗИЯ ТОВАР НЕ ДОСТУПЕННазначение: {{item.ImgPurpose}}
{{ item.PlusItemLicenseSmall }}
Запрос товара
ПРОСТАЯ ЦЕНА RM
ПРОСТАЯ ЦЕНА RM
ТОВАР НЕ ДОСТУПЕН Запрос элемента
Назначение: {{ item.ImgPurpose }}
{{Имя}}
{{ FormatCurrency(item.aStandardPricingPrice[i]) }}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
LabelPB.toLowerCase()» :alt=»‘Add to ‘ + site.LabelPB.toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Заказать печать
Скачать в высоком разрешении
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ — $’ + item.PlusCodeAmount }} {{ item.PlusItemLicenseSmall }}
Перейти к оформлению заказа
Скопировать URL
Скачать Комп
LabelPB.toLowerCase()» :alt=»‘Add to ‘ + site.LabelPB.toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Скачать в высоком разрешении
Скачать в высоком разрешении
Это видео в высоком разрешении невозможно для мгновенной загрузки, так как размер файла превышает 2 ГБ. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Это видео в высоком разрешении сейчас недоступно. Пожалуйста, свяжитесь с нами по адресу info@sciencesource. com, и мы доставим его вам как можно скорее.
com, и мы доставим его вам как можно скорее.
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ — $’ + item.PlusCodeAmount }}
Перейти к оформлению заказаРазмер без сжатия:
ТОВАР НЕ ДОСТУПЕН
Запрос товараНазначение: {{item.ImgPurpose}}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
Удалить с доски
LabelPB.toLowerCase()» aria-label=»‘Add to ‘ + site.LabelPB.toLowerCase()»/>
Добавить на доску
Добавить в корзину
Заказать печать
Скачать в высоком разрешении
ТОВАР НЕ ДОСТУПЕН Запрос товара
Назначение: {{item.ImgPurpose}}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Скачать в высоком разрешении
Скачать в высоком разрешении
Это видео в высоком разрешении невозможно для мгновенной загрузки, так как размер файла превышает 2 ГБ. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Это видео в высоком разрешении сейчас недоступно. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его вам, как только возможный.
Время начала:
{{ SecondsToTime(StartTime) }} Установить
Время окончания:
{{ SecondsToTime(EndTime) }} Установить
Продолжительность: {{ Продолжительность}}
Текущий: {{ Текущий }}
Продолжительность: {{DurationTime}}
Текущее: {{ ТекущееВремя}}
{{ SecondsToTime(Value.StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
Посмотреть
Удалить
Для этого элемента не заданы временные интервалы, поэтому по умолчанию это весь клип.
{{ SecondsToTime(0) }} до {{ SecondsToTime(videocontrols.Duration) }}
Общее время: {{ Math.round(TotalTime * 100) / 100 }}
Цена/сек: {{ FormatCurrency(item.

 ) + CO2 (г) + Н2О (л)
) + CO2 (г) + Н2О (л) е. V мл, гидроксида кальция, использованного во время реакции, и используйте это значение, чтобы узнать силу соляной кислоты.
е. V мл, гидроксида кальция, использованного во время реакции, и используйте это значение, чтобы узнать силу соляной кислоты.