Химики случайно обнаружили новый кристаллогидрат карбоната кальция
Изучая роль ионов магния в кинетике кристаллизации аморфного карбоната кальция, немецкие ученые неожиданно обнаружили ранее неизвестную кристаллическую фазу полуводного карбоната кальция моноклинной структуры. В исследовании, опубликованом в Science, химики описали процесс формирования, состав и структурные характеристики нового кристаллогидрата.
Карбонат кальция CaCO3 является важнейшей частью геохимического цикла углерода, образуется в Земле в процессе осаждения органических веществ и составляет около четырех процентов земной коры. Поэтому это вещество часто становится объектом исследований в различных областях. Палеонтологи пытаются разгадать эволюцию климата на Земле и процессы биоминерализации, а экологи изучают влияние этой соли на кислотность океанов и почв. Карбонат кальция является моделью кристаллизационных механизмов из растворов. Уже более ста лет известны три неводных полиморфа (арагонит, кальцит и фатерит) и два кристаллогидрата – шестиводный икаит и одноводный моногидрокальцит.
Ученые синтезировали новый кристаллогидрат добавлением растворов хлоридов кальция и магния (в различных соотношениях) к карбонату натрия, следили за активностью ионов кальция в растворе и показателем кислотности в зависимости от времени. Состав и структуру полученных кристаллов авторы детально изучили набором аналитических методов и подтвердили расчетами.
Авторы разделили процесс формирования полуводного карбоната на три стадии. Сначала образовался аморфный моногидрат карбонат кальция, содержащий в себе около шести с половиной мольных процентов магния.
Морфологический анализ показал, что полуводный карбонат представляет собой иглы диаметром около 200 нанометров и длиной от одного до пяти микрометров, образующие нанокристаллы диаметром около 30 нанометров. Переход игловидных кристаллов полуводного кристаллогидрата в моногидрат, как отмечают авторы работ, напоминает подобный переход в процессе образования гипса (полуводного сульфата кальция).
Изучение карбонатных минералов помогает
исследователям восстановить историю нашей планеты. Так, по изотопному составу
углерода исследователям удалось доказать наличие жизни на Земле почти четыре
миллиарда лет назад.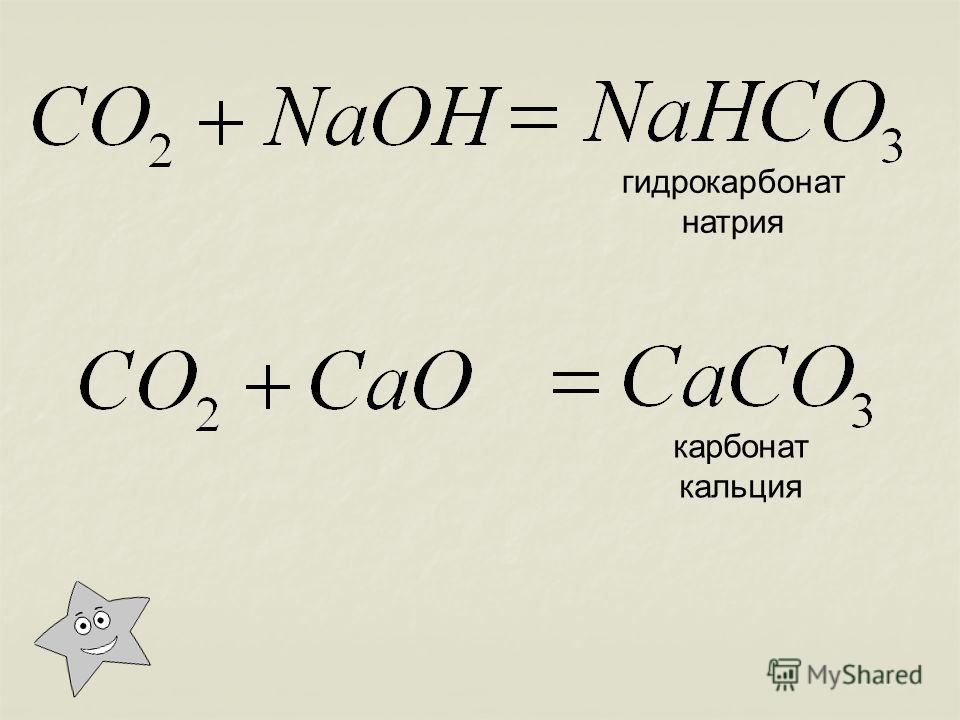
Алина Кротова
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Карбонат кальция — хим. свойства и получение CHEMEGE.RU
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция, образуется карбонат кальция и хлорид натрия:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
CaO + CO2 = CaCO3
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Ca(OH)2 + СO2 = CaСO3 + H2O
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
CaCO3 = CaO + CO2
2. Карбонат кальция вступает в реакцию со многими сложными веществами:
Карбонат кальция вступает в реакцию со многими сложными веществами:
2.1. Карбонат кальция реагирует с оксидами:
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
CaCO3 + SiO2 = CaSiO3 + CO2
2.2. Карбонат кальция реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
CaCO3 + 2HF = CaF2↓ + CO2↑ + H2O
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
CaCO3 + H2S = CaS + H2O + CO2
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Понравилось это:
Нравится Загрузка. ..
..
Карбонат натрия- 100 фунтов
Продукт SDS Sheet
Карбонат натрия (содовая пепела)
Из Википедии, свободная энциклопедия
Карбонат натрия (также известная как Spare Soda или 5 Soda ). , Na2CO3, представляет собой натриевую соль угольной кислоты. Чаще всего он встречается в виде кристаллического гептагидрата, который легко выцветает с образованием белого порошка, моногидрата. Он имеет охлаждающий щелочной вкус и может быть извлечен из пепла многих растений. Он синтетически производится в больших количествах из поваренной соли в процессе, известном как процесс Solvay.
Применение
- Наиболее важным применением карбоната натрия является химический состав стекла. При нагревании до очень высоких температур в сочетании с песком (SiO2) и карбонатом кальция (CaCO3) и очень быстром охлаждении карбонат натрия можно использовать для образования прозрачного некристаллического материала, широко известного как стекло.

- В химии карбонат натрия часто используется в качестве электролита. Это связано с тем, что электролиты обычно основаны на соли, а карбонат натрия действует как очень хороший проводник в процессе электролиза.
- В быту используется для смягчения воды при стирке. Он конкурирует с ионами магния и кальция в жесткой воде и предотвращает их связывание с используемым моющим средством. Без использования соды для стирки требуется дополнительное моющее средство для впитывания ионов магния и кальция. Называемый стиральной содой или Sal Soda в отделе моющих средств в магазинах, он эффективно удаляет масляные, жировые и спиртовые пятна. Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.
- Карбонат натрия широко используется в фотографических процессах в качестве регулятора pH для поддержания стабильных щелочных условий, необходимых для действия большинства проявляющих агентов.
- Карбонат натрия также используется в кирпичной промышленности в качестве смачивающего агента для уменьшения количества воды, необходимой для экструзии глины.
 Кальцинированная сода
Кальцинированная сода - также является распространенной добавкой в муниципальных бассейнах, используемой для нейтрализации кислотного воздействия хлора и повышения pH.
- При литье моногидрат карбоната натрия называется «связующим веществом» и используется для прилипания влажного альгината к гелеобразному альгинату.
- Карбонат натрия часто используется в качестве основного стандарта для кислотно-щелочного титрования, поскольку он является твердым и стабильным на воздухе, что облегчает точное взвешивание.
Распространение
Карбонат натрия растворим в воде, но может встречаться естественным образом в засушливых регионах, особенно в месторождениях полезных ископаемых (эвапоритах), образующихся при испарении сезонных озер. Месторождения минерального натрона, представляющего собой комбинацию карбоната натрия и бикарбоната натрия, добывались на дне высохших озер в Египте с древних времен, когда натрон использовался для изготовления мумий и в раннем производстве стекла. Карбонат натрия имеет три известные формы гидратов: декагидрат карбоната натрия, гептагидрат карбоната натрия и моногидрат карбоната натрия.
Карбонат натрия имеет три известные формы гидратов: декагидрат карбоната натрия, гептагидрат карбоната натрия и моногидрат карбоната натрия.
Производство
Горнодобывающая промышленность
Трона, гидратированный бикарбонат натрия (Na3HCO3CO3·2h3O), добывается в нескольких районах Соединенных Штатов и обеспечивает почти весь отечественный карбонат натрия. Крупные естественные месторождения, обнаруженные в 1938 году у реки Грин, штат Вайоминг, сделали добычу полезных ископаемых более экономичной, чем промышленное производство в Северной Америке.
Его также добывают из некоторых щелочных озер, таких как озеро Магади в Кении, с помощью основного процесса дноуглубительных работ, и он также самовосстанавливается, поэтому никогда не иссякнет в своем естественном источнике.
Барилла и водоросли
Ряд «галофитных» (солеустойчивых) видов растений и видов морских водорослей могут быть переработаны в нечистую форму карбоната натрия, и эти источники преобладали в Европе и других местах до начала 19 века.
Концентрация карбоната натрия в кальцинированной соде варьировалась в очень широких пределах: от 2-3% для формы, полученной из морских водорослей («ламинарии»), до 30% для лучшей бариллы, полученной из галофитных растений в Испании. Источники растений и морских водорослей для кальцинированной соды, а также родственной щелочи «калий» становились все более неадекватными к концу 18-го века, и поиск коммерчески жизнеспособных способов синтеза кальцинированной соды из соли и других химических веществ усилился.
Процесс Леблана
В 1791 французский химик Николя Леблан запатентовал процесс получения карбоната натрия из соли, серной кислоты, известняка и угля. Сначала морскую соль (хлорид натрия) кипятили в серной кислоте с получением сульфата натрия и газообразного хлористого водорода в соответствии с химическим уравнением
Сначала морскую соль (хлорид натрия) кипятили в серной кислоте с получением сульфата натрия и газообразного хлористого водорода в соответствии с химическим уравнением
2 NaCl + h3SO4 → Na2SO4 + 2 HCl
Затем сульфат натрия смешивали с измельченным известняком. (карбонат кальция) и уголь, и смесь сжигалась, образуя карбонат натрия вместе с диоксидом углерода и сульфидом кальция.
Na2SO4 + CaCO3 + 2 C → Na2CO3 + 2 CO2 + CaS
Карбонат натрия экстрагировали из золы водой, а затем собирали, позволяя воде испариться.
Соляная кислота, полученная в процессе Леблана, была основным источником загрязнения воздуха, а побочный продукт сульфид кальция также создавал проблемы с утилизацией отходов. Однако он оставался основным методом производства карбоната натрия до конца 1880-х годов.
Solvay Process
В 1861 году бельгийский промышленный химик Эрнест Солвей разработал метод превращения хлорида натрия в карбонат натрия с использованием аммиака. Процесс Solvay был сосредоточен вокруг большой полой башни. На дне карбонат кальция (известняк) нагревали для выделения углекислого газа:
Процесс Solvay был сосредоточен вокруг большой полой башни. На дне карбонат кальция (известняк) нагревали для выделения углекислого газа:
CaCO3 → CaO + CO2
Сверху в башню поступал концентрированный раствор хлорида натрия и аммиака. Когда углекислый газ барботировал через него, бикарбонат натрия выпадал в осадок:
NaCl + Nh4 + CO2 + h3O → NaHCO3 + Nh5Cl
Бикарбонат натрия затем превращался в карбонат натрия при нагревании с выделением воды и углекислого газа:
2 NaHCO3 → Na2CO3 + h3O + CO2
Тем временем аммиак регенерировали из побочного продукта хлорида аммония, обрабатывая его известью (гидроксид кальция), оставшейся от образования углекислого газа:
CaO + h3O → Ca(OH)2
Ca(OH)2 + 2 Nh5Cl→CaCl2 + 2 Nh4 + 2 h3O
Поскольку в процессе Solvay используется рециркуляция аммиака, он потребляет только рассол и известняк и содержит хлорид кальция как его единственный продукт жизнедеятельности. Это сделало его значительно более экономичным, чем процесс Леблана, и вскоре он стал доминировать в мировом производстве карбоната натрия. К 1900 году 90% карбоната натрия производилось по процессу Сольве, а последний технологический завод Леблана закрылся в начале 1920-х годов.
К 1900 году 90% карбоната натрия производилось по процессу Сольве, а последний технологический завод Леблана закрылся в начале 1920-х годов.
Процесс Хоу
Разработан китайским химиком Хоу Дебангом в 1930-х годах. Это то же самое, что и процесс Solvay в первых нескольких шагах. Но вместо обработки оставшегося раствора известью в раствор закачивают углекислый газ и аммиак и добавляют хлорид натрия до насыщения при 40°С. Затем раствор охлаждают до 10°С. Хлорид аммония выпадает в осадок и удаляется. путем фильтрации раствор повторно используется для получения большего количества бикарбоната натрия. Процесс Хоу исключает производство хлорида кальция, а побочный продукт хлорид аммония можно использовать в качестве удобрения. Процесс Хоу является наиболее распространенным в мире процессом производства карбоната натрия 9.0003
Карбонат натрия- 25 фунтов
Продукт SDS Лист
Карбонат натрия (содовая пепела)
Из Википедии, свободная энциклопедия
Карбонат натрия (также известная как . ), Na2CO3, представляет собой натриевую соль угольной кислоты. Чаще всего он встречается в виде кристаллического гептагидрата, который легко выцветает с образованием белого порошка, моногидрата. Он имеет охлаждающий щелочной вкус и может быть извлечен из пепла многих растений. Он синтетически производится в больших количествах из поваренной соли в процессе, известном как процесс Solvay.
), Na2CO3, представляет собой натриевую соль угольной кислоты. Чаще всего он встречается в виде кристаллического гептагидрата, который легко выцветает с образованием белого порошка, моногидрата. Он имеет охлаждающий щелочной вкус и может быть извлечен из пепла многих растений. Он синтетически производится в больших количествах из поваренной соли в процессе, известном как процесс Solvay.
Применение
- Наиболее важным применением карбоната натрия является химический состав стекла. При нагревании до очень высоких температур в сочетании с песком (SiO2) и карбонатом кальция (CaCO3) и очень быстром охлаждении карбонат натрия можно использовать для образования прозрачного некристаллического материала, широко известного как стекло.
- В химии карбонат натрия часто используется в качестве электролита. Это связано с тем, что электролиты обычно основаны на соли, а карбонат натрия действует как очень хороший проводник в процессе электролиза.
- В быту используется для смягчения воды при стирке.
 Он конкурирует с ионами магния и кальция в жесткой воде и предотвращает их связывание с используемым моющим средством. Без использования соды для стирки требуется дополнительное моющее средство для впитывания ионов магния и кальция. Называемый стиральной содой или Sal Soda в отделе моющих средств в магазинах, он эффективно удаляет масляные, жировые и спиртовые пятна. Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.
Он конкурирует с ионами магния и кальция в жесткой воде и предотвращает их связывание с используемым моющим средством. Без использования соды для стирки требуется дополнительное моющее средство для впитывания ионов магния и кальция. Называемый стиральной содой или Sal Soda в отделе моющих средств в магазинах, он эффективно удаляет масляные, жировые и спиртовые пятна. Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д. - Карбонат натрия широко используется в фотографических процессах в качестве регулятора pH для поддержания стабильных щелочных условий, необходимых для действия большинства проявляющих агентов.
- Карбонат натрия также используется в кирпичной промышленности в качестве смачивающего агента для уменьшения количества воды, необходимой для экструзии глины. Кальцинированная сода
- также является распространенной добавкой в муниципальных бассейнах, используемой для нейтрализации кислотного воздействия хлора и повышения pH.

- При литье моногидрат карбоната натрия называется «связующим веществом» и используется для прилипания влажного альгината к гелеобразному альгинату.
- Карбонат натрия часто используется в качестве основного стандарта для кислотно-щелочного титрования, поскольку он является твердым и стабильным на воздухе, что облегчает точное взвешивание.
Распространение
Карбонат натрия растворим в воде, но может встречаться естественным образом в засушливых регионах, особенно в месторождениях полезных ископаемых (эвапоритах), образующихся при испарении сезонных озер. Месторождения минерального натрона, представляющего собой комбинацию карбоната натрия и бикарбоната натрия, добывались на дне высохших озер в Египте с древних времен, когда натрон использовался для изготовления мумий и в раннем производстве стекла. Карбонат натрия имеет три известные формы гидратов: декагидрат карбоната натрия, гептагидрат карбоната натрия и моногидрат карбоната натрия.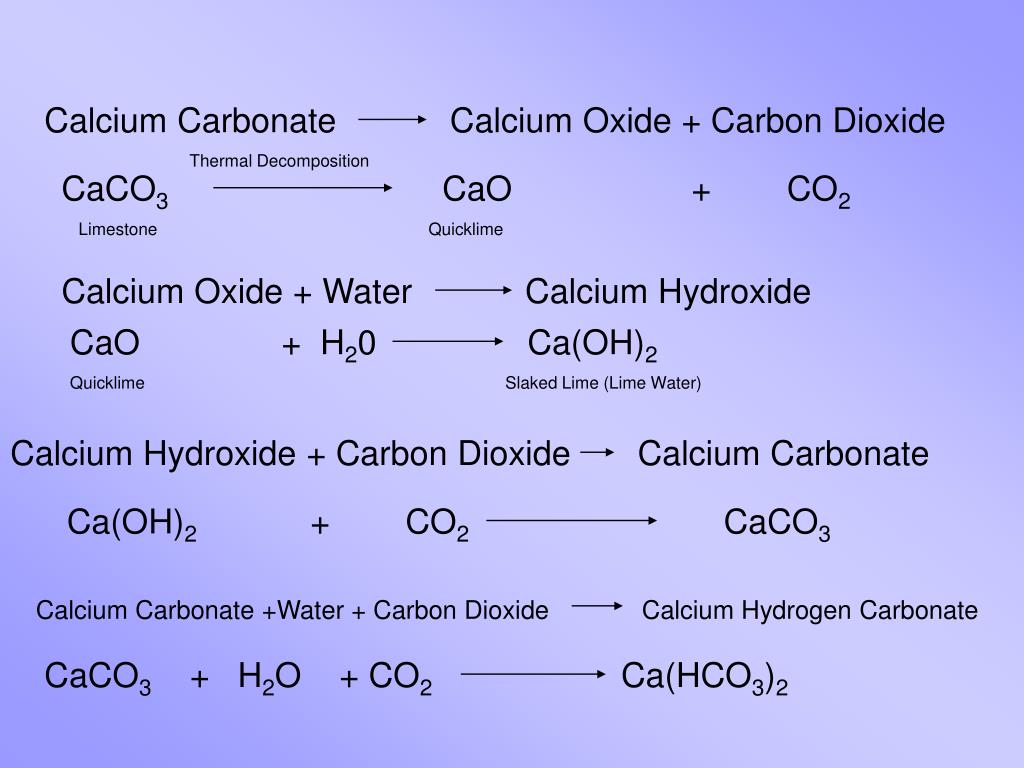
Производство
Горнодобывающая промышленность
Трона, гидратированный бикарбонат натрия (Na3HCO3CO3·2h3O), добывается в нескольких районах Соединенных Штатов и обеспечивает почти весь отечественный карбонат натрия. Крупные естественные месторождения, обнаруженные в 1938 году у реки Грин, штат Вайоминг, сделали добычу полезных ископаемых более экономичной, чем промышленное производство в Северной Америке.
Его также добывают из некоторых щелочных озер, таких как озеро Магади в Кении, с помощью основного процесса дноуглубительных работ, и он также самовосстанавливается, поэтому никогда не иссякнет в своем естественном источнике.
Барилла и водоросли
Ряд «галофитных» (солеустойчивых) видов растений и видов морских водорослей могут быть переработаны в нечистую форму карбоната натрия, и эти источники преобладали в Европе и других местах до начала 19 века. Наземные растения или водоросли собирали, сушили и сжигали. Затем пепел «выщелачивали» (промывали водой) с образованием раствора щелочи. Этот раствор выпаривали, чтобы получить конечный продукт, который получил название «кальцинированная сода». это очень старое название относится к архетипическому растительному источнику кальцинированной соды, которым был небольшой однолетний кустарник Salsola soda («растение барилла»).
Затем пепел «выщелачивали» (промывали водой) с образованием раствора щелочи. Этот раствор выпаривали, чтобы получить конечный продукт, который получил название «кальцинированная сода». это очень старое название относится к архетипическому растительному источнику кальцинированной соды, которым был небольшой однолетний кустарник Salsola soda («растение барилла»).
Концентрация карбоната натрия в кальцинированной соде варьировалась в очень широких пределах: от 2-3% для формы, полученной из морских водорослей («ламинарии»), до 30% для лучшей бариллы, полученной из галофитных растений в Испании. Источники растений и морских водорослей для кальцинированной соды, а также родственной щелочи «калий» становились все более неадекватными к концу 18-го века, и поиск коммерчески жизнеспособных способов синтеза кальцинированной соды из соли и других химических веществ усилился.
Процесс Леблана
В 1791 французский химик Николя Леблан запатентовал процесс получения карбоната натрия из соли, серной кислоты, известняка и угля. Сначала морскую соль (хлорид натрия) кипятили в серной кислоте с получением сульфата натрия и газообразного хлористого водорода в соответствии с химическим уравнением
Сначала морскую соль (хлорид натрия) кипятили в серной кислоте с получением сульфата натрия и газообразного хлористого водорода в соответствии с химическим уравнением
2 NaCl + h3SO4 → Na2SO4 + 2 HCl
Затем сульфат натрия смешивали с измельченным известняком. (карбонат кальция) и уголь, и смесь сжигалась, образуя карбонат натрия вместе с диоксидом углерода и сульфидом кальция.
Na2SO4 + CaCO3 + 2 C → Na2CO3 + 2 CO2 + CaS
Карбонат натрия экстрагировали из золы водой, а затем собирали, позволяя воде испариться.
Соляная кислота, полученная в процессе Леблана, была основным источником загрязнения воздуха, а побочный продукт сульфид кальция также создавал проблемы с утилизацией отходов. Однако он оставался основным методом производства карбоната натрия до конца 1880-х годов.
Solvay Process
В 1861 году бельгийский промышленный химик Эрнест Солвей разработал метод превращения хлорида натрия в карбонат натрия с использованием аммиака. Процесс Solvay был сосредоточен вокруг большой полой башни. На дне карбонат кальция (известняк) нагревали для выделения углекислого газа:
Процесс Solvay был сосредоточен вокруг большой полой башни. На дне карбонат кальция (известняк) нагревали для выделения углекислого газа:
CaCO3 → CaO + CO2
Сверху в башню поступал концентрированный раствор хлорида натрия и аммиака. Когда углекислый газ барботировал через него, бикарбонат натрия выпадал в осадок:
NaCl + Nh4 + CO2 + h3O → NaHCO3 + Nh5Cl
Бикарбонат натрия затем превращался в карбонат натрия при нагревании с выделением воды и углекислого газа:
2 NaHCO3 → Na2CO3 + h3O + CO2
Тем временем аммиак регенерировали из побочного продукта хлорида аммония, обрабатывая его известью (гидроксид кальция), оставшейся от образования углекислого газа:
CaO + h3O → Ca(OH)2
Ca(OH)2 + 2 Nh5Cl→CaCl2 + 2 Nh4 + 2 h3O
Поскольку в процессе Solvay используется рециркуляция аммиака, он потребляет только рассол и известняк и содержит хлорид кальция как его единственный продукт жизнедеятельности. Это сделало его значительно более экономичным, чем процесс Леблана, и вскоре он стал доминировать в мировом производстве карбоната натрия.



 Он конкурирует с ионами магния и кальция в жесткой воде и предотвращает их связывание с используемым моющим средством. Без использования соды для стирки требуется дополнительное моющее средство для впитывания ионов магния и кальция. Называемый стиральной содой или Sal Soda в отделе моющих средств в магазинах, он эффективно удаляет масляные, жировые и спиртовые пятна. Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.
Он конкурирует с ионами магния и кальция в жесткой воде и предотвращает их связывание с используемым моющим средством. Без использования соды для стирки требуется дополнительное моющее средство для впитывания ионов магния и кальция. Называемый стиральной содой или Sal Soda в отделе моющих средств в магазинах, он эффективно удаляет масляные, жировые и спиртовые пятна. Карбонат натрия также используется в качестве средства для удаления накипи в бойлерах, таких как кофейники, эспрессо-машины и т. д.