Калия хлорид — описание вещества, фармакология, применение, противопоказания, формула
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Калия хлорид
- Брутто формула
- Фармакологическая группа вещества Калия хлорид
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Калия хлорид
- Противопоказания
- Применение при беременности и кормлении грудью
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Калия хлорид
Структурная формула
Русское название
Калия хлорид
Английское название
Potassium chloride
Латинское название вещества Калия хлорид
Kalii chloridum (род. Kalii chloridi)
Kalii chloridi)
Брутто формула
KCl
Фармакологическая группа вещества Калия хлорид
Макро- и микроэлементы
Нозологическая классификация
Список кодов МКБ-10
- E87.6 Гипокалиемия
- T46.0 Отравление сердечными гликозидами и препаратами аналогичного действия
- I49.9 Нарушение сердечного ритма неуточненное
Код CAS
7447-40-7
Фармакологическое действие
Фармакологическое действие — восполняющее дефицит калия, нормализующее КЩС.
Характеристика
Бесцветные кристаллы или белый гранулированный порошок без запаха, соленый на вкус. Растворим в воде (1:3), нерастворим в спирте.
Фармакология
Активирует многие цитоплазматические ферменты, регулирует внутриклеточное осмотическое давление, синтез белка, транспорт аминокислот, проведение нервных импульсов, сокращение скелетных мышц. Ионы калия вызывают урежение ЧСС, снижают сократительную активность, уменьшают проводимость, автоматизм и возбудимость миокарда. В малых дозах они расширяют коронарные сосуды, в больших — суживают. Калий способствует повышению содержания ацетилхолина и возбуждению симпатического отдела ЦНС. Оказывает умеренное диуретическое действие. Увеличение уровня калия снижает риск развития токсического действия сердечных гликозидов на сердце.
Из таблеток ретард калий постепенно и медленно высвобождается на всем протяжении ЖКТ. Калия хлорид после приема внутрь легко и практически в любом количестве пассивно абсорбируется, т. к. его концентрация (как пищевого, так и освобожденного из лекарственных форм) выше в просвете тонкой кишки, чем в крови. В подвздошной и толстой кишках калий выделяется в просвет кишок по принципу сопряженного обмена с ионами натрия и выводится с фекалиями (10%). Распределение калия в организме продолжается около 8 ч с момента приема: 1/2″>T1/2 в фазе абсорбции — 1,31 ч; время высвобождения из таблеток (ретард) соответствует 5 таким периодам — 6 ч.
к. его концентрация (как пищевого, так и освобожденного из лекарственных форм) выше в просвете тонкой кишки, чем в крови. В подвздошной и толстой кишках калий выделяется в просвет кишок по принципу сопряженного обмена с ионами натрия и выводится с фекалиями (10%). Распределение калия в организме продолжается около 8 ч с момента приема: 1/2″>T1/2 в фазе абсорбции — 1,31 ч; время высвобождения из таблеток (ретард) соответствует 5 таким периодам — 6 ч.
Применение вещества Калия хлорид
Гипокалиемия (в т.ч. на фоне сахарного диабета, длительной диареи и/или рвоты, терапии гипотензивными средствами, некоторыми диуретиками, глюкокортикоидами), лечение и профилактика дигиталисной интоксикации, профилактика аритмии у больных с острым инфарктом миокарда.
Противопоказания
Гиперчувствительность, острая и хроническая почечная недостаточность, полная блокада сердца, лечение калийсберегающими диуретиками, гиперкалиемия, метаболические нарушения (ацидоз, гиповолемия с гипонатриемией), заболевания ЖКТ в стадии обострения, возраст до 18 лет (эффективность и безопасность не установлены).
Применение при беременности и кормлении грудью
При необходимости применения при беременности следует сопоставить ожидаемую пользу для матери и потенциальный риск для плода.
Категория действия на плод по FDA — C.
На время лечения следует прекратить грудное вскармливание.
Побочные действия вещества Калия хлорид
Со стороны органов ЖКТ: тошнота, рвота, диарея, метеоризм, боль в животе, изъязвления слизистой оболочки ЖКТ, кровотечения, перфорация и непроходимость кишечника.
Со стороны нервной системы и органов чувств: парестезия, миастения, спутанность сознания.
Прочие: гиперкалиемия, снижение АД, аллергические реакции.
Взаимодействие
Калийсберегающие диуретики (в т.ч. спиронолактон, триамтерен, амилорид), НПВС, ингибиторы АПФ (в т.ч. каптоприл, эналаприл) повышают вероятность развития гиперкалиемии.
Передозировка
Симптомы: гиперкалиемия (мышечный гипотонус, парестезия, замедление AV проводимости, аритмия, остановка сердца). Ранние клинические признаки гиперкалиемии обычно появляются при концентрации K
Ранние клинические признаки гиперкалиемии обычно появляются при концентрации K
Лечение: внутрь или в/в — раствор натрия хлорида; при необходимости — гемодиализ и перитонеальный диализ.
Способ применения и дозы
Внутрь, в/в. Дозу и схему лечения устанавливают индивидуально в зависимости от показаний и концентрации K+ в крови. При тяжелых интоксикациях вводят в/в.
Меры предосторожности
С осторожностью назначают пациентам с нарушением AV проводимости. Во время лечения необходимо контролировать содержание K+ в сыворотке крови, ЭКГ, КЩС. Диета с большим содержанием натрия хлорида увеличивает выведение калия из организма.
Следует учитывать, что гиперкалиемия, приводящая к летальному исходу, может развиваться быстро и протекать бессимптомно.
Торговые названия с действующим веществом Калия хлорид
Сбросить фильтры
Лек. форма Все лек. формы концентрат для приготовления раствора для инфузий концентрат для приготовления раствора для инфузий и приема внутрь раствор для внутривенного введения субстанция-порошок
Дозировка Все дозировки 150 мг/мл 30 мг/мл 40 мг/мл 75 мг/мл Без дозировки
Производитель Все производители Армавирская биофабрика ФКП Армавирская биологическая фабрика ФГУП Биннофарм АО Биннофарм ЗАО Биосинтез ОАО Биосинтез ПАО Велфарм ООО Востоквит Гротекс ООО Дальхимфарм К+С КАЛИ ГмбХ Макко Органикс с.р.о. Микроген НПО ФГУП (Аллерген) Микроген НПО ФГУП (НПО «Вирион») Михайловский завод химических реактивов Мосхимфармпрепараты им. Н.А. Семашко Новосибхимфарм АО Новосибхимфарм ОАО Обновление ПФК АО Обновление ПФК ЗАО Озон ООО Славянская аптека ООО Усолье-Сибирский ХФЗ АО Эском НПК ОАО
Калия хлорид (Е508) — МЗХР
Оптовые поставки хлорида калия E508
Наше предприятие предлагает оптовые поставки хлорида калия (KCl) в виде кристаллического порошка в мешках, от 1 т. Мы работаем со всеми регионами Росcии, СНГ и мира, возможны поставки на экспорт в Казахстан, Белоруссию, Армению и другие страны АТР региона. Производство на нашем химическом заводе в Алтайском крае обеспечивает бесперебойное производство вот уже несколько десятков лет, и мы уверены что Вы найдете в нашем лице надежного поставщика пищевых добавок, минеральных удобрений, химические реактивы, а так же химические вещества для использования в фармацевтической индустрии.
Мы работаем со всеми регионами Росcии, СНГ и мира, возможны поставки на экспорт в Казахстан, Белоруссию, Армению и другие страны АТР региона. Производство на нашем химическом заводе в Алтайском крае обеспечивает бесперебойное производство вот уже несколько десятков лет, и мы уверены что Вы найдете в нашем лице надежного поставщика пищевых добавок, минеральных удобрений, химические реактивы, а так же химические вещества для использования в фармацевтической индустрии.
Свойства хлорида калия
Хлорид калия KCl — это неорганическое химическое вещество, встречающееся в природе в виде различных минералов. Альтернативное его название — хлористый калий. Например он входит в состав сильвина который можно найти в соляных озерах и легкорастворимого в воде карналлита. В чистом виде он представляет из себя белое вещество в виде кристаллов, без запаха, и очень хорошо растворимое в воде.
| Систематическое наименование | хлорид калия |
|---|---|
| Традиционные названия | хлористый калий |
Хим. | KCl |
| Физические свойства | |
| Молярная масса | 74,555 г/моль |
| Плотность | 1,984 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 776 °C |
| • кипения | 1407 °C |
| Мол. теплоёмк. | 51,30 Дж/(моль·К) |
| Химические свойства | |
| Растворимость | |
| • в воде при 0 °C | 28,1 г/100 мл |
| • в воде при 20 °C | 34,0 г/100 мл |
| • в воде при 100 °C | 56,7 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7447-40-7 |
| PubChem | 4873 |
| Рег. номер EINECS | 231-211-8 |
| >SMILES | |
| InChI | |
| Кодекс Алиментариус | E508 |
| RTECS | TS8050000 |
| ChEBI | 32588 |
| ChemSpider | 4707 |
| Безопасность | |
| ЛД50 | 2600 мг/кг |
| Токсичность | малотоксичен |
| NFPA 704 | |
| Показатели качества | ||
| Наименование показателя | Требования ТУ | |
| 1 | Внешний вид | белый кристаллический порошок |
| 2 | Массовая доля хлористого калия (КСl) в прокаленном препарате, %, не менее | 99,0 |
| 3 | Массовая доля потерь при прокаливании, %, не более | 0,8 |
Скачать показатели качества
Download quality indicators
Транспортировка
Наш завод предоставляет два года гарантии на соответствие требованиям предъявляемым при хранении вещества в рекомендуемых условиях, при правильной транспортировке и хранении.
Так как Железо (III) оксид для катализаторов требует к себе особого внимания при транспортировке, то нужно отнестись к его упаковке с особой тщательностью. Наша компания может организовать его упаковку по ГОСТ. Поэтому на нашем химическом заводе готовое вещество упаковывается в прочные полиэтиленовые мешки, соответствующие стандартам. На выбор покупателя, так же возможна упаковка этого вещества в бумажные пяти-шести-слойные мешки.
Получение
В лабораторных условиях это вещество можно получить если соединить гидроксида калия и соляную кислоту. Но основной метод его получения гиллургией и флотацией из минералов сильвинита.
Если посмотреть на температуру при которой вещества KCl и NaCl лучше всего растворяются, то можно увидеть что у хлорида калия, с повышением температуры, начинает повышаться гигроскопичность, т. е. растворимость. В то время как NaCl сохраняет свои свойства при нагреве.
youtube.com/embed/z4dAPKKXQ88″/>Именно это свойство и используется в методе галургического метода. Минералы нагреваются, и более растворимое вещество, в данном случае KCl растворяется, а твердые частицы NaCl изымаются из раствора механическим способом, например его можно профильтровать.
После этого прозрачные или белые кристаллы хлорида калия оседают на центрифуге, попутно сушатся, после чего их снимают, т.о. у нас получается требуемое вещество калия хлорид. А оставшийся раствор опять смешивают с уже новой партией сальнивита и процедура повторяется вновь.
Ну а второй метод добычи калия хлорида будет заключаться во флотации. Этот способ рассчитан на то что вещества по разному улавливаются в в водной среде при переходе минералов измельченной руды из твердого состояния в жидко-образное. На границе фаз KCl легко отделяет от основного минерала, таким способом его здесь улавливают и отделяют.
Применение
В фармакологии и медицине
Так как калий является основным веществом играющим важнейшую роль в функционировании организма человека, в частности — он задействован в обмене веществ (как внутриклеточный ион), то конечно медицина не оставила без внимания данный химический элемент. Например его вводят пациентам с проблемами в сердце, для нормализации сердечного ритма или просто для восстановления калия в организме.
Например его вводят пациентам с проблемами в сердце, для нормализации сердечного ритма или просто для восстановления калия в организме.
В сельском хозяйстве
Именно калия хлорид фермеры приобретают в большом количестве, в основном как калийное удобрение, которое вообще является одним из самых популярных минеральных удобрений в мире. Удобрения на основе калия улучшают урожайность, качественные характеристики сельхоз культур, повышают устойчивость к болезням и даже улучшают вкусовые показатели плодов.
В пищевой промышленности
Калия хлорид иногда используется как пищевая добавка к поваренной соли под условным номерным обозначением — Е508, для понижения содержания натрия. При соединении этих двух веществ получается соль с малым содержанием натрия, отчего ее иногда используют как заменитель соли. Так же она используется как пищевой эмульгатор и стабилизатор при производстве сгущенного молока, сливок, сухого молока и сухих сливок. Так же иногда используется как питательная среда для дрожжевых культур; желирующего агента, придающего необходимую консистенцию; антислёживающего агента (антикомкователь) продуктов питания.
Другие виды применения
Благодаря свойствам стабилизатора, KCl так же нашел применение в косметической отрасли, в частности при производстве различных кремов.
Меры предосторожности при обращении с веществом
Хлорид калия E508 является по классификации безопасности химических веществ по воздействию на человека — как умеренно опасным. При попадании на кожу и глаза может вызвать раздражение. Так же при неправильном обращении или хранении, может представлять угрозу для окружающей среды.
Приглашаем к сотрудничеству
Приобрести любую оптовую партию хлорида калия (добавка E508) можно просто позвонив нашим менеджерам. Мы согласуем с Вами удобный вид доставки и набор документов которые потребуются для транспортировки вещества и его дальнейшего применения на вашем производстве. Обратите внимание, у нас можно приобрести так же и чистый калия хлорид.
Krisanalyt — Калий хлористый
Калий хлористыйХимическое соединение, формула KCl, калиевая соль соляной кислоты. Образует белое кристаллическое вещество без запаха. Относится к структурному типу NaCl.
Образует белое кристаллическое вещество без запаха. Относится к структурному типу NaCl.
Применение: В медицине — нормализующее кислотно-щелочное состояние, восполняющее дефицит калия. Активирует многие цитоплазматические ферменты, регулирует внутриклеточное осмотическое давление, синтез белка, транспорт аминокислот, проведение нервных импульсов, сокращение скелетных мышц. В сельском хозяйстве, технике и др. — хлорид калия является наиболее распространённым калийным удобрением. Согласно ГОСТ 4568-95 1-й сорт содержит не менее 60 % K2O, 2-й сорт — не менее 58 % K2O и воды не более 0,5 %. Применяется для производства гидроксида калия методом электролиза. Иногда применяется в качестве добавки (E508) к поваренной соли (так называемая «соль с пониженным содержанием натрия»).При ремонте скважин, раствор хлорида калия используют в качестве бурового раствора. На кристаллах хлорида калия возможно формирование голограмм. В ряде штатов США используется в качестве инъекции при смертной казни.
|
№ п/п |
Наименование показателя |
Требования ГОСТ |
Результаты анализа |
|
1 |
Массовая доля хлористого калия (KCl) в прокаленном препарате, %, не менее |
99,8 |
99,8 |
|
2 |
Массовая доля нерастворимых в воде веществ, %, не более |
0,005 |
0,003 |
|
3 |
Массовая доля потерь при прокаливании, %, не более |
0,5 |
0,46 |
|
4 |
Массовая доля свободных кислот (НСI), %, не более |
0,002 |
0,001 |
|
5 |
Массовая доля свободных щелочей (КОН), %, не более |
0,003 |
0,003 |
|
6 |
Массовая доля общего азота (N), %, не более |
0,0005 |
0,0004 |
|
7 |
Массовая доля сульфатов (SO4) , %, не более |
0,002 |
0,002 |
|
8 |
Массовая доля фосфатов (РО4) , %, не более |
0,0005 |
0,0004 |
|
9 |
Массовая доля хлоратов и нитратов (СIO3) , %, не более |
0,0012 |
0,0010 |
|
10 |
Массовая доля бария (Ва), %, не более |
0,001 |
0,0005 |
|
11 |
Массовая доля железа (Fe), %, не более |
0,0001 |
Менее 0,0001 |
|
12 |
Массовая доля магния (Мg), %, не более |
0,0005 |
Менее 0,0005 |
|
13 |
Массовая доля мышьяка (As), %, не более |
0,00004 |
Менее 0,00004 |
|
14 |
Массовая доля тяжелых металлов (РЬ), %, не более |
0,0005 |
Менее 0,0005 |
|
15 |
Массовая доля натрия (Na), %, не более |
0,2 |
0,16 |
|
16 |
Массовая доля кальция (Са), %, не более |
0,001 |
0,0005 |
Гарантийный срок хранения — 3 года.
[Хлорид калия]
Общедоступный Опубликовано 2017
- EintragstypEntry Type
- Chemical Compound
- EintragsspracheEntry Language
- EnglischEnglish
- SchlagwortKeyword
- Химическое соединение; Хлорид калия
- ИнЧИ
- ИнХИ=1S/ClH.K/h2H;/q;+1/p-1; WCXLLCKVVCTQ-UHFFFAOYSA-M
| Имя ИЮПАК | хлорид калия |
| Альтернативные имена | хлорид калия |
| Молекулярная формула | KCl |
| Молярная масса | 74,548 г/моль |
| ИнЧИ | InChI=1S/ClH. K/h2H;/q;+1/p-1 K/h2H;/q;+1/p-1 |
| Ключ ИнЧИ | WCUXLLCKKVVCTQ-UHFFFAOYSA-M |
| Номер КАС 7447-40-7 | |
| PubChem Идентификационный номер 4873 | |
Калий хлорид
Источник: Национальный центр биотехнологической информации. База данных соединений PubChem; CID=4873, https://pubchem.ncbi.nlm.nih.gov/compound/4873
Дополнительную информацию см. на сайте PubChem Compound. База данных
Найти в базе данных IUPAC
Выпуск 93/2021
Возможность многофункциональности Калибровка H+-чувствительных стеклянных электродов в морской воде
Выпуск 91/2019
Опыты по адсорбции при Поверхности оксидов металлов с ослабленным полным отражением в инфракрасном диапазоне Спектроскопия (Atrirs) (Технический отчет IUPAC)
Выпуск 81/2009
Соленость
Выпуск 80/2008
Соленость
Выпуск 75/2003
Критическая оценка Константы стабильности комплексов альфа-гидроксикарбоновых кислот с Протоны и ионы металлов и сопутствующие изменения энтальпии.
 Часть II.
Алифатические 2-гидроксикарбоновые кислоты
Часть II.
Алифатические 2-гидроксикарбоновые кислоты
Выпуск 74/2002
Очистка сточных вод
Измерение Ph. Определение, стандарты и процедуры
Выпуск 73/2001
Стандарты изотермического Микрокалориметрия
Первичный на основе моляльности Стандарты электролитической проводимости
Выпуск 71/1999
окислительно-восстановительные реакции урана, Нептуний и плутоний в кислых водных растворах.
 Полярография или вольтамперометрия
Полярография или вольтамперометрия
Выпуск 70/1998
Определение Меркурия Виды в экологических и биологических пробах
Выпуск 65/1993
Профили обнаружения Трансфермиум Элементы
Рекомендуемые процедуры для Калибровка ионоселективных электродов
Выпуск 62/1990
2,2,2-трифторэтанол
Выпуск 61/1989
Анализ натрия и калия Пищевые продукты и биологические субстраты методом атомно-абсорбционной спектроскопии (ААС)
Определение рН в высокотемпературных Соленые воды
Выпуск 57/1985
Определение шкал pH, Стандартные справочные значения, измерение pH и связанные с ними Терминология
Рекомендуемые методы для Очистка растворителей и тесты на примеси: метанол и Этиловый спирт
Процедуры тестирования pH Чувствительные стеклянные электроды при 25, 37, 65 и 85°С и определение Щелочные ошибки до 1 моль дм-3 Na+, K+, Li+
Выпуск 56/1984
Первичные алкил- и Ариламины и N-аминокислоты (флуориметрия)
Выпуск 55/1983
Определение шкал pH, Стандартные справочные значения, измерение pH и связанные с ними Терминология
Выпуск 54/1982
Щелочные мыла 4.
 331
Определение содержания эдта (секвестрирующего агента) (титриметрический
Метод)
331
Определение содержания эдта (секвестрирующего агента) (титриметрический
Метод)Щелочные мыла 4.322 Определение содержания хлоридов (потенциометрический метод)
Выпуск 53/1981
Рекомендуемый справочник Материалы для реализации физико-химических свойств. Раздел: Электролитическая проводимость
Выпуск 51/1979
Обзор методов для Определение нелетучих нитрозаминов в пищевых продуктах
21-гидрокси-20-кетостероиды (Колориметрия)
Выпуск 50/1978
Шкала рН Соединенных Штатов царство
Шкалы ионной активности Соединенные Штаты Америки
Выпуск 49/1977
Полярографическая полуволна Возможности неорганических веществ в N,N’-диметилформамиде как Растворитель
Выпуск 48/1976
Магнитный Восприимчивость
Молярная проводимость
Выпуск 45/1976
Статус Фарадея Константа как аналитический стандарт
Выпуск 41/1975
Общие аспекты трассировки Аналитические методы I.
 Методы калибровки в следовом анализе
Методы калибровки в следовом анализе
Выпуск 40/1974
Энтальпия
Выпуск 37/1974
Подход к традиционным Шкалы ионной активности для стандартизации ионоселективных Электроды
Выпуск 29/1972
Молярная проводимость
Выпуск 28/1971
Кристаллические фазы Переменная композиция
Выпуск 26/1971
Критический список Трейсеры
Выпуск 18/1969
Практическое измерение pH в амфипротных и смешанных растворителях
Выпуск 1/1960
Константы диссоциации Органические кислоты в водном растворе
- Название
- Химические соединения
- VerlagPublisher
- 2016
Запись в базе данных [Хлорид калия]
- МДА
- АПА
- Гарвард
- Чикаго
- Ванкувер
Скопировано в буфер обмена
Дополнительные материалы
Пожалуйста, войдите или зарегистрируйтесь в De Gruyter, чтобы заказать этот продукт.
ВойтиРегистрация
Спирт — Sciencemadness Wiki
Спирты — это органические соединения, которые содержат гидроксильную функциональную группу (-ОН), связанную с насыщенным атомом углерода.
Содержание
- 1 Типы спиртов
- 2 Номенклатура
- 2.1 Систематические названия
- 2.2 Общие названия
- 3 Физические и химические свойства
- 4 приложения
- 5 Подготовка
- 6 реакций
- 6.1 Окисление
- 6.2 Этерификация
- 6.3 Обезвоживание
- 6.4 Депротонирование
- 6.5 Нуклеофильное замещение
- 7 Безопасность
- 7.1 Токсичность
- 8 ссылок
- 8.1 Соответствующие темы Sciencemadness
Типы спиртов
Спирты делятся по типу атома углерода, с которым связана гидроксильная функциональная группа:
- Первичные спирты
- Первичные спирты — это спирты, в которых атом углерода, связанный с функциональной гидроксильной группой, связан только с одним другим атомом углерода.

- Первичные спирты сначала окисляются до альдегидов, затем до карбоновых кислот.
- Первичные спирты — это спирты, в которых атом углерода, связанный с функциональной гидроксильной группой, связан только с одним другим атомом углерода.
- Вторичные спирты
- Вторичные спирты — это спирты, в которых атом углерода, связанный с гидроксильной функциональной группой, связан с двумя другими атомами углерода.
- Вторичные спирты окисляются до кетонов.
- Третичные спирты
- Третичные спирты – это спирты, в которых атом углерода, связанный с функциональной гидроксильной группой, связан с тремя другими атомами углерода.
- Третичные спирты не окисляются.
Номенклатура
Систематические названия
Общие названия
| Химическая формула | Имя ИЮПАК | Обычное имя |
|---|---|---|
| Одноатомные спирты | ||
| CH 3 ОН | Метанол | Древесный спирт |
| С 2 Н 5 ОХ | Этанол | Алкоголь |
| С 3 Н 7 ОХ | 2-пропанол | Медицинский спирт |
| С 4 Н 9 ОХ | 1-бутанол | Бутанол |
| С 5 Н 11 ОХ | 1-пентанол | Амиловый спирт |
| С 16 Н 33 ОХ | Гексадекан-1-ол | Спирт цетиловый |
| Многоатомные спирты | ||
| С 2 Н 4 (ОН) 2 | Этан-1,2-диол | Этиленгликоль |
| С 3 Н 6 (ОН) 2 | Пропан-1,2-диол | Пропиленгликоль |
| С 3 Н 5 (ОН) 3 | Пропан-1,2,3-триол | Глицерин |
| С 4 Н 6 (ОН) 4 | Бутан-1,2,3,4-тетраол | Эритрит, Треитол |
| С 5 Н 7 (ОН) 5 | Пентан-1,2,3,4,5-пентол | Ксилит |
| С 6 Н 8 (ОН) 6 | Гексан-1,2,3,4,5,6-гексол | Маннит, сорбит |
| С 7 Н 9 (ОН) 7 | Гептан-1,2,3,4,5,6,7-гептол | Волемитол |
| Спирты алифатические ненасыщенные | ||
| С 3 Н 5 ОХ | Проп-2-ен-1-ол | Спирт аллиловый |
| С 10 Н 17 ОХ | 3,7-Диметилокта-2,6-диен-1-ол | Гераниол |
| С 3 Н 3 ОХ | Проп-2-в-1-ол | Спирт пропаргиловый |
| Спирты алициклические | ||
| С 6 Н 6 (ОН) 6 | Циклогексан-1,2,3,4,5,6-гексол | Инозитол |
| С 10 Н 19 ОХ | 2-(2-пропил)-5-метилциклогексан-1-ол | Ментол |
Физические и химические свойства
Области применения
Подготовка
Метанол можно получить деструктивной перегонкой древесины, хотя в этом процессе также образуется формальдегид.
Этанол можно получить путем ферментации сахара.
Реакции
Окисление
Первичные спирты могут быть окислены либо до альдегидов, либо до карбоновых кислот, тогда как окисление вторичных спиртов обычно заканчивается на стадии кетона. Третичные спирты устойчивы к окислению.
Прямое окисление первичных спиртов до карбоновых кислот обычно протекает через соответствующий альдегид, который трансформируется через гидрат альдегида в результате реакции с водой, прежде чем он может быть дополнительно окислен до карбоновой кислоты.
Механизм окисления первичных спиртов в карбоновые кислоты через альдегиды и гидраты альдегидов
Реагенты, используемые для превращения первичных спиртов в альдегиды, обычно также подходят для окисления вторичных спиртов в кетоны. К ним относятся реактив Коллинза и периодинан Десс-Мартина. Непосредственное окисление первичных спиртов до карбоновых кислот можно осуществить с помощью перманганата калия или реактива Джонса.
Этерификация
Этерификация – это реакция спирта с кислотой, в результате которой образуется сложный эфир.
Подробнее на этой странице.
Дегидратация
Дегидратация – это процесс отделения всех молекул воды от спирта. Это делается с помощью дегидратирующего агента, который более гигроскопичен, чем спирт, одним из таких примеров являются щелочные металлы, обезвоженный хлорид кальция или безводный оксид кальция (негашеная известь).
Это также можно сделать с помощью молекулярных сит 3А.
Депротонирование
Депротонирование спиртов супероснованиями или активными металлами дает солеподобные соединения, называемые алкоксидами. Поскольку большинство спиртов являются более слабыми кислотами, чем вода, алкоксиды обычно полностью и необратимо гидролизуются в исходный спирт и гидроксид. Только некоторые алициклические кетоспирты, такие как родизоновая кислота, обладают достаточной кислотностью, чтобы сделать соответствующие алкоксиды устойчивыми в водном растворе.
Нуклеофильное замещение
Безопасность
Токсичность
Метанол ядовит, прием внутрь может привести к слепоте и смерти. Спирты с более длинной цепью, такие как этанол, н-пропанол и изопропанол, гораздо менее токсичны. Низкой токсичностью обладают также высшие спирты, такие как бутанол, пентанол и их изомеры.
За исключением этиленгликоля, большинство полиолов малотоксичны.
Одноатомные спирты могут всасываться через кожу.
Ссылки
- http://en.wikipedia.org/wiki/Alcohol
Соответствующие темы Sciencemadness
- Синтез третичных спиртов с более длинной цепью
- Изготовление этанола в домашних условиях.
Формула хлората калия – структура, свойства, применение, примерные вопросы
6 4с 1 . Принадлежит к четвертому периоду, первой группе, представляет собой серебристо-белый элемент. Его можно найти в природе в виде минералов и соли. Это помогает вашим нервам функционировать, а мышцы сокращаться. Он чаще всего используется для лечения и предотвращения низкого уровня калия. Калий был открыт сэром Хамфри Дэви в 1807 году. Хлор имеет символ Cl. Его атомный номер 17. Электронная конфигурация 1s 9.0818 2 2s 2 2p 6 3s 2 3p 5 . Хлор обычно используется в качестве антисептика для уничтожения бактерий, а также используется для обеспечения безопасности питьевой воды. Хлор используется во многих промышленных процессах, бумажных изделиях, пластмассах, текстиле и лекарствах. Кислород имеет символ O. Его атомный номер равен 8, а его электронная конфигурация 1s 2 2s 2 2p 4 . Он является членом группы халькогенов в периодической таблице. Это двухатомный газ без запаха, цвета и вкуса, состоящий на 21% из атмосферы. Он играет решающую роль в дыхании. Основные области применения кислорода включают рафинирование, плавку и производство стали наряду с другими металлами.
Он чаще всего используется для лечения и предотвращения низкого уровня калия. Калий был открыт сэром Хамфри Дэви в 1807 году. Хлор имеет символ Cl. Его атомный номер 17. Электронная конфигурация 1s 9.0818 2 2s 2 2p 6 3s 2 3p 5 . Хлор обычно используется в качестве антисептика для уничтожения бактерий, а также используется для обеспечения безопасности питьевой воды. Хлор используется во многих промышленных процессах, бумажных изделиях, пластмассах, текстиле и лекарствах. Кислород имеет символ O. Его атомный номер равен 8, а его электронная конфигурация 1s 2 2s 2 2p 4 . Он является членом группы халькогенов в периодической таблице. Это двухатомный газ без запаха, цвета и вкуса, состоящий на 21% из атмосферы. Он играет решающую роль в дыхании. Основные области применения кислорода включают рафинирование, плавку и производство стали наряду с другими металлами.Хлорат калия
Хлорат калия представляет собой неорганическое соединение, которое содержит один атом калия, один атом хлора и три атома кислорода, и его молекулярная формула KCLO 3 .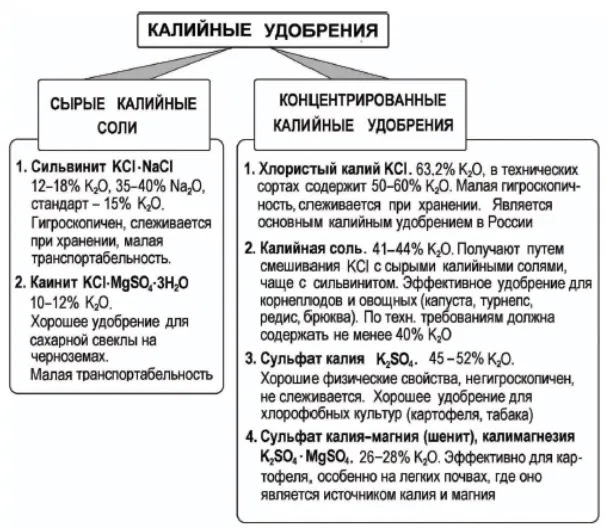 Это сильный окислитель. Он выглядит как белое кристаллическое твердое вещество. В промышленном использовании это второй самый хлорат. Это кристаллическая соль с охлаждающим соленым вкусом, которая используется в ветеринарии в качестве мягкого вяжущего средства. Это более сильный окислитель, чем перхлорат калия. Он широко используется в качестве окислителя в пиротехнике. Хлорат калия обычно изготавливают из бытового отбеливателя и заменителя соли.
Это сильный окислитель. Он выглядит как белое кристаллическое твердое вещество. В промышленном использовании это второй самый хлорат. Это кристаллическая соль с охлаждающим соленым вкусом, которая используется в ветеринарии в качестве мягкого вяжущего средства. Это более сильный окислитель, чем перхлорат калия. Он широко используется в качестве окислителя в пиротехнике. Хлорат калия обычно изготавливают из бытового отбеливателя и заменителя соли.
Структура хлората калия
Хлорат калия представляет собой неорганическое соединение, которое содержит один атом калия, один атом хлора и три атома кислорода, и его молекулярная формула KCLO 3 .
Физические свойства хлората калия
- Хлорат калия имеет молярную массу 122,55 г/мл
- Это плотность 2,34 г/см 3
- .0088
- Температура кипения 356°C
Химические свойства хлората калия
- Хлорат калия представляет собой бесцветное твердое вещество, растворимое в воде различные полярные растворители
- При нагревании в присутствии катализатора диоксида марганца он разлагается с образованием хлорида калия и газообразного кислорода.

2 KCLO 3 ⇢ 2 KCL + 3 O 2
- Хлорат калия реагирует с сахаром в присутствии серной кислоты с выделением большого количества тепловой энергии в виде пурпурного дыма и большого количества дыма .
8 2 OS. 2 2 3 3.C 12 H 22 O 11 + 8 KCLO 3 ⇢ 12 CO 2 + 11 H 2 O + KCL + HEAT
- Хлорат калия используется в качестве окислителя во взрывчатых веществах, спичках, текстильной печати и отбеливателях.
- Используется в фармацевтике и ветеринарии.
- Используется как антисептик и как вяжущее средство.
- Обычно используется в качестве окислителя в пиротехнике.
- Используется для производства газообразного кислорода.
Примеры вопросов
Вопрос 1: Почему хлорат калия используется в спичках?
Ответ:
Головки безопасных спичек изготовлены из окислителей, таких как хлорат калия, с серой, наполнителями и стеклянным порошком.
Сульфид фосфора легко воспламеняется, а затем разлагается с выделением кислорода, что заставляет сульфид фосфора гореть еще сильнее.
Вопрос 2: В чем разница между хлоратом калия и хлоридом калия?
Ответ:
Формула хлората калия Kclo 3 . Формула хлорида калия Kcl. Таким образом, основное отличие состоит в том, что хлорат калия имеет три молекулы в дополнение к иону хлорида. Хлорат калия является окислителем во взрывчатых веществах, спичках, текстильной печати и отбеливателях. Хлорид калия используется в приготовлении пищи
Вопрос 3: Каково использование хлора?
Ответ:
Хлор имеет множество применений. Он используется в качестве отбеливателя при производстве ткани и бумаги. Он используется для дезинфекции воды и является частью процесса обеззараживания сточных вод и промышленных отходов. Хлор растворяется в воде, поэтому его используют в бытовых отбеливателях
Вопрос 4: Каковы факты и области применения кислорода?
Ответ:
Кислород представляет собой двухатомный газ без запаха, цвета и вкуса, состоящий на 21% из атмосферы.

 Часть II.
Алифатические 2-гидроксикарбоновые кислоты
Часть II.
Алифатические 2-гидроксикарбоновые кислоты Полярография или вольтамперометрия
Полярография или вольтамперометрия 331
Определение содержания эдта (секвестрирующего агента) (титриметрический
Метод)
331
Определение содержания эдта (секвестрирующего агента) (титриметрический
Метод) Методы калибровки в следовом анализе
Методы калибровки в следовом анализе

 Сульфид фосфора легко воспламеняется, а затем разлагается с выделением кислорода, что заставляет сульфид фосфора гореть еще сильнее.
Сульфид фосфора легко воспламеняется, а затем разлагается с выделением кислорода, что заставляет сульфид фосфора гореть еще сильнее.