Кальцинированная сода от производителя — АО Альфахимпром
Синонимы, торговые названия:
Натрия карбонат, натриевая соль угольной кислоты, динатрий триоксокарбонат, углекислый натрий
Нормативная документация.
ГОСТ 5100-85
Химическая формула.
Na2CO3
Внешний вид.
Гранулы или порошок белого цвета.
Спецификации.
Норма для марки и сорта | ||||||
Марка А | Марка Б | |||||
Наименование показателя | Высший сорт | Первый сорт | Второй сорт | Высший сорт | Первый сорт | Второй сорт |
1. Внешний вид | Гранулы белого цвета | Порошок белого цвета | ||||
2. Массовая доля углекислого натрия (Na2СОз), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
3. | 98,7 | 98,2 | 98,9 | 98,2 | 97,5 | |
4. Массовая доля потери при прокаливании (при 270-300) °С, %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
5. Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
6. Массовая доля железа в пересчете на Fе2Oз, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
Массовая доля веществ, нерастворимых в воде, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,05 | Не нормируется | 0,04 | 0,05 | Не нормируется |
Насыпная плотность, г/см, не менее | 1,1 | 0,9 | 0,9 | Не нормируется | ||
Гранулометрический состав: | ||||||
Остаток на сите с сеткой № 2К по ГОСТ 6613, %, не более | Не нормируется | 5 | 5 | Не нормируется | ||
Прохождение через сито с сеткой № 1, 25К по ГОСТ 6613, % | 100 | Не нормируется | Не нормируется | |||
Остаток на сите с сеткой № 1К по ГОСТ 6613, %, не более | 3 | То же | Не нормируется | |||
Прохождение через сито с сеткой № 01К по ГОСТ 6613, %, не более | 7 | 15 | 25 | Не нормируется | ||
Магнитные включения размером более 0,25 мм | Отсутствуют | Не нормируется | Не нормируется | |||
Примечания:
- Нормы по показателям 2, 5-8 таблицы даны в пересчете на прокаленное вещество.

- Для производства электровакуумного стекла предназначена техническая кальцинированная сода марки А высшего сорта.
- В технической кальцинированной соде, предназначенной для производства нитрита натрия, используемого для изготовления капролактама, а также производства сульфидных солей, отбеливателей и для обезжиривания деталей в электровакуумной промышленности, массовая доля масел не должна превышать 0,01 %.
- Массовые доли углекислого натрия в непрокаленном продукте и потери при прокаливании технической кальцинированной соды марок А высшего сорта, предназначенного для производства синтетических моющих средств, 1-го и 2-го сортов и Б нормируют на момент отгрузки.
- В кальцинированной соде марки А высшего сорта, предназначенной для производства синтетических моющих средств (CMC) не нормируют массовую долю остатка на сите с сеткой № 01К по ГОСТ 6613.
- По согласованию с потребителем допускается выпуск кальцинированной соды марки Б с нормами по показателям массовая доля углекислого натрия (Na2СО3) -не менее 97 %, массовая доля углекислого натрия в непрокаленном продукте — не менее 94 %, массовая доля потери при прокаливании при 270-300 °С — не более 3, массовая доля хлоридов в пересчете на NaCl — не более 1,5 %, массовая доля железа в пересчете на Fe2О3 — не более 0,03 %.

Применение.
- Широко используется при мыловарении, производстве стиральных и чистящих порошков
- Кальцинированная сода – необходимый ингредиент в составе лако-красочных материалов, в частности эмалей
- Также он применяется для смягчения воды паровых котлов, и вообще уменьшения жёсткости воды;
- Используется для обезжиривания металлов и десульфатизации доменного чугуна;
- Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4 ,NaNO3;
- Может использоваться в сигаретных фильтрах;
- Для приготовления проявителя фотоматериалов;
- В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500.
Кальцинированная сода марки «А» используется в основном для производства электровакуумного стекла.
Кальцинированная сода марки « Б» используется в химической, стекольной и других областях промышленности.
Тара, транспортировка и хранение.

Кальцинированная сода транспортируется в мешках вместимостью 25 кг в соответствии с правилами перевозок, действующими на соответствующем виде транспорта.
Забрать продукт Вы можете самостоятельно либо заказать доставку до Вашего склада/объекта.© АО «АльфаХимПром». Тел/факс: +7 (495) 134-35-24, +7 (495) 665-09-29 (многоканальные)
Кальцинированная сода | это… Что такое Кальцинированная сода?
Карбона́т на́трия — химическое соединение Na2CO3, натриевая соль угольной кислоты.
Содержание
|
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na
- NaHCO3 (гидрокарбонат натрия) — питьевая или пищевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | h3CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрон (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.

Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много, ранее считавшихся редкими, минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40% потребности страны в этом полезном ископаемом. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблана получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000°C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Уголь восстанавливает сульфат натрия до сульфида:
Na2SO4 + 2C → Na2S + 2CO2↑
Сульфид натрия реагирует с карбонатом кальция:
Na2S + СаСО3 → Na2CO3 + CaS
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
2NaCl + H2SO4 → Na2SO4 + 2HCl↑
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90% предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
К 1900 90% предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20°C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160°C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
возвращают в производственный цикл.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского поселка Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год.
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует карбонат кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Хоу.
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017°С переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27°C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а.е.м. | 286,14 а.е.м. |
| Температура плавления | 852°C (по другим источникам, 853°C) | 32°С |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см3 (при 20°C) | 1,446 г/см3 (при 17°C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Уравнение гидролиза (в ионной форме):
CO32- + H2O ↔ HCO3— + OH—
Первая константа диссоциации угольной кислоты равна 4,5·10-7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве синтетических моющих средств, эмалей, для получения ультрамарина. Также он применяется для умягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. [1]
[1]
Ссылки
- Sodium carbonate CAS #: 497-19-8 — Online Informational Database of Chemicals from China англ.
Пищевые добавки
Пищевые красители E1xx | Консерванты E2xx | Антиокислители и регуляторы кислотности E3xx | Стабилизаторы, загустители и эмульгаторы E4xx | Регуляторы рН и вещества против слёживания E5xx | Усилители вкуса и аромата, ароматизаторы E6xx | Разное E9xx | Пеногасители E1xxx
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами (Технический отчет)
Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами (технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
Проведено детальное исследование взаимодействия хлорида натрия с известняками и доломитами при обжиге и сульфатировании. Результаты показывают, что присутствие соли вызывает структурные перестройки в камнях, что приводит к оптимальному распределению пор для реакции со смесями SO/sub 2//O/sub 2/. Взаимодействие предполагает наличие жидкой пленки, которая увеличивает ионную диффузию и подвижность системы, усиливая декарбонизацию, усиливая кристаллизацию CaO и CaSO/sub 4/ и создавая структуру, проницаемую для газовой диффузии.
Результаты показывают, что присутствие соли вызывает структурные перестройки в камнях, что приводит к оптимальному распределению пор для реакции со смесями SO/sub 2//O/sub 2/. Взаимодействие предполагает наличие жидкой пленки, которая увеличивает ионную диффузию и подвижность системы, усиливая декарбонизацию, усиливая кристаллизацию CaO и CaSO/sub 4/ и создавая структуру, проницаемую для газовой диффузии.
- Авторов:
- Ширер, Дж. А.; Джонсон, И.; Тернер, C.B.
- Дата публикации:
- Исследовательская организация:
- Аргоннская национальная лаборатория.
 (ANL), Аргонн, Иллинойс (США)
(ANL), Аргонн, Иллинойс (США)
- Идентификатор ОСТИ:
- 6558260
- Номер(а) отчета:
- АНЛ/СЕН/ФЭ-78-8
- Номер контракта с Министерством энергетики:
- W-31-109-ENG-38
- Тип ресурса:
- Технический отчет
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 01 УГОЛЬ, ЛИГНИТ И ТОРФ; 37 НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, ФИЗИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ; ДОЛОМИТ; ХИМИЧЕСКИЕ РЕАКЦИИ; ИЗВЕСТНЯК; КИСЛОРОД; НАТРИЯ ХЛОРИДА; КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ; ДИОКСИД СЕРЫ; СМЕСИ; ПОРИСТОСТЬ; СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ; СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ; УГЛЕРОДНЫЕ СОЕДИНЕНИЯ; КАРБОНАТНЫЕ ПОРОДЫ; КАРБОНАТЫ; ХАЛЬКОГЕНИДЫ; ХЛОРИДЫ; СОЕДИНЕНИЯ ХЛОРА; КРИОГЕННЫЕ ЖИДКОСТИ; ДИСПЕРСИИ; ЭЛЕМЕНТЫ; ЖИДКОСТИ; ГАЛИДЫ; ГАЛОГЕННЫЕ СОЕДИНЕНИЯ; КИНЕТИКА; КАРБОНАТЫ МАГНИЯ; СОЕДИНЕНИЯ МАГНИЯ; МИНЕРАЛЫ; НЕМЕТАЛЛЫ; ОКСИДЫ; КИСЛОРОДНЫЕ СОЕДИНЕНИЯ; КИНЕТИКА РЕАКЦИИ; РЕЗЕРВУАР РОК; ГОРНЫЕ ПОРОДЫ; ОСАДОЧНЫЕ ПОРОДЫ; СОЕДИНЕНИЯ НАТРИЯ; СОЕДИНЕНИЯ СЕРЫ; ОКСИДЫ СЕРЫ; 010800* — Управление отходами угля, лигнита и торфа; 400201 — Химические и физико-химические свойства
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Ширер Дж. А., Джонсон И. и Тернер С. Б. Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами . США: Н. П., 1978.
Веб. дои: 10.2172/6558260.
А., Джонсон И. и Тернер С. Б. Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами . США: Н. П., 1978.
Веб. дои: 10.2172/6558260.
Копировать в буфер обмена
Ширер Дж. А., Джонсон И. и Тернер С. Б. Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами . Соединенные Штаты. https://doi.org/10.2172/6558260
Копировать в буфер обмена
Ширер Дж. А., Джонсон И. и Тернер С. Б. 1978.
«Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами». Соединенные Штаты. https://doi.org/10.2172/6558260. https://www.osti.gov/servlets/purl/6558260.
Копировать в буфер обмена
@статья{osti_6558260,
title = {Влияние хлорида натрия на реакцию смесей SO/sub 2//0/sub 2/ с известняками и доломитами},
автор = {Шиарер, Дж. А. и Джонсон, И. и Тернер, С. Б.},
А. и Джонсон, И. и Тернер, С. Б.},
abstractNote = {Проведено детальное исследование взаимодействия хлорида натрия с известняками и доломитами при обжиге и сульфатировании. Результаты показывают, что присутствие соли вызывает структурные перестройки в камнях, что приводит к оптимальному распределению пор для реакции со смесями SO/sub 2//O/sub 2/. Взаимодействие предполагает наличие жидкой пленки, которая увеличивает ионную диффузию и подвижность системы, усиливая декарбонизацию, усиливая кристаллизацию CaO и CaSO/sub 4/ и создавая структуру, проницаемую для газовой диффузии.},
дои = {10.2172/6558260},
URL = {https://www.osti.gov/biblio/6558260},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1978},
месяц = {6}
}
Копировать в буфер обмена
Посмотреть технический отчет (12,89 МБ)
https://doi.org/10. 2172/6558260
2172/6558260
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Алхимическое кальцинирование и экстракция — Шримала
Тибетская медицинаАлхимияТравничество
Автор Эрик Джампа Андерссон
Полный процесс прокаливания и экстракции моей настойки Девясила (девясила/эльфворта). Это была трехдневная процедура, точно рассчитанная по времени с движениями планет, согласно традиции. Этот процесс работает, чтобы превратить «тело» растения в его чистейшую телесную сущность, известную как «соль солей». Этот минеральный порошок будет повторно введен в жидкий экстракт в благоприятный момент, создавая полный жидкий экстракт (спагирический) всех компонентов этой чудесной целебной травы.
Этот процесс работает, чтобы превратить «тело» растения в его чистейшую телесную сущность, известную как «соль солей». Этот минеральный порошок будет повторно введен в жидкий экстракт в благоприятный момент, создавая полный жидкий экстракт (спагирический) всех компонентов этой чудесной целебной травы.
В современном мире в значительной степени неправильно понимают алхимию. Большинство просто узнают его по таинственному процессу хризопеи, превращению неблагородных металлов в золото. Но, как гласит древняя алхимическая максима: «aurum nostum non est aurum vulgi» — «наше золото не вульгарное золото». Одним из таких «золотых» в алхимии является и всегда была медицина.
Тантрический буддизм — это форма внутренней алхимии, работающая над преобразованием тела, речи и ума практикующего в просветленные три каи. В тибетской традиции существуют методы внешней алхимии, но лабораторная алхимия чаще всего используется в очистке минеральных веществ для медицины.
Представленный здесь западный метод, популяризированный Парацельсом в 16 веке для приготовления лекарств, представляет собой метод прохождения лекарственного растения через аналогичный процесс освобождения, использующий множество процессов, которые работают для разделения, очистки и повышения уровня компонентов растение в его самое мощное и динамичное целебное выражение.
Растворитель и коагулянт. Ора и труда. གཡུ་ཐོག་མཁྱེན་ནོ།
В западной алхимии все живые и неживые вещества состоят из трех компонентов: «душа» (или алхимическая «сера») — уникальный характер, выраженный в эфирных маслах, «дух» (алхимическая ртуть) — спирт. вырабатывается веществом при брожении вместе с растворимыми соединениями, а «тело» (алхимическая соль) состоит из чистых минеральных солей, которые можно извлечь путем прокаливания.
Это процесс прокаливания. Оставив настойку девясила гелениума (близкого родственника индо-тибетского མ་ནུ་པ་ཏྲ་) вымачиваться в течение нескольких месяцев, я слил настойку и сжег остатки растения. Путем многократного сжигания и растирания я смог превратить растительную массу в тонкий светло-серый/почти белый пепел. Считается, что этот процесс альбедо очищает, утончает и в конечном итоге освобождает вещество от примесей. У нас остается основное «тело» девясила, которое содержит как чистую соль, так и темную капут мортуум/терра дамната (мертвая голова/проклятая земля), которое нужно будет очистить в следующем процессе, растворении (после вскоре).
Путем многократного сжигания и растирания я смог превратить растительную массу в тонкий светло-серый/почти белый пепел. Считается, что этот процесс альбедо очищает, утончает и в конечном итоге освобождает вещество от примесей. У нас остается основное «тело» девясила, которое содержит как чистую соль, так и темную капут мортуум/терра дамната (мертвая голова/проклятая земля), которое нужно будет очистить в следующем процессе, растворении (после вскоре).
В своей медицинской практике я стремлюсь объединить богатую западную алхимическую травяную традицию с традиционной тибетской медициной, чтобы наилучшим образом использовать наши уникальные ресурсы (и их отсутствие) на западе. Я использую в своей практике ряд формул настоек, которые обычно не используются в привычной нам форме в ТТМ. Одним из недостатков настоек является то, что вы обычно не используете все растение целиком, а только соединения, растворимые в воде или спирте.
Как и все процедуры в алхимии, все должно выполняться с учетом планетарных элементов.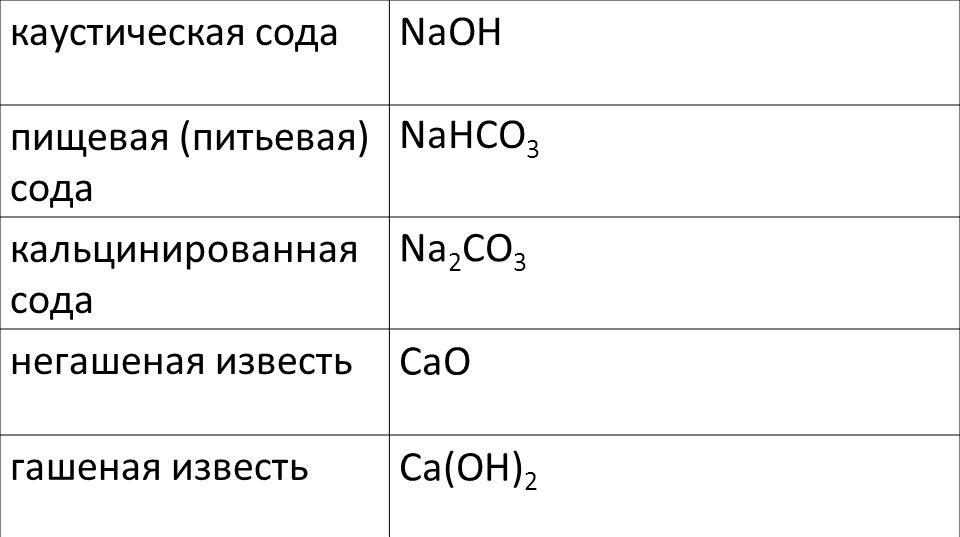

 Массовая доля углекислого натрия (Na2C03) в пересчете на непрокаленный продукт, %, не менее
Массовая доля углекислого натрия (Na2C03) в пересчете на непрокаленный продукт, %, не менее