Реакции и способы получения меди
Медь или купрум, названа так в честь острова Кипр, где нашли крупное ее месторождение. Это один из первых металлов, освоенных человеком. Медный век – удивительная эпоха, в которую обиход человека был наполнен медными орудиями и предметами быта, он продолжался с IV до III тысячелетия до н. э.
Способы получения меди
Для извлечения меди из минералов и руд, в которых она находится, на сегодняшний день используют три метода:
- гидрометаллургический
- пирометаллургичекий
- электролиз.
Получение меди пирометаллургическим методом является наиболее распространенным. Сырьем для этого процесса выступает халькопирит. Чтобы получить из халькопирита чистую медь, необходимо осуществить ряд операций. Первая, из которых, заключается в обогащении медной руды, методом окислительного обжига или флотации.
В основе флотации лежит тот факт, что пустая порода и ее медесодержащие части, смачиваются по-разному. Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.
Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.

Чтобы улучшить показатели штейна его подвергают обдуванию в горизонтальных конвертерах без добавления дополнительного топлива. Таким образом, железо и сульфиды окисляются, оксид железа превращается в шлак, а сера становится оксидом – SO 2.
Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.
Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.

Получение меди электролизом
Электролиз меди является одним этапов химико-физических процессов, которому подвергают руду, чтобы получить медь. Примечательно, что для получения 1 тонны чистой меди, потребуется переработать как минимум 200 тонн медной руды.
Сама процедура обработки медной руды – это многоступенчатый и очень сложный процесс, который состоит из 7 стадий. Самой последней и является электролиз меди.
Руду после добычи необходимо измельчить в особых машинах. Далее происходит процесс флотации, в результате которого, как мы знаем, формируется концентрат с сохранением минералов меди. После этого происходит обжиг при высоких температурах в специальных печах. Шихту, полученную в процессе обжига, помещают в печь для плавки, где она становится штейном, который в свою очередь оправляют на конвертирование. Продукт, полученный после этих процессов, называют черновой медью, где 2-3% объема занимают примеси. В качестве примесей выступают цинк, железо, или сера. Их удаляют реакцией окисления. На этом этапе образуется «красная» медь, в которой присутствует 99,7-99,9% Cu. Последним этапом является непосредственно электролиз меди, который позволяет добиться получения максимально чистой меди.
На этом этапе образуется «красная» медь, в которой присутствует 99,7-99,9% Cu. Последним этапом является непосредственно электролиз меди, который позволяет добиться получения максимально чистой меди.
Чтобы осуществить процесс электролиза меди понадобится специальное оборудование, а именно емкости, которые заполняют водным раствором сульфата меди с содержанием свободной серной кислоты. В результате проведения электролиза, мы получим осадок чистой меди на катодах. А все, что окажется на дне ванны, принято называть шламом. Он является сырьем для получения благородных металлов.
Получение оксида меди
Оксид меди (II) CuO представляет собой кристаллы черного цвета, которые подвергаются кристаллизации в моноклинной сингонии. Плотность соединения составляет 6,51 г/см3, а плавится он при температуре 1447°С в условиях высокого давления. В результате нагревания до 1100°С является выделение оксида меди (I):
- 4CuO = 2Cu2O + O2.
В воде оксид меди не растворяется и не вступает в реакции с ней.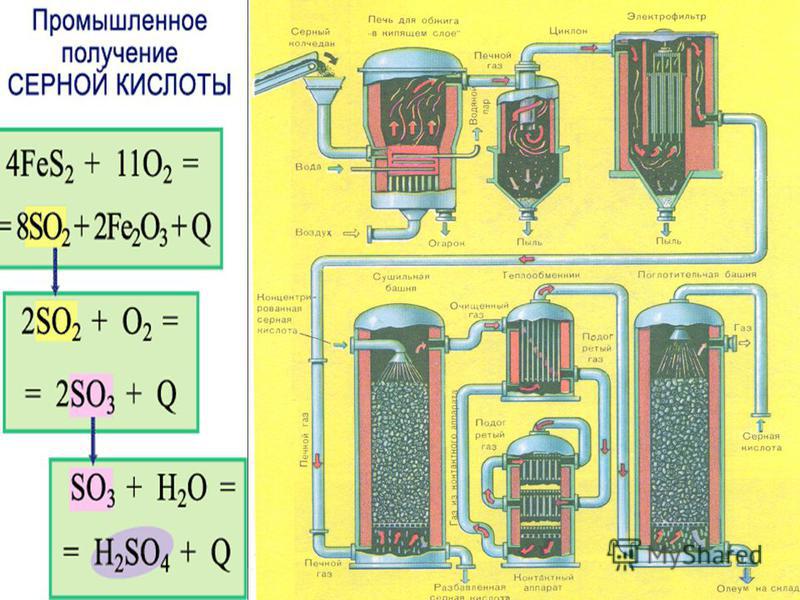 Обладает слабыми амфотерными свойствами с преобладанием основных.
Обладает слабыми амфотерными свойствами с преобладанием основных.
С водными растворами аммиака реагирует с образованием гидроксида тетраамминмеди (II):
- CuO + 4NH3 + H2O = [Cu(NH3)4](OH)2.
Также легко вступает в реакции с разбавленными кислотами с выделением соли и воды:
- CuO + H2SO4 = CuSO4 + H2O.
Результатом сплавления оксида меди со щелочами является образование купратов:
- CuO + 2KOH = K2CuO2 + H2O.
Чистую медь из оксида можно получить методом восстановления водородом, угарным газом и активными металлами:
- CuO + H2 = Cu + H2O
- CuO + CO = Cu + CO2
- CuO + Mg = Cu + MgO.
Реакция получения оксида меди методом прокаливания гидроксида меди (II) при температуре 200°С:
- Cu(OH)2 = CuO + H2O
Также получить оксид меди можно в процессе окисления металлической меди на воздухе при температуре 400–500°С:
- 2Cu + O2 = 2CuO.

Получение сульфата меди
Получить сульфат меди можно тремя реакциями:
растворить CuO в H
- CuO + H2SO4→ CuSO4 + H2O
в присутствии концентрированной серной кислоты с медью, обязательно при нагревании
- Cu + 2H2SO4→ CuSO4 + SO2↑ + 2H2O
методом взаимодействия Cu2O с разбавленной серной кислотой
- Cu2O + H2SO4 = Cu + CuSO4 + H2O.
Получение хлорида меди
В природе хлорид меди находится в составе очень редкого минерала эрнохальцита CuCl₂•2H₂O, который представляет собой кристаллы синего цвета.
Двухвалентный хлорид меди обладает важным практическим значением, и добычи его только лишь из природного минерала очень мало. Поэтому ученые придумали несколько способов искусственного получения данного соединения.
Главной реакцией промышленного синтеза CuCl₂ можно назвать реакцию хлорирования сульфида меди в условиях высокой температуры от 300 до 400 градусов °С. Выглядит реакция так
- CuS + Cl₂ ―› CuCl₂ + S
Еще одним вариантом синтеза хлорида двухвалентной меди является хлорирующий обжиг, который осуществляется при температуре более 500 С:
- CuS + 2NaCl + 2O₂ ―› CuCl₂ + Na₂SO₄
Обе реакции нуждаются в использовании специализированного оборудования и соблюдении повышенных мер безопасности, по этой причине данные реакции можно проводить только в условиях промышленного производства. В лабораторных условиях также можно получить хлорид меди следующими реакциями
- Cu + Cl₂ ―› CuCl₂
- CuO + 2HCl ―› CuCl₂ +H₂O
- Cu(OH)₂ + 2HCl ―› CuCl₂ + 2H₂O. Реакция нейтрализации
- CuCO₃ + 2HCL ―› CuCl₂ + H₂O + CO₂. В результате этой реакции более сильная кислота вытеснит кислотный остаток более слабой кислоты. Протекает реакция замещения
- 3Сu + 2HNO₃ + 6HCl ―› 3CuCl₂ + 2NO +4H₂0.
 Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Получение глицерата меди
Качественная реакция для выявления присутствия глицерина в растворах осуществляется в присутствии сульфата меди (II) и раствора гидроксида натрия. В результате реакции образуется глицерат меди – комплексное соединение сине-василькового оттенка.
Химическую реакцию проводят следующим образом:
- к раствору сульфата меди (II) приливают раствор гидроксида натрия, в результате чего происходит окрашивание раствора в синий цвет. Таким образом, наблюдаем выпадения осадка гидроксида меди (II)
- после этого добавляем несколько мл глицерина и перемешиваем раствор. Образовавшийся осадок растворяется с образованием комплексного соединения оттенка индиго. Это и есть глицерат меди.
Уравнение выглядит следующим образом:
CH2OH-CHOH-CH2OH + Cu(OH)2—> Cu(-O-CH2-CH-O-)-CH2OH
Получение нитрата меди
Получение нитрата меди Cu(NO3)2 довольно увлекательное занятие. А также очень полезное, поскольку он является довольно популярным красителем. Нитрат меди (II) можно получить в процессе растворения чистой меди, ее оксида или гидроксида в азотной кислоте. Уравнения выглядят следующим образом:
А также очень полезное, поскольку он является довольно популярным красителем. Нитрат меди (II) можно получить в процессе растворения чистой меди, ее оксида или гидроксида в азотной кислоте. Уравнения выглядят следующим образом:
- Cu + 4HNO3 —> Cu(NO3)2 + 2NO2 + 2H2O
- CuO + 2HNO3 —> Cu(NO3)2 + H2O
- Cu(OH)2 + 2HNO3 —> Cu(NO3)2 +2H2O.
Получение сульфида меди
Сульфид меди(II) или моносульфид меди — CuS, является неорганическим бинарным соединением двухвалентной меди с серой. Он верного цвета, в воде не растворяется , также как и в разбавленных растворах кисло. В природе его можно встретить в виде редкого минерала ковеллина.
- Na2S+CuSO4=CuS+Na2SO4
- CuCl2 + H2S —> CuS + 2HCl
- 2CuS + H2 —>Cu2S + H2S. Эта реакция протекает в условиях высокой температуры от 600 до 700 oC
Получение сухим методом дает сульфиду меди возможность проводить электрический ток. Когда отметка термометра достигает 400 °C, наблюдается заметное разложение сульфида.
Ответы к упражнениям § 7. Химия 9 класс.
Ответы к упражнениям § 7. Химия 9 класс.
|
||||||||||||||
|
||||||||||||||
Acid Leaching — Copper Ore Treatment Method
Metallurgical Content
- Acid Leaching Process Flowsheet
- CHEMISTRY OF COPPER DISSOLUTION
- PREPARATION OF THE COPPER ORE
- STORAGE AND FEEDING THE ORE
- COPPER LEACHING
- CHARGING THE TANKS
- ОСАЖДЕНИЕ МЕДИ
- ПОСТАВКА КИСЛОТЫ
- ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
Переработка медных руд, как оксидов, так и сульфидов, посредством флотации, гидрометаллургии или других процессов хорошо зарекомендовала себя в течение многих лет. Флотация обычно применялась для обработки сульфидных руд как в мелкомасштабных, так и в крупномасштабных операциях.
Гидрометаллургические методы отдельно или в сочетании с флотацией в основном применялись в крупнотоннажных операциях по извлечению меди из низкосортной самородной меди, окисленных или смешанных оксидных и сульфидных руд, которые трудно концентрировать только флотацией или другими способами, либо из-за к затратам на лечение или низкому выздоровлению. Гидрометаллургическая переработка небольших объемов таких руд не получила широкого распространения из-за высоких капитальных затрат на установку.
Гидрометаллургическая переработка небольших объемов таких руд не получила широкого распространения из-за высоких капитальных затрат на установку.
Метод растворения серной кислотой и сульфатом железа с химическим осаждением с помощью лома или губчатого железа, по-видимому, предлагает наилучшие возможности для широкого применения и низкой стоимости. Его базовая химия несложна, но его экономическое применение зависит от обработки материалов и растворов с помощью таких процедур, которые обеспечивают низкие эксплуатационные расходы.
Технологическая схема, обсуждаемая в данном исследовании, предназначена для обработки 100 тонн оксидно-сульфидной медной руды в день в процессе выщелачивания с использованием растворителя серная кислота-сульфат железа. Эта технологическая схема также подходит для большего тоннажа за счет правильного выбора размеров различных единиц оборудования. Технологическая схема предполагает шести-семидневный цикл выщелачивания-промывки, при котором один резервуар разгружается и загружается каждый день.
На выщелачивающих установках производительностью, показанной на этой технологической схеме, извлечение меди обычно происходит в диапазоне от 80 до 90% оксида меди и 70% или более сульфида меди из средних руд.
ХИМИЯ РАСТВОРЕНИЯ МЕДИРастворение медных минералов представляет собой в основном простое разложение в случае окисленных минералов и окислительно-восстановительное для сульфидных минералов. Полученные продукты растворимы в воде. Реакции обычных минералов меди с серной кислотой и сульфатом железа кратко описаны ниже.
Растворение различных оксидов, карбонатов, силикатов и сульфидов происходит с разной скоростью, что может сильно повлиять на извлечение. Каждая руда имеет свои собственные проблемы, и связанная с ней пустая порода может вступать в реакции с образованием растворимых солей, что приводит к избыточному потреблению растворителя или оказывает неблагоприятное воздействие на растворы, содержащие медь. Эти условия могут быть определены только путем тщательных и адекватных лабораторных и опытно-промышленных испытаний, чтобы установить все факторы, необходимые для разработки процесса.
Это исследование в целом ограничено перколяционным выщелачиванием, поскольку это наиболее широко используемый метод обеспечения надлежащего контакта растворителя с рудой для извлечения меди.
Одним из важных факторов перколяционного выщелачивания является измельчение, необходимое для извлечения меди в разумные сроки.
Само собой разумеется, что чем больше размер частиц, которые можно легко выщелачивать, тем меньше стоимость дробления и чем меньше частицы, тем меньше времени требуется для экстракции. Следовательно, размер должен быть выбран так, чтобы давать минимум мелких частиц и с максимально возможной однородностью, которая позволит проводить выщелачивание в экономичные сроки. В большинстве случаев дробление до минуса было удовлетворительным.
Если измельченная руда содержит избыточную мелочь, может оказаться целесообразным добавить крупную фракцию руды или отходов, чтобы избежать необходимости удаления мелочи.
Используются стальные бункеры для руды, сварные в полевых условиях, так как они могут быть закреплены в большинстве областей и установлены с меньшими затратами, чем другие формы.
Руда размером менее 3/8″ из хранилища мелкозернистой руды направляется питателем с регулируемой скоростью в цилиндрический смесительный барабан для агломерации с водой перед транспортировкой в резервуары для выщелачивания. Конвейер настроен на радиальное перемещение для загрузки любого из резервуаров, которые также расположены с соответствующим радиусом для облегчения загрузки с использованием одного конвейера.
Мелкая фракция, образующаяся при дроблении, или шламы, содержащиеся в руде, мешают выщелачиванию и снижают извлечение из-за прохождения раствора через более крупные сегрегированные частицы. Канализация может быть уменьшена с помощью методов, обеспечивающих равномерное перемешивание и загрузку резервуаров для выщелачивания. Излишки мелких частиц часто необходимо удалять и обрабатывать отдельно путем перемешивания. Однако это является дополнительным усложнением для небольшого завода, поскольку увеличивает первоначальные затраты на завод, требуя дополнительных трудозатрат и внимания.
Излишки мелких частиц часто необходимо удалять и обрабатывать отдельно путем перемешивания. Однако это является дополнительным усложнением для небольшого завода, поскольку увеличивает первоначальные затраты на завод, требуя дополнительных трудозатрат и внимания.
В тех случаях, когда мелкие частицы должны быть удалены из-за образования каналов или плохой пористости, вся или часть может быть отделена мокрым или сухим просеиванием с последующей классификацией для удаления фракции шлама для обработки методами перемешивания и декантации, как показано на технологической схеме.
В некоторых случаях агломерация мелких частиц была эффективной для устранения необходимости отдельного обращения с мелкими частицами. Это достигается путем добавления воды или раствора в измельченную руду для доведения содержания влаги примерно до 10% и перемешивания в цилиндрической мельнице или лопастной мельнице. При смешивании образуются округлые частицы, в которых мелкие частицы прилипают к более крупным частицам, образуя более однородную массу с улучшенной проницаемостью.
Применение гидрометаллургического выщелачивания для окисленных и смешанных окисленных и сульфидных руд зависит, главным образом, от получения растворителя по низкой цене и от удержания первоначальных затрат на установку в допустимых пределах. Было обнаружено, что разбавленный сернокислый сульфат железа является прекрасным растворителем для оксидных минералов, а также для таких сульфидных форм, как халькозин и ковелит, но не для халькопирит.
Перколяция может быть как восходящей, когда растворы поступают снизу и переливаются вверх, так и нисходящей, когда растворы добавляются сверху с нижним сливом.
ЗАРЯДКА РЕЗЕРВУАРОВ При заправке резервуаров необходимо соблюдать осторожность, чтобы равномерно распределить загрузку, чтобы максимально избежать расслоения и уменьшить канавление раствора. Если руда была агломерирована, при загрузке требуется меньше осторожности, поскольку сегрегация значительно снижается. Дренаж резервуаров часто улучшается путем размещения перед загрузкой слоя крупной руды толщиной в несколько дюймов на дно фильтра.
Дренаж резервуаров часто улучшается путем размещения перед загрузкой слоя крупной руды толщиной в несколько дюймов на дно фильтра.
Кроме того, при использовании нисходящей перколяции аналогичный слой крупнозернистой руды, нанесенный сверху, будет способствовать равномерному потоку растворов по всей площади резервуара и поможет уменьшить воздействие растворов из распределительных труб.
Можно использовать несколько методов перколяционного выщелачивания. В одном из них растворы полностью покрывают всю загрузку в течение определенного периода выдержки, за которым следует дренаж и последовательные обработки растворами с уменьшающейся кислотностью, после каждой из которых следует период дренажа. Во время каждого цикла раствор может циркулировать насосом, чтобы обеспечить постоянный поток через загрузку.
Другим заслуживающим внимания методом является открытое дренажное выщелачивание, при котором раствор добавляется с помощью распыления или других средств распределения со скоростью ниже скорости просачивания, чтобы заряд не затоплялся. При правильном распределении раствор покрывает частицы руды пленкой раствора, оставляя воздушные промежутки между которыми способствует растворению любой самородной меди или куприта. Испытания показали увеличение извлечения меди из куприта до 50% из-за наличия в этом методе избытка кислорода.
При правильном распределении раствор покрывает частицы руды пленкой раствора, оставляя воздушные промежутки между которыми способствует растворению любой самородной меди или куприта. Испытания показали увеличение извлечения меди из куприта до 50% из-за наличия в этом методе избытка кислорода.
В данном обсуждении используется противоточное выщелачивание с последовательной обработкой отдельных загрузок в каждом резервуаре раствором более высокой концентрации. Раствор с наибольшей прочностью наносится на загрузку для ее заключительного цикла заданного замачивания и/или рециркуляции перед сливом и подачей в следующий резервуар. Процесс протекает от резервуара к резервуару с постоянным уменьшением концентрации кислоты и увеличением концентрации меди, пока она, наконец, не будет удалена в виде продуктивного раствора из загрузки, прошедшей первый цикл выщелачивания. К этой загрузке часто добавляют промывку слабой кислотой, из которой был слит насыщенный раствор, чтобы удалить как можно больше богатого медью окклюзированного раствора. Эта промывка присоединяется к насыщенному раствору, готовому к осаждению.
Эта промывка присоединяется к насыщенному раствору, готовому к осаждению.
После последнего цикла выщелачивания шихты она подвергается одному или нескольким циклам промывки водой для удаления оставшейся в растворе меди. В некоторых случаях это составляет до 30% от общего количества растворенной меди, и эффективная промывка имеет большое значение. Часть таких промывок может быть добавлена к насыщенному раствору с подачей остатка противотоком.
ОСАЖДЕНИЕ МЕДИМетод извлечения меди из выщелачивающих растворов путем осаждения железом известен уже много лет, и, по сообщениям, он применялся на шахтах Rio Tinto в Испании еще в 1752 году. Железный лом, консервные банки и губка железо использовалось в зависимости от стоимости и доступности. Затраты на оплату труда при использовании металлолома и жестяных банок обычно выше, чем при использовании губчатого железа.
Основная реакция осаждения проста, однако на практике могут происходить другие реакции, влияющие на количество потребляемого железа и качество производимой меди в цементе. Количество свободной кислоты и трехвалентного железа в растворе влияет на количество используемого железа, и если в резервуарах мешалки предусмотрены нижние боковые дверцы, позволяющие вручную удалять цементную медь для дальнейшего дренажа и сушки. Цементная медь обычно упаковывается для отгрузки.
Количество свободной кислоты и трехвалентного железа в растворе влияет на количество используемого железа, и если в резервуарах мешалки предусмотрены нижние боковые дверцы, позволяющие вручную удалять цементную медь для дальнейшего дренажа и сушки. Цементная медь обычно упаковывается для отгрузки.
раствор близок к нейтральному, медь выпадает в осадок мало или вообще не выпадает.
Теоретически один фунт железа осаждает 1,137 фунта меди, в то время как на практике требуется в два-три раза больше этого количества, особенно если используемое железо сильно окислено.
Губчатое железо обычно более эффективно, и его расход часто равен весу осажденной меди. Примеси в железе снижают качество производимой цементной меди. Марка цементной меди обычно колеблется от 50 до 9.0% меди.
Восстановление более 97% меди в растворе не является чем-то необычным из растворов, содержащих медь в диапазоне от 1,0 до 15,0 GPL.
Как указано в технологической схеме, продуктивный раствор из хранилища порциями подается в одну из двух мешалок осаждения, в которые на опорную решетку добавлено железо в виде легкого лома или консервных банок.
После заполнения мешалки продуктивным раствором ее включают в работу, чтобы поддерживать движение раствора через железо для максимально быстрого осаждения меди. Обычно для завершения реакции достаточно перемешивания в течение 2–3 часов в зависимости от силы кислоты и других факторов.
Бесплодный раствор выдерживается в мешалке до тех пор, пока медный цемент не осядет, а затем переливается в резервуар с пустым раствором. Медный цемент можно удалять в конце каждого цикла или после нескольких циклов работы.
ПОСТАВКА КИСЛОТЫИсточник серной кислоты для выщелачивания обычно является основным фактором для небольших предприятий. Если завод расположен в районе, где кислоту можно купить по низкой цене, можно избежать одной из самых крупных статей капитальных затрат. Для большинства растений необходимо производить кислоту.
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ Поскольку концентрация кислоты выше 7% обычно не требуется, процесс «Автоокисление» для производства кислоты может быть организован с меньшими затратами, чем для других процессов. Метод автоокисления уже несколько лет успешно используется на небольших заводах в Европе, Южной Америке и США. В этом процессе сульфат железа используется в качестве катализатора в количестве около 5% от производимой кислоты и превращает серную кислоту в растворитель сульфата железа за счет самоокисления сульфата железа и диоксида серы в присутствии избытка воздуха.
Метод автоокисления уже несколько лет успешно используется на небольших заводах в Европе, Южной Америке и США. В этом процессе сульфат железа используется в качестве катализатора в количестве около 5% от производимой кислоты и превращает серную кислоту в растворитель сульфата железа за счет самоокисления сульфата железа и диоксида серы в присутствии избытка воздуха.
Сульфат железа, содержащийся в бесплодном растворе после осаждения меди, разбавленный водой до требуемого содержания железа, подается в камеру автоокисления вместе с диоксидом серы с избытком воздуха для получения растворителя серная кислота-сульфат железа.
Необходимый диоксид серы получают путем сжигания элементарной серы. Горелка для серы, способная сжигать около 2000 фунтов в день, состоит из облицованного кирпичом стального цилиндра, содержащего котел для плавления серы над поддонами для сжигания серы. Сера подается через верхнюю часть горелки и при плавлении стекает вниз, заполняя лотки для сжигания. Скорость горения регулируется регулированием скорости подачи воздуха, при этом образующийся газ содержит от 6 до 8% диоксида серы. За горелкой следует камера сгорания, охладитель и фильтр, газ сжимается нагнетательным нагнетателем из нержавеющей стали для подачи в камеры автоокисления вместе с воздухом, подаваемым через отдельный нагнетатель.
За горелкой следует камера сгорания, охладитель и фильтр, газ сжимается нагнетательным нагнетателем из нержавеющей стали для подачи в камеры автоокисления вместе с воздухом, подаваемым через отдельный нагнетатель.
Реакция сначала окисляет сульфат железа до сульфата железа, а затем производит серную кислоту. При надлежащем контроле около 90% двухвалентного железа преобразуется до того, как в результате реакции образуется серная кислота. Сила кислоты может быть доведена до или выше той, которая обычно требуется для выщелачивания.
Основным требованием для проведения реакции является поддержание контакта раствора с газами таким образом, чтобы были поглощены как SO2, так и кислород. Газ SO2 более растворим в воде, чем кислород, и газ необходимо вводить в раствор в виде мелких пузырьков,
Изображенные камеры имеют железобетонную конструкцию со свинцовой обшивкой, снабженную пористым материалом из оксида алюминия для диффузии газообразного SO2 и воздуха в раствор. Трубки из пористого оксида алюминия также используются для подачи газа и воздуха в аналогичные ячейки. Давление для поступления газов обычно составляет от 3 до 4 фунтов на квадратный дюйм.
Трубки из пористого оксида алюминия также используются для подачи газа и воздуха в аналогичные ячейки. Давление для поступления газов обычно составляет от 3 до 4 фунтов на квадратный дюйм.
для эффективных результатов. Производительность на квадратный фут площади ячейки с использованием газообразного SO2 от 6 до 8% составляет более 75 фунтов 100%-ной серной кислоты или эквивалента в сульфате железа в течение 24 часов, однако из-за переменных средняя производительность может составлять около 50% от этого количества. Эффективность газообразного SO2, подаваемого в ячейки, обычно составляет порядка 97%. Для наилучшей работы раствор, подаваемый в клетки, должен содержать от 0,5 до 0,7% общего железа, однако, если потребность в сульфате железа превышает это значение, большее количество железа может быть возвращено в клетки для регенерации.
Показанные ячейки автоокисления имеют площадь 150 квадратных футов и могут производить более 6000 фунтов 100% серной кислоты или ее эквивалента в сульфате железа в день. Скорость потока через ячейки регулируют таким образом, чтобы получить растворитель с концентрацией серной кислоты от 3 до 7% по желанию. Примерно пять процентов бесплодного раствора возвращают в клетки для регенерации и получения сульфата железа, необходимого в качестве катализатора. Дополнительные количества могут быть возвращены на регенерацию сульфата железа, если это необходимо для растворения сульфида меди. Остаток бесплодного раствора выбрасывается в отходы.
Скорость потока через ячейки регулируют таким образом, чтобы получить растворитель с концентрацией серной кислоты от 3 до 7% по желанию. Примерно пять процентов бесплодного раствора возвращают в клетки для регенерации и получения сульфата железа, необходимого в качестве катализатора. Дополнительные количества могут быть возвращены на регенерацию сульфата железа, если это необходимо для растворения сульфида меди. Остаток бесплодного раствора выбрасывается в отходы.
Бюллетень № 321 Горнорудного бюро США содержит данные для расчетов производительности ячеек автоокисления.
КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ — Конструкционные материалы ограничены из-за агрессивного характера раствора, содержащего свободную серную кислоту, сульфат железа и железа, сульфат меди и другие возможные соли и кислоты. В сочетании они более агрессивны, чем любой из них по отдельности. Материалы обычно ограничиваются свинцом, дурироном, хастеллоем B, C и D, каучуком, битумными цементами, асфальтом, фарфором, изделиями из стеклокерамики, стеклом и некоторыми пластиками, такими как ПВХ. Бетон, изготовленный с добавками для повышения плотности, широко используется для резервуаров, покрытых внутри битумным, асфальтовым или многослойным пластиком и стекловолокном.
Бетон, изготовленный с добавками для повышения плотности, широко используется для резервуаров, покрытых внутри битумным, асфальтовым или многослойным пластиком и стекловолокном.
ПЕРЕРАБОТКА МАТЕРИАЛОВ — Перемещение материалов является важным экономическим фактором, и используемые методы могут в значительной степени зависеть от характера и условий на производственной площадке, ставок рабочей силы и требований к капиталу.
Резервуары для выщелачивания могут располагаться радиально для использования одного конвейера, поворачиваться в точке загрузки и перемещаться по дуге для заполнения любого резервуара.
Равномерное распределение материалов в наливных резервуарах может осуществляться либо вручную, либо механическим способом, либо с помощью челночных конвейеров.
Методы, используемые при разгрузке резервуаров, варьируются от сгребания всего материала лопатой через стенки резервуара в автомобили или на конвейеры до выгрузки лопатой через днище или боковые двери до использования скребков или грейферных экскаваторов. Кроме того, при наличии достаточного количества воды выщелоченный материал можно смывать струйными потоками через нижние дверцы в желоба для утилизации. Для этого требуется достаточная площадь хвостохранилища с надлежащим уклоном для потока крупнозернистого материала к месту захоронения.
Кроме того, при наличии достаточного количества воды выщелоченный материал можно смывать струйными потоками через нижние дверцы в желоба для утилизации. Для этого требуется достаточная площадь хвостохранилища с надлежащим уклоном для потока крупнозернистого материала к месту захоронения.
Новый способ добычи меди | Новости Массачусетского технологического института
Исследователи Массачусетского технологического института определили правильную температуру и химическую смесь для селективного отделения чистой меди и других металлических микроэлементов от минералов на основе серы с помощью электролиза расплава. Этот одностадийный экологически чистый процесс упрощает производство металлов и устраняет токсичные побочные продукты, такие как диоксид серы.
Постдоктор Сулата К. Саху и аспирант Брайан Дж. Хмеловец ’12 разложили богатые серой минералы на чистую серу и извлекли три различных металла очень высокой чистоты: медь, молибден и рений. Они также подсчитали количество энергии, необходимой для запуска процесса экстракции.
Электролизная ячейка представляет собой замкнутую цепь, похожую на батарею, но вместо производства электрической энергии она потребляет электрическую энергию для разделения соединений на их элементы, например расщепления воды на водород и кислород. Такие электролитические процессы являются основным методом производства алюминия и используются в качестве последнего этапа удаления примесей при производстве меди. Однако, в отличие от алюминия, для медьсодержащих сульфидных минералов не существует прямых процессов электролитического разложения с получением жидкой меди.
Исследователи Массачусетского технологического института нашли многообещающий метод образования жидкой металлической меди и газообразной серы в своей ячейке из электролита, состоящего из сульфида бария, сульфида лантана и сульфида меди, который дает более 99,9% чистой меди. Эта чистота эквивалентна лучшим современным методам производства меди. Их результаты опубликованы в статье Electrochimica Acta под руководством старшего автора Антуана Алланора, доцента кафедры металлургии.
Одноэтапный процесс
«Это одностадийный процесс, нужно просто разложить сульфид на медь и серу. Другие предыдущие методы состоят из нескольких шагов», — объясняет Саху. «Принимая этот процесс, мы стремимся снизить стоимость».
Медь пользуется растущим спросом для использования в электромобилях, солнечной энергии, бытовой электронике и других целях повышения энергоэффективности. Большинство современных процессов извлечения меди сжигают сульфидные минералы в воздухе, что приводит к образованию диоксида серы, вредного загрязнителя воздуха , который необходимо улавливать и перерабатывать, но новый метод производит элементарную серу, которую можно безопасно повторно использовать, например, в удобрениях. Исследователи также использовали электролиз для получения рения и молибдена, которые часто встречаются в сульфидах меди в очень малых количествах.
Новая работа основана на опубликованном в 2016 году Журнале Электрохимического общества документе, предлагающем доказательство электролитического извлечения меди, автором которого являются Самира Соханваран, Санг-Квон Ли, Гийом Ламботт и Алланор. Они показали, что добавление сульфида бария к расплаву сульфида меди подавило электрическую проводимость сульфида меди настолько, чтобы извлечь небольшое количество чистой меди из высокотемпературной электрохимической ячейки, работающей при 1105 градусах Цельсия (2021 по Фаренгейту). Соханваран сейчас работает научным сотрудником в канадской компании Natural Resources-Canmet Mining; Ли — старший научный сотрудник Корейского научно-исследовательского института атомной энергии; а Ламботт сейчас старший инженер-исследователь в Boston Electrometallurgical Corp.
Они показали, что добавление сульфида бария к расплаву сульфида меди подавило электрическую проводимость сульфида меди настолько, чтобы извлечь небольшое количество чистой меди из высокотемпературной электрохимической ячейки, работающей при 1105 градусах Цельсия (2021 по Фаренгейту). Соханваран сейчас работает научным сотрудником в канадской компании Natural Resources-Canmet Mining; Ли — старший научный сотрудник Корейского научно-исследовательского института атомной энергии; а Ламботт сейчас старший инженер-исследователь в Boston Electrometallurgical Corp.
«Эта статья была первой, в которой было показано, что можно использовать смесь, в которой предположительно электронная проводимость доминирует над проводимостью, но на самом деле она не является 100-процентной. Есть крошечная ионная фракция, которая достаточно хороша для производства меди», — объясняет Алланор.
«Новый документ показывает, что мы можем пойти дальше и сделать его почти полностью ионным, то есть уменьшить долю электронной проводимости и, следовательно, повысить эффективность производства металла», — говорит Алланор.
Эти сульфидные минералы представляют собой соединения, в которых металл и элементы серы имеют общие электроны. В расплавленном состоянии у ионов меди отсутствует один электрон, что придает им положительный заряд, в то время как ионы серы несут два дополнительных электрона, что придает им отрицательный заряд. Желаемой реакцией в электролизере является образование атомов элементов путем добавления электронов к металлам, таким как медь, и отнятия электронов у серы. Это происходит, когда дополнительные электроны вводятся в систему приложенным напряжением. Ионы металлов реагируют на катоде, отрицательно заряженном электроде, где они приобретают электроны в процессе, называемом восстановлением; тем временем отрицательно заряженные ионы серы реагируют на аноде, положительно заряженном электроде, где они отдают электроны в процессе, называемом окислением.
В ячейке, в которой использовался, например, только сульфид меди, из-за его высокой электронной проводимости дополнительные электроны просто протекали бы через электролит, не взаимодействуя с отдельными ионами меди и серы на электродах, и не происходило бы разделения. Исследователи Allanore Group успешно идентифицировали другие сульфидные соединения, которые при добавлении к сульфиду меди изменяют поведение расплава, так что ионы, а не электроны, становятся первичными носителями заряда в системе и, таким образом, обеспечивают желаемые химические реакции. С технической точки зрения, добавки увеличивают ширину запрещенной зоны сульфида меди, поэтому он больше не является электропроводящим, объясняет Хмеловец. Доля электронов, участвующих в реакциях окисления и восстановления, измеряемая в процентах от общего тока, то есть общего потока электронов в клетке, называется его фарадеевской эффективностью.
Исследователи Allanore Group успешно идентифицировали другие сульфидные соединения, которые при добавлении к сульфиду меди изменяют поведение расплава, так что ионы, а не электроны, становятся первичными носителями заряда в системе и, таким образом, обеспечивают желаемые химические реакции. С технической точки зрения, добавки увеличивают ширину запрещенной зоны сульфида меди, поэтому он больше не является электропроводящим, объясняет Хмеловец. Доля электронов, участвующих в реакциях окисления и восстановления, измеряемая в процентах от общего тока, то есть общего потока электронов в клетке, называется его фарадеевской эффективностью.
Удвоение эффективности
Новая работа удваивает эффективность электролитического извлечения меди, указанную в первой статье, которая составляла 28 процентов с электролитом, в котором к сульфиду меди добавлялся только сульфид бария, до 59 процентов во второй статье с как сульфид лантана, так и сульфид бария добавляют к сульфиду меди.
«Демонстрация того, что мы можем проводить фарадеевские реакции в жидком сульфиде металла, является новшеством и может открыть дверь для изучения многих различных систем», — говорит Хмеловец. «Это работает не только с медью. Мы смогли получить рений, и мы смогли сделать молибден». Рений и молибден являются промышленно важными металлами, которые находят применение, например, в двигателях реактивных самолетов. Лаборатория Allanore также использовала электролиз расплава для производства цинка, олова и серебра, но возможны свинец, никель и другие металлы, предполагает он.
Количество энергии, необходимое для запуска процесса разделения в электролизере, пропорционально фарадеевскому КПД и напряжению в ячейке. Для воды, которая была одним из первых соединений, выделенных электролизом, минимальное напряжение ячейки или энергия разложения составляет 1,23 вольта. Саху и Хмеловец определили напряжение ячейки в своей ячейке как 0,06 вольта для сульфида рения, 0,33 вольта для сульфида молибдена и 0,45 вольта для сульфида меди. «Для большинства наших реакций мы применяем 0,5 или 0,6 вольта, так что три сульфида вместе восстанавливаются до металла, рения, молибдена и меди», — объясняет Саху. При рабочей температуре элемента и приложенном потенциале от 0,5 до 0,6 вольта система предпочитает разлагать эти металлы, потому что энергия, необходимая для разложения как сульфида лантана — около 1,7 вольт, так и сульфида бария — около 1,9вольт — сравнительно намного выше. Отдельные эксперименты также доказали способность селективно восстанавливать рений или молибден без восстановления меди на основе их разной энергии разложения.
«Для большинства наших реакций мы применяем 0,5 или 0,6 вольта, так что три сульфида вместе восстанавливаются до металла, рения, молибдена и меди», — объясняет Саху. При рабочей температуре элемента и приложенном потенциале от 0,5 до 0,6 вольта система предпочитает разлагать эти металлы, потому что энергия, необходимая для разложения как сульфида лантана — около 1,7 вольт, так и сульфида бария — около 1,9вольт — сравнительно намного выше. Отдельные эксперименты также доказали способность селективно восстанавливать рений или молибден без восстановления меди на основе их разной энергии разложения.
Промышленный потенциал
Важные стратегические и товарные металлы, включая медь, цинк, свинец, рений и молибден, обычно встречаются в сульфидных рудах и реже в оксидных рудах, как в случае с алюминием. «Что обычно делается, так это сжигание их на воздухе, чтобы удалить серу, но при этом вы делаете SO 2 [двуокись серы], и никто не имеет права выбрасывать его прямо в воздух, поэтому они должны как-то улавливать его. Есть много капитальных затрат, связанных с улавливанием SO 2 и преобразованием его в серную кислоту», — объясняет Хмеловец.
Есть много капитальных затрат, связанных с улавливанием SO 2 и преобразованием его в серную кислоту», — объясняет Хмеловец.
Ближайший промышленный процесс к электролитическому извлечению меди, который они надеются увидеть, — это производство алюминия с помощью электролитического процесса, известного как процесс Холла-Эру, в результате которого образуется расплавленный металлический алюминий, который можно непрерывно выпускать. «В идеале процесс должен быть непрерывным, — говорит Хмеловец. «Итак, в нашем случае вы должны поддерживать постоянный уровень жидкой меди, а затем периодически выпускать ее из электролизера. Для алюминиевой промышленности было затрачено много инженерных усилий, поэтому мы надеемся, что это удастся».
Саху и Хмеловец проводили свои эксперименты при температуре 1227°С, что примерно на 150°С выше точки плавления меди. Это температура, обычно используемая в промышленности для извлечения меди.
Дальнейшие улучшения
Системы электролиза алюминия работают с 95-процентным фарадеевским КПД, поэтому есть возможности для улучшения по сравнению с заявленным исследователями 59-процентным КПД. По словам Саху, чтобы повысить эффективность своих ячеек, им может потребоваться модифицировать конструкцию ячеек, чтобы извлекать большее количество жидкой меди. Электролит также можно дополнительно настроить, добавив сульфиды, отличные от сульфида бария и сульфида лантана. «Нет единого решения, которое позволило бы нам это сделать. Это будет оптимизация для увеличения масштаба», — говорит Хмеловец. Эта работа продолжается.
По словам Саху, чтобы повысить эффективность своих ячеек, им может потребоваться модифицировать конструкцию ячеек, чтобы извлекать большее количество жидкой меди. Электролит также можно дополнительно настроить, добавив сульфиды, отличные от сульфида бария и сульфида лантана. «Нет единого решения, которое позволило бы нам это сделать. Это будет оптимизация для увеличения масштаба», — говорит Хмеловец. Эта работа продолжается.
34-летняя Саху получила докторскую степень по химии в Мадрасском университете в Индии. 27-летний Хмеловец, студент второго курса докторантуры и научный сотрудник Salapatas в области материаловедения и инженерии, получил степень бакалавра в области химического машиностроения в Массачусетском технологическом институте в 2012 году и степень магистра в области химического машиностроения в Калифорнийском технологическом институте в 2014 году. работа над высокотемпературными расплавленными материалами, в том числе недавние прорывы в разработке новых формул для прогнозирования полупроводимости в расплавленных соединениях и демонстрация расплавленного термоэлектрического элемента для производства электроэнергии из промышленного сбросного тепла. Allanore Group ищет патент на некоторые аспекты процесса экстракции.
Allanore Group ищет патент на некоторые аспекты процесса экстракции.
Новая и значительная работа
«Используя интеллектуальную схему химического процесса, эти исследователи разработали очень новый способ производства меди», — говорит Рохан Аколкар, доцент кафедры химической и биомолекулярной инженерии Ф. Алекса Нейсона в Case. Western Reserve University, который не участвовал в этой работе. «Исследователи разработали процесс, который включает в себя многие ключевые ингредиенты — это более чистый, масштабируемый и простой одноэтапный процесс производства меди из сульфидной руды».
«С технологической точки зрения авторы осознают необходимость повышения эффективности процесса при сохранении внутренней чистоты производимой меди», — говорит Аколкар, посетивший лабораторию Allanore в конце прошлого года. «Если технология будет развиваться дальше и ее технико-экономические показатели будут выглядеть благоприятными, то она может обеспечить потенциальный путь для более простого и чистого производства металлической меди, что важно для многих приложений». Аколкар отмечает, что «качество этой работы отличное. Исследовательская группа Allanore в Массачусетском технологическом институте находится на переднем крае, когда речь идет о продвижении исследований электролиза расплавленных солей».
Аколкар отмечает, что «качество этой работы отличное. Исследовательская группа Allanore в Массачусетском технологическом институте находится на переднем крае, когда речь идет о продвижении исследований электролиза расплавленных солей».
Профессор химического машиностроения Рочестерского университета Джейкоб Йорне говорит: «Существующие процессы экстракции включают в себя несколько этапов и требуют больших капиталовложений, поэтому дорогостоящие усовершенствования запрещены. Прямой электролиз сульфидных руд металлов также выгоден, поскольку исключает образование двуокиси серы, загрязняющего кислотные дожди. »
«Электрохимия и термодинамика расплавленных солей сильно отличаются от систем на водной основе, и исследования Алланора и его группы показывают, что многие хорошие химические процессы игнорировались в прошлом из-за нашей рабской преданности вода, — предлагает Жорне. «Прямой электролиз металлических руд открывает путь к возрождению металлургии, где могут быть реализованы новые открытия и процессы, которые могут модернизировать стареющую добывающую промышленность и повысить ее энергоэффективность.


 Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот. narod.ru
Народ.Ру Яндексе
narod.ru
Народ.Ру Яндексе
 Так как щелочные и щелочноземельные
металлы взаимодействуют с водой, то получить их из водного раствора их
соли невозможно они вступают в реакцию с водой.
Так как щелочные и щелочноземельные
металлы взаимодействуют с водой, то получить их из водного раствора их
соли невозможно они вступают в реакцию с водой.
 narod.ru/
narod.ru/