Производство аммиака
Азотное производство играет важнейшую роль в современной химической промышленности. Стоит заметить, что соединения азота применяются как при получении органических, так и неорганических веществ. Особую статью в азотной промышленности составляет производство аммиака. Именно при «участии» этого ценнейшего компонента производятся удобрения, азотная кислота, взрывчатые вещества, хладоагенты и многое другое. При всей своей полезности аммиак является довольно сильным ядом, несмотря на то что применяется в медицине в виде нашатыря.
Сам аммиак как вещество впервые был обнаружен в конце XVIII века. Описал его как отдельное вещество англичанин Джозеф Пристли. Спустя 11 лет французом Клодом Луи Бертолле был изучен химический состав этого вещества. Необходимость получения аммиака в промышленных количествах стала остро возникать в конце XIX века, когда стали истощаться месторождения чилийской селитры, из которой в основном получали азотные соединения. Именно «щелочной воздух» стал самым перспективным компонентом для производства различных химических соединений, которые оказали огромное влияние на разные стороны жизни человека: от военного дела, до сельского хозяйства.
Но эта проблема была решена только в начале XX столетия, когда появился способ производства аммиака путем прямого синтеза из азота и водорода. Таким образом, од возникновения проблемы до ее решения прошел довольно длительный период, в ходе которого было сделано несколько открытий, позволивших «сказку сделать былью».
Особенности и этапы производственного процесса
Процесс производства аммиака характеризуется большой энергоемкостью, что является главным его недостатком. Именно поэтому постоянно ведутся научные разработки, которые призваны решить проблемы экономии энергии. В частности разрабатываются способы утилизации выделенной энергии, а также совмещение, например, производства аммиака и карбамида. Все это способствует удешевлению деятельности предприятий и повышению их полезной отдачи.
В основу производства аммиака положены принцип циркуляции, согласно которому процесс идет непрерывно, причем остатки исходных компонентов отделяются от конечного продукта и используются вновь, непрерывности: процесс синтеза происходит без остановки, принцип теплообмена, а также принцип цикличности. Как видно, все эти принципы между собой тесно взаимосвязаны.

Сама технологическая схема производства аммиака зависит, прежде всего, от сырья, из которого получается конечный продукт. Дело в том, что, в отличие от азота, который содержится в воздухе в больших количествах, водород в чистом виде в природе практически не присутствует, а выделять его из воды — довольно трудоемкий и энергозатратный процесс.
Поэтому в качестве сырья для производства аммиака в основном используются углеводороды, содержащиеся в природном газе. В настоящее время именно природный газ является одной из основ аммиачной промышленности. Прежде чем попасть в колонну синтеза, газ проходит несколько стадий обработки. Начинается процесс с того что производится очистка исходного сырья от серы при помощи десульфуратора.
Далее идет так называемый процесс риформинга, который заключается в том, что в его ходе углеводороды сначала превращаются в метан, потом происходит довольно сложный процесс превращения метана в смесь водяного пара, угарного газа, углекислого газа и водорода. При этом также происходит очистка смеси от углекислого газа, после чего водород попадает в колонну синтеза под большим давлением вместе с азотом. Таким образом, прежде чем начать непосредственно производство аммиака, технология предполагает предварительную обработку сырья.

Все процессы риформинга, как и непосредственно сам синтез конечного продукта, происходят при высоком давлении и большой температуре. Именно это приводит к большой их энергозатратности. При этом указанные параметры на всех стадиях производства изменяются.
Сама колонна обычно изготавливается из стали. В ней размещен катализатор, состав которого может быть разным. После прохождения цикла синтеза смесь попадает в холодильник, где от нее оделяется аммиак в жидком виде, а оставшиеся после реакции компоненты снова идут в производство. Такая особенность технологического процесса вызвана тем, что реакция синтеза аммиака является обратимой и в ходе технологического процесса часть конечного продукта распадается на исходные компоненты.
Таким образом, производство аммиака в промышленности, несмотря на кажущуюся простоту реакции, которая лежит в основе процесса, на самом деле является довольно сложной технологической задачей.
Создание интегрированных производств и разработка новых технологий имеют особое значение
Как уже было сказано выше, технология постоянно совершенствуется и главным направлением мероприятий по ее улучшению является снижение энергоемкости самого процесса. А там, где это сделать по разным причинам сложно, применяются способы утилизации тепла, которое также способно принести пользу. Кроме того некоторые заводы по производству аммиака используют побочные продукты для других химических производств. Так может совмещаться, например, производство метанола и аммиака. Этот способ заключается в том, что из образующегося в ходе риформинга из угарного газа и воды синтезируется метанол.

Также было уже сказано про совмещенное производство аммиака и карбамида. Данное совмещение возможно, например, путем реакции полученного при риформинге углекислого газа с полученным аммиаком. Данный способ, конечно же, требует установки дополнительного оборудования. Тем не менее, он позволяет повысить полезную отдачу конкретного предприятия.
Еще одна особенность производства аммиака в промышленности состоит в том, что его цикличность также способствует и безотходности. Причем в ход идут как полученная энергия, так и побочные продукты. Даже сера, полученная при очистке исходного сырья, находит применение в других химических производствах. Помимо перечисленных мер происходит также постоянный поиск оптимального сочетания давления и температуры, при котором происходит процесс. Ведь от сочетания этих параметров зависит конечный выход основного продукта.
Учитывая все вышесказанное, можно с полной ответственностью сделать вывод,что современный завод по производству аммиака представляет из себя довольно сложный комплекс сооружений. Но в основе такого комплекса всегда состоит установка, разработанная в 1909 году немецким ученым Фрицем Габером, который помимо этого изобретения прославился тем, что стал «отцом химического оружия». По иронии судьбы этот ученый получил Нобелевскую премию Мира. Тем не менее, очевидно, что ценность его вклада в развитие современной химической промышленности сомнению не подлежит.
Таким образом, на примере промышленного производства аммиака можно увидеть, как годами можно совершенствовать, казалось бы, неизменный процесс. Также можно проследить, как одно изобретение может на многие года заложить развитие целой отрасли производства (причем, немаловажной) современного производства.

В настоящее время заводы по производству аммиака расположены по всему миру. Более того: постоянно строятся новые предприятия. Данный факт еще раз подчеркивает важность этого вида химического производства. Ведь во многих регионах земного шара наличие, например, азотных удобрений, стало жизненной необходимостью. Можно привести и много других примеров, но факт остается фактом. Кроме того, огромная часть продукции газодобывающей промышленности востребована именно в производстве аммиака, что позволяет ей устойчиво развиваться. На этих немногочисленных примерах достаточно хорошо видно, что роль производства аммиака переоценить довольно трудно. Поэтому можно сделать вывод, что азотная промышленность будет существовать еще долго, а продукция ее будет всегда пользоваться устойчивым спросом.
Таким образом, говоря о производстве аммиака, следует понимать, что речь идет об очень серьезном производстве, которое оказывает огромное влияние на функционирование различных сфер, как хозяйственной деятельности, так и просто жизни людей. И вполне возможно, что важность данной отрасли в будущем будет расти.

Получение аммиака в промышленности | Промышленность России и мира…
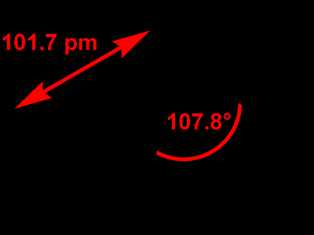
Аммиак— легкий бесцветный газ, имеющий неприятный резкий запах. Он очень важен для химической промышленности, так как в его составе имеется атом азота и три атома водорода. Аммиак применяется в основном для получения азотосодержащих удобрений, сульфата аммония и мочевины, для получения взрывчатых веществ, полимеров и других продуктов, так же аммиак применяется и в медицине.
Получение аммиака в промышленности не простой, трудоемкий и дорогостоящий процесс, основанный на синтезе его из водорода и азота при помощи катализатора, высокой температуры и под давлением. Активированное оксидами калия и алюминия губчатое железо используется как катализатор. Промышленные установки по синтезу аммиака основаны на циркуляции газов. Это выглядит следующим образом: прореагировавшая смесь газов, в которой содержится аммиак, охлаждается и происходит конденсация и отделение аммиака, а азот с водородом, которые не вступали в реакцию перемешиваются с новой порцией газов и вновь подаются на катализатор.
Рассмотрим данный процесс производственного синтеза аммиака, который происходит в несколько стадий, более подробно. На первой стадии производится удаление серы из природного газа при помощи технического устройства десульфуратора. На втором этапе осуществляется процесс конверсии метана при температуре 800 градусов по Цельсию на никелевом катализаторе: Образовавшийся после данной реакции водород пригоден для синтеза аммиака и в реактор подается воздух, содержащий азот. На этой стадии так же происходит частичное сгорание углерода после его взаимодействия с кислородом, который так же содержится в воздухе: 2 h3O + O2->h3О (пар).
Данную очистку проводят с помощью промывания газовой смеси щелочным раствором, который поглощает оксид. Реакция 2 h3O + O2h3О (пар) обратимая и после третьего этапа в газовой смеси остаётся ещё приблизительно 0,5% оксида углерода. Этого количества достаточно, чтобы испортить железный катализатор. На четвертом этапе оксид углерода (II) ликвидируют конверсией водорода в метан на никелевом катализаторе при температурах 400 градусов по Цельсию: СО + 3Н2 ->СН4 +Н2О
Газовая смесь, которая ориентировочно содержит ? 74.5% водорода и 25,5% азота, подвергают сжатию. Сжатие приводит к стремительному повышению температуры смеси. После сжатия смесь охлаждают до 350 градусов по Цельсию. Этот процесс описывается с реакцией: N2 + 3Н2 — 2NН3 ^ + 45,9 кДж. (процесс Гербера)
about-prom.ru
Аммиак промышленность
Тип какого катализатора используется в промышленности для синтеза аммиак
При синтезе аммиака из простых веществ — азота и водорода — используют в качестве катализатора используют пористое железо с примесями Al2O3 и K2O
Источник: интернет (не проверено мне 13 лет
В промышленности аммиак осушают в абсорбционных колоннах. Расходные нормы на тонну аммиака.
В 1908 г. Немецкий химик Ф. Габер обнаружил, что аммиак можно получать из водорода и атмосферного азота на железном катализаторе. Первый завод по производству аммиака этим методом использовал водород, который получали электролизом воды. В последствии водород стали получать из воды путём восстановления коксом. Такой способ получения водорода намного экономичнее. После открытия Габера стремительно стало расти производство аммиака, это неудивительно, поскольку огромные количества аммиака необходимы для получения азот содержащих удобрений. На изготовление их используется приблизительно 80% всего получаемого в мире аммиака. Вместе с азотсодержащими удобрениями в почву вносится в растворимой форме азот, в котором нуждается большинство растений. Остальные ≈20% производимого аммиака используются для получения полимеров, взрывчатых веществ, красителей и других продуктов.
Современный процесс получения аммиак основан на его синтезе из азота и водорода с использованием специального катализатора:
N2 + 3Н2 ↔ 2NН3 ↑ + 45,9 кДж (1)
Поскольку данная реакция обратимая, возникает вопрос: при каких температурах и давления выгоднее всего добиваться максимального выхода
продукта? Так как реакция экзотермическая, то исходя из принципа Ле Шателье ясно, что чем ниже температура процесса, тем больше равновесие будет сдвигаться в сторону образования аммиака, и можно предположить, что следует максимально понижать температуру. Но в действительности всё обстоит сложнее: при низких температурах реакция практически не идёт, поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости — высокая температура, на практике процесс проводят при температуре ≈ 400 – 500 оС.
Но даже при такой высокой температуре для достижения достаточной скорости реакции требуется присутствие специального катализатора. В качестве катализатора используется губчатое железо, активированное оксидами калия и алюминия.
Из уравнения реакции видно, что общее число молей уменьшается от 4 до 2. Согласно принципу Ле Шателье в таком случае процесс выгодно проводить, повышая давление. Но этот вывод лишь качественный, анна практике нужно точно знать, насколько увеличится выход NН3 (на 10% или всего на 0,1%) при увеличение давления. В таблице 1 количественно показано влияние температуры и давления на выход аммиака (процентное содержание аммиака в равновесной смеси) по реакции.
Смесь всевозможных оксидов железа, нанесенная на подложку из Al2O3 плюс некоторое количество примесей (K, Ca, Mn, Ti и т. д.). Используется он, кажется, в таблетках
Получается у вас происходит синтез полимеров, берете оксиды железа http://phct-synthesis.ru/resheniya-dlya-sinteza/sintez-polimerov.html а лучше выучите, как происходит синтез, чтобы у вас потом не было проблем, удачи.
Как получают аммиак в промышленности?
Ну у меня ток пошлые идеи)))
Краткое содержание. Габер Фриц и Карл Бош. Получение аммиака в промышленности.
В промышленности для улавливания аммиака из коксового газа используют раствор серной кислоты. Какое количество вещества
Как получают аммиак в промышленности?
Запишите уравнения реакций, которые используют для получения аммиака:. а) в промышленности- б)в лаборатории-
В промышленности
N2+ 3h3=2Nh4
в лаборатории
2Nh5Cl+Ca(OH)2=CaCl2+2Nh4+2h3O
Аммиак применяется в промышленности в охладительных машинах холодильниках , в медицине, в промышленности. Экологические свойства аммиака.
Как получают аммиак , в промышленности и в лаборатории , напишите их уравнения .
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3h3(г) ↔ 2Nh4(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн.
Как в промышленности добывают аммиак?
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2 + 3h3 ↔ 2Nh4 + 45,9 кДж
Процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза.
Аммиак, Nh4, простейшее химическое соединение азота с водородом. Один из важнейших продуктов химической промышленности синтез аммиака из азота воздуха и водорода…
Как в промышленности добывают аммиак? Как в промышленности добывают аммиак?
Синтезом из азота и водорода.
Аммиак — одно из важнейших соединений азота. Азот, входящий в состав белков и нуклеиновых кислот, является одним из компонентов, составляющих основу жизни.
Почему синтез аммиака в промышленности проводят при повышенной температуре (400 — 500 С)?
Вообще теоретически синтез аммиака — екзотермический процесс. Но для разрыва тройной связи азота необходимо энергия активации. Поэтому температуру «немного» повышают. И давление само собой поднимают.
Расширить представление о развитии азотной промышленности, научных основах и главныхРечь идет о синтезе аммиака основном процессе современной технологии связывания азота.
Потому что катализатор (активированое железо) работает именно при такой температуре
Целюлёзно-бумажная промышленность в аммиаке и хлоре. Где используется?
Хлор для отбеливания бумаги
В промышленности аммиак получают синтезом из азота и водорода N2 3H 2Nh4 В лабаратории действием гашоной извести на соли аммония Ca…
Для отбеливания
Люди что думаете о специальности инженер-химик-технолог(неорганические вещ-ва)
Назвать по одной области применения:. 1) Алюминия 2) Графита 3) Аммиака
Алюминий — строительство (легкие конструкции под гипсокартон, облицовка в составе сэндвич панелей) , аэрокосмическое строительство.
графит — в ядерной энергетике — стержни для торможения нейтронов в ядерных реакторах
аммиак — химия, добыча синтез азотных удобрений
Аммиак. Бесчисленное множество химических реакций осуществил человек в лаборатории и промышленности, но небольшое химическое уравнение
Для чего в промышленности используется аммиачный насос типа 3ц-4 ???
Где примеряются жидкие вещества
Масло для жарки. Уксус для замачивания Вода для разбавления других веществ. Бензин для машин.
На рис. 9 представлены основные направления использования аммиака в промышленности и сельском хозяйстве.
Помогите пожалуйста!
Какие вещества получают из воздуха где и как их используют
А так же из сахарной свеклы при помощи воздуха и воды делают сахар.
Получение водного аммиака. Немецкий физик открыл физико-химическую основу метода получения аммиака в промышленности.
В какой промышленности используют аммиак?
В легкой. питание. в холодильных устройствах, на сколько я знаю используется
Аммиак впервые получил английский ученый Д. Пристли 1774 при действии гашенойСб. науч. работ Ленингр. ин-та гиг. труда, с. 155, 1945 Вредные вещества в промышленности, под ред.
В оСнОвНоМ иСпОлЬзУеТсЯ дЛя ПрОиЗвОдСтВа АзОтНыХ уДоБрЕнИй (НиТрАт И сУлЬфАт АмМоНиЯ, мОчЕвИнА) , вЗрЫвЧаТыХ вЕщЕсТв И пОлИмЕрОв, АзОтНоЙ кИсЛоТы, СоДы (По АмМиАчНоМу МеТоДу) И дРуГиХ пРоДуКтОв ХиМиЧеСкОй ПрОмЫшЛеНнОсТи. ЖиДкИй АмМиАк ИсПоЛьЗуЮт В кАчЕсТвЕ рАсТвОрИт
в ХоЛоДиЛьНоЙ тЕхНиКе ИсПоЛьЗуЕтСя В кАчЕсТвЕ хОлОдИлЬнОгО аГеНтА
Укажите области применения веществ,образующихся при полном и неполном разложении метана
С помощью какой реакции получается аммиак?
Реакция грозы чтоли…
В промышленности аммиак синтезируют из азота см. с водородом. Выпускается промышленностью либо в сжиженном виде…
Какие вещества используются в России в качестве хладагентов? оеп
Фреон
Основные направления в развитии производства аммиака. 1. Кооперирование азотной промышленности с промышленностью основного органического синтеза на базе…
В крупных промышленных установках — аммиак, в остальных различные фреоны
В производствк чего используются аммиак и углекислый газ?
Аммиак плюс углекислый газ = МОЧЕВИНА — удобрение и компонент для последующего орг. синтеза.
В промышленности аммиак синтезируют из азота см. с водородом. Выпускается промышленностью либо в сжиженном виде…
Смещение хим. равновесия на примере реакции синтеза аммиака из водорода и азота.
N2+3h3—t,кат, p—>2Nh4 +Q
при повышении температуры равновесие смещается влево, при повышении — вправо.
Аммиак предъявляет особые требования к материалам. Получаемый при перегонке нефти синтез-газ используется для производства аммиака.
cookker.ru
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола)

Промышленное получение серной кислоты
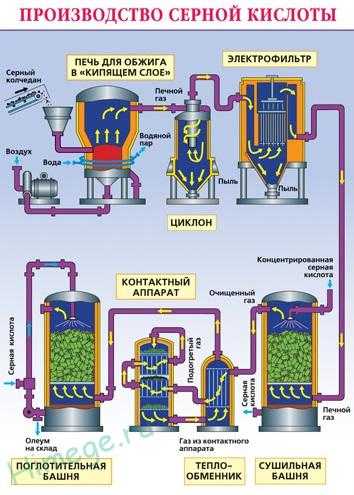 1) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
1) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2) 2SO2 + O2V2O5→ 2SO3
3) nSO3 + H2SO4 → H2SO4·nSO3 (олеум)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора V2O5 ( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3
Промышленное получение аммиака
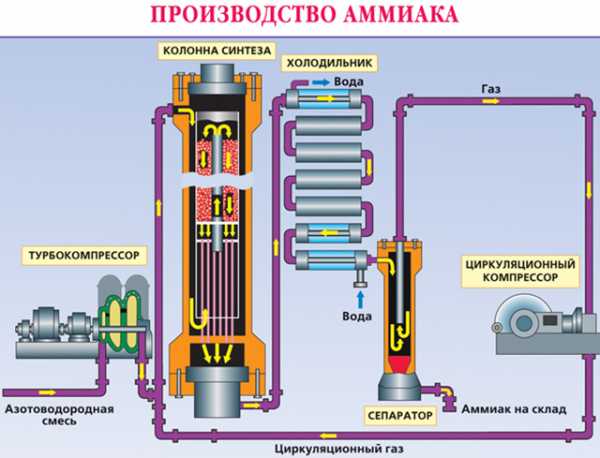 Предварительно получают азотоводородную смесь. Водород получают конверсией метана (из природного газа):
Предварительно получают азотоводородную смесь. Водород получают конверсией метана (из природного газа):
СН4 + Н2О(г) → СО + ЗН2 — Q
2СН4 + О2 → 2СО + 4Н2 + Q
СО + Н2О(г) → СО2 + Н2 + Q
Азот получают из жидкого воздуха.
В турбокомпрессоре происходит сжатие смеси до необходимого давления 25·106 Па. В колонне синтеза газы реагируют при 450—500 °С в присутствии катализатора (пористое железо с примесями Al2O3 и K2O) :
N2 + 3H2 ↔ 2NH3 + 92 кДж (выход 10—20% аммиака)
Образующийся аммиак отделяют от непрореагировавших азота и водорода сжижением в холодильнике, возвращая непрореагировавшую азотоводородную смесь в колонну синтеза.
Процесс непрерывный, циркуляционный.
Применение: производство азотных удобрений, взрывчатых веществ, пластических масс и др.
Производство метилового спирта
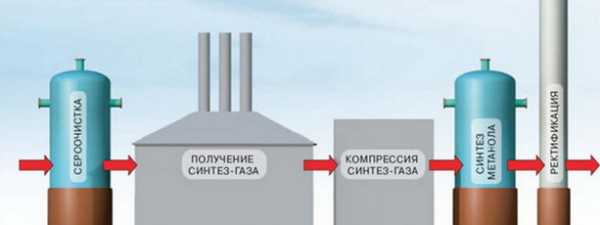
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Современный способ:
Сырье: синтез-газ — смесь оксида углерода (II) с водородом (1:2).
Вспомогательные материалы: катализаторы (ZnO и CuO).
Основной химический процесс: синтез-газ при температуре 250 °С и давлении 7 МПа превращается каталитически в метанол:
СО + 2Н2 ↔ СНзОН + Q
Особенности технологического процесса: при прохождении газовой смеси через слой катализатора образуется 10—15% метанола, который конденсируют, а непрореагировавшую смесь смешивают со свежей порцией синтез — газа и после нагревания снова направляют в слой катализатора (циркуляция). Общий выход — 85%.
Условия проведения синтеза метанола и аммиака при среднем давлении сходны, а сырье (природный газ) общее для обоих процессов. Поэтому чаще всего производства метанола и аммиака объединяют (азотно-туковые заводы).
himege.ru
Аммиак газ, физические свойства аммиака, химические свойства аммиака.
Продажа Производство ДоставкаГазообразный
Жидкий
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуяион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Химические свойства
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
- NH3 + H+ → NH4+
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
- Взаимодействуя с кислотами даёт соответствующие соли аммония:
- NH3 + HNO3 → NH4NO3
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
- 2NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
- NaNH2 + H2O → NaOH + NH3
- CaNH + 2H2O → Ca(OH)2 + NH3↑
- Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑
и в спиртах:
- KNH2 + C2H5OH → C2H5OK + NH3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
- MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
- 4NH3 + 3O2 → 2N2 + 6H20
- 4NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
- 3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- 2NH3 + NaClO → N2H4 + NaCl + H2O
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
- CH4 + NH3 + 1,5O2 → HCN + 3H2O
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского словаамониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
- 2NH3 → NH4+ + NH2−
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
- 2Na + 2NH3 → 2NaNH2 + H2
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
- CuSO4 + 4NH3 → [Cu(NH3)4]SO4
- Ni(NO3)2 + 6NH3 → [Ni(NH2)6](NO3)2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзныйдерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области .
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Обычно лабораторным способом получают получают слабым нагреванием смеси хлорида аммония с гашеной известью. 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление(при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер)[2]. В промышленности аммиак осушают в абсорбционных колоннах.
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания. Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов. При ингаляционном применении — рефлекторная остановка дыхания, при местном применении — раздражения, дерматиты, экземы в месте аппликации. Местное применение возможно только на неповрежденную кожу. При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка. Взаимодействие с другими лекарственными средствами неизвестно. (Инструкция по применению)
xn--c1aomn.xn--p1ai
Производство аммиака: краткая характеристика
Муниципальное образовательное учреждение
Новосафоновская средняя общеобразовательная школа
Производство аммиака: краткая характеристика
Прокопьевский район 2006
Содержание
Введение
1.Способы получения аммиака
2. Современный процесс получения аммиака
Список использованной литературы
Введение
Общей экономической задачей каждого химического предприятия является получение химических веществ высокого качества и в достаточном количестве, чтобы их реализация приносила прибыль. С этим связано требование, чтобы все ресурсы использовались как можно более эффективно. Однако этого можно достичь лишь в том случае, если максимально эффективен сам химический процесс. В химической промышленности вместо понятия «реагенты» гораздо чаще используются термины «исходные материалы», «сырьевые материалы» или просто сырьё», иногда — «руда». Чтобы какой-либо процесс был экономически оправдан, необходимо достичь оптимального выхода целевого продукта из сырьевых материалов. Оптимальный выход не обязательно совпадает с теоретическим выходом или даже с максимально достижимым выходом. Получение максимально достижимого выхода может, например, потребовать слишком большого расхода какого-либо дорогостоящего исходного материала, или же слишком длительного проведения процесса, или же создаются экстремальные условия (очень высокие температуры или давления), чреватые опасными аварийными ситуациями и т.п., — всё это может сделать максимально достижимый выход экономически невыгодным.
Фактический выход каждого конкретного химического процесса может зависеть от целого ряда факторов, главные из них — температура, давление, присутствие катализатора, чистота исходных материалов, эффективность извлечения конечного продукта. Промышленное производство веществ подразумевает отличное знание теоретических закономерностей протекания химических реакций (энергетика химических реакций, химическая кинетика и катализ, химическое равновесие).
Все перечисленные ниже факторы важны, в особенности, если речь идёт о таких многотоннажных производствах, таких, как, например, производство аммиака.
Проектировщики химических предприятий создают сверхмощные установки по производству аммиака. Так, например, созданы установки, производящие 1000-1200 тонн аммиака в сутки. В настоящее время во всём мире ежегодно производится около 5 млн. тонн аммиака.
1. Способы получения аммиака
аммиак цианамидный процесс десульфуратор
Первым промышленным процессом, который использовался для получения аммиака, был цианамидный процесс. При нагревании извести СаО и углерода получали карбид кальция СаС2. Затем карбид нагревали в атмосфере азота и получали цианамид кальция СаСN2; далее аммиак получали гидролизом цианамида:
СаСN2(тв) + 3Н2О = 2NН3↑ + СаСО3(тв)
Этот процесс требовал больших затрат энергии и экономически был невыгоден.
В 1908 г. Немецкий химик Ф. Габер обнаружил, что аммиак можно получать из водорода и атмосферного азота на железном катализаторе. Первый завод по производству аммиака этим методом использовал водород, который получали электролизом воды. В последствии водород стали получать из воды путём восстановления коксом. Такой способ получения водорода намного экономичнее. После открытия Габера стремительно стало расти производство аммиака, это неудивительно, поскольку огромные количества аммиака необходимы для получения азот содержащих удобрений. На изготовление их используется приблизительно 80% всего получаемого в мире аммиака. Вместе с азотсодержащими удобрениями в почву вносится в растворимой форме азот, в котором нуждается большинство растений. Остальные ≈20% производимого аммиака используются для получения полимеров, взрывчатых веществ, красителей и других продуктов.
Современный процесс получения аммиак основан на его синтезе из азота и водорода с использованием специального катализатора:
N2 + 3Н2 ↔ 2NН3 ↑ + 45,9 кДж (1)
Поскольку данная реакция обратимая, возникает вопрос: при каких температурах и давления выгоднее всего добиваться максимального выхода
продукта? Так как реакция экзотермическая, то исходя из принципа Ле Шателье ясно, что чем ниже температура процесса, тем больше равновесие будет сдвигаться в сторону образования аммиака, и можно предположить, что следует максимально понижать температуру. Но в действительности всё обстоит сложнее: при низких температурах реакция практически не идёт, поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости — высокая температура, на практике процесс проводят при температуре ≈ 400 – 500 оС.
Но даже при такой высокой температуре для достижения достаточной скорости реакции требуется присутствие специального катализатора. В качестве катализатора используется губчатое железо, активированное оксидами калия и алюминия.
Из уравнения реакции видно, что общее число молей уменьшается от 4 до 2. Согласно принципу Ле Шателье в таком случае процесс выгодно проводить, повышая давление. Но этот вывод лишь качественный, анна практике нужно точно знать, насколько увеличится выход NН3 (на 10% или всего на 0,1%) при увеличение давления. В таблице 1 количественно показано влияние температуры и давления на выход аммиака (процентное содержание аммиака в равновесной смеси) по реакции.
Из этой таблицы видно, что повышение температуры при любом давлении заметно снижает содержание аммиака в газовой смеси, однако при температурах ниже 500 оС скорость реакции очень мала, поэтому на практике процесс обычно проводят при температуре 450 оС.
Таблица 1
Что касается давления, то здесь используется давления порядка 300 – 100 атм, но чаще всего «среднее» давление ≈ 250 атм. Хотя при этих условиях только около 20% исходных веществ превращается в аммиак, однако в результате использования циркуляционной технологической схемы (введение непрореагировавших Н2 и N2 вновь в реакцию) суммарная степень превращения исходных веществ в аммиак является очень высокой.
2. Современный процесс получения аммиака
Работа современного аммиачного завода очень сложна. Это утверждение кажется удивительным, если «ориентироваться» только лишь на достаточно просто выглядящее уравнение реакции (1), являющееся основой синтеза аммиака. Однако утверждение о сложности промышленного синтеза аммиака не покажется чрезмерным уже после первого ознакомления со схемой действия аммиачного завода, работающего на природном газе (рис.1). Первая стадия в процессе синтеза аммиака включает десульфуратор. Десульфуратор — техническое устройство по удалению серы из природного газа. Это совершенно необходимая стадия, поскольку сера представляет собой каталитический яд и «отравляет» никелевый катализатор на последующей стадии получения водорода.
Вторая стадия промышленного синтеза аммиака предполагает конверсию метана (промышленное получение водорода). Конверсия метана — это обратимая реакция, протекающая при 700 – 800 оС и давлении 30 – 40 атм с помощью никелевого катализатора при смешивании метана с парами воды:
СН4 + Н2О ↔ СО + 3Н2 (2)
Образовавшийся по данной реакции водород, казалось бы, уже можно использовать для синтеза аммиака по реакции (1) — для этого необходимо запустить в реактор воздух содержащий азот. Так и поступают на стадии (3), однако на этой стадии происходят другие процессы.
Происходит частичное сгорание водорода в кислороде воздуха:
2Н2 + О2 = Н2О(пар)
В результате на этой стадии получается смесь водяного пара, оксида углерода (II) и азота. Водяной пар, в свою очередь, восстанавливается снова с образованием водорода, как на второй стадии по торой стадии по им образом, после первых трёх стадий имеется смесь водорода, азота и «нежелательного» оксида углерода (II).
На рис.1 стадия (4) обозначена как реакция «сдвига», но проходить она может при двух температурных режимах и разных катализаторах. Окисление
СО, образующегося на двух предыдущих стадиях, до СО2 проводят именно по этой реакции:
СО + Н2О(пар) ↔ СО2 + Н2 (3)
Процесс «сдвига» проводят последовательно в двух «ректорах сдвига». В первом из них используется катализатор Fe3О4 и процесс проходит при достаточно высокой температуре порядка 400 оС. Во втором процессе используется более эффективный медный катализатор и процесс удаётся провести при более низкой температуре.
На пятой степени оксид углерода (IV) «вымывают» из газовой смеси при помощи поглощения щелочным раствором:
КОН + СО2 = К2СО3.
Реакция «сдвига» (3) обратимая и после 4-й стадии в газовой смеси на самом деле остаётся ещё ≈ 0,5% СО. Этого количества СО вполне достаточно, чтобы загубить железный катализатор на главной стадии синтеза аммиака(1). На 6-й стадии оксид углерода (II) удаляют реакцией конверсии водородом в метан на специальном никелевом катализаторе при температурах 300 – 400 оС:
СО + 3Н2 ↔ СН4 +Н2О
Газовую смесь, которая теперь содержит ≈ 75% водорода и 25% азота, подвергают сжатию; давление её при этом возрастает от 25 – 30 до 200 – 250 атм. В соответствии с уравнением Клайперона-Менделеева такое сжатие приводит к очень резкому повышению температуры смеси. Сразу же после сжатия приходиться охлаждать до 350 – 450 оС. Именно этот процесс и описывается с точностью реакцией (1).
Список использованной литературы
1.Н.Е. Кузьменко, В.В. Ерёмин, В.А. Попков. Химия. Теория и задачи. — М.: ОНИКС 21 век», «Мир и образование», 2003.
mirznanii.com
Аммиак — Мегаэнциклопедия Кирилла и Мефодия — статья
Аммиа́к (от греч. hals ammoniakos — амонова соль, нашатырь, который получали около храма бога Амона в Египте), NH3, бесцветный газ с резким запахом. Молекула имеет форму правильной пирамиды. Связи N—H полярны. Молярная масса 17 г/моль. Плотность 0, 639 г/дм3. Температура кипения –33, 35 °C, температура плавления –77, 7 °C. Критическая температура 113 °C, критическое давление 11, 425 кПа. Теплота испарения 23, 27 кДж/моль, теплота плавления 5, 86 кДж/моль. Впервые чистый аммиак был получен в 1774 году британским естествоиспытателем и химиком Джозефом Пристли. Промышленную технологию получения аммиака разработали и осуществили в 1913 году немецкие ученые Ф. Габер и К. Бош, получившие за свои исследования Нобелевские премии.В промышленности аммиак получают в стальных колоннах синтеза, наполненных катализатором — пористым железом. Через колонну под давлением 30 МПа и при температуре 420-500 °C пропускают смесь азота и водорода. Так как реакция3Н2 + N2 = 2NH3 + 104 кДж
обратима, при однократном проходе газовой смеси через колонну в аммиак превращается не более 15-25% исходных веществ. Для полного превращения необходима многократная циркуляция, которую осуществляют с помощью компрессора. В цикл непрерывно вводят свежую газовую смесь взамен использованной на образование аммиака.
В лаборатории газообразный аммиак получают нагреванием аммиачной воды или твердой смеси NH4Сl и Сa(OH)2:
2NH4Сl + Сa(OH)2 = 2NH3 + CaCl2 + 2H2О
Для осушения аммиака его пропускают через смесь извести с едким натром.
Хорошо растворим в воде (700 объемов NH3 в 1 объеме воды при комнатной температуре). Максимальная массовая концентрация (%) аммиака в водном растворе 42, 8 (0 °C), 33, 1 (20 °C), 23, 4 (40 °C). Плотность водных растворов аммиака (кг/дм3): 0, 97 (8% по массе), 0, 947 (16%), 0, 889 (32 %). Раствор аммиака в воде называют аммиачной водой, ее концентрация 25%. В водном растворе аммиак частично ионизирован, что обусловливает щелочную реакцию раствора:
NH3 + Н2О = NH4+ + ОН–
На самом деле молекул NH4ОН в растворе не существует. Атом N в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподеленную пару. Он не может быть соединен с атомами кислорода и водорода пятью полярными ковалентными связями. Имеется в виду гидратированный аммиак, NН3·Н2О.Аммиак проявляет свойства основания (основания Бренстедта). В кислой среде молекула NH3 присоединяет ион Н+, образуется ион аммония NH4+. Реагируя с кислотами, аммиак нейтрализует их, образуя соли аммония:NH3 + HCl = NH4Cl
Большинство солей аммония бесцветны и хорошо растворимы в воде. Растворы солей, образованные аммиаком и сильными кислотами, имеют слабокислую реакцию.
Смесь аммиака и воздуха взрывоопасна. Но горит аммиак только в чистом кислороде бледным зеленым пламенем:4NH3 + 3О2 = 2N2 + 6Н2О,
применение платинового катализатора, образуется оксид азота (II) NО:
4NH3 + 5О2 = 4NО + 6Н2О
Аммиак обладает восстановительными свойствами:
2NH3 + Fe2O3 = 2Fe + N2 + 3H2O
При определенных условиях аммиак реагирует с галогенами. Щелочные и щелочно-земельные металлы реагируют с жидким и газообразным аммиаком, давая амиды. При нагревании в Атмосфере аммиака многие металлы и неметаллы (Zn, Cd, Fe, Cr, B, Si и другие) образуют нитриды. Жидкий аммиак взаимодействует с серой:10S + 4 NH3 = 6 Н2S + N4S4При 1000 °C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород.
В промышленности аммиак используют при получении азотной кислоты HNO3, в производстве азотных минеральных удобрений, в качестве хладагента. Аммиачная вода является азотным удобрением. Нашатырный спирт используют в медицине.
Аммиак ядовит, ПДК 20 мг/м3. Жидкий аммиак вызывает сильные ожоги. При содержании в воздухе 0, 5% по объему аммиак сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхательные пути. При хроническом отравлении — расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
megabook.ru
