Свойства кислорода, уксусной кислоты и алюминия
| Свойства вещества | Вещество | ||
| Kислород | Уксусная кислота | Алюминий | |
| Агрегатное состояние при обычных условиях | Газ | Жидкость | Твердое вещество |
| Цвет | Без цвета | Без цвета | Серебристо-белый |
| Вкус | Безвкусный | Kислый | Безвкусный |
| Запах | Не имеет | Резкий специфический | Не имеет |
| Растворимость в воде | Плохо растворим | Растворима | Практически нерастворим |
| Теплопроводность | Низкая | Небольшая | Высокая |
| Электропроводность | Отсутствует | Малая | Высокая |
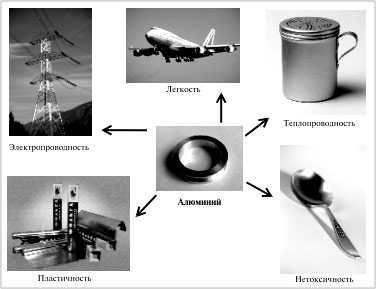
Знание свойств веществ необходимо для их практического применения. Например, на рис. 5 (см.
с. 14) представлены области применения алюминия, обусловленные свойствами этого металла.
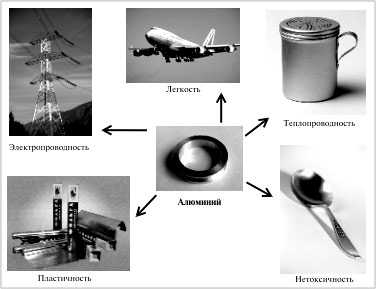 |
| Рис. 5. Области применения алюминия, обусловленные его свойствами |
Многие вещества – ядовитые, взрывоопасные и горючие, а поэтому требуют осторожного и грамотного отношения при работе с ними. Теперь вам, очевидно, стало понятно, почему химию изучают на более старшей ступени обучения в школе – в 8-м классе.
Наш курс призван подготовить вас к изучению этого серьезного и важного предмета, поэтому он так и называется: «Старт в химию».
Но является ли химия совершенно новой для вас дисциплиной? Об этом вы узнаете из следующих параграфов.
1. Какие учебные предметы относятся к естественным?
2.Приведите примеры положительного воздействия человека на окружающую среду.
3.Приведите примеры отрицательного воздействия человека на природу.
4.Что изучает химия?
5. Из следующего перечня названий выпишите отдельно тела и вещества: снежинка, капля росы, вода, льдинка, сахар-песок, кусочек сахара, мел, школьный мелок. Сколько тел и сколько веществ названо в этом списке?
6.Сравните свойства веществ (т. е. установите общее и различное между ними): а) углекислый газ и кислород; б) азот и углекислый газ; в) сахар и соль; г) уксусная и лимонная кислоты.
7. Какие свойства алюминия лежат в основе его применения?
8. Почему химию начинают изучать позже, чем биологию, географию, физику?
Продолжение. Начало см. в № 1/2006
§ 2. Наблюдение и эксперимент как методы
изучения естествознания и химии
Знания о природе человек получает с помощью такого важнейшего метода, как наблюдение.
Наблюдение– это концентрация внимания на познаваемых объектах с целью их изучения.
С помощью наблюдения человек накапливает информацию об окружающем мире, систематизирует ее и ищет закономерности в этой информации. Следующий важный шаг – поиск причин, которые объясняют найденные закономерности.
Для того чтобы наблюдение было плодотворным, необходимо соблюдать ряд условий.
1. Нужно четко определить предмет наблюдения, на что будет обращено внимание наблюдателя, – конкретное вещество, его свойства или превращение одних веществ в другие, условия осуществления этих превращений и т.д.
2. Наблюдатель должен знать, зачем он проводит наблюдение, т.е. четко сформулировать цель наблюдения.
3. Чтобы достигнуть поставленной цели, можно составить план наблюдения. А для этого лучше выдвинуть предположение о том, как будет происходить наблюдаемое явление, т.е. выдвинуть гипотезу. В переводе с греческого «гипотеза» (hypo’thesis) означает «предположение». Гипотеза может быть выдвинута и в результате наблюдения, т.е. тогда, когда получен какой-то результат, который нужно объяснить.
Научное наблюдение отличается от наблюдения в житейском смысле этого слова. Как правило, научное наблюдение проводится в строго контролируемых условиях, причем условия эти можно изменять по желанию наблюдателя. Чаще всего такое наблюдение проводится в специальном помещении – лаборатории (рис. 6).
 |
| Рис. 6. В химической лаборатории |
Наблюдение, которое проводится в строго контролируемых условиях, называется экспериментом.
Слово «эксперимент» (experimentum) имеет латинское происхождение и на русский язык переводится как «опыт», «проба». Эксперимент позволяет подтвердить или опровергнуть гипотезу, которая родилась из наблюдения. Так формулируется вывод.
Проведем небольшой эксперимент, с помощью которого изучим строение пламени.
Зажгите свечу и внимательно рассмотрите пламя. Вы заметите, что оно неоднородно по цвету. Пламя имеет три зоны (рис. 7). Темная зона 1 находится в нижней части пламени. Это самая холодная зона по сравнению с другими. Темную зону окаймляет самая яркая часть пламени 2. Температура здесь выше, чем в темной зоне, но наиболее высокая температура – в верхней части пламени 3.
| Рис. 7. Строение пламени свечи |
Чтобы убедиться, что различные зоны пламени имеют разную температуру, можно провести такой опыт. Поместите лучинку (или спичку) в пламя так, чтобы она пересекала все три зоны. Вы увидите, что лучинка сильнее обуглилась там, где она попала в зоны 2 и 3. Значит, пламя там более горячее.
Возникает вопрос: будет ли пламя спиртовки или сухого горючего иметь такое же строение, как и пламя свечи? Ответом на этот вопрос могут служить два предположения – гипотезы: 1) строение пламени будет таким же, как и пламя свечи, потому что в его основе лежит один и тот же процесс горения; 2) строение пламени будет различным, т.к. оно возникает в результате горения различных веществ. Для того чтобы подтвердить или опровергнуть ту или иную гипотезу, обратимся к эксперименту – проведем опыт.
Исследуем с помощью спички или лучинки строение пламени спиртовки (с устройством этого нагревательного прибора вы познакомитесь при выполнении практической работы) и сухого горючего.
Несмотря на то, что язычки пламени в каждом случае отличаются формой, размерами и даже окраской, все они имеют одинаковое строение – те же три зоны: внутреннюю темную (самую холодную), среднюю светящуюся (горячую) и внешнюю бесцветную (самую горячую).
Следовательно, выводом из проведенного эксперимента может быть утверждение о том, что строение любого пламени одинаково. Практическое значение этого вывода состоит в следующем: для того чтобы нагреть в пламени какой-либо предмет, его надо вносить в самую горячую, т.е. в верхнюю, часть пламени.
Оформлять эксперименты принято в специальном журнале, который называют лабораторным. Для этого подойдет обыкновенная тетрадь, а вот записи в ней делают не совсем обычные. Отмечают дату проведения эксперимента, его название, а ход опыта часто оформляют в виде таблицы.
| Что делал | Что наблюдал | Вывод |
Попробуйте таким образом описать эксперимент по изучению строения пламени.
Великий Леонардо да Винчи говорил, что науки, которые не родились из эксперимента, этой основы всех познаний, бесполезны и полны заблуждений.
Все естественные науки – науки экспериментальные. А для постановки эксперимента часто необходимо специальное оборудование. Например, в биологии широко используются оптические приборы, которые позволяют во много раз увеличить изображение наблюдаемого объекта: увеличительное стекло, лупа, микроскоп. Физики при изучении электрических цепей используют приборы для измерения напряжения, силы тока и электрического сопротивления. Ученые-географы имеют специальные приборы – от самых простейших (например, компас, метеорологические зонды) до уникальных космических орбитальных станций и научно-исследовательских судов.
Химики в своих исследованиях также используют специальное оборудование. Простейшее из них – это, например, уже знакомый вам нагревательный прибор спиртовка и различная химическая посуда, в которой проводят и изучают превращения веществ, т.е. химические реакции (рис. 8).
 |
| Рис. 8. Лабораторная химическая посуда и оборудование |
Справедливо говорят, что лучше один раз увидеть, чем сто раз услышать. А еще лучше – подержать в руках и научиться пользоваться. Поэтому ваше первое знакомство с химическим оборудованием произойдет во время практической работы, которая вас ожидает на следующем уроке.
1. Что такое наблюдение? Какие условия необходимо соблюдать, чтобы наблюдение было результативным?
2. Чем различаются гипотеза и вывод?
3. Что такое эксперимент?
4. Какое строение имеет пламя?
6.Какое лабораторное оборудование вы применяли при изучении биологии и географии?
7. Какое лабораторное оборудование используется при изучении химии?
Практическая работа № 1.
Знакомство с лабораторным оборудованием.
Правила техники безопасности
Большинство химических опытов проводят в стеклянной посуде. Стекло прозрачно, и вы можете наблюдать, что происходит с веществами. В некоторых случаях стекло заменяют прозрачной пластмассой, она не бьется, но такую посуду, в отличие от стеклянной, нельзя нагревать.
| Рис. 9. Штатив с пробирками |
Химические реакции проводят в пробирках (рис. 9), плоскодонных (рис. 10) или конических (рис. 11) колбах. Если содержимое пробирки нужно нагреть, пользуются специальными держателями
(рис. 12). Нагревать можно только те колбы, которые сделаны из специального термостойкого стекла. Такую посуду помечают специальным знаком – матовым прямоугольником.
| Рис. 10. Плоскодонные колбы | Рис. 11. Конические колбы |
Для демонстрационного эксперимента часто используют химические стаканы (рис. 13). Часто стаканы и конические колбы имеют специальные отметки, с их помощью можно приблизительно определить объем находящейся в них жидкости.
| Рис. 12. Держатель для пробирок | Рис. 13. Химические стаканы |
Круглодонные колбы (рис. 14) нельзя поставить на стол, их закрепляют на металлических стойках – штативах (рис. 15) – с помощью лапок. Лапки, а также металлические кольца крепят на штативе специальными зажимами. В круглодонных колбах удобно получать какие-либо вещества, например газообразные. Для того чтобы собирать образующиеся газы, используют колбу с отводом (ее называют колбой Вюрца (рис. 16)) или пробирку с газоотводной трубкой.
| Рис. 14. Круглодонная колба | Рис. 15. Штатив с кольцом, лапкой и зажимами |
Если образующиеся газообразные вещества нужно охладить, сконденсировать в жидкость, используют стеклянный холодильник (рис. 17). По его внутренней трубке движутся охлаждаемые газы, превращаясь в жидкость под действием холодной воды, которая течет по «рубашке» холодильника в обратном направлении.
| Рис. 16. Колба Вюрца | Рис. 17. Стеклянные холодильники |
Конусные воронки (рис. 18) служат для переливания жидкостей из одного сосуда в другой, они также незаменимы в процессе фильтрования. Вы, наверное, знаете, что фильтрованием называют процесс отделения жидкости от частиц твердого вещества.
| Рис. 18. Конусные воронки |
Для разделения двух несмешивающихся жидкостей, например бензина и воды, служат делительные воронки (рис. 19). Нижний слой более тяжелой жидкости сливается с помощью краника через нижнюю трубку, жидкость с меньшей плотностью остается в воронке.
| Рис. 19. Делительные воронки |
Посуда с толстыми стенками, похожая на глубокую тарелку, называется кристаллизатором (рис. 20). Из-за большой площади поверхности налитого в кристаллизатор раствора растворитель быстро испаряется, растворенное вещество выделяется в виде кристаллов. Нагревать кристаллизатор нельзя ни в коем случае: его стенки только кажутся прочными, на самом деле при нагревании он обязательно треснет.
| Рис. 20. Кристаллизаторы |
При выполнении химического эксперимента часто приходится отмерять необходимый объем жидкости. Чаще всего для этого используют мерные цилиндры (рис. 21).
| Рис. 21. Мерные цилиндры |
Помимо стеклянной посуды в школьной химической лаборатории есть посуда фарфоровая. В ступке пестиком (рис. 22) измельчают кристаллические вещества. Стеклянная посуда для этого не подходит: от давления пестика она сразу расколется.
| Рис. 22. Ступка с пестиком |
Стенки фарфоровой чашки гладкие и блестящие (рис. 23). Она похожа на маленький кристаллизатор, и нагревать ее можно даже на открытом пламени до полного выпаривания раствора.
| Рис. 23. Фарфоровая чашка |
Чтобы избежать неприятностей и травм, каждый предмет нужно использовать строго по назначению, знать, как с ним обращаться. Химический эксперимент будет действительно безопасным, поучительным и интересным, если соблюдать меры предосторожности при работе с химической посудой, реактивами, оборудованием. Эти меры называются правилами техники безопасности.
Кабинет химии – необычный кабинет. Значит, и требования к вам здесь особенные. Например, в химическом кабинете ни в коем случае нельзя есть, поскольку многие из веществ, с которыми вы будете работать, ядовиты.
От других кабинетов химический отличается тем, что здесь есть вытяжной шкаф (рис. 24). Многие вещества имеют резкий неприятный запах, их пары не безвредны для здоровья. С такими веществами работают в вытяжном шкафу, из которого газообразные вещества попадают прямо на улицу.
| Рис. 24. Вытяжной шкаф |
Для защиты глаз при проведении особо опасных опытов используют защитные очки (рис. 25).
| Рис. 25. Защитные очки |
Склянку с реактивом нужно брать так, чтобы этикетка оказалась в ладони. Это делается для того, чтобы случайные потеки не испортили надпись.
Некоторые химические вещества ядовиты, есть реактивы, разъедающие кожу, многие вещества легко воспламеняются. Предупреждают об этом специальные знаки на этикетках (рис. 26, см. с. 7).
 |
| Рис. 26. Правила работы в химической лаборатории регулируются специальными знаками |
Не приступайте к эксперименту, если точно не знаете, что и как нужно делать. Работать надо, строго соблюдая инструкцию и только с теми веществами, которые для опыта необходимы.
Подготовьте рабочее место, рационально разместите реактивы, посуду, принадлежности, чтобы не пришлось тянуться через стол, опрокидывая рукавом колбы и пробирки. Не загромождайте стол тем, что не потребуется для эксперимента.
Опыты нужно проводить только в чистой посуде, а значит, после работы ее нужно тщательно вымыть. Заодно вымойте руки.
Все манипуляции нужно проводить над столом.
Чтобы определить запах вещества, не подносите сосуд близко к лицу, а подгоните рукой воздух от отверстия сосуда к носу (рис. 27).
| Рис. 27. Определение запаха веществ |
Никакие вещества нельзя пробовать на вкус!
Никогда не выливайте излишек реактива обратно в склянку. Пользуйтесь для этого специальным стаканом для отходов. Рассыпанные твердые вещества тоже нежелательно собирать обратно, тем более руками.
Если вы нечаянно обожглись, порезались, разлили реактив на стол, на руки или на одежду, сразу обращайтесь к учителю или лаборанту.
Закончив эксперимент, приведите рабочее место в порядок.
Практическая работа № 2.
Наблюдение за горящей свечой
Казалось бы, что можно написать о таком простом объекте наблюдения, как горящая свеча? Однако наблюдательность – это не только способность видеть, это способность обращать внимание на детали, сосредоточенность, умение анализировать, порой даже обыкновенная настойчивость. Великий английский физик и химик М.Фарадей писал: «Рассмотрение физических явлений, происходящих при горении свечи, представляет собой самый широкий путь, которым можно подойти к изучению естествознания».
Цель данной практической работы – научиться наблюдать и описывать результаты наблюдения. Вам предстоит написать небольшое сочинение-миниатюру про горящую свечу (рис. 28). Чтобы помочь вам в этом, предлагаем несколько вопросов, на которые нужно дать подробные ответы.
| Рис. 28. Горящая свеча |
Опишите внешний вид свечи, вещество, из которого она изготовлена (цвет, запах, ощущение на ощупь, твердость), фитиль.
Зажгите свечу. Опишите внешний вид и строение пламени. Что происходит с материалом свечи при горении фитиля? Как выглядит фитиль в процессе горения? Нагревается ли свеча, слышен ли звук при горении, выделяется ли тепло? Что происходит с пламенем, если появляется движение воздуха?
Как быстро сгорает свеча? Изменяется ли длина фитиля в процессе горения? Что представляет собой жидкость у основания фитиля? Что с ней происходит, когда она поглощается материалом фитиля? А когда ее капли стекают вниз по свече?
Многие химические процессы протекают при нагревании, однако пламя свечи для этой цели не используется. Поэтому во второй части этой практической работы познакомимся с устройством и работой уже знакомого вам нагревательного прибора – спиртовки (рис. 29). Спиртовка состоит из стеклянного резервуара 1, который заполняют спиртом не более чем на 2/3 объема. В спирт погружен фитиль 2, который сделан из хлопчатобумажных нитей. Он удерживается в горлышке резервуара с помощью специальной трубочки с диском 3. Зажигают спиртовку только с помощью спичек, для этой цели нельзя использовать другую горящую спиртовку, т.к. при этом может разлиться и вспыхнуть пролитый спирт. Фитиль необходимо ровно обрезать ножницами, в противном случае он начинает обгорать. Чтобы потушить спиртовку, нельзя дуть на пламя, для этой цели служит стеклянный колпачок 4. Он же предохраняет спиртовку от быстрого испарения спирта.
| Рис. 29. Устройство спиртовки |
Моделирование
Кроме наблюдения и эксперимента в познании естественного мира и химии большую роль играет моделирование.
Мы уже говорили о том, что одна из главных целей наблюдения – поиск закономерностей в результатах экспериментов.
Однако некоторые наблюдения неудобно или невозможно проводить непосредственно в природе. Естественную среду воссоздают в лабораторных условиях с помощью особых приборов, установок, предметов, т.е. моделей. В моделях копируются только самые важные признаки и свойства объекта и опускаются несущественные для изучения. Слово «модель» имеет франко-итальянские корни и переводится на русский как «образец». Моделирование – это изучение некоторого явления с помощью его моделей, т.е. заменителей, аналогов.
Например, для того чтобы изучить молнию (природное явление), ученым не нужно было дожидаться непогоды. Молнию можно смоделировать на уроке физики и в школьной лаборатории. Двум металлическим шарикам нужно сообщить противоположные электрические заряды – положительный и отрицательный. При сближении шариков до определенного расстояния между ними проскакивает искра – это и есть молния в миниатюре. Чем больше заряд на шариках, тем раньше при сближении проскакивает искра, тем длиннее искусственная молния. Такую молнию получают с помощью специального прибора, который называется электрофорной машиной.
Изучение модели позволило ученым определить, что природная молния – это гигантский электрический разряд между двумя грозовыми облаками или между облаками и землей. Однако настоящий ученый стремится найти практическое применение каждому изучаемому явлению. Чем мощнее электрическая молния, тем выше ее температура. А ведь превращение электрической энергии в теплоту можно «укротить» и использовать, например, для сварки и резки металлов. Так родился знакомый сегодня каждому процесс электросварки.
Каждая естественная наука использует свои модели, которые помогают зримо представить себе реальное природное явление или объект.
Самая известная географическая модель – глобус. Это миниатюрное объемное изображение нашей планеты, с помощью которой вы можете изучать расположение материков и океанов, стран и континентов, гор и морей. Если же изображение земной поверхности нанести на лист бумаги, то такая модель называется картой.
Моделирование в физике используется особенно широко. На уроках по этому предмету вы будете знакомиться с самыми разными моделями, которые помогут вам изучить электрические и магнитные явления, закономерности движения тел, оптические явления.
При изучении биологии модели также широко используются. Достаточно упомянуть, например, модели – муляжи цветка, органов человека и т.д.
Не менее важно моделирование и в химии. Условно химические модели можно разделить на две группы: материальные и знаковые (или символьные).

Материальные модели атомов, молекул, кристаллов, химических производств химики используют для большей наглядности.
Вы, наверное, видели изображение модели атома, напоминающее строение Солнечной системы (рис. 30).
| Рис. 30. Модель строения атома |
Для моделирования молекул химических веществ используют шаростержневые или объемные модели. Их собирают из шариков, символизирующих отдельные атомы. Различие состоит в том, в шаростержневых моделях шарики-атомы расположены друг от друга на некотором расстоянии и скреплены друг с другом стерженьками. Например, шаростержневая и объемная модели молекул воды показаны на рис. 31.
| Рис. 31. Шаростержневая и объемная модели молекулы воды |
Модели кристаллов напоминают шаростержневые модели молекул, однако изображают не отдельные молекулы вещества, а показывают взаимное расположение частиц вещества в кристаллическом состоянии (рис. 32).
| Рис. 32. Модель кристалла меди |
Однако чаще всего химики пользуются не материальными, а знаковыми моделями – это химические символы, химические формулы, уравнения химических реакций.
Разговаривать на химическом языке, языке знаков и формул, вы начнете уже со следующего урока.
1. Что такое модель и что – моделирование?
2.Приведите примеры: а) географических моделей; б) физических моделей; в) биологических моделей.
3.Какие модели используют в химии?
4.Изготовьте из пластилина шаростержневые и объемные модели молекул воды. Какую форму имеют эти молекулы?
5.Запишите формулу цветка крестоцветных, если вы изучали это семейство растений на уроках биологии. Можно ли назвать эту формулу моделью?
6.Запишите уравнение для расчета скорости движения тела, если известны путь и время, за которое он пройден телом. Можно ли назвать это уравнение моделью?
Химические знаки и формулы
К символьным моделям в химии относят знаки или символы химических элементов, формулы веществ и уравнения химических реакций, которые лежат в основе «химической письменности». Ее основоположником является шведский химик Йенс Якоб Берцелиус. Письменность Берцелиуса строится на важнейшем из химических понятий – «химический элемент». Химическим элементом называют вид одинаковых атомов.
Берцелиус предложил обозначать химические элементы первой буквой их латинских названий. Так символом кислорода стала первая буква его латинского названия: кислород – О (читается «о», т.к. латинское название этого элемента oxygenium). Соответственно водород получил символ H (читается «аш», т.к. латинское название этого элемента hydrogenium), углерод – С (читается «цэ», т.к. латинское название этого элемента carboneum). Однако латинские названия хрома (chromium), хлора (chlorum) и меди (cuprum) так же, как и углерода, начинаются на «С». Как же быть? Берцелиус предложил гениальное решение: такие символы записывать первой и одной из последующих букв, чаще всего второй. Так, хром обозначается Сr (читается «хром»), хлор – Cl (читается «хлор»), медь – Cu (читается «купрум»).
| Й.Я.Берцелиус (1779–1848) |
Русские и латинские названия, знаки 20 химических элементов и их произношения приведены в табл. 2.
В нашей таблице уместилось всего 20 элементов. Чтобы увидеть все 110 элементов, известных на сегодняшний день, нужно посмотреть в таблицу химических элементов Д.И.Менделеева.
Таблица 2
infopedia.su
Свойства aлюминия, его применение и история производства
Свойства Al, его применение и история производства.
1.1. Свойства Al и его применение.
Алюминий (Al) – химический элемент III группы Периодической системы элементов Д.И. Менделеева (порядковый номер 13, атомная масса 26,9815). В природе существует один стабильный изотоп — 27Al. Искусственно были получены еще 3 изотопа с массовыми числами 26, 28 и 29 и периодами полураспада 7, 138 и 402 соответственно.
Атом aлюминия имеет конфигурацию 1S22S22p63S23p1. На внешнем электронном слое атома aлюминия (оболочка М) находится три валентных электрона: два на 3S-орбите с потенциалами ионизации 1800 и 2300 кДж/моль и один на 3р-орбите с потенциалом 574,5 кДж/моль. Поэтому обычно проявленная валентность у aлюминия «+3», реже, при высоких температурах «+1» (в субсоединениях), редко «+2». Кристаллическая решетка aлюминия — гранецентрированный куб, а0=0,404 нм. Атомный радиус aлюминия — 0,143 нм, ионный — 0,057 нм. Температура плавления aлюминия высокой чистоты (99,996% Al) — 620,240С; температура кипения 25000С. Плотность твердого aлюминия при 20 0С -2,6996 г/см3; плотность жидкого при 10000С — 2,289 г/см3; удельное электросопротивление при 200С — 0,0265 мкОм×м; коэффициент расширения при 200С — 23×10-6 К-1; электрохимический эквивалент — 0,3354 г/А*ч. Стандартный электродный потенциал: -1,67В.
Алюминий — один из наиболее электроотрицательных элементов, однако на воздухе процесс окисления существенно замедляется, благодаря образованию тонкой пленки оксида. Высокая электропроводность aлюминия и его положение в ряду напряжений выше водорода исключает его получение электролизом водных растворов, и поэтому применяют технологии с обязательным получением оксида алюминия (Al2О3 — глинозема).
Теплота образования Al2О3 равна 1670 кДж/моль, что позволяет эффективно использовать алюминий для восстановления других металлов из оксидов (алюминотермия). Алюминий — металл, обладающий амфотерными свойствами, т.е. реагируя с кислотами, образует соответствующие соли, со щелочами — алюминаты. Это существенно расширяет возможности извлечения алюминия по массе в земной коре 8,13% — третье после О2 и Si. Однако для получения оксида алюминия, необходимого полупродукта в технологии алюминия, используется ограниченный круг минералов и руд.
Уникальные сочетания свойств алюминия — малая плотность, высокая теплопроводность и электропроводность, механическая прочность и высокая пластичность обеспечили широкое применение как чистого металла, так и сплавов на его основе.
Чистый алюминий широко используется в пищевой промышленности (упаковочные материалы) и в электротехнической промышленности (кабели, провода, шинопроводы и т.д.)
Алюминиевые сплавы делятся на две большие группы — деформируемые (80% от общего объема) и литейные (20%). К деформируемым относятся несколько десятков сплавов, среди которых наиболее известен дюралюминий. Алюминий и большинство Алюминиевых сплавов относятся к весьма пластичным металлическим материалам. Из алюминиевых сплавов изготавливаются почти все известные в технике деформируемые полуфабрикаты: фольгу, лист, плиты, прутки, различные профили, трубы, головки и штамповки, проволоку. Заготовками во многих случаях служат слитки, полученные методом непрерывного литья. При производстве полуфабрикатов широко используются способы горячей и холодной обработки давлением.
Среди большого числа литейных сплавов самые распрастраненные — силумины (сплавы на основе системы Al-Si).
Широко применяются модифицированные силумины (т.е. с улучшенными механическими свойствами вследствие модифицирования малыми добавками) для литья ответственных деталей, когда требуется высокая прочность, хорошие литейные свойства.
Алюминиевые сплавы широко применяются в машиностроении, в первую очередь в авиа- и автомобилестроении, а так же в транспортном машиностроении. В последние годы существенно расширилось применение алюминиевых сплавов в промышленном и гражданском строительстве. В США, например, более четверти производимого Al идет на эти нужды.
В последние годы резко возрос интерес к новым материалам на основе Al. Среди них пеноалюминий [Al или алюминиевых сплавов, насыщенный H2 для образования ячеистого (пористого) строения] — уникальный материал с низкой плотностью (0.23-0.75), низкой теплопроводностью и электропроводностью, который режется ножом и паяется.
Большой интерес вызывают так же спеченные алюминиевые порошки (САП). Они могу содержать до 25% Al2O3, при этом прочность при температуре до 5000С.
Спеченные алюминиевые сплавы (САС) имеют коэффициент линейного расширения a=14¸15×10-6К-1 (у чистого Al a=23×10-6К-1), близкий к a для стали. Это позволяет использовать его вместе со сталью в различных механизмах и приборах.
Все более широкое применение находит алюминий и как эффективный раскислитель стали. В этих процессах используется высокое сродство алюминия к кислороду, позволяющее восстанавливать и переводить в шлак или в расплав, те или иные металлы.
То же свойство лежит и в основе алюминотермии — все более расширяющейся области применения Al. Она используется для восстановления трудно восстанавливаемых соединений таких металлов, как Cu, Ma, W, а в последние годы и для соединений таких металлов, как Ca, Sr, Ba и Li. Та алюминотермическая реакция положена и основу часто применяемой термитной сварки железных и стальных изделий.
И, наконец, среди менее емких, но не менее важных областей применения алюминия необходимо назвать новейшие области техники, в которых используется металл особой чистоты (ОЧ), а также производство товаров народного потребления.
В ядерной энергетике используется малая величина поперечного сечения захвата тепловых нейтронов у Al особой чистоты (нейтронопрозрачность). В радиоэлектронике используется полупроводниковые свойства Al и его соединений, что делает возможным создание на их основе элементов солнечных батарей. Производство товаров народного потребления в качестве основного металла так же потребляет Al технической чистоты и сплавы на его основе. Они идут на изготовление посуды, галантереи, бижутерии и т.д.
vunivere.ru
Старт в химию 7 класс
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
Глава 1. Химия в центре естествознания
§ 1. Химия как часть естествознания. Предмет химии
Человек связан с окружающим его миром живой и неживой природы тысячами незримых нитей. Он и сам является ее частью. Природа кормит, поит человека, обеспечивает его повседневные потребности, дарит несказанное удовольствие от общения с ней.
Однако взаимоотношения человека с окружающей средой складываются очень непросто. С одной стороны, человек благоговеет перед природой, восторгается ею, воспевает ее в стихах, запечатлевает в прекрасных картинах и фотографиях (рис. 1).
Рис.
1. |
С другой стороны, тот же человек вырубает леса, истребляет животных, загрязняет окружающий мир промышленными и бытовыми отходами, превращает прекрасные и полноводные реки в сточные канавы (рис. 2).
|
Рис.
2. |
Терпеливая и мудрая природа в ответ наказывает человека землетрясениями и цунами, наводнениями и снежными лавинами, непредсказуемыми сменами климата и погоды (рис. 3).
|
Рис.
3. |
Чтобы взаимоотношения человека и окружающего его мира были добрыми и гармоничными, необходимо знать и понимать природу, бережно к ней относиться, разумно и грамотно вести хозяйственную деятельность. Этому призваны способствовать и изучаемые в школе предметы, которые относятся к естествознанию: география, биология, физика, химия. С некоторыми из них вы уже успели познакомиться на предыдущих этапах обучения в школе.
В этом году вы начинаете изучать физику. И только через год, в 8-м классе, будете знакомиться с таким учебным предметом, как химия. И это не случайно. Ведь химия – эта та учебная дисциплина, которая требует к себе ответственного и взрослого отношения.
Химия – это наука о веществах, их строении, свойствах и превращениях одних веществ в другие.
Как вы знаете, все окружающие нас предметы принято называть физическими телами, а то, из чего они состоят, – веществами (рис. 4, см. с. 14).
|
Рис.
4. |
Всякое тело имеет форму и объем. В свою очередь, каждое вещество индивидуально и неповторимо по своим признакам – свойствам: агрегатному состоянию, плотности, цвету, блеску, запаху, вкусу, твердости, пластичности, растворимости в воде, способности проводить тепло и электрический ток.
Опишем, например, свойства трех различных веществ в трех различных агрегатных состояниях: кислорода, уксусной кислоты и алюминия (табл. 1, см. с. 14).
Таблица 1
Свойства кислорода, уксусной кислоты и алюминия
Свойства вещества | Вещество | ||
Kислород | Уксусная кислота | Алюминий | |
Агрегатное состояние при обычных условиях | Газ | Жидкость | Твердое вещество |
Цвет | Без цвета | Без цвета | Серебристо-белый |
Вкус | Безвкусный | Kислый | Безвкусный |
Запах | Не имеет | Резкий специфический | Не имеет |
Растворимость в воде | Плохо растворим | Растворима | Практически нерастворим |
Теплопроводность | Низкая | Небольшая | Высокая |
Электропроводность | Отсутствует | Малая | Высокая |
Знание
свойств веществ необходимо для их
практического применения. Например, на
рис. 5 (см.
с. 14) представлены области
применения алюминия, обусловленные
свойствами этого металла.
|
Рис.
5. |
Многие вещества – ядовитые, взрывоопасные и горючие, а поэтому требуют осторожного и грамотного отношения при работе с ними. Теперь вам, очевидно, стало понятно, почему химию изучают на более старшей ступени обучения в школе – в 8-м классе.
Наш курс призван подготовить вас к изучению этого серьезного и важного предмета, поэтому он так и называется: «Старт в химию».
Но является ли химия совершенно новой для вас дисциплиной? Об этом вы узнаете из следующих параграфов.
1. Какие учебные предметы относятся к естественным?
2. Приведите примеры положительного воздействия человека на окружающую среду.
3. Приведите примеры отрицательного воздействия человека на природу.
4. Что изучает химия?
5. Из следующего перечня названий выпишите отдельно тела и вещества: снежинка, капля росы, вода, льдинка, сахар-песок, кусочек сахара, мел, школьный мелок. Сколько тел и сколько веществ названо в этом списке?
6. Сравните свойства веществ (т. е. установите общее и различное между ними): а) углекислый газ и кислород; б) азот и углекислый газ; в) сахар и соль; г) уксусная и лимонная кислоты.
7. Какие свойства алюминия лежат в основе его применения?
8. Почему химию начинают изучать позже, чем биологию, географию, физику?
Продолжение. Начало см. в № 1/2006
§
2. Наблюдение и эксперимент как
методы
изучения естествознания и
химии
Знания о природе человек получает с помощью такого важнейшего метода, как наблюдение.
Наблюдение – это концентрация внимания на познаваемых объектах с целью их изучения.
С помощью наблюдения человек накапливает информацию об окружающем мире, систематизирует ее и ищет закономерности в этой информации. Следующий важный шаг – поиск причин, которые объясняют найденные закономерности.
Для того чтобы наблюдение было плодотворным, необходимо соблюдать ряд условий.
1. Нужно четко определить предмет наблюдения, на что будет обращено внимание наблюдателя, – конкретное вещество, его свойства или превращение одних веществ в другие, условия осуществления этих превращений и т.д.
2. Наблюдатель должен знать, зачем он проводит наблюдение, т.е. четко сформулировать цель наблюдения.
3. Чтобы достигнуть поставленной цели, можно составить план наблюдения. А для этого лучше выдвинуть предположение о том, как будет происходить наблюдаемое явление, т.е. выдвинуть гипотезу. В переводе с греческого «гипотеза» (hypo’thesis) означает «предположение». Гипотеза может быть выдвинута и в результате наблюдения, т.е. тогда, когда получен какой-то результат, который нужно объяснить.
Научное наблюдение отличается от наблюдения в житейском смысле этого слова. Как правило, научное наблюдение проводится в строго контролируемых условиях, причем условия эти можно изменять по желанию наблюдателя. Чаще всего такое наблюдение проводится в специальном помещении – лаборатории (рис. 6).
|
Рис.
6. |
Наблюдение, которое проводится в строго контролируемых условиях, называется экспериментом.
Слово «эксперимент» (experimentum) имеет латинское происхождение и на русский язык переводится как «опыт», «проба». Эксперимент позволяет подтвердить или опровергнуть гипотезу, которая родилась из наблюдения. Так формулируется вывод.
Проведем небольшой эксперимент, с помощью которого изучим строение пламени.
Зажгите свечу и внимательно рассмотрите пламя. Вы заметите, что оно неоднородно по цвету. Пламя имеет три зоны (рис. 7). Темная зона 1 находится в нижней части пламени. Это самая холодная зона по сравнению с другими. Темную зону окаймляет самая яркая часть пламени 2. Температура здесь выше, чем в темной зоне, но наиболее высокая температура – в верхней части пламени 3.
Рис.
7. |
Чтобы убедиться, что различные зоны пламени имеют разную температуру, можно провести такой опыт. Поместите лучинку (или спичку) в пламя так, чтобы она пересекала все три зоны. Вы увидите, что лучинка сильнее обуглилась там, где она попала в зоны 2 и 3. Значит, пламя там более горячее.
Возникает вопрос: будет ли пламя спиртовки или сухого горючего иметь такое же строение, как и пламя свечи? Ответом на этот вопрос могут служить два предположения – гипотезы: 1) строение пламени будет таким же, как и пламя свечи, потому что в его основе лежит один и тот же процесс горения; 2) строение пламени будет различным, т.к. оно возникает в результате горения различных веществ. Для того чтобы подтвердить или опровергнуть ту или иную гипотезу, обратимся к эксперименту – проведем опыт.
Исследуем с помощью спички или лучинки строение пламени спиртовки (с устройством этого нагревательного прибора вы познакомитесь при выполнении практической работы) и сухого горючего.
Несмотря на то, что язычки пламени в каждом случае отличаются формой, размерами и даже окраской, все они имеют одинаковое строение – те же три зоны: внутреннюю темную (самую холодную), среднюю светящуюся (горячую) и внешнюю бесцветную (самую горячую).
Следовательно, выводом из проведенного эксперимента может быть утверждение о том, что строение любого пламени одинаково. Практическое значение этого вывода состоит в следующем: для того чтобы нагреть в пламени какой-либо предмет, его надо вносить в самую горячую, т.е. в верхнюю, часть пламени.
Оформлять эксперименты принято в специальном журнале, который называют лабораторным. Для этого подойдет обыкновенная тетрадь, а вот записи в ней делают не совсем обычные. Отмечают дату проведения эксперимента, его название, а ход опыта часто оформляют в виде таблицы.
Что делал | Что наблюдал | Вывод |
|
|
|
Попробуйте таким образом описать эксперимент по изучению строения пламени.
Великий Леонардо да Винчи говорил, что науки, которые не родились из эксперимента, этой основы всех познаний, бесполезны и полны заблуждений.
Все естественные науки – науки экспериментальные. А для постановки эксперимента часто необходимо специальное оборудование. Например, в биологии широко используются оптические приборы, которые позволяют во много раз увеличить изображение наблюдаемого объекта: увеличительное стекло, лупа, микроскоп. Физики при изучении электрических цепей используют приборы для измерения напряжения, силы тока и электрического сопротивления. Ученые-географы имеют специальные приборы – от самых простейших (например, компас, метеорологические зонды) до уникальных космических орбитальных станций и научно-исследовательских судов.
Химики в своих исследованиях также используют специальное оборудование. Простейшее из них – это, например, уже знакомый вам нагревательный прибор спиртовка и различная химическая посуда, в которой проводят и изучают превращения веществ, т.е. химические реакции (рис. 8).
|
Рис.
8. |
Справедливо говорят, что лучше один раз увидеть, чем сто раз услышать. А еще лучше – подержать в руках и научиться пользоваться. Поэтому ваше первое знакомство с химическим оборудованием произойдет во время практической работы, которая вас ожидает на следующем уроке.
1. Что такое наблюдение? Какие условия
необходимо соблюдать, чтобы наблюдение
было результативным?
2. Чем различаются гипотеза и вывод?
3. Что такое эксперимент?
4. Какое
строение имеет пламя?
5. Как следует
проводить нагревание?
6. Какое
лабораторное оборудование вы применяли
при изучении биологии и географии?
7. Какое лабораторное оборудование
используется при изучении химии?
Практическая работа
№ 1.
Знакомство с лабораторным
оборудованием.
Правила техники
безопасности
gigabaza.ru
Свойство — алюминий — Большая Энциклопедия Нефти и Газа, статья, страница 1
Свойство — алюминий
Cтраница 1
Свойства алюминия, обусловившие его широкое использование, перечислены в табл. II.9. После железа алюминий — наиболее широко используемый металл. Как автомобильная, так и аэрокосмическая промышленность широко используют алюминий в качестве конструкционного материала из-за его прочности и легкости. Уменьшение массы автомобиля и самолета приводит к значительной экономии топлива. [2]
Свойства алюминия фторида И алюминия хлорида см. в соответств. [3]
Свойства алюминия фторида и алюминия хлорида см. в соответств. [4]
На свойства алюминия оказывают влияние содержащиеся в нем примеси. Основными из них являются железо и кремний. Они понижают электропроводность, теплопроводность, пластичность и коррозионную стойкость алюминия. [5]
Какие свойства алюминия определяют его свариваемость. [6]
Сравнение свойств алюминия и меди показывает, что алюминиевые провода имеют ряд преимуществ. Известно, что при равной проводимости вес алюминиевого провода в два раза меньше веса медного, а увеличение сечения алюминиевых проводов для сохранения одинаковой проводимости с медными способствует их лучшему охлаждению. С увеличением диаметра алюминиевых проводов линий передач высокого напряжения уменьшаются потери на корону. Алюминиевые шины более стойки в отношении кратковременного действия электрической дуги. [7]
Для улучшения свойств алюминия во время механической обработки его сплавляют с небольшими количествами висмута и свинца. [8]
Многие из свойств алюминия снова встречаются в элементах группы IVA, VA и V. A, большинство из которых имеет плохо растворимую окисную пленку с высоким электросопротивлением. Эта пленка сообщает массивному металлу заметную устойчивость в атмосфере, однако, в порошкообразном состоянии эти металлы в некоторых случаях весьма реакционно-способны, на что указывает значительное сродство их к кислороду. Металлы этих трех групп похожи на алюминий также и в том отношении, что обладают электролитическим вентильным действием3, что указывает на то, что оксидная пленка обладает большим электросопротивлением при прохождении тока в анодном направлении, чем в катодном. Эти металлы вообще растворяются быстрее в щелочах, чем в кислотах, а сами окислы обладают во многих случаях кислотным характером. Металлы группы VA действительно заметно устойчивы относительно большинства кислот, исключая плавиковой. Однако вольфрам быстро растворяется в смеси плавиковой и азотной кислот, а молибден корродирует в разбавленной азотной и концентрированной серной кислоте. Хром и уран образуют окислы основного характера и соответственно легче разрушаются в кислотах. [9]
Дальнейшее изучение свойств алюминия вне решетки возможно при регид-ратации цеолитов после активирования. В табл. 7 количество алюминия; находящегося вне решетки цеолита ( 6.7 — п 1), сравнивается с количеством алюминия, образующего подвижные водные комплексы ( ra J. Из данных табл. 7 видно, что для образцов, активированных при 300 С, более 70 % алюминия вне решетки находится в высокодиспергированной форме. [10]
Существенное отличие свойств алюминия от других металлов почти по всем показателям и особенно по удельному весу затрудняет его сопоставление с другими материалами в общем виде. Известны попытки обойти это затруднение. Смысл перехода к объемной стоимости заключается в том, что при определенных габаритах детали затраты материала определяются объемом, а вес является производным от объема и удельного веса. [11]
Основана на свойстве алюминия и окиси железа вступать между собой в химическое соединение с выделением большого количества тепла. Это тепло используется для нагрева свариваемых деталей. Применяется при сварке рельсов и стальных отливок. В тигель 3 засыпается термит — порошок, состоящий из алюминия и окиси железа. [12]
Основана на свойстве алюминия и окиси железа вступать между собой в химическое соединение с выделением большого количества тепла. [13]
На каком свойстве алюминия основано его применение в различных областях производства. [14]
При таких свойствах алюминия необходимы специальные шайбы увеличенного размера, которые подкладывают под головки болтов и гайки, и более частые ревизии алюминиевых шин, чем медных или стальных. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Применение алюминия и его сплавов (химия 9 класс). Рабочие материалы
Дополнительные сочиненияУрок посвящен изучению темы «Применение алюминия и его сплавов». Из материалов урока Вы узнаете, благодаря каким свойствам алюминий так широко используется, каковы области применения этого металла и его сплавов.
Тема: Химия металлов
Урок: Применение алюминия и его сплавов
1. Применение алюминия и его физические свойства, на которых оно основано
Алюминий называют «крылатым металлом». Такое название этот металл получил за свою легкость и широкое применение, в первую очередь, в самолетостроении. Алюминий прочно вошел в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока. А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 году стоимость 1 кг алюминия была 1200 долларов, т. е. дороже золота. Почему же со временем цена на алюминий так упала?
Дело в том, что алюминий широко распространен в земной коре (8%), самый распространенный металл. Но для восстановления алюминия из руд необходимо затратить большое количество энергии. К концу 19 века разработали новый способ получения алюминия с помощью электролиза, ежегодное получение металла возросло в тысячи раз, и цена на него упала.
Алюминий очень устойчив по отношению к кислороду и воде. Эта устойчивость обусловлена образованием на его поверхности тонкой, но плотной и прочной оксидной пленки – Al2O3. Благодаря этому свойству алюминий и его сплавы нашли широкое применение в быту и промышленности. Вам хорошо известно о применении алюминия для изготовления кухонной посуды.
Рис. 1. Алюминий применяется для изготовления кухонной посуды
Высокая электропроводность алюминия (по этому качеству он уступает лишь серебру и меди) позволяет широко его применять в электротехнике. Кроме того, алюминий дешевле и легче, чем медь и серебро.
Но мы перечислили пока не все достоинства этого удивительно практичного металла. При 100-150°С алюминий настолько пластичен, что из него можно получить тонкую фольгу, толщиной менее 0,01 мм. Алюминиевая фольга применяется для изготовления электрических конденсаторов и изделий, защищающих от тепловой радиации.
Алюминий также используют для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии. Порошок алюминия используют для изготовления серебряной краски, устойчивой к атмосферным воздействиям.
2. Сплавы алюминия
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дуралюмины, содержащие медь и магний, и силумины – сплавы алюминия с кремнием. Основные преимущества этих сплавов – легкость, высокая прочность и коррозионная стойкость.
Сплавы алюминия широко используют в качестве конструкционного материала в авиастроении, а также в авто-, судо — и приборостроении, в ракетной технике и строительстве.
Рис. 2. Дюралюмины широко применяются в авиастроении
3. Восстановительные свойства алюминия
Методом алюмотермии получают в лаборатории многие металлы и некоторые неметаллы. Смесь алюминиевого порошка с железной окалиной (термитную смесь) использовали при сварке стыков железных рельсов. В основе этого процесса лежит следующая реакция:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe + Q
В результате данной реакции выделяется так много теплоты, что поверхность рельса на стыке расплавляется, а пространство в стыке рельсов занимает расплавленное железо.
Список рекомендованной литературы
1. Микитюк А. Д. Сборник задач и упражнений по химии. 8-11 классы / А. Д. Микитюк. – М.: Изд. «Экзамен», 2009.
2. Оржековский П. А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. (§28)
3. Оржековский П. А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§33)
4. Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
5. Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
6 Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) .
2. Электронная версия журнала «Химия и жизнь» .
Домашнее задание
с.229 № 2,3 из Учебника Оржековского П. А. «Химия: 9-ый класс» (М.: Астрель, 2013).
dp-adilet.kz