Алюминий, его физические и химические свойства. Применение алюминия
Цели урока: продолжить формирование ключевых компетенций: учебно-познавательных, информационных, ценностно-смысловых, общекультурных, коммуникативных и личностного самосовершенствования учащихся.
Основные задачи урока:
- создать условия для исследования учащимися физических и химических свойств алюминия на основе его положения в ПСХЭ, строения атома;
- совершенствовать логические умения устанавливать причинно-следственную связь между строением и свойствами;
- продолжить развитие умений наблюдать, анализировать, сравнивать, выделять главное, выполнять химический эксперимент, делать аргументированные умозаключения, формулировать выводы;
- продолжить формирование навыков составления молекулярных и ионных уравнений химических реакций; электронного баланса, развитие химического языка;
- показать практическое значение химических знаний, в т.
 ч. раскрыть военно-прикладное значение изучаемых соединений;
ч. раскрыть военно-прикладное значение изучаемых соединений; - развивать коммуникативные качества личности;
- в целях развития творчества, интеллектуальных способностей и мыслительных умений использовать выполнение и представление индивидуальных творческих заданий (презентации, синквейны).
Оборудование и реактивы:
- интерактивная доска, компьютер, презентация к уроку,
- видеоматериал (электронное пособие к учебнику О.С.Габриеляна, 9 класс, видеоопыты), маршрутная карта;
- наборы реактивов и оборудование на столах учащихся: алюминиевая проволока, фольга, гранулы алюминия, пробирки с водой, в которые помещены железный гвоздь и алюминиевая проволока, растворы соляной и серной кислот, раствор хлорида меди (II), раствор гидроксида натрия, вода, пробирки, держатели для пробирок, спиртовки.
Этапы урока
I. Мотивация. Актуализаций знаний.Учитель: Мы продолжаем изучать металлы, а какой металл мы будем изучать сегодня,
предстоит определить вам.
В самолетах — это Я.
На Свердловской ТЭЦ, друзья,
Самый важный тоже Я.
Кто здесь лампочки зажег?
Я несу в проводке ток.
Я с коррозией на «ты».
Я добрался до звезды.
В космос я людей унес…
Учащиеся: Алюминий.
Учитель: Совершенно верно, алюминий. И тема нашего урока «Алюминий, его физические и химические свойства. Применение алюминия». Запишите название темы урока в тетради. Давайте вместе с вами определим задачи урока.
Учащиеся: Предлагают свои варианты.
Учитель: Комментирует, дополняет, обобщает.
II. Изучение нового материала.Учитель: Сейчас вы отправитесь в путешествие, чтобы познакомиться с удивительным химическим элементом и образованном им простом веществе — алюминии. Ознакомьтесь с маршрутной картой.
Учащиеся: Знакомятся с маршрутной картой.
Станция 1. Визитная карточка химического элемента
Учитель: Работая в паре, определите местонахождение элемента в Периодической системе, составьте электронную формулу. В тетради отметьте: порядковый номер, период, группу, подгруппу, электронную формулу элемента, его валентность и возможные степени окисления.
Учащиеся: выполняют задание, затем один ученик выполняет задание у доски, остальные проверяют, при необходимости вносят коррективы, оценивают ответ.
Станция 2. Физические свойства простого вещества
Учитель: Ознакомьтесь с образцами алюминия (гранула, проволока, фольга). Запишите в тетради физические свойства: цвет, запах, металлический блеск, твердость, пластичность, тепло- и электропроводность, плотность, температура плавления. За необходимой информацией обратитесь к материалу учебника.
Учащиеся: Знакомятся с образцами, изучают материал учебника, делают записи.
Учитель: Легким или тяжелым металлом является алюминий, легкоплавким или тугоплавким; мягким или твердым, что можно сказать о его тепло- и электропроводности?
Учащиеся: Используя знания об общих свойствах металлов, отвечают на вопрос.
Станция 3. Химические свойства простого вещества
Учитель: Зная электронное строение атома алюминия, его положение в электрохимическом ряду напряжений металлов, как вы можете характеризовать химическую активность алюминия, предсказать возможность его взаимодействия с простыми и сложными веществами?
Учащиеся: Опираясь на знание общих химических свойств металлов, предсказывают возможность его взаимодействия с простыми веществами, сложными (водой, кислотами, солями).
Учитель: Сделайте подзаголовок «Химические свойства алюминия».
1. Взаимодействие с простыми веществами.
В соответствии с маршрутной картой напишите уравнения химических реакций, характеризующих взаимодействие алюминия с простыми веществами (1 вариант — с серой, кислородом; 2 вариант — с хлором, углеродом), назовите продукты реакции, составьте сокращенный электронный баланс). Обменяйтесь тетрадями с соседом, проверьте правильность выполнения, при необходимости внесите коррективы, объясните допущенные ошибки.
Обменяйтесь тетрадями с соседом, проверьте правильность выполнения, при необходимости внесите коррективы, объясните допущенные ошибки.
Учащиеся: Выполняют задание с последующей проверкой у доски (оба варианта).
Учитель: Запишите:
2. Взаимодействие со сложными веществами.
Как вы правильно определили, алюминий — активный металл, в электрохимическом ряду напряжений находится сразу после активных металлов, а за ним стоят также достаточно активные металлы, следовательно, алюминий должен взаимодействовать с водой, но в реальной жизни мы в алюминиевой посуде кипятим воду, готовим пищу, и никаких видимых изменение не наблюдаем. Как вы можете объяснит это противоречие? У вас на столах находятся две пробирки с водой, в которые несколько дней назад поместили алюминиевую проволоку и железный гвоздь. Какой металл активнее? Что вы наблюдаете?
Учащиеся: Отвечают, что железный гвоздь вступил во взаимодействие с водой, а алюминиевая проволока не изменилась, хотя более активным металлом является алюминий. Высказывают различные предположения.
Высказывают различные предположения.
Учитель: В учебнике говорится о характерном серебристо-белом цвете алюминия. Еще раз внимательно ознакомьтесь с представленными образцами. Что вы видите?
Учащиеся: Тусклый матовый цвет.
Учитель: Как вы можете объяснить этот факт?
Учащиеся: Высказывают свои предположения.
Учитель: Такой цвет и малая активность алюминия при комнатной температуре объясняется образованием на его поверхности тонкой оксидной пленки, которая и защищает металл от химического воздействия. Как можно разрушить эту пленку?
Учащиеся: Высказывают свои предположения о физическом или химическом удалении пленки.
Учитель: Познакомиться с химическими свойствами алюминия нам поможет эксперимент. Сейчас вам предстоит работа в парах. Напоминаю о необходимости соблюдения правил техники безопасности (напоминает о правилах ТБ).
Ознакомьтесь с заданиями маршрутной карты и выполните опыты, характеризующие взаимодействие алюминия с растворами соляной и серной кислот, раствором хлорида меди (II). Запишите в тетради название свойства, составьте молекулярное и ионное уравнения взаимодействия алюминия с соляной кислотой, сокращенный электронный баланс для уравнений реакций взаимодействия алюминия с серной кислотой, раствором соли и водой (при удалении оксидной пленки).
При необходимости пробирки слегка нагрейте, соблюдая правила ТБ.
Учащиеся: Выполняют химический эксперимент, составляют уравнения реакций, делают вывод о химической активности алюминия, осуществляют взаимопроверку. Два ученика составляют уравнения у доски.
Учитель: Следит за выполнением опытов, соблюдением правил ТБ, проверяет правильность составления уравнений химических реакций, при необходимости оказывая помощь.
Как мы убедились, для алюминия характерны общие химические свойства металлов. Отметьте, концентрированные серная и азотная кислоты пассивируют алюминий.
Отметьте, концентрированные серная и азотная кислоты пассивируют алюминий.
Но алюминий, как и его оксид и гидроксид, взаимодействует не только с кислотами, но и со щелочами. О проявлении каких свойств это говорит?
Учащиеся: Амфотерных свойств.
Учитель: В соответствии с заданием маршрутной карты выполните опыт, характеризующий взаимодействие алюминия с раствором щелочи. При необходимости пробирку слегка нагрейте, соблюдая правила ТБ. Напишите название свойства, составьте соответствующее уравнение реакции, отметьте признак реакции.
Учащиеся: осуществляют взаимопроверку, затем сверяются с доской.
Ознакомьтесь с видеоопытом (взаимодействие алюминия с оксидом железа (III) — электронное пособие). Напишите названия свойства, составьте уравнение реакции, приведите электронный баланс. Где используется это свойство?
Учащиеся: Знакомятся с видеоопытом, составляют уравнение, отвечают на вопрос, что это свойство лежит в основе получения металлов из их оксидов – способ алюминотермии.
Учитель: Сформулируйте и запишите вывод о химических свойствах алюминия.
Учащиеся: Формулируют и записывают вывод.
Станция 4. Получение алюминия
Учитель: Алюминий — самый распространенный из металлов в земной коре. Встречается ли алюминий в свободном виде в природе? Дайте обоснованный ответ.
Учащиеся: Дают аргументированный ответ о невозможности существования алюминия в свободном виде.
Учитель: Основные месторождения алюминиевого сырья: Урал, Казахстан, Сибирь, Башкирия. Ознакомьтесь с природными соединениями алюминия (демонстрация видеофрагмента — электронного пособия, коллекции минералов). Запишите названия важнейших природных соединений, при необходимости обратитесь к материалу учебника.
Учащиеся: Знакомятся с природными соединениями, делают записи.
Учитель: Как вы считаете, почему в конце 19 века резко снизилась стоимость алюминия (в несколько десятков раз)?
Учащиеся: Высказывают различные предположения.
Учитель: Выбирает верное – открыт способ получения алюминия электролизом расплава оксида алюминия. Составьте уравнение реакции, укажите условия протекания, ознакомьтесь с электролизной установкой (электронное пособие).
Учащиеся: Знакомятся с электролизной установкой, составляют уравнение реакции.
Учитель: Какие предприятия, связанные с производством алюминия, имеются в нашем регионе?
Учащиеся: Отвечают (Полевской криолитовый завод, Уральский алюминиевый завод, Богословский алюминиевый завод и т.д.).
Учитель: Какие еще алюминиевые предприятия вы знаете?
Учащиеся: Волховский, Красноярский, Братский, Саяногорский алюминиевые заводы и т.д.
Учитель: А почему именно там расположены эти предприятия?
Учащиеся: Предприятия расположены рядом с ГЭС (энергозатратное производство).
Станция 5. Применение алюминия
Учитель: Какие области применения, исходя из знания свойств алюминия, можно назвать?
Учащиеся: Называют конкретное свойство и возможную область применения.
Учитель: А сейчас мы более подробно познакомимся с важнейшими областями применения алюминия и его соединений, сделав акцент на использование в военных целях. Вам необходимо, знакомясь с презентацией, сделать краткие записи, дать оценку работе своих одноклассников.
Учащиеся: Двое учащихся представляют презентацию, отвечая на заданные вопросы. Остальные ученики делают краткие записи, при желании задают вопросы, оценивают представленную работу (содержание, требования к оформлению, представление и т. д.).
III. Первичная проверка усвоения знанийУчитель: Сегодня на уроке мы расширили представления о металлах. Какие вопросы (при наличии отвечает на вопросы учащихся)?
Ответьте на предложенные вопросы:
- Почему в алюминиевой посуде нельзя хранить кислые и щелочные растворы?
- Какие свойства алюминия позволяют широко применять его в качестве упаковочного материала (фольги)?
- Какая реакция алюминия является основой бенгальских огней и фейерверков?
- Какие реакции подтверждают амфотерность алюминия и его соединений?
- Подвергается ли алюминий коррозии? Аргументируйте.

Учащиеся: Отвечают на вопросы.
IV. Подведение итогов. РефлексияУчитель: Подведем итоги сегодняшнего урока. Какие задачи мы поставили в начале урока? Удалось ли нам их решить? Я прошу вас выбрать из предложенного перечня свой вариант и ответить:
Учащиеся: Выбирают вариант, отвечают.
V. Домашнее задание Учитель: Дает инструктаж по домашнему заданию, включая творческое задание (синквейн на слово «алюминий»). Благодарит учащихся за работу, выставляет оценки (за презентацию, работу у доски, устные ответы и т.д.) с комментариями.
Благодарит учащихся за работу, выставляет оценки (за презентацию, работу у доски, устные ответы и т.д.) с комментариями.
* * *
Приложение к домашнему заданию
Слово «синквейн» — французское, обозначающее «пять строк». При его написании существуют определенные правила, которые в незначительной мере варьируют от автора к автору.
Правила написания синквейна:
- 1 строка заключает в себе одно слово, обычно существительное или местоимение, которое обозначает объект или предмет, о котором пойдет речь.
- 2 строка – два слова, чаще всего прилагательные или причастия. Они дают описание признаков и свойств выбранного в синквейне предмета или объекта
- 3 строка – образована тремя глаголами или деепричастиями, описывающими характерные действия объекта.
- 4 строка – фраза из четырех слов, выражает личное отношение автора синквейна к описываемому предмету или объекту.

- 5 строка – одно слово, характеризующее суть предмета или объекта.
Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
Уроки химии (учимся дома) > Уроки в 9 классе > Химия 9 класс — 4 четверть > Урок №1 > УРОК №2 Химические свойства углерода. Адсорбция. > урок № 3 > урок № 4 > Урок № 5 > урок № 9 > Щёлочноземельные металлы > Кальций,стронций …. >
Кроссенс – это ассоциативная головоломка. Название «кроссенс» переводится с английского языка как «пересечение смыслов» и придумано по аналогии с словом «кроссворд», что означает «пересечение слов»… Рассмотрите изображения. Как они связаны с темой этого урока? Я начну с более сложных ассоциаций 1. 2.Обшивка космического челнока «Буран» была выполнена из сплава алюминия и скандия. 3. Экран смартфона. В его состав входит оксид алюминия, который по прочности уступает только алмазам.
4. Наполеон III. 5. Рубиновые звёзды. 6. Хамелеон. 7. Пёрышко. 8. Audi 80 1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления. Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными. Al +13 )2)8)3 , p – элемент, Алюминий проявляет в соединениях степень окисления +3: Al0 – 3 e— → Al+3 2. Физические свойства Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл. 3. Нахождение в природе По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры. В природе алюминий встречается только в соединениях (минералах). На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия. 4. Химические свойства алюминия и его соединений Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами. Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы). I. Взаимодействие с простыми веществами Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора — воды: 2Аl + 3S = Аl2S3 (сульфид алюминия), 2Аl + N2 = 2АlN (нитрид алюминия), Аl + Р = АlР (фосфид алюминия), 4Аl + 3С = Аl4С3 (карбид алюминия). 2 Аl + 3 I2 = 2 AlI3 (йодид алюминия) Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S Al4C3 + 12H2O = 4Al(OH)3+ 3CH4 В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты: 4Аl + 3O2 = 2Аl2О3 + 1676 кДж. ГОРЕНИЕ АЛЮМИНИЯ НА ВОЗДУХЕ
Если Вы хорошо изучили эту часть урока,ответьте на 5 вопросов теста II. Взаимодействие со сложными веществами
Взаимодействие с водой: 2 Al + 6 H2O = 2 Al (OH)3 + 3 H2 без оксидной пленки Взаимодействие с оксидами металлов: Алюминий – хороший восстановитель, так как является одним из активных металлов. 3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe +Q Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке. Сr2О3 + 2Аl = 2Сr + Аl2О3 Взаимодействие с кислотами: С раствором серной кислоты: 2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2 С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода: 2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О, Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О. Взаимодействие со щелочами. 2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2 Na[Аl(ОН)4] – тетрагидроксоалюминат натрия По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
С растворами солей: 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu Обнаружение ионов алюминия в растворах: Если поверхность алюминия потереть солью ртути, то происходит реакция: 2Al + 3HgCl2 = 2AlCl3 + 3Hg Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
5. РИСУНОК 1 РИСУНОК 2
6. Получение алюминия 1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия — электролитом. 2Al2O3 эл.ток→ 4Al + 3O2
ЭТО ИНТЕРЕСНО:
Если Вы хорошо изучили эту часть урока,ответьте на 10 вопросов теста ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТРЕНАЖЁРЫ
Тренажёр №1 — Характеристика алюминия по положению в Периодической системе элементов Д. И. Менделеева Тренажёр №2 — Уравнения реакций алюминия с простыми и сложными веществами Тренажёр №3 — Химические свойства алюминия
|
Физические и химические свойства алюминия 丨CHAL
Часы
Алюминий — мягкий и легкий металл. Поскольку он подвергается воздействию воздуха для быстрого образования тонкого слоя оксидного слоя, он имеет матово-серебристый вид. Алюминий не токсичен (как металл), не магнитится и не образует искр.
Алюминий используется во многих отраслях промышленности для производства миллионов различных продуктов и играет очень важную роль в мировой экономике. Благодаря использованию различных комбинаций своих доминирующих характеристик, таких как прочность, легкий вес, коррозионная стойкость, восстанавливаемость и формуемость, алюминий используется все чаще. Ассортимент продукции варьируется от конструкционных материалов до тонкой упаковочной пленки. Подробнее о применении алюминия вы можете просмотреть в этой статье: Чего вы не знаете об алюминиевой трубке
Физические свойства алюминияКаковы физические свойства алюминия? Физические свойства обычно являются характеристиками, которые можно наблюдать с помощью органов чувств, таких как цвет, плотность, твердость, коррозионная стойкость, теплопроводность, проводимость и т. д. Физические свойства алюминия следующие:
| Свойства | Описание |
| Цвет | Алюминий представляет собой серебристо-белый металл без запаха. |
| Плотность | Плотность алюминия составляет около одной трети плотности стали или меди, что делает его одним из самых легких коммерческих металлов. |
| Прочность | Прочность на растяжение чистого алюминия невысокая. Однако легирующие элементы, такие как марганец, кремний, медь и магний, могут повысить прочность алюминия и получить сплав со свойствами, подходящими для конкретного применения. Алюминий очень подходит для холодных условий. По сравнению со сталью его преимущество заключается в том, что его прочность на растяжение увеличивается с понижением температуры при сохранении его ударной вязкости. С другой стороны, сталь становится хрупкой при низких температурах. |
| Коррозионная стойкость | При контакте с воздухом поверхность алюминия почти сразу покрывается оксидом алюминия. Этот слой обладает отличной коррозионной стойкостью. Обладает значительной устойчивостью к большинству кислот, но устойчивость к основаниям низкая. |
| Теплопроводность | Теплопроводность алюминия примерно в три раза выше, чем у стали. Это приводит к тому, что алюминий становится важным материалом для систем охлаждения и обогрева (например, для теплообменников). В сочетании с его нетоксичностью эта особенность означает, что алюминий широко используется в кухонной посуде и кухонной утвари. |
| Электропроводность | Алюминий имеет достаточно высокую электропроводность и может использоваться в качестве электрических проводников. |
| Отражательная способность | От УФ до инфракрасного излучения алюминий является отличным отражателем энергии излучения. Те же самые характеристики отражения делают алюминий теплоизоляционным материалом, который предотвращает солнечный свет летом и предотвращает потери тепла зимой. |
Химические свойства относятся к тому, что вещество вступает в реакцию с другими веществами или изменяется от одного вещества к другому. В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
В общем, химические свойства можно наблюдать только во время химической реакции. Реакция вещества может быть вызвана изменениями, вызванными горением, ржавчиной, нагревом, взрывом, обесцвечиванием и т.п. Ниже приведены химические свойства алюминия:
| Свойства | Описание |
| Окисление | Как правило, алюминиевые металлы не реагируют на эрозию воздуха, поскольку воздух покрывает их металл тонким слоем оксидов. Однако, если оксидный слой поврежден и оголен металлический алюминий, он снова вступит в реакцию с образованием амфотерного оксида. |
| Реакция с кислотой | Алюминий легко реагирует с неорганической кислотой с образованием раствора, содержащего гидратированные ионы алюминия, при этом выделяется водород. В случае реакции с азотной кислотой он пассивно реагирует, образуя защитный оксидный слой на поверхности оксида алюминия |
| Реакция со щелочью | Алюминий реагирует с основанием с образованием алюмината с выделением водорода. |
| Реакция с водой | Реакция с горячей водой. |
| Соединение | Смеси алюминия, кислорода и других элементов производят алюминиевые рудники, алюминиевый рудник является основным источником алюминия. |
| Сплав | В сочетании с такими элементами, как медь, кремний или магний, образует сплавы с высокой прочностью. |
Благодаря физическим и химическим свойствам алюминия его можно смешивать с другими металлами в алюминиевых сплавах, которые используются в различных алюминиевых сплавах. Алюминиевый сплав имеет характеристики, отличные от характеристик одного металла, и алюминиевый сплав классифицируется в соответствии с другими содержащимися элементами. Ниже приводится серия алюминиевого сплава и его основное использование:
| Series | Alloy Element | Application |
| 1xxx | Almost pure aluminum | Decoration, chemical equipment, heat reflector |
| 2xxx | Copper | Truck panel , детали самолетов |
| 3xxx | Марганец | Посуда, дорожный знак, холодильник |
| 4xxx | Кремний | Ship, bridge |
| 5xxx | Magnesium | Aircraft fuel tank |
| 6xxx | Magnesium + silicon | Low-pressure weapon, aircraft connector |
| 7xxx | Zinc | Aircraft structure |
| 8xxx | Другие элементы представляют собой элементы из основных сплавов | Алюминиевая фольга, радиатор |
Алюминий не потеряет своих характеристик после сильной деформации. Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и т.п. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
Благодаря этому из алюминия можно изготавливать различные формы алюминиевых изделий путем прокатки, экструзии, волочения, механической обработки и других механических процессов, таких как алюминиевые трубы, алюминиевые пластины, алюминиевые пластины, алюминиевая фольга и т.п. Легирование, холодная обработка и термическая обработка могут использоваться для настройки характеристик алюминия. Посмотреть Технологии обработки алюминиевых сплавов
CHAL Aluminium Corporation специализируется на производстве и исследованиях композитных материалов из алюминия и алюминиевых сплавов, высокоточных алюминиевых труб, полос, фольги и пайки алюминиевых сплавов. Мы искренне приветствуем вас связаться с нами для любого делового сотрудничества! Мы более чем рады тесно сотрудничать с друзьями дома и за рубежом, чтобы создать лучшее будущее.
Похожие статьиХарактеристики алюминия и его горение
Зажигание
Алюминий — металл серебристо-белого цвета, быстро окисляющийся на воздухе и покрывающийся оксидной пленкой. Эта реакция также происходит, когда металл реагирует с концентрированными кислотами.
Эта реакция также происходит, когда металл реагирует с концентрированными кислотами.
Общие характеристики алюминия и его физические свойства
Алюминий — легкий, мягкий, устойчивый к коррозии, высокопрочный металл.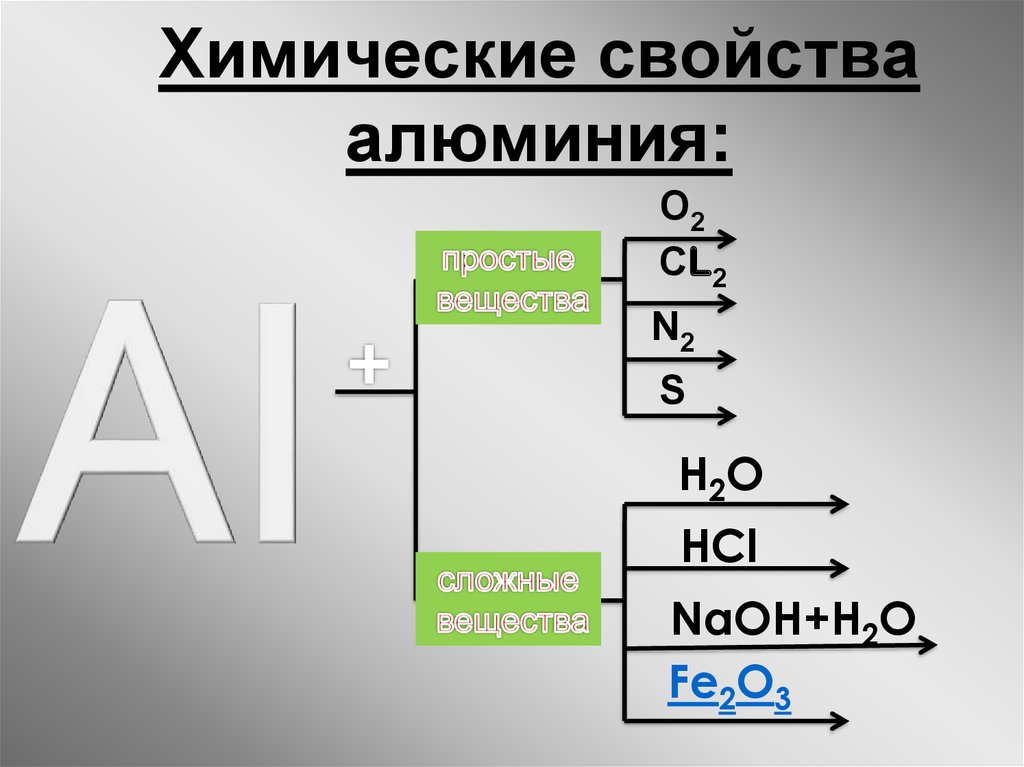 Не каждое вещество может похвастаться такими характеристиками. Основные физические свойства алюминия:
Не каждое вещество может похвастаться такими характеристиками. Основные физические свойства алюминия:
- температура плавления – 660 °С; гранецентрированная кубическая кристаллическая структура
- ; температура кипения
- – 2470 °С; плотность
- – 2,7 г/см3;
- тип связки – металлическая;
- , поскольку алюминий обладает высокой пластичностью и податливостью, из него изготавливают прочную, легкую и тонкую фольгу. Он также свернут в проволоку.
Восстановительная способность алюминия и химические свойства
Восстановительные свойства алюминия можно наблюдать в реакциях элемента с оксидами менее активных металлов. Вот пример одного из таких уравнений реакции:
Cr₂O3 + 2Al = Al₂O3 + 2Cr
В промышленности восстановительные свойства алюминия позволяют использовать его для получения других металлов.
Горение алюминия — описание реакции
Частицы чистого алюминия не горят на воздухе или в водяном паре при температуре ниже 1727 °C. Чтобы воспламенить алюминий в воздухе, на поверхность нагревательного элемента помещают горящие частицы магния, а над ними на острие иглы помещают частицы алюминия.
Частицы алюминия воспламеняются в паровой фазе, и интенсивность свечения, возникающего вокруг частиц, медленно увеличивается.
4Al + 3O₂ = 2Al₂O₃
Шаростержневая модель части кристаллической структуры Al₂O₃ [Викимедиа]Горение в водяном паре: воспламенение алюминия в водяном паре неоднородно. Выделяющийся в реакции водород способствует разрушению оксидной пленки, и жидкий оксид алюминия разлетается в виде капель. Эта оксидная пленка образуется и разрушается неоднократно, так как значительный процент металла выгорает на поверхности частиц. Алюминий сгорает в водяном паре в пять раз быстрее, чем на воздухе.
Открытие горения алюминия
Горение алюминиевого порошка в смеси с газообразным кислородом было впервые применено в 1930 году химиками Беккером и Стронгом в изобретенной ими кислородно-алюминиевой паяльной лампе. В качестве топлива ученые использовали мелкий алюминиевый порошок. Для стабилизации горения в устройстве формировалась и постоянно подавалась гомогенная взвесь алюминиевой пудры в кислороде. Смесь поджигали горелкой Бунзена. Он горел ослепительно белым пламенем, выпуская большое количество дыма оксида алюминия. Эти частицы были настолько малы, что дым не оседал в течение 24 часов. Беккер и Стронг установили, что продукты горения содержат около 2% свободного алюминия. Испытывая воздействие пламени паяльной лампы на различные материалы, ученые приблизительно определили температуру пламени. Молибден расплавился, а вольфрамовая нить толщиной 1 мм — нет. Таким образом, ученые установили, что температура горения алюминия в смеси с кислородом находится в пределах от 2535 °С (температура плавления молибдена) до 3400 °С (температура плавления вольфрама).
Чтобы понаблюдать за реакцией горения алюминия и полюбоваться впечатляющими искрами, появляющимися в результате, можно провести следующий эксперимент: в пламя горящей спиртовки всыпать алюминиевый порошок, добавляя его фарфоровой ложкой или шпателем очень маленькими порциями.
В качестве топлива ученые использовали мелкий алюминиевый порошок. Для стабилизации горения в устройстве формировалась и постоянно подавалась гомогенная взвесь алюминиевой пудры в кислороде. Смесь поджигали горелкой Бунзена. Он горел ослепительно белым пламенем, выпуская большое количество дыма оксида алюминия. Эти частицы были настолько малы, что дым не оседал в течение 24 часов. Беккер и Стронг установили, что продукты горения содержат около 2% свободного алюминия. Испытывая воздействие пламени паяльной лампы на различные материалы, ученые приблизительно определили температуру пламени. Молибден расплавился, а вольфрамовая нить толщиной 1 мм — нет. Таким образом, ученые установили, что температура горения алюминия в смеси с кислородом находится в пределах от 2535 °С (температура плавления молибдена) до 3400 °С (температура плавления вольфрама).
Чтобы понаблюдать за реакцией горения алюминия и полюбоваться впечатляющими искрами, появляющимися в результате, можно провести следующий эксперимент: в пламя горящей спиртовки всыпать алюминиевый порошок, добавляя его фарфоровой ложкой или шпателем очень маленькими порциями.

 ч. раскрыть военно-прикладное значение изучаемых соединений;
ч. раскрыть военно-прикладное значение изучаемых соединений; Виктор Цой. В его репертуаре есть песня «Алюминиевые огурцы»
Виктор Цой. В его репертуаре есть песня «Алюминиевые огурцы» Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.
Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.



 Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др. 
 Применение алюминия и его соединений
Применение алюминия и его соединений

 В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами. А. Цандер.
А. Цандер.