ХиМиК.ru — § 3. Щелочноземельные металлы
Элементы подгруппы кальция носят название щелочноземельных металлов. Происхождение этого названия связано с тем, что их окислы («земли» алхимиков) сообщают воде щелочную реакцию.
На долю кальция приходится 1,5% от общего числа атомов земной коры, тогда как содержание в ней радия очень мало (8·10–12%). Промежуточные элементы – стронций (0,008%) и барий (0,005%) стоят ближе к кальцию.
Помимо различных силикатных пород, Са, Sr и Ва встречаются главным образом в виде своих труднорастворимых углекислых и сернокислых солей, каковы минералы:
CaCO3 – кальцит
SrCO3 – стронцианит
BaCO3 – витерит
CaSO4 – ангидрит
SrSO4 – целестин
BaSO4 – тяжелый шппат
Углекислый кальций в виде известняка и мела иногда разует целые
горные хребты. Значительно реже встречается кристаллизованная форма СаСО3
– мрамор.
Для стронция и бария сернокислые минералы более распространены, чем углекислые. Радий в природе связан с урановыми рудами (причем на 1000 кг урана руда содержит лишь 0,3 г радия).
Промышленное применение находят почти исключительно соединения рассматриваемых элементов, характерные свойства которых и определяют области их использования. Химия радия и его соединений изучена еще очень неполно. В общем, по химическим свойствам он похож на барий.
В свободном состоянии элементы подгруппы
кальция могут быть получены электролизом их расплавленных солей. Они
представляют собой серебристо–белые металлы. Кальций довольно тверд, стронций и
особенно барий значительно мягче. Некоторые константы щелочноземельных металлов
сопоставлены в приводимой таблице.
Летучие соединения щелочноземельных металлов окрашивают пламя в характерные цвета: Са – в оранжево–красный, Sr (и Ra)–в карминово–красный, Ва – в желтовато–зеленый. Этим пользуются при химических анализах для открытия рассматриваемых элементов.
На воздухе кальций и его аналоги тотчас покрываются желтоватой пленкой, в которой наряду с нормальными окислами (ЭО) частично содержатся также перекиси (ЭО2 ) и нитриды (Э3 N2 ). В ряду напряжений щелочноземельные металлы располагаются левее магния и поэтому легко вытесняют водород не только из разбавленных кислот, но и из воды. При переходе от Са к Ra энергичность взаимодействия усиливается. Во всех своих устойчивых соединениях рассматриваемые элементы двухвалентны.
С металлоидами щелочноземельные металлы
соединяются весьма энергично и с значительным выделением тепла, как это видно
из рис. 178. Особенно интересны гидриды ЭН2 , образующиеся при
нагревании кальция и его аналогов з токе сухого водорода.
Соединения эти имеют типичный ионный характер, причем анионом является отрицательно заряженный водород (Н–). Водой они энергично разлагаются по схеме:
ЭН2 + 2НОН = 2Н2 + Э(ОН)2
С таким химически инертным в свободном состоянии элементом, как азот, щелочноземельные металлы соединяются уже при сравнительно слабом нагревании. При накаливании они соединяются также с углеродом, образуя карбиды типа ЭС2 .
Окиси кальция и его аналогов (ЭО) представляют собой белые тугоплавкие вещества, энергично присоединяющие воду с образованием белых гидроокисей [Э(ОН) 2 ]. Последние являются сильными основаниями, довольно хорошо растворимыми в воде. По ряду Са—Sr—Ва основной характер гидроокисей усиливается.
Параллельно с этим и весьма быстро растет их растворимость.
1) Свойства окисей и их гидратов
изменяются довольно закономерно не только для самих щелочноземельных металлов,
но и по всему ряду Be–Ва. Обусловлено
это последовательным увеличением радиусов ионов Э2+ при сохранении
ими однотипной электронной структуры (инертного газа).
Обусловлено
это последовательным увеличением радиусов ионов Э2+ при сохранении
ими однотипной электронной структуры (инертного газа).
Для вторых констант диссоциации Mg(OH)2 , Ca(OH)2 и Ва(ОН)2 были получены значения, равные соответственно 0,003, 0,03 и 0,23.
Окись кальция (негашеная известь, или
«кипелка») и продукт ее взаимодействия с водой –Са(ОН)
СаО+Н2 О = Са(ОН)2 + 16 ккал
Гидроокись кальция является наиболее дешевым и поэтому чаще всего используемым в технике сильным основанием. Раствор Ва(ОН)2 («баритовая вода») применяется для открытия СО2 .
Наряду с нормальными окислами для
элементов подгруппы Са известны белые перекиси типа ЭО2 . Практическое значение из них имеет только перекись б а р и я. (ВаО2 ),
применяемая, в частности, как исходный продукт для получения перекиси водорода.
Последнее основано на обратимости реакции:
Практическое значение из них имеет только перекись б а р и я. (ВаО2 ),
применяемая, в частности, как исходный продукт для получения перекиси водорода.
Последнее основано на обратимости реакции:
Ва(ОН) 2 + Н2 О2 = ВаО2 + 2Н2 О
Так как сама Н2 О2 является кислотой очень слабой, равновесие этой реакции практически полностью смещается влево под действием даже таких кислот, как угольная [вследствие нейтрализации Ва(ОН)2 ].
Технически ВаО2 получают нагреванием ВаО в токе воздуха до 600 °С При этом происходит присоединение кислорода по реакции:
2ВаО + О2 = 2ВаО2
Дальнейшее нагревание выше 800°С ведет, наоборот, к распаду ВаО2 на окись бария и кислород. Поэтому сжигание металлического бария сопровождается образованием только его окиси.
При взаимодействии с кислотами окислы и
гидроокиси щелочноземельных металлов легко образуют соответствующие соли.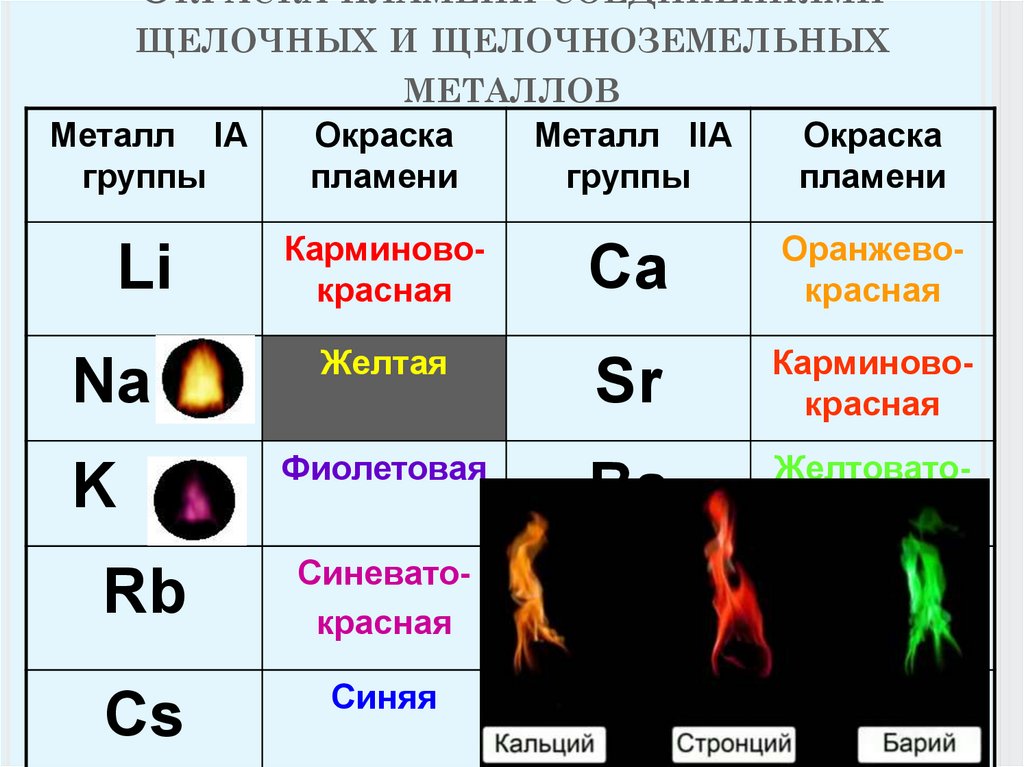 Последние,
как правило, бесцветны. Из производных обычных минеральных кислот соли с
анионами Cl
Последние,
как правило, бесцветны. Из производных обычных минеральных кислот соли с
анионами Cl
2) Растворимость важнейших солей (а также
гидроокисей) Са, Sr и Ва при обычных условиях сопоставлена на рис. 179,
из которого видно, что для отдельных анионов по ряду Са–Sr–Ва она изменяется различно.Это обстоятельство важно для аналитической химии. В частности,
резкое различие растворимости хромовокислых солей дает возможность отделять Ва
от Sr и Са. Крайне малой растворимостью
щавелевокислого кальция пользуются для открытия следов этого элемента
(например, в обычной питьевой воде).
Галогениды щелочноземельных металлов по своим свойствам делятся на две довольно резко обособленные группы. К одной относятся фториды, к другой – производные остальных галоидов,
Фториды почти нерастворимы не только в воде, но и в разбавленных кислотах. Кристаллогидраты для них неизвестны. Хлориды, бромиды и иодиды хорошо растворимы в воде и из растворов выделяются в виде кристаллогидратов.
Азотнокислый барий кристаллизуется при обычных условиях без воды. Напротив, нитраты Са и Sr выделяются в виде; кристаллогидратов. Последние легко растворимы в воде, тогда как растворимость Ва(NO3 )3 и Ra(NO3 )2 значительно меньше. Нитрат кальция широко применяется в качестве азотсодержащего минерального удобрения. Нитраты стронция и бария служат в пиротехнике для изготовления составов, сгорающих красным (Sr)j или зеленым (Ва) пламенем.
Сернокислые соли Sr и Ва кристаллизуются без воды выше 66°С в безводном состоянии
выделяется из раствора и сульфат кальция, ниже указанной температуры осаждается
гипс – CaSO4 ·2H2 O. В воде рассматриваемые сульфаты
труднорастворимы, причем по ряду Са–Ra растворимость
быстро уменьшается.
В воде рассматриваемые сульфаты
труднорастворимы, причем по ряду Са–Ra растворимость
быстро уменьшается.
Нагревание до 150°С обусловливает переход гипса в более бедный водой гидрат 2CaSO4 ·H2 O. При замешивании теста из порошка этого гидрата с водой (60–80% от его веса) происходит обратное присоединение последней, сопровождающееся отвердеванием всей массы вследствие ее закристаллизовывания. На этом основано применение гипса для изготовления слепков с различных предметов, а также в качестве вяжущего строительного материала.
3) Обжиг гипса для получения вяжущего
материала проводят обычно при температурах не выше 180 °С. Полученный продукт
поступает в продажу под названием жженого (штукатурного) гипса, или алебастра.
Обжиг выше 350°С ведет к образованию растворимой формы безводного CaSO4 , а выше; 500 °С – его нерастворимой формы,
которая вновь воду уже не присоединяет и поэтому в качестве вяжущего материала
использована быть не может («мертвый гипс»).
Образующиеся при еще более сильном обжиге (900–1200 °С) основные соли состава xCaSO4 ·yCaO (гидравлический гипс), будучи замешаны с водой, вновь дают затвердевающую массу. Ее твердение вызывается присоединением воды и кристаллизацией материала, причем образующиеся кристаллы тесна переплетаются и срастаются друг с другом, что обусловливает большую мехамическую прочность затвердевшей массы. Последняя вместе с тем весьма стойка по отношению к действию воды, изменениям температуры и т. д. Гидравлический гипс применяется для изготовления ступенек, подоконников и т. п. и в качестве вяжущего материала. Он был известен египтянам еще за 2000 лет до н. э. и широко использовался ими при возведении различных построек.
Углекислые соли щелочноземельных металлов практически нерастворимы
в воде. При накаливании они отщепляют СО2 и переходят в
соответствующие окиси. По ряду Са–Sr––Ва термическая устойчивость карбонатов быстро возрастает. Наиболее практически важным из ‘них является карбонат кальция.
Наиболее практически важным из ‘них является карбонат кальция.
Применение отдельных природных разновидностей СаСО3 весьма различно. Известняк служит исходным сырьем для получения важнейших строительных материалов – извести и цемента.
Мел используется в качестве минеральной краски, как основа составов для полировки и т. д. Мрамор является прекрасным материалом для скульптурных работ, изготовления электрических распределительных щитов и т. д.
Ежегодная мировая выработка извести из известняка исчисляется десятками миллионов тонн. Термическая диссоциация СаСОз идет со значительным поглощением тепла:
СаСОз + 43 ккал = > СаО + СО2
Зависимость равновесия этой реакции от температуры видна из следующих данных:
Технически обжиг известняка чаще всего осуществляется в шахтных печах (рис. 180). Важным побочным продуктом производства является углекислый газ.
Известь находит широкое применение в ряде
отраслей промышленности.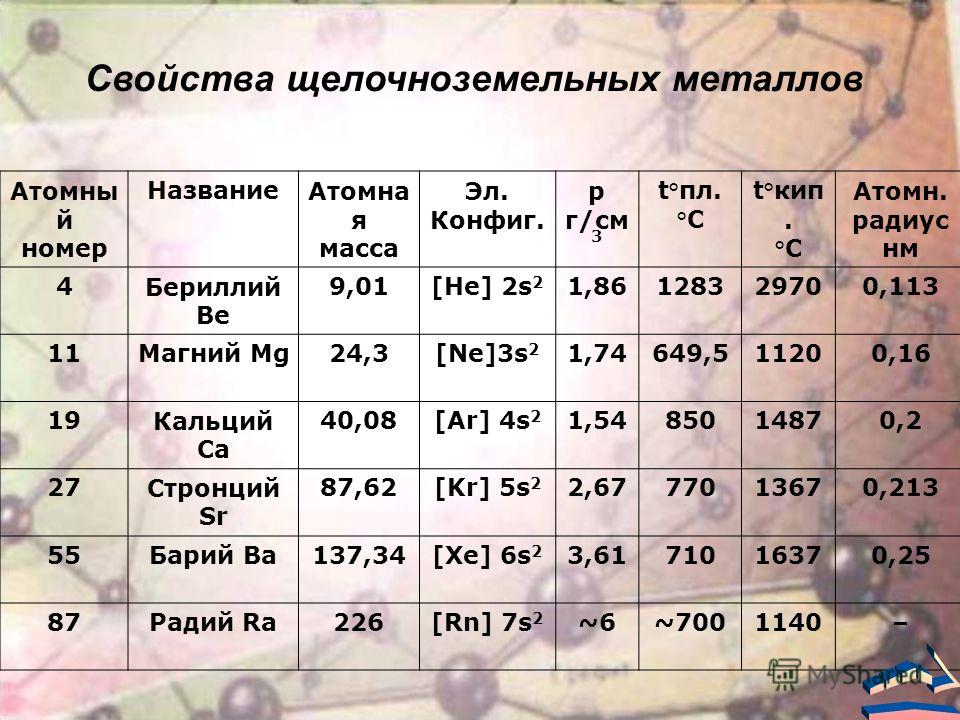 Значительные ее количества потребляются также сельским
хозяйством. Важнейшей и с наиболее давних времен известной человечеству
областью применения извести является, однако, использование ее (под названием
«известкового раствора») в качестве вяжущего строительного материала для
скрепления друг с другом камней, кирпичей и т. п. Обычно приготовляют смесь
извести с песком (1 часть на 3–4 части песка) и водой вколичестведостаточном для получения тестообразной массы. Последняя
постепенно твердеет вследствие кристаллизации гидроокиси кальция и образования
кристаллического СаСОз (за счет углекислоты воздуха) по реакции:
Значительные ее количества потребляются также сельским
хозяйством. Важнейшей и с наиболее давних времен известной человечеству
областью применения извести является, однако, использование ее (под названием
«известкового раствора») в качестве вяжущего строительного материала для
скрепления друг с другом камней, кирпичей и т. п. Обычно приготовляют смесь
извести с песком (1 часть на 3–4 части песка) и водой вколичестведостаточном для получения тестообразной массы. Последняя
постепенно твердеет вследствие кристаллизации гидроокиси кальция и образования
кристаллического СаСОз (за счет углекислоты воздуха) по реакции:
Са (ОН) 2 + СО2 = СаСО3 + Н2 О
Одновременно идет образование также силикатов кальция (за счет SiO2 песка). Ввиду выделения воды при твердении известкового раствора в построенных с его помощью зданиях долгое время сохраняется сырость.
Значительные преимущества перед известью
имеет другой вяжущий строительный материал – цемент.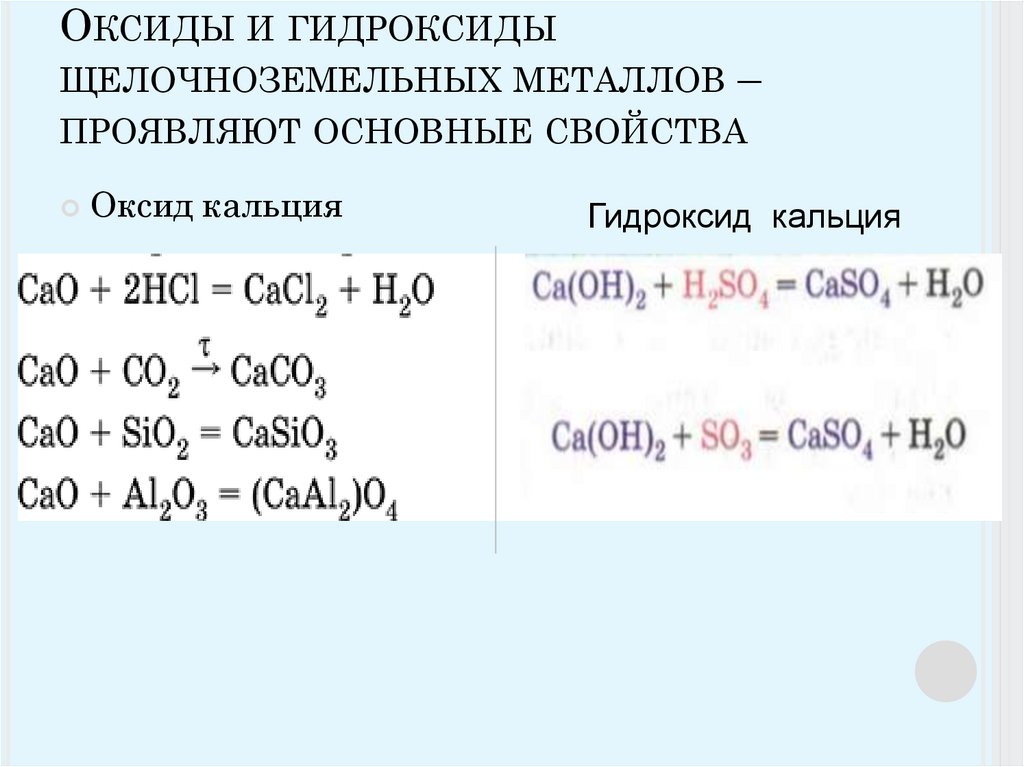 Помимо того, что его
применением устраняется долговременная сырость зданий, цемент характеризуется
способностью затвердевать не только на воздухе, но и под водой. Затвердевание его идет,
кроме того, значительно быстрее, чем в случае известкового раствора. Выработка
цемента по СССР составила в 1962 г. 57,3 млн. т (против 5,7 млн. г в 1940 г. и
1,5 млн. т в 1913 г.).
Помимо того, что его
применением устраняется долговременная сырость зданий, цемент характеризуется
способностью затвердевать не только на воздухе, но и под водой. Затвердевание его идет,
кроме того, значительно быстрее, чем в случае известкового раствора. Выработка
цемента по СССР составила в 1962 г. 57,3 млн. т (против 5,7 млн. г в 1940 г. и
1,5 млн. т в 1913 г.).
Цемент представляет собой зеленовато–серый порошок, состоящий в основном из смеси различных силикатов и алюминатов кальция, преимущественно Ca3 SiO5 , Ca2 SiO4 и Са3 (АlO3 )2 . Будучи замешан с водой, он дает отвердевающую массу. Переход последней из тестообразного в твердое состояние носит название «схватывания» и осуществляется обычно в течение нескольких часов. С химической стороны процесс схватывания цемента обусловлен главным образом гидратацией его составных частей.
4) При производстве цемента смесь тонко
измельченных известняка и богатой SiO2глины обжигают
до начала спекания (1400–1600 °С) в специальных вращающихся печах (рис. 181).
Последние представляют собой слегка наклонные, выложенные внутри огнеупорным
кирпичом стальные трубы диаметром 2–3 м и длиной в несколько десятков метров.
Печь лежит на роликах и приводится мотором в медленное вращение. В ее верхнюю
часть непрерывновводится исходная смесь, которая при
постепенном продвижении вниз все более разогревается за счет тепла сгорающих в
печи газов (или каменноугольной пыли). Обожженный продукт (цементный клинкер)
после остывания тщательно перемалывается.
181).
Последние представляют собой слегка наклонные, выложенные внутри огнеупорным
кирпичом стальные трубы диаметром 2–3 м и длиной в несколько десятков метров.
Печь лежит на роликах и приводится мотором в медленное вращение. В ее верхнюю
часть непрерывновводится исходная смесь, которая при
постепенном продвижении вниз все более разогревается за счет тепла сгорающих в
печи газов (или каменноугольной пыли). Обожженный продукт (цементный клинкер)
после остывания тщательно перемалывается.
5) Состав цементов выражают обычно в виде
весового процентного содержания входящих в них окислов (в основном CaO, SiO2 , Al2 O3 и Fe2 O3 ). Первый из них
играет в цементе роль основания, остальные – роль кислотных ангидридов, весовое
отношение СаО / (SiO2 + Al2 O3
+Fe2 O3 ) носит название
гидромодуля цемента и хорошо характеризует его качества.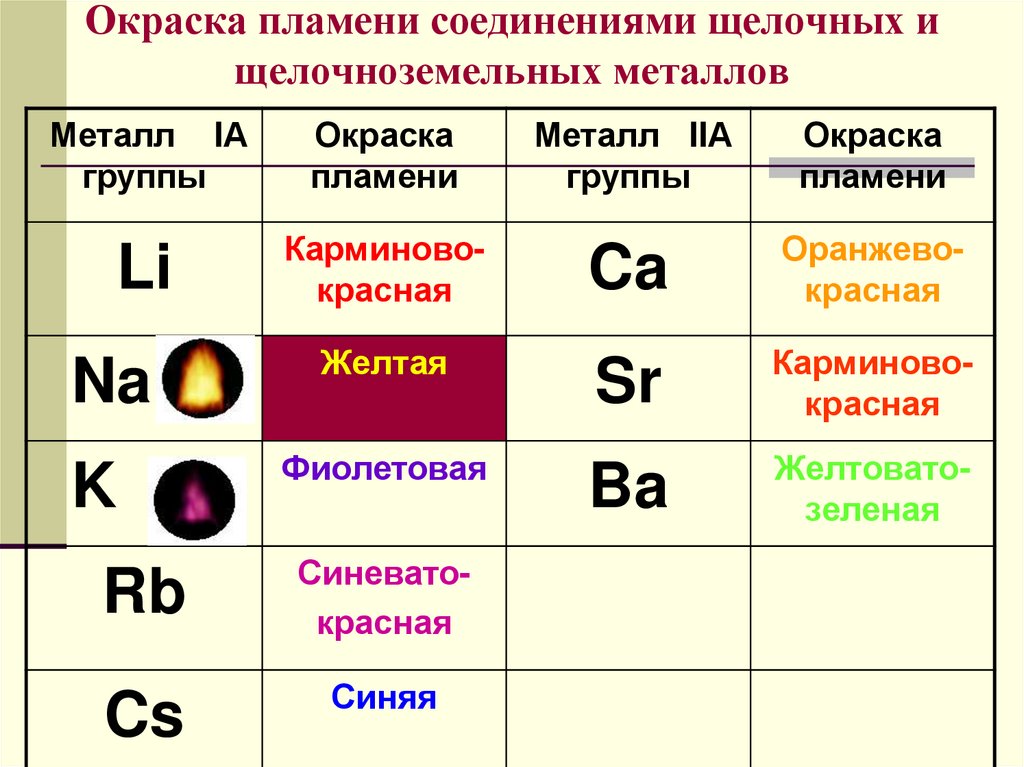 Числовая величина
гидромодуля обычного (силикатного) цемента колеблется около двух.
Приблизительные типичные результаты его анализа приводятся ниже (% по весу):
Числовая величина
гидромодуля обычного (силикатного) цемента колеблется около двух.
Приблизительные типичные результаты его анализа приводятся ниже (% по весу):
6) Схватывание цемента обусловлено в основном реакциями по схемам:
Ca3 SiO5 + 5Н2 О = Ca2 SiO4 ·4H2 O + Са(ОН)2
Ca2 SiO4 + 4H2 O = Ca2 SiO4 ·4Н2 О
Са3 (АlO3 )2 + 6Н2 О = Са3 (АlО3 )2 ·6Н2 О
После первоначального схватывания твердость цемента в течение длительного времени продолжает возрастать. Основной причиной этого является, по–видимому, распространение процессов гидратации в глубь цементных зерен.
Наряду с рассмотренными выше солями для
химии Са, Sr и Ва весьма важны их известные только в
растворе кислые карбонаты Э(НСО3 )2 . Они образуются при
взаимодействии растворенного в воде углекислого газа с нормальными карбонатами
по схеме:
Они образуются при
взаимодействии растворенного в воде углекислого газа с нормальными карбонатами
по схеме:
ЭСО3 + СО2 + Н2 О = Э(НСО3 )2
Реакция эта обратима, причем нагревание смещает ее равновесие в сторону распада бикарбоната. Довольно часто из бикарбонатов щелочноземельных металлов в природных водах содержится только Са(НСО3 )2 . Наличие его придает воде приятный освежающий вкус (который отсутствует у дистиллированной воды).
Содержание в природной воде солей
двухвалентных металлов часто оценивают, говоря о той или иной ее «жесткости».
При этом различают жесткость временную и постоянную. Первая обусловлена
присутствием в воде бикарбонатов – Са(НСО3 )2 , реже Mg(HCO3 )2 и иногда также Fe(HCO3 )2 . Временной она
названа потому, что может быть устранена простым кипячением воды: бикарбонаты
при этом разрушаются и нерастворимые продукты их распада (карбонаты Са и Mg, гидроокись железа) оседают на стенках сосуда в
виде накипи. По цвету последней можно оценить содержание Fe(HCO3 )2 в потребляемой
воде: если его вовсе нет, накипь имеет белый цвет, при значительном его
количестве – красно–бурый.
По цвету последней можно оценить содержание Fe(HCO3 )2 в потребляемой
воде: если его вовсе нет, накипь имеет белый цвет, при значительном его
количестве – красно–бурый.
Постоянная жесткость воды обусловлена присутствием в ней солей двухвалентных металлов, не дающих осадка при кипячении. Наиболее обычны сульфаты и хлориды Са и Mg. Из них особое значение имеет малорастворимый CaSO4 , который оседает в виде очень плотной накипи.
При работе парового котла на жесткой воде
его нагреваемая поверхность покрывается накипью. Так как последняя плохо
проводит тепло; прежде всего становится неэкономичной сама работа котла: уже
слой накипи толщиной в 1 мм повышает расход топлива приблизительно на 5%. С
другой стороны, изолированные от воды слоем накипи стенки котла могут нагреться
до весьма высоких температур. При этом железо постепенно окисляется и стенки
теряют прочность, что может повести к взрыву котла.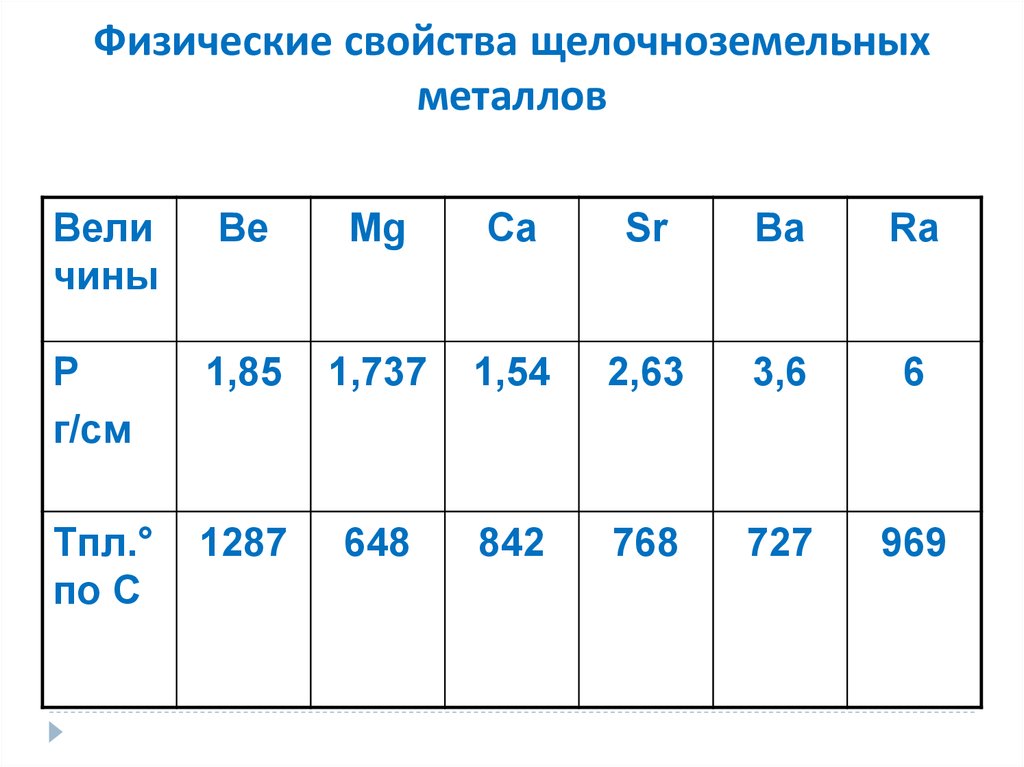 Так как паросиловое
хозяйство существует во многих промышленных предприятиях и на транспорте,
вопрос о жесткости воды практически весьма важен.
Так как паросиловое
хозяйство существует во многих промышленных предприятиях и на транспорте,
вопрос о жесткости воды практически весьма важен.
Жесткая вода оказывается также непригодной для проведения технологических процессов ряда отраслей промышленности. Пользование ею затрудняет стирку белья, мытье волос и другие операции, связанные с потреблением мыла. Обусловлено это нерастворимостью солей двухвалентных металлов и входящих в состаз мыла органических кислот, из–за чего, с одной стороны, загрязняются отмываемые предметы, с другой – непроизводительно расходуется мыло.
7) И постоянную и временную жесткость воды
в СССР принято оценивать числом содержащихся в одном литре
миллиграмм–эквивалентов двухвалентных металлов (мг–экв/л). За рубежом
пользуются условными «градусами жесткости», величины которых в отдельных
странах различны (1 мг–экв/л соответствует 2,8 немецким, 3,5 английским, 5
французским или 50 американским градусам). До 1952 г. в СССР обычно применялись
немецкие градусы.
До 1952 г. в СССР обычно применялись
немецкие градусы.
Сумма временной и постоянной жесткости определяет общую жесткость воды. Последняя характеризуется по этому признаку следующими наименованиями: очень мягкая (до 1,5), мягкая (1,5–3), среднежесткая (3–6), жесткая (6–9), очень жесткая (>9 мг–экв/л). Жесткость отдельных естественных вол . колеблется в весьма широких пределах. Для открытых водоемов она часто зависит от времени года и даже погоды. Наиболее «мягкой» природной водой является атмосферная (дождь, снег), почти не содержащая растворенных солей.
Так как очистка воды от растворенных солей при помощи перегонки слишком дорога, в местностях с жесткой водой для ее «умягчения» пользуются химическими методами. Временную (иначе – карбонатную) жесткость обычно устраняют, прибавляя к воде Са(ОН)2 в количестве, строго отвечающем найденному по анализу содержанию бикарбонатов. При этом по реакции
Са(НСО3 )2 + Са(ОН)2 = 2СаСО3 + 2Н2 О
весь бикарбонат переходит в нормальный
карбонат и осаждается.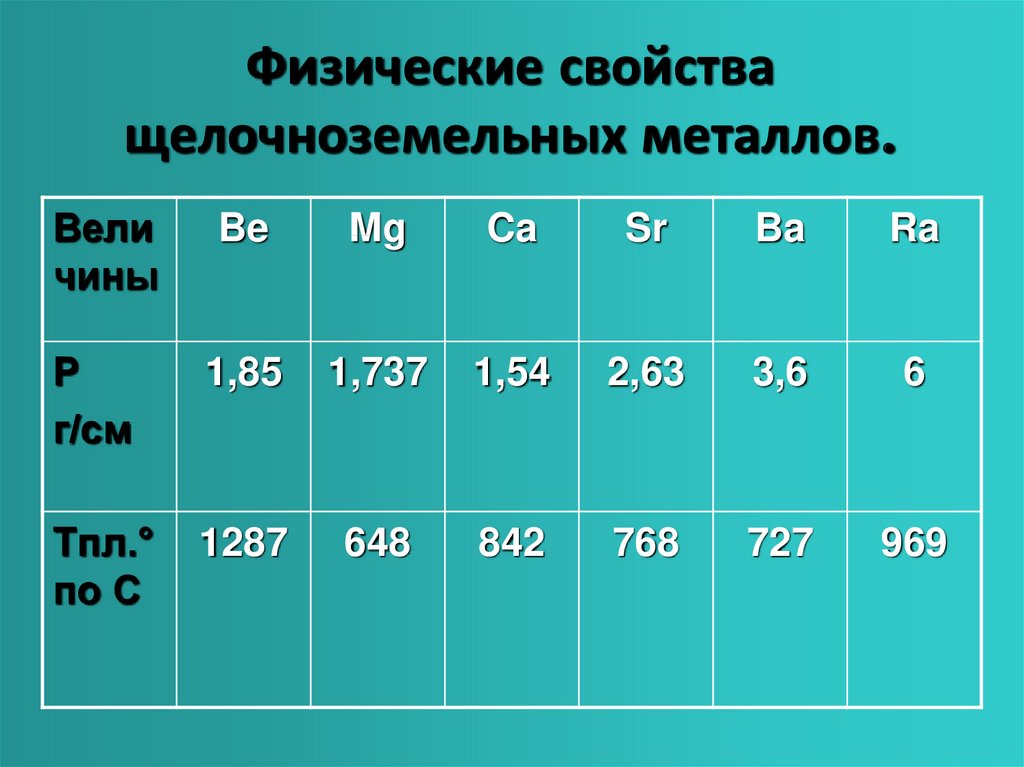 От постоянной (иначе, некарбонатной) жесткости чаще всего
освобождаются добавлением к воде соды, которая вызывает образование осадка по
реакции:
От постоянной (иначе, некарбонатной) жесткости чаще всего
освобождаются добавлением к воде соды, которая вызывает образование осадка по
реакции:
CaSO4 + Na2 CO3 = CaCO3 + Na2 SO4
Воде дают затем отстояться и лишь после этого пользуются ею для питания котлов или в производстве. Для умягчения небольших количеств жесткой воды (в прачечных и т. п.) обычно добавляют к ней немного соды и дают отстояться. При этом двухвалентные металлы полностью осаждаются в виде карбонатов, а остающиеся в растворе соли натрия употреблению мыла не мешают.
Из изложенного следует, что содой можно пользоваться для Устранения и временной и постоянной жесткости, а гидроокисью кальция – только для устранения временной. Тем не менее в технике стараются применять именно Са (ОН)2 , что обусловлено гораздо большей дешевизной этого продукта сравнительно с содой.
Таблица Менделеева online — Щёлочноземельные металлы
Щёлочноземельные металлы — химические элементы 2-й группы периодической таблицы элементов: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.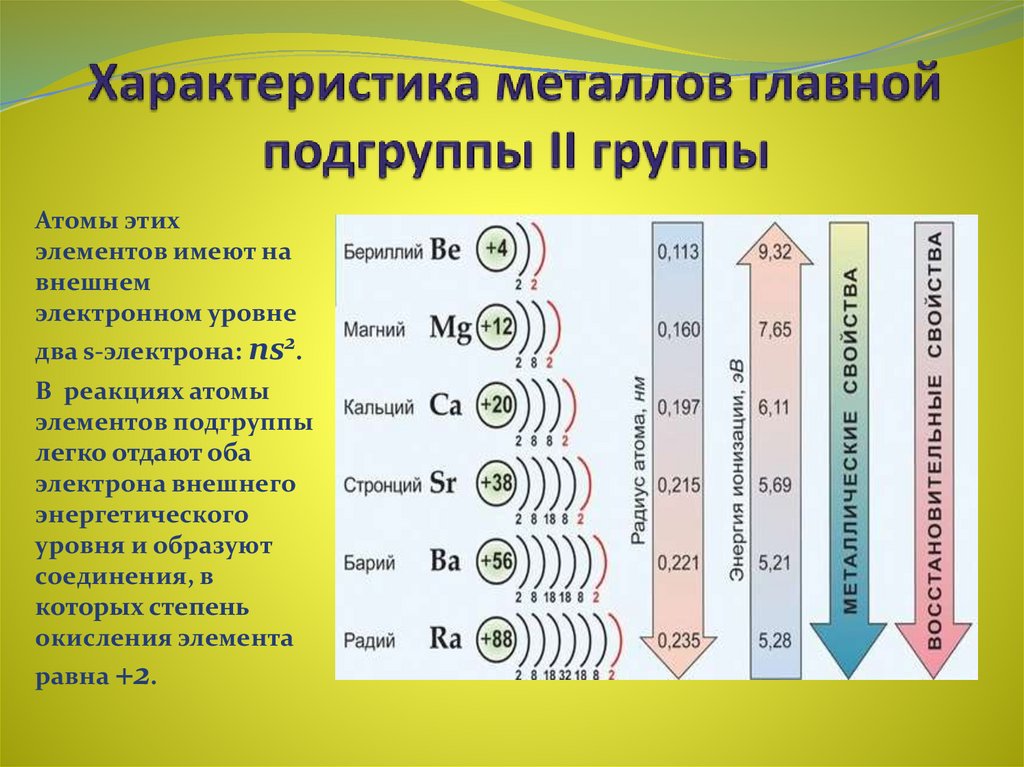
Общая характеристика группы
К щёлочноземельным металлам чаще относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако, согласно номенклатуре ИЮПАК, щёлочно-земельными металлами следует считать все элементы 2-й группы. Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит (диагональное сходство). Второй элемент этой группы, магний, уже проявляет некоторые общие свойства щелочноземельных металлов, но в остальном заметно отличается от них. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
Некоторые атомные и физические свойства элементов группы
| Атомный номер |
Название, символ |
Число природных изотопов | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм радиус, нм |
Ионный радиус, нм | tпл, °C |
tкип, °C |
ρ, г/см³ |
ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
Использование щелочноземельных металлов
Обновлено 14 мая 2018 г.
А. П. Ментцер
Щелочноземельные металлы — это блестящие, мягкие или полумягкие металлы, нерастворимые в воде. Как правило, они более твердые и менее реакционноспособные, чем металлы группы IA, такие как натрий, и мягче и более реакционноспособны, чем металлы группы IIIA, такие как алюминий. Когда они соединяются с оксидами (молекулы кислорода плюс еще один элемент), они составляют одни из самых распространенных минералов на Земле, которые можно использовать в промышленности, медицине и потребительских товарах. Некоторые соединения излучают много света при нагревании, что делает их ключевыми ингредиентами фейерверков.
Химия группы IIA
В соединениях щелочноземельные металлы теряют два электрона, образуя ионы с зарядом 2+. Они легко реагируют с кислородом, который принимает электроны с образованием ионов с зарядом 2-. Положительные и отрицательные ионы притягиваются друг к другу, в результате чего образуется связь с нулевым суммарным зарядом. Образующиеся соединения называются оксидами. Растворы, приготовленные из этих оксидов и воды, являются основаниями с pH выше 7. Щелочная природа этих растворов дала название этой группе металлов. Щелочноземельные металлы обладают высокой реакционной способностью, и активность этих металлов возрастает при движении вниз по группе. Кальций, стронций и барий могут реагировать с водой при комнатной температуре.
Образующиеся соединения называются оксидами. Растворы, приготовленные из этих оксидов и воды, являются основаниями с pH выше 7. Щелочная природа этих растворов дала название этой группе металлов. Щелочноземельные металлы обладают высокой реакционной способностью, и активность этих металлов возрастает при движении вниз по группе. Кальций, стронций и барий могут реагировать с водой при комнатной температуре.
Бериллий
В своей элементарной форме бериллий представляет собой мягкий металл серебристо-белого цвета. Рудные соединения, содержащие бериллий, алюминий и кремний, могут образовывать драгоценные камни зеленого и голубоватого цвета, такие как изумруды, аквамарины и александриты. Бериллий полезен в радиологии, потому что рентгеновские лучи могут проходить через бериллий, делая его прозрачным. Его часто используют для изготовления рентгеновских трубок и окон. Бериллий увеличивает твердость сплавов, которые используются для изготовления инструментов и часовых пружин.
Магний
Физические свойства магния аналогичны бериллию. Он не реагирует с водой при комнатной температуре, но легко реагирует с кислотами. Магний является одним из самых распространенных элементов в земной коре и является ключевым компонентом хлорофилла, вещества зеленых растений, используемого в процессе фотосинтеза. Магний полезен в здравоохранении, так как он является одним из основных ингредиентов антацидов, слабительных и солей Эпсома. Сгорание магния дает яркое, белое, продолжительное пламя, что делает его полезным в фейерверках и сигнальных ракетах.
Кальций
Кальция на Земле даже больше, чем магния. Серебристый полумягкий металл легко образует соединения как с молекулами кислорода, так и с водой. В природе он обычно встречается в виде карбоната кальция или известняка. Кальций является ключевым компонентом в структурах живых существ, включая кости, зубы, раковины и экзоскелеты. Кальций также является важным веществом для искусственных конструкций, поскольку он используется для изготовления гипса, цемента, гипсокартона и других строительных материалов.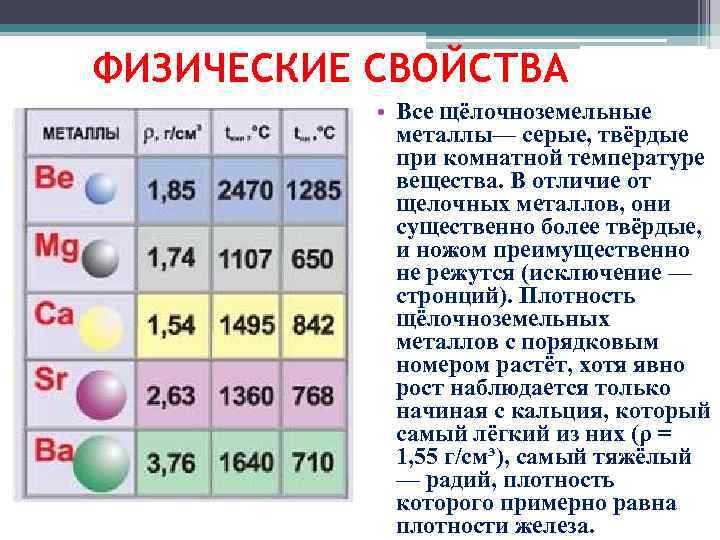
Стронций
Блестящий и мягкий, стронций образует соединения с кислородом и другими оксидами, такими как карбонат (CO 3 ), нитрат (NO 3 ), сульфат (SO 4 ) и хлорат (ClO 8 3 ) . Соли, полученные из соединений стронция, горят красным и используются в фейерверках и сигнальных ракетах.
Барий
В отличие от прозрачности бериллия, рентгеновские лучи не могут проникать через барий. Сульфат бария обычно используется для помощи в использовании рентгеновских лучей для выявления проблем в пищеварительном тракте. Это соединение нерастворимо в воде и при проглатывании обволакивает пищевод, желудок и кишечник. Нитрат бария и хлорат бария используются в фейерверках, чтобы дать зеленый свет при нагревании. Барий также входит в состав пигментов для красок.
Радий
Радий белого цвета, мягкий и блестящий, как и другие щелочноземельные металлы. Однако его радиоактивность отличает его от остальной группы. Вскоре после его открытия Кюри в конце 1800-х годов радий стал использоваться в медицинских целях, а также для изготовления светящихся в темноте часов. Спустя десятилетия использование радия прекратилось, когда люди обнаружили опасность радиации. Сегодня радий используется для лечения некоторых видов рака.
Вскоре после его открытия Кюри в конце 1800-х годов радий стал использоваться в медицинских целях, а также для изготовления светящихся в темноте часов. Спустя десятилетия использование радия прекратилось, когда люди обнаружили опасность радиации. Сегодня радий используется для лечения некоторых видов рака.
Металлы щелочные, очень активные | Камео Кемикалс
Добавить в MyChemicals Страница для печати
Reactive Group Datasheet
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом. способами, поскольку они сходны по своему химическому строению. Каждое вещество с лист химических данных был назначен одной или нескольким реакционноспособным группам, и CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность. предсказания. Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа
он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы
чтобы увидеть прогнозы реактивности.
Есть 14 химических паспортов относятся к этой реактивной группе.
Описание
Воспламеняемость
Щелочные металлы негорючи, но горючи. Они также могут гореть в углекислом газе и азоте. Их реакция с водой очень быстрая и весьма экзотермическая. Он производит газообразный водород и другие продукты. Образовавшегося тепла достаточно, чтобы расплавить непрореагировавший металл, воспламенить выделившийся водород и воспламенить сам металл.
Реакционная способность
Материалы этой группы реагируют, как правило, энергично, с любым веществом, содержащим активные атомы водорода, с выделением газообразного водорода. Сюда входят спирты и кислоты, и самое главное, вода. Реагируют с сульфидами, окислителями, альдегидами и цианидами. Они быстро разъедают при контакте с воздухом, покрываясь белыми оксидами и пероксидами. На практике большинство других органических соединений, включая эфиры, достаточно влажны (содержат достаточное количество воды в качестве примеси), чтобы вызвать нагревание и выделение газов при контакте со щелочными металлами.
