Группы металлов в химии — Мир Сплава
Слово «металл» происходит от латинского «metallum», что переводится, как «рудник» (другой вариант перевода – «шахта»). Металлы – группа химических элементов, объединенных рядом общих характеристик: высокой электроповодностью, ковкостью, хорошей пластичностью, высокой теплопроводностью. Еще одна из общих для всех металлов особенностей – металлический блеск. Большая часть металлов в природе находится в виде руд или соединений. Для получения какого-либо металла в чистом виде руду обрабатывают различными методами, а полученное сырье проводят через процесс очистки.
Металлы делят на ряд групп: щелочные металлы, щелочноземельные металлы, переходные металлы, легкие металлы, полуметаллы, лантаноиды, актиноиды.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
В группу входит шесть химических элементов:
Литий (Li), Натрий (Na), Калий (K), Рубдий (Rb), Цезий (Cs), Франций (Fr)
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
В группу входит четыре элемента:
Кальций (Ca), Стронций (Sr), Барий (Ba), Радий (Ra)
ПЕРЕХОДНЫЕ МЕТАЛЛЫ
В группе – сорок химических элементов:
Скандий (Sc), Титан (Ti), Ванадий (V), Хром (Cr), Марганец (Mn), Железо (Fe), Кобальт (Co), Никель (Ni), Медь (Cu), Цинк (Zn), Иттрий (Y), Цирконий (Zr), Ниобий (Nb), Молибден (Mo), Технеций (Tc), Рутений (Ru), Родий (Rh), Палладий (Pd), Серебро (Ag), Кадмий (Cd), Лантан (La), Гафний (Hf), Тантал (Ta), Вольфрам (W), Рений (Re), Осмий (Os), Иридий (Ir), Платина (Pt), Золото (Au), Ртуть (Hg), Актиний (Ac), Резерфордий (Rf), Дубний (Db), Сиборгий (Sg), Борий (Bh), Хассий (Hs), Мейтнерий (Mt), Дармштадтий (Ds), Рентгений (Rg), Коперниций (Cn).
ЛЕГКИЕ МЕТАЛЛЫ
В группе семь металлов:
Алюминий (Al), Галлий (Ga), Индий (In), Олово (Sn), Таллий (Tl), Свинец (Pb), Висмут (Bi)
ПОЛУМЕТАЛЛЫ
К этой группе относят семь элементов:
Бор (B), Кремний (Si), Германий (Ge), Мышьяк (As), Сурьма (Sb), Теллур (Te), Полоний (Po)
ЛАНТАН и ЛАНТАНОИДЫ
Помимо лантана (La) – в группе еще 14 элементов:
Церий (Ce), Празеодим (Pr), Неодим (Nd), Прометий (Pm), Самарий (Sm), Европий (Eu), Гадолиний (Gd), Тербий (Tb), Диспрозий (Dy), Гольмий (Ho), Эрбий (Er), Тулий (Tm), Иттербий (Yb), Лютеций (Lu)
АКТИНИЙ и АКТИНОИДЫ
В группе, помимо Актиния (Ac) – еще четырнадцать элементов:
Торий (Th), Протактиний (Pa), Уран (U,) Нептуний (Np), Плутоний (Pu), Америций (Am), Кюрий (Cm), Берклий (Bk), Калифорний (Cf), Эйнштейний (Es), Фермий (Fm), Менделевий (Md), Нобелий (No), Лоуренсий (Lr).
Вне обособленных групп остаются два металла — БЕРИЛЛИЙ (Be) и МАГНИЙ (Mg).
Таково деление на группы металлов в химии. В металлургии принято свое разделение металлов: на черные, цветные и драгоценные.
Остались еще вопросы?
Оставьте заявку и мы Вам перезвоним.
mirsplava.ru
Металлы и неметаллы — урок. Химия, 8–9 класс.
Простые вещества по их свойствам делят на металлы и неметаллы.
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Ртуть
Алюминий
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Хлор
Бром
Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Красный фосфор
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
www.yaklass.ru
Металлы как химические элементы | Химическая энциклопедия

Подавляющее большинство (93 из 117) известных в настоящее время химических элементов относится к металлам.
Атомы различных металлов имеют много общего в строении, а образуемые ими простые и сложные вещества имеют схожие свойства (физические и химические).
Положение в периодической системе и строение атомов металлов.
В периодической системе металлы располагаются левее и ниже условной ломаной линии, проходящей от бора к астату (см. таблицу ниже). К металлам относятся почти все s-элементы (за исключением Н, Не), примерно половина р-элементов, все d— и f-элементы (лантаниды и актиниды).
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых атомов р-элементов (Sn, Pb, Bi, Ро) их больше (от четырех до шести). Валентные электроны атомов металлов слабо (по сравнению с атомами неметаллов) связаны с ядром. Поэтому атомы металлов относительно легко отдают эти электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы:
Me — пе– = Меn+.
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8.
Легкость, с которой атомы металла отдают свои валентные электроны другим атомам, характеризует восстановительную активность данного металла. Чем легче атом металла отдает свои электроны, тем он более сильный восстановитель. Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов (см. таблицу ниже).
Распространенность металлов в природе.
В первую тройку наиболее распространенных в земной коре (это поверхностный слой нашей планеты толщиной примерно 16 км) металлов входят алюминий, железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
Распространенность металлов в земной коре
| Металл | Массовая доля в земной коре, % | Металл | Массовая доля в земной коре, % |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10-3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10-3 |
| Ca | 3,38 | Ni | 8 ∙ 10-3 |
| Na | 2,65 | Cu | 4,7 ∙ 10-3 |
| K | 2,41 | Pb | 1,6 ∙ 10 |
| Mg | 2,35 | Ag | 7 ∙ 10-6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10-6 |
| Mn | 0,10 | Au | 5 ∙ 10-8 |
Элементы, массовая доля которых в земной коре составляет менее 0,01 %, называются редкими. К числу редких металлов относятся, например, все лантаниды. Если элемент не способен концентрироваться в земной коре, т. е. не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам. Рассеянными, например, являются следующие металлы: Sc, Ga, In, Tl, Hf.
В 40-х годах XX в. немецкие ученые Вальтер и Ида Нолла к высказали мысль о том. что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы. Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа ученые все больше убеждаются в справедливости этих слов.
Поскольку все живые организмы находятся в тесном контакте с окружающей средой, то и в каждом из них должны содержаться если не все, то большая часть химических элементов периодической системы. Например, в организме взрослого человека массовая доля неорганических веществ составляет 6 %. Из металлов в этих соединениях присутствуют Mg, Са, Na, К. В составе многих ферментов и иных биологически активных органических соединений в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Сг и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия. Потребность в ионах натрия настолько велика, что их необходимо специально добавлять в пищу. Значительная потеря ионов натрия (в виде NaCl с мочой и потом) неблагоприятно сказывается на здоровье человека. Поэтому в жаркую погоду врачи рекомендуют пить минеральную воду. Однако и избыточное содержание соли в пище негативно сказывается на работе наших внутренних органов (в первую очередь, сердца и почек).
abouthist.net
Какие бывают металлы? — Мир вокруг нас — Любовь Васильевна Кашинская — rutlib2.com
Какие бывают металлы?
В древние века считалось, что металлов на Земле всего семь. Тогда к ним относили только золото, серебро, медь, олово, свинец, железо и ртуть. М. В. Ломоносов считал, что металлами можно назвать только шесть веществ. К числу металлов он не относил ртуть, потому что определял металл как «светлое тело, которое ковать можно». Ртуть – это жидкий металл, и, конечно, ковать его невозможно. А вот знаменитый французский ученый А. Лавуазье в своей книге «Начальный курс химии» называл уже 17 металлов. Сейчас их известно более 80-ти.
Все металлы отличаются друг от друга. Одни из них твердые, а другие совсем мягкие. Есть даже один-единственный жидкий металл – ртуть. Самый твердый из металлов – хром. Он даже режет стекло. Самые же мягкие – калий, рубидий и цезий – легко режутся ножом.
Электрический ток тоже проводится не одинаково разными металлами. Лучше всего его проводит серебро, за ним идут медь, золото, алюминий и железо.
Другими физическими свойствами металлов, по которым они отличаются друг от друга, являются плотность и температура плавления. В этом отношении самым легким из металлов является литий: его плотность всего 0,53 г/см3, а самым тяжелым – осмий, с плотностью 22,6 г/см3. Те металлы, плотность которых составляет меньше 5 г/см3, относятся к легким металлам, остальные – к тяжелым.
Также различается у разных металлов и температура плавления. Если цезий и галлий можно расплавить теплом ладоней, то вольфрам, например, плавится только при температуре +3 410 градусов по Цельсию.
Многие металлы в чистом виде не используются. Из них делают сплавы. Так обстоит дело, например, с чистым железом. Оно очень мягкое и не годится в чистом виде для промышленных нужд. Поэтому его соединяют с углеродом, и тогда получается сталь. К железу добавляют также и другие, более твердые металлы – хром, ванадий, вольфрам. Все сплавы, которые делаются на основе железа, называются черными металлами, а все остальные металлы называются цветными.
rutlib2.com
Простые вещества — металлы
Из 109 химических элементов Периодической системы Дмитрия Ивановича Менделеева 87 элементов образуют в свободном состоянии простые вещества с металлической связью.
Еще в давние времена человек обращал свое внимание на особые свойства металлов: их можно плавить, а после этого придавать им любую форму, изготовив при этом наконечники копий и стрел, секиры и мечи, посуду и даже плуги. Как нам известно, из истории, на смену каменному веку пришел медный век, затем – бронзовый, еще позже – железный. Абсолютно все металлы, кроме ртути, в своем обычном состоянии твердые вещества, обладающие определенным набором общих свойств. Металлы – это пластичные, ковкие, тягучие вещества, обладающие металлическим блеском, а также способностью проводить электрический ток и тепло.
В древние времена, металлам приписывались различные чудодейственные свойства. В Древнем Египте семь металлов считались олицетворением семи планет на Земле.
Такой драгоценный металл как золото, наши праотцы олицетворяли с Солнцем, серебро – с Луной, медь – с Венерой, железо – с Марсом, олово – с Юпитером, свинец – с Сатурном, ртуть – с Меркурием. Количество металлов, которое на тот момент было известно людям, казалось бы, только подтверждало подобную взаимосвязь между планетами и металлами. Когда в шестнадцатом веке алхимики сумели открыть металлическую сурьму, они на протяжении долгого времени не хотели признавать ее металлом – ведь для сурьмы на небе не хватало определенной планеты.
М.В. Ломоносов описывал металлы как «светлое тело, которое ковать можно», он приписывал это свойство к золоту, серебру, меди, олову, железу и свинцу. А. Лавузье упоминал в своей книге «Начальный курс химии» написанной в 1789 году, уже около семнадцати металлов. В начале девятнадцатого века произошло открытие платиновых металлов. В наши дни, число металлов которые известны человеку, достигло 87.
Пластичность – одно из важнейших свойств металлов, позволяющее им видоизменять свою форму при ударе, сплющиваться в тонкие листы или вытягиваться в проволоку. Таким образом, подвижные обобществленные электроны смягчают перемещение положительных ионов, экранируя их друг от друга. Именно поэтому обработка металла при изменении его формы происходит без разрушения оного.
По своей пластичности, из драгоценных металлов можно выделить золото. Всего из одного грамма золота можно изготовить проволоку протяженностью в три километра.
Наличие обобществленных электронов объясняет также и такое характерное свойство металлов, как их электропроводность. Хватит даже небольшой разности потенциалов, и хаотично двигающиеся электроны начинают перемещаться в строго упорядоченном направлении. Самыми оптимальными проводниками электрического тока являются такие металлы как серебро, медь, золото, алюминий. В такой последовательности, уменьшается их электропроводность.
Помимо этого, свободные электроны являются причиной блеска металлов. Свет поглощается поверхностью металла, его электроны начинают испускать свои, уже вторичные, волны излучения, мы их можем наблюдать как металлический блеск. Хорошим примером этого могут послужить такие металлы как ртуть, медь серебро – они прекрасно отражают свет.
Большое количество металлов фигурирует в природе в виде руды и различных соединений. Они могут образовывать сульфиды, оксиды, карбонаты и многие другие химические соединения. Чтобы получить чистый метал из руды необходимо выделить его и произвести очистку. Если возникает необходимость, то производится легирование и другая обработка металла. Наука, которая изучает металлы, а также все, что связано с ними называется металлургия.
Остались вопросы? Не знаете, как сделать домашнее задание?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
« Химия металлов» | Kursak.NET
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ПЕРМСКОГО КРАЯ
Государственное бюджетное образовательное учреждение
среднего профессионального образования
«СОЛИКАМСКИЙ ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ»
Внеурочное задание по теме:
« Химия металлов»
Учебная дисциплина (Междисциплинарный курс :_______ Химия________
Студентка_____Циковкиной Эльвиры
Курс _1_ Группа (шифр)_К-11
Специальность (код, название) __38,02,04, Коммерция_________________________________
Выполнила:_Циковкина Эльвира __ ________________
(подпись) (Ф.И.О.)
Проверил Филиппова Н. В_ _____________
(подпись) (Ф.И.О.)
г. Соликамск 2015 г.
Содержание.
1. Положение металлов в Периодической системе химических элементов Д. И. Менделеева.
2. Строение атомов металлов , его свойства.
3. Содержание ионов металла в живых организмах.
4. Металл – простое вещество.
5. Физические свойства.
6. Химические свойства.
7. Способы получения металлов.
8. Применение металлов.
9. Список литературы.
Положение металлов в Периодической системе химических элементов Д. И. Менделеева.
В настоящее время известно 105 химических элементов, большинство из них – металлы. Последние весьма распространены в природе и встречаются в виде различных соединений в недрах земли, водах рек, озер, морей, океанов, составе тел животных, растений и даже в атмосфере.
По своим свойствам металлы резко отличаются от неметаллов. Впервые это различие металлов и неметаллов определил М. В. Ломоносов. “Металлы, – писал он, – тела твердые, ковкие блестящие”.
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду наличие у него определенного комплекса свойств:
1. Плотная кристаллическая структура.
2. Характерный металлический блеск.
3. Высокая теплопроводность и электрическая проводимость.
4. Уменьшение электрической проводимости с ростом температуры.
5. Низкие значения потенциала ионизации, т.е. способность легко отдавать электроны.
6. Ковкость и тягучесть.
7. Способность к образованию сплавов.
Строение атомов металлов ,его свойства.
Металлы составляют большую часть химических элементов. Каждый период периодической системы (кроме 1-го) химических элементов начинается с металлов, причем с увеличением номера периода их становится все больше. Если во 2-м периоде металлов всего 2 (литий и бериллий), в 3-м — 3 (натрий, магний, алюминий), то уже в 4-м — 13, а в 7-м — 29.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn. Составляя схемы строения атомов, по желанию можно составлять электронные формулы и приводить примеры строения элементов больших периодов, например цинка.
В связи с тем что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
Свойство атомов металлов отдавать электроны явтяется их характерным химическим свойством и свидетельствует о том, что металлы проявляют восстановительные свойства.
При характеристике физических свойств металлов следует отметить их общие свойства: электрическую проводимость, теплопроводность, металлический блеск, пластичность, которые обусловлены единым видом химической связи — металлической, и металлической кристаллической решетки. Их особенностью является наличие свободно перемещающихся обобществленных электронов между ион – атомами, находящимися в узлах кристаллической решетки.
При характеристике химических свойств важно подтвердить вывод о том, что во всех реакциях металлы проявляют свойства восстановителей, и проиллюстрировать это записью уравнений реакции. Особое внимание следует обратить на взаимодействие металлов с кислотами и растворами солей, при этом необходимо обратиться к ряду напряжений металлов (ряд стандартных электродных потенциалов).
Примеры взаимодействия металлов с простыми веществами (неметаллами): 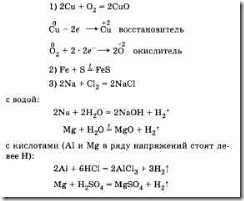
с солями ( Zn в ряду напряжений стоит левее Сu): Zn + СuС12 = ZnCl2 + Сu!
Таким образом, несмотря на большое многообразие металлов, все они обладают общими физическими и химическими свойствами, что объясняется сходством в строении атомов и строении простых веществ.
Содержание ионов металла в живых организмах.
Бионеорганическая химия изучает в первую очередь поведение десяти металлов жизни в живом организме. К металлам жизни относятся пять ионов с замкнутыми электронными оболочками (ионы нз- рия, калия, магния, кальция и цинка), четыре иона с недостроенной З -электронной оболочкой (ионы марганца, железа, кобальта и меди) и только один элемент молибден, у которого могут появиться электроны на 4 -оболочке.
Ионы многих металлов, в том числе железа (Ре), калия (К), кальция (Са) и магния (М ), необходимы для здоровья человека. Л,о 10% наших потребностей в этих элементах удовлетворяется за счет минералов, растворенных в питьевой воде. Другие металлы, называемые тяжелыми, образованы более массивными атомами, чем металлы, необходимые для здоровья. Они также могут растворяться в воде в виде ионов. Наиболее важные тяжелые металлы свинец (РЬ), ртуть (Hg) и кадмий (Сс1). Ионы этих элементов токсичны даже в малых количествах. Они связываются с белками, из которых состоит живой организм, и приводят к их неправильному функционированию. Отравление тяжелыми металлами может приводит), к очень серьезным последствиям. Сюда относятся повреждения нервной системы, почек, печени, слабоумие и даже смерть. Свинец, ртуть и кадмий особенно опасны, поскольку они широко распространены и могут попадать в пищу или воду. По мере накопления в организме эти элементы могут стать еще более опасными.
Эти два соединения, хлорофилл и гем, играют важнейшую роль в сложном механизме поглощения солнечной энергии и ее превращении для использования живыми организмами. Мы уже знаем, что характерным свойством комплексов переходных металлов является наличие нескольких близко расположенных -уровней, что позволяет им поглощать свет в видимой области спектра и придает окраску. Порфириновый цикл вокруг иона Mg в молекуле хлорофилла выполняет такую же роль. Хлорофилл в растениях поглощает фотоны видимого света и переходит в возбужденное электронное состояние Эта энергия возбуждения может инициировать цепь химических реакций, приводящих в конце концов к образованию сахаров из диоксида углерода и воды
Шесть металлов Ь1, Ма, К, КЬ, Сз, Рг называют щелочными, так как их гидроксиды хорошо растворимы в воде и полностью диссоциируют на ионы. Наиболее распространены в природе натрий и калий (по 2,5%). Они входят в состав большинства горных пород, множества минералов и солей, в состав морской воды, рассолов и минерализованных вод, живых организмов и т. д. Литий входит в состав многих алюмосиликатов и алюмофосфатов (его кларк — 6,5 10″ , цезий и особенно рубидий — очень рассеянные элементы, также встречающиеся в некоторых алюмосиликатах (кларки соответственно 7 10 % и 3 10″ %).
Многие ионы металлов необходимы клеткам живых организмов. Это Na, К, Mg, Са, Мп, Fe, Со, Си, Мо, Zn. Они составляют 3% массы человеческого тела. Na(I), К(1) и Са(П) особенно важны как участники так называемого ионного насоса , который сопровождается активным транспортом метаболитов и энергетическими процессами. Другие металлы, такие, как Zn(II) и Со(И), обнаружены в различных металлоферментах, где они координируются с аминокислотами и ускоряют реакции, происходящие в активном центре [214]. Они выступают как сверхкислотные катализаторы, оказывающие прямое или матричное действие. В то же время ионы Fe(II) и u(II) предпочтительно связываются с простетическими группами порфиринового типа и участвуют во многих системах электронного переноса
В свою очередь гомогенный катализ можно разделить по типу применяемого катализатора на кислотно-основной (в присутствии кислот и оснований), окислительно -восстановительный (в присутствии ионов металлов переменной валентности), координационный или металлокомплексный (промежуточные продукты — комплексные соединения) и гомогенный газофазный (например, окисление диоксида серы кислородом в присутствии следов оксидов азота). К гомогенно-каталитическим процессам относят и ферментативный катализ биохимических процессов, происходящих в живых организмах под влиянием сложных белковых катализаторов — ферментов (энзимов).
Большое значение имеют иониты при охране окружающей среды. Так, например, в сточных водах многих производств содержатся ионы тяжелых металлов, которые очень вредны для живых организмов. Так как концентрация тяжелых металлов в сточных водах очень мала, применение обычных методов удаления (например, осаждение) неэффективно и дорого. Сточные воды обрабатывают катионитом, причем можно использовать катионит, содержащий не ион водорода, а, например, ион натрия. Ионы тяжелых металлов, обмениваясь на ион натрия, поглощаются катионитом, нз которого их можно легко извлечь и использовать в народном хозяйстве.
Металл – простое вещество.
Металлы – простые вещества. Металлов в природе больше оттого, что у них у всех одинаковое строение кристаллической решетки и один тип химической связи. Это и придает им ряд общих свойств. Это отличает металлы от неметаллов, которым присуще больше различие свойств, чем их общность. В виде простого вещества атомы металлов связаны между собой, так называемой металлической связью. У металлов, особенно щелочных, валентные электроны связаны с атомами слабо и при отрыве затрачивается сравнительно немного энергии. При этом возникают ионы, имеющие устойчивый электронный слой из 8 электронов. Поэтому металлы как в твердом, таки в жидком состоянии существуют в виде ионов, между которыми в хаотичном движении находятся электроны, получившие условное название электронного газа. Ионы при столкновении с электронами на некоторое время превращаются в атомы. Таким образом, твердый металл представляет собой каркас из положительных ионов, атомов, погруженных в море подвижных электронов.
Физические свойства.
С внешней стороны металлы, как известно, характеризуются прежде всего особым “металлическим” блеском, который обусловливается их способностью сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно только в том случае, когда металл образует сплошную компактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в порошок, но большинство металлов в мелкораздробленном виде имеет черный или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и электропроводностью, причем по способности проводить тепло и ток располагаются в одном и том же порядке: лучшие проводники – серебро и медь, худшие – свинец и ртуть. С повышением температуры электропроводность падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с особенностями их внутренней структуры. Согласно современным воззрениям, кристаллы металлов состоят из положительно заряженных ионов и свободных электронов, отщепившихся от соответствующих атомов. Весь кристалл можно себе представить в виде пространственной решетки, узлы которой заняты ионами, а в промежутках между ионами находятся легкоподвижные электроны. Эти электроны постоянно переходят от одних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Так как электроны не связаны с определенными ионами, то уже под влиянием небольшой разности потенциалов они начинают перемещаться в определенном направлении, т.е. возникает электрический ток.
Наличием свободных электронов обусловливается и высокая теплопроводность металлов. Находясь в непрерывном движении, электроны постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в данной части металла вследствие нагревания, сейчас же передаются соседним ионам, от них – следующим и т.д., и тепловое состояние металла быстро выравнивается; вся масса металла принимает одинаковую температуру.
Химические свойства.
Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением:
Zn + Pb(NO 3 ) 2 = Pb + Zn(NO 3 ) 2
Из уравнения следует, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам двухвалентного свинца, тем самым превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в виде металлического свинца. Если поступить наоборот, то есть погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено русским ученым Бекетовым, расположившим металлы по их убывающей химической активности в так называемый “вытеснительный ряд”. В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
В таблице №2 представлены значения стандартных электродных потенциалов некоторых металлов. Символом Me + /Me обозначен металл Me, погруженный в раствор его соли. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-” , а знаком “+” отмечены стандартные потенциалы электродов, являющихся окислителями.
Способы получения металлов.
Огромное большинство металлов находится в природе в виде соединений с другими элементами.
Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, серебро и медь – отчасти в самородном виде; иногда попадаются также самородные ртуть, олово и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой воды, или путем извлечения их из породы различными реагентами с последующим выделением металла из раствора. Все остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главными рудами являются оксиды, сульфиды и карбонаты металлов.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем.
Если, например, смешать красную медную руду (куприт) Cu 2 O с углем и подвергнуть сильному накаливанию, то уголь, восстанавливая медь, превратится в оксид углерода(II), а медь выделится в расплавленном состоянии:
Cu 2 O + C = 2Cu + CO
Подобным же образом производится выплавка чугуна их железных руд, получение олова из оловянного камня SnO 2 и восстановление других металлов из оксидов.
При переработке сернистых руд сначала переводят сернистые соединения в кислородные путем обжигания в особых печах, а затем уже восстанавливают полученные оксиды углем. Например:
2ZnS + 3O 2 = 2ZnO + 2SO 2
ZnO + C = Zn + CO
В тех случаях, когда руда представляет собой соль угольной кислоты, ее можно непосредственно восстанавливать углем, как и оксиды, так как при нагревании карбонаты распадаются на оксид металла и двуокись углерода. Например:
ZnCO 3 = ZnO + CO 2
Обычно руды, кроме химического соединения данного металла, содержат еще много примесей в виде песка, глины, известняка, которые очень трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают различные вещества, образующие с примесями легкоплавкие соединения – шлаки. Такие вещества называются флюсами. Если примесь состоит из известняка, то в качестве флюса употребляют песок, образующий с известняком силикат кальция. Наоборот, в случае большого количества песка флюсом служит известняк.
Во многих рудах количество примесей (пустой породы) так велико, что непосредственная выплавка металлов из этих руд является экономически невыгодной. Такие руды предварительно “обогащают”, то есть удаляют из них часть примесей. Особенно широким распространением пользуется флотационный способ обогащения руд (флотация), основанный на различной смачиваемости чистой руды и пустой породы.
Техника флотационного способа очень проста и в основном сводится к следующему. Руду, состоящую, например, из сернистого металла и силикатной пустой породы, тонко измельчают и заливают в больших чанах водой. К воде прибавляют какое-нибудь малополярное органическое вещество, способствующее образованию устойчивой пены при взбалтывании воды, и небольшое количество специального реагента, так называемого “коллектора”, который хорошо адсорбируется поверхностью флотируемого минерала и делает ее неспособной смачиваться водой. После этого через смесь снизу пропускают сильную струю воздуха, перемешивающую руду с водой и прибавленными веществами, причем пузырьки воздуха окружаются тонкими масляными пленками и образуют пену. В процессе перемешивания частицы флотируемого минерала покрываются слоем адсорбированных молекул коллектора, прилипают к пузырькам продуваемого воздуха, поднимаются вместе с ними кверху и остаются в пене; частицы же пустой породы, смачивающиеся водой, оседают на дно. Пену собирают и отжимают, получая руду с значительно большим содержанием металла.
Для восстановления некоторых металлов из их оксидов применяют вместо угля водород, кремний, алюминий, магний и другие элементы.
Процесс восстановления металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии.
Очень важным способом получения металлов является также электролиз. Некоторые наиболее активные металлы получаются исключительно путем электролиза, так как все другие средства оказываются недостаточно энергичными для восстановления их ионов.
Применение металлов.
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется, прежде всего, их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
Список использованной литературы.
1. “Основы общей химии”. Ю.Д.Третьяков , Ю.Г.Метлин. Москва “Просвещение” 1980 г.
2. “Общая химия”. Н.Л.Глинка. Издательство “Химия”, Ленинградское отделение 1972 г.
3. “Отчего и как разрушаются металлы”. С.А.Балезин. Москва “Просвещение” 1976 г.
4. “Пособие по химии для поступающих в вузы”. Г.П.Хомченко. 1976 г.
5. “Книга для чтения по неорганической химии”. Часть 2. Составитель В.А.Крицман. Москва “Просвещение” 1984 г.
6. “Химия и научно-технический прогресс”. И.Н.Семенов, А.С.Максимов, А.А.Макареня. Москва “Просвещение” 1988г.
kursak.net
Металлы и неметаллы
Все металлы, кроме ртути, в обычных условиях твердые вещества, характеризующиеся «металлическим» блеском, хорошей тепло- и электропроводимостью, пластичностью. Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы.
Неметаллы в обычных условиях находятся в твердом (фосфор, сера, селен, углерод и др.), жидком (бром) и газообразном (кислород, водород, азот и др.) состояниях. Твердые неметаллы отличаются хрупкостью и, как правило, обладают плохой тепло- и электропроводимостью.
Типичными неметаллами являются галогены (фтор, хлор, бром, иод), сера, селен, теллур, азот, фосфор, углерод.
Резкой границы между металлами и неметаллами не существует. Некоторые элементы одновременно совмещают свойства металлов и неметаллов, причем и те и другие свойства у них выражены недостаточно резко. Например, цинк, бериллий, алюминий, хром, олово, свинец в кислой среде проявляют свойства металлов, а в щелочной — неметаллов.
Все наиболее распространенные металлы и неметаллы как твердые, так и жидкие и газообразные, входят в ассортимент химических реактивов. Большинство металлов поступает в продажу в виде порошка, небольших слитков или кусков. Для облегчения работы с ними некоторые металлы переплавляют и выпускают в виде палочек (висмут, кадмий, олово, свинец), гранул (кадмий,, свинец, цинк), губки (олово), пыли (цинк, алюминий), листа или ленты (золото, медь), проволоки (алюминий, железо), стружки (железо) и т. п.
Некоторые металлы и неметаллы чрезвычайно легко окисляются на воздухе и поэтому их хранят в определенных условиях. Так, натрий и калий хранят под слоем керосина или другого углеводорода, а белый фосфор — под слоем воды.
Применение. Чистые металлы и неметаллы используют в неорганическом и органическом синтезе для получения химических реактивов и препаратов. Окислением некоторых металлов получают непосредственно окислы этих металлов реактивной чистоты, а растворением их в кислотах — соответствующие соли.
В органическом синтезе металлы находят применение в качестве катализаторов (алюминий, медь, никель, палладий, платина, серебро и др.), при получении металлоорганических соединений и т. д.
Белый фосфор, сера и другие неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений. Бром, хлор, иод используются в органическом синтезе для получения галогенорганических производных, а также для получения некоторых галогенсодержащих кислот и их солей.
Металлы и неметаллы играют известную роль и в аналитической химии. Большая группа металлов — алюминий, железо, цинк, магний, олово, никель — применяются в качестве восстановителей. Натрий используют для определения хлора в органических веществах, при восстановлении и гидрировании многих органических соединений, для глубокой осушки органических жидкостей, для приготовления амальгам и т. д. Бром служит окислителем при аналитических определениях марганца, никеля, хрома, висмута, железа, цианидов, роданидов, мочевины, муравьиной кислоты.
Чистые элементы, такие, как сера, свинец, алюминий, кобальт, медь, никель, олово, палладий, сурьма, цинк, характеризующиеся четкой температурой плавления, используются в термометрии для калибровки термометров и пирометров.
abakbot.ru
