Металлы в химии – формула класса, таблица (9 класс)
4
Средняя оценка: 4
Всего получено оценок: 2119.
4
Средняя оценка: 4
Всего получено оценок: 2119.
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.
Рис. 2. Металлы в таблице Д.И. Менделеева.Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т. д. д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,5 г/см
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
4Al+3O2=Al2O3
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают
Рис. 3. Металлы главных подгрупп.Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Илья Васечко
10/10
Дархан Дарибаев
10/10
Лиза Комиссарова
10/10
Софа Данилова
10/10
Наири Аракелян
10/10
Вадим Якшимбетов
10/10
Лилия Алишева
10/10
Анастасия Анисина
10/10
Влад Сергеев
9/10
Руслан Гайс
9/10
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 2119.
А какая ваша оценка?
Химические свойства металлов — с чем реагируют? Свойства и таблица
Поможем понять и полюбить химию
Начать учиться
123.6K
Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
| Li, K, Na, Ca, Ba | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину.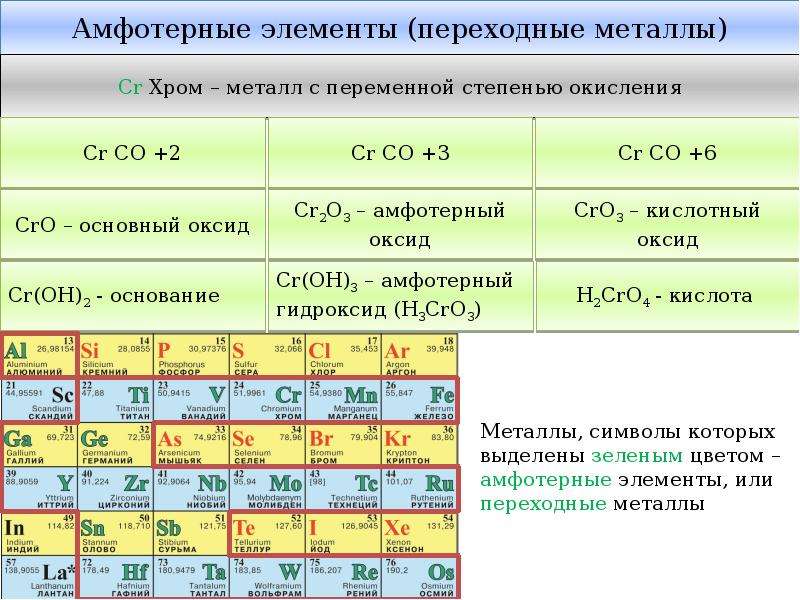 Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2
= MgCl22Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.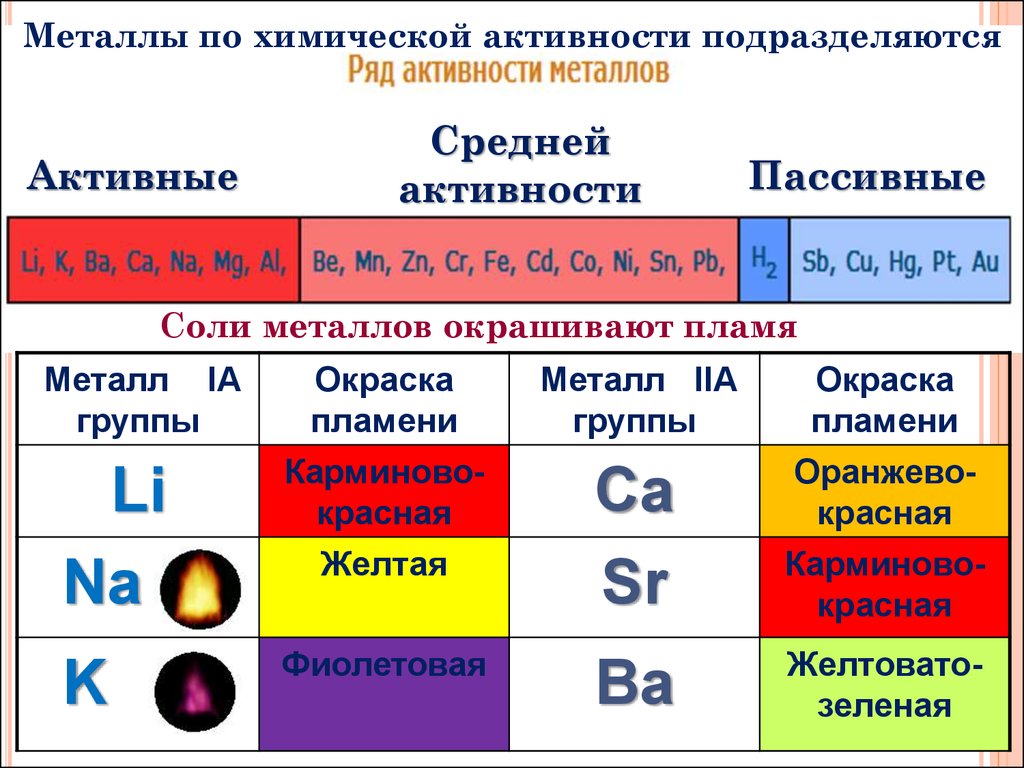
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Li, K,Ca, Na, | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au | |
|---|---|---|---|---|
Восстановительная способность металлов в свободном состоянии | ||||
Взаимодействие металлов с кислородом | Быстро окисляются при обычной температуре | Медленно окисляются при обычной температуре или при нагревании | Не окисляются | |
Взаимодействие с водой | Выделяется водород и образуется гидроксид | При нагревании выделяется водород и образуются оксиды | Водород из воды не вытесняют | |
Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот (кроме HNO3) | Не вытесняют водород из разбавленных кислот | ||
Реагируют с концентрированными азотной и серной кислотами | С кислотами не реагируют, растворяются в царской водке | |||
Взаимодействие с солями | Не могут вытеснять металлы из солей | Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей | ||
Взаимодействие с оксидами | Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов | |||
Татьяна Сосновцева
К предыдущей статье
126. 7K
7K
Оксиды
К следующей статье
Химические свойства кислот
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Металл | Определение, характеристики, типы и факты
слиток золота
Посмотреть все СМИ
- Ключевые люди:
- Элсворт Келли Дэвид Смит Жан Тэнгли Сэр Энтони Каро Уильям Э. Додж
- Похожие темы:
- редкоземельный элемент переходный металл щелочной металл актиноидный элемент натрий
См. все связанные материалы →
металл , любой из классов веществ, характеризующихся высокой электро- и теплопроводностью, а также ковкостью, пластичностью и высокой светоотражательной способностью.
Приблизительно три четверти всех известных химических элементов составляют металлы. Наиболее распространенными разновидностями в земной коре являются алюминий, железо, кальций, натрий, калий и магний. Подавляющее большинство металлов находится в рудах (минералосодержащих веществах), но некоторые из них, такие как медь, золото, платина и серебро, часто встречаются в свободном состоянии, поскольку они плохо реагируют с другими элементами.
Викторина «Британника»
Наука: правда или вымысел?
жидкий металл
Посмотреть все видео к этой статье Металлы обычно представляют собой кристаллические твердые тела. В большинстве случаев они имеют относительно простую кристаллическую структуру, отличающуюся плотной упаковкой атомов и высокой степенью симметрии. Как правило, атомы металлов содержат менее половины полного набора электронов в своей внешней оболочке. Из-за этой характеристики металлы, как правило, не образуют соединений друг с другом. Однако они легче соединяются с неметаллами (например, с кислородом и серой), которые обычно имеют более половины максимального числа валентных электронов. Металлы сильно различаются по своей химической активности. К наиболее реакционноспособным относятся литий, калий и радий, а к менее реакционноспособным относятся золото, серебро, палладий и платина.
Однако они легче соединяются с неметаллами (например, с кислородом и серой), которые обычно имеют более половины максимального числа валентных электронов. Металлы сильно различаются по своей химической активности. К наиболее реакционноспособным относятся литий, калий и радий, а к менее реакционноспособным относятся золото, серебро, палладий и платина.
Высокая электрическая и теплопроводность простых металлов (т. е. непереходных металлов периодической таблицы) лучше всего объясняется со ссылкой на теорию свободных электронов. Согласно этой концепции, отдельные атомы в таких металлах уступили свои валентные электроны всему твердому телу, и эти свободные электроны, вызывающие проводимость, движутся группой по всему твердому телу. В случае более сложных металлов (т. е. переходных элементов) проводимости лучше объясняются зонной теорией, учитывающей не только наличие свободных электронов, но и их взаимодействие с так называемыми d электронов.
Механические свойства металлов, такие как твердость, способность противостоять повторяющимся нагрузкам (усталостная прочность), пластичность и ковкость, часто объясняются дефектами или несовершенствами их кристаллической структуры. Отсутствие слоя атомов в его плотноупакованной структуре, например, позволяет металлу пластически деформироваться и предотвращает его хрупкость.
Отсутствие слоя атомов в его плотноупакованной структуре, например, позволяет металлу пластически деформироваться и предотвращает его хрупкость.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Барбарой А. Шрайбер.
2.1: Введение в металлы — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 189612
- Крис Шаллер
- Колледж Святого Бенедикта/Университет Святого Иоанна
Большинство элементов, найденных на Земле, являются металлами. Взгляд на периодическую таблицу показывает, что эти элементы занимают всю левую часть таблицы, от основной группы до переходных металлов, лантаноидов, актиноидов, щелочных и щелочноземельных элементов.
Один элемент, включенный сюда, водород, редко классифицируется как металл. На Земле водород — это газ, и его обычно классифицируют как неметалл, как кислород и азот. Однако при очень низких температурах и очень высоких давлениях водород является твердым телом, и в правильных условиях ожидается, что он будет вести себя скорее как металл. Считается, что газовые гиганты, такие как Юпитер и Сатурн в нашей Солнечной системе, могут иметь ядра из металлического водорода.
Металлические элементы обычно не встречаются в виде отдельных атомов. Вместо этого атомы в таком элементе, как железо, собираются вместе, образуя более крупную структуру. Сформированные таким образом материалы имеют некоторые сходные свойства. Металлы блестят. Металлы податливы; их можно сгибать и придавать им разные формы (по крайней мере, при нагревании). Металлы являются хорошими проводниками электричества.
- В металлах большие группы атомов группируются вместе.
- Атомы металлов образуют большие протяженные массивы, в которых атомы повторяются определенным образом по всему телу.
Свойства металлов очень важны. Тот факт, что металлы податливы, позволяет превращать их в листы, которые можно использовать для изготовления автомобилей, самолетов, железнодорожных путей, грузовых контейнеров и кораблей, а также более деликатных предметов, таких как ювелирные изделия и хирургические инструменты. Родственное свойство, пластичность, позволяет металлу растягиваться в длинные тонкие проволоки. Вместе с проводимостью металлов это свойство позволяет линиям электропередач передавать электроэнергию от электростанций к таким людям, как вы. Иногда источник электричества находится за сотни миль; электричество, используемое для питания ноутбука в Нью-Йорке, может поступать из таких мест, как Ла-Гранд-Бален или Джеймс-Бей на северо-западе Квебека.
Некоторые из этих свойств можно понять, если подумать о структуре металлических элементов. Большая часть нашего понимания структуры металлов и других материалов исходит из исследований дифракции рентгеновских лучей. Очень сфокусированный пучок рентгеновских лучей можно направить в материал, где они будут отражаться от атомов и рассеиваться в разных направлениях. Результат звучит хаотично, но если твердое тело хорошо организовано, рентгеновские лучи ведут себя очень предсказуемо. В результате получается рентгенограмма. Дифракционная картина немного напоминает узор ряби на пруду, когда камень брошен в спокойную воду. Узор можно изучить и расшифровать математически, чтобы найти расположение атомов внутри материала.
Большая часть нашего понимания структуры металлов и других материалов исходит из исследований дифракции рентгеновских лучей. Очень сфокусированный пучок рентгеновских лучей можно направить в материал, где они будут отражаться от атомов и рассеиваться в разных направлениях. Результат звучит хаотично, но если твердое тело хорошо организовано, рентгеновские лучи ведут себя очень предсказуемо. В результате получается рентгенограмма. Дифракционная картина немного напоминает узор ряби на пруду, когда камень брошен в спокойную воду. Узор можно изучить и расшифровать математически, чтобы найти расположение атомов внутри материала.
- Рентгеновская дифракция может выявить структуры на атомном уровне высокоупорядоченных материалов, таких как металлы.
О чем говорит нам рентгеновская дифракция? Очевидно, кусок металла — это не просто масса беспорядочно слипшихся атомов. Вместо этого атомы располагаются аккуратными слоями весьма специфическим образом. Эти слои атомов располагаются друг над другом, образуя трехмерное твердое тело.
Одним из свойств, возникающих в результате такого организованного расположения атомов, является ковкость металлов. Если вы возьмете хороший мягкий металл, такой как медь, после отжига в огне или в печи его можно легко согнуть и придать ему форму. С медью это можно сделать даже после того, как металл остынет до комнатной температуры. Когда вы сгибаете медь, вы фактически заставляете слои атомов скользить друг по другу, пока вы не перестанете сгибаться и они не остановятся в новом месте.
Рисунок \(\PageIndex{3}\): Сила (жирная стрелка) толкает слой атомов мимо другого слоя атомов, создавая новую форму. Если вы когда-либо делали это, то знаете, что чем больше вы работаете с медью, тем сложнее ее согнуть. Это потому, что пока вы двигаете слои атомов вперед и назад, иногда атом (или целый ряд атомов) соскальзывает со своего места. Он больше не является частью гладкого слоя, и поэтому другие атомы не могут так легко скользить мимо него. Такая ситуация называется дефектом. Когда в металле достаточно дефектов, гнуть материал уже невозможно.
Он больше не является частью гладкого слоя, и поэтому другие атомы не могут так легко скользить мимо него. Такая ситуация называется дефектом. Когда в металле достаточно дефектов, гнуть материал уже невозможно.
- Атомы металлов находятся в организованных слоях.
- Поскольку эти слои могут накладываться друг на друга, металлу можно придавать различные формы.
Упражнение \(\PageIndex{1}\)
Сплав представляет собой смесь двух металлов. Сталь представляет собой сплав железа с любым из ряда других элементов, таких как хром или ванадий. Сплавы часто тверже, чем металлы, состоящие из чистого элемента. Покажите, как легирование вносит дефект в металл и как это делает металл более прочным.
- Ответить
Размер второго атома металла отличается от размера основного атома металла. Он не совсем впишется в массив атомов. Следовательно, атомы не смогут так легко скользить друг мимо друга.
Что удерживает эти атомы металла вместе? Чтобы ответить на этот вопрос, важно понять, где в периодической таблице находятся металлические материалы. В нижней левой части периодической таблицы находятся наименее электроотрицательные элементы. На самом деле все эти элементы легко теряют электроны, и они часто встречаются в виде катионов в природных соединениях. Например, гематит — обычная железная руда, содержащая катионы железа (Fe 3 + ) и анионов кислорода (O 2-). Формула этого соединения Fe 2 O 3 , что означает, что на каждые два катиона железа в гематите всегда приходится три аниона кислорода.
Упражнение \(\PageIndex{2}\)
Покажите, как соотношение элементов в гематите приводит к получению сбалансированного по заряду (в целом нейтрального) соединения.
- Ответить
2 Fe: (3 + ) х 2 = (6 + )
3 О: (2 — ) х 3 = (6 — )
Fe 2 O 3 : нейтральный
Многие атомы в металлическом материале присутствуют в виде катионов. Но куда делись их потерянные электроны? Что ж, эти электроны все еще находятся в материале, перемещаясь между атомами железа и катионами. В куске железа притяжение между катионами железа и свободно движущимися электронами помогает удерживать металл вместе. Такой взгляд на металлы иногда называют моделью связи «электронного моря».
Рисунок \(\PageIndex{5}\): Катионы металлов в электронном море.- Связь в металлах часто описывается с помощью «модели электронного моря».
- Ионы металлов окружены делокализованными электронами.
- Делокализованные электроны не ограничены тем или иным атомом; они распределены по нескольким атомам в твердом теле.

Почему металлы проводят электричество? Электричество — это движение электронов через материал. Но проведение тока через металл, вероятно, происходит в результате ряда событий. Если электрон ввести на одном конце материала, он, вероятно, будет притягиваться катионом металла. Он может даже быть захвачен этим металлом. Иногда мы описываем, что этот электрон движется в «дыру»; дырка, с точки зрения проводимости, — это просто положительный заряд, который захватывает электрон. Но помните, что металлы все еще довольно электроположительны (противоположны электроотрицательности), и этот атом металла, вероятно, потеряет еще один электрон. Это может быть не тот электрон, который вы вставили; это наверное другой. Этот электрон, в свою очередь, может быть захвачен другой дыркой в другом металле. Этот металл может потерять еще один электрон и так далее. Электроны будут прыгать и перескакивать с одного металла на другой по всему материалу. Электрический ток возникает из-за того, что эти прыгающие электроны в металле удаляются от электронов, которые подаются с одного конца. Вместо этого они движутся к другому концу.
Вместо этого они движутся к другому концу.
Блеск металлов также приписывается аспекту электронного моря металлической связи. Столкновения между падающими фотонами и «свободными» электронами на поверхности металла заставляют фотоны отскакивать от поверхности. Красноватый цвет меди является результатом ограничения длины волны видимого света, отражающегося от металла.
- Модель электронного моря используется для объяснения нескольких уникальных свойств металлов.
До сих пор мы рассматривали модель электронного моря исключительно с точки зрения электростатики: отрицательно заряженный электрон притягивается к положительно заряженному ядру. Однако мы уже видели при обсуждении квантовой механики атома, что кинетическая энергия и длина волны электрона также являются важным фактором в химии.
Упражнение \(\PageIndex{3}\)
Предположим, что следующие ящики наполовину заполнены водой. Покажите максимально возможную длину волны в каждом из прямоугольников.
- Ответить
Чем длиннее коробка, тем длиннее возможная длина волны.
В модели металлической связи электронного моря электроны могут быть делокализованы. Они больше не ограничиваются одним атомом, а могут распространяться на несколько атомов. В результате длина волны электрона увеличивается. Поскольку длина волны обратно пропорциональна энергии, по мере увеличения длины волны электрона его энергия уменьшается. В результате распространение электронов по группе металлов приводит к уменьшению энергии из-за волновых свойств электронов.
В результате распространение электронов по группе металлов приводит к уменьшению энергии из-за волновых свойств электронов.
- Делокализация — важное понятие в химии.
- Делокализация связана с концепцией «частица в коробке»: чем длиннее контейнер, тем длиннее возможная длина волны.
- Распределяясь по большей группе атомов, электрон может принять более длинную длину волны.
- Электрон с большей длиной волны имеет меньшую энергию.
Некоторые свойства металлов можно понять, имея общее представление о структуре металла. Мы собираемся более подробно рассмотреть, как именно атомы металлов превращаются в твердые тела, прежде чем мы рассмотрим некоторые способы, которыми металлы образуют соединения с другими элементами.
Эта страница под названием 2.1: Introduction to Metals распространяется под лицензией CC BY-NC 3.0 и была создана, изменена и/или курирована Крисом Шаллером с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.

