Металлы в химии – формула класса, таблица (9 класс)
4
Средняя оценка: 4
Всего получено оценок: 1847.
4
Средняя оценка: 4
Всего получено оценок: 1847.
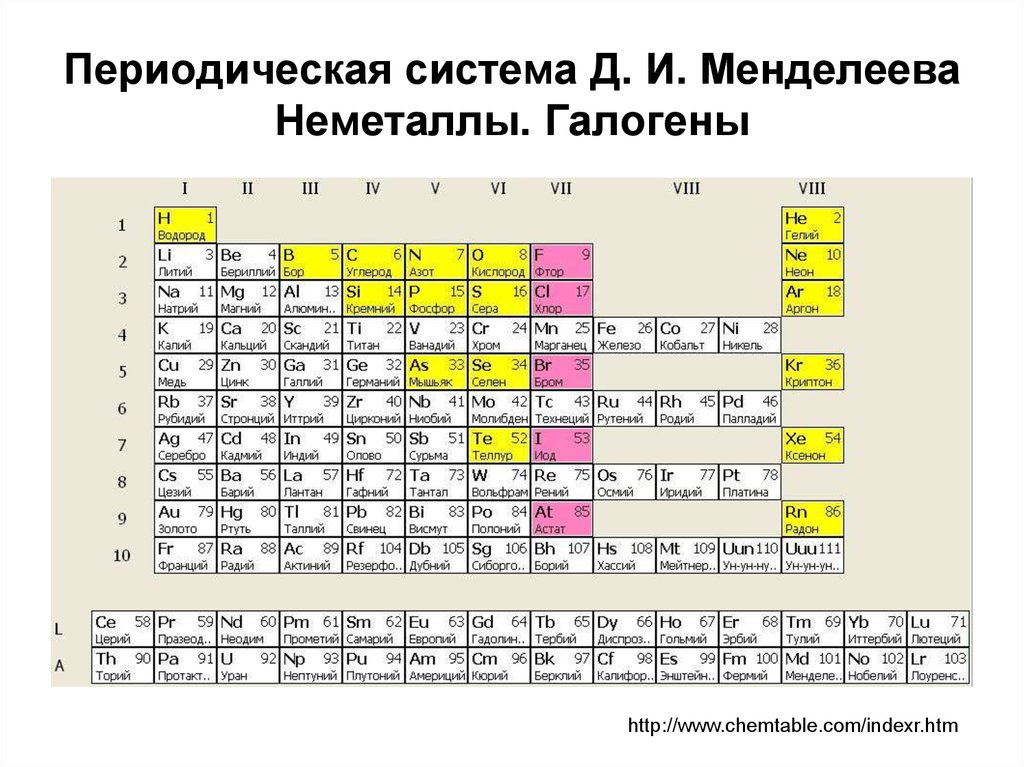
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
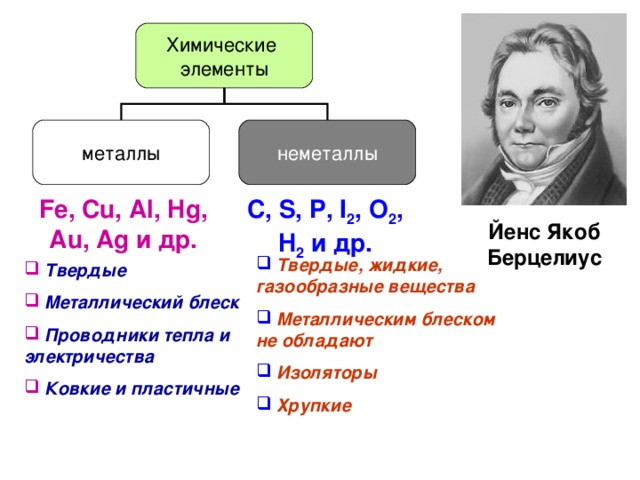
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
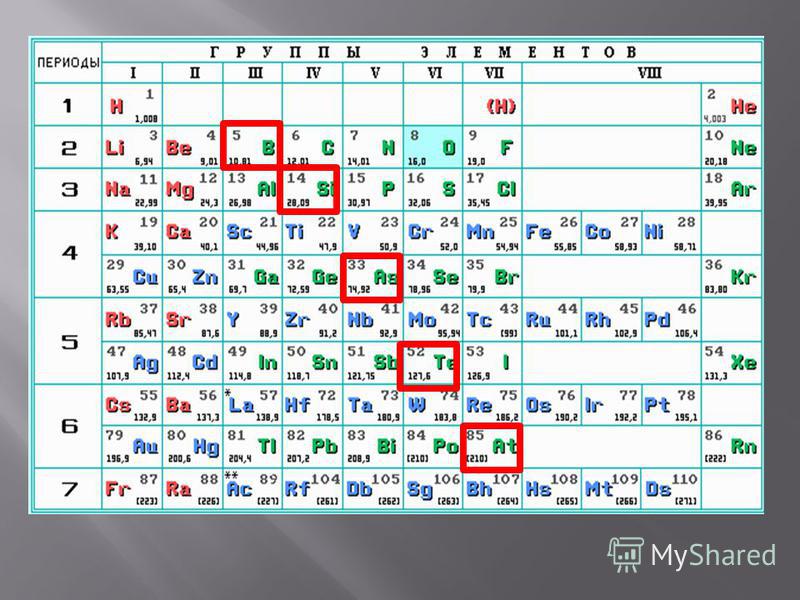
Рис. 1. Список металлов.Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.
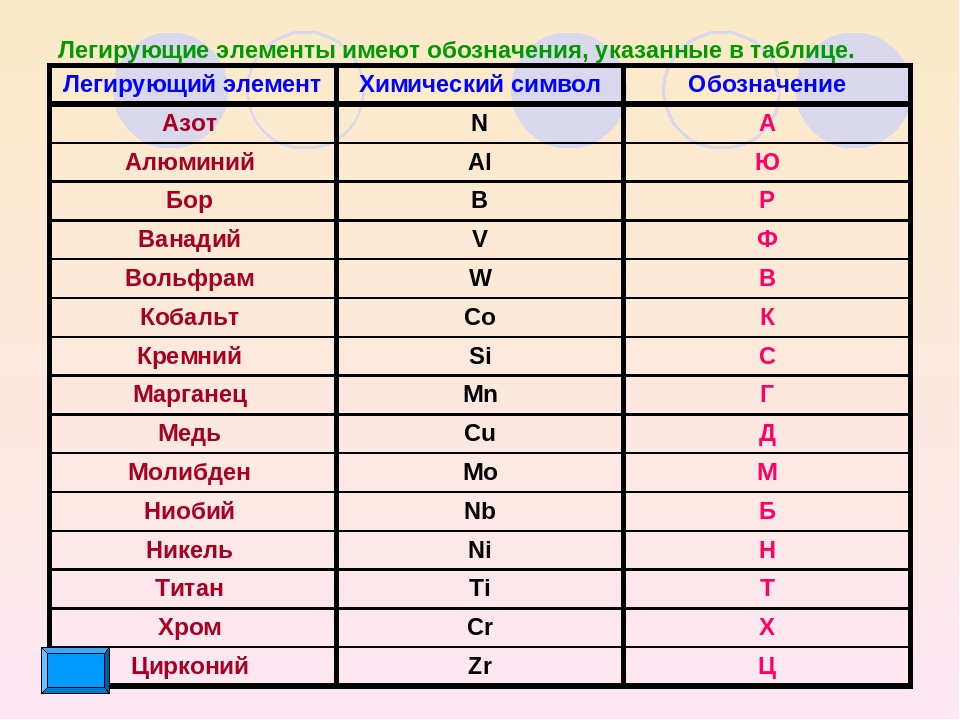
Рис. 2. Металлы в таблице Д.И. Менделеева.Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
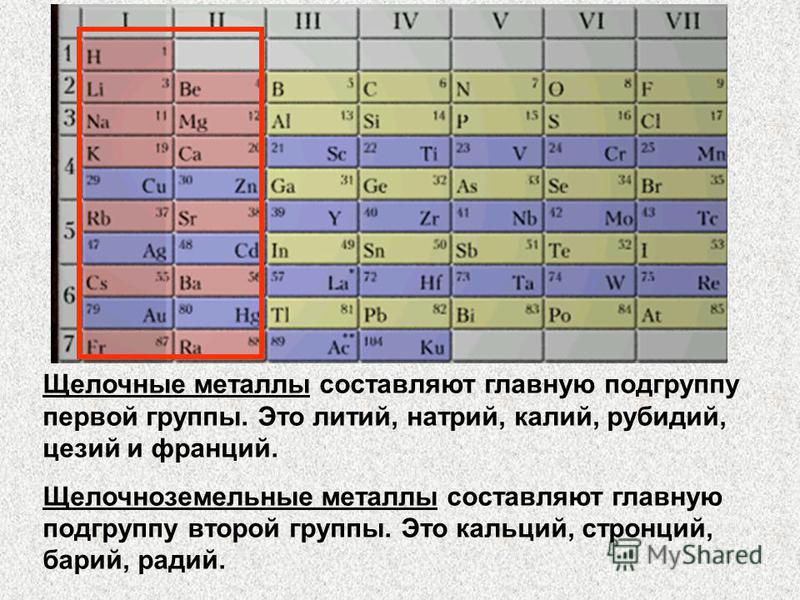
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т. д. д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,5 г/см
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
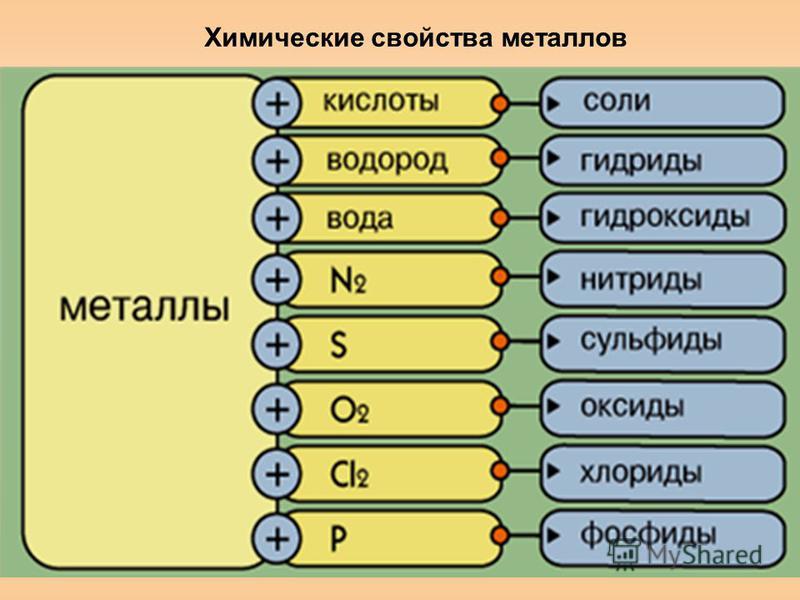
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
4Al+3O2=Al2O3
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
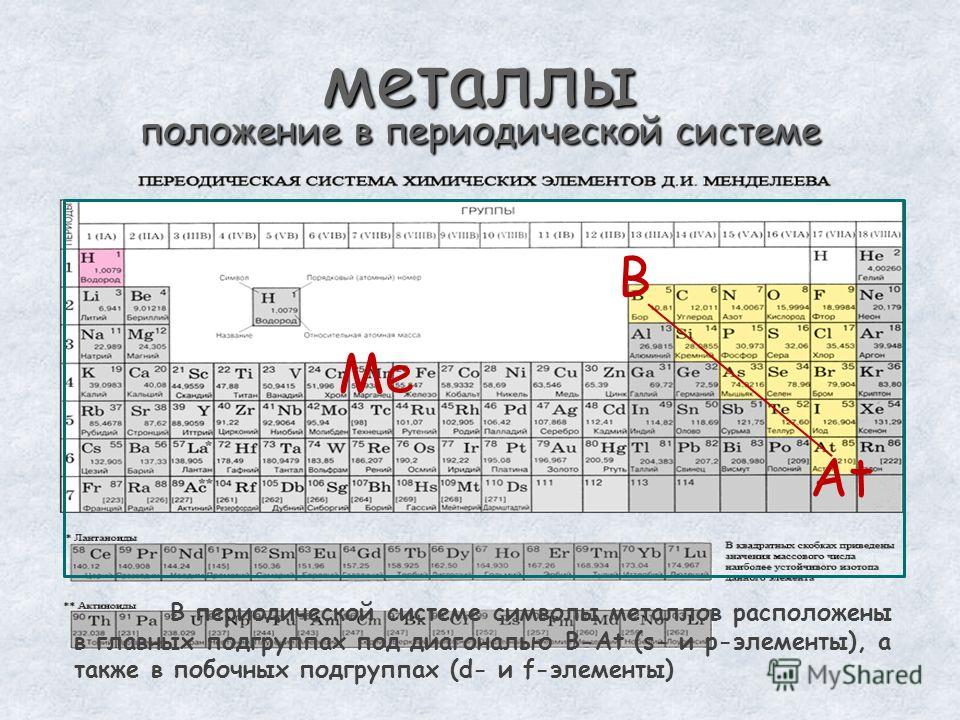
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают
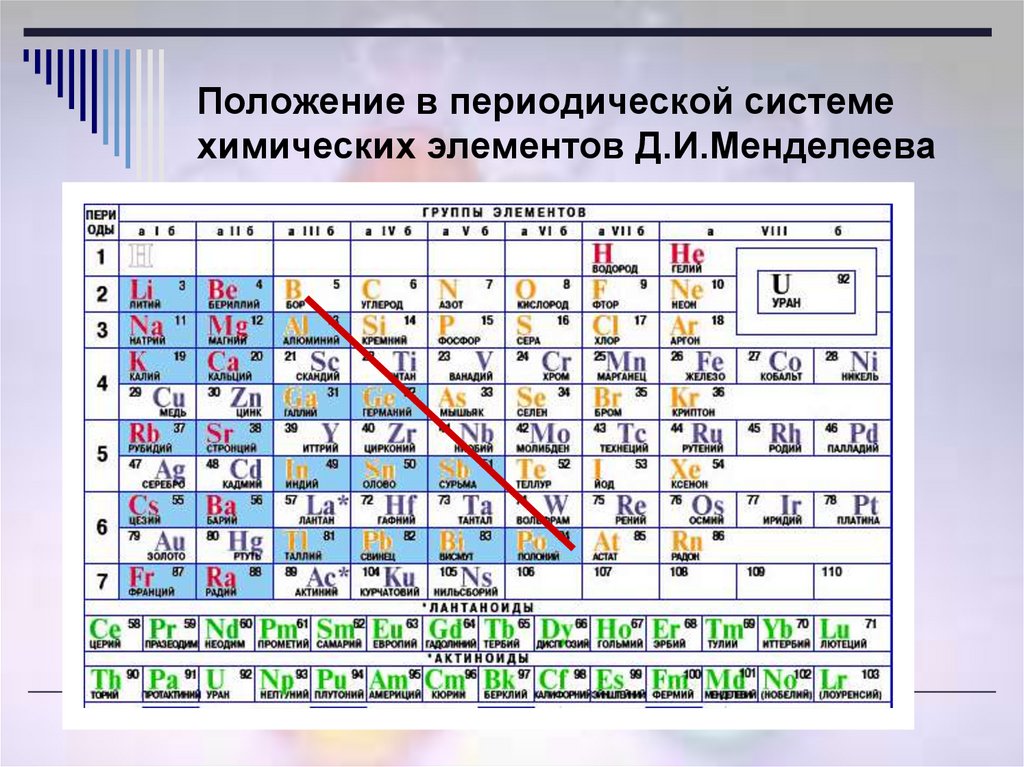
Рис. 3. Металлы главных подгрупп.Нахождение металлов и способы их получения
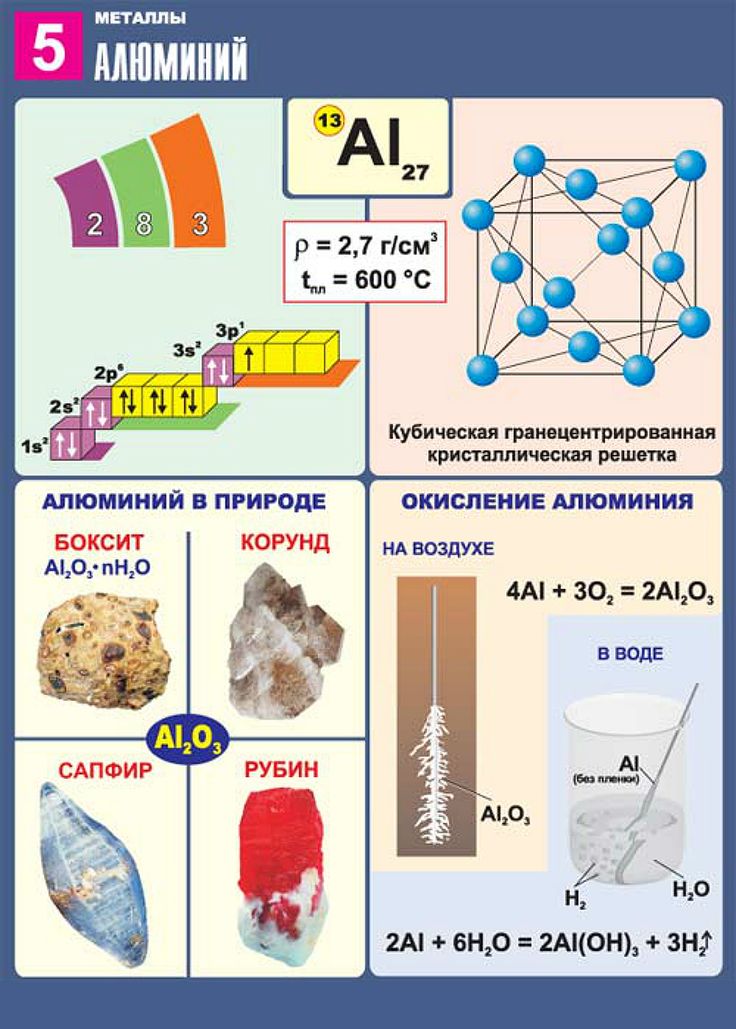
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Илья Васечко
10/10
Дархан Дарибаев
10/10
Лиза Комиссарова
10/10
Софа Данилова
10/10
Наири Аракелян
10/10
Вадим Якшимбетов
10/10
Лилия Алишева
10/10
Анастасия Анисина
10/10
Влад Сергеев
9/10
Руслан Гайс
9/10
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 1847.
А какая ваша оценка?
Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
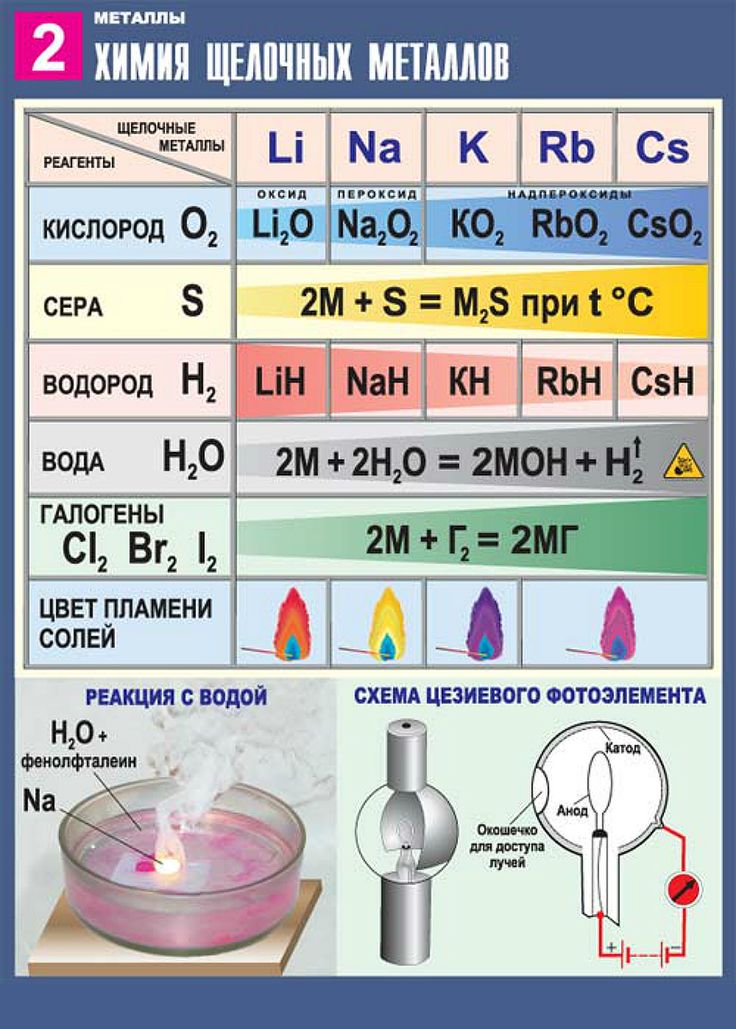
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Какими бывают металлы? | Техника и Интернет
Не будем разбираться в тонкостях науки, просто отметим, что металлы и их сплавы бывают очень и очень разными.
Мы считаем металлы твердыми, но ртуть плавится при -39оС, галлий — при 30оС, цезий — при 28оС (правда, заметить это сложно, т.к. он на воздухе мгновенно воспламеняется). А еще несколько металлов, хотя и твердые в комфортном для нас температурном диапазоне, но плавятся при температуре до +500оС. Это цинк (419оС), свинец (327оС), кадмий (321о
А еще несколько металлов, хотя и твердые в комфортном для нас температурном диапазоне, но плавятся при температуре до +500оС. Это цинк (419оС), свинец (327оС), кадмий (321о
Мы считаем, что металлы тяжелые (т.е. имеют высокую плотность). А у лития плотность (0.531 г/см3) почти вдвое меньше, чем плотность воды, что позволяло бы ему плавать в воде — если бы он не реагировал так активно с водой, начиная с ней реагировать при малейшей влажности воздуха. При этом осмий в 22.5 раза тяжелее воды.
Мы считаем, что металлы прочные, понимая под прочностью способность сопротивляться разрушению, притом что по шкале прочности металлы делятся на:
— непрочные (свинец, олово, висмут и несколько других), прутки из таких металлов без труда гнутся руками, их сопротивление не выше 50 МПа;
— прочные, чье сопротивление от 50 до 500 МПа, это титан, железо, медь, алюминий… руками их не погнуть, но хороший инструмент позволит… заставить их поменять форму.
— высокопрочные, такие как молибден, вольфрам, ниобий, чья прочность превышает 500 МПа; их крайне сложно обработать — как можно заточить победитовый наконечник?
А еще металлы распределяют по пластичности. Это способность твердых тел при снятии нагрузок сохранять часть деформации, вызванной нагрузками. По этому свойству металлы разделяют на:
— хрупкие (относительное удлинение меньше 3%), это сурьма, кобальт, марганец, хром… (приложи к ним силу — и они растрескаются).
— пластичные (относительное удлинение от 3% до 40%), это вольфрам, молибден, висмут, магний и др.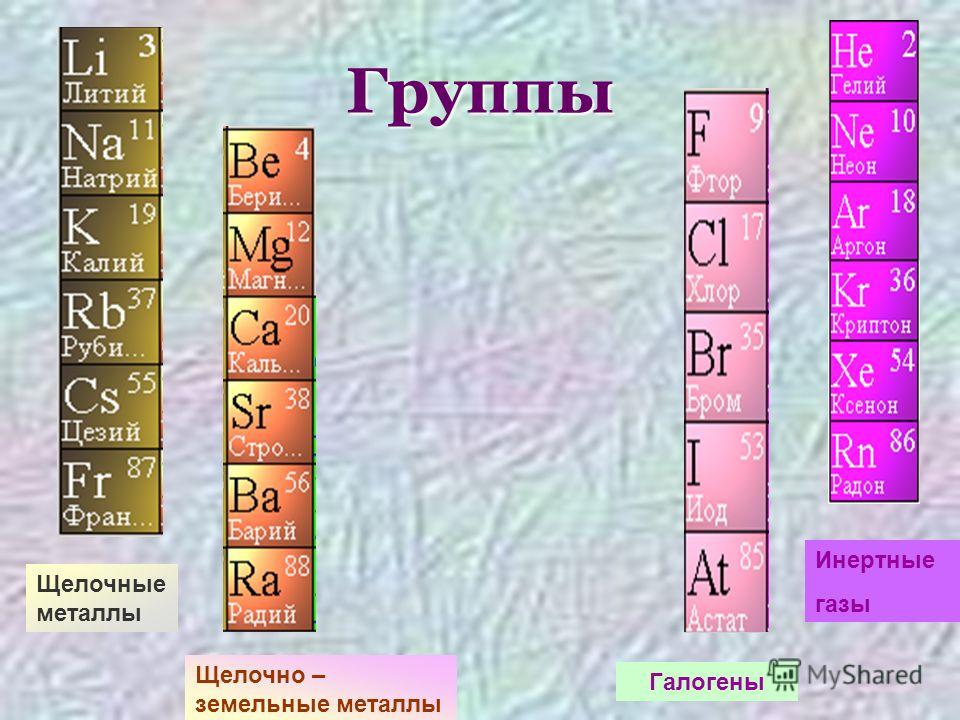
— высокопластичные — это металлы, из которых делают большинство современных конструкционных сплавов (медь, железо, титан, алюминий, свинец, олово…).
И рекордсмен по пластичности тут, несомненно, золото. Один грамм золота можно вытянуть в проволоку длиной 2500 метров. А сусальное золото, которое и в наше время широко применяют для декоративного золочения, состоит из листочков золота толщиной примерно 100 нм. Сто нанометров, или 0.0001 мм! Сусальное золото продают обычно книжками. При этом книжка в 60 листов 91.5×91.5 см (общая площадь листочков сусального золота — почти 60 кв. м) содержит 1.1 грамм золота.
Все металлы электропроводны, но их сопротивление варьируется в очень широких пределах — от 0,015 Ом·мм2/м у серебра, до 1,40 Ом·мм2/м у нихрома.
…Впрочем, нихром — сплав никеля, хрома, с добавками железа, марганца и других металлов, обладающий высокой жаропрочностью, стойкостью к коррозии и высоким электрическим сопротивлением — изначально и был придуман для изготовления электрических нагревательных элементов.
Вот так и выходит, что металлы — и пластичные, и хрупкие, и твердые, и жидкие… Совершенно разные!
Теги: физика, интересный факт, металл, свойства, химия
Металлы и неметаллы
|
|
|
|||||||||||||||||||||
Простые вещества — металлы
Репетиторы ❯ Химия ❯ Простые вещества — металлы
Автор: Андрей Ф., онлайн репетитор по химии
●
08. 02.2012
02.2012
●
Раздел: Химия
Из 109 химических элементов Периодической системы Дмитрия Ивановича Менделеева 87 элементов образуют в свободном состоянии простые вещества с металлической связью.
Еще в давние времена человек обращал свое внимание на особые свойства металлов: их можно плавить, а после этого придавать им любую форму, изготовив при этом наконечники копий и стрел, секиры и мечи, посуду и даже плуги. Как нам известно, из истории, на смену каменному веку пришел медный век, затем – бронзовый, еще позже – железный. Абсолютно все металлы, кроме ртути, в своем обычном состоянии твердые вещества, обладающие определенным набором общих свойств. Металлы – это пластичные, ковкие, тягучие вещества, обладающие металлическим блеском, а также способностью проводить электрический ток и тепло.
В древние времена, металлам приписывались различные чудодейственные свойства. В Древнем Египте семь металлов считались олицетворением семи планет на Земле.
Такой драгоценный металл как золото, наши праотцы олицетворяли с Солнцем, серебро – с Луной, медь – с Венерой, железо – с Марсом, олово – с Юпитером, свинец – с Сатурном, ртуть – с Меркурием. Количество металлов, которое на тот момент было известно людям, казалось бы, только подтверждало подобную взаимосвязь между планетами и металлами. Когда в шестнадцатом веке алхимики сумели открыть металлическую сурьму, они на протяжении долгого времени не хотели признавать ее металлом – ведь для сурьмы на небе не хватало определенной планеты.
М.В. Ломоносов описывал металлы как «светлое тело, которое ковать можно», он приписывал это свойство к золоту, серебру, меди, олову, железу и свинцу. А. Лавузье упоминал в своей книге «Начальный курс химии» написанной в 1789 году, уже около семнадцати металлов. В начале девятнадцатого века произошло открытие платиновых металлов. В наши дни, число металлов которые известны человеку, достигло 87.
В наши дни, число металлов которые известны человеку, достигло 87.
Пластичность – одно из важнейших свойств металлов, позволяющее им видоизменять свою форму при ударе, сплющиваться в тонкие листы или вытягиваться в проволоку. Таким образом, подвижные обобществленные электроны смягчают перемещение положительных ионов, экранируя их друг от друга. Именно поэтому обработка металла при изменении его формы происходит без разрушения оного.
По своей пластичности, из драгоценных металлов можно выделить золото. Всего из одного грамма золота можно изготовить проволоку протяженностью в три километра.
Наличие обобществленных электронов объясняет также и такое характерное свойство металлов, как их электропроводность. Хватит даже небольшой разности потенциалов, и хаотично двигающиеся электроны начинают перемещаться в строго упорядоченном направлении. Самыми оптимальными проводниками электрического тока являются такие металлы как серебро, медь, золото, алюминий. В такой последовательности, уменьшается их электропроводность.
Помимо этого, свободные электроны являются причиной блеска металлов. Свет поглощается поверхностью металла, его электроны начинают испускать свои, уже вторичные, волны излучения, мы их можем наблюдать как металлический блеск. Хорошим примером этого могут послужить такие металлы как ртуть, медь серебро – они прекрасно отражают свет.
Большое количество металлов фигурирует в природе в виде руды и различных соединений. Они могут образовывать сульфиды, оксиды, карбонаты и многие другие химические соединения. Чтобы получить чистый метал из руды необходимо выделить его и произвести очистку. Если возникает необходимость, то производится легирование и другая обработка металла. Наука, которая изучает металлы, а также все, что связано с ними называется металлургия.
Остались вопросы? Не знаете, как сделать домашнее задание?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog. tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
Задать вопрос
Физика
Курсы по физике 10 класс
Математика
Математика 11 класс
Математика
Курсы по геометрии 8 класс
История России
Курс подготовки к ГИА по «Истории»
Испанский язык
Курсы испанского для начинающих
Цифровая фотография
Курс цифровой фотографии
Математика
Курсы по математике 10 класс
Математика
Курсы по алгебре 7 класс
Металл и химия | Металлургический портал MetalSpace.
 ru
ruМеталл вокруг нас
- Образование и карьера
- Металлургия и общество
- Металл вокруг нас
16 июля 2012 8005 0
В исследовании веществ, как мы уже знаем, люди шли, опираясь на их внешние отличия. С металлами человечество познакомилось примерно 6-7 тысяч лет назад. И хотя медь, железо, олово, золото, серебро и ртуть (первые открытые людьми металлы) отличаются по внешнему виду, у них есть и много общего. Прежде всего, это характерный металлический блеск. Другое их свойство — пластичность, способность изменять свою форму под действием нагрузок.
Ударяя по куску металла тяжелым предметом, можно придать ему новую форму (это свойство металлов называется «ковкость»). Кусок металла можно прокатать и сделать из него тонкий лист. Из металла можно вытянуть тонкую проволоку. Что особенно ценно, металл сохраняет свою форму после обработки.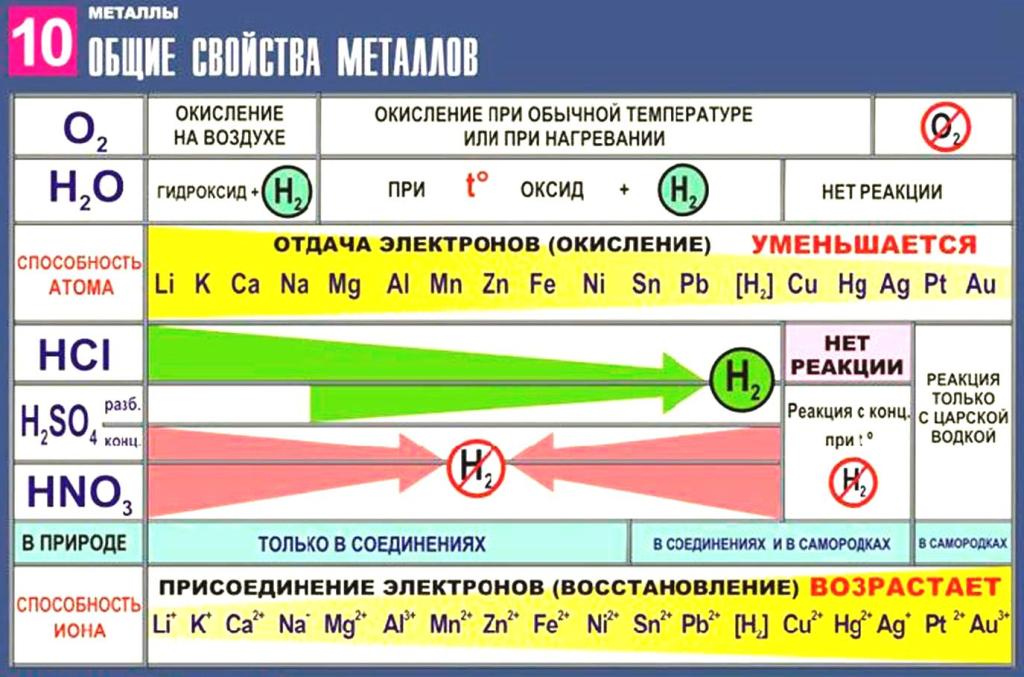
Металлические гвозди
Конечно, не со всеми металлами можно проделать подобные операции. Ртуть, например, при обычной комнатной температуре выглядит как жидкость. Но если ее охладить, внешний вид и свойства станут привычно металлическим. Металлы хорошо проводят тепло. Если налить чай в алюминиевую или эмалированную кружку, то надо будет долго ждать, прежде чем взяться за ручку. А вот в фарфоровой посуде за ручку чашки можно взяться сразу же. С открытием электричества ученые добавили к списку отличительных особенностей металлов способность проводить электрический ток. На сегодня именно это свойство является определяющим.
Свойства металлов объясняются их сходным внутренним строением. Между атомами металлов «гуляют» свободные электроны. Они образуют особый тип связи, которая так и называется — металлическая. Такая связь соединяет сразу большое количество атомов, поэтому-то металлы и обладают такой пластичностью. Именно большим количеством свободных электронов объясняется способность металлов проводить электрический ток.
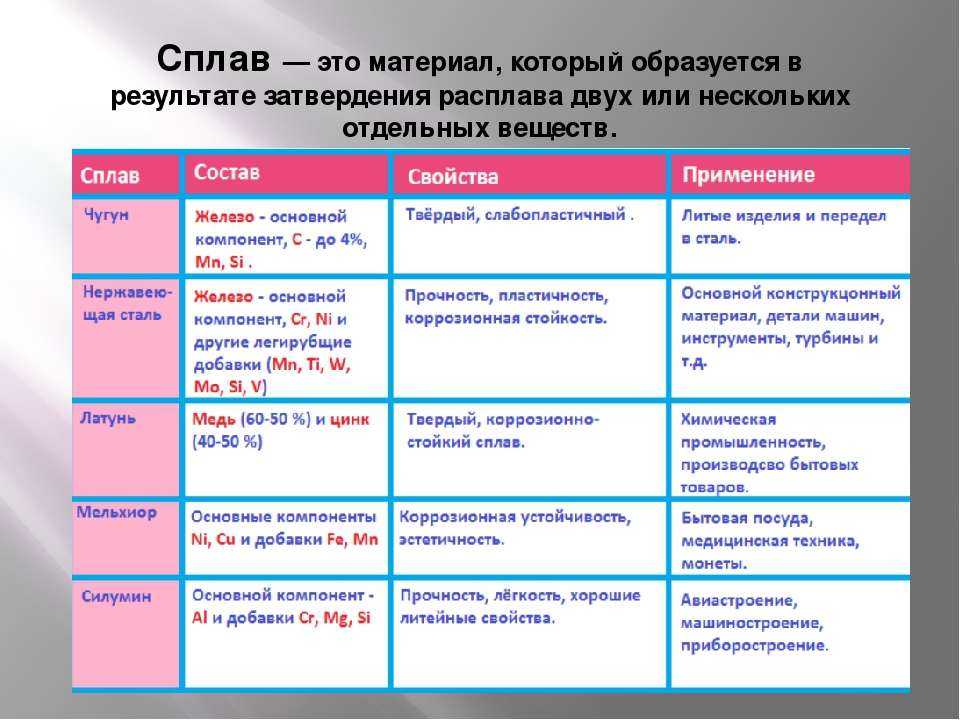
Всего известно более 80 химических элементов, которые имеют металлические свойства. Металлы между собой и с некоторыми другими элементами образуют особые соединения — сплавы. Сплавы с древнейших времен использовались человечеством, целую историческую эпоху назвали по одному из таких сплавов — бронзе.
Железо, знак Fe (читается «феррум»), занимает в таблице Менделеева ячейку № 26. Это достаточно распространенный в природе элемент. На воздухе железо окисляется, то есть вступает в реакцию с кислородом и образует оксиды. Атомы железа могут присоединять различное число атомов кислорода, то есть обладать разной валентностью, поэтому и оксиды железа бывают разные. На поверхности изделий из железа в обычных условиях всегда находится пленка оксида. Если металл соприкасается с водой или водяными парами, то оксид «захватывает» части молекул воды и превращается в ржавчину. Чем больше в железе примесей, тем легче оно покрывается ржавчиной и постепенно разрушается.
Ржавчина на железе
А вот чистое железо может спокойно оставаться на воздухе и соприкасаться с водой. Но чистое железо можно получить только в лабораториях. Железо присутствует во всех живых организмах, правда, в малых количествах, но обязательно. Способность атомов железа «захватывать» кислород используется животными в процессах дыхания и еще в некоторых. Железо сыграло огромную роль в человеческой истории, так как, научившись его выплавлять, человечество смогли быстро усовершенствовать орудия труда. Если к железу добавить углерод, а в небольших количествах другие металлы, например, молибден, то можно получить чугун и разные сорта сталей. Железо и его сплавы часто называют «черными металлами», в отличие от всех остальных.
Но чистое железо можно получить только в лабораториях. Железо присутствует во всех живых организмах, правда, в малых количествах, но обязательно. Способность атомов железа «захватывать» кислород используется животными в процессах дыхания и еще в некоторых. Железо сыграло огромную роль в человеческой истории, так как, научившись его выплавлять, человечество смогли быстро усовершенствовать орудия труда. Если к железу добавить углерод, а в небольших количествах другие металлы, например, молибден, то можно получить чугун и разные сорта сталей. Железо и его сплавы часто называют «черными металлами», в отличие от всех остальных.
Плуг с железным лемехом
Золото, знак Au (читается «аурум»), в таблице Менделеева занимает ячейку № 79. Золото было известно раньше железа. Это довольно мягкий металл красивого желтого цвета. Золото легко поддается обработке даже в холодном виде, что так важно было в старину. Но золото нельзя использовать для орудий труда или для воинских доспехов, так как оно мягкое. Зато золото, в отличие от железа, не окисляется на воздухе, спокойно вступает в контакт с водой и мало изменяется со временем. Поэтому золото издавна использовалось в «престижных» целях — для украшений, предметов искусства.
Зато золото, в отличие от железа, не окисляется на воздухе, спокойно вступает в контакт с водой и мало изменяется со временем. Поэтому золото издавна использовалось в «престижных» целях — для украшений, предметов искусства.
Слитки золота
Новая эпоха настала с открытием электричества. Золото оказалось одним из лучших проводников. А теперь золото используется для создания деталей компьютеров и другой техники. Поэтому теперь золота требуется гораздо больше, чем для ювелирных изделий в прошлом. Но это редкий металл.
Серебро часто упоминают рядом с золотом, так как это драгоценный металл. Теперь, правда, серебро гораздо дешевле золота, а раньше их цена отличалась ненамного. Номер «квартиры» у серебра 47, знак Ag, произносится «аргентум». На воздухе серебро покрывается оксидной пленкой, но спокойно выносит присутствие воды. Время разрушает серебро быстрее, чем золото, поэтому находки серебряных древностей — редкость. Серебро — замечательный проводник электричества, широко применяется в технике. Оно входит в состав многих лекарственных средств. Вода, настоянная на серебре, обладает лечебными свойствами.
Оно входит в состав многих лекарственных средств. Вода, настоянная на серебре, обладает лечебными свойствами.
Серебряная супница
Ртуть — удивительный жидкий металл. Ее номер 80, знак Hg, читается «гидраргирум». В природе ртуть распространена довольно широко, встречается и в чистом виде, и вместе с другими элементами. В соединении с серой ртуть образует киноварь, минерал красивого красного цвета. Удивительный «быстрый» и «живой» металл использовался главным образом для извлечения из земли золота и серебра. Ртуть образует с ними прочный сплав при обычной температуре; таким образом, на ртуть «налипает» золото или серебро, образуя амальгаму. Ее собирают, а затем нагревают осторожно. Ртуть улетучивается при небольшом нагреве, а золото или серебро остаются. Ртуть применяют в лекарственных целях, используют в термометрах. Она легко образует пары при обычной комнатной температуре, а пары эти ядовиты. Поэтому, разбив термометр, ртуть надо тщательно собрать. Лучше вызвать специальную службу.
ПОДЕЛИСЬ ИНТЕРЕСНОЙ ИНФОРМАЦИЕЙ
Металлургия и общество
Культурные, социально-политические и технические взаимосвязи современной индустриальной цивилизации, в основе которой лежат металлургические технологии.
АНАЛИТИКА
Научные статьи и методические материалы о природных и вторичных ресурсах металлов, а также металлургических технологиях
Производство и наука
- Эколого-экономическая эффективность реновации технических изделий июль 22, 2019
- Сжиженный природный газ март 19, 2018
- Ветроэнергетика в России, развитие технологии в ветроэнергетике янв 23, 2018
Методические материалы
- Модернизация барабанных летучих ножниц — Дипломный проект дек 03, 2020
- Схема рециклинга автомобильных катализаторов, содержащих металлы платиновой группы авг 15, 2018
- Историко-реконструкторское движение в России фев 04, 2017
Интерактивный учебник
- Как правильно согнуть металлический квадрат апр 01, 2020
- Сталь с полимерным покрытием янв 04, 2019
- Топливо из ТБО дек 17, 2018
Потенциал Забайкальского .
 ..
..Обработка металлов …
Пластическая деформация …
Металлургические технологии …
Основоположники отечественной …
Основоположники отечественной …
Русская средневековая .
 ..
..Русская средневековая …
ИНТЕРАКТИВ
Интерактивная картина мира металлов на ключевых этапах истории цивилизации
Энциклопедия «Металлургия и время»
- «Дредноуты» и «крупповские пушки» март 10, 2014
- Преимущества получения ферромарганца в электропечах март 09, 2014
- Проблемы производства доменных ферросплавов март 08, 2014
Металлургические объекты
- Музей истории МИСиС.
 Металлургия – кузница победы
апр 20, 2020
Металлургия – кузница победы
апр 20, 2020 - Доменная печь Лиенсхютте (Lienshytte blast-furnace) авг 28, 2014
- Железоделательный завод Энгельсберг (Engelsbergs bruk) авг 27, 2014
Обучающие игры
- Маша и компания — Таланты дек 07, 2014
- Маша и компания — Игры на природе дек 06, 2014
- Легенды огня и металла Часть 3.
 Мушкет
июнь 19, 2014
Мушкет
июнь 19, 2014
Copyright © 2011 — 2022 MetalSpace
22: Металлы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49645
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Приблизительно три четверти известных элементов являются металлами и очень хорошо проводят как тепло, так и электричество. Более того, у них блестящие поверхности; они способны к формованию молотком (ковкие), а также могут быть вытянуты в проволоку (пластичные). Эти свойства можно понять с точки зрения металлической связи, при которой валентные электроны делокализованы по всему металлическому кристаллу. Прочность металлической связи варьируется примерно в зависимости от количества электронов, доступных в этом море. Химические свойства металлов включают тенденцию терять электроны и образовывать положительные ионы, а также способность их оксидов действовать как основания. Степень этих характеристик варьируется от одного металла к другому.
Более того, у них блестящие поверхности; они способны к формованию молотком (ковкие), а также могут быть вытянуты в проволоку (пластичные). Эти свойства можно понять с точки зрения металлической связи, при которой валентные электроны делокализованы по всему металлическому кристаллу. Прочность металлической связи варьируется примерно в зависимости от количества электронов, доступных в этом море. Химические свойства металлов включают тенденцию терять электроны и образовывать положительные ионы, а также способность их оксидов действовать как основания. Степень этих характеристик варьируется от одного металла к другому.
- 22.1: Прелюдия к металлам
- Химические свойства металлов включают тенденцию терять электроны и образовывать положительные ионы, а также способность их оксидов действовать как основания. Степень этих характеристик варьируется от одного металла к другому. Несколько пограничных случаев, таких как B, Si, Ge, As, Sb и Te, трудно классифицировать как металлы или неметаллы.
 Эти элементы обычно называют металлоидами или полуметаллами.
Эти элементы обычно называют металлоидами или полуметаллами.
- 22.2: Металлическая связь
- Электроны могут быть подведены к одному концу металлической проволоки и удалены с другого конца, не вызывая явного изменения физических и химических свойств металла. Чтобы объяснить эту свободу движения, современные теории металлических связей предполагают, что валентные электроны полностью делокализованы; то есть они занимают молекулярные орбитали, принадлежащие металлическому кристаллу в целом. Эти делокализованные электроны часто называют электронным газом или электронным морем.
- 22.3: Металлургия
- Обработка руды может быть разделена на три этапа. (1) Обогащение для удаления бесполезного материала (пустой породы) или преобразования минерала в подходящую форму для последующей обработки. (2) Наиболее важным этапом является восстановление металла из положительной степени окисления.
 Это может включать повышенные температуры, химические восстановители, электролиз или некоторую комбинацию этих видов обработки. (3) Очистка необходима для достижения желаемой чистоты конечного продукта.
Это может включать повышенные температуры, химические восстановители, электролиз или некоторую комбинацию этих видов обработки. (3) Очистка необходима для достижения желаемой чистоты конечного продукта.
- 22.4: Обогащение
- Обогащение – это любой процесс, в ходе которого из руды удаляются пустые минералы с целью получения продукта более высокого качества и потока отходов. Обогащение может включать физические или химические процессы. Часто, как в случае промывки золота, желаемая руда или металл имеют большую плотность, чем пустая порода. Последний можно подвесить в потоке воды и смыть.
- 22.5: Восстановление металлов
- Легкость, с которой металл может быть получен из руды, значительно варьируется от одного металла к другому. Поскольку большинство руд представляют собой оксиды или могут быть превращены в оксиды путем обжига, изменение свободной энергии, сопровождающее разложение оксида, представляет собой удобную меру того, насколько легко металл может быть получен из руды.
- 22.6: Очистка металлов
- После того, как металл восстановлен, он не всегда достаточно чист для всех возможных применений. Очевидным примером является хрупкость и низкая прочность чугуна на растяжение, характеристики, которые делают его пригодным для литья, но не более того. Производство стали включает окисление примесей в основном кислороде, мартеновских или электрических печах.
- 22.7: Коррозия
- Важным аспектом использования некоторых металлов, особенно железа, является возможность коррозии. Подсчитано, что около одной седьмой части всего производства железа идет на замену металла, утраченного в результате коррозии. Ржавчина, по-видимому, представляет собой гидратированную форму оксида железа (III). Для ржавчины требуются как кислород, так и вода, и обычно она ускоряется кислотами, напряжениями в железе, контактом с менее активными металлами и наличием самой ржавчины.

- 22.8: Координационные соединения
- Характерной особенностью переходных металлов является их способность образовывать группу соединений, называемых координационными соединениями, комплексными соединениями или иногда просто комплексами.
- 22.9: Геометрия комплексов
- 22.10: Хелатирующие агенты Важным и интересным примером этого являются хелатирующие агенты — лиганды, способные образовывать две и более координационных ковалентных связи с ионом металла. Одним из наиболее распространенных из них является 1,2-диаминоэтан (обычно называемый этилендиамином и сокращенно эн). Для металлов с координационным числом 6 особенно мощным лигандом является ион этилендиаминтетраацетата (ЭДТА).
- 22.11: Ионы переходных металлов в водных растворах
Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан.
Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги

7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21742
Цели обучения
- Понять основные свойства, отличающие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Неблестящий, различных цветов |
| Ковкий и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
| Проведение тепла и электричества | Плохие проводники |
| Оксиды металлов основные, ионные | Оксиды неметаллов кислотные, ковалентные |
| Катионы формы в водном растворе | Образуют анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, образующие положительные ионы за счет потери электронов в ходе химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, ковкие, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы являются твердыми при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (галлий жидкий в жаркие дни).
- Блеск : Металлы обладают способностью отражать свет от своей поверхности и могут быть отполированы, например, золото, серебро и медь.
- Пластичность: Металлы обладают способностью выдерживать удары молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле. - Пластичность: Металлы можно волочить в проволоку. Например, 100 г серебра можно вытянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут резаться ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на самой внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что они имеют свободные электроны. Серебро и медь являются двумя лучшими проводниками тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Температуры плавления и кипения : Металлы имеют высокие температуры плавления и кипения. У вольфрама самые высокие температуры плавления и кипения, а у ртути самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы представляют собой электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, и обычно теряют электроны (т. е. окисляются ), когда подвергаются химическим реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в с подоболочкой)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в с подоболочкой )
- Ионы переходных металлов не следуют очевидной схеме, 2 9{-}} \label{1.
 3} \]
3} \]Соединения металлов с неметаллами имеют тенденцию быть ионными по своей природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\[\ce{Na2O(s) + h3O(l) \rightarrow 2NaOH(aq)}\label{1.4} \]
\[\ce{CaO(s) + h3O(l) \rightarrow Ca(OH)2(aq)} \label{1.5} \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислоты 9{2-}\), таким образом, \(Al_2O_3\).
Пример \(\PageIndex{2}\)
Как вы думаете, будет ли он твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример \(\PageIndex{3}\)
Напишите сбалансированное химическое уравнение для реакции оксида алюминия с азотной кислотой:
Раствор
2
2 Оксид металла + кислота -> соль + вода
\[\ce{Al2O3(s) + 6HNO3(aq) \rightarrow 2Al(NO3)3(aq) + 3h3O(l)} \nonumber \]
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны с образованием анионов во время химических реакций, называются неметаллами.
 Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существуют в двух из трех состояний вещества при комнатной температуре: газообразное (кислород) и твердое тело (углерод). Только бром существует в виде жидкости при комнатной температуре.
- Нековкий и пластичный : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Плохие проводники тепла и электричества.
- Блеск: Не имеют металлического блеска и не отражают свет.
- Температуры плавления и кипения : Температуры плавления неметаллов обычно на ниже, чем у металлов, но сильно варьируются.

- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \(\ce{h3(g)}\), \(\ce{N2(g)}\), \(\ce{O2(g) }\), \(\ce{F2(g)}\), \(\ce{Cl2(g)}\), \(\ce{Br2(l)}\), \(\ce{I2( с)}\).
Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами. Они электроотрицательны по характеру. Неметаллы, реагируя с металлами, имеют тенденцию приобретать электроны (обычно приобретают электронную конфигурацию благородного газа) и становятся анионы:
\[\ce{3Br2(l) + 2Al(s) \rightarrow 2AlBr3(s)} \nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами. Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\[\ce{CO2(g) + h3O(l)} \rightarrow \underset{\text{угольная кислота}}{\ce {h3CO3(aq)}} \nonumber \]
Как вы знаете, газированная вода слабокислая (угольная кислота).

Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\[\ce{CO2(g) + 2NaOH(aq) \rightarrow Na2CO3(aq) + h3O(l)} \nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.

Таблица \(\PageIndex{2}\): Элементы, разделенные на металлы, неметаллы и металлоиды. Металлы Неметаллы Металлоиды Золото Кислород Кремний Серебро Углерод Бор Медь Водород Мышьяк Железо Азот Сурьма Меркурий Сера Германий Цинк Фосфор Тенденции металлических и неметаллических свойств
Металлический характер наиболее силен для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер увеличивается с увеличением электроотрицательности и ионизации).
 энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
Неметаллический характер увеличивается снизу вверх и слева направо с наибольшим количеством неметаллических элементов в правом верхнем углу. металлический характер демонстрирует противоположную тенденцию: самый металлический элемент находится внизу слева.Авторы и ссылки
Майк Блабер (Университет штата Флорида)
Бинод Шреста (Университет Лотарингии)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- сплав
- металл
- металлический символ
- металлоид
- неметалл
Металл: Руководство по химии
Любой химический элемент, являющийся эффективным проводником электричества и тепла, можно определить как металл. Металл также хорошо образует связи и катионы с неметаллами. Атомы внутри металла быстро теряют электроны, чтобы образовать положительные ионы или катионы. Ионы, в свою очередь, окружены делокализованными электронами, которые придают металлу его электропроводность.
Различные типы металлов в периодической таблице
Ниже мы более подробно рассмотрим различные типы металлов в периодической таблице, их свойства и использование.

Щелочные металлы
Какие элементы периодической таблицы относятся к щелочным металлам? Щелочные металлы представляют собой группу металлов в периодической таблице, известную как элементы группы 1. К щелочным металлам относятся калий, натрий, литий, цезий, рубидий и затем франций. Один элемент, водород, который обычно входит в эту группу металлов, часто не проявляет поведения, сравнимого с поведением остальных щелочных металлов. Что касается остальных щелочных металлов, то они демонстрируют один из лучших примеров групповых трендов свойств среди элементов периодической таблицы.
- Радиоактивные щелочные металлы: объяснение того, что такое щелочные металлы.
- Реакционная способность щелочных металлов: краткое объяснение реакционной способности щелочных металлов.
- Группа металлов под названием щелочные: статья о щелочных металлах содержит подробные пояснения и диаграммы.
- Факты о щелочных металлах: веб-страница, посвященная свойствам щелочных металлов.

- Щелочные металлы и их относительная активность: схема относительной активности щелочных металлов.
- Щелочные металлы и водород: быстрое объяснение связи щелочных металлов с водородом.
- Периодическая таблица, группа 1A: обсуждение той части периодической таблицы, которая включает щелочные металлы.
Щелочноземельный
Щелочноземельные металлы относятся к элементам 2 группы периодической таблицы и состоят из радия, бария, стронция, кальция, магния и бериллия. Название этой конкретной группы металлов происходит от их собственных оксидов, которые, в свою очередь, обеспечивают основные щелочные растворы. Помимо магния и бериллия, щелочноземельные металлы обладают узнаваемым цветом пламени. Эти цвета пламени: малиново-красный для радия, зеленый для бария, ярко-красный для стронция и оранжевый для кальция.
- Реакционная способность и щелочноземельные металлы: эксперимент по демонстрации реакционной способности щелочноземельных металлов.
- Группа 2А: лекция о группе 2А периодической таблицы, где вы найдете щелочноземельные металлы.
- Место щелочноземельных металлов в периодической таблице: веб-страница, объясняющая, как читать щелочноземельные металлы в периодической таблице.
- О щелочноземельных металлах: исследование того, как эти металлы образуют ионы.
- Химический глоссарий: глоссарий, который содержит определение щелочноземельных металлов наряду с другими химическими терминами.
- Данные о щелочноземельных металлах: информационная страница о щелочноземельных металлах.
Лантаниды
Лантаноиды — это 15 элементов с атомными номерами от 57 до 71 в периодической таблице. Ряд элементов варьируется от лантана до лютеция. Все лантанидные элементы являются элементами f-блока, что означает, что они коррелируют с заполнением электронной оболочки 4f. Несмотря на то, что элемент под названием лютеций является элементом d-блока, в большинстве случаев он также считается элементом d-блока.
 Группа элементов в целом называется лантанидом, потому что более легкие элементы в их ряду химически подобны лантану.
Группа элементов в целом называется лантанидом, потому что более легкие элементы в их ряду химически подобны лантану.- Что такое лантаноидные элементы? : Объяснение того, чем на самом деле являются лантаноиды.
- Лантаниды и периодическая таблица: веб-страница, на которой отображается ответ на вопрос о месте лантаноидов в таблице.
- Лантаниды и трансмутация отходов: веб-страница, на которой обсуждается, что происходит с лантанидами во время трансмутации отходов.
- Противоречие и лантаноиды: статья о сомнительном месте лантаноидов в периодической таблице.
- Страница ресурсов по лантаноидам: веб-страница, на которой рассказывается о распространении и извлечении лантаноидов.
Актиниды
Актиниды — это 15 химических элементов с номерами от 89 до 103, которые соответствуют актинию и лоуренцию. Название этой серии элементов происходит от элемента актиний. В то время как большинство актинидных элементов в списке актинидных элементов являются синтетическими элементами, уран и торий можно найти в природе не только в следовых количествах.
 Одним из свойств, которым славятся эти элементы, является радиоактивность, присущая всем им; плутоний, торий и уран используются в ядерном оружии и реакторах.
Одним из свойств, которым славятся эти элементы, является радиоактивность, присущая всем им; плутоний, торий и уран используются в ядерном оружии и реакторах.- Actinide Проблемы со здоровьем: изучаются проблемы со здоровьем, вызванные использованием актинидов.
- Совместное осаждение актинидов и кальцита: обсуждение утилизации ядерных отходов.
- Actinide Studies: статья, в которой рассказывается об исследованиях электронной структуры актинидов.
- Profiles of Actinides: веб-страница с изображениями и описаниями актинидов.
- Объяснение актинидов: веб-страница, объясняющая, что такое актиниды металлов.
- Actinides: пошаговое руководство: введение в актиноиды.
Переходные металлы
Переходные металлы — это элементы, атомы которых имеют незавершенную подоболочку. Переходные металлы или элементы отличаются от других элементов своими общими свойствами. Одним из свойств является то, что они образуют множество соединений в нескольких степенях окисления.
 Другое свойство, которым они известны, — это их склонность к образованию множества парамагнитных соединений, в основном из-за низкой реакционной способности их неспаренных d-электронов.
Другое свойство, которым они известны, — это их склонность к образованию множества парамагнитных соединений, в основном из-за низкой реакционной способности их неспаренных d-электронов.- Важность переходных металлов: изложены переходные металлы и их важность.
- Кластеры переходных металлов: взгляд на кластеры переходных металлов.
- Цвета в комплексах переходных металлов: введение в то, как цвет фигурирует в комплексах переходных металлов, и взгляд на таблицу цветов переходных металлов.
- Основы переходных металлов: на этой веб-странице описаны все основы переходных металлов.
- Список переходных металлов: представлен авторитетный список переходных металлов.
- Обзор: Обзор всего, что необходимо знать о переходных металлах.
Металлоиды
Металлоиды — это химические элементы, которые лучше всего определяются по двум критериям. Они часто образуют амфотерные оксиды и ведут себя так же, как полупроводники.
 Кремний, бор, германий, теллур, сурьма и мышьяк обычно классифицируются как металлоиды. Иногда в классификацию металлоидов включают также элемент под названием полоний, но по этому поводу среди специалистов до сих пор ведутся споры.
Кремний, бор, германий, теллур, сурьма и мышьяк обычно классифицируются как металлоиды. Иногда в классификацию металлоидов включают также элемент под названием полоний, но по этому поводу среди специалистов до сих пор ведутся споры.- Металлоиды в периодической таблице: список всех металлоидов в периодической таблице и их распределение.
- Эксперимент: эксперимент, связанный с физическими науками и металлоидами.
- Металлоиды (полупроводники): объяснение того, какое место занимают металлоиды в периодической таблице.
- Исследование металлоидов: научный эксперимент, который учит студентов классифицировать и идентифицировать металлоиды.
- Свойства металлоидов: веб-страница, содержащая простое определение свойств металлоидов.
- Классификация: веб-страница, содержащая урок о том, как классифицировать элементы, включая металлоиды.
- Токсичные металлоиды: взгляд на биометилирование токсичных металлоидов.
Химия металлов – другие металлы
Другие металлы или постпереходные металлы — это группа элементов периодической таблицы, расположенная справа от переходных элементов.
 До сих пор ведутся острые споры о том, какие элементы должны быть включены в эту группу. Обычно цинк, галлий, кадмий, индий, олово, ртуть, таллий, свинец и висмут включаются в число других металлов периодической таблицы. Ртуть, кадмий и цинк (так называемые элементы 12-й группы) в разной степени включены в списки этих других металлов, а также исключены из них.
До сих пор ведутся острые споры о том, какие элементы должны быть включены в эту группу. Обычно цинк, галлий, кадмий, индий, олово, ртуть, таллий, свинец и висмут включаются в число других металлов периодической таблицы. Ртуть, кадмий и цинк (так называемые элементы 12-й группы) в разной степени включены в списки этих других металлов, а также исключены из них.- Определение постпереходного металла: приведено понятное определение постпереходного металла.
- Профиль цинка: Профиль этого постпереходного металла.
- Описание цинка: описание этого интеграла, другого металла.
- Кадмий в детских украшениях: исследовательская статья о роли кадмия в детских украшениях.
- История металлов: история металлов включает упоминание о ртути.
- Исследование Меркурия: взгляд на металл включает всестороннее изучение его состава.
- Элемент ртути: подробный анализ элемента ртути.
Прочие металлы и изделия из металла
- Титан
- Трубы из нержавеющей стали
- Алюминиевые и никелевые сплавы
Прочие химические вещества
- Процессы химической очистки сточных вод
- Виды разделительных составов для форм
- Что такое зеленая химия? Взгляд на принципы, историю и хронологию зеленой химии
Больше из Металлы и изделия из металла
Металлы и неметаллы – определение, свойства, использование и применение
Металлы и неметаллы – это два типа веществ, которые можно различать по их физическим и химическим характеристикам.
 Металлы — это элементы, которые обычно являются твердыми из-за наличия прочной металлической связи между атомами. С другой стороны, неметаллы часто являются мягкими компонентами. Металлы определяются как элементы, которые имеют один, два или три электрона в своей валентной оболочке. Неметаллы — это элементы, содержащие 4, 5, 6 или 7 электронов на внешней оболочке.
Металлы — это элементы, которые обычно являются твердыми из-за наличия прочной металлической связи между атомами. С другой стороны, неметаллы часто являются мягкими компонентами. Металлы определяются как элементы, которые имеют один, два или три электрона в своей валентной оболочке. Неметаллы — это элементы, содержащие 4, 5, 6 или 7 электронов на внешней оболочке.Что такое металлы?
Металлы — это вещества, которые естественным образом образуются под поверхностью Земли. Большинство металлов lustrous, то есть они блестят. Металлы состоят из веществ, которые никогда не были живыми.
Это означает, что они неорганические. Это природные соединения земной коры, обычно встречающиеся в виде металлических руд. Они связаны друг с другом, а также с другими элементами. Металлы присутствуют в горных породах, вымываемых поверхностными и подземными водами. Они также появляются в атмосферной пыли. Они прочны, пластичны, пластичны и хорошо проводят тепло и электричество.
Физические свойства металлов Металлы используются, среди прочего, в производстве автомобилей, спутников и кухонной утвари. Большинство металлов обычно твердые. Заметными исключениями являются натрий и калий. Для их разрезания можно использовать ножи. Большинство металлов твердые, за исключением ртути, которая при комнатной температуре представляет собой жидкий металл.
Металлы используются, среди прочего, в производстве автомобилей, спутников и кухонной утвари. Большинство металлов обычно твердые. Заметными исключениями являются натрий и калий. Для их разрезания можно использовать ножи. Большинство металлов твердые, за исключением ртути, которая при комнатной температуре представляет собой жидкий металл.- Они являются хорошими проводниками тепла и электричества и поэтому находят применение в повседневной жизни, например, кухонная утварь, сделанная из железа или алюминия, поскольку они являются хорошими проводниками тепла.
- Способность вещества втягиваться в проволоку известна как пластичность, и именно это свойство позволяет использовать металлы в качестве проводов кабелей и для пайки.
- Ковкость – это свойство металлов, позволяющее выковывать их в плоские листы. Из-за легкости и прочности алюминиевые листы используются в производстве самолетов. Таким образом, металлы податливы.

- Металлы издают глубокий или звенящий звук при ударе другим твердым предметом. Таким образом, они звонкие.
- Большинство металлов блестящие, т. е. блестящие, но их также можно отполировать, чтобы они приобрели блестящий вид.
Использование и применение металлов
Металлы, как правило, очень прочные, долговечные и обладают высокой устойчивостью к повседневному износу. Таким образом, они должны были использоваться в прошлом для множества вещей. Даже сейчас, с развитием технологий и множеством других факторов, применение металлов значительно расширилось. Металлы важны даже в экономике.
- Строительная промышленность: Металлы являются основным компонентом жилищного строительства. Железо и сталь являются одними из наиболее используемых металлов в строительстве зданий и даже домов.
- Электроника: Металлы используются для изготовления кабелей и деталей для электрических устройств и гаджетов, поскольку они являются хорошими проводниками электричества.
 Телевизоры, сотовые телефоны, холодильники, утюги и компьютеры — вот лишь несколько примеров.
Телевизоры, сотовые телефоны, холодильники, утюги и компьютеры — вот лишь несколько примеров. - Медицина: Металлические элементы необходимы для различных функций, включая передачу нервных импульсов, приток кислорода, ферментативную реакцию и т. д. Для лечения определенных недостатков или болезней некоторые лекарства сочетаются с соединениями металлов. Антациды содержат такие металлы, как железо, кальций, магний, калий, титан и алюминий, которые обычно используются в медицине.
- Автомобили и оборудование: Они широко используются в производстве машин для промышленности, сельского хозяйства и сельского хозяйства, а также автомобилей, таких как дорожные транспортные средства, железные дороги, самолеты и ракеты. Железо, алюминий и сталь являются наиболее часто используемыми металлами в этой области. Большинство кухонных принадлежностей изготовлены из металлов, таких как сталь, алюминий и медь. Металлы предпочтительны из-за их отличной термостойкости.

- Другое применение: В наши дни большая часть мебели изготавливается из металла. Металлы также используются в вооруженных силах, где они используются в производстве оружия и боеприпасов. Гальванизация защищает металлы от ржавчины, используя определенные металлы.
Что такое неметаллы?
Элементы, не обладающие свойствами металлов, называются неметаллами.
Неметаллы являются хорошими изоляторами тепла и электричества. В основном это газы и жидкости. Некоторые неметаллы находятся в твердом состоянии при комнатной температуре. Например. Углерод, сера и фосфор.
Некоторые важные общие свойства неметаллов:
- Неметаллы обладают очень низкой электропроводностью и являются наиболее важным свойством, отличающим неметаллы от металлов.
- Обладают высокой электроотрицательностью. Электроотрицательность — это концепция, при которой атомы имеют сильную тенденцию притягивать больше электронов, чем обычно.

- При нормальных условиях некоторые неметаллы находятся в виде газов, некоторые — в твердом состоянии, а один — в жидком, т.е. бром.
- Многие неметаллы существуют в виде жидкостей или газов, что означает, что неметаллы имеют более низкие температуры плавления и кипения по сравнению с металлами.
- В твердом состоянии неметаллы склонны к хрупкости. В результате им не хватает пластичности и пластичности, которыми обладают металлы.
Физические свойства неметаллов
- Углеродные волокна используются в различных отраслях промышленности, включая спортивное и музыкальное оборудование, и являются единственными неметаллами, обладающими пластичностью.
- Они не податливы, так как хрупки и ломаются при приложении давления.
- Они не блестят, так как не имеют блестящего вида.
- Неметаллы не издают глубокого звенящего звука при ударе о другой материал. Таким образом, они не звонкие.
- Они также являются плохими проводниками тепла и электричества.
 Заметным исключением является графит.
Заметным исключением является графит.
Использование и применение неметаллов
- Повседневная жизнь: Процессу дыхания способствует кислород, который составляет 21 % по объему. Он также используется для изготовления стали и поддержания высокой температуры в процессе изготовления металла. В больнице используются кислородные баллоны. Как отбеливающий химикат, хлор эффективен для удаления пятен и цветовых пятен. Хлор используется для производства различных полимеров и пестицидов. Помогает с фильтрацией воды. Как? Бактерии погибают при добавлении хлора в питьевую воду. Для научных экспериментов в качестве инертного газа используется гелий. Метеозонды также используют его. Йод применяют как антисептик при лечении ран и порезов, а также при лечении инфекций горла.
- Удобрения: Азот содержится в удобрениях. Это помогает в росте растений. Это увеличивает скорость роста растения. Растениям также может быть полезен неметаллический фосфор.
 Эти два неметалла необходимы для роста растений.
Эти два неметалла необходимы для роста растений. - Крекеры: Сера и фосфор используются в фейерверках.
Примеры вопросов
Вопрос 1: Дайте определение металлам и неметаллам.
Ответ:
Металлы – это вещества, которые естественным образом образуются под поверхностью Земли. Элементы, не обладающие свойствами металлов, называются неметаллами.
Вопрос 2: Напишите короткую заметку о металлах.
Ответ:
Большинство металлов блестящие, т.е. блестящие. Металлы состоят из веществ, которые никогда не были живыми. Это означает, что они неорганические. Это природные соединения земной коры, в которой они обычно находятся в виде металлических руд. Они связаны друг с другом, а также с другими элементами. Металлы присутствуют в горных породах, вымываемых поверхностными и подземными водами. Они также появляются в атмосферной пыли.
 Они прочны, пластичны, пластичны и хорошо проводят тепло и электричество. Металлы используются, среди прочего, в производстве автомобилей, спутников и кухонной утвари. Большинство металлов обычно твердые. Заметными исключениями являются натрий и калий. Для их разрезания можно использовать ножи. Большинство металлов твердые, за исключением ртути, которая при комнатной температуре представляет собой жидкий металл.
Они прочны, пластичны, пластичны и хорошо проводят тепло и электричество. Металлы используются, среди прочего, в производстве автомобилей, спутников и кухонной утвари. Большинство металлов обычно твердые. Заметными исключениями являются натрий и калий. Для их разрезания можно использовать ножи. Большинство металлов твердые, за исключением ртути, которая при комнатной температуре представляет собой жидкий металл.Вопрос 3: Дайте определение электроотрицательности.
Ответ:
Электроотрицательность — это концепция, согласно которой атомы имеют сильную тенденцию притягивать больше электронов, чем обычно. Например, хлор имеет тенденцию притягивать один электрон для достижения стабильности.
Вопрос 4: Каковы физические свойства металлов?
Ответ:
Физические свойства металлов:
- Они являются хорошими проводниками тепла и электричества и поэтому находят применение в повседневной жизни, например, кухонная утварь, сделанная из железа или алюминия, поскольку они являются хорошими проводниками тепла.
- Способность вещества втягиваться в проволоку известна как пластичность, и именно это свойство позволяет использовать металлы в качестве проводов кабелей и для пайки.
- Ковкость – это свойство металлов, позволяющее выковывать их в плоские листы. Из-за легкости и прочности алюминиевые листы используются в производстве самолетов. Таким образом, металлы податливы.
- Металл издает глубокий или звенящий звук при ударе другим твердым предметом. Таким образом, они звонкие.
- Большинство металлов блестящие, т. е. блестящие, но их также можно отполировать, чтобы они приобрели блестящий вид.
Вопрос 5: Каковы физические свойства неметаллов?
Ответ:
Физические свойства неметаллов:
- Углеродные волокна используются в различных отраслях промышленности, включая спортивное и музыкальное оборудование, и являются единственными неметаллами, обладающими пластичностью.

- Они не податливы, так как хрупки и ломаются при приложении давления.
- Они не блестящие, так как не имеют блестящего вида.
- Неметаллы не издают глубокого звенящего звука при ударе о другой материал. Таким образом, они не звонкие.
- Они также являются плохими проводниками тепла и электричества. Заметным исключением является графит.
Список металлов
Запись опубликована от Todd Helmenstine (обновлено )
Выделенные элементы считаются металлическими элементами.Большинство элементов периодической таблицы — металлы. Они сгруппированы посередине в левой части периодической таблицы. Металлы состоят из щелочных металлов, щелочноземельных металлов, переходных металлов, лантаноидов и актиноидов.
Вот список металлов, их положение в периодической таблице, их свойства и применение.

Свойства металлов
Металлы имеют несколько общих свойств, в том числе:
- Металлы твердые при комнатной температуре (за исключением ртути).
- Металлы блестящие, с металлическим блеском.
- За некоторыми исключениями большинство металлов имеют высокую температуру плавления.
- Большинство из них являются хорошими проводниками тепла.
- Большинство из них являются хорошими проводниками электричества.
- Имеют низкую энергию ионизации.
- Металлы имеют низкую электроотрицательность.
- Они податливы – их можно растолочь в листы.
- Они пластичны – их можно втягивать в провода.
- Металлы имеют высокие значения плотности (исключения: литий, калий и натрий).
- Большинство металлов подвержены коррозии на воздухе или в морской воде.
- Атомы металлов теряют электроны в реакциях. Другими словами, они образуют катионы.
*Дополнительный факт* При определенных условиях водород может действовать как металлический элемент.
 Эти условия обычно возникают в экстремальных условиях, таких как высокое давление или замерзание.
Эти условия обычно возникают в экстремальных условиях, таких как высокое давление или замерзание.Список металлов
Это список металлов в порядке возрастания атомного номера.
NUMBER SYMBOL ELEMENT 3 Li Lithium 4 Be Beryllium 11 Na Sodium 12 Mg Магний 13 Al Aluminum 19 K Potassium 20 Ca Calcium 21 Sc Scandium 22 Ti Titanium 23 V Vanadium 24 CR Хром 25 MN 25 MN 25 MN 31MN 9040.
 0224
022426 Fe Iron 27 Co Cobalt 28 Ni Nickel 29 Cu Copper 30 Zn Zinc 31 Ga Gallium 37 Rb Rubidium 38 Sr Strontium 39 Y Yttrium 40 Zr Zirconium 41 Nb Niobium 42 Mo Molybdenum 43 TC Technetium 44 RU Ruthenium 45 RHA 45 RH 45 .022446 Pd Palladium 47 Ag Silver 48 Cd Cadmium 49 In Indium 50 SN TIN 55 CS Цезия 56 BA 11111111111111111111111111111111111111111111111111111111111111111111111111111511159НД11111111111111111111115115115115115115115115115115111111111111111111111111111111511159нте.  0231
0231Lanthanum 58 Ce Cerium 59 Pr Praseodymium 60 Nd Neodymium 61 Pm Promethium 62 Sm Samarium 63 Eu Europium 64 Gd Gadolinium 65 Tb Terbium 66 Dy Dysprosium 67 Ho Holmium 68 Er Erbium 69 TM Thulium 70 YB Ytterbium LU LU 9040 0231 Hf Hafnium 73 Ta Tantalum 74 W Tungsten 75 Re Rhenium 76 Os Osmium 77 IR IRIDIUM 78 PT 4040404040404090 9
131 9- 1
0404040404040404079 99131 9 131
0404040404040404040404040404040404040404040404040404023 чем0231 80 Hg Mercury 81 Tl Thallium 82 Pb Lead 83 Bi Bismuth 84 Po Polonium 87 Fr Francium 88 Ra Radium 89 Ac Actinium 90 Th Thorium 91 Pa Protactinium 92 U Uranium 93 Np Neptunium 94 Pu Plutonium 95 Am Americium 96 Cm Curium 97 Bk Berkelium 98 Cf Californium 99 Es Einsteinium 100 Fm Fermium 101 MD Mendelevium 102 NO НОБЕЛИЯ 103 LR 40 LR 40 LR 40 40 40 .  0215
0215104 Rf Rutherfordium 105 Db Dubnium 106 Sg Seaborgium 107 Bh Bohrium 108 Hs Hassium 109 MT MEITNERIUM 110 DS DARMSTTALTIME 9040 DSDARMSTATTAM 41244124 12491243333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333н.0231Rg Roentgenium 112 Cn Copernicium 113 Nh Nihonium 114 Fl Flerovium 115 Mc Moscovium 116 Lv Ливерморий Знакомство с неметаллами
Неметаллы являются еще одной ключевой группой элементов.
 Вот их список и их свойства.
Вот их список и их свойства.Расположение металлов в периодической таблице
Более 75% элементов составляют металлы, поэтому они заполняют большую часть периодической таблицы. Металлы находятся в левой части стола. Два ряда элементов под основной частью таблицы (лантаноиды и актиноиды) — это металлы.
Использование металлов
Металлы находят применение во всех сферах жизни. Вот список некоторых видов их использования:
- Структурные компоненты
- Контейнеры
- Провода и электроприборы
- Газета
- зеркала
- монеты
- Ювелирные изделия
- Оружие
- Питание (железо, медь, кобальт, никель, цинк, молибденам)
СПИСОМЫ
- COX P. A. A. A. A. Элементы: их происхождение, распространенность и распространение . Издательство Оксфордского университета: Оксфорд. ISBN 978-0-19-855298-7.
- Эмсли, Дж. (2003). Строительные блоки природы: Путеводитель по элементам от А до Я .
 Издательство Оксфордского университета. ISBN 978-0-19-850340-8.
Издательство Оксфордского университета. ISBN 978-0-19-850340-8. - Соса Торрес, Марта; Кронек, Питер М.Х. (2021). Металлы, микробы и минералы: биогеохимическая сторона жизни . Берлин: Вальтер де Грюйтер. doi: 10.1515/9783110589771-001
- Стратерн, П. (2000). Сон Менделеева: В поисках элементов . Хэмиш Гамильтон ООО ISBN 978-0-241-14065-9 .
- Улица А.; Александр, В. (1998). Металлы на службе человека (11-е изд.). Книги пингвинов: Лондон. ISBN 978-0-14-025776-2.
Химия неметаллов
Химия Неметаллы
Какие Неметаллы? Неметаллы Какие Неметаллы?
Более 75% известных элементов имеют характеристику свойства металлов (см. рисунок ниже). У них есть металлический блеск; они податливы и пластичны; и они проводят тепло и электричество.
 Восемь других элементов (B, Si, Ge, As, Sb,
Te, Po и At) лучше всего описать как полуметаллы или металлоиды .
Они часто выглядят как металлы, но имеют тенденцию быть хрупкими и
они скорее полупроводники, чем проводники
электричество.
Восемь других элементов (B, Si, Ge, As, Sb,
Te, Po и At) лучше всего описать как полуметаллы или металлоиды .
Они часто выглядят как металлы, но имеют тенденцию быть хрупкими и
они скорее полупроводники, чем проводники
электричество.После исключения металлов и полуметаллов из списка известных элементов, осталось только 17, которые можно классифицировать как неметаллы . Шесть из этих элементов принадлежат к семейству инертных газов в группе VIIIA, большинство из которых практически инертны к химическим реакциям. Таким образом, обсуждение химии неметаллов имеет тенденцию сосредоточиться на следующих элементах: H, C, N, O, F, P, S, Cl, Se, Br, Я и Зе.
Неметаллы
В химическом составе основной группы имеется четкая закономерность металлы: Металлы основной группы окисляются во всех их химические реакции.
 Эти металлы окисляются при
они реагируют с неметаллическими элементами. Алюминий, например,
окисляется бромом.
Эти металлы окисляются при
они реагируют с неметаллическими элементами. Алюминий, например,
окисляется бромом.Химия неметаллов более интересна, потому что эти элементы могут подвергаться как окислению, так и восстановлению. Фосфор, например, окисляется при взаимодействии с кислородом. сформировать П 4 О 10 .
Но он восстанавливается, когда реагирует с кальцием с образованием кальция фосфид.
Эти реакции можно понять, взглянув на относительную электроотрицательности этих элементов. Фосфор ( EN = 2.19) менее электроотрицателен, чем кислород ( EN = 3.44). Когда эти элементы реагируют, электроны притягиваются к более электроотрицательных атомов кислорода. Следовательно, фосфор окисляется в этой реакции, а кислород восстанавливается. Кальций ( ЕН = 1,00), с другой стороны, значительно менее электроотрицательна. чем фосфор ( EN = 2,19).
 Когда эти элементы реагируют,
электроны притягиваются к более электроотрицательным
атомы фосфора. В результате кальций окисляется, а фосфор
уменьшен.
Когда эти элементы реагируют,
электроны притягиваются к более электроотрицательным
атомы фосфора. В результате кальций окисляется, а фосфор
уменьшен.Поведение неметаллов можно резюмировать следующим образом.
1. Неметаллы склонны к окислению металлов.
2 мг( с ) + О 2 ( г ) 2 MgO( с ) 2. Неметаллы с относительно большой электроотрицательностью (такие как кислород и хлор) окисляют вещества, с которыми реагируют.
2 H 2 S( г ) + 3 О 2 ( г ) 2 SO 2 ( г ) + 2 H 2 O( г ) РН 3 ( г ) + 3 Кл 2 ( г ) ПКл 3 ( л ) + 3 HCl( г ) 3.
 Неметаллы с относительно небольшим
электроотрицательности (такие как углерод и водород) могут уменьшить
другие вещества.
Неметаллы с относительно небольшим
электроотрицательности (такие как углерод и водород) могут уменьшить
другие вещества.Fe 2 O 3 ( с ) + 3 С( с ) 2 Fe( с ) + 3 СО( г ) CuO( с ) + Н 2 ( г ) Cu( с ) + H 2 O( г ) Практическая задача 1: Определить какой элемент окисляется, а какой восстанавливается при пары серы реагируют с раскаленным углем с образованием углерода дисульфид.


 Часть вторая
Часть вторая Частное решение.
Частное решение.
 Большинство металлов поступает в продажу в виде порошка, небольших слитков или кусков. Для облегчения работы с ними некоторые металлы переплавляют и выпускают в виде палочек (висмут, кадмий, олово, свинец), гранул (кадмий,, свинец, цинк), губки (олово), пыли (цинк, алюминий), листа или ленты (золото, медь), проволоки (алюминий, железо), стружки (железо) и т. п.
Большинство металлов поступает в продажу в виде порошка, небольших слитков или кусков. Для облегчения работы с ними некоторые металлы переплавляют и выпускают в виде палочек (висмут, кадмий, олово, свинец), гранул (кадмий,, свинец, цинк), губки (олово), пыли (цинк, алюминий), листа или ленты (золото, медь), проволоки (алюминий, железо), стружки (железо) и т. п. ), при получении металлоорганических соединений и т. д.
), при получении металлоорганических соединений и т. д.
 Настройка.
Настройка. Подробно
Подробно