Электрокорунд Нескольких Видов. (ООО ЛИВ Уникон)
Исходя из показателей равновесия в системе Al2O3 ‒ H2O, в условиях температурных показателей от 400 до 500 градусов, устойчивой фазой принято считать именно корунд. Однако промежуточные фазы Al2O3 также могут образовываться и при этом сохраняться при условии повышенных температур. Появление таких фаз объясняется увеличенной энергией активации при превращении гидроксид алюминия (за исключением диаспора) в корунд. Это зависит от различных структур представленных элементов. Но при этом скорость реакции остается минимальной. Для сравнения: энергия активации в результате превращения гидроксид алюминия в структурно связанные с ними промежуточные формы оксида алюминия небольшая, а вот скорость реакции, наоборот, достаточно высокая.
До
1946 года включительно большинство ученых придерживались мнения, что процесс
термического разложения байерита, гидраргиллита и бёмита, а также их
последующий переход в корунд осуществляется за счет стадии γ-Al Но со временем исследования других ученых (Фрэри, Штумпф) доказали, что такие
продукты разложения гидроксидов алюминия принято считать смесью всевозможных
фаз.
Но со временем исследования других ученых (Фрэри, Штумпф) доказали, что такие
продукты разложения гидроксидов алюминия принято считать смесью всевозможных
фаз.
Таким образом, было определено, что модификация оксид алюминия, которая создается посредством термического разложения гидроксид алюминия ‒ это не что иное, как дискретная полиморфная фаза. Однако другие ученые при проведении собственных исследований указали, что оксид алюминия ‒ это нестабильное переходное состояние между беспорядочно распавшимся гидроксидом алюминия и упорядоченной решеткой γ-Al2O3.
На организованном симпозиуме в Мюнстере в 1957 году была представлена первая классификация оксидов алюминия, которая в дальнейшем немного усовершенствовалась Липпенсом. Согласно такой классификации одними из главных признаков являются именно температурные показатели, в результате которых оксид алюминия образовываются из гидроксидов.
Исходя из указанной классификации:
- К
первой группе оксидов алюминия принято относить низкотемпературные формы,
которые были образованы при температуре не больше 600 градусов.
 В качестве
основного стабилизирующего компонента они содержат определенное количество воды
или других веществ.
В качестве
основного стабилизирующего компонента они содержат определенное количество воды
или других веществ. - Ко второй группе принадлежат высокотемпературные формы, которые образовываются в условиях температуры от 600 до 1500 градусов.
Несмотря на то, что по химическому составу все переходные формы Al2O3 практически идентичны, по кристаллической структуре, оптическим и физико-химическим свойствам это совершенно разные элементы.
Для сравнения:
- Показатели преломления промежуточной формы, что осуществляется в условиях кальцинации гидроксидов алюминия, могут увеличиваться от 1,58 (актуально для гидраргиллита) до 1,75 (актуально для корунда).
- Степень ионности связи кислорода с алюминием приводит к изменению координационного числа алюминия по кислороду. Поэтому показатели могут увеличиваться от 0,50 до 0,63.
- Изменение
энтальпии в условиях перехода промежуточных форм оксида алюминия в корунд
варьируется от 2,7 до 5,3.

Несмотря на все вышеуказанные изменения кристаллической структуры, формы агрегатов остаются прежними. От степени упорядоченности кристаллической структуры, а также характера связи между набором атомов в гидроксиде алюминия напрямую зависит температурный интервал и кинетика процесса рекристаллизации.
Влияние температурных показателей осаждения гидроксид алюминия на чистоту активного оксида алюминия, который был получен в результате процесса кальцинации при температуре 500 градусов:
| Температура осаждения гидроксида алюминия в 0С | 20 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Содержание примеси Na3O в оксиде алюминия в % | 2,00 | 1,20 | 1,00 | 0,40 | 0,10 | 0,08 | 0,07 | 0,05 |
Корунд является единственной модификацией оксид алюминия, которую можно встретить в природе. В категорию простых непрозрачных видов природного корунда принято относить следующие элементы:
В категорию простых непрозрачных видов природного корунда принято относить следующие элементы:
- обыкновенный корунд;
- алмазный шпат или, как его еще называют, армянский точильный камень;
- наждак ‒ это смесь (60-70%) корунда с гематитом, магнетитом и шпинелью.
В категорию прозрачных видов природного корунда входят:
- все минералы корунда, наделенные высокими показателями преломления света;
- бесцветные или слегка окрашенные небольшим количеством железа, кобальта, титана, хрома, никеля, ванадия и прочих возможных элементов.
В
природе корунд представлен в виде россыпей или небольших месторождений, которые
достаточно часто образуются в результате метаморфизма бокситовых залежей.
Иногда он образовывается за счет магматических и метаморфических пород. Это
происходит в процессе распада их полевошпатовой составляющей с применением
десилицификации кислых магматических пород, что были внедрены в ультрабазиты
или известняки. Иногда этот процесс осуществляется в результате неустойчивости
полевошпатовой решетки под влиянием высоких показателей давления.
Корунд часто находят в базальтах: это объясняется распадом анортита под высоким давлением. В бокситах содержание корунда варьируется от 15 до 20%.
Месторождение корунда ‒ это Индия, США, Канада, Мадагаскар, ЮАР, Австралия, Афганистан, Колумбия и другие страны.
Корунд также добывают и искусственным путем за счет прокаливания низкотемпературных форм оксид и гидроксид алюминия, гелей, осуществляется плавление бокситов и глинозема. Для этого используются различные методы создания корунда, но чаще всего применяют метод Вернейля и Чохральского.
При этом стоит помнить, что корунд относится к элементам, которые практически не поддаются физико-химическим и химическим изменениям формы. Находясь в обычных условиях (на воздухе), корунд считается химически инертным и вовсе не гигроскопичным. Таким образом, он практически не растворяется во всевозможных кислотах или в щелочах.
Если
температурные показатели будут выше 1000-1100 градусов, тогда корунд может
вступать в активную реакцию с едкими и углекислыми щелочами.
Показатели термической стабильности корунда во время атмосферного давления находятся ниже, чем 2300 градусов. При этом температура плавления варьируется от 2040 до 2050 градусов. Температура, при которой корунд закипает ‒ 2980 градусов.
Кристаллическая форма корунда совершенно бесцветна. Наличие окраски на корунде объясняется небольшим содержанием следующих элементов:
- хром дает желтоватый или красный оттенки;
- титан и железо дают фиолетово-синий оттенок;
- никель и железо ‒ оранжевый оттенок;
- ванадий и хром ‒ фиолетово-розовый оттенок.
Также,
в природе можно встретить корунд серого, черного или коричневого цвета.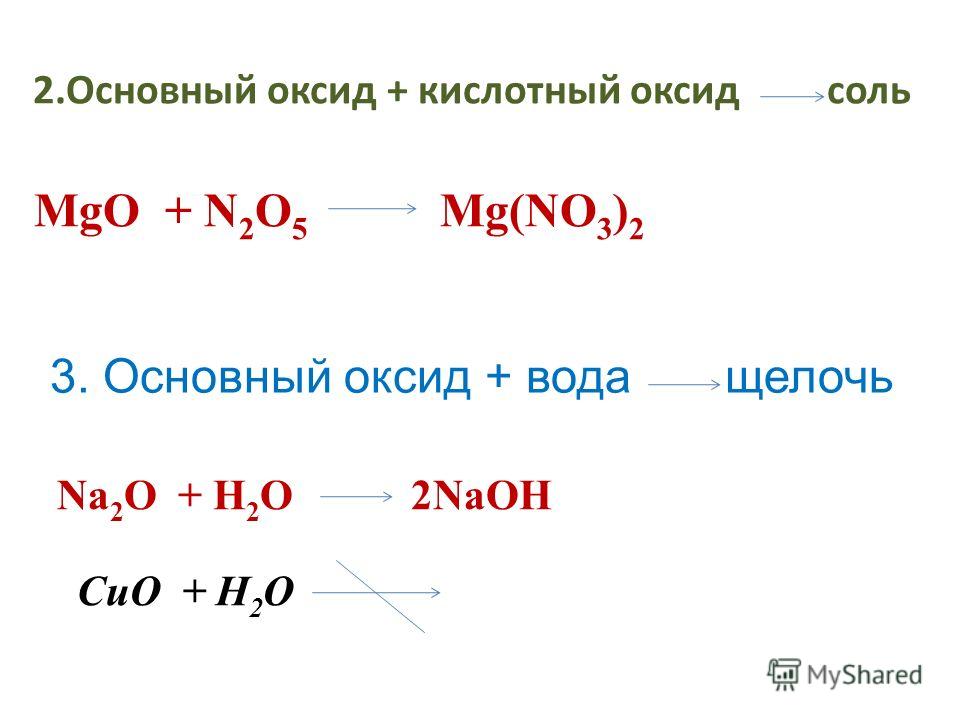
Достаточно часто встречаются такие популярные формы корунда:
- призматические;
- таблитчатые;
- дипирамидальные;
- пластинчатые;
- реже встречаются ромбоэдрические с характерными гранями гексагональной призмы;
- гексагональные дипирамиды;
- ромбоэдры;
- пинакоиды.
Удельный вес представленных минералов варьируется от 3,95-4,10 г/см3, а показатели твердости равняются 9. Если сравнивать все остальные модификации глинозема, можно отметить, что корунд является наиболее твердым. По шкале Мооса он находится на втором месте, сразу после алмаза.
Самая простая элементарная ячейка данного минерала ‒ это острый ромбоэдр, состоящий из четырех ионов алюминия и шести ионов кислорода. Такие показатели соответствуют двум молекулам Al
Впервые структуру корунда исследовал Брэгг, а затем его дело продолжили Паулинг и Хендрикс. Она состоит из слоев кислородных ионов, которые наложены друг на друга. Таким образом, образовывается достаточно плотная гексагональная упаковка, где между слоями находится Al3+.
Она состоит из слоев кислородных ионов, которые наложены друг на друга. Таким образом, образовывается достаточно плотная гексагональная упаковка, где между слоями находится Al3+.
Корунд отличается наличием двух видов поляризации: электронная и ионная. В сравнении с другими разновидностями оксида алюминия корунд характеризуется достаточно высокими показателями плотности упаковки кристаллической решетки (76%). Как результат: он имеет высокие показатели твердости, превосходные диэлектрические и механические свойства.
Электрокорунд
Образование искусственного плавленого корунда происходит в результате плавления глинозема или же боксита в условиях температуры от 2000 до 2400 градусов. Это и есть электрокорунд. После приготовления в электропечах расплав достают и подвергают процессу дробления (по завершению его остывания). Затем, происходит процедура сортировки и дальнейшее измельчение продукта в порошкообразную смесь.
В результате плавки боксита в электропечах можно получить электрокорунд нескольких видов:
- стандартный ‒ от 91 до 95% Al2O3;
- розовый ‒ от 96 до 97% Al2O3;
- черный ‒ от 75 до 85% Al2O3;
- корунды
и монокорунды, представленные в виде монокристаллов гексагональной системы.

Белый электрокорунд ‒ это поликристаллический оксид алюминия, в составе которого содержится:
- около 98,0-99,5% Al2O3%;
- 0,10-0,30% SiO2;
- 0,02-0,12%
Fe
- 0,20-0,60% Na2O.
Показатели удельного веса варьируются от 3,93 до 4,01 г/см3. Белый электрокорунд широко известен за счет своих высоких показателей твердости, прочности, высокого модуля эластичности и великолепной проводимости тепла.
Всевозможные абразивные инструменты из белого электрокорунда активно используют для эффективной обработки мягких и вязких видов материалов: пластмасса, кожа, резина, разные виды цветных металлов.
Монокристаллический корунд
В процессе получения монокристаллов корунда принято использовать уже два проверенных метода ‒ Чохральского и Вернейля.
Согласно
методу Вернейля чистый тонкодисперсный оксид алюминия, частицы которого
размером 0,1-0,2 мкм, представлен в порошковой форме и подается в струю пламени
горючего газа. Таким образом, материал расплавляется, а его частицы попадают на
верхний оплавленный торец ориентированной монокристаллической затравки ‒
корундовый стержень. Он постепенно опускается и выполняет вращение вокруг
вертикальной оси. В результате удается обеспечить рост монокристаллов корунда в
виде стержней, длина которых варьируется от 500 до 800 мм, а в диаметре ‒ 12-15
мм.
Таким образом, материал расплавляется, а его частицы попадают на
верхний оплавленный торец ориентированной монокристаллической затравки ‒
корундовый стержень. Он постепенно опускается и выполняет вращение вокруг
вертикальной оси. В результате удается обеспечить рост монокристаллов корунда в
виде стержней, длина которых варьируется от 500 до 800 мм, а в диаметре ‒ 12-15
мм.
Согласно методу Чохральского монокристаллы выращивают с помощью принципа затравки. Их погружают сверху в иридиевый, вольфрамовый или же молибденовый тигель с расплавом. В результате удается получить кристаллы длиной до 250 мм и в диаметре от 30 до 50 мм.
Искусственные монокристаллы получают также с применением других не менее актуальных методов:
- Получение кристаллов за счет расплава в специальных контейнерах при использовании направленной кристаллизации путем охлаждения расплава во время заданного температурного градиента.
- При использовании принципа кристаллизации из газовой фазы.
- В
гидротермальных условиях из щелочных растворов, когда температурные показатели
превышают температуру перехода диаспор.

При этом монокристаллы отличаются всевозможными формами. К примеру, нитевидные кристаллы удается получить за счет применения трех возможных методов: гидролиз хлорида алюминия в условиях высоких температур; восстановление оксида алюминия посредством углерода, водорода; при окислении расплавленного металлического алюминия при 1400 градусах в среде влажного водорода.
Кристалл корунда в форме «меча»Такие монокристаллы корунда, как сапфир и рубин, используются в ювелирной сфере и приборостроении. Они применяются в виде опорных деталей, которые подвергаются процессу стирания.
Синтетический рубин нашел свое применение для устройств, эксплуатирующихся в квантовой электронике. В последнее время активно развивается производство обтекателей оптических приборов в виде плоских сапфировых дисков.
Нитевидные
монокристаллы корунда применяют в процессе создания жаропрочных композиций, в
виде армирующего материала, который имеет высокие показатели механической
прочности, а также характеризуется высоким модулем упругости. Они используются
для дисперсно-упрочненных композиций ‒ это псевдосплавы гетерогенной структуры.
Они используются
для дисперсно-упрочненных композиций ‒ это псевдосплавы гетерогенной структуры.
Исследования доказали возможное применение нитевидных кристаллов корунда в виде наполнителей в пластиковых матрицах, чтобы улучшить механические свойства пластмасс, для дальнейшего изучения механических характеристик пластмасс, пластического деформирования, процессов окисления, испарения и растворения.
По материалам книги «Глинозем и пути содержания в нем примесей», А. А. Ханамирова, издательство АН Армянской ССР, Ереван, 1983 г.
Получение оксида алюминия с низким содержанием примесей на основе переработки алюмоаммониевых квасцов, выделенных из нефелина
Journals → Цветные металлы → 2018 → #11 → Back
| Легкие металлы, углеродные материалы | |
| ArticleName | Получение оксида алюминия с низким содержанием примесей на основе переработки алюмоаммониевых квасцов, выделенных из нефелина |
| DOI | 10. 17580/tsm.2018.11.06 17580/tsm.2018.11.06 |
| ArticleAuthor | Матвеев В. А., Майоров Д. В. |
| ArticleAuthorData | Федеральное государственное бюджетное учреждение науки Институт химии и технологии редких элементов и минерального сырья им. И. В. Тананаева Кольского научного центра РАН, Апатиты, Мурманская обл., Россия: В. А. Матвеев, зав. лабораторией, эл. почта: [email protected] |
| Abstract | Приведены результаты исследований переработки алюмоаммониевых квасцов (ААК), выделенных из нефелина, с получением оксида алюминия с низким содержанием примесей. Показано, что примеси щелочей, содержащиеся в межкристалльном пространстве и входящие в структуру гидроксида алюминия, образующегося в процессе аммонизации ААК, могут быть эффективно удалены при трансформации структуры гидроксида в структуру соединения другого класса, например гидрокарбоната алюминия и аммония NH4AlCO3(OH)2. |
| keywords | Алюмокалиевые квасцы, алюмоаммониевые квасцы, гидратированный оксид алюминия, щелочные примеси, карбонат аммония, гидрокарбонат алюминия, гидрокарбонат аммония, аммиак, оксид алюминия |
| References | 1. |
| Language of full-text | russian |
| Full content | Buy |
Back
Способ получения оксида алюминия
Изобретение относится к химико-технологическим процессам, в частности к химическим способам получения оксида алюминия из нитрата алюминия с высоко упорядоченной структурой. Способ получения оксида алюминия, включает предварительное смешивание водного раствора нитрата алюминия с компонентом, повышающим однородность структуры раствора, и последующую термообработку. В качестве компонента, повышающего однородность структуры раствора, используют полиэтиленгликолевый эфир изооктилфенола (ОП-10), при этом 37,5 масс. % водный раствор нитрата алюминия смешивают с 39-49 масс. % ОП-10. Полученный раствор подвергают гидролизу парами аммиака в реакторе с сосудом с 10 масс. % раствором аммиака. Полученный продукт промывают в 96 масс. % этаноле, затем высушивают при 80-90°С и подвергают прокаливанию при 440-460°С. Обеспечивается повышение химической активности оксида алюминия путем увеличения однородности размера мезопор. 1 табл.
Обеспечивается повышение химической активности оксида алюминия путем увеличения однородности размера мезопор. 1 табл.
Изобретение относится к химико-технологическим процессам, в частности к химическим способам получения оксида алюминия из нитрата алюминия с высоко упорядоченной структурой.
Известен способ получения оксида алюминия из бокситовых руд. Чаще всего применяется метод спекания боксито-известковой шихты (алюминиевой руды, соды и известняка), с последующим выщелачиванием полученного спека водой. (Металлургия цветных металлов. Уткин Н.И. Учебник для техникумов. М.: Металлургия, 1985. 440 с.).
Недостатком данного способа являются низкая чистота, а также низкая химическая активность получаемого оксида алюминия.
Наиболее близким по технической сущности и достигаемому предлагаемому эффекту является способ получения однородной фазы нанокристаллического порошка оксида алюминия с размером частиц менее 100 нм (Патент РФ №2424186, Способ получения нанокристаллов оксида алюминия МПК C01F 7/02, В82В 3/00 от 20. 07.2011 г.). В данном способе соединения алюминия (из ряда: хлорид, нитрат, сульфат, гидроксид) смешивают с целлюлозой в воде до образования однородной дисперсной фазы. Состав исходной смеси соединений алюминия с целлюлозой готовят при массовом соотношении 1:1,3÷2,0. Полученную дисперсную фазу отфильтровывают, нагревают до 500-850°С, затем помещают в автоклав, где осуществляется гидротермальная обработка в кислой среде.
07.2011 г.). В данном способе соединения алюминия (из ряда: хлорид, нитрат, сульфат, гидроксид) смешивают с целлюлозой в воде до образования однородной дисперсной фазы. Состав исходной смеси соединений алюминия с целлюлозой готовят при массовом соотношении 1:1,3÷2,0. Полученную дисперсную фазу отфильтровывают, нагревают до 500-850°С, затем помещают в автоклав, где осуществляется гидротермальная обработка в кислой среде.
Недостатком указанного метода является низкая степень однородности размера мезопор оксида алюминия, а также техническая сложность осуществления автоклавной обработки.
Технической проблемой является трудность получения оксида алюминия с высокой степенью однородности размера мезопор.
Техническим результатом является повышение химической активности оксида алюминия путем увеличения однородности размера мезопор.
Поставленный технический эффект достигается тем, что в способе получения оксида алюминия, включающем предварительное смешивание водного раствора нитрата алюминия с компонентом, повышающим однородность структуры раствора, с последующей термообработкой, согласно предлагаемому решению, в качестве компонента, повышающего однородность структуры раствора, используют полиэтиленгликолевый эфир изооктилфенола (ОП-10), при этом 37,5 масс. % водный раствор нитрата алюминия смешивают с 39-49 масс. % ОП-10, затем подвергают гидролизу парами аммиака в реакторе с сосудом с 10 масс. % раствором аммиака, после чего полученный продукт промывают в 96 масс. % этаноле, затем высушивают при 80-90°С и подвергают прокаливанию при 440-460°С.
% водный раствор нитрата алюминия смешивают с 39-49 масс. % ОП-10, затем подвергают гидролизу парами аммиака в реакторе с сосудом с 10 масс. % раствором аммиака, после чего полученный продукт промывают в 96 масс. % этаноле, затем высушивают при 80-90°С и подвергают прокаливанию при 440-460°С.
То, что в предлагаемом решении предварительно смешивают водный раствор нитрата алюминия с неиногенным поверхностно-активным веществом ОП-10 позволяет влиять на морфологию и дисперсный состав конечного продукта оксида алюминия, т.е. получить высоко однородный наноразмерный материал за счет образования промежуточного жидкокристаллического раствора с последующим его гидролизом. Известно, что в многокомпонентных системах, содержащих воду и ПАВ, могут возникать термодинамически устойчивые фазы, в т.ч. жидкие кристаллы, обладающие однородной структурой с характерным размером мицелл от 3 до 100 нм. Образование таких жидких кристаллов, содержащих нитрат алюминия, позволяет при последующей обработке парами аммиака получать однородный по дисперсной структуре оксигидроксид алюминия, обладающий высоким объемом мезопор, в результате чего повышается химическая активность конечного продукта. При использовании паров аммиака формирование оксигидроксида алюминия протекает медленно, в условиях, близких к равновесию, так что при гидролизе образуется однородный высоко упорядоченный продукт.
При использовании паров аммиака формирование оксигидроксида алюминия протекает медленно, в условиях, близких к равновесию, так что при гидролизе образуется однородный высоко упорядоченный продукт.
При этом используют постоянные по массе количества нитрата алюминия и воды и переменные концентрации поверхностно-активного вещества (ОП-10).
Введение менее 39 масс. % ОП-10 не позволяет получить жидкокристаллический раствор и приводит к формированию оксида алюминия с неоднородной структурой и низким объемом мезопор. Увеличение количества ОП-10 более 49 масс. % практически полностью исключает образование оксида алюминия ввиду его растворимости в столь концентрированных растворах ОП-10.
Высушивание полученного продукта при температуре менее 80°С увеличивает время выдержки для обеспечения полного испарения спирта, а при температуре более 90°С процесс высушивания происходит очень интенсивно и приводит к перегреву образцов.
Прокаливание продукта при температуре менее 440°С увеличивает время выдержки для обеспечения полного разрушения остатков, а при температуре более 460°С процесс прокаливания происходит очень интенсивно и приводит к изменению морфологии образцов.
Способ осуществляется следующим образом.
Нитрат алюминия помещают в сосуд и добавляют воду. Затем полученную смесь перемешивают 20-30 минут до полного растворения соли. После этого к раствору добавляют ОП-10, нагревают до 80-90°С и перемешивают до однородности в течение 1-1,5 ч, охлаждают и выдерживают 1,5-2 ч при комнатной температуре до формирования жидкокристаллической структуры. Емкость с полученным жидкокристаллическим раствором помещают в реактор совместно с сосудом с 10 масс. % раствором аммиака в воде и оставляют на 15-20 суток до полного протекания гидролиза. Полученный продукт промывают 96 масс. % раствором этанола, объем которого в 5-7 раз больше объема влажного оксигидроксида. После 3-5 суток выдержки влажного оксигидроксида в этаноле, раствор сливают, а промытый оксигидроксид высушивают при 80-90°С в течение 1-1,5 суток и подвергают прокаливанию при 440-460°С в течение 1-1,5 суток с целью окончательного удаления примесей ОП-10 и нитрата аммония, а также формирования оксида алюминия.
Согласно предлагаемому способу был осуществлен синтез оксида алюминия. Нитрат алюминия (Al(NO3)3*9H2O) в количестве 36 г растворяли в 60 г воды для получения 37,5 масс. % водного раствора нитрата алюминия. Затем к полученному раствору добавляли 39 масс. % полиэтиленгликолевого эфира изооктилфенола (ОП-10). После этого выдерживали при 80°С 1,5 ч до полного растворения компонентов и 2 ч при комнатной температуре до формирования жидкокристаллического раствора. Полученный жидкокристаллический раствор помещали в реактор с сосудом, содержащим 10 масс. % раствор аммиака и оставляли до полного формирования осадка оксигидроксида алюминия в течение 20 суток. Полученный продукт промывали в 96 масс. % этаноле в течение 4 суток, затем высушивали при 80°С в течение 1,5 суток и подвергали прокаливанию при 450°С в течение 1,5 суток.
Аналогично был получен оксид алюминия в условиях, отличающихся тем, что использовали 37,5 масс. % водный раствор нитрата алюминия, к которому добавляли 29 или 49 масс. % ОП-10. Каждый опыт проводился дважды для увеличения надежности результатов.
% ОП-10. Каждый опыт проводился дважды для увеличения надежности результатов.
Результаты исследования удельной площади поверхности, объема и среднего диаметра пор оксида алюминия сведены в таблицу. Данные получены по изотермам низкотемпературной адсорбции-десорбции азота. Для расчета применялись методы, реализованные программным обеспечением прибора ASAP Micromeritics.
Как видно из таблицы, все образцы обладают одинаково высокой удельной поверхностью и объемом микропор, но диаметр и объем мезопор монотонно увеличивается с ростом концентрации ОП-10. При этом одновременно повышается однородность по размеру мезопор.
Предлагаемый способ найдет применение в химической промышленности для получения мезопористого оксида алюминия, предназначенного для изготовления специальных видов керамики, производства сорбентов и носителей для катализаторов.
Способ получения оксида алюминия, включающий предварительное смешивание водного раствора нитрата алюминия с компонентом, повышающим однородность структуры раствора, с последующей термообработкой, отличающийся тем, что в качестве компонента, повышающего однородность структуры раствора, используют полиэтиленгликолевый эфир изооктилфенола (ОП-10), при этом 37,5 масс. % водный раствор нитрата алюминия смешивают с 39-49 масс. % ОП-10, затем подвергают гидролизу парами аммиака в реакторе с сосудом с 10 масс. % раствором аммиака, после чего полученный продукт промывают в 96 масс. % этаноле, затем высушивают при 80-90°С и подвергают прокаливанию при 440-460°С.
% водный раствор нитрата алюминия смешивают с 39-49 масс. % ОП-10, затем подвергают гидролизу парами аммиака в реакторе с сосудом с 10 масс. % раствором аммиака, после чего полученный продукт промывают в 96 масс. % этаноле, затем высушивают при 80-90°С и подвергают прокаливанию при 440-460°С.
3.11.2. Пористый оксид алюминия и структуры на его основе
Пористый анодный оксид алюминия обладает уникальной «собственной» структурой, позволяющей изготавливать столбиковые, нитевидные, точечные, конусообразные и другие элементы с нанометровыми размерами, которые невозможно получить и воспроизвести известными методами микрообработки, в частности литографии. Особенностями структуры являются:
· равномерное распределение микроскопических пор с диаметром от субмикронного до нанометрового диапазона;
· расположение вертикально направленных пор с высоким аспектовым отношением (до 1000) на почти одинаковом расстоянии друг от друга;
· высокая воспроизводимость геометрических параметров структуры на образцах большой площади;
· возможность управления геометрическими размерами пор и ячеек пористого оксида путем изменения состава электролита и режимов электрохимической обработки.
Оборудование для получения анодных оксидов алюминия включает двухэлектродную ячейку с термостатированием и мешалкой, а также систему синхронного контроля за электрическими параметрами анодирования. Электрохимическая ячейка аналогична той, которая используется для анодирования кремния. Но так как используются неагрессивные электролиты, ячейка может быть изготовлена из стекла или металла, а катод из графита или любого, не растворяющегося в электролите металла или сплава, например, тантала, титана, алюминия, ниобия, стали.
Образование анодных оксидов из тонких пленок или массивного алюминия в жидких электролитах при электрохимическом анодном окислении (оксидировании) происходит в результате встречной миграции ионов Аl+3 и О–2 в электрическом поле большой напряженности. Сложный процесс пористого анодного окисления алюминия целесообразно разделить на три стадии:
1) протекание реакции передачи кислорода от анионов или молекул раствора на анодируемый металл и возникновение первичного соединения алюминия с кислородом;
2) формирование сплошной тонкой оксидной пленки барьерного типа;
3) рост утолщенной пленки пористого типа.
Донорами кислорода могут быть все кислородсодержащие ионы электролита (SO42–, HSO4–, РО43–, С2O42–, ОН–), а также недиссоциированные молекулы раствора и прежде всего молекулы воды. Так как при анодировании в водных растворах кислот (например, серной) не наблюдается восстановления кислоты (например, H2SO4 до SO2
или элементарной серы), можно заключить, что анионы кислот (SO4) в водных растворах электролитов являются только переносчиками кислорода, а основным донором кислорода являются молекулы воды.
Реакция анодного окисления в общем виде:
2Al + 3H2O → Al2O3 + 6H+ + 6e– | (3.13) |
является суммарной ряда частных реакций, наиболее вероятной из которых является анодная ионизация Аl на границе раздела металл–барьерная окисная пленка:
Al → Al3+ + 3e–. | (3.14) |
Образующиеся по этой реакции электроны уходят во внешнюю цепь, образуя ток анодирования. Ионы Аl3+ мигрируют в электрическом поле оксида (в ионной решетке оксида) к внешней поверхности барьерного слоя.
При анодировании алюминия заметного выделения кислорода не происходит, поэтому процесс передачи кислорода на алюминий, который протекает на границе раздела барьерный слой–электролит, следует представить непосредственно как анодный процесс образования иона кислорода
Н2O →H++O2–, | (3.15) |
а не процесс выделения кислорода на аноде
Н2O→2H++½O + 2e–, | th=215 valign=top style=’width:161.2pt;border:none;padding:0cm 5.4pt 0cm 5. |
Ион кислорода, образующийся на поверхности барьерного слоя по реакции (3.15), может мигрировать в барьерном слое под действием электрического поля по направлению к металлу навстречу иону алюминия.
Толщина беспористого оксидного слоя зависит от напряжения формовки и составляет 1,4 нм/В в электролитах (с pH, равным 5,5), не растворяющих оксид алюминия. Рассчитанный для этой толщины градиент потенциала (Uf/h) соответствует критической напряженности электрического поля:
Екр = (7…8)∙106В/см,
ниже которой движение ионов алюминия и кислорода прекращается, а следовательно, прекращается и рост пленки.
Толщина пористой части пленки (если еще не достигнута её предельная величина) зависит от количества электричества, прошедшего через анод, т.е. растет в соответствии с законом Фарадея. Толщина барьерного слоя в пористой пленке является функцией формующего напряжения и в процессе анодирования остается практически постоянной и пропорциональной 1,0 нм/В в большинстве используемых электролитов.
Образование пор начинается не одновременно по всей поверхности металла, а в энергетически выгодных местах, которыми могут быть места выхода дислокаций на поверхность, линии скольжения, границы зерен, примеси, структурные дефекты и др. Так, первоначальное распределение пор на поверхности алюминия случайно, хаотично и не подчиняется упорядочению. Одновременно с ростом пор на внешней поверхности на границе раздела металл–оксид начинает расти новый слой оксида, отдельные ячейки которого имеют вид полусферы.
Вначале на поверхности металла возникают отдельные ячейки. По мере роста напряжения формовки между имеющимися ячейками начинают образовываться новые ячейки, постепенно заполняя всю поверхность металла. Очевидно, что самые первые ячейки с полусферическим основанием не могут расти безгранично, так как размеры ячейки будут определяться приложенным напряжением и проводимостью пленки. Но в начальный момент размеры ячеек будут различаться, так как ячейки, возникшие позже, будут иметь меньше времени для роста, а центры ячеек будут расположены хаотично. После того, как отдельные ячейки сомкнутся и покроют всю по
После того, как отдельные ячейки сомкнутся и покроют всю по
верхность металла, возможным останется рост каждой ячейки только в глубину. В этих условиях ячейки, имеющие меньшую полусферу в основании (запоздавшие), будут иметь большую возможность для роста, так как имеют меньшую толщину барьерного слоя. Следовательно, они будут выравнивать свои размеры за счет остальных (соседних), т.е. процесс образования строго упорядоченной ячеистой структуры состоит в перестройке самих ячеек в период роста.
Таким образом, через несколько секунд (в порообразующем электролите) на поверхности металла вырастает барьерная пленка, внешний слой которой в результате воздействия электролита постепенно и непрерывно превращается в пористый оксид. Через поры осуществляется подход электролита к барьерному слою и таким образом поддерживается возможность дальнейшего формирования новых слоев оксида.
Рост и растворение оксида определяются (и усиливаются) локальным увеличением поля на дне пор. Этот механизм считается в настоящее время наиболее приемлемым. Для того чтобы объяснить тот факт, что поры возникают не сразу, а как только будет достигнута некоторая критическая толщина барьерного слоя, Гоар и Яхалом предположили, что для формирования пор необходимо проникновение в оксид протона, который участвует в реакции растворения против анодного поля. А это возможно при уменьшении этого поля до некоторой характеристической величины (т.е. до достижения некоторой критической толщины барьерного слоя на дне поры).
Для того чтобы объяснить тот факт, что поры возникают не сразу, а как только будет достигнута некоторая критическая толщина барьерного слоя, Гоар и Яхалом предположили, что для формирования пор необходимо проникновение в оксид протона, который участвует в реакции растворения против анодного поля. А это возможно при уменьшении этого поля до некоторой характеристической величины (т.е. до достижения некоторой критической толщины барьерного слоя на дне поры).
Исследования показали, что и барьерные, и пористые пленки развивают ячеистую структуру только по истечении некоторого времени (tmin), при котором ток имеет минимальное значение в режиме постоянного напряжения. В порообразующих электролитах это время равно примерно 2с, в 3%-м растворе тартрата аммония (pH = 5,5) tmin = 12 мин, а в том же электролите (pH = 7,0) – 90 мин. В порообразующих электролитах минимум плотности тока в точке tmin соответствует началу формирования пор. Последующее увеличение тока (Uf = const) отражает погружение барьерного слоя на дно пор по мере их роста. Дальнейшая стабильность тока означает стабильность роста барьерной пленки (с постоянной анодирования ~ 1,0 нм/В), и поры растут (развиваются) преимущественно в пленке, а не за счет подложки (м
Дальнейшая стабильность тока означает стабильность роста барьерной пленки (с постоянной анодирования ~ 1,0 нм/В), и поры растут (развиваются) преимущественно в пленке, а не за счет подложки (м
еталла). По мере роста пор более развитые поры поглощают соседние, образуя новые поры.
Таким образом, в каждый данный момент потенциостатического анодирования происходит распределение пор по размерам и формам. И только после некоторого времени диаметр пор становится постоянным, а до этого момента он подчиняется распределению:
, | (3.17) |
где d – диаметр пop; h – толщина барьерного слоя; К – постоянная анодирования; t – время анодирования; t0 – время зарождения пор,.
Полная застройка оксидными ячейками поверхности металла происходит через несколько секунд (4…7 с), и в дальнейшем структура пленки не изменяется, если условия анодного окисления остаются постоянными. Толщина барьерного слоя изменяется только в первые секунды процесса (4…7 с), в дальнейшем оставаясь постоянной даже после длительного анодирования (часы).
Толщина барьерного слоя изменяется только в первые секунды процесса (4…7 с), в дальнейшем оставаясь постоянной даже после длительного анодирования (часы).
Затем происходит упорядочение ячеисто-пористой структуры путем доанодирования участков алюминия в тангенциальном направлении (между растущими оксидными ячейками). Замедление растворения можно объяснить снижением количества эжектируемых ионов алюминия и/или возрастанием вклада процессов встраивания в оксид анионных комплексов алюминия.
Рис. 3.29. Фрагмент пористого оксидас плотно упакованными гексагональными ячейками в центре с порой
Так как электрическое поле около точки (единичной поры на начальном участке) стремится быть сферическим, то передний фронт растущей оксидной ячейки также будет сферическим, если пора действительно является точечным источником. Но так как пора имеет конечный размер, передний фронт ячейки будет иметь форму сектора. После длительного анодирования и слияния отдельных ячеек образуются ячейки с цилиндрическими порами в центре и с промежуточными, сквозными металлическими столбиками с треугольным сечением (рис. 3.29). Эти столбики на репликах с поверхности оксида выглядят как темные участки, увеличивая видимую плотность пор, которые также являются темными на фотографиях.
3.29). Эти столбики на репликах с поверхности оксида выглядят как темные участки, увеличивая видимую плотность пор, которые также являются темными на фотографиях.
Остатки металла между ячейками все еще находятся в действующей электрической цепи и поэтому будут превращаться в оксид анодным способом до окончательного смыкания ячеек. Металл будет расходоваться в равной степени с каждой стороны под влиянием тока в порах трех окружающих ячеек. Когда весь металл из этих столбиков израсходуется полностью, слой оксида станет непрерывным, и ячейки приобретут форму гексагональных призм, а не цилиндров. При таком преобразовании идеальной цилиндрической ячейки в плотно упакованный ряд гексагональных ячеек должна изменяться и форма пор. Поперечное сечение поры окончательно сформированной ячейки будет иметь форму шестиконечной звезды.
Изменение формы ячеек требует изменения формы дна оксидной ячейки в месте контакта с металлом. В месте соединения трех соседних ячеек металл находится под влиянием тока в этих трех ячейках (порах) и будет преобразовываться в оксид быстрее из-за более высокой плотности тока, получающейся в результате перекрещивающихся электрических полей. Следовательно, дно единичной ячейки в плотно упакованной регулярной структуре будет иметь больший радиус кривизны, чем в единичной, изолированной ячейке (от точечного источника). Плотность пор, определенная по репликам поверхности и по РЭМ-фотографиям, будет примерно одинаковой и будет соответствовать действительной плотности пор.
Следовательно, дно единичной ячейки в плотно упакованной регулярной структуре будет иметь больший радиус кривизны, чем в единичной, изолированной ячейке (от точечного источника). Плотность пор, определенная по репликам поверхности и по РЭМ-фотографиям, будет примерно одинаковой и будет соответствовать действительной плотности пор.
Размер ячейки и для плотных, и для пористых электролитов является линейной функцией напряжения формовки и, кроме того, зависит от свойств электролита. Диаметр поры определяется только типом электролита и не зависит от формующего
напряжения. Толщина барьерного слоя в основании оксидных ячеек для оксидов, сформированных в четырех различных электролитах (3%-й хромовой, 15%-й серной, 4%-й фосфорной, 2%-й щавелевой кислотах) примерно одного порядка.
Объем поры должен уменьшаться с увеличением напряжения формовки, так как размер ячейки при этом увеличивается, количество ячеек на единице площади уменьшается, а диаметр поры остается постоянным.
Таким образом, основные структурные параметры (размеры) пористого оксида будут пропорциональны только одному саморегулирующемуся,
Активность — оксид — алюминий
Cтраница 1
Адсорбенты для жидкостной адсорбционной хроматографии. [1]
[1] |
Активность оксида алюминия при нагревании увеличивается, несмотря на полную потерю гидроксильных групп при 800 С. Отсюда следует, что поверхностные гидроксипьные группы не являются активными центрами оксида алюминия. [2]
Активность оксида алюминия и силикагелей в значительной степени зависит от содержания в них влаги. [3]
Активность оксида алюминия, как и силикагелей, зависит от содержания в нем воды. [4]
| Характеристика силикагелей для хроматографии. [5] |
Активность оксида алюминия в значительной степени зависит от содержания влаги в нем. Это имеет важное практическое значение для адсорбционной хроматографии, так как позволяет заменить набор адсорбентов различной адсорбционной емкости одним адсорбентом. Увлажняя наиболее активную форму оксида алюминия различным количеством воды, можно получить набор адсорбентов с различной емкостью. [6]
[6]
| Адсорбенты для жидкостной адсорбционной хроматографии. [7] |
Активность оксида алюминия при нагревании увеличивается, несмотря на полную потерю гидроксильных групп при 800 С. Отсюда следует, что поверхностные гидроксильные группы не являются активными центрами оксида алюминия. [8]
Дополнительные сведения об активности оксида алюминия приведены в разд. [9]
Несмотря на то что активность оксида алюминия увеличивается с температурой активации вплоть до температуры 1000 С, рекомендуется активировать оксид алюминия при 150 — 400 С, так как при более высокой температуре активации образуется адсорбент, который может в большей степени вызывать нежелательные реакции разделяемых образцов. Активация оксида алюминия при 400 С с последующей дезактивацией водой приводит к появлению таких же свойств, как и при низкотемпературной активации. [10]
[10]
Большое распространение для оценки активности оксида алюминия получил метод, предложенный Брокманом и Шоддером [16], По этому методу проводят разделение на данном сорбенте смеси шести различных красителей. Определяется пять степеней активности оксида алюминия, соответствующих содержанию 0; 3; 6; 10 и 15 % воды, в зависимости от того, удерживается лк в начале колонки с оксидом: алюминия или проходит до конца слоя тот или иной краситель. Однако такие схемы позволяют лишь отнести адсорбент к той или иной группе активности и не позволяют оценить его активность с точностью, необходимой для стандартизации условий хроматографического разделения нефтепродуктов. [11]
Корреляция между кислотностью и активностью оксида алюминия в реакциях дегидратации и изомеризации показана в ряде работ. В частности, в работе [141 ] с помощью ИК-спектроскопии подтверждено, что значительно более высокая изомеризующая активность т ] — оксида алюминия по сравнению с у ксиД м связана с его более высокой кислотностью и что сила кислотных центров увеличивается при хлорировании оксида алюминия. [12]
[12]
| Механизм дегидратации и исследующей дезактивации диоксида кремния при температурах свыше 400 С ( схема. [13] |
В отличие от диоксида кремния активность оксида алюминия повышается при нагревании вплоть до 1000 С. Это служит убедительным доказательством, что активными центрами на поверхности оксида алюминия являются не гидроксильные группы. В действительности, как можно судить по характеристикам удерживания, при хроматографировании на оксиде алюминия проявляются три типа взаимодействий растворенного вещества с адсорбентом. В первом типе адсорбаты с легко поляризующимися электронами ( основания Льюиса) взаимодействуют с очень сильными положительными полями вокруг ионов А13 на поверхности оксида алюминия. Взаимодействия второго типа приводят к преимущественному удерживанию кислых растворенных веществ, по-видимому, в результате образования донор-но-акцепторных связей между протонами и основными центрами ( О2 — — ионами) на поверхности оксида алюминия. И, наконец, некоторые соединения ароматического ряда, очевидно, удерживаются в результате взаимодействий, связанных с переносом заряда, возможно из-за переноса электрона к положительно заряженным А13 — центрам. Кажется-совершенно естественным, что когда два растворенных вещества отличаются главным образом своей электронной структурой, то из адсорбентов наиболее предпочтителен в этом случае оксид алюминия. Так, он превосходит диоксид кремния по разделению ароматических ил, олефиновых углеводородов.
[14]
И, наконец, некоторые соединения ароматического ряда, очевидно, удерживаются в результате взаимодействий, связанных с переносом заряда, возможно из-за переноса электрона к положительно заряженным А13 — центрам. Кажется-совершенно естественным, что когда два растворенных вещества отличаются главным образом своей электронной структурой, то из адсорбентов наиболее предпочтителен в этом случае оксид алюминия. Так, он превосходит диоксид кремния по разделению ароматических ил, олефиновых углеводородов.
[14]
Из сравнения приведенных данных видно, что активность оксида алюминия через 6 мес эксплуатации снижается почти в 1 5 раза, силикагеля — на 45 %, а цеолитов — — лишь на 13 — 22 % в зависимости от начальной влажности адсорбата. [15]
Страницы: 1 2
Физико-химические свойства оксида алюминия, получаемого на основе продукта центробежно-термической активации гидраргиллита, и катализаторы глубокого гидрообессеривания дизельных топлив
Список источников диссертации и автореферата по химии, кандидата химических наук, Кулько, Евгения Владимировна, Новосибирск
1. Дзисько В.А., Иванова А.С. Основные методы получения активного оксида алюминия. //Изв. СО АН СССР, сер. хим. наук, 1985, № 15, вып. 5, с. 110-119.2. Pat. 2915365 USA.
Дзисько В.А., Иванова А.С. Основные методы получения активного оксида алюминия. //Изв. СО АН СССР, сер. хим. наук, 1985, № 15, вып. 5, с. 110-119.2. Pat. 2915365 USA.
2. Буянов Р.А., Криворучко О.П., Золотовский Б.П. О природе термохимической активации кристаллических гидроксидов. // Изв. СО АН СССР, сер. хим. наук. 1986, № И, вып. 4, с. 39-44.
3. Ingram-Jones V.J., Davies R.C.T., Southern J.С., Salvador S. Dehydroxylation sequences of gibbsite and boehmite: study of differences between soak and flash calcination and of particle-size effects. // J. Mater. Chem., 1996, v. 6, p. 73-79.
4. Пат. № 2186616, РФ. Установка и способ термоударной обработки сыпучих материалов. // Пинаков В.И, Стояновский О.И., Гринберг Б.Е., Дряб В.Н., Пикаревский А.А.
5. Tanashev Yu.Yu., Isupova L.A., Ivanova A.S. et al. II 16th International Congress of Chemical and Process Engineering (CHISA), 22 26 August 2004, Praha, Czech Republic, Abstracts, P. 214.
6. Zolotovskii В.Р., Buyanov R. A., Bukhtiyarova G.A., Demin V.V., Tsybulevskii A.M. Low-waste production of alumina catalysts for gas sulfur recovery. // React. Kinet. Catal. Lett., 1995, v. 55, p. 523-535.
A., Bukhtiyarova G.A., Demin V.V., Tsybulevskii A.M. Low-waste production of alumina catalysts for gas sulfur recovery. // React. Kinet. Catal. Lett., 1995, v. 55, p. 523-535.
7. Mista W„ WrzyszczJ. Rehydration of transition aluminas obtained by flash calcination of gibbsite. // Thermochimica Acta, 1999, v. 331, p. 67-72.
8. Topsae H, Clausen B.S., Massoth F.E. II Eds.: Anderson J.R., Boudard M., Catalysis Science and Technology, v. 11, Springer-Verlag, Berlin, 1996.
9. Строение и свойства адсорбентов и катализаторов. // Под ред. Линсена Б.Г., пер. с англ., М.: Мир, 1973, 656с.
10. Дзисько В.А., Карнаухов А.П., Тарасова Д.В. Физико-химические основы синтеза окисных катализаторов. // Новосибирск, наука, 1978, 384с.
11. Дзисько В.А. Основы методов приготовления катализаторов. // Новосибирск, Наука, 1983, 264с.
12. Maillet Т., Barbier J., Gelin P., Praliaud H., Duprez D. Effects of Pretreatments on the Surface Composition of Alumina-Supported Pd-Rh Catalysts. // J. Catal., 2001, v. 202, p. 367-378.
// J. Catal., 2001, v. 202, p. 367-378.
13. Prins P., De Beer V.H.J., Somorjai G.A. Structure and function of the promoter in Co-Mo hydrodesulfurization catalysts. // Catal. Rev., 1989, v. 31, p. 1-41.
14. Prins P. Catalytic hydrodenitrogenation. // Adv. Catal., 2001, v. 46, p. 399-464.
15. Belton D.N., Taylor K.C. Automobile exhaust emission control by catalysts. // Curr. Opin. Solid State Mater. Sci., 1999, v. 4, p. 97-102.
16. Ломберов А.А. Разработка катализаторов процессов органического синтеза с использованием нового метода получения активного оксида алюминия. // Док. дисс. Казань, КГТУ, 1999, 257с.
17. Тарасова Т.В., Гажур Л.К, Иванова А.С., Ле Тхи Май Хыонг, Пути интенсификации процесса растворения гидроксида алюминия в азотной кислоте. // Труды ГИАП: Исследование и разработка сырья для приготовления катализаторов, М., 1990, с. 7-15.
18. Иванова А.С., Пугач М.М., Мороз Э.М., Литвак Г.С., Крюкова Г.Н., Мастихин В.М., Криворучко О.П. Влияние условий получения на физико-химические свойства гидроксидов алюминия и магния. // Изв. АН СССР, сер. хим. наук, 1989, № 10, с. 21692176.
// Изв. АН СССР, сер. хим. наук, 1989, № 10, с. 21692176.
19. Иванова А. С. Основы получения активного оксида алюминия осаждением из растворов. // Материалы респ. конференции: «Анод-90», Казань, 1990, ч. И, с.85-88.
20. Inui Т., Miyaka Т., Fukuda К. Control of pore-structures of y-alumina by the calcination of boehmite prepared from gibbsite under specific conditions. // Appl. Catal., 1983, v. 6, p. 165-173.
21. Decller I.G.M. TG/XRD/SEM Study the conversion of gibbsite to (pseudo)boehmite. // Bull. Soc. Chim. Belg., 1989, v. 98, p. 449-461.
22. Pat 1599374 (GB), COI F 7/02. Method of preparing granulated activated alumina. // Icaev B.N., Kuyazev V.M., Moroz E.M. and at al. -30.09.1981.
23. Pat 3226191 (US) COI A 7/02. Method of producing active alumina and the resulting product. // Osment H.E., Joues R., Rouge B. 28.12.1965.
24. Pat 3222129 (US), COI F 7/02. Method for producing active alumina nodules. // Osment H.E., Emerson R., Ronge B. 7.12.1965.
25. Пат. 682120 (СССР), МКИ COI F 7/30. Способ получения окиси алюминия. // Маршесо Ф., Ре А., ПлассЛ., ШепеГ., Шмидт Х.В. -25.08.1979.
26. Pat 3701718 (US), COI F 7/02. High-porous activated alumina and method. // Pappe D., LavalonM. -31.10.1972.
27. Pat 1367925 (GB), COI F 7/44. Active aluminium oxide and process of producing Some. // Podschus E. 25.09.1974.
28. А.С. № 524768 СССР, МКИ COI F 7/02. Способ получения осадка гидроокиси алюминия. И Любушко Г.И., Хомякова Л.Г., Воробьев Ю.К., Левицкий Э.А. № 1948554 с приор. 12.07.73, бюл. № 30 от 15.03.76.
29. Золотовский Б. П. Научные основы механохимической и термохимической активации кристаллических гидроксидов при приготовлении носителей и катализаторов. // Дисс. на соискание, уч. степени доктора хим. наук, 1992, ИК СО РАН, Новосибирск.
30. Jovanovic N., Novakovic Т., Janackovic J., Terlecki-Baricevic A. Properties of Activated Alumina Obtained by Flash Calcination of Gibbsite. // J. Colloid and Interface Science, 1992, v. 150, № 1, p. 36-41.
150, № 1, p. 36-41.
31. Пинаков В.К, Стояновский О.И., Гринберг Б.Е. и др. II Матер. VIII Междунар. науч.-техн. конф. по проблемам наукоемких химических технологий, Уфа, 7-10 октября 2002г, Уфа: Реактив, 2002, с. 156.
32. Sato Т. Thermal decomposition of aluminum hydroxides to aluminas. // Thermochim. Acta, 1985, v. 88, № l,p. 69-84.
33. Sato T. The dehydration of alumina trihydrate. // J. Appl. Chem., 1959, № 9, p. 331-340.
34. Сеттерфилд Ч. Практический курс гетерогенного катализа. // Пер. с англ., М.: Мир, 1984, 520 с.
35. Иванова А.С., Литвак Г.С., Крюкова Г.Н., Цыбуля С.В., Паукштис Е.А. Реальная структура метастабильных форм оксида алюминия. // Кинетика и катализ, 2000, т.41, № 1, с.137-141.
36. Kryukova G.N., Klenov D.O., Ivanova A.S., Tsybulya S. V. Vacancy ordering in the structure of 7-AI2O3. // J. Europ. Ceramic Society, 2000, v. 20, № 8, p. 1187-1189.
37. Cai S.-H., Rashkeev S.N., Pantelides S. Т., Sohlberg K. Atomic Scale Mechanism of the Transformation of y-Alumina to 0-Alumina. // Phys. Rev. Lett., 2002, v. 89, № 23, p. 235501-235504.
// Phys. Rev. Lett., 2002, v. 89, № 23, p. 235501-235504.
38. Паукштис Е.А. ИК спектроскопия в гетерогенном кислотно-основном катализе. // Новосибирск: Наука, 1992, 256 с.
39. Гейтс Б., Кетцир Дж., Шуйт Г. Химия каталитических процессов. // М., 1981, 551с.
40. Олешко В.П., Лунина Е.В., Голубев В.Б. и др. Исследование кинетики и механизма каталитического радикального распада 2-нитрозо-2-метилпропана на поверхности окиси алюминия. //Ж. физ. химии, 1981, т. 55, № 5, с. 1160-1164.
41. Чукин Г.Д. Строение поверхности у-окиси алюминия. //Ж. структур, химии, 1976, т. 17, № 1, с. 122-128.
42. Knozinger Н., Ratnasamy P. Catalytic aluminas: surface models and characterization of surface sites. // Catal. Rev., 1978, v. 17, № 1, p. 31-70.
43. Peri J. A Model for the Surface of 7-Alumina. // J. Phys. Chem., 1965, v. 69, № 1, p. 220-230.
44. Катализ. II Под ред. Петрия О.А., Лунина В.В., Изд. Московского Университета, 1987.
45. Song С. An overview of new approaches to deep desulfurization for ultra-clean gasoline, diesel fuel and jet fuel. // Catal. Today, 2003, v. 86, p. 211-263.
// Catal. Today, 2003, v. 86, p. 211-263.
46. Каминский Э.Ф., Осипов Л.Н., Хавкин B.A., Курганов В.М., Виноградов Н.Я. Развитие технологий глубокой гидроочистки дизельных топлив и вакуумных дистиллятов на НПЗ России. // Нефтегазовые технологии, 2001, №1, с.36-42.
47. Бхарвани P.P., Гендерсон Р. С. Модернизация установок гидроочистки для углубления гидрообессеривания. // Нефтегазовые технологии, 2002, №3, с. 107-111.
48. Babich I. V., Moulijn J.A. Science and technology of novel processes for deep desulfurization of oil refinery streams: a review. // Fuel, 2003, v. 82, p. 607-631.
49. Майо С., Бревурд E., Геритсен Л., Плантенго Ф. Процесс получения сверхмалосернистого дизельного топлива. // Нефтегазовые технологии, 2001, №3, с. 91-93.
50. Шифлет У.К., Кренцке Л.Д. Совершенствование катализаторов для производства сверхмалосернистых топлив. // Нефтегазовые технологии, 2002, №3, с.105-106.
51. Shafi R., Hutchings G.J. Hydrodesulfurization of hindered dibenzothiophenes: an overview. // Catal. Today, 2000, v. 59, p. 423-442.
// Catal. Today, 2000, v. 59, p. 423-442.
52. Gates В. C., Topsoe H. Reactivities in deep catalytic hydrodesulfurization: challenges, opportunities, and the importance of 4-methyldibenzothiophene and 4,6-dimethyldibenzothiophene. // Polyhedron, 1997, v. 16, № 18, p. 3213-3217.
53. Ma X, Sakanishi K., Isoda T. Hydrodesulfurization reactivities of narrow-cut fractions in gas oil. // Ind. Eng. Chem. Res., 1995, v. 34, p 748-754.
54. Старцев A.H. Сульфидные катализаторы гидроочистки: синтез, структура, свойства. // Дисс. на соиск. уч. степени доктора хим. наук, 1997, ИК СО РАН, Новосибирск.
55. Furimskya Е., Massoth F.E. Deactivation of hydroprocessing catalysts. // Catal. Today, 1999, v. 52, p. 381-495.
56. Лолер Д., Робинсон С. Модернизация установок гидроочистки для получения сверхмалосернистого дизельного топлива. // Нефтегазовые технологии, 2002, №2, с.105-110.
57. Zepeda Т.A., Pawelec В., Fierro J.L.G., Halachev Т. Removal of refractory S-containing compounds from liquid fuels on novel bifunctional CoMo/HMS catalysts modified with Ti. // Appl. Catal. B: Envir., 2006, v. 71, p. 223-236.
// Appl. Catal. B: Envir., 2006, v. 71, p. 223-236.
58. Leyva C., Ancheyta J., Rana M.S., Marroqun G. A comparative study on the effect of promoter content of hydrodesulfurization catalysts at different evaluation scales. // Fuel, 2007, v. 86, p. 1232-1239.
59. Grzechowiak JR., Wereszczako-Zielinska I., Mrozinska K. HDS and HDN activity of molybdenum and nickel-molybdenum catalysts supported on alumina-titania carriers. // Catal. Today, 2007, v. 119, p. 23-30.
60. Yoshimura Y., Matsubayashi N., Sato T., Shimada H., Nishijima A. Molybdate catalysts prepared by a novel impregnation method. Effect of citric acid as a ligand on the catalytic activities. //Appl. Catal. A: General, 1991, v. 79, p. 145-159.
61. Sun M., Nicosia D., Prins R. The effects of fluorine, phosphate and chelating agents on hydrotreating catalysts and catalysis. // Catal. Today, 2003, v. 86, p. 173-189.
62. Al-Dalama K., Aravind B., Stanislaus A. Influence of complexing agents on the adsorption of molybdate and nickel ions on alumina. // Appl. Catal. A: General, 2005, v. 296, p. 49-53.
// Appl. Catal. A: General, 2005, v. 296, p. 49-53.
63. Medici L., Prins R. The Influence of Chelating Ligands on the Sulfidation of Ni and Mo in NiMo/Si02 Hydrotreating Catalysts. // J. Catal., 1996, v. 163, p. 38-49.
64. Tops0e H., Clausen B.S. Importance of Co-Mo-S Type Structures in Hydrodesulfurisation. // Catal. Rev. Sci. Eng., 1984, v. 26, p. 395-420.
65. LuckF. //Bull. Soc. Chim. Belg., 1991, v. 100, p. 781-788.
66. Breysse M., Portefai J.L., Vrinat M. Support effects on hydrotreating catalysts. // Catal. Today, 1991, v. 10, p. 489-505.
67. Breysse M., Afanasiev P., Geantet C., Vrinat M. Overview of support effects in hydrotreating catalysts. // Catal. Today, 2003, v. 86, p. 5-16.
68. Massoth F.E., Muralidhar G., ShabtaiJ. Catalytic Functionalities of Supported Sulfides: II. Effect of Support on Mo Dispersion. // J. Catal., 1984, v. 85, p. 53-62.
69. Flego C, Arrigoni V, Ferrari M., Riva R„ Zanibelli L. Mixed oxides as a support for new CoMo catalysts. // Catal. Today, 2001, v. 65, p. 265-270.
// Catal. Today, 2001, v. 65, p. 265-270.
70. Hicks R.W., Castagnola N.B., Zhang Z., Pinnavaia T.J., Marshall C.L. Lathlike mesostructured 7-aIumina as a hydrodesulfurization catalyst support. // Appl. Catal. A: General, 2003, v. 254, p. 311-317.
71. Zdrazil M. MgO-supported Mo, CoMo and NiMo sulfide hydrotreating catalysts. // Catal. Today, 2003, v. 86, p. 151-171.
72. Chary K.V.R., Ramkrishna H„ Rama Rao K.S., Murali Dhar G., Kanta Rao P. Hydrodesulfurization on MoS2/MgO. // Catal. Lett., 1991, v. 10, p. 27-33.
73. Klicpera T., Zdrazil M. Preparation of High-Activity MgO-Supported Co-Mo and Ni-Mo Sulfide Hydrodesulfurization Catalysts. // J. Catal., 2002, v. 206, p. 314-320.
74. Pratt K.C., Sanders J.V., Christov V. Morphology and Activity of M0S2 on Various Supports: Genesis of the Active Phase. // J. Catal., 1990, v. 124, p. 416-432.
75. Maity S.K., Rana M.S., Srinivas B.N., Bej S.K., Murali Dhar G., Prasada Rao T.S.R. Characterization and evaluation of Zr02 supported hydrotreating catalysts. // J. Mol. Catal. A: Chem., 2000, v. 153, p. 121-127.
// J. Mol. Catal. A: Chem., 2000, v. 153, p. 121-127.
76. Weissman J.G., Ko E.I., Kaytal S. Titania-zirconia mixed oxide aerogels as supports for hydrotreating catalysts. // Appl. Catal. A: General, 1993, v. 94, p. 45-59.
77. Srinivasan S., Datye A.K., Peden C.H.F. The Morphology of Oxide-Supported MoS2. // J. Catal., 1992, v. 137, p. 513—522.
78. Datye A.K., Srinivasan S., Allard L. F., Peden C.H.F., Brenner J.R., Thompson L. T. Oxide Supported MoS2 Catalysts of Unusual Morphology. // J. Catal., 1996, v. 158, p. 205-216.
79. Wang S., Shen B., Qu L. Commercial application of titania-supported hydrodesulfurization catalysts in the production of hydrogen using full-range FCC off-gas. // Catal. Today, 2004, v. 98, p. 339-342.
80. Farag H., Whitehurst D.D., Mochida I. Synthesis of Active Hydrodesulfurization Carbon-Supported Co-Mo Catalysts. Relationships between Preparation Methods and Activity/Selectivity. // Ind. Eng. Chem. Res., 1998, v. 37, is. 9, p. 3533-3539 —
81. Farag H., Whitehurst D.D., Sakanishi K., Mochida I. Carbon versus alumina as a support for Co-Mo catalysts reactivity towards HDS of dibenzothiophenes and diesel fuel. // Catal. Today, 1999, v. 50, Is. 1, p. 9-17.
Farag H., Whitehurst D.D., Sakanishi K., Mochida I. Carbon versus alumina as a support for Co-Mo catalysts reactivity towards HDS of dibenzothiophenes and diesel fuel. // Catal. Today, 1999, v. 50, Is. 1, p. 9-17.
82. Okamoto Y. Preparation and characterization of zeolite-supported molybdenum and cobalt-molybdenum sulfide catalysts. // Catal. Today, 1997, v. 39, Is. 1-2, p. 45-59.
83. Rawat K.S., Rana M.S., Murali Dhar G. Catalytic functionalities of USY zeolite supported hydrotreating catalysts. // Stud. Surf. Scien. Catal., 2001, v. 135, p. 301-.
84. Wang A., Wang Y., Kabe T., Chen Y, Ishihara A., Qiany W. Hydrodesulfurization of Dibenzothiophene over Siliceous MCM-41 -Supported Catalysts: I. Sulfided Co-Mo Catalysts. // J. Catal., 2001, v. 199, p. 19-29.
85. Reddy K.M., Wei B., Song C, Mesoporous molecular sieve MCM-41 supported Co-Mo catalyst for hydrodesulfurization of petroleum resides. // Catal. Today, 1998, v. 43, p. 261-272.
86. Song C., Reddy K.M. Mesoporous molecular sieve MCM-41 supported Co-Mo catalyst for hydrodesulfurization of dibenzothiophene in distillate fuels. // Appl. Catal. A: General, 1999, v. 176, p. 1-10.
Mesoporous molecular sieve MCM-41 supported Co-Mo catalyst for hydrodesulfurization of dibenzothiophene in distillate fuels. // Appl. Catal. A: General, 1999, v. 176, p. 1-10.
87. Chiranjeevi T., Kumar P., Maity S.K., Rana M.S., Murali Dhar G., Prasada Rao T.S.R., Characterization and hydrodesulfurization catalysis on WS2 supported on mesoporous Al-HMS material. // Micropor. Mesopor. Mater., 2001, v. 44-45, p. 547-556.
88. Chiranjeevi T., Kumar P., Rana M.S., Murali Dhar G., Prasada Rao T.S.R. Physico-chemical characterization and catalysis on mesoporous Al-HMS supported molybdenum hydrotreating catalysts. // J. Molec. Catal.s A: Chem., 2002, v. 181, p. 109-117.
89. Maity S.K., Srinivas B.N., V.V.D.N. Prasad, Singh A., Murali Dhar G., Prasada Rao T.S.R. Studies on sepiolite supported hydrotreating catalysts. // Stud. Surf. Sci. Catal., 1998, v. 113, p. 579-590.
90. Carrado K.A., Xu L., Marshall C.L., Wei D., Seifert S., Bloomquist C.A.A. Mesoporous synthetic clays: synthesis, characterization, and use as HDS catalyst supports. // Stud. Surf. Sci. Catal., v. 129,2000, p. 417-424.
// Stud. Surf. Sci. Catal., v. 129,2000, p. 417-424.
91. Carrado K.A., Marshall C.L., Brenner J.R., Song K. Materials derived from synthetic organo-clay complexes as novel hydrodesulfurization catalyst supports. // Micropor. Mesopor. Mater., 1998, v. 20, Is. 1-3, p. 17-26.
92. Segawa K., Satoh S. Ti02-coated on A1203 support prepared by CVD method for HDS catalysts.// Stud. Surf. Sci. Catal., 1999, v. 127, p. 129-136.
93. Yoshinaka S., Segawa K. Hydrodesulfurization of dibenzothiophenes over molybdenum catalyst supported on Ti02-Al203. // Catal. Today, 1998, v. 45, p. 293-298.
94. Rana MS., Srinivas B.N., Maity S.K., Murali Dhar G„ Prasada Rao T.S.R. Catalytic functionalities of Ti02 based Si02, A1203, Zr02 mixed oxide hydroprocessing catalysts. // Stud. Surf. Sci. Catal., 1999, v. 127, p. 397-400.
95. Wei Z.B., Yan W., Zhang H., Ren T., Xin 0., Li Z. Hydrodesulfurization activity of NiMo/Ti02-Al203 catalysts. //Appl. Catal. A: General, 1998, v. 167, p. 39-48.
96. Miciukiewicz J., Mang T., Knôzinger H. Raman spectroscopy characterization of molybdena supported on titania-zirconia mixed oxide. // Appl. Catal. A: General, 1995, v. 122, p. 151-159.
97. Daly F.P., Ando H., Schmitt J.L., Sturm E.A. Hydrodesulfurization over a Ti02-Zr02-Supported C0O-M0O3 Catalyst. //J. Catal., 1987, v. 108, p. 401-408.
98. Barrera M.C., Viniegra M., Escobar J., Vrinat M., J.A. de los Reyes, Murrieta F., Garcia J. Highly active MoS2 on wide-pore Zr02-Ti02 mixed oxides. // Catal. Today, 2004, v. 98, p. 131-139.
99. Damyanova S., Petrov L., Centeno M.A., Grange P. Characterization of molybdenum hydrodesulfurization catalysts supported on Zr02-Al203 and Zr02-Si02 carriers. // Appl. Catal. A: General, 2002, v. 224, p. 271-284.
100. Klimova T., Rojas M.L., Castillo P., Cuevas R., Ramirez J. Characterization of Al203-Zr02 mixed oxide catalytic supports prepared by the sol-gel method. // Microp. Mesopor. Mater., 1998, v. 20, p. 293-306.
101. HamonD., Vrinat M., Breysse M., Durand B., Jebrouni M., Roubin M., Magnoux P., T. des Courières. Molten salt preparation of stabilized zirconia catalysts : characterization and catalytic properties. // Catal. Today, 1991, v. 10, p. 613-627.
HamonD., Vrinat M., Breysse M., Durand B., Jebrouni M., Roubin M., Magnoux P., T. des Courières. Molten salt preparation of stabilized zirconia catalysts : characterization and catalytic properties. // Catal. Today, 1991, v. 10, p. 613-627.
102. Vrinat M., Hamon D., Breysse M., Durand B., T. des Courieres. Zirconia- and alumina-supported molybdenum-based catalysts: a comparative study in hydrodesulfurization and hydrogénation reactions. // Catal. Today, 1994, v. 20, p. 273-282.
103. HenkerM., Wendlandt K.P. Structure of Mo03/Al203-Si02 catalysts.//Appl. Catal., 1991, v. 69, p. 205-220.
104. Henker M., Wendlandt K.-P., Shpiro E.S., Tkachenko O.P. Phase and surface composition and dispersion of M0O3 in Mo03/Al203-Si02 catalysts. // Appl. Catal., 1990, v. 61, p. 253-263.
105. Rajagopal S., Grimm T.L., Collins D.J., Miranda R. Denitrogenation of Piperidine on Alumina, Silica, and Silica-Aluminas: The Effect of Surface Acidity. // J. Catal., 1992, v. 137, p. 453-461.
106. Rao K.S., Murali Dhar G. Catalytic functionalities of supported tungsten sulfide catalysts. //J. Catal., 1989, v. 115, p. 277-281.
107. Murali Dhar G., Massoth F.E., Shabtai J. Catalyst Catalytic Functionalities of Supported Sulfides: I. Effect of Support and Additives on the C0M0. // J. Catal., 1984, v. 85, p. 44-52.
108. Dubois J.-L., Fujieda S. Effects of boron in C0-M0/B-AI2O3 hydrotreatment catalysts. // Catal. Today, 1996, v. 29, p. 191-195.
109. Li D., Sato T., Immamura M., Shimada H., Nishijima A. The effect of boron on HYD, HC and HDS activities of model compounds over Ni-Mo/y-AhOs-BiOs catalysts. // Appl. Catal. B: Envir., 1998, v. 16, p. 255-260.
110. Li D., Sato T., Imamura M., Shimada H., Nishijima A. Spectroscopic Characterization of Ni-Mo/7-Al203-B203 Catalysts for Hydrodesulfurization of Dibenzothiophene. // J. Catal., 1997, v. 170, p. 357-365.
111. Rana M.S., Srinivas B.N., Maity S.K., Murali Dhar G., Prasada Rao T.S.R. Origin of Cracking Functionality of Sulfided (Ni)CoMo/Si02-Zr02 Catalysts. // J. Catal., 2000, v. 195, p. 31-37.
// J. Catal., 2000, v. 195, p. 31-37.
112. Solisa D., Klimova T., Ramirez J., Cortez T. NiMo/Al203-MgO(x) catalysts: the effect of the prolonged exposure to ambient air on the textural and catalytic properties. // Catal. Today, 2004, v. 98, p. 99-108.
113. Gulkova D., Vit Z. Silica-ceria as support for the preparation of NiMo(P) hydrodesulfurization and hydrodenitrogenation catalysts. // Appl. Catal. A: General, 1995, v. 125, p. 61-70.
114. Iwamoto R., Grimblot J. Acidity and Hydrogenation Properties of Mo-P-Alumina Catalysts Prepared by a Sol-Gel Method. // J. Catal., 1997, v. 172, p. 252-255.
115. Dzwigaj S., Louis C., Breysse M., Cattenot M., Belliere V., Geantet C., Vrinat M., Blanchard P., Payen E., Inoue S„ Kudo H., Yoshimura Y. New generation of titanium dioxide support for hydrodesulfurization. // Appl. Catal. B, 2003, v. 41, p. 181-191.
116. Afanasiev P., Thiollier A., Breysse M., Dubois J.L. Control of the textural properties of zirconium oxide. //Top. Catal., 1999, v. 8, p. 147-160.
Catal., 1999, v. 8, p. 147-160.
117. Zhao E., Hardcastle S.E., Pacheco G., Garcia A., BlumenfeldA.L., Fripiat J.J. Aluminum-doped mesoporous zirconia obtained from anionic surfactants. // Micropor. Mesopor. Mater., 1999, v. 31, p. 9-21.
118. Pacheco G., Zhao E., Valdes E.D., Garcia A., Fripiat J.J. Microporous zirconia from anionic and neutral surfactants. // Micropor. Mesopor. Mater., 1999, v. 32, p. 175-188.
119. Afanasiev P. Zr(IV) basic carbonate complexes as precursors for new materials: synthesis of the zirconium-surfactant mesophase. // Mater. Res. Bull., 2002, v. 37, p. 1933-1940.
120. Blin J.L., Flamant R„ Su B.L. Synthesis of nanostructured mesoporous zirconia using CTMABr-Zr0Cl2*8h30 systems: a kinetic study of synthesis mechanism. // Int. J. Inorg. Mater., 2001, v. 3, p. 959-972.
121. Chen H.R., Shi J.L., Chen T., Yan J.N., Yan D.S. Preparation and characteristics of the ordered porous zirconia containing cerium // Mater. Lett., 2002, v. 54, p. 200-204.
200-204.
122. Chuah G.K., Jaenicke S., Cheong S.A., Chan K.S. The influence of preparation conditions on the surface area of zirconia. // Appl. Catal. A, 1996, v. 145, p. 267-284.
123. Chuah G.K. An investigation into the preparation of high surface area zirconia. // Catal. Today, 1999, v. 49, p. 131-139.
124. Damyanova S., Spojakina A., Jiratova K. Effect of mixed titania-alumina supports on the phase composition of NÍM0/TÍO2-AI2O3 catalysts. // Appl. Catal. A: General, 1995, v. 125, p. 257-269.
125. Grzechowiak J. R., Rynkowski J., Wereszczako-Zieliñska I. Catalytic hydrotreatment on alumina-titania supported NiMo sulphides. // Catal. Today, 2001, v. 65, is. 2-4, p. 225-231.
126. Pophal C., Kameda F., Hoshino K., Yoshinaka S., Segawa K. Hydrodesulfurization of dibenzothiophene derivatives over TÍO2-AI2O3 supported sulfided molybdenum catalyst. // Catal. Today, 1997, v. 39, is. 1-2, p. 21-32.
127. Segawa K., Takahashi K., Satoh S. Development of new catalysts for deep hydrodesulfurization of gas oil. // Catal. Today, 2000, v. 63, p. 123-131. ~ ~
// Catal. Today, 2000, v. 63, p. 123-131. ~ ~
128. Martin C., Martin I., Rives V, Damyanova S., Spojakina A. Catalytic activity of NÍM0/TÍO2-AI2O3 systems in thiophene hydrodesulfurization. // React. Kinet. Catal. Lett., 1995, v. 54, p. 203-208.
129. Segawa K., Katsuta M., Kameda F. Ti02-coated on Al203 support prepared by the CVD method for HDS catalysts. // Catal. Today, 1996, v. 29, p. 215-219.
130. Lecrenay E., Sakanishi K., Nagamatsu T., Mochida I., Suzuka T. Hydrodesulfurization activity of C0M0 and NiMo supported on Al203-Ti02 for some model compounds and gas oils. // Appl. Catal. B, 1998, v. 18, p. 325-330.
131. Holt T.E., Logan A.O., Chakraborti S., Datye A.K. The effect of catalysts supports preparation conditions on the morphology of MgO catalysts. // Appl. Catalysis, 1987, v. 34, p. 199-213.
132. Gil A., Gandia L.M., Vicente M.A. Recent Advances in the Synthesis and Catalytic Applications of Pillared Clays. // Catal. Rev.-Sci. Eng., 2000, v. 42, p. 145-212.
145-212.
133. Sakanishi K., Nagamatsu T., Mochida I., Whitehurst D.D. Hydrodesulfurization kinetics and mechanism of 4,6-dimethyldibenzothiophene over NiMo catalyst supported on carbon. //J. Mol. Catal. A: Chem., 2000, v. 155, p. 101-109.
134. Pawalec B., Mariscal R., Fierro J.L.G., Grennwood A., Vasudevan P.T. Carbon-supported tungsten and nickel catalysts for hydrodesulfurization and hydrogenation reactions. // Appl. Catal. A, 2001, v. 206, p. 295-307.
135. Farag H„ Mochida I., Sakanishi K. Fundamental comparison studies on hydrodesulfurization of dibenzothiophenes over CoMo-based carbon and alumina catalysts. //Appl. Catal. A: General, 2000, v. 194 -195, p. 147-157.
136. Tops0e II., Clausen B.S. Active sites and support effect in hydrodesulfurization catalysts. // Appl. Catal., 1986, v. 25, p. 273-293.
137. Candia R„ Sorensen O., Villadsen J., Topsee N.-Y., Clausen B.S., Topsee H. Effect of sulfiding temperature of activity and structures of C0-M0/AI2O3 catalysts. II // Bull. Soc. Chim. Belg., 1984, v. 93, № 8-9, p. 763-773.
II // Bull. Soc. Chim. Belg., 1984, v. 93, № 8-9, p. 763-773.
138. Eijsbouts S. On the flexibility of the active phase in hydrotreating catalysts. // Appl. Catal. A: General, 1997, v. 158, p. 53-92.
139. Browne KM., Louwers S.P.A., Prins R. The effect of passivation on the activity of sulfided Mo and Co-Mo hydrodesulphrization catalysts. // Catal. Today, 1991, v. 10, p. 345-352.
140. Louwers S.P.A., Craje M. W.J., A.M. van der Kraan, Geantet C., Prins R. The Effect of Passivation on the Activity and Structure of Sulfided Hydrotreating Catalysts. // J. Catal., 1993, v. 144, p. 579-596.
141. Whitehurst D.D., Isoda T., Mochida I. II Adv. Catal., 1998, v. 42, p. 345-360.
142. Shimada H. Morphology and orientation of M0S2 clusters on AI2O3 and Ti02 supports and their effect on catalytic performance. // Catal. Today, 2003, v. 86, p. 17-29.171172,173,174175,176,177,178,179.180.181.182.183.184.
143. Sakashita Y., Araki Y., Honna K., Shimada H. Orientation and morphology of molybdenum sulfide catalysts supported on titania particles, observed by using high-resolution electron microscopy. // Appl. Catal. A: General, 2000, v. 197, p. 247-253.
// Appl. Catal. A: General, 2000, v. 197, p. 247-253.
144. Нефедов Б.К. Технологии и катализаторы глубокой гидроочистки моторных топлив для обеспечения требований нового стандарта Евро-4. // Катализ в промышленности, 2003, №2, с. 20-27.
145. Пат. N 2234460, РФ. Способ получения гидроксида алюминия псевдобемитной структуры и гамма-оксида алюминия на его основе. // Иванова А.С., Карасюк Н.В., Кругляков В.Ю., Танашев Ю.Ю., Мороз Э.М., Золотарскнй И.А., Пармон В.Н., 2004, БИ № 23.
146. Пат. № 236438, РФ. Способ получения байеритного гидроксида алюминия. // Дзисько В.А., Винникова Т.С., Булгакова Ю.О., 2000, БИ № 7.
147. Прайс В. Аналитическая атомно-абсорбционная спектроскопия. //. М.: Мир, 1976.
148. Уманский Я.С. Рентгенография металлов. // М.: Металлургия, 1970, с. 273.
149. Мороз Э.М. Рентгенографическое исследование носителей и нанесенных металлических катализаторов. // Успехи химии, 1992, т. 61, вып. 2, с. 356-383.
150. Зюзин ДА. Локальная структура гидроксидных и оксидных соединений циркония и церия. // Дисс. на соискание уч. степени канд. хим. наук: 02.00.04, Институт катализа СО РАН, Новосибирск, 2005.
// Дисс. на соискание уч. степени канд. хим. наук: 02.00.04, Институт катализа СО РАН, Новосибирск, 2005.
151. Буянова Н.Е., Карнаухов А.П., Алабужев Ю.А. Определение поверхности дисперсных и пористых материалов. // Новосибирск: ИК СО АН СССР, 1978.
152. Ушаков В.А., Мороз Э.М. Рентгенографическое исследование оксидов алюминия. I. Анализ дифракционных картин. // Кинетика и катализ, 1985, т. 26, № 4, с. 963-967.
153. ASTM Diffraction Data Cards and Alphabetical and Grouped Numerical Index of X-Ray Diffraction Data. // Philadelphia: ASTM, 1967.
154. Violante A., Huang P.M. Formation Mechanism of Aluminum Hydroxide Polymorphs // Clays and Clay Minerals, 1993, v. 41, p. 590-597.
155. Yamaguchi G., Chiu W. The Hydration and Crystallization of p-Alumina and Alumina-gel in Aqueous Solutions of Various Basic Reagents. // Bull. Chem. Soc. Jpn., 1968, v. 41, p. 348-353.
156. Andryushkova О. V., Kirichenko O.A., Ushakov V.A. Thermal stability of low-temperature alumina sorbents and catalysts. // Studies in surface science and catalysis, 1998, v. 120, p. 587-619.
// Studies in surface science and catalysis, 1998, v. 120, p. 587-619.
157. Чукин Г.Д., Сергиенко C.A., Селезнев Ю.Л., Малевич В.И., Радченко Е.Д. Инфракрасные спектры оксида алюминия, модифицированного молибденом. // Ж. прикл. спектроскопии, 1987, т.47, № 3, с. 427-432.
158. Сеченя И.Н., Чувылкин Н.Д., Казанский В.Б. Квантово-химическое исследование взаимодействия молекул азота и оксида углерода с лыоисовскими кислотными центрами оксида алюминия. // Кинетика и катализ, 1986, т. 27, № 3, с. 608-613.
159. Данюшевский В.Г. Конформационный анализ органических молекул. // М.: Химия, 1982, 232 с.
160. БокийГ.Б. Кристаллохимия. //М.: Наука, 1971, 400 с.
161. Digne М„ Sautet P., Raybaud P., Euzen P., Toulhoat Н. Hydroxyl Groups on 7-Alumina Surfaces: A DFT Study. // J. Catal., 2002, v. 211, p. 1-5.
162. Mangnus P.J., Van Veen J.A.R., Eijsbouts S., De Beer V.H.J., Moulijn J.A. Structure of phosphorus containing CoO—M0O3/AI2O3 catalysts. // Appl. Catal., 1990, v. 61, p. 99-122.
61, p. 99-122.
163. Mangnus P. J., van Langeveld A.D., De Beer V.H.J., Moulijn J.A. Influence of phosphate on the structure of sulfided alumina supported cobalt-molybdenum catalysts. // Appl. Catal., 1991, v. 68, p. 161-177.
164. Okamoto Y., Ochiai K., Kawano M., Kobayashi K., Kubota T. Effects of support on the activity of Co-Mo sulfide model catalysts. // Appl. Catal. A, 2002, v. 226, p. 115-127.
165. Li H., Shen B., Zhang IV., Zhao Y., WangX., Zhang Z., Shen S. Effect of the incorporation of ETS-10 into alumina on metal-support interactions and hydrodesulfurization activity. // Fuel, 2006, v. 85, p. 2445-2449.
166. Hadjiivanov K.I., Vayssilov G.N. Characterization of oxide surfaces and zeolites by carbon monoxide as an IR probe molecule. I I Adv. Catal., 2002, v. 47, p. 307-511.
167. Vaqueiro P., Kosidowski M.L., Powell A.V. Structural Distortions of the Metal Dichalcogenide Units in AM02S4 (A = V, Cr, Fe, Co) and Magnetic and Electrical Properties//Chem. Mater.,T002, v. 14, p. 1201 -1209.1. БЛАГОДАРНОСТИ
Mater.,T002, v. 14, p. 1201 -1209.1. БЛАГОДАРНОСТИ
Формула оксида алюминия. Структура, свойства, применение, примерные вопросы
Оксид алюминия представляет собой химическое вещество, состоящее из атомов алюминия и кислорода. Алюминий теряет в химическом процессе три электрона, тогда как кислород приобретает два. Его часто называют глиноземом. Альфа-глинозем, глинозем, алунд или алкоксид — другие его названия. Оксид алюминия представляет собой белое аморфное вещество без запаха. Благодаря своим многочисленным полезным свойствам это химическое вещество вносит значительный вклад в широкий спектр приложений для продления жизни и социального обеспечения. Его также можно найти в бокситах.
Формула оксида алюминия
Оксид алюминия встречается в природе в виде корунда, рубинов, сапфиров и изумрудов. Это щелочноземельное соединение, которое взаимодействует как с кислотами, так и с основаниями. Он выглядит белым и существует в виде твердого тела.
Не имеет запаха и не растворяется в воде. Эта молекула чаще всего встречается в кристаллической форме, известной как -оксид алюминия или корунд. Из-за своей твердости он обычно используется в качестве абразива и в режущих инструментах.
Эта молекула чаще всего встречается в кристаллической форме, известной как -оксид алюминия или корунд. Из-за своей твердости он обычно используется в качестве абразива и в режущих инструментах.
Химическая формула оксида алюминия: Al 2 O 3 неорганический химический реагент .
Структура оксида алюминия
Два атома алюминия связываются с двумя атомами кислорода каждый, образуя структуру оксида алюминия, что означает, что он имеет три атома кислорода.
Физические свойства оксида алюминия
- Оксид алюминия представляет собой беловатое твердое вещество.
- Нерастворим в воде, а также во всех других растворителях.
- Хотя оксид алюминия является электрическим изолятором, он проявляет теплопроводность в керамическом материале.
- Оксид алюминия имеет относительно высокие температуры плавления (2345К) и кипения (3250К).
- Оксид алюминия имеет плотность 3,987 г/см 3 .

Химические свойства оксида алюминия
- Алюминат натрия и вода образуются при взаимодействии оксида алюминия с гидроксидом натрия. Эта реакция протекает при температуре от 900 до 1100°С. Эта реакция, в которой оксид алюминия служит кислотой, дает соль и воду.
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O
- Металлические оксиды, как правило, являются основными по своей природе, хотя оксиды алюминия являются ампероксидами. Как следствие, он действует как кислота и как основание. В этом случае он действует не как кислота, а как основание.
Алюминий 2 О 3 + Н 2 SO 4 → Al 2 (SO4) 3 + H 2 O
Это называется реакцией нейтрализации.
- Оксид алюминия содержит оксид-ионы, поэтому взаимодействует с кислотами аналогично оксидам натрия или магния.
 Раствор хлорида алюминия образуется при взаимодействии оксида алюминия с горячей разбавленной соляной кислотой.
Раствор хлорида алюминия образуется при взаимодействии оксида алюминия с горячей разбавленной соляной кислотой.
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Использование оксида алюминия
- Оксид алюминия в основном используется в качестве абразива из-за его твердости и прочности. Оксид алюминия используется в качестве заменителя технического алмаза при производстве наждачной бумаги, режущих инструментов и других изделий.
- Чаще всего используется в качестве керамического материала.
- Используется как пластиковый наполнитель.
- Часто используется в качестве ингредиента солнцезащитного крема, губной помады, румян и краски для ногтей.
- Используется в производстве стекла. а алюмосиликатное стекло представляет собой обычное стекло, содержащее оксид алюминия. Алюмосиликатное стекло содержит 5–10 % оксида алюминия.
- Используется в качестве катализатора в различных промышленных процессах.
 Например, оксид алюминия используется в качестве катализатора в процессе Клауса, который превращает сероводородные отходы в элементарную серу.
Например, оксид алюминия используется в качестве катализатора в процессе Клауса, который превращает сероводородные отходы в элементарную серу. - Оксид алюминия можно использовать для удаления воды из газовых потоков.
- Хлопья оксида алюминия используются в красках для придания отражающего или декоративного вида.
- Оксид алюминия используется в качестве электрического изолятора в интегральных схемах.
- Прозрачный оксид алюминия используется в натриевых лампах и компактных люминесцентных лампах.
Примеры вопросов
Вопрос 1. Вреден ли оксид алюминия для человека?
Ответ:
По сравнению с другими химическими веществами оксид алюминия менее опасен. Однако при увеличении концентрации увеличивается токсичность.
Вопрос 2: Каково назначение оксида алюминия?
Ответ:
Оксид алюминия представляет собой высококачественный керамический оксид, используемый в различных целях в производстве адсорбентов и катализаторов.
Он также используется в аэрокосмической промышленности и в производстве различных экономически важных химических веществ.
Вопрос 3: Что такое оксид алюминия кислотный или основной?
Ответ:
Оксид алюминия (III) является амфотерным оксидом металла, что означает, что он обладает как кислотными, так и основными свойствами. Кислотный или основной характер Al 2 O 3 определяется природой другого реагента в химическом процессе.
Вопрос 4: Какие жидкости реагируют с алюминием?
Ответ:
При соединении алюминия с разбавленной соляной кислотой образуются хлорид алюминия и газообразный водород. При комнатной температуре хлор и жидкий бром реагируют с алюминием.
Вопрос 5: Почему алюминий не может реагировать с водой?
Ответ:
Металлический алюминий быстро образует тонкое покрытие из оксида алюминия толщиной в несколько миллиметров, что препятствует его реакции с водой.
Когда этот слой подвергается коррозии, происходит реакция, в результате которой выделяется чрезвычайно горючий газообразный водород.
Вопрос 6: Является ли оксид алюминия газом?
Ответ:
Al 2 O обычно встречается в виде газа, поскольку твердое состояние не стабильно при комнатной температуре и стабильно только при температуре от 1050 до 1600°C. Оксид алюминия(I) получают кипячением Al и Al 2 O 3 в вакууме в присутствии SiO 2 и C с последующей конденсацией продуктов.
Оксиды алюминия: глинозем и алюмосиликаты | Химия наноструктур оксидов металлов: синтез из водных растворов
Фильтр поиска панели навигации Oxford AcademicНаноструктуры оксидов металлов Химия: синтез из водных растворовФизическая химияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicНаноструктуры оксидов металлов Химия: синтез из водных растворовФизическая химияКнигиЖурналы Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Жоливе, Жан-Пьер,
‘Оксиды алюминия: алюминия и алюминосиликаты’
,
Наноструктура наноструктуры металлов Химия: Синтез из водных растворов
(
New York,
2019;
Online Edn,
Oxcord Academer,
Online EDN,
OXFORD ACADIMEN,
,
Academic,
,
. , 2020
, 2020
), https://doi.org/10.1093/oso/97801
117.003.0009,, по состоянию на 2 октября 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicНаноструктуры оксидов металлов Химия: синтез из водных растворовФизическая химияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicНаноструктуры оксидов металлов Химия: синтез из водных растворовФизическая химияКнигиЖурналы Термин поиска на микросайте
Advanced Search
Abstract
Алюминий является третьим наиболее распространенным элементом в земной коре (8,3% по массе) после кислорода (45,5%) и кремния (27,2%). Образует в природе различные кислородсодержащие минеральные фазы: гидроксиды Al(OH) 3 , оксигидроксиды AlOOH, основной рудой которых является боксит, и оксиды Al 2 O 3 , глинозем. Корунд, α-Al 2 O 3 , входит в состав многих драгоценных камней: сапфира (чистый Al 2 O 3 , совершенно бесцветный), рубин (красный из-за присутствия ионов Cr 3+ ) и синий сапфир (синий из-за присутствия ионов Ti 4+ и Fe 2+ ), среди многих других . Содержание посторонних элементов, замещающих ионы Al 3+ в этих фазах, составляет лишь небольшой процент от общего количества. Алюминий также образует много природных фаз в сочетании с различными элементами, особенно с кремнием в алюмосиликатах, таких как полевые шпаты, глины, цеолиты, аллофаны и имоголиты. В биохимическом круговороте элементов участвуют многие растворимые в природных водах комплексы алюминия [1, 2].
Образует в природе различные кислородсодержащие минеральные фазы: гидроксиды Al(OH) 3 , оксигидроксиды AlOOH, основной рудой которых является боксит, и оксиды Al 2 O 3 , глинозем. Корунд, α-Al 2 O 3 , входит в состав многих драгоценных камней: сапфира (чистый Al 2 O 3 , совершенно бесцветный), рубин (красный из-за присутствия ионов Cr 3+ ) и синий сапфир (синий из-за присутствия ионов Ti 4+ и Fe 2+ ), среди многих других . Содержание посторонних элементов, замещающих ионы Al 3+ в этих фазах, составляет лишь небольшой процент от общего количества. Алюминий также образует много природных фаз в сочетании с различными элементами, особенно с кремнием в алюмосиликатах, таких как полевые шпаты, глины, цеолиты, аллофаны и имоголиты. В биохимическом круговороте элементов участвуют многие растворимые в природных водах комплексы алюминия [1, 2].
Оксиды и оксиды (гидрокси) алюминия являются важными материалами и наноматериалами, используемыми во многих областях: например, в качестве активной фазы для адсорбции при очистке воды; в качестве инертного носителя и активной фазы в катализе; в качестве активной фазы в огнестойких полимерах; как огнеупорный материал для лабораторных приборов и в керамической промышленности; и в качестве абразивов [3, 4]. Глинозем Al 2 O 3 производится в различных формах (трубки, шарики, волокна и порошки) для различных промышленных применений (лабораторные инструменты, фильтрационные мембраны, шарикоподшипники, мелкие порошки в качестве носителей катализа и т. д.).
Глинозем Al 2 O 3 производится в различных формах (трубки, шарики, волокна и порошки) для различных промышленных применений (лабораторные инструменты, фильтрационные мембраны, шарикоподшипники, мелкие порошки в качестве носителей катализа и т. д.).
Структурная химия окси(гидрокси)десов алюминия богата. Существуют различные гидроксиды Al(OH) 3 (гиббсит, также называемый гидраргиллит, байерит и некоторые другие политипы, такие как нордстрандит и дойлеит), оксигидроксиды AlOOH (бемит и диаспор) и ряд оксидов Al 2 O 3 , так называемые переходные оксиды алюминия. Эти последние фазы имеют разную степень гидратации и разную степень упорядоченности катионов Al 3+ внутри кубической плотной упаковки атомов кислорода в зависимости от температуры, при которой они находились. Они относятся к различным структурным типам (γ, δ, θ, η, κ и др.). Эти оксиды алюминия с большой удельной поверхностью обычно используются в катализе, особенно γ-оксид алюминия с кристаллической структурой шпинели.
Ключевые слова: Структура Кеггина, боксит, корунд, поликатион галлия, имоголит, каолинит, монтмориллонит, пирофиллит, смектит, зуньит
Тема
Физическая химия
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр ваших зарегистрированных учетных записей
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
Покупка
Наши книги можно приобрести по подписке или приобрести в библиотеках и учреждениях.
Информация о покупке
Частицы оксида алюминия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Частицы оксида алюминия
Номер продукта: Все применимые коды продуктов American Elements, например AL-OX-02-PTCS , АЛ-ОКС-03-ПТС , АЛ-ОКС-04-ПТС , AL-OX-05-PTCS
Номер CAS: 1344-28-1
Соответствующие установленные области применения вещества: Научные исследования и разработки
Сведения о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
0 Телефон службы экстренной помощи 100003
07 , Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
Вещество не классифицируется как опасное для здоровья или окружающей среды согласно регламенту CLP.
Классификация в соответствии с Директивой 67/548/ЕЭС или Директивой 1999/45/ЕС
Н/Д
Информация об особых опасностях для человека и окружающей среды:
Нет данных
Опасности, не классифицированные иначе
Нет данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Указания на опасность
Н/Д
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0–4)
(Система идентификации опасных материалов)
Здоровье (острые воздействия) = 1
Воспламеняемость = 0
Физическая опасность = 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: нет данных
vPvB: N/A
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ Вещества
Номер CAS / Название вещества:
1344-28-1 Оксид алюминия
Идентификационный номер(а):
Номер ЕС: 1-215-69 6
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5.
 МЕРЫ ПОЖАРОТУШЕНИЯ
МЕРЫ ПОЖАРОТУШЕНИЯ Средства пожаротушения
Подходящие средства пожаротушения
Продукт негорючий. Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть высвобождены следующие вещества:
Дым оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и чрезвычайные меры
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания продукта в канализацию, канализационные системы или другие водоемы.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации по средствам индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия безопасного хранения, включая любые несовместимости
Требования, предъявляемые к складским помещениям и емкостям:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Не хранить вместе с кислотами.
Хранить вдали от прочных оснований.
Хранить вдали от окислителей.
Хранить вдали от галогенов.
Хранить вдали от галогеноуглеродов.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Конкретное конечное применение
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем: не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующими контроля на рабочем месте:
1344-28-1 Оксид алюминия (100,0%)
PEL (США) Долговременное значение: 15*; 15** мг/м 3
*Общая пыль; ** Вдыхаемая фракция
REL (США) Долговременное значение: 10* 5** мг/м 3
*Общая пыль ** Вдыхаемая фракция
TLV (США) Долгосрочное значение: 1* мг/м 3 как Al; *в виде вдыхаемой фракции
EL (Канада) Долгосрочное значение: 10 мг/м 3
EV (Канада) Долговременное значение: 10 мг/м 3 общая пыль
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
При наличии высоких концентраций используйте подходящий респиратор.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа N95 (США) или PE (EN 143) в качестве резервного средства технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук: Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Материал перчаток
Нитриловый каучук, NBR
Время проникновения материала перчаток (в минутах)
480
Толщина перчаток
0,11 мм
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Порошок или твердое вещество в различных формах
Цвет: Белый
Запах: Без запаха
Порог запаха: Нет данных.
pH: неприменимо
Точка плавления/диапазон плавления: 2045 °C (3713 °F)
Точка кипения/диапазон кипения: 2980 °C (5396 °F)
Температура сублимации/начало: Данные отсутствуют газ): нет данных.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров при 2158 °C (3916 °F): 1,33 гПа (1 мм рт. ст.)
ст.)
Плотность при 20 °C (68 °F): 3,965 г/см 3 (33,088 фунта/гал)
Относительная плотность: Данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): Нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Данные отсутствуют
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Реагирует с сильными окислителями
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Кислоты
Основания
Окислители
Галогены
Галогенуглероды
Опасные продукты разложения:
Дым оксида металла
РАЗДЕЛ 11.
 ИНФОРМАЦИЯ О ТОКСИЧНОСТИ
ИНФОРМАЦИЯ О ТОКСИЧНОСТИ Информация о токсикологическом воздействии
Острая токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности для этого вещества.
Значения LD/LC50, важные для классификации: Нет данных
Раздражение или коррозия кожи: Может вызывать раздражение
Раздражение или коррозия глаз: Может вызывать раздражение
Повышение чувствительности: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность:
ACGIH A4: Не классифицируется как канцероген для человека: Недостаточно данных для классификации агента с точки зрения его канцерогенности для людей и/или животных.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об онкогенности, и/или канцерогенности, и/или новообразованиях для этого вещества.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Влияние не известно.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при многократном приеме для этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
Канцерогенные категории
OSHA-Ca (Управление по безопасности и гигиене труда)
Вещество не указано.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Потенциал биоаккумуляции
Нет данных
Подвижность в почве
Нет данных
Дополнительная экологическая информация:
Избегать попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные воздействия
Данные отсутствуют
РАЗДЕЛ 13.
 РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ Методы обработки отходов
Рекомендация
Проконсультируйтесь с официальными правилами, чтобы обеспечить надлежащую утилизацию.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Класс опасности при транспортировке 07 90 DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
Н/Д
Опасности для окружающей среды:
Н/Д
Особые меры предосторожности для пользователей Дополнительная информация:
DOT
Загрязнитель морской среды (DOT):
№
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Закон о контроле за токсичными веществами Агентства по охране окружающей среды США Инвентаризация химических веществ.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
1344-28-1 Оксид алюминия
Предложение штата Калифорния 65
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Удаление оксида с алюминия на производственных линиях (3 метода)
Удаление оксида с алюминия обычно является необходимым злом для обеспечения производства высококачественных деталей. Если вы раньше очищали оксиды вручную, вы, вероятно, много тратили на ручной труд и с трудом добивались стабильных результатов.
Лазерная, механическая и электрохимическая очистка эффективно удаляют оксиды и другие загрязнения с алюминиевых поверхностей. Все эти методы могут быть автоматизированы или выполняться вручную. Давайте посмотрим, как они работают и каковы их преимущества и недостатки.
Расскажите нам о своем применении
Очистка оксидов алюминия с помощью лазерной технологии
Волоконные лазеры удаляют оксиды, направляя лазерный луч на поверхность детали. Луч нагревает оксиды и поверхностные загрязнения до такой степени, что они испаряются в виде дыма.
Автоматическое лазерное удаление оксида
Лазерное удаление оксида легче автоматизировать, чем другие технологии. На самом деле многие встроенные решения уже существуют. Поскольку лазерные системы не имеют движущихся частей, они требуют минимального обслуживания. И в отличие от механической и электрохимической очистки, лазеры работают без расходных материалов. В результате они очень хорошо подходят для автоматизации и могут работать круглосуточно и без выходных в течение всего года с минимальным временем простоя.
Автоматическая лазерная очистка идеально подходит для случаев, когда необходимо удалить оксиды и загрязнения с определенных участков, например, до и после сварки. Также было доказано, что он очень хорошо работает в качестве предварительной обработки для склеивания.
Лазерное удаление оксидов вручную
Вы можете удалить оксиды вручную с помощью ручного лазера. Поскольку этот тип лазера легко адаптируется к сложной геометрии и различным деталям, он лучше всего подходит для технического обслуживания и ремонта. Производители используют их для удаления оксидов до/после сварки, а также для улучшения электропроводности алюминия.
Поскольку портативные лазеры не находятся в корпусе лазера, для них требуются дополнительные меры безопасности. Например, оператору необходимо носить очки для защиты от лазерного излучения. Любой, кто не носит лазерные очки, должен находиться за пределами периметра безопасности, чтобы предотвратить попадание в глаза лазерного луча. В идеале портативные лазеры используются в помещении в контролируемой среде, но их также можно использовать на открытом воздухе с соблюдением надлежащих мер безопасности.
Недостатки лазерной технологии
Одним из недостатков лазерной очистки является то, что она может быть медленной, если вам нужно удалить толстый слой оксида алюминия или если вы очищаете большую алюминиевую поверхность. Другие методы, такие как механические щетки, могут быть лучше адаптированы для таких применений.
Другие методы, такие как механические щетки, могут быть лучше адаптированы для таких применений.
Механическая очистка алюминия
Оксид алюминия можно очистить, протирая поверхность вращающимися щетками. Эти щетки прекрасно работают даже с толстыми слоями оксида, превращая их в пыль. Щетки также могут одновременно удалять заусенцы, что делает их отличным выбором для очистки алюминия после резки.
Но имейте в виду: перед очисткой металлической поверхности может потребоваться удалить масло, жир и другие загрязнения ацетоном. Вам нужно сделать это, например, для сварочных приложений. С помощью лазерной очистки можно одновременно удалить все виды загрязнений с поверхности.
Автоматические щетки требуют частого контроля и обслуживания. Поскольку кисти быстро расходуются, качество результатов со временем снижается. Без тщательного контроля это приводит к противоречивым результатам и бракованным изделиям. Следовательно, процесс очистки алюминия необходимо часто останавливать для замены щеток.
Если у вас небольшой объем производства, вы можете удалить оксидную пленку вручную с помощью проволочной щетки из нержавеющей стали или стальной мочалки, но будьте готовы к тому, что придется немного повозиться.
Удаление оксидов с помощью химикатов
При электрохимической очистке для удаления оксидов с поверхности алюминия используются кислоты. Как только кислоты наносятся нагретой угольной щеткой, последующая химическая реакция удаляет оксиды со скоростью, которая варьируется в зависимости от температуры и уровня концентрации кислоты.
Затем необходимо удалить и нейтрализовать чистящее средство. Для этого сначала протирают поверхность влажной чистой тканью, затем наносят нейтрализующее средство и, наконец, смывают водой. Для сварных швов из нержавеющей стали может потребоваться последующее применение пассивирующего агента.
Электрохимическая очистка обычно выполняется вручную с помощью специального чистящего средства для алюминия, но ее также можно автоматизировать. Например, роботы могут использоваться для автоматического нанесения кислоты на сварные швы с помощью кисти или распылителя.
Недостатки химикатов
Электрохимическая очистка дает потрясающие результаты, качество которых не всегда можно воспроизвести с помощью других технологий, но она дорога, сложна в управлении и потенциально опасна. Если вы хотите внедрить эту технологию, вы должны быть готовы работать с ее ограничениями.
Управление химическими веществами может стать настоящей головной болью. Чтобы следовать правилам охраны окружающей среды и безопасности, вам необходимо убедиться, что вы получили все химические вещества, используемые в процессе очистки. Например, вам необходимо правильно хранить и утилизировать воду для полоскания.
Химические вещества также могут нанести серьезный вред вашим сотрудникам, если с ними не обращаться должным образом. Чтобы предотвратить это, список средств индивидуальной защиты довольно длинный. Работники должны носить химически стойкие перчатки, комбинезон, обувь и защитные очки для защиты тела, а также респиратор для защиты органов дыхания. Вам также может понадобиться закрытое помещение для процесса очистки, чтобы правильно управлять токсичными парами.
Чтобы предотвратить это, список средств индивидуальной защиты довольно длинный. Работники должны носить химически стойкие перчатки, комбинезон, обувь и защитные очки для защиты тела, а также респиратор для защиты органов дыхания. Вам также может понадобиться закрытое помещение для процесса очистки, чтобы правильно управлять токсичными парами.
Как выбрать наилучший метод удаления оксида алюминия
Теперь, когда вы хорошо понимаете три наиболее распространенных метода удаления оксида алюминия, у вас должно быть хорошее представление о том, какой метод подходит именно вам. Для лазерного удаления оксидов свяжитесь с нашими экспертами, чтобы обсудить ваш производственный процесс и выяснить, какие продукты лучше всего соответствуют вашим потребностям.
Связаться с экспертом по лазерной технике
обработка алюминия | История, добыча полезных ископаемых, переработка и факты
обработка алюминия
Посмотреть все СМИ
- Ключевые люди:
- Генри Дж.
 Кайзер
Кайзер
- Похожие темы:
- алюминий обработка материалов
См. все связанные материалы →
обработка алюминия , подготовка руды для использования в различных продуктах.
Алюминий или алюминий (Al) представляет собой серебристо-белый металл с температурой плавления 660 °C (1220 °F) и плотностью 2,7 грамма на кубический сантиметр. Самый распространенный металлический элемент, он составляет 8,1 процента земной коры. В природе встречается в химическом соединении с кислородом и другими элементами. В чистом виде он мягкий и пластичный, но его можно легировать многими другими элементами для повышения прочности и придания ему ряда полезных свойств. Сплавы алюминия легкие, прочные и поддаются формовке почти всеми известными процессами металлообработки. Они могут быть отлиты, соединены различными способами и легко обработаны, и они допускают широкий спектр отделки.
В дополнение к его низкой плотности многие области применения алюминия и его сплавов основаны на его высокой электро- и теплопроводности, высокой отражательной способности и устойчивости к коррозии. Своей коррозионной стойкостью он обязан непрерывной пленке оксида алюминия, которая быстро растет на зарождающейся поверхности алюминия, подвергаемой воздействию воздуха.
Своей коррозионной стойкостью он обязан непрерывной пленке оксида алюминия, которая быстро растет на зарождающейся поверхности алюминия, подвергаемой воздействию воздуха.
История
Раннее использование и добыча
До 5000 г. до н.э. люди в Месопотамии делали прекрасную керамику из глины, которая состояла в основном из соединения алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химических веществах и лекарствах. Плиний относится к алюмен , известный сейчас как квасцы, соединение алюминия, широко используемое в древнем и средневековом мире для закрепления красителей в текстиле. К 18 веку глинозем землистого происхождения был признан потенциальным источником металла.
Английский химик Хамфри Дэви в 1807 году попытался извлечь металл. Несмотря на неудачу, он убедился, что оксид алюминия имеет металлическую основу, которую он назвал алюминием , а позже изменил на алюминий . Название было сохранено в Соединенных Штатах, но изменено на 9. 0908 алюминий во многих других странах.
0908 алюминий во многих других странах.
Датский физик и химик Ганс Кристиан Эрстед в 1825 году, наконец, получил алюминий. «Он образует, — сообщал Эрстед, — кусок металла, который по цвету и блеску чем-то напоминает олово».
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Несколько лет спустя Фридрих Велер, немецкий химик из Геттингенского университета, получил металлический алюминий в виде частиц размером с булавочную головку и впервые определил следующие свойства алюминия: удельный вес, пластичность, цвет и стабильность на воздухе.
Алюминий оставался лабораторной диковинкой, пока французский ученый Анри Сент-Клер Девиль не объявил о значительном усовершенствовании метода Вёлера, которое позволило «булавочным головкам» Вёлера сливаться в куски размером с мрамор. Процесс Девиля стал основой алюминиевой промышленности. Слитки алюминия, изготовленные на химическом заводе Жавеля и выставленные в 1855 году на Всемирной выставке в Париже, представили публике новый металл.
Хотя тогда о свойствах алюминия было известно достаточно, чтобы указать на многообещающее будущее, стоимость химического процесса производства металла была слишком высока, чтобы его можно было широко использовать. Но важные улучшения в настоящее время привели к прорывам на двух фронтах: во-первых, процесс Девиля был улучшен; и, во-вторых, разработка динамо-машины сделала доступным большой источник энергии для электролиза, который оказался очень успешным при отделении металла от его соединений.
Работа Холла и Эру
Современный электролитический метод производства алюминия был открыт почти одновременно и совершенно независимо Шарлем Мартином Холлом из Соединенных Штатов и Полем-Луи-Туссеном Эру из Франции в 1886 году. (По странному совпадению оба мужчины родились в 1863 году и оба умерли в 1914 году.) Основы процессов Холла-Эру были идентичны и остаются основой сегодняшней алюминиевой промышленности. Очищенный глинозем растворяют в расплавленном криолите и подвергают электролизу на постоянном токе. Под действием тока кислород глинозема осаждается на угольном аноде и выделяется в виде углекислого газа, а свободный расплавленный алюминий, который тяжелее электролита, осаждается на угольной футеровке на дне электролизера.
Под действием тока кислород глинозема осаждается на угольном аноде и выделяется в виде углекислого газа, а свободный расплавленный алюминий, который тяжелее электролита, осаждается на угольной футеровке на дне электролизера.
Холл сразу осознал ценность своего открытия. 9 июля 1886 года он подал заявку на патент США и энергично работал над разработкой процесса. С другой стороны, Эру, хотя и подал заявку на патент несколькими месяцами ранее, по-видимому, не понял значения процесса. Он продолжил работу над вторым успешным процессом получения алюминиево-медного сплава. К счастью, в 1888 году австрийский химик Карл Йозеф Байер открыл усовершенствованный метод получения чистого глинозема из бокситовых руд с низким содержанием кремнезема.
Холл и группа бизнесменов основали Pittsburgh Reduction Company в 1888 году в Питтсбурге. Первый слиток был отлит в ноябре того же года. Спрос на алюминий рос, и в Нью-Кенсингтоне, штат Пенсильвания, был построен более крупный восстановительный завод, который к 1894 году использовал электричество, вырабатываемое паром, для производства одной тонны алюминия в день. Потребность в дешевой и обильной гидроэлектроэнергии привела молодую компанию к Ниагарскому водопаду. где в 1895 году он стал первым заказчиком новой разработки электростанции Ниагарского водопада.
Потребность в дешевой и обильной гидроэлектроэнергии привела молодую компанию к Ниагарскому водопаду. где в 1895 году он стал первым заказчиком новой разработки электростанции Ниагарского водопада.
За короткое время спрос на алюминий превзошел самые оптимистичные ожидания Холла. В 1907 году компания сменила название на Aluminium Company of America (Alcoa). До Второй мировой войны он оставался единственным производителем первичного алюминия в США, но за полвека в Соединенных Штатах насчитывалось 15 первичных производителей.
Европейская промышленность
Нойхаузен, Швейцария, является «питомником» европейской алюминиевой промышленности. Там, чтобы воспользоваться гидроэнергией водопада Рейна, Эру построил свой первый завод по производству алюминия и бронзы, который позже стал Aluminium-Industrie-Aktien-Gesellschaft. Британская алюминиевая компания с ограниченной ответственностью, организованная в 189 г.4, вскоре осознал богатство дешевой электроэнергии, доступной в Норвегии, и сыграл важную роль в строительстве алюминиевых заводов в Стонгфьорде в 1907 году, а затем в Вигеланде. Во Франции Société Électrométallurgique Française, также основанное на патенте Эру, было основано около Гренобля около 1888 года. В 1899 году в Ленде, Австрия, был запущен алюминиевый завод. спроса, и несколько плавильных заводов начали производство электроэнергии, вырабатываемой паровой энергией. Позднее СССР начал производить значительные объемы алюминия в Уральском промышленном комплексе, а к 1990 первичных металлов производилось в 41 стране мира. Крупнейший в мире алюминиевый завод (мощностью один миллион тонн в год) расположен в сибирском городе Братске.
Во Франции Société Électrométallurgique Française, также основанное на патенте Эру, было основано около Гренобля около 1888 года. В 1899 году в Ленде, Австрия, был запущен алюминиевый завод. спроса, и несколько плавильных заводов начали производство электроэнергии, вырабатываемой паровой энергией. Позднее СССР начал производить значительные объемы алюминия в Уральском промышленном комплексе, а к 1990 первичных металлов производилось в 41 стране мира. Крупнейший в мире алюминиевый завод (мощностью один миллион тонн в год) расположен в сибирском городе Братске.
Как получить алюминий – основные методы
[Депозитные фотографии] Алюминий – это металл, который используется во многих сферах человеческой деятельности. Этот элемент широко распространен в природе, но не встречается в чистом виде. Это связано с тем, что алюминий обладает высокой химической активностью и может вступать в химические реакции с различными элементами. Благодаря этой особенности получение свободного алюминия является трудоемким и сложным процессом. Давайте рассмотрим это подробно.
Благодаря этой особенности получение свободного алюминия является трудоемким и сложным процессом. Давайте рассмотрим это подробно.
Сырье для производства металла
Алюминий получают из бокситов, которые находятся в значительных слоях на поверхности земли и содержат около 50 % оксидов и гидратов оксидов алюминия. Химический состав бокситов сложен; эта алюминиевая руда содержит около 20% кремниевой земли, от 30% до 70% алюминиевых сланцев и до 10% оксида титана. Оксиды железа в бокситах могут составлять от 2% до 50%. Квасцовые сланцы, содержащие оксид алюминия, состоят из каолинита, корунда и гидроксида алюминия.
[Депозитные фотографии] С недавнего времени алюминий получают из нефелинов и алунитов, состоящих из кремния, оксида калия и оксида натрия.
Для производства одной тонны чистого алюминия необходимо переработать две тонны алюминиевых сланцев. Для производства двух тонн квасцового сланца необходимо переработать 4,5 тонны бокситов.
Для производства двух тонн квасцового сланца необходимо переработать 4,5 тонны бокситов.
Запасы бокситов на Земле относительно скудны. Страны с большими месторождениями бокситов могут производить алюминий в промышленных масштабах — Бразилия, Австралия, Гвинея, Китай, Индия, Турция, Греция, Суринам, Венесуэла, Ямайка и Россия.
Как зародилось производство алюминия
через GIPHY
Первым ученым, выделившим алюминий в свободной форме, был датский физик Эрстед в 1825 году. Эрстед провел химическую реакцию амальгамы калия и хлорида алюминия. Два года спустя немецкий физик Вёлер заменил амальгаму калия металлическим калием. Так как калий — дорогостоящий материал, который нерентабельно использовать в промышленном производстве, ученые искали замену этому элементу. В 1854 году французский ученый Девиль начал использовать натрий, а также прочный двойной хлорид натрия и алюминия.
Позже производство алюминия стало осуществляться с использованием магния из расплавленного криолита – эту технологию изобрел русский ученый Бекетов, но впервые в промышленном производстве применили немцы в 1880-х годах. В Германии был построен первый завод по производству алюминия, но производство металла оставалось очень дорогим.
В 1886 году алюминий был впервые получен с помощью реакции электролиза. Этот метод был запатентован практически одновременно двумя учеными – Эру из Франции и Холлом из США.
Процесс Холла-Эру для производства алюминия [Викимедиа] Оба физика предложили растворять оксид алюминия в расплавленном криолите, после чего алюминий должен был быть получен электролизом. Благодаря Эру и Холлу в 1886 году началась эра промышленного производства алюминия. Нажмите здесь, чтобы узнать больше интересных фактов об алюминии.
Технология производства алюминия — этапы
В 21 веке до сих пор используется технология производства алюминия, разработанная в 1886 году. Процесс включает три стадии: сначала из нефелинов или бокситов получают оксид алюминия, затем из него извлекают технический алюминий с уровнем чистоты 99,5%. Для некоторых промышленных целей этого недостаточно, поэтому на последней стадии металл очищается до 99,99%.
Получение оксида алюминия
[Викимедиа]Оксид алюминия можно получить тремя способами:
- электролитический;
- кислый;
- щелочной.
Наиболее распространен третий метод, который совершенствовался и развивался с момента его изобретения в 18 веке. Бокситы измельчают с известью и едкой щелочью, затем плавят в автоклаве при температуре 250 °С, в результате чего происходит химическое разложение боксита с образованием алюмината натрия. Полученное вещество разбавляют щелочным раствором, отделяют от шлама и промывают в осушителях. После того, как алюминат натрия разложится, его прокачивают через фильтры и перемешивают, добавляя твердый гидроксид алюминия в качестве затравки к оставшемуся остатку гидроксида алюминия из раствора. Затем гидроксид алюминия нагревают для получения оксида алюминия. Это первая стадия получения металлического алюминия.
Полученное вещество разбавляют щелочным раствором, отделяют от шлама и промывают в осушителях. После того, как алюминат натрия разложится, его прокачивают через фильтры и перемешивают, добавляя твердый гидроксид алюминия в качестве затравки к оставшемуся остатку гидроксида алюминия из раствора. Затем гидроксид алюминия нагревают для получения оксида алюминия. Это первая стадия получения металлического алюминия.
Электролиз оксида алюминия
Реакцию электролиза проводят в специальной ванне с электрическим током, футерованной углеводородными блоками. В ванну погружают угольные аноды, которые сгорают с выделением чистого кислорода из оксида алюминия и образуют монооксид и диоксид углерода.
Электролизеры постепенно включаются в электрическую цепь, образуя ряд. Аноды могут быть прокаленными из крупных угольных блоков массой более одной тонны, и самокальцинирующими, состоящими из угольных блоков в алюминиевой оболочке, которые обжигаются при высоких температурах в процессе электролиза.

 В качестве
основного стабилизирующего компонента они содержат определенное количество воды
или других веществ.
В качестве
основного стабилизирующего компонента они содержат определенное количество воды
или других веществ.


 Тем более, что это соединение является перспективным источником для получения мелкодисперсного оксида алюминия. Исходные ААК были выделены из растворов сернокислотного разложения нефелинового концентрата их кристаллизацией при 15 oC с последующей перекристаллизацией для снижения содержания примесей. ААК состава (на сухое), % (мас.): 0,05–0,06 K2O; 0,06–0,07 Na2O гидролизовали путем обработки их газообразным аммиаком. Продукт аммонизации, представляющий собой смесь гидроксида алюминия (ГА) и сульфата аммония, выщелачивали водой. Суспензию фильтровали, а осадок ГА тщательно промывали. Гидроксид алюминия подвергали автоклавной обработке растворами карбоната аммония, варьируя их концентрацию, а также продолжительность и температуру процесса. Продукт реакции анализировали методами ИК-спектроскопии, дифференциально-термического и рентгенофазового анализов. Установлено, что во всех случаях образовался NH4AlCO3(OH)2. Термообработкой образцов NH4AlCO3(OH)2 при 550 oC был получен оксид алюминия в γ-форме с содержанием примесей K2O и Na2O менее 0,02 % (мас.
Тем более, что это соединение является перспективным источником для получения мелкодисперсного оксида алюминия. Исходные ААК были выделены из растворов сернокислотного разложения нефелинового концентрата их кристаллизацией при 15 oC с последующей перекристаллизацией для снижения содержания примесей. ААК состава (на сухое), % (мас.): 0,05–0,06 K2O; 0,06–0,07 Na2O гидролизовали путем обработки их газообразным аммиаком. Продукт аммонизации, представляющий собой смесь гидроксида алюминия (ГА) и сульфата аммония, выщелачивали водой. Суспензию фильтровали, а осадок ГА тщательно промывали. Гидроксид алюминия подвергали автоклавной обработке растворами карбоната аммония, варьируя их концентрацию, а также продолжительность и температуру процесса. Продукт реакции анализировали методами ИК-спектроскопии, дифференциально-термического и рентгенофазового анализов. Установлено, что во всех случаях образовался NH4AlCO3(OH)2. Термообработкой образцов NH4AlCO3(OH)2 при 550 oC был получен оксид алюминия в γ-форме с содержанием примесей K2O и Na2O менее 0,02 % (мас. ). Определены удельная поверхность и пористость образцов γ-Al2O3, которые составили 374–406 м2/г и 0,72–0,81 см3/г соответственно. Такие образцы γ-Al2O3 по своим характеристикам могут быть использованы для получения катализаторов, адсорбентов и осушителей. Рентгенофазовый анализ продуктов термообработки γ-Al2O3 при 1100–1250 oC в течение 1 ч показал, что уже при 1150 oC он практически полностью переходит в корунд, что свидетельствует о высокой активности полученного оксида алюминия к спеканию и предопределяет возможность его использования для получения алюмооксидной керамики. На основании проведенных исследований показана возможность получения оксида алюминия с пониженным содержанием примесей. Разработана принципиальная технологическая схема процесса на основе переработки алюмоаммониевых квасцов, выделенных из нефелина.
). Определены удельная поверхность и пористость образцов γ-Al2O3, которые составили 374–406 м2/г и 0,72–0,81 см3/г соответственно. Такие образцы γ-Al2O3 по своим характеристикам могут быть использованы для получения катализаторов, адсорбентов и осушителей. Рентгенофазовый анализ продуктов термообработки γ-Al2O3 при 1100–1250 oC в течение 1 ч показал, что уже при 1150 oC он практически полностью переходит в корунд, что свидетельствует о высокой активности полученного оксида алюминия к спеканию и предопределяет возможность его использования для получения алюмооксидной керамики. На основании проведенных исследований показана возможность получения оксида алюминия с пониженным содержанием примесей. Разработана принципиальная технологическая схема процесса на основе переработки алюмоаммониевых квасцов, выделенных из нефелина.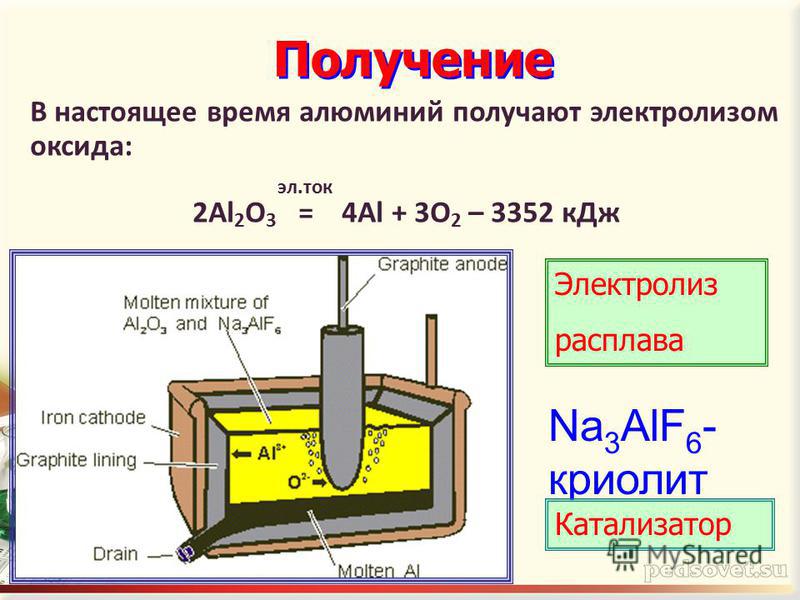 Иванова А. С. Оксид алюминия: применение, способы получения, структура и кислотно-основные свойства // Промышленный катализ в лекциях. 2009. № 8. С. 7–61.
Иванова А. С. Оксид алюминия: применение, способы получения, структура и кислотно-основные свойства // Промышленный катализ в лекциях. 2009. № 8. С. 7–61. Владимира Даля. 2014. № 9 (216). С. 15–18.
Владимира Даля. 2014. № 9 (216). С. 15–18. В., Першиков С. А., Харатян С. Ю. Методы получения оксида алюминия высокой степени чистоты для выращивания кристаллов лейкосапфира (обзор) // Химическая технология. 2017. № 9. С. 393–400.
В., Першиков С. А., Харатян С. Ю. Методы получения оксида алюминия высокой степени чистоты для выращивания кристаллов лейкосапфира (обзор) // Химическая технология. 2017. № 9. С. 393–400. Ammonium aluminium carbonate hydroxide NH4Al(OH)2CO3 as an alternative route for alumina preparation: Comparison with the classical boehmite precursor // Powder Technology. 2017. Vol. 320. P. 565–573.
Ammonium aluminium carbonate hydroxide NH4Al(OH)2CO3 as an alternative route for alumina preparation: Comparison with the classical boehmite precursor // Powder Technology. 2017. Vol. 320. P. 565–573. 2012. № 4. С. 46–49.
2012. № 4. С. 46–49. 2011. Vol. 25. P. 231–236.
2011. Vol. 25. P. 231–236.
 4pt’>
4pt’>
 Раствор хлорида алюминия образуется при взаимодействии оксида алюминия с горячей разбавленной соляной кислотой.
Раствор хлорида алюминия образуется при взаимодействии оксида алюминия с горячей разбавленной соляной кислотой. Например, оксид алюминия используется в качестве катализатора в процессе Клауса, который превращает сероводородные отходы в элементарную серу.
Например, оксид алюминия используется в качестве катализатора в процессе Клауса, который превращает сероводородные отходы в элементарную серу. Он также используется в аэрокосмической промышленности и в производстве различных экономически важных химических веществ.
Он также используется в аэрокосмической промышленности и в производстве различных экономически важных химических веществ. Когда этот слой подвергается коррозии, происходит реакция, в результате которой выделяется чрезвычайно горючий газообразный водород.
Когда этот слой подвергается коррозии, происходит реакция, в результате которой выделяется чрезвычайно горючий газообразный водород.