Как из оксида алюминия получить алюминий? Химические формулы
Алюминий обладает свойствами, которые применимы во многих промышленностях: военном деле, строительстве, питании, транспорте и др. Он пластичный, легкий и широко распространен в природе. Многие люди даже не подозревают того, как широко можно использовать алюминий.
Многие сайты и книги описывают этот чудесный металл и его свойства. Информация находится в свободном доступе.
В лаборатории можно производить любые соединения алюминия, но в малых количествах и по высоким ценам.
История добычи элемента
Вплоть до середины девятнадцатого века ни об алюминии, ни о восстановлении его оксида речи не шло. Первая попытка получения алюминия была предпринята химиком Х. К. Эрстедом и закончилась успешно. Чтобы восстановить металл из его оксида, он использовал амальгамированный калий. Но никто не понял, что получилось в итоге.
Прошло несколько лет, и алюминий снова был получен химиком Велером, который нагрел безводный хлорид алюминия с калием. Ученый упорно трудился 20 лет и, наконец, сумел создать гранулированный металл. По цвету он напоминал серебро, но был легче него в несколько раз. Длительное время до начала двадцатого века алюминий ценился больше золота и выставлялся в музеях как экспонат.
Где-то в начале XIX века английский химик Дэви провел электролиз оксида алюминия и получил металл, названный «алюмиум» или «алюминум», что можно переводить как «квасцы».
Алюминий очень трудно отделить от других веществ — это одна из причин его дороговизны в то время. Ученое собрание и промышленники быстро узнали о потрясающих свойствах нового металла и продолжили попытки его добычи.
В больших количествах алюминий стали получать уже в конце того же девятнадцатого века. Ученый Ч. М. Холлом предложил растворять оксид алюминия в расплаве криолита и пропускать эту смесь через электрический ток. Через какое-то время в сосуде появлялся чистый алюминий. В промышленности и сейчас производят металл этим методом, но об этом позже
Для производств нужна прочность, которой, как выяснилось чуть позднее, у алюминия не было. Тогда металл стали сплавлять с иными элементами: магнием, кремнием и т. д. Сплавы были намного прочнее обычного алюминия — именно из них стали выплавлять самолеты и военную технику. А придумали слить алюминий и другие металлы в единое целое в Германии. Там же, в Дюрене, сплав, названный дюралюминием, поставили на производство.
Как из оксида алюминия получить алюминий
В рамках школьной программы по химии проходят тему «Как из оксида металла получить чистый металл».
К этому методу мы можем отнести и наш вопрос, как из оксида алюминия получить алюминий.
Чтобы образовать металл из его оксида, нужно добавить восстановитель — водород. Пойдет реакция замещения с образованием воды и металла: МеО + Н2 = Ме + Н2О (где Ме — металл, а Н2 — водород).
Пример с алюминием: Al2О3 + 3Н2 = 2Al + 3Н2О
На практике такой прием позволяет получать чистые активные металлы, которые не восстанавливаются оксидом углерода. Метод подходит для очистки небольшого количества алюминия и довольно-таки дорого стоит.
Как получить алюминий из оксида алюминия через добавление более электроотрицательного металла
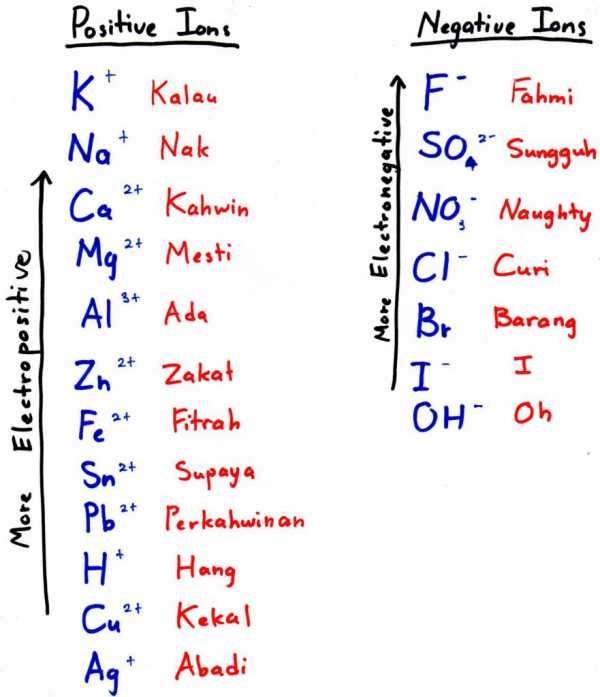
Чтобы получить алюминий этим способом, нужно подобрать более электроотрицательный металл и добавить его к оксиду — он вытеснит наш элемент из кислородного соединения. Более электроотрицательный металл — это тот, что стоит левее в электрохимическом ряду (на фото к подзаголовку — выше).
Примеры: 3Mg + Al2О3 = 2Al + 3MgO
6К + Al2О3 = 2Al + 3К2О
6Li + Al2О3 = 2Al + 3Li2О
Но как получить алюминий из оксида алюминия в условиях широкой промышленности?
Промышленный способ

Большинство производств для добычи элемента используют руды, которые называют бокситами. Сначала из них выделяют оксид, потом растворяют его в расплаве криолита, а затем получают чистый алюминий путем электрохимической реакции.
Это обходится дешевле всего и не требует дополнительных операций.
Кроме того, можно получить хлорид алюминия из оксида алюминия. Как это сделать?
Получение хлорида алюминия
Хлоридом алюминия называют среднюю (нормальную) соль из соляной кислоты и алюминия. Формула: AlCl3.
Для получения нужно добавить кислоту.
Уравнение реакции выглядит следующим образом — Al2О3 + 6HCl = 2AlCl3 + 3Н2О.
Как получить хлорид алюминия из оксида алюминия, не добавляя кислот?
Для этого надо прокалить спрессованную смесь оксида алюминия и углерода (сажа) в токе хлора при 600-800 гр. Хлорид должен отогнаться.
Эту соль применяют в качестве катализатора многих реакций. Ее главная роль — образование продуктов присоединения с разными веществами. Хлоридом алюминия протравливают шерсть, и его добавляют в антиперспиранты. Также соединение играет не последнюю роль в переработке нефти.
Получение гидроксоалюмината натрия

Как из оксида алюминия получить гидроксоалюминат натрия?
Чтобы получить это сложное вещество, можно продолжить цепочку превращений и сначала получить из оксида хлорид, а потом добавить гидроксид натрия.
Хлорид алюминия — AlCl3, гидроксид натрия — NaOH.
Al2O3 → AlCl3 → Na[Al(OH)4]
Al2О3 + 6HCl = 2AlCl3 + 3Н2О
AlCl3 + 4NaOH (концентрированный) = Na[Al(OH)4] + 3NaCl5
Но как из оксида алюминия получить тетрагидроксоалюминат натрия, избегая превращения в хлорид?
Чтобы из оксида алюминия получить алюминат натрия, нужно создать гидроксид алюминия и добавить к нему щелочь.
Следует напомнить, что щелочь — это основание, растворимое в воде. Сюда относят гидроксиды щелочных и щелочноземельных металлов (I и II группа таблицы Менделеева).
Al→ Al(ОН)3 → Na[Al(OH)4]
Из оксидов металлов средней активности, к которым относится алюминий, нельзя получать гидроксиды. Поэтому сначала мы восстановим чистый металл, например, через водород:
Al2О3 + 3Н2 = 2Al + 3Н2О.
А потом получим гидроксид.
Чтобы получить гидроксид, надо растворить алюминий в кислоте (для примера, во фтороводородной): 2Al + 6HF = 2AlF3 + 3Н2. А затем прогидролизовать полученную соль с добавлением равного количества щелочи в разбавленном растворе: AlF3 +3NaOH = Al(ОН)3 + 3NaF.
И дальше: Al(ОН)3 + NaOH = Na[Al(ОН)4]
(Al(ОН)3 — амфотерное соединение, которое может взаимодействовать и с кислотами, и с щелочами).
Тетрагидроксоалюминат натрия отлично растворяется в воде, а еще это вещество широко применяют в оформлении и добавляют в бетон, чтобы ускорить отвердевание.
Про метаалюминаты

Начинающие производители глинозема, наверное, задавались вопросом: «Как из оксида алюминия получить метаалюминат натрия?»
Алюминаты используются в широком производстве для ускорения некоторых реакций, окрашивания тканей и получения глинозема.
Лирическое отступление: глинозем — это, по сути, и есть оксид алюминия Al2О3.
Обычно оксид добывают из метаалюминатов, но здесь будет рассмотрен «обратный» способ.
Итак, чтобы получить наш алюминат, нужно просто смешать оксид натрия с оксидом алюминия при очень высокой температуре.
Случится реакция соединения — Al2О3 + Na2О = 2NaAlO2
Для нормального протекания требуется температура в 1200°C.
Можно проследить за изменением энергии Гиббса в реакции:
Na2O(к.)+ Al2O3(к.)= 2NaAlO2(к.), ΔG0298= -175 кДж.
Еще одно лирическое отступление:
Энергия Гиббса (или «свободная энергия Гиббса») — это зависимость, которая существует между энтальпией (энергией, доступной для преобразований) и энтропией (мерой «хаоса», беспорядка в системе). Абсолютное значение измерить невозможно, поэтому измеряются изменения во время протекания процесса. Формула: G (энергия Гиббса) = Н (изменение энтальпии между продуктами и исходными веществами реакции) — Т (температура) * S (изменение энтропии между продуктами и исходниками). Измеряется в Джоулях.
Как из оксида алюминия получить алюминат?
Для этого подойдет и тот способ, который был рассмотрен выше — с глиноземом и натрием.
Оксид алюминия, смешанный с оксидом другого металла при высоких температурах, и дает метаалюминат.
Но еще можно сплавить гидроксид алюминия со щелочью в присутствии оксида углерода СО:
Al(ОН)3 + NaOH = NaAlO2 + 2Н2О.
Примеры:
- Al2О3 + 2КОН = 2KAlO2 + Н2О (здесь глинозем растворяется в едкой щелочи калия) — алюминат калия;
- Al2О3 + Li2О = 2LiAlO2 — алюминат лития;
- Al2О3 + СаО = СаО × Al2О3 — сплавление оксида кальция с окисью алюминия.
Получение сульфата алюминия

Как получить сульфат алюминия из оксида алюминия?
Способ включен в школьную программу восьмых и девятых классов.
Сульфат алюминия — это соль вида Al2(SO4)3. Представлена может быть в виде пластинок или порошка.
Это вещество может разлагаться на оксиды алюминия и серы при температуре от 580 градусов. Сульфат используется для очистки воды от мельчайших частиц, очень полезен в пищевой, бумажной, тканевой и других отраслях производства. Он широко доступен благодаря своей низкой цене. Очистка воды происходит из-за некоторых особенностей сульфата.
Дело в том, что загрязняющие частицы имеют вокруг себя двойной электрический слой, а рассматриваемый реагент является коагулянтом, который, при проникновении в электрическое поле частиц, вызывает сжатие слоев и нейтрализует заряд частиц.
Теперь о самом методе. Чтобы получить сульфат, нужно смешать оксид и серную (не сернистую) кислоту.
Выходит реакция взаимодействия глинозема с кислотой:
Al2O3+3H2SO4=Al2(SO4)3+H2O
Вместо оксида можно добавить сам алюминий или его гидроксид.
В промышленности для получения сульфата используют уже известную из третьей части этой статьи руду — боксит. Ее обрабатывают серной кислотой и получают «загрязненный» сульфат алюминия. В боксите содержится гидроксид, а реакция в упрощенном виде выглядит так:
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
Бокситы
Боксит — это руда, состоящая сразу из нескольких минералов: железа, бемита, гиббсита и диаспора. Является главным источником добычи алюминия, образуется путем выветривания. Крупнейшие месторождения бокситов находятся в России (на Урале), США, Венесуэле (река Ориноко, штат Боливар), Австралии, Гвинее и Казахстане. Эти руды бывают моногидратными, тригидратными и смешанными.
Получение оксида алюминия
Про глинозем выше сказано много, но до сих пор не описано, как получить оксид алюминия. Формула — Al2О3.
А нужно всего-навсего сжечь алюминий в кислороде. Горение — процесс взаимодействия О2 и другого вещества.
Простейшее уравнение реакции выглядит следующим образом:
4Al + 3О2 = 2Al2О3
Оксид не растворяется в воде, но он хорошо растворим в криолите при высокой температуре.
Свои химические свойства оксид проявляет при температуре от 1000°С. Именно тогда он начинает взаимодействовать с кислотами и щелочами.
В естественных условиях корунд является единственный устойчивой вариацией вещества. Корунд очень твердый, с плотностью примерно 4000 г/м3. Твердость этого минерала по шкале Мооса — 9.

Оксид алюминия — амфотерный оксид. Легко преобразовывается в гидроксид (см. выше), а превратившись, сохраняет все свойства своей группы с преобладанием основных.
Амфотерные оксиды — это оксиды, которые могут проявлять как основные (свойства оксидов металлов), так и кислотные (оксидов неметаллов) свойства в зависимости от условий.
К амфотерным оксидам, исключая оксид алюминия, относятся: оксид цинка (ZnO), оксид бериллия (ВеО), оксид свинца (PbO), оксид олова (SnO), оксид хрома (Cr2О3), оксид железа (Fe2О3) и оксид ванадия (V2О5).
Соли: комплексные и не очень
Бывают средние (нормальные), кислые, основные и комплексные.
Средние соли состоят из самого металла и кислотного остатка и имеют вид AlCl3 (хлорид алюминия), Na2SO4 (сульфат натрия), Al(NO3)3 (нитрат алюминия) или MgPO4.
Кислые соли — это соли из металла, водорода и кислотного остатка. Их примеры: NaHSO4, CaHPO4.
Основные соли так же, как и кислые, состоят из кислотного остатка и металла, но вместо Н там ОН. Примеры: (FeOH)2SO4, Ca(OH)Cl.
И, наконец, комплексные соли — это вещества из ионов разных металлов и кислотного остатка многоосновной кислоты (соли, содержащие сложный ион): Na3[Co(NO2)6], Zn[(UO2)3(CH3COO)8].
Речь пойдет о том, как из оксида алюминия получить комплексную соль.
Условием превращения оксида в это вещество является его амфотерность. Глинозем отлично подходит для метода. Чтобы получить комплексную соль из оксида алюминия, нужно смешать этот оксид с раствором щелочи:
2NaOH + Al2O3 + H2O → Na2[Al(ОН)4]
Этот род веществ также образуется при воздействии растворов щелочей на амфотерные гидроксиды.
Раствор гидроксида калия взаимодействует с основанием цинка с получением тетрагидроксоцинката калия:
2KOH + Zn(OH)2 → K2[Zn(OH)4]
Раствор щелочи натрия реагирует, например, с гидроксидом берилия с образованием тетрагидроксобериллата натрия:
NaOH + Be(OH)2 → Na2[Be(OH)4]
Использование солей
Комплексные соли алюминия часто используют в фармацевтике, производстве витаминов и биологически активных веществ. Препараты, созданные на основе этих веществ, помогают в борьбе с похмельем, улучшают состояние желудка и общее самочувствие организма человека. Очень полезные соединения, как можно заметить.
Реактивы дешевле покупать в интернет-магазинах. Там большой выбор веществ, но сайты лучше выбирать надежные и проверенные временем. Если покупать что-то на «однодневках», то риск потерять деньги увеличивается.
При работе с химическими элементами нужно соблюдать правила безопасности: обязательно наличие перчаток, защитного стекла, специализированной посуды и приборов.
Эпилог
Химия – несомненно, сложная для понимания наука, но иногда полезно в ней разобраться. Проще всего это сделать через интересные статьи, простой слог и понятные примеры. Не лишним будет прочитать пару книг по теме и освежить в памяти курс школьной программы по химии.
Здесь было разобрано большинство тем химии, связанных с преобразованиями алюминия и его оксидов, в том числе, как из оксида алюминия получить тетрагидроксоалюминат, и еще множество интересных фактов. Оказалось, что у алюминия есть много самых необычных сфер применения в производстве и в быту, да и история получения металла весьма незаурядна. Химические формулы соединений алюминия тоже заслуживают внимания и подробного разбора, что и было освящено в этой статье.
autogear.ru
Реферат — Методы получения оксида алюминия
Реферат — Методы получения оксида алюминия
скачать (13.2 kb.)
Доступные файлы (1):
содержание
реферат.doc
Реклама MarketGid:Омский Государственный Технический Университет
Кафедра Химическая технология переработки углеводородов
Реферат на тему:
Методы получения оксида алюминия
Студент гр. НПМ-219
Составил:
Акимов М.Ю.
Проверил:
Белый А.С.
Омск 2010
Содержание:
1.Общая характеристика………………………………………………….3
2.Получение оксида алюминия…………………………………………5
2.1.Процесс Байера………………………………………………………5
2.2.Быстрое прокаливание………………………………………………5
2.3.Подкисление алюмината…………………………………………….6
2.4.Нейтрализация солей алюминия……………………………………7
2.5.Гидролиз алкоголятов………………………………………………7
3.Список используемой литературы…………………………………..9
1.Общая характеристика
Свойства оксида алюминия:
-Бесцветные нерастворимые в воде кристаллы.
-Химические свойства — амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей.
-tпл =2044 °C.
-Является полупроводником n-типа, но несмотря на это используется в качестве диэлектриков в алюминиевых электролитических конденсаторах.
-Диэлектрическая проницаемость 9,5 — 10.
-Электрическая прочность 10 кВ/мм.
Оксид алюминия обладает всеми качествами хорошего носителя и на его примере можно рассматривать многие проблемы, возникающие при подборе носителя. Амфотерен, когда оксид алюминия взаимодействует с оксидом магния (основание), образуя шпинель – алюминат магния, или с фторсиликатом (кислота), образуя топаз.
Ценным для носителя качеством является высокая температура плавления оксида алюминия – немного выше 2000°С. Он является тугоплавким оксидом, т.е. он обладает замечательной способностью стабилизировать мелкодисперсные частицы катализатора и предотвращать их (имеющих более низкую температуру плавления) слипание или спекание, являясь термостабилизатором катализатора. Гидрооксид алюминия может образовывать объемистый гель, что дает возможность получать оксид алюминия с высокоразвитой поверхностью, высокой пористостью и относительно низкой плотностью. Из водной формы гидрооксида можно приготовить взвесь или суспензию в таких спиртах, как метанол, этанол или пропанол, и получить алкогель, размеры пор которого в высушенном состоянии контролируют подбором спирта. Алкогель имеет еще меньшую плотность, чем гидрогель.
Самой замечательной особенностью оксида алюминия является многообразие его модификаций и наличие фазовых переходов между ними в очень широком интервале температур. Эти фазы, которые обычно характеризуются шпинельной структурой, отличаются друг от друга наличием дефектов в кристаллической решетке. Хотя образование плотноупакованной решетки α-Al2O3 термодинамически возможно при низкой температуре, реально оно происходит только после некоторой перестройки кристаллических решеток переходных фаз оксида алюминия, что требует высокой температуры. Этим объясняется тот факт, что оксид алюминия сохраняет развитую поверхность при температурах прокаливания 1000 и даже 1200°С.
Оксид алюминия может быть получен из разных источников. Самая чистая форма получается из металла путем его растворения либо в кислоте, как это происходит в процессе UOP, либо в спирте, как в процессах CONOCO и CONDEA. Однако большую часть производимого оксида алюминия получают или из гидрата по процессу Байера, или путем растворения в соде с последующим осаждением (так называемый гель-метод),или быстрым прокаливание как в процессах Rhone Poulenc Kaiser.
Чистый оксид получают также окислением металлического алюминия, что использую для образования сотовой структуры. Согласно этой методике, металлический алюминий покрывают небольшим количеством силиката натрия или калия, служащего катализатором окисления, и ступенчато (через 100°С) нагревают до 800-1000°С в мягкой окислительной атмосфере в течение 72-120 ч. до образования α-Al 2O3, содержащий около 1% SiO2 и небольшое количество щелочи, большая часть которого сублимируется при очень высокой температуре. По мере окисления алюминий мигрирует к поверхности, образуя оксид и оставляя пустоты, при этом получается жесткая высокопористая керамическая форма с большим количеством пустот, в которых может локализоваться каталитический компонент. Хотя этот метод дороже, его преимущество заключается в возможности получения разных геометрических форм: сот, пластин, проволоки, стержней. По химическому составу все эти формы являются оксидом алюминия и для них характерна, в частности, мала я устойчивость к термическому удару.
^
Существует 4 основных процесса получения носителей катализаторов в соотвествии с главными способами получения оксида алюминия:
Быстрое прокаливание гидрата
Подкисление алюмината
Нейтрализация солей алюминия
Гидролиз алкоголята
2.1.Процесс Байера:
По способу Байера измельченный в шаровых мельницах боксит выщелачивают в автоклавах оборотным щелочным раствором алюмината Na (после выделения из него части А12О3) при 225-250°С. При этом алюминий переходит в раствор в виде алюмината Na. В случае бокситов, содержащих гиббсит, выщелачивание можно производить при 105°С и обычном давлении в аппаратах с мешалкой. Алюминатные растворы разбавляют водой, отделяют шлам и подвергают разложению в аппаратах с мешалкой или эрлифтом 30-70 ч, причем выделяется около 1/2 образовавшегося при этом Аl(ОН)3. Его отфильтровывают и прокаливают во вращающихся печах или в кипящем слое при ~ 1200°С. В результате получается глинозем, содержащий 15-60% А12О3. Маточный раствор упаривается и поступает на выщелачивание новой партии боксита.
2 NaAlO2 + 4 Н2О = Al2O3 3 H2O + 2 NaOH. (1)
^
Термическое разложение гидрата Байера (гиббсита) должно протекать по реакции:
2Al(OH)3→ Al2O3+3H2O, (2)
Которая приводит к очень развитой поверхности, если её проводят при 250°С и выше. Однако учитывая размеры кристаллитов промышленного гиббсита, следует признать, что внутри зерен создается высокое парциальное давление воды и существует возможность гидротермального процесса по уравнениям:
Al (OH)3 AlO(ОН) + H2O, (3)
Al2O3 + H2O 2AlO(ОН). (4)
Такое течение процесса приводит к образованию хорошо окристаллизованного бемита с низким значением удельной поверхности. Быстрое прокаливание было предложено французским исследователем Сосолем, который обнаружил, что прокаливание гидрата Байера короткими быстрыми импульсами ведет к развитию чрезвычайно большой поверхности и к получению очень реакционноспособного порошка. Реакции 3 и 4 в этих условиях не протекают. Эта большая реакционная способность позволяет осуществлять простой процесс получения порошка на вращающейся пластине, приводящей к образованию мелких шариков с большой поверхностью и высокой механической прочностью, которые используют главным образом как осушающие агенты и катализаторы Клауса.
Последующая гидрообработка в соответствии с уравнением 4 снова приводит к образованию α-Al2O3, характеризующегося высоким сопротивлением к раздавливанию.
^
Этот метод – самый распространенный способ производства алюмогеля для катализа. Каждая компания по производству катализаторов имеет несколько патентов в этой области. Это обстоятельство вполне понятно, поскольку гель-процесс является самым экономичным и дает возможность получать продукт довольно высокой чистоты.
Если в качестве исходного материала используют гидрат Байера, процесс можно описать следующими уравнениями.
Al (OH)3 + ОН AlO2+ 2 H2O, (5)
AlO2+ H2O + Н+ Al (OH)3 . (6)
Это означает, что расход составляет лишь один моль щелочи и моль кислоты на моль алюминия. На практике обычно прибавляют больше одного моля щелочи.
В то же время стоимость кислоты, количество которой увеличивается в той же пропорции, часто оказывается ниже ожидавшейся благодаря использованию дешевых остаточных кислот или солей алюминия. В последнем случае реакция нейтрализации описывается уравнением:
3AlO2— + Al3+ + 6H2O— 4Al(OH)3 (7)
Этот процесс изучен достаточно подробно. Меняя различные параметры, такие как pH, температура и природа аниона, можно получить большое разнообразие структур (байерит, бемит и псевдобемит) и текстур с различными удельными поверхностями и распределением порю чистота продукта может быть достаточно высокой в зависимости от чистоты исходного гидрата и от возможности дополнительной очистки алюминатного раствора. В действительности единственным ограничением является стоимость удаления натрия, которая высока в связи с трудностью промывания геля. Последним обстоятельством объясняется применение процесса UOP и алкоголятного процесса.
2.4.Нейтрализация солей алюминия.
Получение алюмогеля протекает по реакции
Al2(OH)x+6-x — x OH 2Al(OH)3, (8)
где 1 х 6.
Если исходить из гидрата Байера, то этот процесс оказывается более дорогим, чем алюминатный, поскольку реакция гидрата с кислотой затруднена и требуется больше одного моля кислоты на моль алюминия, а значит, и больше одного моля щелочи при последующем взаимодействии.
Пример такого процесса — процесс UOP.
Исходное соединение — основная соль алюминия Al2(OH)5Cl, полученная действием соляной кислоты на металлический алюминий. Соль смешивается с гексаметилентетраамином (ГМТА). Этот раствор подается через фильтры в колонну, в которой происходит образование шариков и их желатинирование при разложении ГМТА по уравнению:
(CH2)6N2 + 4 H+ + 6 H2O 6CH2O + 4NH4+. (9)
Полупрозрачные шарики извлекают со дна колонны и подвергают кристаллизации. Гомогенное желатинирование и кристаллизация уже сформированных частиц приводят к узкому распределению кристаллитов по размерам и, как следствие, к однородным порам. Диаметр и объем пор легко регулировать, изменяя условия кристаллизации, что дает возможность получать высокопрочные частицы с большим объемом пор.
Вторым примером является процесс получения глинозема Баймала, осуществленный фирмой ДюПон. При гидротермальной обработке основных солей по уравнению 8 образуется концентрированный золь метагидрооксида с твердыми частицами, удельная поверхность которых достигает 600м2/г. Такой же результат может быть получен при автоклавной обработке аморфного геля.
^
Исходной реакцией этого процесса является реакция Циглера. В то время, когда нефтехимические продукты были дешевы, этот метод прменяли для производства высших линейных спиртов. Исходя из алюминия обычного качества, водорода и этилена, можно осуществить следующие реакции:
синтез триэтилалюминия
Al + 1/2 H2 + 3 C2H4 Al (C2H5)3 , (10)
рост цепи
Al (C2H5)3 + 3n C2H4 Al [(C2H4)n C2H5]3 , (11)
окисление триалкилалюминия
Al R3 + 3/2 O2 Al (OR)3 , (12)
гидролиз алкоголята
Al (OR)3 + 3 H2O Al (OH)3 +3ROH. (13)
Конечным продуктом является спирт, а в качестве побочного продукта образуется гидроксид алюминия. Из-за высокой селективности реакции 10 примеси, содержащиеся в Al, остаются в виде нерастворимого шлама, который удаляют фильтрованием и центрифугированием. Таким образом, если не считать минеральную примесь TiO2, неизбежно вносимую катализатором полимеризации, получается очень чистый глинозем, имеющий к тому же высокоразвитую поверхность. Эти два обстоятельства и тот факт, что оксид алюминия оказывается в этом случае дешевым побочным продуктом, приводят к увеличению использования глинозема этого типа в катализе. Компанией Condea был разработан подобный процесс получения оксида алюминия со спиртом, причем спирт затем снова вводили в процесс. В этом случае большая часть примесей в металле не растворяется в растворе алкоголята и может быть удалена фильтрованием до стадии гидролиза. В этом случае получается довольно чистый глинозем, не достигающий однако степени чистоты описанного выше продукта реакции 13. Все дело в том, компенсируется ли низкое содержание щелочных металлов в глиноземе по рассматриваемому методу большей стоимостью этого процесса по сравнению с алюминатным.
3.Список используемой литературы:
Элвин Б. Стайлз Носители и нанесенные катализаторы.Теория и практика. — М.: Химия, 1991. — 240 с.
Скачать файл (13.2 kb.)
gendocs.ru
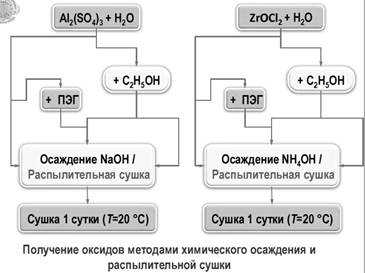
Получение оксидов алюминия и циркония химическими методами — МегаЛекции
3.3.1. Получение оксидов алюминия Процесс Байера. Быстрое прокаливание гидрата. Подкисление алюмината. Нейтрализация солей алюминия. Гидролиз алкоголята.
ПОЛУЧЕНИЕ ОКСИДА АЛЮМИНИЯ
Существует 4 основных способа получения оксида алюминия:
— Быстрое прокаливание гидрата
— Подкисление алюмината
— Нейтрализация солей алюминия
— Гидролиз алкоголята
Процесс Байера
— измельченный в шаровых мельницах боксит выщелачивают в автоклавах оборотным щелочным раствором алюмината Na (после выделения из него части А12О3) при 225-250°С. При этом алюминий переходит в раствор в виде алюмината Na.
— В случае бокситов, содержащих гиббсит, выщелачивание можно производить при 105°С и обычном давлении в аппаратах с мешалкой.
— Алюминатные растворы разбавляют водой, отделяют шлам и подвергают разложению в аппаратах с мешалкой 30-70 ч, при этом выделяется около 1/2 образовавшегося при этом А1(ОН)3.
— Осадок отфильтровывают и прокаливают во вращающихся печах или в кипящем слое при 1200°С. В результате получается глинозем, содержащий 15-60% А12О3.
— Маточный раствор упаривается и поступает на выщелачивание новой партии боксита.
2 NaAlO2 + 4 Н2О = Al2O3 3h3O + 2NaOH
Быстрое прокаливание
Термическое разложение гидрата Байера (гиббсита) протекает по реакции:
2Al(OH)3→Al2O3+3H2O
Которая приводит к очень развитой поверхности, если её проводят при 250°С и выше.
Однако внутри зерен создается высокое парциальное давление воды и существует возможность гидротермального процесса по уравнениям:
Al(ОН)3→Аl(ОН)+ Н2O, (1)
Al2O3 + Н2O→2АlO(ОН) (2)
Такое течение процесса приводит к образованию хорошо окристаллизованного бемита с низким значением удельной поверхности.
Быстрое прокаливание позволяет избежать реакций 1 и 2
Подкисление алюмината
Этот метод — самый распространенный способ производства алюмогеля для катализа, так как гель-процесс является самым экономичным и дает возможность получать продукт высокой чистоты.
Если в качестве исходного материала используют гидрат Байера, процесс можно описать следующими уравнениями.
Al(OH)3 + ОН— →AlO—2 + 2H2O,
AlO—2 + H2O + Н+ →Al(OH)3 .
Это означает, что расход составляет один моль щелочи и моль кислоты на моль алюминия. На практике обычно прибавляют больше одного моля щелочи. Меняя различные параметры, такие как pH, температура и природа аниона, можно получить большое разнообразие структур (байерит, бемит и псевдобемит) и текстур с различными удельными поверхностями и распределением пор. Чистота продукта может быть достаточно высокой в зависимости от чистоты исходного гидрата и от возможности дополнительной очистки алюминатного раствора. Ограничением является стоимость удаления натрия, которая высока в связи с трудностью промывания геля.
Нейтрализация солей алюминия
Получение алюмогеля протекает по реакции
Al2(OH)x+6-x– xOH →2Al(OH)3, где 1 < х < 6.
Если исходить из гидрата Байера, этот процесс оказывается более дорогим, чем алюминатный, так как реакция гидрата с кислотой затруднена и требуется больше одного моля кислоты на моль алюминия, а значит, и больше одного моля щелочи при последующем взаимодействии.
Пример такого процесса — процесс UOP.
S Исходное соединение — основная соль алюминия Al2(OH)5Cl, полученная действием соляной кислоты на металлический алюминий.
S Соль смешивается с гексаметилентетраамином (ГМТА).
S Этот раствор подается через фильтры в колонну, в которой происходит образование шариков и их желатинирование при разложении ГМТА по уравнению:
(CH2)6N2 + 4 H+ + 6 H2O→6CH2O + 4NH4+
S Полупрозрачные шарики извлекают со дна колонны и подвергают кристаллизации.
S Гомогенное желатинирование и кристаллизация уже сформированных частиц приводят к узкому распределению кристаллитов по размерам и, как следствие, к однородным порам.
S Диаметр и объем пор легко регулировать, изменяя условия кристаллизации, что дает возможность получать высокопрочные частицы с большим объемом пор.
Второй пример — процесс получения глинозема Баймала.
S При гидротермальной обработке основных солей по уравнению
Al2(OH)x+6-x — x OH → 2Al(OH)3
образуется концентрированный золь метагидрооксида с твердыми частицами, удельная поверхность которых достигает 600м2/г.
S Такой же результат может быть получен при автоклавной обработке аморфного геля
Гидролиз алкоголятов
Исходной реакцией этого процесса является реакция Циглера.
Исходя из алюминия обычного качества, водорода и
этилена, можно осуществить следующие реакции: синтез триэтилалюминия
Al + 1/2 H2 + 3 C2H4→ Al (C2H5)3 ,
рост цепи (Kt)
Al (C2H5)3 + 3n C2H4 → Al [(C2H4)n C2H5]3 ,
окисление триалкилалюминия
Al R3 + 3/2 O2→ Al (OR)3 ,
гидролиз алкоголята
Al (OR)3 + 3 h3O → Al (OH)3 +3ROH.
Конечным продуктом является спирт, а в качестве побочного продукта образуется гидроксид алюминия.
Из-за высокой селективности реакции 1 примеси, содержащиеся в Al, остаются в виде нерастворимого шлама, который удаляют фильтрованием и центрифугированием.
Таким образом, получается очень чистый глинозем, имеющий к высокоразвитую поверхность (если не считать примесь TiO2, неизбежно вносимую катализатором полимеризации).
Оксид алюминия оказывается в этом случае дешевым побочным продуктом, приводят к увеличению использования глинозема этого типа в катализе.
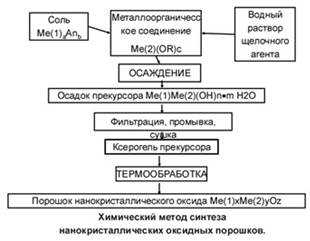
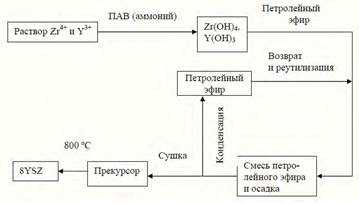
3.3.2. Получение оксида циркония. Химический метод синтеза нанокристаллических оксидных порошков.
ПОЛУЧЕНИЕ ОКСИДА ЦИРКОНИЯ
Химический метод синтеза нанокристаллических оксидных порошков представляет собой двухстадийный процесс, заключающийся в синтезе прекурсора с последующей его термообработкой до нанокристаллических оксидов
От скорости и способа экстракции зависит качество продукта
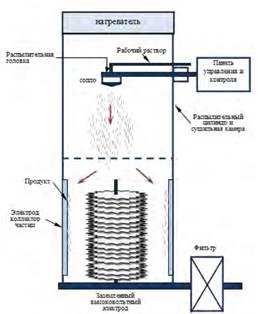
3.3.3. Получение оксидов методом распылительной сушки.Принцип работы аппарата распылительной сушки. Морфология продукта. Преимущества метода.
Распылительная сушка — самый распространенный промышленный процесс сушки и формирования частиц. Он приспособлен для непрерывной переработки жидкого сырья в сухой продукт в форме порошка, гранулята или агломерата.
Сырьем могут служить растворы, эмульсии и перекачиваемые суспензии.
Распылительная сушка начинается с распыления (атомизации) жидкого сырья на капли.
В сушильной камере эти капли контактируют с горячим воздухом.
Испарение влаги из капель и формирование сухих частиц происходит при регулировании температуры и воздушного потока.
Порошок непрерывно выгружается из сушильной камеры.
Синтез нанопорошков оксида алюминия и циркония методом распыления из растворов(NanoSprayDryerB-90) Преимущества:
Возможность получать чистый гранулированный продукт, с минимальными потерями (извлечение до 90 %)
Возможность контролировать фазовый состав продукта
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
megalektsii.ru
Алюминий, его соединения
Алюминий, его соединения.
Сегодня мы познакомимся с удивительным металлом. Из стихотворения мы узнаем немного о нём.
Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой
Чтоб меня кислород не достал.
Конечно, речь идёт об алюминии. Попробуем составить подробный рассказ о нём.
Алюминий живёт в III A группе в 3 периоде. Поэтому он имеет 3 энергетических уровня, на которых расположены все его электроны. Порядковый номер алюминия – 13, значит у него 13 электронов в атоме. На первом энергетическом уровне 2 электрона, на втором – 8, на третьем – 3. Значит, атом алюминия содержит 3 электрона на внешнем энергетическом уровне, которые он отдаёт и превращается в ион. Алюминий почти во всех своих соединениях имеет степень окисления +3, потому что это элемент III A группы.
Сравним алюминий с его соседями. Радиус атома у алюминия больше, чем у его соседа сверху – бора, и восстановительные свойства у алюминия выражены значительно больше. Кроме бора у алюминия есть ещё соседи по периоду. Это кремний, радиус у кремния меньше, чем у алюминия, к тому же кремний является неметаллом и проявляет кислотные свойства. В периоде с увеличением заряда ядра атома – уменьшается радиус атома и способность элемента отдавать электроны тоже уменьшается, поэтому алюминий проявляет более слабые восстановительные и металлические свойства, чем натрий и магний, он относится к переходным металлам и занимает промежуточное положение между металлами и неметаллами, его соединения являются амфотэрными.
Как простое вещество, алюминий:
· представляет собой серебристо-белый металл
· лёгкий (плотность его два целых семь десятых грамма на сантиметр кубический)
· мягкий
· плавится при температуре 660 0С
· очень пластичный и легко вытягивается в проволоку и прокатывается в фольгу
· обладает большой электро- и теплопроводностью
· высокая упругость, то есть он не становится хрупким при низких температурах
А теперь поговорим о нахождении в природе алюминия и его получении.
Посмотрев на диаграмму, можно с уверенностью сказать, что алюминий — самый распространенный металл в природе. Его содержание в земной коре составляет восемь целых восемь десятых процента. Он занимает третье место по распространенности среди других элементов (после кислорода и кремния).
В земной коре алюминий встречается только в виде соединений, преимущественно с кремнием и кислородом — в виде алюмосиликатов. Алюмосиликаты представляют собой соли, образованные оксидами алюминия, кремния, щелочных и щелочноземельных металлов. Алюмосиликаты входят в состав полевых шпатов.
Боксит представляет собой горную породу, из которой получают алюминий, он содержит оксид алюминия.
Корунд является минералом состава Al2O3, он очень твёрдый, его разновидность, содержащая примеси – наждак – применяется как шлифовальный материал. Корунд содержит прозрачные и окрашенные примеси: если они красные, тогда он называется рубин, если синие – то сапфир.
Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно. Алюминий можно получить электролизом — разложением расплава его оксида с помощью электрического тока. Но температура плавления оксида алюминия более 2000 0C. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому на практике его получают методом электролиза. Проводить процесс при более высокой температуре технически очень сложно и экономически нецелесообразно. На практике вместо расплава оксида алюминия используют его раствор в криолите – Na3AlF6, который плавится при гораздо более низкой температуре.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления (а не восстанавливания) хлорида алюминия калием при высокой температуре.
Но почему же такой распространённый в природе металл и к тому же очень важный стал известен людям менее двухсот лет назад? Послушайте историю…
Однажды к древнеримскому императору Тиберию пришёл ремесленник и принёс чашу невиданной красоты, изготовленную из серебристого и на удивление лёгкого металла. На вопрос императора о названии чудесного металла ремесленник ответил, что металл получен им из …глины и пока не имеет названия. «Дальновидный» император, испугавшись, что новый металл, который можно получать из обыкновенной глины, обесценит серебро и подорвёт могущество Рима, повелел: чашу уничтожить, ремесленника обезглавить, его мастерскую сровнять с землёй!»
…Спустя полторы тысячи лет, в шестнадцатом веке, талантливый немецкий врач и естествоиспытатель Парацэльс, исследуя различные вещества и минералы, установил, что в состав некоторой минеральной породы, которую издревле применяли при крашении тканей и называли «алюмэн» (вяжущая) входит окись неизвестного металла, названная впоследствии глинозёмом. В Древней Руси эту породу называли «квасцы».
В 1754 году немецкий химик и металлург Маргграф с помощью щёлочи выделил из раствора квасцов «квасцовую землю», впоследствии названную алюминой (это и был оксид алюминия), и указал на её особые свойства.
А в 1782 году Лавуазье предположил, что алюмина или глинозём является оксидом неизвестного элемента. Уже в1789 году алюмина была отнесена к «группе простых тел, солеобразующих и землистых».
После нескольких неудачных попыток, выделить таинственный элемент из глинозёма с помощью гальванического тока удалось датскому ученому Эрстэду в 1825 году. Для этого он использовал соль алюминия и натрий.
Однако это осталось почти незамеченным. И только другу Эрстэда немецкому химику Вёлеру удалось разработать метод получения нового металла. На это ему потребовалось восемнадцать лет. Он использовал для этого криолит и металлический калий.
В 1855 году на Всемирной выставке в Париже было представлено «серебро из глины», которое произвело большую сенсацию. Металл был весьма дорогим, и только членам монарших семей было доступным щеголять в камзолах с алюминиевыми пуговицами и есть алюминиевыми ложками и вилками. Интересно, что даже в 1889 году алюминий оставался главным образом ювелирным металлом. Именно тогда Менделееву за его выдающиеся заслуги в развитии химии был преподнесён Лондонским королевским обществом подарок – весы, сделанные из золота и алюминия.
Так ценился алюминий. Даже у последнего русского царевича Алексея была очень дорогая игрушка – погремушка из алюминия.
И только к концу девятнадцатого века работавший в России австрийский химик Байер создал и применил в заводских условиях оригинальную технологию получения глинозёма, основного сырья для получения алюминия. Производство алюминия резко возросло, цены на него снизились в тысячи раз, и алюминий сразу приковал к себе внимание промышленного мира – электротехнической промышленности, машиностроения, автомобилестроения.
Промышленный способ производства алюминия, который в своей основе применяется до сих пор, был разработан в 1866 году двумя молодыми учёными американцем Чарльзом Холлом и французом Полем Эру, причём независимо друг от друга.
В настоящее время по объёму производства алюминий прочно занимает второе место после железа и его сплавов (среди металлов). Для выплавки одной тонны алюминия требуется от тринадцати до семнадцати тысяч квт/час электрической энергии, поэтому алюминиевые заводы расположены вблизи крупных ГЭС.
Естественно, если бы не технические трудности, алюминий давно бы был самым дешёвым металлом. Но из-за высокой химической активности, алюминий встречается в природе только в связанном виде. А из-за высокого сродства к кислороду, восстановить алюминий можно либо ещё более активным металлом, например калием, либо при помощи электролиза. Поэтому открытие этого самого распространённого металла состоялось после открытия щелочных металлов, а промышленное получение началось после изобретения электролиза.
Что касается химических свойств алюминия, то они обусловлены положением его в ряду активности металлов. Алюминий представляет собой очень активный металл, потому что в ряду напряжений металлов он стоит сразу после щелочноземельный металлов, он активнее и таких металлов, как цинк, железо, свинец, олово.
При комнатной температуре на воздухе алюминий не изменяется, потому что он покрыт прочной и тонкой плёнкой оксида, которая защищает металл от внешнего воздействия.
Но если разрушить оксидную плёнку, то алюминий показывает свой «буйный характер». Сделать же это путём простого механического воздействия на его поверхности чем-нибудь твёрдым невозможно, поскольку очень быстро повреждённые места «залечиваются». Для этого можно использовать способность алюминия образовывать амальгаму – сплав с ртутью. Такой алюминий называется амальгамированный.
При высокой температуре алюминий энергично взаимодействует с кислородом, при этом образуется оксид алюминия. Алюминий повышает свою степень окисления с 0 до +3, а кислород понижает с 0 до -2. Четыре атома алюминия отдают по 3 электрона молекуле кислорода. Поэтому в этой реакции алюминий является восстановителем, а кислород – окислителем.
Эту реакцию можно наблюдать при горении бенгальских огней и фейерверков.
Алюминий будет взаимодействовать с неметаллами, особенно в порошкообразном состоянии. Но для того, чтобы реакция прошла, необходимо первоначальное нагревание, за исключением реакций с галогенами – хлором и бромом, но потом эти реакции идут бурно с выделением большого количества теплоты.
Например, в реакции алюминия с хлором образуется бинарное соединение – хлорид алюминия. Два атома алюминия отдают по 3электрона молекуле хлора. При этом алюминий повышает свою степень окисления с 0 до +3, а хлор понижает с 0 до -1.
В реакции алюминия с серой образуется сульфид алюминия, два атома алюминия отдают по 3 электрона молекуле серы, при этом алюминий повышает свою степень окисления с 0 до +3, а сера понижает с 0 до -2.
В реакции алюминия с азотом образуется бинарное соединение – нитрид алюминия, два атома алюминия отдают по 1 электрону молекуле азота, алюминий при этом повышает свою степень окисления с 0 до +3, а азот понижает с 0 до -3.
Таким образом, в этих реакциях алюминий повышает свою степень окисления, поэтому является восстановителем, а неметаллы понижают свою степень окисления, поэтому являются окислителями.
Интересно протекает реакция алюминия с йодом. Катализатором в этой реакции является вода. При этом выделяется так много теплоты, что содержащийся в смеси йод испаряется и образует густые темно-фиолетовые пары. В результате этой окислительно-восстановительной реакции образуется йодид алюминия.
Амальгамированный алюминий реагирует с водой, при этом образуется гидроксид алюминия и водород. Алюминий в этой реакции выступает в роли восстановителя. Потому что повышает свою степень окисления, а ионы водорода выступают в роли окислителя, потому что водород понижает свою степень окисления с +1 до 0. Это уравнение химической реакции является доказательством того, что алюминий – активный металл, потому что только активные металлы могут реагировать с водой.
Алюминий также взаимодействует с растворами кислот с выделением водорода. Так, в реакции алюминия с серной кислотой образуется сульфат алюминия и выделяется водород, в реакции алюминия с соляной кислотой образуется соль – хлорид алюминия и выделяется водород. Алюминий в этих реакциях выступает в роли восстановителя, потому что повышает свою степень окисления с 0 до +3, а ионы водорода здесь выступают в роли окислителя, потому что водород понижает степень окисления с +1 до 0.
А концентрированные серная и азотная кислоты пассивируют поверхность алюминия, образуя на его поверхности прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Алюминий реагирует и с растворами щелочей с образованием комплексных солей. В реакции алюминия с водным раствором гидроксида калия образуется комплексная соль – тэтрагидроксоалюминат калия и выделяется газ – водород. Алюминий в этой реакции выступает в роли восстановителя, а водород – в качестве окислителя.
Алюминотэрмия — это способ восстановления многих металлов из их оксидов с помощью алюминия. Так, алюминий используется для получения хрома, марганца, ванадия, титана, циркония из их оксидов.
Как вы думаете, будет ли протекать реакция алюминия с оксидом железа?
Данная реакция будет протекать, так как алюминий в электрохимическом ряду напряжений стоит правее железа, то есть он будет вытеснять железо из его оксида.
Например, если эту смесь поджечь с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты.
Таким образом, алюминий является активным металлом, реагирует с простыми веществами – неметаллами, восстанавливает металлы до свободного состояния, стоящие в электрохимическом ряду напряжения справа от него. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, так как покрыт защитной оксидной пленкой.
Алюминий образует оксид состава Al2O3, который представляет собой белое, твёрдое вещество, широко распространённое в природе, с высокой температурой плавления. Оно обладает инертностью при обычных условиях. Действительно, оксид алюминия огнеупорен, является абразивным материалом, нерастворим в воде; с кислотами и щелочами, основными оксидами реагирует либо при кипячении, либо при сплавлении.
Например, в при сплавлении оксида алюминия с гидроксидом калия образуется соль – метаалюминат калия – и вода, при сплавлении с оксидом кальция, который является основным оксидом, образуется соль – метаалюминат кальция. В реакции оксида алюминия с раствором гидроксида калия образуется комплексная соль – тэтрагидроксоалюминат калия. В реакции оксида алюминия с раствором серной кислоты образуется соль – сульфат алюминия и вода.
Оксид алюминия может быть получен при нагревании гидроксида алюминия.
Гидроксид алюминия – Al(OH)3 – обладают амфотэрными свойствами. Оксид алюминия не растворим в воде, и поэтому гидроксид алюминия получают осаждением из растворимых солей алюминия действием щелочей.
Так как гидроксид алюминия – амфотэрное основание, поэтому он реагирует и с кислотами, и со щелочами. В реакции с соляной кислотой гидроксид алюминия ведёт себя как основание, а в реакции с гидроксидом натрия он ведёт себя, как кислота.
Проведём эксперимент, нальём в пробирку хлорид алюминия, а затем несколько капель щелочи. У нас, как вы видите, образовался осадок белого цвета. Если к этому осадку добавить кислоты, то осадок растворяется. Если к этому осадку добавить щёлочь, то он также растворяется.
Эти реакции доказывают то, что гидроксид алюминия является амфотэрным основанием
К наиболее распространённым солям алюминия относятся соли ортоалюминиевой кислоты – H3AlO3 и метаалюминиевой – HAlO2.
К природным алюминатам относится благородная шпинэль, которая украшает историческую реликвию – корону российских императоров, а также драгоценный хризоберилл.
Все соли алюминия, кроме фосфатов, хорошо растворимы в воде. Некоторые соли, такие как сульфиды, сульфиты разлагаются водой.
Такая соль алюминия, как хлорид алюминия, применяется как катализатор во многих органических реакциях.
Таким образом, оксид алюминия при обычных условиях является достаточно инертным веществом и широко распространён в природе, гидроксид алюминия получают из растворимых солей алюминия действием щелочей, он взаимодействует как с кислотами, так и со щелочами, образуя растворимые соли, следовательно проявляет амфотэрные свойства.
Рассмотрим области применения алюминия.
Как вы думаете, с чем связано столь широкое применение алюминия?
· во-первых, алюминий — самый распространённый металл в земной коре
· во-вторых, обладает высокой коррозионной стойкостью и малой плотностью
· в-третьих, сплавы на основе алюминия обладают прочностью
· в-четвёртых, для алюминия характерна высокая электропроводность и теплопроводность, а высокая химическая активность используется в алюминотэрмии.
Основные области применения алюминия связаны с лёгкостью, прочностью
и устойчивостью. В таком сочетании полезных свойств нуждается в первую очередь
транспорт. Главные потребители алюминиевых сплавов — самолетостроение и
автомобилестроение. Применение
алюминия и его сплавов во всех видах транспорта, а в особенности воздушного
привело к уменьшению собственной массы транспортных средств и к резкому
увеличению эффективности их использования. Авиаконструкции, моторы, блоки,
головки цилиндров, картеры, коробки передач, насосы и многие другие детали
также изготавливают из алюминия и его сплавов.
Алюминий и его сплавы применяют также при отделке железнодорожных вагонов,
изготовлении корпусов и дымовых труб судов, спасательных лодок, радарных мачт,
трапов.
Также
алюминий широко применяется в таких областях техники как — ядерная
энергетика, полупроводниковая электроника, радиолокация, отражающие поверхности
нагревательных и осветительных рефлекторов и зеркал своим существованием также
обязаны алюминию, в частности его высокой отражающей способности.
Различные свойства алюминиевых сплавов, а
также их красивый внешний вид обусловили широкое применение их в строительстве.
Алюминий и его сплавы используют при отделке станций метрополитена, фасадов
зданий. Гофрированными листами сплавов покрывают крыши. Активно применяется алюминий и
его сплавы в промышленном и гражданском строительстве при изготовления каркасов
зданий, ферм, оконных рам, лестниц и др. конструкций.
Высокая электрическая проводимость чистого алюминия используется в электротехнике. Из алюминия изготавливают электропровода. При одинаковом электрическом сопротивлении масса алюминиевого провода значительно меньше массы медного. Это облегчает сооружение опорных мачт, на которые подвешиваются провода. Активно используют алюминий и его сплавы в электротехнической промышленности для изготовления кабелей и проводов, конденсаторов, выпрямителей переменного тока. В приборостроении алюминий и его сплавы используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры, различных контрольно-измерительных приборов.
Широко применяется «серебряная краска» на основе алюминиевого порошка. Она не только придает красивый внешний вид изделиям, но и защищает их от химического разрушения. Для защиты от солнечных лучей ею покрывают цистерны, предназначенные для перевозки нефтепродуктов.
Учитывая высокую коррозионную стойкость и нетоксичность алюминия, его широко применяют при изготовлении аппаратуры для производства и хранения крепкой азотной кислоты, пероксида водорода, органических веществ и пищевых продуктов.
В быту алюминий используют в виде кухонной посуды. Здесь используются такие свойства как высокая теплопроводность, способность противостоять действию не только холодной, но и кипящей воды, а также неядовитость его соединений, которые в небольшом количестве могут образоваться при действии на алюминий слабых органических кислот, содержащихся в пище. Алюминиевая фольга, обладая большей прочностью и будучи дешевле оловянной, полностью заменила ее как упаковочный материал для пищевых продуктов.
Природный минерал корунд, представляющий собой чистый кристаллический оксид алюминия, из-за высокой твёрдости применяется в качестве абразивного материала, а синтетический оксид алюминия – в производстве керамики, устойчивой при очень высоких температурах. Природные монокристаллы оксида алюминия – это минералы рубин, сапфир являются драгоценными камнями и используются в производстве ювелирных украшений.
Очень важное значение, имеет каолин – основной компонент глины, огромное количество которого расходуются при производстве цемента.
Теперь можно сделать вывод, что алюминий – самый распространённые металл в природе, он расположенный в третьем периоде III A группы, со степенью окисления +3. В связи с большой активностью в природе встречается только в виде соединений. Алюминий по физическим свойствам – типичный металл. Он химически очень активен и реагирует как с кислотами, так и со щелочами.
По отношению к другим веществам алюминий, его оксид и гидроксид проявляют амфотэрные свойства. Алюминий и его сплавы находит широкое распространение в промышленности и в быту.
videouroki.net
Как из оксида алюминия получить алюминий
Окись алюминия встречается в природе в виде корунда и наждака. Имеет важное промышленное значение в аналитической химии алюминия, так как является весовой формой при его определении. Окись алюминия образуется при прокаливании гидроокиси и других соединений алюминия; полиморфна и существует в основном в трех различных формах: , и .
Корунд или представляет собой белый тугоплавкий порошок плотностью 4,0 , по твердости близкий к алмазу, химически инертный. Он не взаимодействует с растворами кислот и щелочей и может быть растворен лишь в расплавленной щелочи. Высокая устойчивость корунда объясняется прочностью его кристаллической структуры, представляющей собой двухслойную плотнейшую шаровую упаковку из ионов кислорода, в октаэдрических пустотах которой размещены ионы алюминия.
Получают корунд термическим разложением гидроксида алюминия или квасцов при . Корунд используется в качестве высокотемпературных инертных волокон для упрочнения металлических сплавов и керамики, создания химически и термически стойких фильтров, теплозащитных покрытий космических аппаратов. Сильно прокаленный , называемый алундом, идет на изготовление тиглей и огнеупорных материалов.
Металлический алюминий из оксида получают путем электролиза из раствора в расплавленном криолите (6 – 8% и 92 – 94% ) (как из оксида алюминия получить алюминий). Молекулярное уравнение имеет вид:
ru.solverbook.com
Получение алюминия | khimie.ru
Все применяемые в настоящее время способы промышленного получения алюминия основаны на электролитическом разложении оксида алюминия, растворенной в расплавленном криолите. В качестве материала для электродов используют обычно ретортный графит. Содержимое ванны поддерживается в жидком состоянии за счет тепла электрнческого тока. Температура ванны не должна превышать 1000 °С. Выделяющийся на катоде металлический алюминий собирается в расплавленном состоянии на дне печи. На погруженном сверху в ванну аноде кислород окисляет графит с образованием оксида углерода СО, которая сейчас же сгорает до диоксида СО2. Диоксид углерода частичпо образуется также и непосредственно на аноде.
Потенциалы разложения составляют (при 950 °С): для NаF 4,5, для А1F3 3,5 и для А12O3 2,18 е. Эти данные имеют значение в том случав, если анод не взаимодействует c выделяющимися веществами. Если применяют угольный электрод, то потенциал разложения А12O3, теоретически равный 1,00 В (из-за образования СО), повышается при большой силе тока до 2 В, так как образующаяся СО препятствует разрядке ионов кислорода. Если напряжение на ванне не слишком большое и содержание оксида алюминия в расплаве не слишком мало, разлагается преимущественно только А12О3. В очень незначительной степени на аноде происходит образование СF4. При правильном проведении электролиза натрий никогда не выделяется. Так как значительная часть напряжения, подаваемого на ванну, тратится па преодоление ее омического сопротивления, на практике напряжение на ванне поддерживается около 5-6 В. Как только напряжение начинает заметно возрастать, необходимо добавлять новые порции оксида алюминия.
Все попытки при получении алюминия заменить электролиз расплава термическим восстановлением оксида алюминия до сих пор не имели практического успеха. При использовании в качестве восстановителя углерода происходит образование карбида алюминия Аl4С3, которое не удается предотвратить. Его, однако, можно, как указал Кольмейер,. сильно ограничить, если А1203 плавить очень быстро и смешивать лишь со строго определенным количеством угля. Этим способом в лабораторных опытах удавилось получать 93 % алюминий.
Оксид алюминия, пригодный для получения из него металла, чрезвычайно редко встречается в природе в достаточно чистом состоянии. Его получают почти всюду из боксита, который добывают главным образом во Франции, Венгрии, Далмации, Истрии, России, Индии, Арканзасе и Гвиане. Употребляемый для растворения криолит частично изготовляют искусственно. Для понижения температуры плавления обычно прибавляют флюсы, например фторид кальция. Таким образом, можно без труда поддерживать находящийся в ванне плав с 20-30 % А12О3 в жидком состоянии при 800-900 °С. При более высокой температуре разница между удельными весами плава и расплавленного алюминия уменьшается, вследствие чего А1 не опускается. больше на дно ванны и, попадая на поверхность, сгорает.
Встречающийся в природе бокситы всегда более или менее сильно загрязнены оксидами железа (II) кремневой кислотой. Для получения чистого оксида алюминия, пригодного для использования в электрометаллургии, руду вскрывают нагреванием. с СаО и Na2СО3 (сухой способ) или нагреванием с едким натром в автоклавах (способ Бауэра). В обоих случаях оксид алюминия в виде алюминатов переходит в раствор, который затем разлагают либо пропусканием через него диоксида углерода, либо добавлением уже приготовленного заранее гидроксида алюминия. В первом случае разложение происходит по уравнению
2[А1(ОН)4]— + СО2 = 2А1(ОН)3 + СО32- + Н2О.
Разложение по второму способу основало на том, что раствор алюмината, полученный при нагревании в автоклаве, после охлаждения и разбавления метастабилен. Добавляемый гидроксид алюминия ускоряет распад алюмината, причем разложение происходит следующим образом; [А1(ОН)4]— = А1(ОН)3 + Н2О. Частицы гидроксида алюминия служат центрами кристаллизации. Разновидностью способа Байера является способ башенного вскрытия. По зтому способу вскрытие производят не в автоклавах, а в высоких башнях, в которых едкий натр стекает сквозь слои боксита. Товарная стоимость алюминия определяется следующими расходами: 32% на А1203, 4% на криолит, 12% на электродные угли 25% на электрическую энергию, если считать стоимость 1 квт-ч в 1,2 цфенига. Цена боксита Составляет только 6% ойщей стоимости алюминиевого производства. Для Германии имеет большое значение вопрос извлечения А12О3 из местного сырья, т. е. из широко распространенных глин. Вследствие высокого содержания в глинах кремневой кислоты щелочные методы вскрытия, как, например, способ Байера, для них почти не пригодны. Чтобы уменьшить переход кремневой кислоты в раствор, для вскрытия глин применяют кислоты, и процесс при этом ведут так, чтобы по возможности избежать растворения оксидов железа, ибо последующее отделение больших количеств железа от алюминия представляет значительные трудности.
По способу Бухнера отделение А12О3 от SiO2, Fе2O3 и ТiO2 достигается нагреванием глины в автоклаве с азотной кислотой, соответствующей концентрации и в необходимом количестве. Нитрат алюминия, переходящий в раствор, загрязнен в основном только нитратами щелочных и щелочноземельных металлов, от которых его можно отделить фракционной кристаллизацией. Азотная кислота выделяется при термическом разложении водного нитрата алюминия, и А12О3 получается в очень чистом состоянии. По способу Гольдчимидта для вскрытия используют водный раствор значительно более дешевой сернистой кислоты. При этом в болышшстве случаев в раствор переходят значительные количества железа, которое, однако, образует с алюминием хорошо кристаллизующуюся основную соль; до тех пор пока количество железа не слишком велико, возможно сравнительно просто отделение алюминия путем фракционной кристаллизации основного сульфита.
Для очистки полученного электролитическим путем алюминия его почти всегда переплавляют в пламенной печи. Технический алюминий в большинстве случаев содержит 99,5 % алюминия. Примеси состоят преимущественно из кремния и железа, а иногда — из следов меди.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
2QM.ru: Как из оксида алюминия получить алюминий? Химические формулы
Алюминий обладает свойствами, которые применимы во многих промышленностях: военном деле, строительстве, питании, транспорте и др. Он пластичный, легкий и широко распространен в природе. Многие люди даже не подозревают того, как широко можно использовать алюминий.
Многие сайты и книги описывают этот чудесный металл и его свойства. Информация находится в свободном доступе.
В лаборатории можно производить любые соединения алюминия, но в малых количествах и по высоким ценам.
Содержание статьи
История добычи элемента
Вплоть до середины девятнадцатого века ни об алюминии, ни о восстановлении его оксида речи не шло. Первая попытка получения алюминия была предпринята химиком Х. К. Эрстедом и закончилась успешно. Чтобы восстановить металл из его оксида, он использовал амальгамированный калий. Но никто не понял, что получилось в итоге.
Прошло несколько лет, и алюминий снова был получен химиком Велером, который нагрел безводный хлорид алюминия с калием. Ученый упорно трудился 20 лет и, наконец, сумел создать гранулированный металл. По цвету он напоминал серебро, но был легче него в несколько раз. Длительное время до начала двадцатого века алюминий ценился больше золота и выставлялся в музеях как экспонат.
Где-то в начале XIX века английский химик Дэви провел электролиз оксида алюминия и получил металл, названный «алюмиум» или «алюминум», что можно переводить как «квасцы».
Алюминий очень трудно отделить от других веществ — это одна из причин его дороговизны в то время. Ученое собрание и промышленники быстро узнали о потрясающих свойствах нового металла и продолжили попытки его добычи.
В больших количествах алюминий стали получать уже в конце того же девятнадцатого века. Ученый Ч. М. Холлом предложил растворять оксид алюминия в расплаве криолита и пропускать эту смесь через электрический ток. Через какое-то время в сосуде появлялся чистый алюминий. В промышленности и сейчас производят металл этим методом, но об этом позже
Для производств нужна прочность, которой, как выяснилось чуть позднее, у алюминия не было. Тогда металл стали сплавлять с иными элементами: магнием, кремнием и т. д. Сплавы были намного прочнее обычного алюминия — именно из них стали выплавлять самолеты и военную технику. А придумали слить алюминий и другие металлы в единое целое в Германии. Там же, в Дюрене, сплав, названный дюралюминием, поставили на производство.
Как из оксида алюминия получить алюминий
В рамках школьной программы по химии проходят тему «Как из оксида металла получить чистый металл».
К этому методу мы можем отнести и наш вопрос, как из оксида алюминия получить алюминий.
Чтобы образовать металл из его оксида, нужно добавить восстановитель — водород. Пойдет реакция замещения с образованием воды и металла: МеО + Н2 = Ме + Н2О (где Ме — металл, а Н2 — водород).
Пример с алюминием: Al2О3 + 3Н2 = 2Al + 3Н2О
На практике такой прием позволяет получать чистые активные металлы, которые не восстанавливаются оксидом углерода. Метод подходит для очистки небольшого количества алюминия и довольно-таки дорого стоит.
Как получить алюминий из оксида алюминия через добавление более электроотрицательного металла
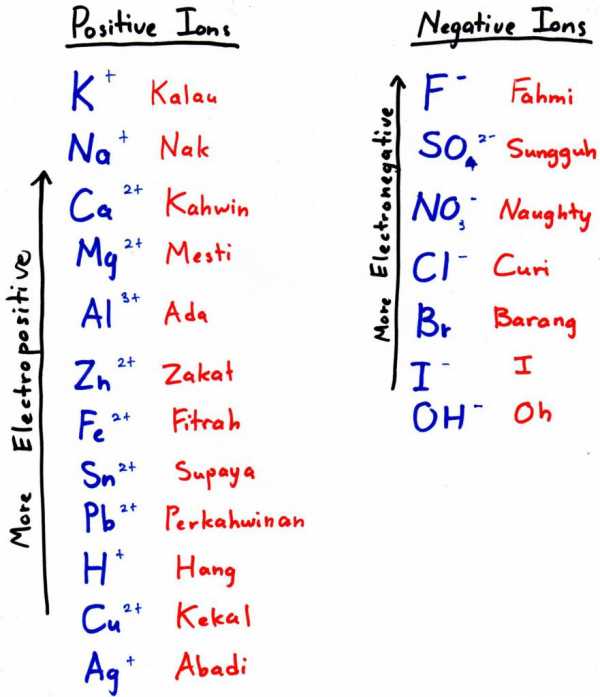
Чтобы получить алюминий этим способом, нужно подобрать более электроотрицательный металл и добавить его к оксиду — он вытеснит наш элемент из кислородного соединения. Более электроотрицательный металл — это тот, что стоит левее в электрохимическом ряду (на фото к подзаголовку — выше).
Примеры: 3Mg + Al2О3 = 2Al + 3MgO
6К + Al2О3 = 2Al + 3К2О
6Li + Al2О3 = 2Al + 3Li2О
Но как получить алюминий из оксида алюминия в условиях широкой промышленности?
Промышленный способ

Большинство производств для добычи элемента используют руды, которые называют бокситами. Сначала из них выделяют оксид, потом растворяют его в расплаве криолита, а затем получают чистый алюминий путем электрохимической реакции.
Это обходится дешевле всего и не требует дополнительных операций.
Кроме того, можно получить хлорид алюминия из оксида алюминия. Как это сделать?
Получение хлорида алюминия
Хлоридом алюминия называют среднюю (нормальную) соль из соляной кислоты и алюминия. Формула: AlCl3.
Для получения нужно добавить кислоту.
Уравнение реакции выглядит следующим образом — Al2О3 + 6HCl = 2AlCl3 + 3Н2О.
Как получить хлорид алюминия из оксида алюминия, не добавляя кислот?
Для этого надо прокалить спрессованную смесь оксида алюминия и углерода (сажа) в токе хлора при 600-800 гр. Хлорид должен отогнаться.
Эту соль применяют в качестве катализатора многих реакций. Ее главная роль — образование продуктов присоединения с разными веществами. Хлоридом алюминия протравливают шерсть, и его добавляют в антиперспиранты. Также соединение играет не последнюю роль в переработке нефти.
Получение гидроксоалюмината натрия

Как из оксида алюминия получить гидроксоалюминат натрия?
Чтобы получить это сложное вещество, можно продолжить цепочку превращений и сначала получить из оксида хлорид, а потом добавить гидроксид натрия.
Хлорид алюминия — AlCl3, гидроксид натрия — NaOH.
Al2O3 → AlCl3 → Na[Al(OH)4]
Al2О3 + 6HCl = 2AlCl3 + 3Н2О
AlCl3 + 4NaOH (концентрированный) = Na[Al(OH)4] + 3NaCl5
Но как из оксида алюминия получить тетрагидроксоалюминат натрия, избегая превращения в хлорид?
Чтобы из оксида алюминия получить алюминат натрия, нужно создать гидроксид алюминия и добавить к нему щелочь.
Следует напомнить, что щелочь — это основание, растворимое в воде. Сюда относят гидроксиды щелочных и щелочноземельных металлов (I и II группа таблицы Менделеева).
Al→ Al(ОН)3 → Na[Al(OH)4]
Из оксидов металлов средней активности, к которым относится алюминий, нельзя получать гидроксиды. Поэтому сначала мы восстановим чистый металл, например, через водород:
Al2О3 + 3Н2 = 2Al + 3Н2О.
А потом получим гидроксид.
Чтобы получить гидроксид, надо растворить алюминий в кислоте (для примера, во фтороводородной): 2Al + 6HF = 2AlF3 + 3Н2. А затем прогидролизовать полученную соль с добавлением равного количества щелочи в разбавленном растворе: AlF3 +3NaOH = Al(ОН)3 + 3NaF.
И дальше: Al(ОН)3 + NaOH = Na[Al(ОН)4]
(Al(ОН)3 — амфотерное соединение, которое может взаимодействовать и с кислотами, и с щелочами).
Тетрагидроксоалюминат натрия отлично растворяется в воде, а еще это вещество широко применяют в оформлении и добавляют в бетон, чтобы ускорить отвердевание.
Про метаалюминаты

Начинающие производители глинозема, наверное, задавались вопросом: «Как из оксида алюминия получить метаалюминат натрия?»
Алюминаты используются в широком производстве для ускорения некоторых реакций, окрашивания тканей и получения глинозема.
Лирическое отступление: глинозем — это, по сути, и есть оксид алюминия Al2О3.
Обычно оксид добывают из метаалюминатов, но здесь будет рассмотрен «обратный» способ.
Итак, чтобы получить наш алюминат, нужно просто смешать оксид натрия с оксидом алюминия при очень высокой температуре.
Случится реакция соединения — Al2О3 + Na2О = 2NaAlO2
Для нормального протекания требуется температура в 1200°C.
Можно проследить за изменением энергии Гиббса в реакции:
Na2O(к.)+ Al2O3(к.)= 2NaAlO2(к.), ΔG0298= -175 кДж.
Еще одно лирическое отступление:
Энергия Гиббса (или «свободная энергия Гиббса») — это зависимость, которая существует между энтальпией (энергией, доступной для преобразований) и энтропией (мерой «хаоса», беспорядка в системе). Абсолютное значение измерить невозможно, поэтому измеряются изменения во время протекания процесса. Формула: G (энергия Гиббса) = Н (изменение энтальпии между продуктами и исходными веществами реакции) — Т (температура) * S (изменение энтропии между продуктами и исходниками). Измеряется в Джоулях.
Как из оксида алюминия получить алюминат?
Для этого подойдет и тот способ, который был рассмотрен выше — с глиноземом и натрием.
Оксид алюминия, смешанный с оксидом другого металла при высоких температурах, и дает метаалюминат.
Но еще можно сплавить гидроксид алюминия со щелочью в присутствии оксида углерода СО:
Al(ОН)3 + NaOH = NaAlO2 + 2Н2О.
Примеры:
- Al2О3 + 2КОН = 2KAlO2 + Н2О (здесь глинозем растворяется в едкой щелочи калия) — алюминат калия;
- Al2О3 + Li2О = 2LiAlO2 — алюминат лития;
- Al2О3 + СаО = СаО × Al2О3 — сплавление оксида кальция с окисью алюминия.
Получение сульфата алюминия

Как получить сульфат алюминия из оксида алюминия?
Способ включен в школьную программу восьмых и девятых классов.
Сульфат алюминия — это соль вида Al2(SO4)3. Представлена может быть в виде пластинок или порошка.
Это вещество может разлагаться на оксиды алюминия и серы при температуре от 580 градусов. Сульфат используется для очистки воды от мельчайших частиц, очень полезен в пищевой, бумажной, тканевой и других отраслях производства. Он широко доступен благодаря своей низкой цене. Очистка воды происходит из-за некоторых особенностей сульфата.
Дело в том, что загрязняющие частицы имеют вокруг себя двойной электрический слой, а рассматриваемый реагент является коагулянтом, который, при проникновении в электрическое поле частиц, вызывает сжатие слоев и нейтрализует заряд частиц.
Теперь о самом методе. Чтобы получить сульфат, нужно смешать оксид и серную (не сернистую) кислоту.
Выходит реакция взаимодействия глинозема с кислотой:
Al2O3+3h3SO4=Al2(SO4)3+h3O
Вместо оксида можно добавить сам алюминий или его гидроксид.
В промышленности для получения сульфата используют уже известную из третьей части этой статьи руду — боксит. Ее обрабатывают серной кислотой и получают «загрязненный» сульфат алюминия. В боксите содержится гидроксид, а реакция в упрощенном виде выглядит так:
3h3SO4 + 2Al(OH)3 = Al2(SO4)3 + 6h3O
Бокситы
Боксит — это руда, состоящая сразу из нескольких минералов: железа, бемита, гиббсита и диаспора. Является главным источником добычи алюминия, образуется путем выветривания. Крупнейшие месторождения бокситов находятся в России (на Урале), США, Венесуэле (река Ориноко, штат Боливар), Австралии, Гвинее и Казахстане. Эти руды бывают моногидратными, тригидратными и смешанными.
Получение оксида алюминия
Про глинозем выше сказано много, но до сих пор не описано, как получить оксид алюминия. Формула — Al2О3.
А нужно всего-навсего сжечь алюминий в кислороде. Горение — процесс взаимодействия О2 и другого вещества.
Простейшее уравнение реакции выглядит следующим образом:
4Al + 3О2 = 2Al2О3
Оксид не растворяется в воде, но он хорошо растворим в криолите при высокой температуре.
Свои химические свойства оксид проявляет при температуре от 1000°С. Именно тогда он начинает взаимодействовать с кислотами и щелочами.
В естественных условиях корунд является единственный устойчивой вариацией вещества. Корунд очень твердый, с плотностью примерно 4000 г/м3. Твердость этого минерала по шкале Мооса — 9.

Оксид алюминия — амфотерный оксид. Легко преобразовывается в гидроксид (см. выше), а превратившись, сохраняет все свойства своей группы с преобладанием основных.
Амфотерные оксиды — это оксиды, которые могут проявлять как основные (свойства оксидов металлов), так и кислотные (оксидов неметаллов) свойства в зависимости от условий.
К амфотерным оксидам, исключая оксид алюминия, относятся: оксид цинка (ZnO), оксид бериллия (ВеО), оксид свинца (PbO), оксид олова (SnO), оксид хрома (Cr2О3), оксид железа (Fe2О3) и оксид ванадия (V2О5).
Соли: комплексные и не очень
Бывают средние (нормальные), кислые, основные и комплексные.
Средние соли состоят из самого металла и кислотного остатка и имеют вид AlCl3 (хлорид алюминия), Na2SO4 (сульфат натрия), Al(NO3)3 (нитрат алюминия) или MgPO4.
Кислые соли — это соли из металла, водорода и кислотного остатка. Их примеры: NaHSO4, CaHPO4.
Основные соли так же, как и кислые, состоят из кислотного остатка и металла, но вместо Н там ОН. Примеры: (FeOH)2SO4, Ca(OH)Cl.
И, наконец, комплексные соли — это вещества из ионов разных металлов и кислотного остатка многоосновной кислоты (соли, содержащие сложный ион): Na3[Co(NO2)6], Zn[(UO2)3(Ch4COO)8].
Речь пойдет о том, как из оксида алюминия получить комплексную соль.
Условием превращения оксида в это вещество является его амфотерность. Глинозем отлично подходит для метода. Чтобы получить комплексную соль из оксида алюминия, нужно смешать этот оксид с раствором щелочи:
2NaOH + Al2O3 + h3O → Na2[Al(ОН)4]
Этот род веществ также образуется при воздействии растворов щелочей на амфотерные гидроксиды.
Раствор гидроксида калия взаимодействует с основанием цинка с получением тетрагидроксоцинката калия:
2KOH + Zn(OH)2 → K2[Zn(OH)4]
Раствор щелочи натрия реагирует, например, с гидроксидом берилия с образованием тетрагидроксобериллата натрия:
NaOH + Be(OH)2 → Na2[Be(OH)4]
Использование солей
Комплексные соли алюминия часто используют в фармацевтике, производстве витаминов и биологически активных веществ. Препараты, созданные на основе этих веществ, помогают в борьбе с похмельем, улучшают состояние желудка и общее самочувствие организма человека. Очень полезные соединения, как можно заметить.
Реактивы дешевле покупать в интернет-магазинах. Там большой выбор веществ, но сайты лучше выбирать надежные и проверенные временем. Если покупать что-то на «однодневках», то риск потерять деньги увеличивается.
При работе с химическими элементами нужно соблюдать правила безопасности: обязательно наличие перчаток, защитного стекла, специализированной посуды и приборов.
Эпилог
Химия – несомненно, сложная для понимания наука, но иногда полезно в ней разобраться. Проще всего это сделать через интересные статьи, простой слог и понятные примеры. Не лишним будет прочитать пару книг по теме и освежить в памяти курс школьной программы по химии.
Здесь было разобрано большинство тем химии, связанных с преобразованиями алюминия и его оксидов, в том числе, как из оксида алюминия получить тетрагидроксоалюминат, и еще множество интересных фактов. Оказалось, что у алюминия есть много самых необычных сфер применения в производстве и в быту, да и история получения металла весьма незаурядна. Химические формулы соединений алюминия тоже заслуживают внимания и подробного разбора, что и было освящено в этой статье.
2qm.ru
