Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.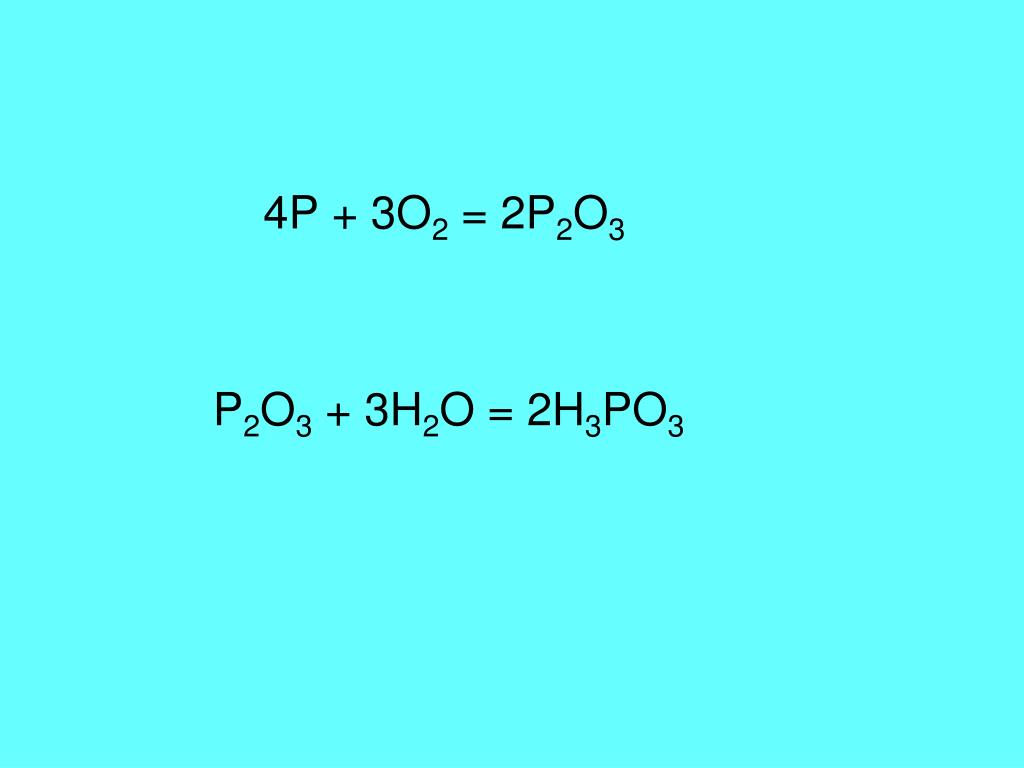
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
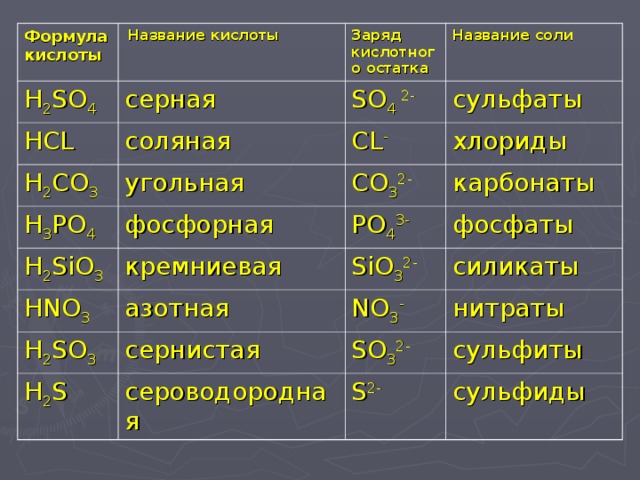
НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ И ХАРАКТЕРИЗУЮЩИЕ СЛЕДУЮЩИЕ ПР… -reshimne.ru
Новые вопросы
Ответы
1. S + h3 → h3S
2. 2h3S + 3O2 → 2SO2 + 2h3O
3. SO2 + h3O → h3SO3
4. h3SO3 + KOH → KHSO3 +h3O
5. 2h3SO3 + O2 → 2h3SO4
Похожие вопросы
Вычислите массу хлорида кальция, образующийся при взаимодействии 250 г карбоната кальция, содержащего 10% примесей, с соляной кислотой….
Что такое аллотрафия? сравнить кислород и азот. ..
..
Каков состав воздуха?…
Составить 10 тестовых заданий по теме кислород и водород с 4 вариантами ответа где один правильный…
В Казахстане добывают глиназем Al2O3 найдите моссовую доль алюминия по формуле и вычислите сколько алюбиния можно получить из глинозема массой 1 моль…
Определите число молекул N2 в азоте массой 3.2 грамм…
Математика
Литература
Алгебра
Русский язык
Геометрия
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мирГеография
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Характер оксида хлора.
 Как получить оксиды хлора В заданиях категории С3 ЕГЭ особые трудности вызывают реакции окисления органических веществ перманганатом калия KMnO 4 в кислой среде, протекающие с разрывом углеродной цепочки. Например, реакция окисления пропена, протекающая согласно уравнению:
Как получить оксиды хлора В заданиях категории С3 ЕГЭ особые трудности вызывают реакции окисления органических веществ перманганатом калия KMnO 4 в кислой среде, протекающие с разрывом углеродной цепочки. Например, реакция окисления пропена, протекающая согласно уравнению:CH 3 – CH = CH 2 + KMnO 4 + H 2 SO 4 → CH 3 COOH + CO 2 + MnSO 4 + K 2 SO 4 + H 2 O.
Чтобы расставить коэффициенты в сложных уравнениях окислительно-восстановительных реакций, подобных этой, стандартная методика предлагает составить электронный баланс, но после очередной попытки становится очевидно, что этого недостаточно. Корень проблемы здесь кроется в том, что коэффициент перед окислителем, взятый из электронного баланса, необходимо заменить. Данная статья предлагает два способа, которые позволяют выбрать правильный коэффициент перед окислителем, чтобы, наконец, уравнять все элементы.
Скачать:
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
По теме: методические разработки, презентации и конспекты
Расстановка коэффициентов в химических уравнениях
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обуче…
Организация эффективного обуче…
18. Окислительно-восстановительные реакции (продолжение 2)
18.9. ОВР с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (охлаждение)
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (нагревание)
2) 5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (нагревание)
3) CH 3 CH=CHCH 2 CH 3 + 6KMnO 4 + 10KOH CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 6K 2 MnO 4 (нагревание)
4) CH 3 CH=CH 2 + 10KMnO 4 + 13KOH CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4 (нагревание)
Дихромат калия в сернокислотной среде окисляет
алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH 3 C CH + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O (нагревание)
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R 1 –CO–CO–R 2), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C 2 H 2 + 8KMnO 4 = 3K 2 C 2 O 4 +2H 2 O + 8MnO 2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Гомологи бензола. Гомологи бензола могут
быть окислены раствором перманганата калия в
нейтральной среде до бензоата калия:
Гомологи бензола могут
быть окислены раствором перманганата калия в
нейтральной среде до бензоата калия:
C 6 H 5 CH 3 +2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O (при кипячении)
C 6 H 5 CH 2 CH 3 + 4KMnO 4 = C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O (нагревание)
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7)
в любой среде первичные спирты окисляются до
карбоновых кислот или их солей, а вторичные – до
кетонов. Третичные спирты в этих условиях не
окисляются, а метиловый спирт окисляется до
углекислого газа. Все реакции идут при
нагревании.
Третичные спирты в этих условиях не
окисляются, а метиловый спирт окисляется до
углекислого газа. Все реакции идут при
нагревании.
Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислотной среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH 2 –COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , OH. Все реакции идут при нагревании:
3CH 3 CHO + 2KMnO 4 = CH 3 COOH + 2CH 3 COOK +
2MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4
= 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2OH = CH 3 COONH 4
+ 2Ag + H 2 O + 3NH 3
Формальдегид с избытком окислителя окисляется до углекислого газа.
18.10. Сравнение окислительно-восстановительной активности различных веществ
Из определений понятий » атом-окислитель»
и » атом-восстановитель» следует, что только
окислительными свойствами обладают атомы в
высшей степени окисления.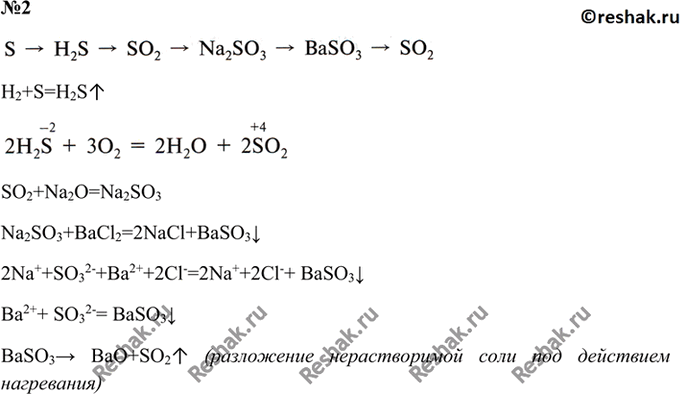 Наоборот, только
восстановительными свойствами обладают атомы в
низшей степени окисления. Атомы, находящиеся в
промежуточных степенях окисления, могут быть как
окислителями, так и восстановителями.
Наоборот, только
восстановительными свойствами обладают атомы в
низшей степени окисления. Атомы, находящиеся в
промежуточных степенях окисления, могут быть как
окислителями, так и восстановителями.
Вместе с тем, основываясь только на степени окисления, невозможно однозначно оценить окислительно-восстановительные свойства веществ. В качестве примера рассмотрим соединения элементов VA группы. Соединения азота(V) и сурьмы(V) являются более или менее сильными окислителями, соединения висмута(V) – очень сильные окислители, а соединения фосфора(V) окислительными свойствами практически не обладают. В этом и других подобных случаях имеет значение, насколько данная степень окисления характерна для данного элемента, то есть, насколько устойчивы соединения, содержащие атомы данного элемента в этой степени окисления.
Любая ОВР протекает в направлении образования
более слабого окислителя и более слабого
восстановителя. В общем случае возможность
протекания какой-либо ОВР, как и любой другой
реакции, может быть определена по знаку
изменения энергии Гиббса. Кроме того, для
количественной оценки
окислительно-восстановительной активности
веществ используют электрохимические
характеристики окислителей и восстановителей
(стандартные потенциалы
окислительно-восстановительных пар).
Основываясь на этих количественных
характеристиках, можно построить ряды
окислительно-восстановительной активности
различных веществ. Известный вам ряд напряжений
металлов построен именно таким образом. Этот ряд
дает возможность сравнивать восстановительные
свойства металлов в водных растворах,
находящихся в стандартных условиях (с = 1
моль/л, Т = 298,15 К), а также окислительные
свойства простых аквакатионов. Если в верхней
строке этого ряда поместить ионы (окислители), а в
нижней – атомы металлов (восстановители), то
левая часть этого ряда (до водорода) будет
выглядеть так:
Кроме того, для
количественной оценки
окислительно-восстановительной активности
веществ используют электрохимические
характеристики окислителей и восстановителей
(стандартные потенциалы
окислительно-восстановительных пар).
Основываясь на этих количественных
характеристиках, можно построить ряды
окислительно-восстановительной активности
различных веществ. Известный вам ряд напряжений
металлов построен именно таким образом. Этот ряд
дает возможность сравнивать восстановительные
свойства металлов в водных растворах,
находящихся в стандартных условиях (с = 1
моль/л, Т = 298,15 К), а также окислительные
свойства простых аквакатионов. Если в верхней
строке этого ряда поместить ионы (окислители), а в
нижней – атомы металлов (восстановители), то
левая часть этого ряда (до водорода) будет
выглядеть так:
В этом ряду окислительные свойства ионов (верхняя строка) усиливаются слева направо, а восстановительные свойства металлов (нижняя строка), наоборот, справа налево.
Учитывая различия в
окислительно-восстановительной активности в
разных средах, можно построить аналогичные ряды
и для окислителей. Так, для реакций в кислотной
среде (pH = 0) получается » продолжение» ряда
активности металлов в направлении усиления
окислительных свойств
Так, для реакций в кислотной
среде (pH = 0) получается » продолжение» ряда
активности металлов в направлении усиления
окислительных свойств
Как и в ряду активности металлов, в этом ряду окислительные свойства окислителей (верхняя строка) усиливаются слева направо. Но, используя этот ряд, сравнивать восстановительную активность восстановителей (нижняя строка) можно только в том случае, когда их окисленная форма совпадает с приведенной в верхней строке; в этом случае она усиливается справа налево.
Рассмотрим несколько примеров. Чтобы узнать, возможна ли данная ОВР будем использовать общее правило, определяющее направление протекания окислительно-восстановительных реакций (реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя).
1. Можно ли магнием восстановить кобальт из
раствора CoSO 4 ?
Магний более сильный восстановитель, чем
кобальт, и ионы Co 2
более сильные окислители, чем ионы Mg 2 , следовательно, можно.
2. Можно ли раствором FeCl 3 окислить медь до CuCl 2
в кислотной среде?
Так как ионы Fe 3B более сильные окислители,
чем ионы Cu 2 , а медь
более сильный восстановитель, чем ионы Fe 2 , то можно.
3. Можно ли, продувая кислород через подкисленный
соляной кислотой раствор FeCl 2 , получить
раствор FeCl 3 ?
Казалось бы нет, так как в нашем ряду кислород
стоит левее ионов Fe 3
и является более слабым окислителем, чем эти
ионы. Но в водном растворе кислород практически
никогда не восстанавливается до H 2 O 2 , в
этом случае он восстанавливается до H 2 O и
занимает место между Br 2 и MnO 2 .
Следовательно такая реакция возможна, правда,
протекает она довольно медленно (почему?).
4. Можно ли в кислотной среде перманганатом калия
окислить H 2 O 2 ?
В этом случае H 2 O 2 восстановитель и
восстановитель более сильный, чем ионы Mn 2B ,
а ионы MnO 4
окислители более сильные, чем образующийся из
пероксида кислород. Следовательно, можно.
Аналогичный ряд, построенный для ОВР в щелочной среде, выглядит следующим образом:
В отличие от » кислотного» ряда, этот ряд нельзя использовать совместно с рядом активности металлов.
Метод электронно-ионного баланса (метод
полуреакций), межмолекулярные ОВР,
внутримолекулярные ОВР, ОВР дисмутации
(диспропорционирования,
самоокисления-самовосстановления), ОВР
конмутации, пассивация.
- Используя метод электронно-ионого баланса, составьте уравнения реакций, протекающих при добавлении к подкисленному серной кислотой раствору перманганата калия раствора а) H 2 S {S, точнее, S 8 }; б) KHS; в) K 2 S; г) H 2 SO 3 ; д) KHSO 3 ; е) K 2 SO 3 ; ё) HNO 2 ; ж) KNO 2 ; и) KI {I 2 }; к) FeSO 4 ; л) C 2 H 5 OH {CH 3 COOH}; м) CH 3 CHO; н) (COOH) 2 {CO 2 }; п) K 2 C 2 O 4 . Здесь и далее в необходимых случаях в фигурных скобках указаны продукты окисления.
- Составьте уравнения реакций, протекающих при пропускании следующих газов через подкисленный серной кислотой раствор перманганата калия: а) C 2 H 2 {CO 2 }; б) C 2 H 4 {CO 2 }; в) C 3 H 4 (пропин) {CO 2 и CH 3 COOH}; г) C 3 H 6 ; д) CH 4 ; е) HCHO.
- То же, но раствор восстановителя добавлен к нейтральному раствору перманганата калия: а) KHS; б) K 2 S; в) KHSO 3 ; г) K 2 SO 3 ; д) KNO 2 ; е) KI.
- То же, но в раствор перманганата калия
предварительно добавлен раствор гидроксида
калия: а) K 2 S {K 2 SO 4 }; б) K 2 SO 3 ;
в) KNO 2 ; г) KI {KIO 3 }.

- Составьте уравнения следующих реакций,
протекающих в растворе: а) KMnO 4 + H 2 S …;
б) KMnO 4 + HCl …;
в) KMnO 4 + HBr …;
г) KMnO 4 + HI … - Составьте следующие уравнения ОВР диоксида марганца:
- К подкисленному серной кислотой раствору дихромата калия добавлены растворы следующих веществ: а) KHS; б) K 2 S; в) HNO 2 ; г) KNO 2 ; д) KI; е) FeSO 4 ; ж) CH 3 CH 2 CHO; и) H 2 SO 3 ; к) KHSO 3 ; л) K 2 SO 3 . Составьте уравнения протекающих реакций.
- То же, но через раствор пропущены следующие газы: а) H 2 S; б) SO 2 .
- К раствору хромата калия, содержащему гидроксид калия, добавлены растворы а) K 2 S {K 2 SO 4 }; б) K 2 SO 3 ; в) KNO 2 ; г) KI {KIO 3 }. Составьте уравнения протекающих реакций.
- К раствору хлорида хрома(III) прибавили раствор гидроксида калия до растворения первоначально образовавшегося осадка, а затем – бромную воду. Составьте уравнения протекающих реакций.
- То же, но на последнем этапе был добавлен
раствор пероксодисульфата калия K 2 S 2 O 8 ,
восстановивегося в процессе реакции до сульфата.

- Составьте уравнения реакций, протекающих в растворе:
- Составьте уравнения реакций, протекающих между твердым триоксидом хрома и следующими веществами: а) C; б) CO; в) S {SO 2 }; г) H 2 S; д) NH 3 ; е) C 2 H 5 OH {CO 2 и H 2 O}; ж) CH 3 COCH 3 .
- Составьте уравнения реакций, протекающих при добавлении в концентрированную азотную кислоту следующих веществ: а) S {H 2 SO 4 }; б) P 4 {(HPO 3) 4 }; в) графит; г) Se; д) I 2 {HIO 3 }; е) Ag; ж) Cu; и) Pb; к) KF; л) FeO; м) FeS; н) MgO; п) MgS; р) Fe(OH) 2 ; с) P 2 O 3 ; т) As 2 O 3 {H 3 AsO 4 }; у) As 2 S 3 ; ф) Fe(NO 3) 2 ; х) P 4 O 10 ; ц) Cu 2 S.
- То же, но при пропускании следующих газов: а) CO; б) H 2 S; в) N 2 O; г) NH 3 ; д) NO; е) H 2 Se; ж) HI.
- Одинаково, или по-разному будут протекать
реакции в следующих случаях: а) в высокую
пробирку на две трети заполненную
концентрированной азотной кислотой, поместили
кусочек магния; б) на поверхность магниевой
пластины поместили каплю концентрированной
азотной кислоты? Составьте уравнения реакций.

- В чем отличие реакции концентрированной азотной кислоты с сероводородной кислотой и с газообразным сероводородом? Составьте уравнения реакций.
- Одинаково ли будут протекать ОВР при добавлении к концентрированному раствору азотной кислоты безводного кристаллического сульфида натрия и его 0,1 M раствора?
- Концентрированной азотной кислотой обработали смесь следующих веществ: Cu, Fe, Zn, Si и Cr. Составьте уравнения протекающих реакций.
- Составьте уравнения реакций, протекающих при добавлении в разбавленную азотную кислоту следующих веществ: а) I 2 ; б) Mg; в) Al; г) Fe; д) FeO; е) FeS; ж) Fe(OH) 2 ; и) Fe(OH) 3 ; к) MnS; л) Cu 2 S; м) CuS; н) CuO; п) Na 2 S кр; р) Na 2 S р; с) P 4 O 10 .
- Какие процессы будут протекать при пропускании через разбавленный раствор азотной кислоты а) аммиака, б) сероводорода, в) диоксида углерода?
- Составьте уравнения реакций, протекающих при
добавлении в концентрированную серную кислоту
следующих веществ: а) Ag; б) Cu; в) графит; г) HCOOH; д) С 6 H 12 O 6 ;
е) NaCl кр; ж) C 2 H 5 OH.

- При пропускании через холодную концентрированную серную кислоту сероводорода образуется S и SO 2 , горячая концентрированная H 2 SO 4 окисляет серу до SO 2 . Составьте уравнения реакций. Как будет протекать реакция между горячей концентрированной H 2 SO 4 и сероводородом?
- Почему хлороводород получают, обрабатывая кристаллический хлорид натрия концентрированной серной кислотой, а бромоводород и йодоводород этим способом не получают?
- Составьте уравнения реакций, протекающих при взаимодействии разбавленной серной кислоты с а) Zn, б) Al, в) Fe, г) хромом в отсутствии кислорода, д) хромом на воздухе.
- Составьте уравнения реакций, характеризующих окислительно-восстановительные свойства пероксида водорода:
- Какие реакции протекают при нагревании следующих веществ: а) (NH 4) 2 CrO 4 ; б) NaNO 3 ; в) CaCO 3 ; г) Al(NO 3) 3 ; д) Pb(NO 3) 3 ; е) AgNO 3 ; ж) Hg(NO 3) 2 ; и) Cu(NO 3) 2 ; к) CuO; л) NaClO 4 ; м) Ca(ClO 4) 2 ; н) Fe(NO 3) 2 ; п) PCl 5 ; р) MnCl 4 ; с) H 2 C 2 O 4 ; т) LiNO 3 ; у) HgO; ф) Ca(NO 3) 2 ; х) Fe(OH) 3 ; ц) CuCl 2 ; ч) KClO 3 ; ш) KClO 2 ; щ) CrO 3 ?
- При сливании горячих растворов хлорида аммония
и нитрата калия протекает реакция,
сопровождающаяся выделением газа.
 Составьте
уравнение этой реакции.
Составьте
уравнение этой реакции. - Составьте уравнения реакций, протекающих при пропускании через холодный раствор гидроксида натрия а) хлора, б) паров брома. То же, но через горячий раствор.
- При взаимодействии с горячим концентрированным раствором гидроксида калия селен подвергается дисмутации до ближайших устойчивых степеней окисления (–II и +IV). Составьте уравнение этой ОВР.
- При тех же условиях сера подвергается аналогичной дисмутации, но при этом избыток серы реагирует с сульфит-ионами с образованием тиосульфат ионов S 2 O 3 2 . Составьте уравнения протекающих реакций. ;
- Составьте уравнения реакций электролиза а) раствора нитрата меди с серебряным анодом, б) раствора нитрата свинца с медным анодом.
а) CrCl 2 + FeCl 3 ; б) CrSO 4 + FeCl 3 ; в) CrSO 4 + H 2 SO 4 + O 2 ;
г) CrSO 4 + H 2 SO 4 + MnO 2 ; д) CrSO 4 + H 2 SO 4 + KMnO 4 .
В каких из этих реакций пероксид водорода является окислителем, а в каких – восстановителем?
Опыт 1. Окислительные
свойства перманганата калия в кислотной среде. K 3-4 каплям раствора перманганата калия прилить
равный объем разбавленного раствора серной
кислоты, а затем раствор сульфита натрия до
обесцвечивания. Составить уравнение реакции. Составить уравнение реакции.Опыт 2. Окислительные свойства перманганата калия в нейтральной среде. К 3-4 каплям раствора перманганата калия прилить 5-6 капель раствора сульфита натрия. Какое вещество выделилось в виде осадка? Опыт 3 . Окислительные свойства перманганата калия в щелочной среде. К 3-4 каплям раствора перманганата калия прилить 10 капель концентрированного раствора гидроксида натрия и 2 капли раствора сульфита натрия. Раствор должен приобрести зеленую окраску. Опыт 4 . Окислительные свойства дихромата калия в кислотной среде. 6 капель раствора дихромата калия подкислить четырьмя каплями разбавленного раствора серной кислоты и добавить раствор сульфита натрия до изменения окраски смеси. Опыт 5. Окислительные свойства
разбавленной серной кислоты. В одну пробирку
поместить гранулу цинка, а в другую – кусочек
медной ленты. В обе пробирки добавить 8-10 капель
разбавленного раствора серной кислоты. Опыт 6. Окислительные свойства концентрированной серной кислоты. Аналогично опыту 5, но добавить концентрированный раствор серной кислоты. Через минуту после начала выделения газообразных продуктов реакции ввести в пробирки полоски фильтровальной бумаги, смоченные растворами перманганата калия и сульфата меди. Объяснить происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 7. Окислительные свойства разбавленной азотной кислоты. Аналогично опыту 5, но добавить разбавленный раствор азотной кислоты. Наблюдать изменение цвета газообразных продуктов реакции. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 8 . Окислительные свойства концентрированной азотной кислоты. В пробирку поместить кусочек медной ленты и прилить 10 капель концентрированного раствора азотной кислоты. Осторожно нагреть до полного растворения металла. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 9 . Опыт 10 . Восстановительные свойства нитрита калия. К 5-6 каплям раствора перманганата калия добавить равный объем разбавленного раствора серной кислоты и раствор нитрита калия до полного обесцвечивания смеси. Опыт 11. Термическое разложение нитрата меди. Один микрошпатель тригидрата нитрата меди поместить в пробирку, закрепить ее в штативе и осторожно нагреть открытым пламенем. Наблюдать обезвоживание и последующее разложение соли. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 12 . Термическое разложение нитрата свинца. Провести аналогично опыту 11, поместив в пробирку нитрат свинца. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! В чем отличие процессов, протекающих при разложении этих солей? |
Алкены – это углеводороды, в молекулах которых есть ОДНА двойная С=С связь.
Номенклатура алкенов: в названии появляется суффикс -ЕН.
Первый член гомологического ряда – С2Н4 (этен).
Для простейших алкенов применяются также исторически сложившиеся названия:
· этилен (этен),
· пропилен (пропен),
В номенклатуре часто используются следующие одновалентные радикалы алкенов:
СН2-СН=СН2 |
Виды изомерии алкенов:
1. Изомерия углеродного скелета: (начиная с С4Н8 – бутен и 2-метилпропен)
2. Изомерия положения кратной связи: (начиная с С4Н8): бутен-1 и бутен-2.
3. Межклассовая изомерия: с циклоалканами (начиная с пропена):
C4H8 — бутен и циклобутан.
4. Пространственная изомерия алкенов:
Из-за того, что вокруг двойной связи невозможно свободное вращение, становится возможной цис-транс- изомерия .
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители , могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи:
Химические свойства алкенов.
Для алкенов характерны:
· реакции присоединения к двойной связи,
· реакции окисления,
· реакции замещения в «боковой цепи».
1. Реакции присоединения по двойной связи: менее прочная π-связь разрывается, образуется насыщенное соединение. Это реакции электрофильного присоединения — АЕ. | 1) Гидрирование: СН3-СН=СН2 + Н2 à Ch4-Ch3-Ch4 2) Галогенирование: СН3-СН=СН2 + Br2 (раствор)à Ch4-CHBr-Ch3Br Обесцвечивание бромной воды – качественная реакция на двойную связь. 3) Гидрогалогенирование: СН3-СН=СН2 + НBr à Ch4-CHBr-Ch4 (ПРАВИЛО МАРКОВНИКОВА: водород присоединяется к наиболее гидрированному атому углерода). 4) Гидратация — присоединение воды: СН3-СН=СН2 + НОН à Ch4-CH-Ch4 (присоединение также происходит по праилу Марковникова) | ||||||||||||||||
2. | СН3-СН=СН2 + HBr -(Н2О2)à СН3-СН2-СН2Br (реакция с бромоводородом в присутствии пероксида протекает против правила Марковникова ) | ||||||||||||||||
3. Горение – полное окисление алкенов кислородом до углекислого газа и воды. | С2Н4 + 3О2 = 2СО2 + 2Н2О | ||||||||||||||||
4. Мягкое окисление алкенов – реакция Вагнера : реакция с холодным водным раствором перманганата калия. | 3СН3-СН=СН2 + 2KMnO4 + 4h3O à 2MnO2 + 2KOH + 3СН3 — СН — СН2 OH OH (образуется диол) Обесцвечивание алкенами водного раствора перманганата калия – качественная реакция на алкены. | ||||||||||||||||
5. Жесткое окисление алкенов – горячим нейтральным или кислым раствором перманганата калия. | 1. При действии перманганата калия в кислой среде в зависимости от строения скелета алкена образуется:
СН3-С -1 Н =С-2 Н2 +2 KMn+7O4 + 3h3SO4 à Ch4-C +3 OOH + C+4 O2 + 2Mn+2SO4 + K2SO4 + 4h3O 2. Если реакция протекает в нейтральной среде ПРИ нагревании, то соответственно получаются калиевые соли :
3СН3С -1Н =С -2Н2 +10K MnO4 — tà 3CH 3 C +3OOK + + 3K 2C +4O3 + 10MnO2 +4Н2О+ K OH | ||||||||||||||||
6. | СН2=СН2 + O2 –(kat)à CН3СНО (уксусный альдегид) | ||||||||||||||||
7. Хлорирование и бромирование в боковую цепь: если реакция с хлором проводится на свету или при высокой температуре – идёт замещение водорода в боковой цепи. | СН3-СН=СН2 + Cl2 –(свет)à СН2-СН=СН2 +HCl | ||||||||||||||||
8. Полимеризация: | n СН3-СН=СН2 à(-CH–Ch3-)n пропилен ô полипропилен |
ПОЛУЧЕНИЕ АЛКЕНОВ
I. Крекинг алканов: | С7Н16 –(t)à Ch4- CH=Ch3 + C4h20 Алкен алкан |
II. Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи — реакция ЭЛИМИНИРОВАНИЯ. | Правило Зайцева: Отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода. |
III . Дегидратация спиртов при повышенной температуре (выше 140°C) в присутствии в одоотнимающих реагентов — оксида алюминия или концентрированной серной кислоты – реакция элиминирования. | Ch4-CH-Ch3 -Ch4 – (h3SO4,t>140o)à à h3O +Ch4-CH=CH -Ch4 (также подчиняется правилу Зайцева) |
IV . Дегалогенирование дигалогеналканов , имеющих атомы галогена у соседних атомов углерода , при действии активных металлов. | Ch3Br -CHBr -Ch4 +Mg àCh3=CH-Ch4+MgBr2 Также может использоваться цинк. |
V . Дегидрирование алканов при 500°С: | |
VI . Неполное гидрирование диенов и алкинов | С2Н2 + Н2 (недостаток) –(kat)à С2Н4 |
АЛКАДИЕНЫ.
Это углеводороды, содержащие две двойные связи. Первый член ряда – С3Н4 (пропадиен или аллен). В названии появляется суффикс – ДИЕН .
Типы двойных связей в диенах:
1.Изолированные двойные связи разделены в цепи двумя или более σ-связями: СН2=СН–СН2–СН=СН2 . Диены этого типа проявляют свойства, характерные для алкенов. |
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен) Подобные диены (аллены) относятся к довольно редкому и неустойчивому типу соединений. |
3.Сопряженные двойные связи разделены одной σ-связью: СН2=СН–СН=СН2 Сопряженные диены отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода. |
Изомерия диенов
1. Изомерия положения двойных связей : |
2. Изомерия углеродного скелета : |
3. Межклассовая изомерия с алкинами и циклоалкенами . Например, формуле С4Н6 соответствуют следующие соединения: |
4. Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию . (1)Цис-изомер (2) Транс-изомер |
Электронное строение сопряженных диенов.
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp 2 — гибридизованном состоянии и имеет плоское строение.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему ) и делокализованы между всеми атомами углерода.
Кратность связей (число общих электронных пар) между атомами углерода имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
ХИМИЧЕСКИЕ СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ К СОПРЯЖЕННЫМ ДИЕНАМ. Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах). Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная системы из двух двойных связей: Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). |
1. Гидрирование. CН3-СН2-СН=СН2 (1,2-продукт) СН2=СН-СН=СН2 + Н2 СН3-СН=СН-СН3 (1,4-продукт) В присутствии катализатора Ni получается продукт полного гидрирования: Ch3=CH-CH=Ch3 + 2 h3 –(Ni, t)à Ch4-Ch3-Ch3-Ch4 |
2. Галогенирование, гидрогалогенирование и гидратация 1,4-присоединение. 1,2-присоединение. При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана. |
3. Реакция полимеризации. Реакция протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком : nСН2=СН-СН=СН2 à (-СН2-СН=СН-СН2-)n полимеризация изопрена: nCh3=C–CH=Ch3 à(–Ch3 –C =CH –Ch3 –)n Ch4 Ch4 (полиизопрен) |
РЕАКЦИИ ОКИСЛЕНИЯ – мягкое, жесткое, а также горение. Протекают так же, как и в случае алкенов – мягкое окисление приводит к многоатомному спирту, а жесткое окисление – к смеси различных продуктов, зависящих от строения диена: СН2=СН –СН=СН2 + KMnO4 + h3O à СН2 – СН – СН – СН2 +MnO2 + KOH |
Алкадиены горят – до углекислого газа и воды. |
ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
1. Каталитическое дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах: Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен: |
2. Синтез Лебедева: (катализатор – смесь оксидов Al2O3,MgO, ZnO 2 C2H5OH –(Al2O3,MgO, ZnO, 450˚C)à Ch3=CH-CH=Ch3 + 2h3O + h3 |
3. Дегидратация двухатомных спиртов: |
4. Действие спиртового раствора щелочи на дигалогеналканы (дегидрогалогенирование ): |
Математическая подготовка при изучении химии – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
Требования ФГОС из предметной области «Математика и информатика», связанные с химией
- Овладение навыками устных, письменных, инструментальных вычислений.

- Развитие умений пользоваться оценкой и прикидкой при практических расчетах.
- Владение стандартными приемами решения рациональных и иррациональных, показательных, степенных, тригонометрических уравнений и неравенств, их систем.
- Развитие умений применять изученные понятия, результаты, методы для решения задач практического характера и задач из смежных дисциплин.
- Развитие умения использовать функционально-графические представления для описания и анализа реальных зависимостей.
- Развитие умений извлекать информацию, представленную в таблицах, на диаграммах, графиках.
- Формирование представлений о математике как о методе познания действительности, позволяющем описывать и изучать реальные процессы и явления.
Кроме того, предметная область «Естественные науки», согласно стандартам, должна обеспечить сформированность основ целостной научной картины мира, понимание взаимосвязи и взаимозависимости естественных наук. Достижение этого результата обеспечит способность ребенка применить знания, полученные на уроках математики, в новых обстоятельствах — например, на уроке химии.
Что выявило НИКО по химии 2017 года
- У подавляющего большинства учащихся 10 классов не сформированы навыки вычислений с использованием понятий «массовая доля элемента», «процент», «количество вещества».
- Многие десятиклассники допускают ошибки при нахождении молярной массы вещества, переводе массы элемента из килограммов в граммы, расчетах по уравнениям реакций, сравнении отрицательных температур.
- Не все школьники могут правильно интерпретировать табличную и графическую зависимость и давать ей хотя бы минимальное разумное объяснение.
Как отметили в Рособрнадзоре, неуспех по химии связан, в частности, с низким уровнем базовой математической подготовки. Решить проблему поможет отработка необходимых навыков на уроках химии, решение разноплановых задач. Например, в УМК «Химия» В.В. Еремина корпорации «Российский учебник» широко представлены задания на анализ таблиц, работу с рисунками и графиками, вычисление процентов и т.д.
Разберем решения нескольких задач, в которых применяются математические знания.
Загляните в учебник «Химия. Углубленный уровень. 10 класс», чтобы узнать еще больше о заданиях с вычислениями.
Примеры заданий на основе кривых растворимости
Задание 1
На графике представлена зависимость растворимости аммиака в воде от температуры:
Используя график, определите:
а) массовую долю аммиака в насыщенном растворе при температуре 60 °С;
б) объем (н.у.) аммиака, который следует растворить в 1 л воды при температуре 25 °С для получения насыщенного раствора.
Решение.
а) По графику определяем растворимость аммиака в насыщенном растворе при температуре 60 °С: s = 20 г / 100 г воды. Находим массовую долю аммиака в насыщенном растворе: w = s / (s + 100) = 20 / (20 + 100) = 0,167, или 16,7 %.
б) По графику определяем растворимость аммиака в насыщенном растворе при температуре 25 °С: s = 50 г / 100 г воды.
Значит, в 1 л воды, масса которой равна 1000 г, растворится 50 ∙ 1000 /100 = 500 г аммиака, количество которого составит n = 500 /17 = 29,41 моль.
Объем аммиака будет равен V = 22,4 ∙ 29,41 = 659 л.
Ответ: 16,7 %, 659 л.
Задание 2
На графике представлена зависимость растворимости некоторых солей в воде от температуры:
Используя график, определите:
а) массовую долю нитрата калия в насыщенном растворе при температуре 20 °С;
б) массу нитрата калия, которая выпадет в осадок из 150 г насыщенного при 70 °С раствора при его охлаждении до 50 °С.
Решение.
а) По графику определяем растворимость KNO3 в насыщенном растворе при температуре 20 °С: s = 30 г / 100 г воды.
Находим массовую долю KNO3 в насыщенном растворе: w = s / (s + 100) = 30/(30 + 100) = 0,23, или 23 %.
б) По графику определяем растворимость KNO3 в насыщенном растворе при температуре 70 °С: s = 120 г / 100 г воды, а при 50 °С − 80 г / 100 г воды. При охлаждении насыщенного при 70 °С раствора до 50 °С из (120 + 100) г раствора выпадает (120 − 80) г KNO3, из 150 г раствора – х г KNO3
х = 150 ∙ 40 / 220 = 27,3 г.
Ответ: 23 %, 27,3 г.
Пример решения задачи на «кислые − средние соли» с помощью системы алгебраических уравнений
Какие соли и в каких количествах образуются при пропускании 4,48 л оксида серы (IV) через 70 г 20% раствора гидроксида калия?
Решение.
При взаимодействии SO2 и KOH возможно протекание двух реакций с образованием средней или кислой соли:
SO2 + KOH = KHSO3,
SO2 + 2KOH = K2 SO3 + H2O.
По условию задачи v(SO2) = 4,48 / 22,4 = 0,2 моль, v(KOH) = 70 ⋅ 0,2 / 56 = 0,25 моль.
Так как v(KOH) / v(SO2) = 1,25, то частично пойдут обе реакции.
Пусть x моль SO2 вступит в первую реакцию, а y моль — во вторую, тогда x + y = 0,2
xSO2 + xKOH = xKHSO3,
ySO2 + 2y2KOH = yK2HSO3 + H2O.
Согласно уравнениям реакций, в первую реакцию вступит x моль KOH, а во вторую — 2y моль KOH, всего: x + 2y = 0,25 моль. Составим систему уравнений:
Составим систему уравнений:
{ x + y = 0,2x + 2y = 25
Находим: x = 0,15, y = 0,05.
Ответ: 0,15 моль KHSO3, 0,05 моль K2SO3.
Читайте также:
Неметаллы
Карбоновые кислоты
Великие женщины: химики-исследователи
Технология критического мышления на уроке химии
Пример решения химической задачи с помощью неравенства
Для сгорания газовой смеси двух ближайших гомологов алкенов объемом 6 л потребовалось 30 л кислорода (объемы газов измерены при одинаковых условиях). Определите, какие алкены входили в состав исходной газовой смеси.
xCnH2n + 1,5nx1,5nO2 → nCO2 + nH2O
6 − xCn+1H2n+2 + (1,5n + 1,5)(6 − x)(1,5n + 1,5)O2 → (n + 1)CO2 + (n + 1)H2O
Пусть в смеси было x л первого гомолога, тогда второго — (6 − х) л.
V(O2) = 1,5nx + (1,5n + 1,5)(6 − x) = 9n − 1,5x + 9 = 30
9n − 1,5x = 21
Пусть в смеси был только первый гомолог, т. е. х = 6. Тогда
е. х = 6. Тогда
9n − 1,5 ∙ 6 = 21, 9n = 30, откуда n = 3,33
Пусть в смеси был только второй гомолог, т.е. х = 0. Тогда
9n − 1,5 ∙ 0 = 21, 9n = 21, откуда n = 2,33
2,33 < n < 3,33, n — целое число => n = 3.
Формулы алкенов: C3H6 и C4H8
Рассчитайте рН раствора уксусной кислоты с концентрацией 1,5 моль/л. Константа диссоциации СН3СООН равна 1,7 ⋅ 10−5.
Решение.
Запишем уравнение диссоциации:
CH3COOH ⇆ CH3COO− + H+
Воспользуемся приближенной формулой для нахождения степени диссоциации:
Концентрация ионов водорода равна:
Водородный показатель: рН = − lg(5,0 ∙ 10−3) = −lg5,0 − lg10-3 = — 0,7 + 3 = 2,3.
Ответ: рН = 2,3.
#ADVERTISING_INSERT#
youtube.com/embed/itGJf_z9Fqg» frameborder=»0″ allowfullscreen=»»>РАСТВОР БИСУЛЬФИТА КАЛИЯ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора включают общие идентификационные номера, алмаз NFPA Знаки опасности Министерства транспорта США и общий описание хим. Информация в CAMEO Chemicals поступает из множества источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
| никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто | никто | ||
NFPA 704
нет данных
Общее описание
Бесцветный водный раствор со слабым запахом диоксида серы. Используется в качестве восстановителя и химического консерванта.
Используется в качестве восстановителя и химического консерванта.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
- Сильный восстановитель
Реакции с воздухом и водой
Растворим в воде.
Пожароопасность
Выдержка из Руководства ERG 154 [Вещества – Токсичные и/или Коррозионные (Негорючие)]:
Негорючее, само по себе вещество не горит, но может разлагаться при нагревании с образованием едких и/или токсичных паров. Некоторые из них являются окислителями и могут воспламенять горючие материалы (дерево, бумагу, масло, одежду и т. д.). При контакте с металлами может выделяться легковоспламеняющийся газообразный водород. Контейнеры могут взорваться при нагревании. Для электромобилей или оборудования также следует обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ЭРГ, 2020)
д.). При контакте с металлами может выделяться легковоспламеняющийся газообразный водород. Контейнеры могут взорваться при нагревании. Для электромобилей или оборудования также следует обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ЭРГ, 2020)
Опасность для здоровья
Выдержка из Руководства ERG 154 [Вещества – токсичные и/или коррозионно-активные (негорючие)]:
ТОКСИЧНЫЕ; вдыхание, проглатывание или контакт с кожей материала может привести к серьезной травме или смерти. Контакт с расплавленным веществом может вызвать сильные ожоги кожи и глаз. Избегайте любого контакта с кожей. Эффекты контакта или вдыхания могут быть отсрочены. При пожаре могут выделяться раздражающие, коррозионные и/или токсичные газы. Сток от пожаротушения или вода для разбавления могут быть коррозионно-активными и/или токсичными и вызывать загрязнение окружающей среды. (ЭРГ, 2020)
Профиль реакционной способности
РАСТВОР БИСУЛЬФИТА КАЛИЯ является восстановителем.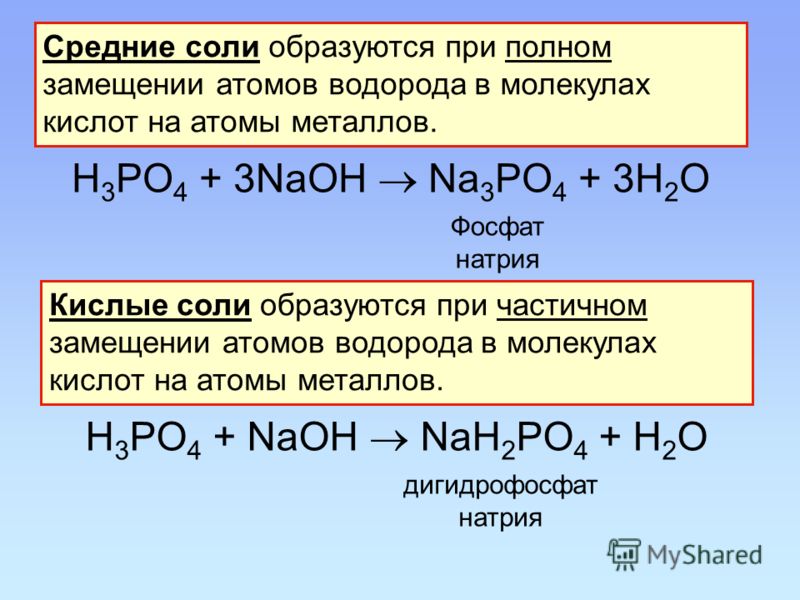 Реагирует как основание для нейтрализации кислот.
Реагирует как основание для нейтрализации кислот.
Принадлежит к следующей реакционной группе(ам):
- Сульфитные и тиосульфатные соли
- Вода и водные растворы
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по реагированию
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 154 [Вещества — токсичные и/или коррозионные (негорючие)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров. (75 футов) для твердых веществ.
РАЗЛИВ: При необходимости увеличьте расстояние для немедленных мер предосторожности в подветренном направлении.
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 154 [Вещества – Токсичные и/или Коррозионные (Негорючие)]:
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, CO2 или распыленная вода.
БОЛЬШОЙ ПОЖАР: Сухой химикат, CO2, спиртоустойчивая пена или распыленная вода. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня. Сток дамбы от пожарной охраны для последующей утилизации.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 154 [Вещества – токсичные и/или коррозионные (негорючие)]:
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя) в непосредственной близости. Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если вы не надели соответствующую защитную одежду. Остановите утечку, если вы можете сделать это без риска. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры. НЕ ПОЛУЧАЙТЕ ВОДУ ВНУТРИ КОНТЕЙНЕРОВ. (ЭРГ, 2020)
Защитная одежда
Выдержка из Руководства ERG 154 [Вещества – токсичные и/или коррозионные (негорючие)]:
Наденьте автономный дыхательный аппарат с избыточным давлением (SCBA). Носите одежду химической защиты, специально рекомендованную производителем, когда НЕТ РИСКА ПОЖАРА. Структурная защитная одежда пожарных обеспечивает тепловую защиту, но лишь ограниченную химическую защиту. (ЭРГ, 2020)
Носите одежду химической защиты, специально рекомендованную производителем, когда НЕТ РИСКА ПОЖАРА. Структурная защитная одежда пожарных обеспечивает тепловую защиту, но лишь ограниченную химическую защиту. (ЭРГ, 2020)
Ткани для костюмов DuPont Tychem®
Нет доступной информации.
Первая помощь
Выдержка из Руководства ERG 154 [Вещества – токсичные и/или коррозионные (негорючие)]:
Позвоните в службу 911 или в службу неотложной медицинской помощи. Убедитесь, что медицинский персонал знает о материале(ах) и принимает меры предосторожности для своей защиты. Переместите пострадавшего на свежий воздух, если это можно сделать безопасно. Сделайте искусственное дыхание, если пострадавший не дышит. Не проводите реанимацию рот в рот, если пострадавший проглотил или вдохнул вещество; вымойте лицо и рот перед проведением искусственного дыхания. Используйте карманную маску с односторонним клапаном или другое надлежащее респираторное медицинское устройство. Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно промойте кожу или глаза проточной водой в течение не менее 20 минут. При незначительном контакте с кожей избегайте нанесения материала на здоровую кожу. Держите пострадавшего в покое и тепле. Последствия воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут проявляться с задержкой. (ЭРГ, 2020)
Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно промойте кожу или глаза проточной водой в течение не менее 20 минут. При незначительном контакте с кожей избегайте нанесения материала на здоровую кожу. Держите пострадавшего в покое и тепле. Последствия воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут проявляться с задержкой. (ЭРГ, 2020)
Физические свойства
Что это за информация?
Поля физических свойств включают в себя такие свойства, как давление пара и температура кипения, а также пределы взрываемости и пороги токсического воздействия Информация в CAMEO Chemicals поступает из различных источников. источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: данные отсутствуют
Давление пара: данные отсутствуют ): данные отсутствуют
Удельный вес: данные отсутствуют
Температура кипения: данные отсутствуют
Молекулярная масса: данные отсутствуют
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные недоступны
IDLH: данные недоступны
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитных действий)
Информация о PAC отсутствует.Нормативная информация
Что это за информация?
Поля нормативной информации включить информацию из Сводный список III Агентства по охране окружающей среды США списки, Химический завод Агентства кибербезопасности и безопасности инфраструктуры США антитеррористические стандарты, и Управление по охране труда и здоровья США Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами (подробнее об этих источники данных).
Сводный перечень списков EPA
Отсутствует нормативная информация.
Антитеррористические стандарты химического предприятия CISA (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- КИСЛОТА КАЛИЯ СУЛЬФИТ
- КАЛИЯ БИСУЛЬФИТ
- РАСТВОР БИСУЛЬФИТА КАЛИЯ
- КАЛИЯ БИСУЛЬФИТА РАСТВОР
- КАЛИЙ ВОДОРОД СУЛЬФИТ
- КАЛИЯ СУЛЬФИТ (KHSO3)
? => KHSO3 (гидросульфит калия; гидросульфит калия; сульфит калия; монокалий сернистой кислоты; водород сернистой кислоты = калийная соль)
| Поиск |
= гидросульфит калия; гидросульфит калия; сульфит калия; Сернистая кислота монокалиевая; Сернистая кислота водород=калиевая соль
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>




 Составьте
уравнение этой реакции.
Составьте
уравнение этой реакции. Сравнить
происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ
ШКАФУ!
Сравнить
происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ
ШКАФУ! Окислительные свойства
нитрита калия. К 5-6 каплям раствора нитрита
калия прилить равный объем разбавленного
раствора серной кислоты и 5 капель раствора
иодида калия. Образование каких веществ
наблюдается?
Окислительные свойства
нитрита калия. К 5-6 каплям раствора нитрита
калия прилить равный объем разбавленного
раствора серной кислоты и 5 капель раствора
иодида калия. Образование каких веществ
наблюдается? Присоединение бромоводорода в присутствии пероксидов (эффект Хараша) — это радикальное присоединение — АR
Присоединение бромоводорода в присутствии пероксидов (эффект Хараша) — это радикальное присоединение — АR Идёт с разрывом двойной связи С=С.
Идёт с разрывом двойной связи С=С. Окисление кислородом этилена в присутствии солей палладия.
Окисление кислородом этилена в присутствии солей палладия.


 С4Н6 + 5,5О2 à 4СО2 + 3Н2О
С4Н6 + 5,5О2 à 4СО2 + 3Н2О
 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
 2 2NaOH + K 2 HPO 4 → 2KOH + Na 2 HPO 4 H 2 O + K 2 O → 2KOH
2 2NaOH + K 2 HPO 4 → 2KOH + Na 2 HPO 4 H 2 O + K 2 O → 2KOH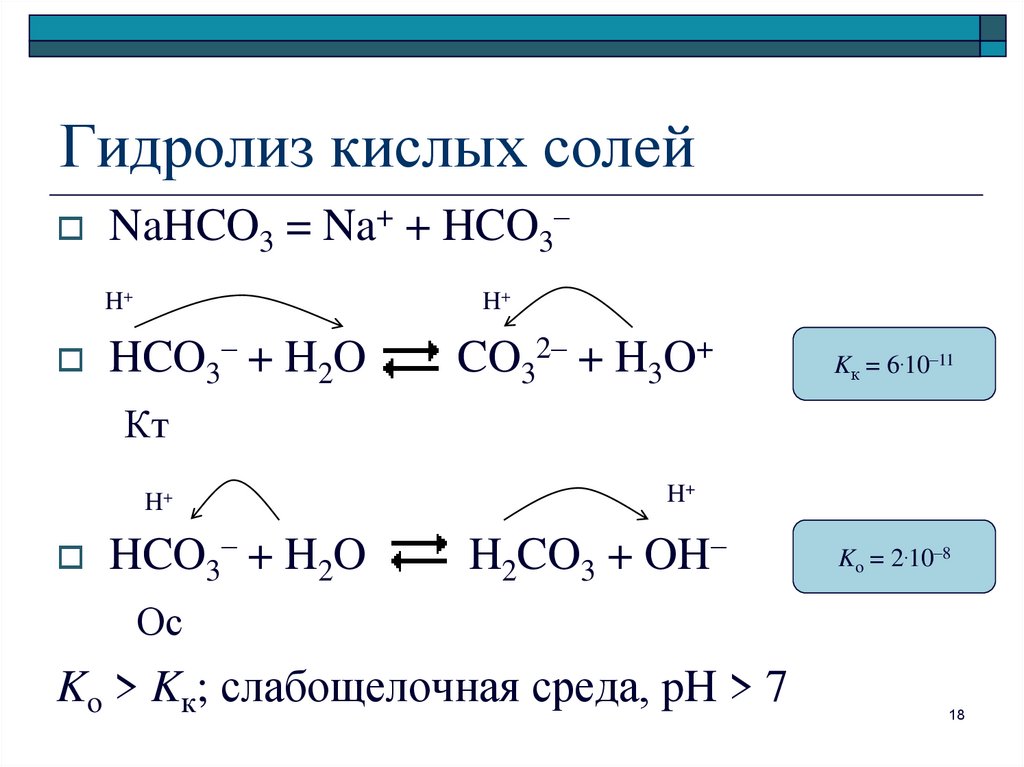 Однако
Однако  Гидросульфит калия или бисульфит калия представляет собой химическое соединение с химической формулой KHSO3. Применяется при производстве алкогольных напитков в качестве стерилизующего средства. Его получают реакцией диоксида серы и карбоната калия. Диоксид серы пропускают через раствор карбоната калия до тех пор, пока не перестанет выделяться диоксид углерода. Раствор концентрируют и затем дают кристаллизоваться. Бисульфит калия используется для консервации бесцветных пищевых продуктов, таких как фруктовые соки, кабачки, яблоки и сырое манго
Гидросульфит калия или бисульфит калия представляет собой химическое соединение с химической формулой KHSO3. Применяется при производстве алкогольных напитков в качестве стерилизующего средства. Его получают реакцией диоксида серы и карбоната калия. Диоксид серы пропускают через раствор карбоната калия до тех пор, пока не перестанет выделяться диоксид углерода. Раствор концентрируют и затем дают кристаллизоваться. Бисульфит калия используется для консервации бесцветных пищевых продуктов, таких как фруктовые соки, кабачки, яблоки и сырое манго Целью данного проекта является изучение действия бисульфита калия в качестве пищевого консерванта. я. При разных температурах. II. С разной концентрацией сахара. III. Для разной концентрации KHSO3.
Целью данного проекта является изучение действия бисульфита калия в качестве пищевого консерванта. я. При разных температурах. II. С разной концентрацией сахара. III. Для разной концентрации KHSO3. Смешать с сахаром и красителями. Образовавшийся таким образом материал называется фруктовым джемом. Это может быть использовано для изучения влияния концентрации, температуры и времени.
Смешать с сахаром и красителями. Образовавшийся таким образом материал называется фруктовым джемом. Это может быть использовано для изучения влияния концентрации, температуры и времени. Этанольный гриб, стал зеленоватым цветом.0003
Этанольный гриб, стал зеленоватым цветом.0003 г 3 г
г 3 г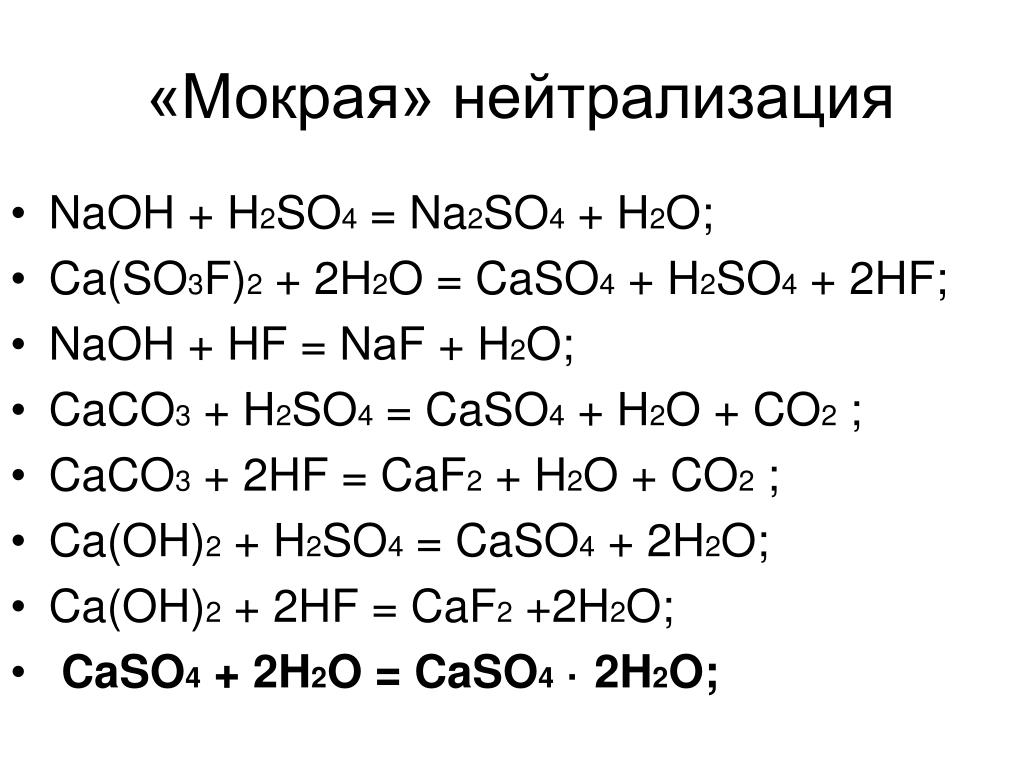 Номер бутылки Масса взятого варенья Масса добавленного сахара Масса KHSO3 Наблюдение (дни) Цвет Запах День 1 Грибок
Номер бутылки Масса взятого варенья Масса добавленного сахара Масса KHSO3 Наблюдение (дни) Цвет Запах День 1 Грибок запах Грибок стал зеленоватым Темно-оранжевый Темно-оранжевый Запах приятный Резкий запах Белый грибок не образовался Зеленый цвет Образование грибка Темно-оранжевый Оранжевый Приятный запах Резкий запах Белый грибок нет Грибок превратился образовался черный цвет
запах Грибок стал зеленоватым Темно-оранжевый Темно-оранжевый Запах приятный Резкий запах Белый грибок не образовался Зеленый цвет Образование грибка Темно-оранжевый Оранжевый Приятный запах Резкий запах Белый грибок нет Грибок превратился образовался черный цвет В форме спрея он может помочь предотвратить обесцвечивание или потемнение продуктов.
В форме спрея он может помочь предотвратить обесцвечивание или потемнение продуктов. Однако химические вещества не должны быть вредными для человека. Такие химические вещества, которые добавляют в пищевые продукты для предотвращения их порчи, известны как химические консерванты. В нашей стране разрешены к использованию два химических консерванта: 1. Бензойная кислота (или бензоат натрия) 2. Диоксид серы (или бисульфит калия) Бензойная кислота или ее натриевая соль, бензоат натрия обычно используются для консервации пищевых материалов. . Для консервирования фруктов, фруктовых соков, кабачков и джемов в качестве консерванта используется бензоат натрия, поскольку он растворим в воде и, следовательно, легко смешивается с пищевым продуктом. Гидросульфит калия или бисульфит калия представляет собой химическое соединение с химической формулой KHSO3. Применяется при производстве алкогольных напитков в качестве стерилизующего средства.
Однако химические вещества не должны быть вредными для человека. Такие химические вещества, которые добавляют в пищевые продукты для предотвращения их порчи, известны как химические консерванты. В нашей стране разрешены к использованию два химических консерванта: 1. Бензойная кислота (или бензоат натрия) 2. Диоксид серы (или бисульфит калия) Бензойная кислота или ее натриевая соль, бензоат натрия обычно используются для консервации пищевых материалов. . Для консервирования фруктов, фруктовых соков, кабачков и джемов в качестве консерванта используется бензоат натрия, поскольку он растворим в воде и, следовательно, легко смешивается с пищевым продуктом. Гидросульфит калия или бисульфит калия представляет собой химическое соединение с химической формулой KHSO3. Применяется при производстве алкогольных напитков в качестве стерилизующего средства. Раствор концентрируют, а затем дают кристаллизоваться. Бисульфит калия используется для консервации бесцветных пищевых материалов, таких как фруктовые соки, кабачки, яблоки и чатни из сырого манго. Это не используется для консервирования цветных пищевых материалов, потому что диоксид серы, полученный из этого химического вещества, представляет собой отбеливающий порошок. Бисульфит калия при реакции с кислотой сока высвобождает диоксид серы, который очень эффективно убивает вредные микроорганизмы, присутствующие в пище, и, таким образом, предотвращает ее порчу.
Раствор концентрируют, а затем дают кристаллизоваться. Бисульфит калия используется для консервации бесцветных пищевых материалов, таких как фруктовые соки, кабачки, яблоки и чатни из сырого манго. Это не используется для консервирования цветных пищевых материалов, потому что диоксид серы, полученный из этого химического вещества, представляет собой отбеливающий порошок. Бисульфит калия при реакции с кислотой сока высвобождает диоксид серы, который очень эффективно убивает вредные микроорганизмы, присутствующие в пище, и, таким образом, предотвращает ее порчу. Эти изменения можно проверить добавлением небольшого количества бисульфита калия. Эффективность KHSO3 как консерванта зависит от его концентрации в различных условиях, которую можно определить экспериментально.
Эти изменения можно проверить добавлением небольшого количества бисульфита калия. Эффективность KHSO3 как консерванта зависит от его концентрации в различных условиях, которую можно определить экспериментально. 7. Наблюдайте за изменениями, происходящими в джеме каждый день. ЗАПИСЬ: Номер бутылки Вес взятого варенья Вес добавленного сахара Вес KHSO3 Наблюдение (дни) Цвет День 1
7. Наблюдайте за изменениями, происходящими в джеме каждый день. ЗАПИСЬ: Номер бутылки Вес взятого варенья Вес добавленного сахара Вес KHSO3 Наблюдение (дни) Цвет День 1 цвет грибка усилился Желтая окраска исчезла Запах Этанол
цвет грибка усилился Желтая окраска исчезла Запах Этанол 0gm
0gm 0gm
0gm
 Аллергии Сульфиты, такие как бисульфит калия, могут вызвать приступ у людей, страдающих астмой. Бисульфит калия может вызвать раздражение легких.
Аллергии Сульфиты, такие как бисульфит калия, могут вызвать приступ у людей, страдающих астмой. Бисульфит калия может вызвать раздражение легких. Б.ГОШХ.О.Д. Химия 12-й
Научный ролл №. = «Лестнице успеха все равно, кто поднимается
это.»
Б.ГОШХ.О.Д. Химия 12-й
Научный ролл №. = «Лестнице успеха все равно, кто поднимается
это.» Мой проект никогда не был бы возможен
без вашего руководства. Большое спасибо.Особая благодарность моему
директор, который оказал мне поддержку, и библиотека, которая обеспечивает меня
полезные книги, связанные с этим проектом. Следующими в моем списке благодарностей являются
мои друзья, преподаватели, студенты, которые действительно осыпались конструктивными
отзывы и предложения, без которых этого проекта не было бы
был в нынешнем виде.
Мой проект никогда не был бы возможен
без вашего руководства. Большое спасибо.Особая благодарность моему
директор, который оказал мне поддержку, и библиотека, которая обеспечивает меня
полезные книги, связанные с этим проектом. Следующими в моем списке благодарностей являются
мои друзья, преподаватели, студенты, которые действительно осыпались конструктивными
отзывы и предложения, без которых этого проекта не было бы
был в нынешнем виде. Однако химические вещества
не должны быть опасны для человека. Такие химические вещества
которые добавляют в пищевые продукты для предотвращения их порчи.
известны как химические консерванты. В нашей стране два химических
консерванты, которые разрешены к использованию: 1. Бензойная кислота (или
бензоат натрия)2. Диоксид серы (или бисульфит калия) Бензойная
кислоты или ее натриевой соли, бензоат натрия обычно используется для
консервирование пищевых материалов. Для сохранения фруктов,
фруктовые соки, кабачки и джемы Бензоат натрия используется в качестве
консервант, потому что он растворим в воде и, следовательно, легко смешивается
с пищевым продуктом.2
Однако химические вещества
не должны быть опасны для человека. Такие химические вещества
которые добавляют в пищевые продукты для предотвращения их порчи.
известны как химические консерванты. В нашей стране два химических
консерванты, которые разрешены к использованию: 1. Бензойная кислота (или
бензоат натрия)2. Диоксид серы (или бисульфит калия) Бензойная
кислоты или ее натриевой соли, бензоат натрия обычно используется для
консервирование пищевых материалов. Для сохранения фруктов,
фруктовые соки, кабачки и джемы Бензоат натрия используется в качестве
консервант, потому что он растворим в воде и, следовательно, легко смешивается
с пищевым продуктом.2 HSO3(водн.) + H+ (водн.)> h3O(ж) + SO2(г)Преимущество
этого метода заключается в том, что в пище не остается вредных химических веществ.
Целью данного проекта является изучение действия бисульфита калия
в качестве пищевого консерванта.i. При разных температурах.ii. В разных
концентрации иiii. За разные промежутки времени.3
HSO3(водн.) + H+ (водн.)> h3O(ж) + SO2(г)Преимущество
этого метода заключается в том, что в пище не остается вредных химических веществ.
Целью данного проекта является изучение действия бисульфита калия
в качестве пищевого консерванта.i. При разных температурах.ii. В разных
концентрации иiii. За разные промежутки времени.3 Его можно использовать для изучения влияния
концентрация сахара и KHSO3, температура и время.
Его можно использовать для изучения влияния
концентрация сахара и KHSO3, температура и время. 00 грамм0.5
gmNOChangeFewChangeFewChangeSomeChangeMoreChange
00 грамм0.5
gmNOChangeFewChangeFewChangeSomeChangeMoreChange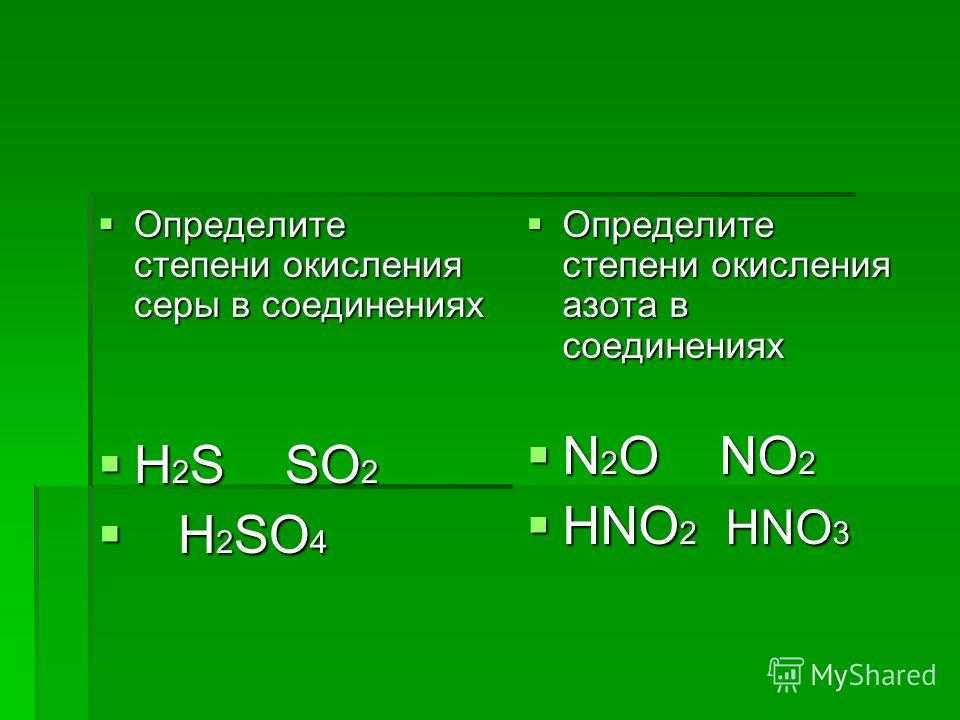 3.
Тщательно перемешайте содержимое палочкой для перемешивания.4. Сохраните номер бутылки.
I в холодильнике при 0С, флакон №II при комнатной температуре
(25С) и флакон №III в термостате при 50С. Соблюдайте
изменения, происходящие в варенье в течение 10 дней. из
варенье взято добавленоМас. сахараВес. KHSO3Наблюдений (Дней)
3.
Тщательно перемешайте содержимое палочкой для перемешивания.4. Сохраните номер бутылки.
I в холодильнике при 0С, флакон №II при комнатной температуре
(25С) и флакон №III в термостате при 50С. Соблюдайте
изменения, происходящие в варенье в течение 10 дней. из
варенье взято добавленоМас. сахараВес. KHSO3Наблюдений (Дней)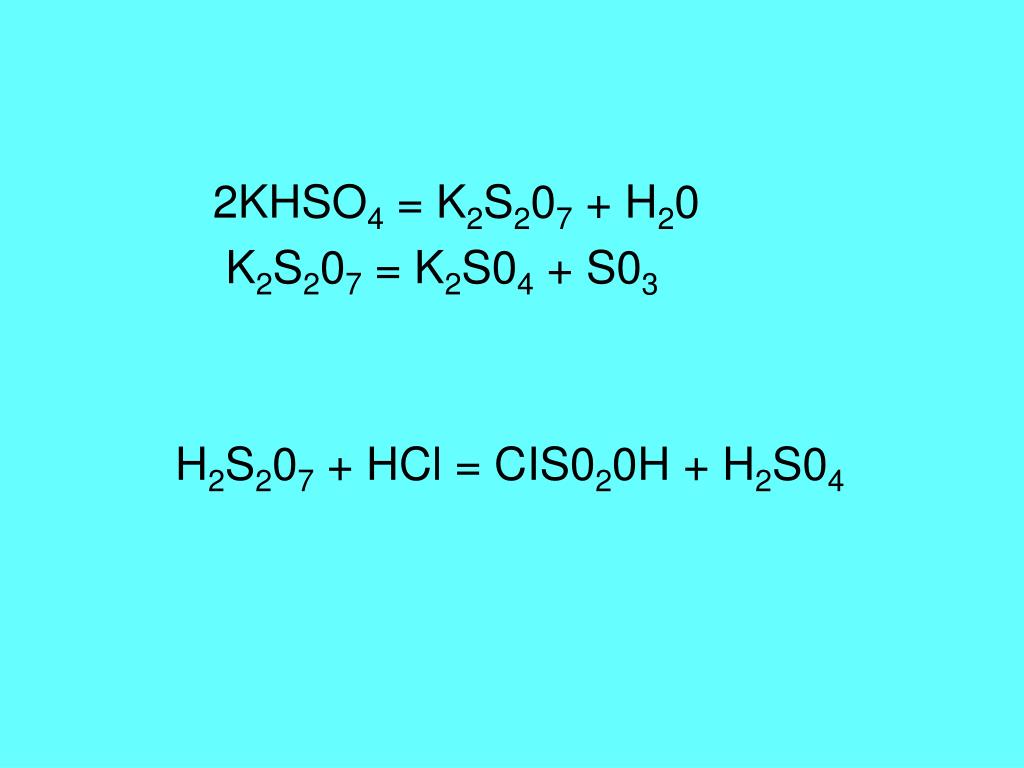 10
10
 Для сохранения фруктов,
фруктовые соки, кабачки и джемы Бензоат натрия используется в качестве
консервант, потому что он растворим в воде и, следовательно, легко смешивается
с пищевым продуктом.2
Для сохранения фруктов,
фруктовые соки, кабачки и джемы Бензоат натрия используется в качестве
консервант, потому что он растворим в воде и, следовательно, легко смешивается
с пищевым продуктом.2 3
3 Добавить 5,0 г, 10,0
г и 15,0 г сахара в бутылки №№ I, II и III
соответственно.4. Добавьте в каждую бутылку 0,5 г KHSO3.5. Смешайте содержимое
тщательно с помощью палочки для перемешивания.6. Закройте бутылку и позвольте им
выдержать одну неделю или 10 дней при комнатной температуре.7. Соблюдайте
изменения происходят в Варенье каждый день.BottleNo.Wt. взятого варенья
добавленная масса сахараВес. KHSO3Наблюдений (Дней)
Добавить 5,0 г, 10,0
г и 15,0 г сахара в бутылки №№ I, II и III
соответственно.4. Добавьте в каждую бутылку 0,5 г KHSO3.5. Смешайте содержимое
тщательно с помощью палочки для перемешивания.6. Закройте бутылку и позвольте им
выдержать одну неделю или 10 дней при комнатной температуре.7. Соблюдайте
изменения происходят в Варенье каждый день.BottleNo.Wt. взятого варенья
добавленная масса сахараВес. KHSO3Наблюдений (Дней) 4. Добавьте 1,0 г,
2,0 г и 3,0 г KHSO3 во флакон № I, II и III
соответственно.5. Тщательно перемешайте содержимое стеклянной палочкой.6.
Держите все бутылки при комнатной температуре около 10 дней и
наблюдать за изменениями каждый день.ЗАПИСЬ:BottleNo.Wt. взятого варенья
добавленная масса сахараВес. KHSO3Наблюдений (Дней)
4. Добавьте 1,0 г,
2,0 г и 3,0 г KHSO3 во флакон № I, II и III
соответственно.5. Тщательно перемешайте содержимое стеклянной палочкой.6.
Держите все бутылки при комнатной температуре около 10 дней и
наблюдать за изменениями каждый день.ЗАПИСЬ:BottleNo.Wt. взятого варенья
добавленная масса сахараВес. KHSO3Наблюдений (Дней)