4 способа получения карбоната натрия????
Почему горячая вода при температуре -30° остывает быстрее холодной воды, при той же температуре -30°???Температура холодной воды (-3°)
Задача 7 – Абракадабра
Ученик получил задание, в котором по названиям веществ необходимо было
составить их химические формулы. Выполняя это задание, о
… н не оставил
пробелы между формулами веществ, в результате чего у него получилась
запись: h3ON2O3NaBO2h3CO2K3NCFeCl3N2К2SO3
1. Выделите из этой записи формулы индивидуальных веществ (учитывая,
что ни одно из веществ дважды не повторяется).
2. Отметьте простые вещества.
3. Напишите уравнения всех возможных реакций (с указанием условий их
протекания) записанных в п.1 веществ с водой.
Задача 8 – Изоэлектронные молекулы
Молекула вещества Х изоэлектронна молекуле азота (приставка «изо», про-
исходящая от греч. ισος – «равный», обозначает единообразие, равенство).
Вещества Х и азот имеют не только близкие физические свойства, но и
определенные аналогии в своих химических превращениях (хотя соеди-
нение Х более активно, чем азот).
Азот смешали с одним из газообразных (н.у.) алканов. В данной смеси газов объемная доля (N2) = 20%, а массовая доля (N2)= 13,73%. Установите молекуляр … ную формулу алкана.
Сплавили смесь равных масс ацетата натрия и гидроксида наьрия. Выделившийся газ сожгли в кислороде (недостатке) и получили смесь двух окчидов углерода
… объемом (н. у.) 8,96 дм³ и плотностью 1,538 г/дм³. Рассчитайте массу исходной смечи соли и щелочи
у.) 8,96 дм³ и плотностью 1,538 г/дм³. Рассчитайте массу исходной смечи соли и щелочи
Рассчитайте число формульных единиц в элементарной ячейке минерала сфалерита ZnS, если известно, что ионы цинка образуют ГЦК, в которой половина тетра … эдрических пустот заселена ионами серы.
Минерал Li2O имеет структуру анти-флюорита (расположение катионов и анионов обратно структуре флюорита). Укажите значение координационного числа лития … в структуре.
Решите пожалуйста задачу . Розрахуйте співвідношення мас Літію і Оксигену в літій оксиді (Li2O).(заранее спасибо♡)
Решите пожалуйста задачу ♡ .Розрахуйте співвідношення мас Літію і Оксигену в літій оксиді (Li2O).
Помогите пожалуйста.Задача 4. Розрахуйте співвідношення мас Магнію і Оксигену в магній оксиді (MgO).
Помогите пожалуйста.Задача 3. Скласти формулу сполуки Нітрогену з Оксигеном, якщо відношення мас Нітрогену та Оксигену в ній становить 7:20.
Карбонат натрия — это.
 .. Что такое Карбонат натрия?
.. Что такое Карбонат натрия?Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.

Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO 2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказал фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH 4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Карбонат натрия (кальцинированная сода) Название и функция вещества:
Карбонат натрия (кальцинированная сода) — регулятор кислотности; окислитель. Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Примечания
Карбонат натрия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.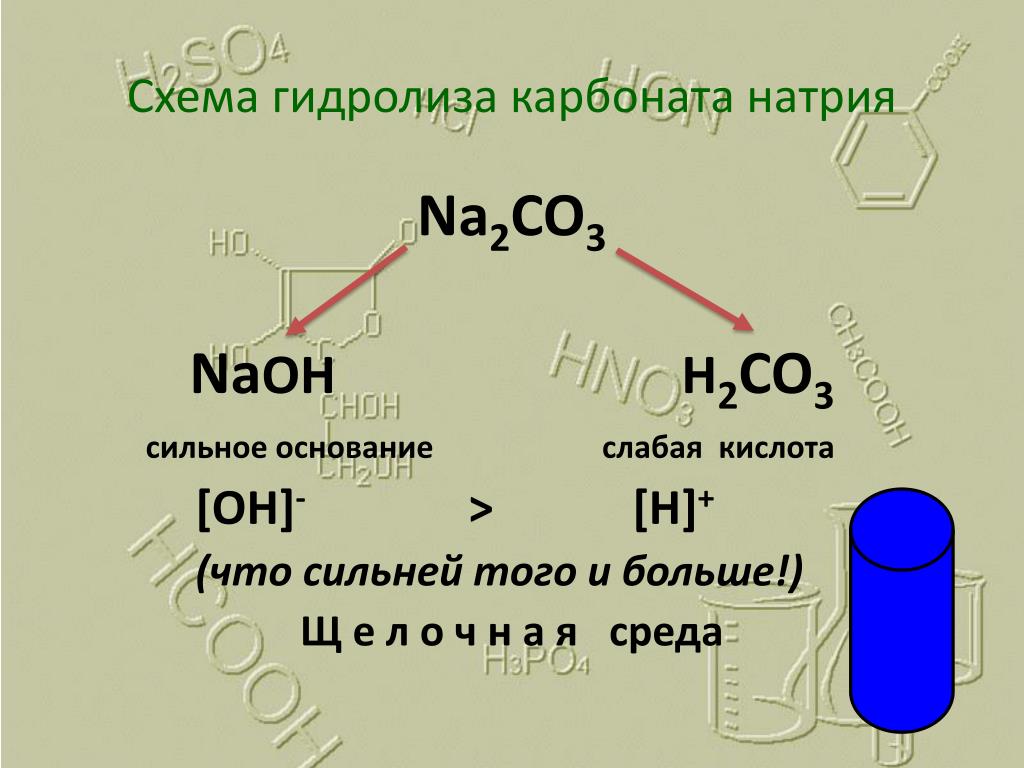
Чтобы получить подробное описание элемента, кликните по его названию.
Решение задачи 123
1. Na2CO3 – карбонат натрия, сода кальцинированная. Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2.
2. Пусть формула натрона Na2CO3*хН2О. Массовая доля воды в нем 0,63 (63 %). Составим уравнение 18х/(18х+106) = 0,63, решив которое получаем х = 10. Можно посчитать и по-другому. Содержание безводной соды в кристаллогидрате 100-63 = 37 %, что соответствует 106 а.е.м. Тогда 63 % соответствуют у а.е.м., откуда у = 106*63/37 »180. Отсюда х = 10. Таким образом, натрон — Na2CO3*10Н2О – декагидрат карбоната натрия, сода стиральная.
Если 63 % массы натрона отвечают 180 а.е.м. или 10 молекулам воды, то 31,5 % будет соответствовать 180*31,5/63 = 90 а.е.м. или 5 молекулам воды. То есть точный состав гидрата А — Na2CO3*5Н2О.
Для термонатрита с формулой Na2CO3*zН2О содержание натрия 37,1 %, что соответствует 2*23 = 46 а.е.м. Следовательно, молекулярная масса термонатрита (100 %) будет равна 46/0,371 »124, откуда z= 1. Можно посчитать и по уравнению 2*23/(106+18z) = 0,371. Итак, точный состав термонатрита — Na2CO3*Н2О.
3. Молярная масса безводной соды 106 г/моль, натрона – 286 г/моль. В расчете на натрон мировое потребление соды получится 33*286/106 = 89 млн. т. Основные отрасли промышленности, потребляющие соду: стекольная (48 %), химическая (24%), мыловаренная и производства чистящих средств (14%), целлюлозо-бумажная (4 %). На все остальные области применения в сумме расходуется не более 10 % соды.
4. В 300 г насыщенного при 25оС раствора содержится 29,5*3 = 88,5 г безводной соды. Натрон содержит такой соды 37 %, следовательно, его понадобится 88,5/0,37 = 239,2 г. Соответственно, воды надо будет взять 300-239,2 = 60,8 г.
Пусть х – масса натрона, выделяющегося при охлаждении этого раствора до 0 оС. Тогда 0,37 х – масса выделяющейся безводной соды. В растворе останется 88,5-0,37х безводной соды при массе раствора 300-х. Отношение этих величин в насыщенном при 0 оС растворе составляет 7/100. Решая уравнение (88,5-0,37х)/(300-х) = 0,07, получаем х = 225 г.
5. Итак, при охлаждении до 0 оС 300 г насыщенного при 25 оС раствора выделяется 225 г натрона. Следовательно, для получения 100 г натрона потребуется в 225/100 = 2,25 раза меньше раствора, т.е. 300/2,25 = 133,3 г. Масса безводной соды в нем составит 0,295*133,3 = 39,3 г. На 124 г термонатрита приходится 106 г безводной соды, следовательно, термонатрита нам понадобится 39,3*124/106 = 46,0 г. Воды, соответственно, надо будет взять 133,3-46,0 = 87,3 г.
6 Сода питьевая (пищевая) – NaHCO3– гидрокарбонат натрия. Сода каустическая – NaOH– гидроксид натрия.
Способ получения карбоната натрия
Предлагаемое изобретение относится к способам получения карбонатов щелочно-земельных металлов, в частности карбоната натрия, применяемого для оптического стекловарения и волоконной оптики.
Известно, что к продуктам, применяемым для оптического стекловарения и волоконной оптики, предъявляются особые требования по содержанию основного вещества и лимитированных примесей, а именно такой продукт должен содержать (масс. %): основное вещество не менее 99,8; а примесей не более: железа — 3·10-5, кобальта, меди, никеля, ванадия, марганца и хрома — 5·10-6, хлоридов — 1·10-3, сульфатов — 3·10-3 каждой.
Для получения высокочистого карбоната натрия может быть применен метод соосаждения, проводимый, как известно, с использованием различных коллекторов. Например, этот метод применяется в известном способе очистки различных солей от красящих металлов, включая очистку и карбоната натрия (SU 1675204, C01D 7/28, 1991). Согласно данному способу к исходному водному раствору карбоната натрия, содержащему примеси металлов на уровне 10-2 масс. %, добавляют нитрат ртути (Hg(NO3)2) и сульфид натрия (Na2S), после чего реакционную массу отстаивают, затем проводят центрифугирование при определенной скорости (2500 об/мин), после чего к декантированному раствору приливают 3 об. % формамида и карбонат натрия затем высаживают ацетоном. Данным способом получают карбонат натрия с содержанием лимитированных примесей на уровне 10-6-10-7 мacc. %, который может быть применен при производстве оксидных стекол. Хотя данный способ и обеспечивает получение карбоната натрия высокой чистоты, но он трудоемок, экологически небезопасен из-за применения токсичных продуктов, таких как нитрат ртути и ацетон.
% формамида и карбонат натрия затем высаживают ацетоном. Данным способом получают карбонат натрия с содержанием лимитированных примесей на уровне 10-6-10-7 мacc. %, который может быть применен при производстве оксидных стекол. Хотя данный способ и обеспечивает получение карбоната натрия высокой чистоты, но он трудоемок, экологически небезопасен из-за применения токсичных продуктов, таких как нитрат ртути и ацетон.
Для получения чистого карбоната натрия применяется и комплексная очистка, включающая различные методы. Так, в известном способе получения безводного карбоната натрия фармацевтической степени чистоты исходный 26-30%-ный раствор карбоната натрия повергают фильтрации, затем обработке активированным углем, последующему упариванию, центрифугированию, после чего образующийся моногидрат карбоната натрия промывают чистой водой для очистки от примесей хлоридов, затем подвергают вакуумной сушке или упариванию при температуре не менее 109°С (CN 102476816, C01D 7/12, 2010). Основной недостаток данного способа — его многостадийность.
Основной недостаток данного способа — его многостадийность.
Как показывает изучение достигнутого уровня техники, определенного внимания заслуживает метод, основанный на применении циркулирующей карбонизации. Этот метод применяется на стадии получения бикарбоната натрия, из которого может быть в дальнейшем получен карбонат натрия. Исходным продуктом при получении бикарбоната натрия в данном методе является водный раствор либо суспензия троны, состава: Na2CO3·NaHCO3·H2O. Этот исходный продукт обычно инжектируется в зону карбонизации, где через него пропускается диоксид углерода. Так, в известном способе (ЕР 0005981, С01D 7/12, 1989) бикарбонат натрия, полученный после карбонизации, подвергают кристаллизации и выделенные кристаллы кальцинируют или сушат. При этом в качестве карбонизирующего агента применяется либо чистый диоксид углерода либо его смесь с воздухом, которая подается под давлением 4,55 кг/см2 при скорости 0,255 м3/мин, и процесс карбонизации проводится при температуре 60-80°С (ЕР 0005981, C01D 7/12, 1989).
Наиболее близким к предлагаемому способу является известный способ получения гранулированной кальцинированной соды, содержащей минимальное количество примесей щелочных металлов (CN 101475195, C01D 7/12, 2009). В данном способе исходным продуктом является раствор в реактор со скоростью 10-15 л/час с избытком 10-15% масс. Процесс ведут при температуре 60-70°С.
Количество и скорость подачи диоксида углерода подобраны экспериментально, и именно проведение процесса при выбранных параметрах позволяет проводить наиболее полную карбонизацию с получением гидрокарбоната натрия. Это подтверждается ниже приведенными примерами и Таблицей 1. В случае отклонения от изложенных выше технологических параметров ухудшается чистота продукта, снижается выход.
Существенную роль на эффективность процесса оказывают условия обработки выделенного промежуточного гидрокарбоната натрия, включающие фильтрацию кристаллического NaHCO3, промывку кристаллов водой для удаления маточника и отжим. Соблюдение именно таких условий процесса выделения промежуточного продукта позволяет снизить содержание в конечном продукте Fe и 3d элементов. На эффективность процесса существенно влияют и условия термообработки гидрокарбоната натрия, а именно проведение термообработки, начиная при 80°С и заканчивая при 300°С (скорость нагрева 55 град/час), что позволяет вначале избавиться от сорбционной воды, а затем перевести гидрокарбонат натрия в карбонат.
Соблюдение именно таких условий процесса выделения промежуточного продукта позволяет снизить содержание в конечном продукте Fe и 3d элементов. На эффективность процесса существенно влияют и условия термообработки гидрокарбоната натрия, а именно проведение термообработки, начиная при 80°С и заканчивая при 300°С (скорость нагрева 55 град/час), что позволяет вначале избавиться от сорбционной воды, а затем перевести гидрокарбонат натрия в карбонат.
В качестве исходных веществ используются чистые продукты, например карбонат натрия ос. ч. 5-4, содержащий примеси металлов на уровне 10-4-10-5 масс. %, а для промывки образующегося промежуточного бикарбоната натрия — высокочистая вода, например вода ос. ч. 27-5, содержащая примеси металлов на уровне 10-6-10-8 масс. %. В результате проведения предлагаемого способа получается карбонат натрия с содержанием основного вещества 99,85 и лимитированных примесей на уровне 10-5-10-6 масс. %, в частности железа 1·10-5, и суммарным содержанием 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) троны, Na2CO3·NaHCO3·Н2О, которая инжектируется в зону карбонизации, где через этот раствор при температуре 50-52°С пропускается газообразный диоксид углерода. Данным способом получают карбонат натрия, практически не содержащий примеси щелочных металлов, но содержащий примеси железа на уровне 3·10-4 и свинца 5·10-4 масс. %, что не соответствует требованиям, предъявляемым к высокочистому карбонату натрия для оптического стекловарения.
%, в частности железа 1·10-5, и суммарным содержанием 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) троны, Na2CO3·NaHCO3·Н2О, которая инжектируется в зону карбонизации, где через этот раствор при температуре 50-52°С пропускается газообразный диоксид углерода. Данным способом получают карбонат натрия, практически не содержащий примеси щелочных металлов, но содержащий примеси железа на уровне 3·10-4 и свинца 5·10-4 масс. %, что не соответствует требованиям, предъявляемым к высокочистому карбонату натрия для оптического стекловарения.
Для получения высокочистого продукта, применимого для использования в оптическом стекловарении и волоконной оптике, предлагается способ получения чистого карбоната натрия, включающий первоначальную стадию приготовления 20%-го водного раствора карбоната натрия, фильтрацию полученного раствора и последующую его карбонизацию, осуществляемую пропусканием через него при температуре 60-70°С и со скоростью 10-15 л/час газообразного диоксида углерода, взятого с 10-15%-м избытком от стехиометрии, последующую обработку полученной суспензии гидрокарбоната натрия фильтрацией, промывкой водой и отжиманием и конечную термообработку выделенных кристаллов, начиная с 80°С и заканчивая 300°С.
Предлагаемое изобретение, как и способ-прототип, осуществляют методом карбонизации. Химизм процесса карбонизации, имеющий место в заявляемом способе, отражается в ниже приведенных уравнениях, в соответствии с которыми рассчитывается избыток диоксида углерода.
Na2СО3+H2O+СO2 — 2NaHCO3
2NaHCO3 — Na2СО3+Н2O+CO2
Но, в отличие от прототипа, процесс карбонизации проводят при определенной скорости подачи диоксида углерода и при использовании его избыточного количества от стехиометрии по отношению к исходному количеству 20% масс. карбоната натрия, а именно: диоксид углерода подают 3·10-6 масс. %, что соответствует требованиям, предъявляемым к продуктам для волоконной оптики и оптического стекловарения. Получаемый карбонат натрия соответствует квалификации ос. ч. 7-5. Максимальный выход продукта составляет 76,5-77,0%.
Ниже, изобретение иллюстрируется следующими примерами и Таблицей.
Пример 1. В реактор, снабженный мешалкой якорного типа с частотой вращения 100 об/мин и паровой рубашкой, подают воду ос. ч. 27-5 в количестве 300 мл. Отдельными порциями при непрерывном перемешивании загружают 70 г натрия карбоната ос. ч. 5-4. Концентрация карбоната натрия при этом соответствует 20% масс., а плотность получаемого раствора составляет 1,217 г/см3. Приготовленный раствор карбоната натрия подается для фильтрования на нутч-фильтр. Отфильтрованный раствор карбоната натрия заливают в карбонизатор и проводят карбонизацию раствора газообразным СО2, подаваемым со скоростью 10 л/час с 10% масс. избытком от стехиометрии. Избыточное давление углекислого газа 0,1 атм. Температура 60-70°С. Процесс ведут до рН 9,0. Полученную суспензию гидрокарбоната натрия направляют на нутч-фильтр. Кристаллы промывают водой ос. ч. 27-5 и отжимают. Полученные кристаллы подвергают термообработке, начиная при 80°С и заканчивая при 300°С. Получают 53,55 г карбоната натрия, с выходом 76,5% от теории, содержанием основного вещества 99,85, железа 1·10-5, суммарным содержанием 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) — 3·10-6 масс. %.
Остальные примеры проводят аналогично примеру 1 при температуре 60-70°С, изменяя только такие числовые показатели процесса, как скорость пропускания СО2 и избыточное количество CO2 или так называемое отклонение от стехиометрии.
Пример 2. Через 20% масс. раствор карбоната натрия пропускают СО2 со скоростью 10 л/час с 15% масс. отклонением от стехиометрии и при температуре 60-70°С. Получают 53,90 г карбоната натрия с выходом 77,0% от теории. Содержание основного вещества 99,85, железа 3·10-5, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 5·10-6 мacc. %.
Пример 3. Через 20% масс. раствор карбоната натрия пропускают СО2 со скоростью 15 л/час с 10% масс. отклонением от стехиометрии при температуре 60-70°С. Получают 53,55 г карбоната натрия с выходом 76,5% от теории. Содержание основного вещества 99,85, железа 1·10-5, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 3·10-6 масс. %.
Пример 4. Через 20% масс. раствор карбоната натрия пропускают СO2 со скоростью 15 л/час с 15% масс. отклонением от стехиометрии при температуре 60-70°С. Получают 53,9 г карбоната натрия с выходом 77,0% от теории. Содержание основного вещества 99,85, железа 3·10-5, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 5·10-6 мacc. %.
Пример 5. Через 20% масс. раствор карбоната натрия пропускают СО2 со скоростью 17 л/час с 17% масс. отклонением от стехиометрии при температуре 60-70°С. Получают 51,1 г карбоната натрия с выходом 73,0% от теории. Содержание основного вещества 99,80, железа 1·10-4, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 1·10-5 масс. %.
Пример 6. Через 20% масс. раствор карбоната натрия пропускают СО2 со скоростью 18 л/час с 8% масс. отклонением от стехиометрии при 60-70°С. Получают 49,0 г карбоната натрия с выходом 70,0% от теории. Содержание основного вещества 99,80, железа 1·10-4, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 1·10-5 масс. %.
Пример 7. Через 20% масс. раствор карбоната натрия пропускают СО2 со скоростью 20 л/час с 10% масс. отклонением от стехиометрии при 60-70°С. Получают 51,1 г карбоната натрия с выходом 73,0% от теории. Содержание основного вещества 99,80, железа 3·10-4, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 2·10-5 масс. %.
Пример 8. Через 20% масс. раствор карбоната натрия пропускают СО2 со скоростью 20 л/час с 15% масс. отклонением от стехиометрии при температуре 60-70°С. Получают 51,1 г карбоната натрия с выходом 73,0% от теории. Содержание основного вещества 99,80, железа 3·10-4, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 2·10-5 масс. %.
Пример 9. Через 20% масс. раствор карбоната натрия пропускают CO2 со скоростью 8 л/час с 10% масс. отклонением от стехиометрии при температуре 60-70°С. Получают 52,5 г карбоната натрия с выходом 75,0% от теории. Содержание основного вещества 99,80, железа 1·10-4, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 1·10-5 масс. %.
Пример 10. Через 20% масс. раствор карбоната натрия пропускают СO2 со скоростью 8 л/час с 17% масс. отклонением от стехиометрии при температуре 60-70°С. Получают 52,5 г карбоната натрия с выходом 75,0% от теории, содержание основного вещества 99,80, железа 1·10-4, суммарное содержание 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) 1·10-5 масс. %.
Как видно из примеров 5-10 уже незначительное изменение заявляемых параметров снижает выход и чистоту получаемого продукта и не соответствует требуемому качеству. Таким образом, приведенные примеры в таблице 1 подтверждают эффективность проведения способа при заявленных режимах, выполнение которых обеспечивает получение натрия карбоната высокой чистоты для оптического стекловарения и волоконной оптики. Содержание основного вещества на уровне 99,85, железа (1-3)·10-5, 3d-элементов (медь, никель, кобальт, хром, марганец, ванадий) (3-5)·10-6 масс. %. Выход конечного продукта составляет 76,5-77,0%.
Содержание хлоридов (Сl) и сульфатов (SO4) во всех приведенных примерах одинаково и составляет 5·10-4 и 1·10-3 масс. %, соответственно.
Зависимость выхода натрия карбоната от скорости подачи СО2
Способ получения чистого карбоната натрия, включающий первоначальную стадию приготовления водного раствора натрия карбоната, фильтрацию полученного раствора с последующей его карбонизацией и выделение конечного продукта, отличающийся тем, что карбонизацию полученного 20% раствора карбоната натрия проводят пропусканием через него при температуре 60-70°C и со скоростью 10-15 л/час газообразного диоксида углерода, взятого с 10-15% избыточным количеством от стехиометрии, после чего суспензию образовавшегося гидрокарбоната натрия очищают фильтрацией, промывают водой и отжимают, а выделенные кристаллы подвергают термообработке, начиная с 80°C и заканчивая при 300°C.E500 – Карбонаты натрия | Добавкам.нет
Другие названия добавки (синонимы)
бикарбонат натрия, натрий двууглекислый, сода пищевая, Е500, гидрокарбонат натрия, карбонаты натрия, Е 500, sodium bicarbonate, E 500, baking soda, бікарбонат натрію, натрій двовуглекислий, сода харчова, гідрокарбонат натрію, карбонати натрію, сода питьевая, содовий гідрокарбонат, Sodium hydrogen carbonate, карбонат натрия
E500 — группа пищевых добавок использующаяся в основном в качестве разрыхлителей и регуляторов кислотности. В обиходе добавки E500 называют содой. По химическому составу они представляют собой карбонаты натрия — натриевые соли угольной кислоты. В пищевых продуктах в основном используются:
- карбонат натрия (sodium carbonate, Na2CO3) — кальцинированная сода;
- гидрокарбонат натрия (sodium hydrogen carbonate, NaHCO3) — питьевая или пищевая сода. Также используются названия: натрий двууглекислый, бикарбонат натрия sodium bicarbonate;
- смесь карбоната и гидрокарбоната натрия (sodium sesquicarbonate).
Слово «сода» берет свое название от латинского названия растения «Salsola Soda». Ранее большой объем соды добывали именно из золы этого растения. Данный клас веществ был известен еще за много веков до нашей эры. В то время ее добывали из месторождений минералов (термонатрит, трон, натрон, нахколит) или из содовых озер. Также сода встречается в природе в составе некоторых морских водорослей.
Сегодня известно несколько способов получения соды, но наибольшее распространение получил способ Сольве. Именно он используется более чем в 90% промышленной добычи соды. Исходными веществами в данном процессе является хлорид натрия (поваренная соль), амиак, диоксид углерода (углекислый газ) и вода. Для получения карбоната натрия необходим процесс кальцинирования (нагревание до высокой температуры). Именно поэтому карбонат натрия часто называют кальцинированной содой. В США более 40% соды получают из природных месторождений. В странах СНГ сода получается промышленным способом в виду отсутствия крупных залежей содосодержащих минералов.
Многовековой опыт использования соды, показал что добавку E500 никак нельзя относить к разряду вредных для человеческого организма. В пищевых продуктах она выполняет лишь полезные функции.
Карбонаты натрия применяются в пищевой промышленности для препятствования слёживанию и комкованию продуктов, а также для регулирования их кислотности. Наиболее часто добавка встречается в хлебобулочных изделиях, разнообразных рулетах, тортах, печеньях.
Как получить карбонат натрия
представляет собой бесцветные кристаллы, в быту – это обычная кальцинированная сода, которая используется при стирке белья, мытье посуды и лакированных поверхностей. В природе он встречается в открытых рассолах, чаще всего грунтовых, в озерных отложениях и минералах. Добывают его также и из природных залежей, но добыть его – только полдела., конечно же, не сразу находится в то виде, в котором мы привыкли его видеть в упаковках. Сначалаон подвергается тщательной очистке, его прогоняют через специальные растворы, которые должны избавить сам карбонат от различных шлаков и примесей.
Первый способ называется аммиачно-хлоридный. Его можно провести и в домашних условиях, при условии, что у вас есть специальное помещение и реактивы. Способ этот заключается в том, что естественный и искусственно полученный рассол хлорида натрия очищается от примесей с помощью растворов аммиака и хлора.
В процессе отфильтровываются кальций и магний, а остается натрий. В промышленных условиях он проходит стадию насыщения Nh4 и карбонизации в специальных барботажных камерах. Но в домашних условиях повторить эту процедуру сложно, из-за отсутствия специального оборудования.
Прокаливание. получают при процессе прокаливания другого химического соединения NaHCO3. Это щелочь. Накаливать ее нужно либо на огне, либо в специальной камере, где существуют отводы для выделяющихся в процессе веществ.
Применение карбоната натрия очень распространено в производстве: это и компонент в производстве стекла, и моющие средства, также используется карбонат и при изготовлении целлюлозы, при чистке нефти и нефтепродуктов.
Электролиз. В науке он называется электролизный процесс. Но опять же, это технический способ, требующий наличия специальной камеры, в которой водяной пар и диоксид углерода взаимодействуют с едким натрием, который окисляется и превращается в карбонат.
Щелок. Это второстепенный способ получения карбоната натрия из продуктов под названием «щелок» (например, NaOH), которые образуются в процессе выщелачивания древесной золы. в свою очередь является одним из главных компонентов некоторых растений. Именно поэтому древесная зола содержит около 70 % карбоната натрия.
Превратите пищевую соду в стиральную соду
Это простые инструкции по приготовлению карбоната натрия, также известного как стиральная сода или кальцинированная сода, из пищевой соды или бикарбоната натрия.
Сделайте карбонат натрия
Бикарбонат натрия — это CHNaO 3, , а карбонат натрия — Na 2 CO 3 . Просто нагрейте пищевую соду или бикарбонат натрия в духовке с температурой 200 ° F примерно в течение часа. Выделяются углекислый газ и вода, оставляя сухой карбонат натрия.Это кальцинированная сода.
Химическая реакция процесса:
2 NaHCO 3 (с) → Na 2 CO 3 (с) + CO 2 (г) + H 2 O (г)
Соединение легко впитывает воду, образуя гидрат (возвращаясь в пищевую соду). Вы можете хранить сухой карбонат натрия в закрытом контейнере или с осушителем, чтобы он оставался сухим, или вы можете позволить ему образовать гидрат, если хотите.
Хотя карбонат натрия довольно стабилен, он медленно разлагается в сухом воздухе с образованием оксида натрия и диоксида углерода.Реакцию разложения можно ускорить, нагревая стиральную соду до 851 ° C (1124 K).
Ключевые выводы: пищевая и стиральная сода
- Бикарбонат натрия (пищевая сода) и карбонат натрия (сода для стирки) имеют похожие молекулы. Разница в том, сколько воды входит в молекулу.
- Если выпекать пищевую соду, она разлагается с образованием стиральной соды с выделением углекислого газа и воды.
- Со временем стиральная сода разлагается с образованием оксида натрия с выделением диоксида углерода.Более теплые условия ускоряют процесс разложения.
Использование для стирки соды
Стиральная сода — хорошее универсальное чистящее средство. Его высокая щелочность помогает удалять жир, смягчать воду и дезинфицировать поверхности. Имейте в виду, что раствор карбоната натрия раздражает кожу и может вызвать химические ожоги в чистом виде. При использовании надевайте перчатки.
Карбонат натрия используется для регулирования pH в бассейне, предотвращения слеживания в продуктах, а также для лечения стригущего лишая и экземы. Он также используется в промышленных масштабах для изготовления изделий из стекла и бумаги.
Как приготовить раствор карбоната натрия
Карбонат натрия — это неорганическая соль с химической формулой Na2CO3. Это соединение, используемое в таких промышленных применениях, как производство стекла, в качестве электролита или компонента зубных паст, также работает как чистящее средство. Приготовьте растворы карбоната натрия с определенной концентрацией, обычно выражаемой либо как массовый процент растворенного соединения (например, 5-процентный раствор), либо как молярность — количество молей такого вещества на 1 л раствора.
Приготовление карбоната натрия
Карбонат натрия для этих растворов можно приготовить самостоятельно дома, просто нагревая бикарбонат натрия или бытовую пищевую соду. Когда его нагревают до температуры выше 80 градусов по Цельсию (176 градусов по Фаренгейту), бикарбонат натрия распадается на карбонат натрия, диоксид углерода и водяной пар. На каждые 2 моля бикарбоната натрия вы получаете 1 моль карбоната натрия плюс газообразный CO2 и воду; кажется, что порошок бикарбоната «сжимается», когда вы его запекаете.Вы можете нагреть бикарбонат натрия в чистой стеклянной посуде или на алюминиевой сковороде.
Создание решений с заданным массовым процентом
••• Николас Биондо / Demand Media
Рассчитайте необходимую массу карбоната натрия по следующей формуле: Масса = (объем x массовый процент) / (100 — массовый процент). Например, чтобы приготовить 12-процентный раствор с использованием 350 мл воды, используйте это уравнение для определения количества карбоната натрия, которое нужно использовать: Масса = 350 x 12 / (100 — 12) = 47.73 г
••• Николас Биондо / Demand Media
Взвесьте рассчитанное количество карбоната натрия на весах.
••• Николас Биондо / Demand Media
Налейте воду (350 л в нашем примере) в стакан и добавьте карбонат натрия.
••• Nicholas Biondo / Demand Media
Перемешайте раствор ложкой или осторожно встряхните стакан до полного растворения соли.
Приготовление растворов с заданной молярностью
••• Николас Биондо / Demand Media
Умножьте молярность на объем раствора (в литрах) и число 106 — молярную массу карбоната натрия — для вычисления массы натрия. карбонат нужен.Например, для приготовления 300 мл 0,2 молярного раствора вам потребуется: 0,2 x 0,3 л x 106 = 6,36 г Обратите внимание, что 300 мл = 0,3 л
••• Николас Биондо / Demand Media
Взвесьте рассчитанное количество натрия. карбонат по шкале.
••• Николас Биондо / Demand Media
Налейте в стакан дистиллированную воду — на 20–30 мл меньше конечного объема, затем добавьте карбонат натрия. В нашем примере начните с 270–280 мл воды.
••• Nicholas Biondo / Demand Media
Смешайте раствор ложкой или осторожно взбалтывайте стакан до полного растворения соли.
••• Николас Биондо / Demand Media
Налейте раствор в мерный цилиндр и долейте дистиллированную воду до конечного объема.
Как превратить пищевую соду в стиральную соду (бикарбонат натрия в карбонат натрия)
С химической точки зрения разница между пищевой содой и стиральной содой заключается в уровне гидратации молекулы.Пищевая сода и стиральная сода — два удобных средства бытовой химии. Возможно, вы сможете найти стиральную соду (кальцинированную соду) вместе с принадлежностями для стирки в магазине, но если вы не можете ее найти, то это химическое вещество, которое очень легко сделать из пищевой соды.
Сделайте стиральную соду
- Налейте пищевую соду в противень. Распространите это, чтобы сформировать слой.
- Выпекайте соду при 400 ° F (200 ° C) от 30 минут до 1 часа. Время не критично. Соду нельзя «переварить», но нужно обязательно слить всю воду.
- Снимите кастрюлю с огня, дайте соде остыть и храните ее в закрытом контейнере, чтобы она не собирала влагу из воздуха.
Как это работает
Пищевая сода — это бикарбонат натрия (NaCHO 3 ), а стиральная сода — это карбонат натрия (Na 2 CO 3) .Когда вы нагреваете пищевую соду, вода (H 2 O) и углекислый газ (CO 2 ) уносятся, оставляя вас с содой для стирки.
Что делать с содой для стирки
Что делать, если у вас есть стиральная сода?
- Стиральную соду можно использовать как щадящее, нетоксичное и не царапающееся средство.
- Смешайте немного стиральной соды с водой, чтобы образовалась паста, которая поможет удалить жирные пятна или следы ожогов с кастрюль и сковородок. Избегайте использования этой обработки на алюминиевых сковородах или поверхностях.
- Используйте карбонат натрия, чтобы удалить пятна от жесткой воды, очистить плитку и раствор, а также удалить мыльную пену с ванн.
- Вы можете добавить 1/2 стакана в загрузку белья, чтобы осветлить белое белье и удалить запахи.
- Поскольку он щелочной, вы можете втереть его в качестве предварительной обработки жирных пятен. Однако не оставляйте его включенным слишком долго, иначе он может испортить цвета или повредить деликатные ткани. Другой способ — добавить стиральную соду в цикл предварительного замачивания белья. Добавьте в загрузку чашку стиральной соды и дайте ей впитаться примерно 20 минут, прежде чем продолжить обычный цикл стирки.
Исчезающая пищевая сода — Scientific American
Ключевые концепции
Химия
Газы
Химическая реакция
Термическое разложение
Введение
Пищевая сода не только отлично подходит для приготовления пищи, но и является полезным химическим веществом для научных проектов. Вы, наверное, слышали о реакции пищевой соды и уксуса и, возможно, даже использовали ее, чтобы вызывать извержения самодельных вулканов, запускать в воздух ракеты из бутылок или обнаруживать кислоты и основания.Однако существует множество других химических реакций, которые можно исследовать с помощью пищевой соды. Одна из них называется реакцией разложения, которая заставляет пищевую соду худеть! Хотите узнать, как это работает?
Фон
Химические вещества могут претерпевать множество различных реакций, таких как реакции синтеза, в результате которых образуются новые вещества, или реакции горения, в которых вещество обычно вступает в реакцию с кислородом и генерирует энергию в виде тепла. Другой тип реакции — это реакция разложения, которая противоположна реакции синтеза.Когда химическое вещество разлагается, оно распадается с образованием двух или более отдельных соединений. Большинство химических соединений довольно стабильны и не разлагаются самопроизвольно. Вы должны вложить много энергии, чтобы разорвать их химические связи. Однако, когда химические вещества подвергаются воздействию достаточного количества энергии, которая может быть в виде тепла, излучения, электричества или света, они разлагаются.
Реакции разложения являются причиной того, что некоторые химические вещества или лекарства, отпускаемые по рецепту, хранятся во флаконах из темного стекла.Часто вы не хотите, чтобы химическое вещество разлагалось, потому что его химическая природа изменится. Темное стекло уменьшает количество света, попадающего на химическое вещество или лекарство, и, следовательно, предотвращает индуцированное светом разложение химического вещества.
Пищевая сода или бикарбонат натрия (NaHCO 3 ) — это химическое вещество, которое может подвергаться реакции разложения при нагревании. При температуре выше 176 градусов по Фаренгейту (80 градусов Цельсия) бикарбонат натрия начинает распадаться на три соединения, образуя карбонат натрия (Na 2 CO 3 ), воду (H 2 O) и диоксид углерода (CO ). 2 ).Вы используете эту реакцию каждый раз, когда готовите и запекаете. Произведенный углекислый газ заставляет выпечку расти! Чем выше температура бикарбоната натрия, тем быстрее он разлагается. Только карбонат натрия останется твердым продуктом. И углекислый газ, и вода при высокой температуре газообразны, а это означает, что они исчезнут в окружающем воздухе. Вы действительно можете измерить эту потерю — возьмите немного пищевой соды и узнайте, как это сделать!
Материалы
- Две жаропрочные плиты
- Ложка
- Пищевая сода
- Цифровая шкала (желательно с 0.С шагом 1 грамм)
- Духовка
- Прихватки для духовки
- Помощник для взрослых
- Жаростойкая поверхность
- Таймер
- Бумага и ручка или карандаш
Препарат
- Разогрейте кухонную духовку до 200 градусов F (около 93 градусов C).
- Включите весы и обнулите их.
- Поместите первую тарелку на весы. Запишите его точную массу.
- Затем снова обнулите шкалу и добавьте ложкой 15 грамм пищевой соды.
- Добавьте массу пустой тарелки к массе пищевой соды, чтобы рассчитать их общий вес. Запишите результат на листе бумаги.
- Повторите эти шаги со второй пластиной. Обязательно запомните, какая тарелка какая. Вы можете пометить их, если хотите.
Процедура
- Когда духовка достигнет заданной температуры (200 градусов по Фаренгейту), попросите вашего взрослого помощника поставить первую тарелку с пищевой содой в духовку.Запишите, какой именно.
- Установите таймер на 15 минут и оставьте тарелку в духовке, пока таймер не сработает. Как вы думаете, что будет с пищевой содой в духовке?
- Попросите вашего взрослого помощника осторожно вынуть тарелку с пищевой содой из духовки. Обязательно наденьте прихватки для духовки! Как выглядит пищевая сода? Изменился ли внешний вид при нагревании?
- Установите пластину на жаропрочную поверхность рабочего места и дайте ей остыть в течение 5–10 минут.
- Установите духовку на 400 градусов по Фаренгейту (около 204 градусов по Цельсию).
- Снова включите весы, обнулите их и установите на весы остывшую тарелку с пищевой содой. Запишите его точную массу. Какова разница между массой и массой до того, как вы поместили тарелку с пищевой содой в духовку? Он стал тяжелее, легче или остался прежним?
- Когда духовка достигнет новой целевой температуры, попросите вашего взрослого помощника поставить вторую тарелку с пищевой содой внутри.
- Снова установите таймер на 15 минут и оставьте пищевую соду в духовке на все время. Как вы думаете, вы получите другой результат при 400 градусах по Фаренгейту? Что будет с пищевой содой на этот раз?
- Через 15 минут попросите вашего взрослого помощника при помощи прихваток осторожно вынуть тарелку с пищевой содой из духовки. Как на этот раз выглядит пищевая сода? Он изменил цвет или все еще выглядит?
- Отложите и дайте пластине остыть в течение 5–10 минут.
- Затем снова включить весы, обнулить и поставить на весы вторую остывшую пластину. Запишите его точную массу. Как изменяется масса пищевой соды (плюс пластина) при нагревании до 400 градусов по Фаренгейту в течение 15 минут?
- Рассчитайте разницу в массе пищевой соды до и после нагрева при 200 и 400 градусах F. Вычтите массу пластины и пищевой соды после нагрева из массы пластины и пищевой соды перед нагревом. Сколько массы было потеряно или набрано в процессе нагрева? Была ли разница между двумя температурами?
- Вы также можете выразить изменение массы пищевой соды, вычислив ее потерю в процентах (разница массы пищевой соды до и после нагревания, умноженная на 100 и затем разделенная на исходную массу пищевой соды). Какой процент массы пищевая сода потеряла или набрала в процессе нагрева при обеих температурах? Было то же самое? Если нет, то можете ли вы объяснить разницу?
- Extra : Вы можете проверить, как изменяется масса пищевой соды при других температурах.Повторите тот же тест, но установите в духовке другую температуру (например, 250, 300 или 350 градусов по Фаренгейту). Как вы думаете, ваши результаты будут разными для разных температур или одинаковыми? Почему?
- Extra : Можете ли вы найти на кухне другие вещества, которые могут разлагаться? Узнайте, при каких температурах разлагаются эти соединения, и, если возможно (и безвредно), проверьте сами!
Наблюдения и результаты
Вы видели, как ваша пищевая сода похудела? Вы должны — по крайней мере, для более высокой температуры в 400 градусов по Фаренгейту.При более низкой температуре масса пищевой соды после нагрева, вероятно, была такой же (или почти такой же), как и до того, как вы поместили ее в духовку. Пищевая сода начинает разлагаться при температуре около 176 градусов по Фаренгейту. Однако при этих температурах разложение будет относительно медленным. Пятнадцать минут в духовке при температуре 200 градусов по Фаренгейту — недостаточно, чтобы значительно разложить пищевую соду.
Когда вы увеличиваете температуру до 400 градусов по Фаренгейту, реакция разложения будет происходить намного быстрее.Пятнадцати минут достаточно, чтобы разложить пищевую соду на карбонат натрия, воду и углекислый газ. Газообразные продукты (вода и углекислый газ) улетучиваются в воздух, поэтому полученный продукт должен быть значительно легче того, что вы кладете в духовку.
Внешний вид пищевой соды не изменится ни при каких температурах. Хотя вы делаете новый продукт — карбонат натрия — из пищевой соды во время реакции разложения, он все равно будет выглядеть так же.Оба вещества представляют собой белый порошок.
Очистка
Обязательно выключите духовку. Дайте обеим пластинам остыть до комнатной температуры. Затем вы можете выбросить использованную пищевую соду в мусорное ведро. Вымойте руки теплой водой с мылом и очистите рабочее место.
Больше для изучения
Термическое разложение, от BBC Bitesize
Химия для детей, химические реакции, с сайта Ducksters Education
Уравнение разложения бикарбоната натрия или пищевой соды от ThoughtCo.
Эта деятельность предоставлена вам в сотрудничестве с Science Buddies
Сделай сам: сделай сам дешево кальцинированную соду
Пищевую соду можно купить где угодно. Супермаркеты, Walmart, даже Dollar Store. Коробка стоит 0,99 доллара и совершенно безопасна для вашего рифа. Пищевая сода — это бикарбонат натрия , который можно использовать для выпечки, очистки и дезодорирования. И мы, любители, используем его, чтобы снизить уровень щелочности в наших аквариумах.
Бикарбонат натрия (пищевая сода) повышает щелочность при понижении pH, а Карбонат натрия (кальцинированная сода) повышает и то, и другое.Выпекая пищевую соду в духовке, тепло вытеснит углекислый газ в порошке, который снизит уровень pH и превратит его в карбонат натрия . Мы хотим использовать кальцинированную соду , и сделать ее самостоятельно легко и недорого. Вы можете использовать Arm & Hammer или любой другой бренд, продающийся там, где есть продукты. Вот тот, который я купил в Aldi. Равномерно нанесите содержимое коробки на противень для пиццы / печенья.
Разогрейте духовку до 300 ° F и подождите, пока погаснет свет.
Как только свет погаснет, духовка нагрелась до нужной температуры. Не ставьте противень в духовку до тех пор, пока не будет достигнута температура, чтобы продукт не пригорел, пока духовка нагревается.
Поставьте его на решетку посередине духовки.
Установите таймер на 60 минут. Пусть запекается. Нет причин открывать духовку во время этого процесса. Как только таймер прозвонит, снимите сковороду и дайте ей остыть.
Он все еще должен быть белым.Если вы подожгли его, и он стал коричневым, выбросьте его и приготовьте новую партию.
После охлаждения перелейте кальцинированную соду в контейнер для хранения, например, в одноразовый контейнер Ziploc.
Как пользоваться:
Если вы хотите смешать галлон щелочного раствора для ежедневного приема, смешайте 1 галлон воды RODI с 2 стаканами кальцинированной соды. Очень хорошо перемешайте 30 секунд, затем дайте несколько минут перемешаться. После очистки он готов к подключению к дозирующему насосу.
Вы также можете вносить меньшие суммы для быстрой корректировки. Например, если вы смешали партию новой соленой воды, а pH или щелочность низкие, пара чайных ложек кальцинированной соды, смешанная в стакане воды RODI, может быть как раз тем количеством, которое необходимо для правильного измерения этой партии соленой воды. Вы можете настроить то, что вам нужно, просто экспериментируйте и тщательно проверяйте, пока не узнаете, какое количество лучше всего подходит для вас. Кроме того, если вы смешали чашку кальцинированной соды и воды, это не значит, что вы должны вылить все это в свою бочку.Влейте немного, дайте ему смешаться с соленой водой и измерьте щелочность или pH. Добавьте еще немного, перемешайте и тестируйте, пока не достигнете желаемого уровня.
Помните: Щелочность всегда следует дозировать в зоне с высоким потоком, подавать очень медленно, а не сразу.
Карбонат натрия — обзор
15.5.3.6.4 Синтез с Na
2 CO 3Безводный карбонат натрия может разлагать многие силикатные материалы в платиновых тиглях при нагревании до 1000–1200 ° C в течение примерно 1 часа при температуре отношение пробы к флюсу составляет 1: 3 или 1: 5 для кислых пород и до 1:15 для ультраосновных пород (менее 40% SiO 2 ) (Šulcek and Povondra, 1989).Летучие элементы, такие как As, Se, Tl и Hg, теряются во время этого типа синтеза. Некоторые тугоплавкие минералы не разлагаются Na 2 CO 3 . Добавление окислителя, такого как KNO 3 , Na 2 O 2 или KClO 3 , усиливает разложение. Na 2 CO 3 вместе с NaOH или Na 2 O 2 разлагает вспомогательные фазы, такие как циркон, касситерит, корунд, ильменит и монацит, и плавится при гораздо более низких температурах, чем Na 2 CO 3 флюсов (Potts, 1987).Платиновый тигель может окраситься железом после нескольких применений сплава Na 2 CO 3 , что указывает на то, что некоторое количество железа было восстановлено до металлического состояния и стало сплавлено с платиной. Железо можно удалить путем нагревания с 6 н. HCl или плавления с пиросульфатом калия в тиглях.
Метод щелочного плавления традиционно используется для анализа основных элементов в силикатных породах (Jeffery, 1975). Когда для этой цели использовались NaOH, KOH и Na 2 O 2 , Na и K не могли быть обнаружены, и большие количества данного элемента могут привести к многоатомным помехам во время анализа ICP-MS (Jarvis, 1992).Для разных типов образцов можно использовать разные комбинации реагентов для флюса, упомянутого ранее. Например, комбинации Na 2 CO 3 и H 3 BO 3 (Watanabe, 2001; Watanabe and Otsuki, 2008), Na 2 CO 3 и Na 2 B 4 O 7 (Mitsumata, Aoki, 2004) и KOH и H 3 BO 3 (Mutsuga et al., 2011) используются для разложения SiC, силиката, синего люминофора и диоксида титана. соответственно.Одним из преимуществ метода плавления щелочью является быстрое разложение геологических образцов, содержащих тугоплавкие минералы, по сравнению с кислотным разложением. Почти все минералы и вспомогательные минералы могут быть полностью растворены. Например, элементы платиновой группы (ЭПГ) в основных и ультраосновных породах (Jarvis et al., 1997; Meisel et al., 2003b; Qi et al., 2003; Stone, Crocket, 1993; Totland et al., 1995), графит и карбид кремния (Yamaguchi et al., 2000), сульфат бария (с использованием гидросульфата аммония для разложения) (Matsumoto and Koura, 2001), керамические материалы (с использованием смеси Na 2 CO 3 и ZnO для разложение) (Mihaljevic et al., 2001), циркон (Jain et al., 2001; Yamagata et al., 2008) и хромититы (Potts et al., 1992) могут быть растворены.
Основным недостатком использования плавления для разложения горных пород и минералов является относительно высокий уровень холостого хода и высокий уровень общих растворенных твердых веществ в конечном растворе, что влияет на современные инструментальные методы анализа (например, ICP-MS и ICP- AES). Например, когда используется метод плавления щелочью, коэффициент разбавления для ИСП-МС в 5-10 раз выше, чем у кислотного разложения (не менее 1000), что приводит к ухудшению пределов обнаружения и необходимости частой очистки конусы, распылитель и распылительную камеру.При использовании LiBO 2 может быть трудно определить Li или B в последующих циклах кислотного разложения из-за высоких фоновых уровней, оставшихся в ICP-MS. Таким образом, относительно высокий холостой уровень и высокая концентрация соли в растворе после плавления щелочного металла ограничивают применение метода плавления щелочного металла для анализа следовых элементов, что привело к появлению ограниченного числа статей, в которых сообщается об использовании плавления щелочного металла для обнаружения основных для выявления ультрамикроэлементов в образцах с использованием ICP-AES или ICP-MS (Awaji et al., 2006; Fujimori et al., 2001; Секимото и др., 2002; Wei and Haraguchi, 1999). Wang et al. (2003) использовали сплав LiBO 2 для разложения геологических образцов. После плавления и последующего растворения с HNO 3 элементы Ti, Mn, Co, Sr, Y, Nb, Ta, Zr, Hf, In, Ba, Th и РЗЭ могут быть количественно осаждены с использованием 50% NaOH до доведите раствор до сильной щелочи. Этот метод позволяет эффективно разлагать образцы, содержащие высокие концентрации Al, Nb, Ta, Zr и Hf, которые трудно разложить с помощью кислотного разложения.Матрица из флюса удаляется, и пределы обнаружения улучшаются этим методом, но можно определить только 26 элементов.
Летучие элементы, такие как Sn, Sb, Tl, Pb и Zn, могут теряться, когда сплав LiBO 2 или Na 2 CO 3 используется при высоких температурах (Totland et al., 1992; Yu и др., 2001). Однако плавление щелочей часто используется для приготовления образцов некоторых летучих элементов, которые могут легко испаряться при кислотном расщеплении, таких как фтор и хлор (Anazawa et al., 2001; Malde et al., 2001; Tarafder et al., 1997), бор (Terashima et al., 1998), изотоп бора (Tonarini et al., 1997) и йод (Yamada et al., 1996).
Таким образом, метод плавления щелочью используется в первую очередь для анализа основных элементов, разложения тугоплавких минералов и подготовки образцов некоторых летучих элементов, которые могут легко испаряться при кислотном разложении. В отличие от бомбы высокого давления из ПТФЭ, опасные реагенты, такие как HF или HClO 4 , не используются для плавления щелочей.Однако трудно очистить щелочной поток, что приводит к относительно высоким холостым уровням и большим коэффициентам разбавления для современного инструментального анализа. Хотя время разложения в методе плавления мало по сравнению с временем разложения при кислотном разложении, метод плавления является трудоемким и более сложным для применения с большим количеством геологических образцов. Сообщалось, что автоматическая система плавления упрощает процедуру плавления щелочью (Govindaraju and Mevelle, 1987).
Кальцинированная сода vs.Пищевая сода | Новости бассейна и спа
Предоставлено: пользователь Flickr Ракка.«Вы знаете, что вы единственный, кто это покупает», — говорил продавец моего местного дистрибьютора, направляясь на склад, чтобы вытащить 50-фунтовый мешок кальцинированной соды.
Промышленным стандартом всегда было использование бикарбоната натрия (пищевой соды) для повышения общей щелочности и карбоната натрия (кальцинированной соды) для повышения pH — за исключением случаев, когда и общая щелочность, и pH низкие. Понимая, что невозможно поднять (или опустить) одно без химического воздействия на другое, все же в игру вступает аналогия «правильный инструмент для работы».
Использование бикарбоната натрия будет иметь более ощутимый эффект на общую щелочность, лишь слегка повышая pH воды. Карбонат натрия на самом деле оказывает сильное влияние как на pH, так и на общую щелочность. Использование бикарбоната натрия для повышения pH эквивалентно вбиванию гвоздя в стену с помощью ручки отвертки — это можно сделать, но молоток справится с этой работой более эффективно и с гораздо меньшими затратами.
Итак, если очень мало сервисных компаний покупают кальцинированную соду, можно экстраполировать, что либо pH в воде плавательного бассейна никогда не бывает низким, либо люди используют пищевую соду натрия для регулирования pH.Фактически, именно последнее стало обычной практикой, часто поддерживаемой аргументом, что карбонат натрия с большей вероятностью слегка помутнет воду при добавлении. При этом необходимо понимать, что принятие этого химического решения связано как с последствиями для водного баланса, так и со стоимостью продукта.
Шестнадцать унций бикарбоната натрия повысят общую щелочность 10 000 галлонов воды на 7,14 частей на миллион. Эта же доза также повысит pH на величину, которую невозможно измерить стандартными промышленными тест-наборами.С другой стороны, 12,2 унции карбоната натрия повысят pH 10 000 галлонов воды на 0,4, а также увеличат общую щелочность примерно на 8,6 частей на миллион. (Это предполагает pH 7,2; начальную общую щелочность 60 ppm; свободный хлор 1 ppm; уровень циануровой кислоты 0 ppm; кальциевую жесткость 300 ppm; уровень TDS 900 ppm и температуру воды 80 ° F. ) Обычно используется дозировка 6 унций карбоната натрия на 10 000 галлонов, что приводит к увеличению на 0,2, что позволяет точно настроить параметры pH.Эти 6 унций также приведут к увеличению общей щелочности примерно на 5 частей на миллион, поэтому мы используем карбонат натрия для корректировки, если показания pH и общей щелочности низкие.
В нашем реальном сценарии с отверткой и гвоздем для корректировки показателя pH от 7,2 до 7,6 на 10 000 галлонов потребуется около 21 фунта бикарбоната натрия. Эта доза также увеличит общую щелочность на 149,8 частей на миллион. В нашем сценарии с молотком и гвоздем мы можем достичь того же 0.4 увеличивают pH с помощью 12,2 унций карбоната натрия, увеличивая общую щелочность всего на 8,6 ppm.
Чтобы помочь объяснить кажущуюся большую дозу бикарбоната натрия (опять же, это пищевая сода), необходимую для повышения pH, я обратился к давнему другу Роберту Лоури, владельцу Lowry Consulting Group, LLC в Лиме, Перу.
Вот как это объяснил г-н Лоури: «Поймите, что максимальное значение pH очень концентрированного раствора бикарбоната составляет 8,3. Следовательно, чем ближе начальный pH к 8.3, тем больше потребуется бикарба ».
Следует учитывать множество факторов. Он продолжил: «Шкала pH логарифмическая, поэтому чем дальше от 7,0, тем больше требуется в геометрической прогрессии. Одно целое число в 10 раз больше предыдущего. Щелочность линейная. При заданных параметрах потребуется 91,9 унции. или 5,75 фунтов бикарбоната натрия для повышения pH с 7,2 до 7,4 с исходной общей щелочностью 60 ppm. Новая общая щелочность составит 101 ppm. Тогда это займет 243,9 унции.или 15,24 фунта, чтобы поднять pH с 7,4 до 7,6, увеличивая общую щелочность со 101 ppm до 208,7 ppm. Если циануровая кислота присутствует, то необходимо также учитывать влияние CYA (буферная емкость) на pH и щелочность, что приводит к увеличению количества химического вещества, которое вызывает изменение pH на 0,4 ».
Получил все это?
В любом бизнесе прибыльность чрезвычайно важна для его выживания. Одним из факторов, напрямую влияющих на прибыльность, является контроль над расходами.Необходимо отслеживать влияние каждого решения, включая решение использовать бикарбонат натрия для контроля pH. Используя текущие доступные цены, сервисная компания может купить пакет бикарбоната натрия весом 50 фунтов примерно за 13 долларов. Сравните это со стоимостью 50-фунтового мешка карбоната натрия, который стоит около 18 долларов. Если бы мы смотрели на соотношение дозировки яблок к яблокам для контроля pH, это означало бы экономию в размере 0,10 доллара на фунт. Однако, как мы обнаружили выше, мы будем использовать гораздо больше бикарбоната натрия для корректировки pH, чем мы использовали бы карбонат натрия.
Мы определили, что потребуется 20,98 фунтов бикарбоната натрия, чтобы довести значение pH от 7,2 до 7,6 в 10 000 галлонах воды. (Используя параметры, указанные выше). При средней стоимости пакета бикарбоната натрия на 50 фунтов в 13 долларов (0,26 доллара за фунт) такая корректировка обойдется сервисной компании в 5,45 доллара. В среднем 18 долларов за тот же объем карбоната натрия, стоимость 0,36 доллара за фунт, такая же корректировка будет стоить сервисной компании 0 долларов.27. Если у обслуживающей компании есть 100 сервисных счетов (10 000 галлонов каждый) и ей придется производить эту корректировку в 25 бассейнах, которые они обслуживают каждую неделю, использование кальцинированной соды вместо пищевой соды приведет к экономии 129,50 долларов в неделю. Ребята, это 6 734 доллара в год! Очевидно, что бассейны емкостью более 10 000 галлонов позволят добиться пропорционально большей экономии.
Также необходимо учитывать потенциальную стоимость эффекта «йо-йо» этого химического выбора. Если бы обслуживающая компания действительно достигла желаемого изменения pH с помощью бикарбоната натрия, то, как обсуждалось выше, результатом также была бы общая щелочность 208.7 частей на миллион. Количество соляной кислоты, необходимое для корректировки этого химического дисбаланса общей щелочности (при уровне циануровой кислоты 30 ppm) (идеальным будет от 80 до 120 ppm), также приведет к уровню pH 6,5 — намного ниже нашей начальной точки и снова. нуждается в настройке.

