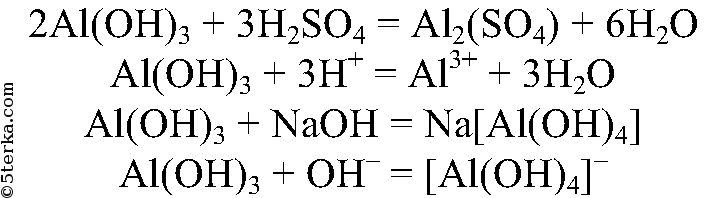Как из хлорида алюминия получить гидроксид алюминия
При действии на хлорид алюминия щелочного раствора происходит реакция обмена, в ходе которой наблюдается выпадение аморфного осадка белого цвета (как из хлорида алюминия получить гидроксид алюминия):
Хлорид алюминия – средняя соль, образованная сильной кислотой – соляной и слабым основанием – гидроксидом алюминия, вследствие чего она подвергается гидролизу по катиону. Практически осуществим гидролиз только по первой ступени, в теории же при полном гидролизе хлорида алюминия образуется гидроксид этого металла.
По методу кислотно-основного титрования чаще всего работают с растворами соляной кислоты, которые можно приготовить по точной навеске, т.е. получить растворы этой кислоты с приготовленным титром. Однако методики получения растворов в этом случае довольно сложны, поэтому, как правило, пользуются рабочими растворами , титр которых устанавливают по растворам стандартных веществ (исходных). В качестве стандартных веществ для определения титра кислот пользуются тетраборатом натрия (бура), безводным карбонатом натрия (сода), окисью ртути, иодатом калия и др.
ru.solverbook.com
СПОСОБ ПОЛУЧЕНИЯ ОСНОВНОГО ХЛОРИДА АЛЮМИНИЯ
Изобретение относится к способам получения основного хлорида алюминия, используемого преимущественно в качестве коагулирующего реагента в процессах водоочистки и водоподготовки.
Большинство существующих способов получения основного хлорида алюминия заключается в растворении металлического алюминия в соляной кислоте при заданном соотношении реагентов и концентрировании полученного раствора, обычно упариванием. Главным недостатком этих способов является использование дорогостоящего и дефицитного металлического алюминия. Более предпочтительно получение основного хлорида алюминия с использованием вместо металлического алюминия более дешевого гидроксида алюминия. Однако известные способы не позволяют обеспечить достаточно высокую основность получаемого хлорида алюминия, являются энергоемкими и многостадийными. Кроме того, эти способы связаны с образованием жидких или твердых отходов, что снижает их экологичность.
Известен способ получения основного хлорида алюминия (см. патент РФ 2237021, МПК7 C01F 7/60, C02F 1/52, 2004) из отходов электролитического травления алюминиевых изделий в среде хлорида натрия, содержащих 26-30% Al(OH)3, включающий растворение отходов в соляной кислоте при массовом соотношении Al(OH)
Данный способ характеризуется относительно низкой основностью получаемого хлорида алюминия, так как молярное отношение Al:Cl не превышает 0,44:1 при узком диапазоне основности (0,35-0,44:1). Способ отличается высокой энергоемкостью, поскольку растворение ведется при температуре кипения раствора в течение длительного времени, и многостадийностью. Все это снижает эффективность получения основного хлорида алюминия. Кроме того, с учетом неполноты извлечения алюминия образуются твердые отходы, требующие утилизации.
Известен также принятый в качестве прототипа способ получения основного хлорида алюминия (см. патент Украины 59047, МПК 7 C01F 7/56, 7/60, 2003), включающий смешение аморфного технического гидроксида алюминия с концентрированной (33%) соляной кислотой при молярном отношении гидроксида алюминия и соляной кислоты 1:2,0-3,3, нагревание полученной смеси до 90-100°C и выдержку при этой температуре в течение 4 часов при перемешивании. После отделения фильтрацией нерастворимых твердых примесей и непрореагировавшего гидроксида алюминия, масса которого составляет 10-25% от исходной массы гидроксида алюминия, фильтрат упаривают при температуре 80-140°C и остаточном давлении 1,33·103-2,0·103 Па с отгонкой воды и остаточной соляной кислоты. Получают хорошо растворимый в воде сухой основный хлорид алюминия состава Al(OH)3-nCln, где n=0,5-1,0, что соответствует молярному отношению Al:Cl, равному 1-2:1.
Известный способ характеризуется недостаточно высокой основностью получаемого хлорида алюминия, так как молярное отношение Al:Cl не превышает 2:1 и имеет относительно узкий диапазон основности (1-2:1). Способ является высокоэнергоемким и многостадийным. Все это снижает эффективность получения основного хлорида алюминия. Кроме того, с учетом образующихся твердых отходов и жидких отходов в виде конденсата разбавленной соляной кислоты, требующих утилизации, способ недостаточно экологичен.
Настоящее изобретение направлено на достижение технического результата, заключающегося в повышении эффективности получения основного хлорида алюминия за счет расширения диапазона основности в сторону более высоких ее значений и снижения энергоемкости способа при одновременном сокращении числа операций. Кроме того, техническим результатом является повышение экологичности способа.
Технический результат достигается тем, что в способе получения основного хлорида алюминия, включающем солянокислотную обработку активного гидроксида алюминия, согласно изобретению, используют активный гидроксид алюминия с удельным объемом пор не менее 0,2 см 3/г и средним диаметром пор не менее 2,5 нм, обработку гидроксида алюминия ведут газообразной соляной кислотой при массовом соотношении HCl:H2O в газовой фазе 1-15:1 до достижения молярного отношения Al:Cl, равного 1-4,5:1.
Технический результат достигается также тем, что используют газообразную соляную кислоту, полученную путем обработки хлорида натрия 90-94% серной кислотой.
Технический результат достигается и тем, что используют газообразную соляную кислоту, полученную путем продувки воздухом раствора 30-37% соляной кислоты.
Существенные признаки заявленного изобретения, определяющие объем правовой охраны и достаточные для получения вышеуказанного технического результата, выполняют функции и соотносятся с результатом следующим образом.
Использование активного гидроксида алюминия с удельным объемом пор не менее 0,2 см
При величине удельного объема пор активного гидроксида алюминия менее 0,2 см3/г поры недостаточно равномерно распределены по объему, что приводит к неполноте протекания химической реакции с образованием основного хлорида алюминия. При величине среднего диаметра пор менее 2,5 нм существенно затрудняется проникновение молекул газообразной соляной кислоты в поры гидроксида алюминия, что также приводит к неполноте химической реакции.
Обработка активного гидроксида алюминия, имеющего вышеуказанные характеристики, газообразной соляной кислотой, обладающей исключительно высокой реакционной способностью, позволяет в сочетании с высокой реакционной способностью активного гидроксида алюминия осуществить получение основного хлорида алюминия в условиях твердофазного процесса при температуре окружающей среды в одну стадию без образования жидких и твердых отходов.
Обработка гидроксида алюминия при массовом соотношении HCl:H2O в газовой фазе, равном 1-15:1, обеспечивает быстрое протекание химической реакции с образованием хлорида алюминия высокой основности. При массовом соотношении HCl:H2O менее 1:1, в силу высокого содержания паров воды в газовой фазе, существенно затрудняется проникновение молекул газообразной соляной кислоты в поры гидроксида алюминия, что препятствует протеканию химической реакции. При массовом соотношении HCl:H
Обработка активного гидроксида алюминия до достижения молярного отношения Al:Cl, равного 1-4,5:1, обеспечивает получение хлорида алюминия достаточно высокой основности при одновременном расширении ее диапазона в сторону более высоких значений. Обработка до молярного отношения Al:Cl менее 1:1 приводит к образованию хлорида алюминия низкой основности при неоправданном увеличении продолжительности процесса и повышении расхода газообразной соляной кислоты. Обработка до молярного отношения Al:Cl более 4,5:1 приводит к образованию основного хлорида алюминия в водонерастворимой форме.
Совокупность вышеуказанных признаков необходима и достаточна для достижения технического результата изобретения, заключающегося в расширении диапазона основности в сторону более высоких ее значений и снижении энергоемкости способа при одновременном сокращения числа операций. Все это повышает эффективность получения основного хлорида алюминия и экологичность способа.
В частных случаях осуществления изобретения предпочтительны следующие конкретные операции и режимные параметры.
Использование газообразной соляной кислоты, полученной путем обработки хлорида натрия 90-94% серной кислотой, предпочтительно с учетом того, что данный процесс получения газообразной соляной кислоты не требует применения дефицитных и дорогостоящих реагентов и специального оборудования, что способствует повышению эффективности способа.
Использование газообразной соляной кислоты, полученной путем продувки воздухом раствора 30-37% соляной кислоты, способствует снижению энергоемкости способа, поскольку по такому варианту осуществления способа кислотный реагент образуется самопроизвольно при температуре окружающей среды и не требует дополнительных энергетических затрат, а также соответствует требуемому массовому соотношению HCl:H
Вышеуказанные частные признаки изобретения позволяют осуществить способ в оптимальном режиме с точки зрения повышения эффективности получения основного хлорида алюминия и улучшения экологичности способа.
Сущность предлагаемого способа и достигаемые результаты более наглядно могут быть проиллюстрированы следующими примерами.
Пример 1. Берут 20 г порошкообразного активного гидроксида алюминия с удельным объемом пор 0,2 см3/г и средним диаметром пор 2,5 нм и помещают в лабораторный реактор кипящего слоя. В нижнюю часть реактора через газораспределительную решетку подают под давлением газообразную соляную кислоту при массовом соотношении HCl:H2O в газовой фазе 1:1. Газообразную соляную кислоту получают путем обработки хлорида натрия 90% серной кислотой. Обработку гидроксида алюминия ведут при температуре окружающей среды до достижения молярного отношения Al:Cl, равного 1:1. Получают 28,6 г основного хлорида алюминия в виде порошка, отвечающего химической формуле Al(OH)2Cl. Полученный продукт полностью растворяется в воде.
Пример 2. Берут 20 г порошкообразного активного гидроксида алюминия с удельным объемом пор 0,35 см3/г и средним диаметром пор 3 нм и помещают в лабораторный реактор кипящего слоя. В нижнюю часть реактора через газораспределительную решетку подают под давлением газообразную соляную кислоту при массовом соотношении HCl:H2O в газовой фазе 9:1. Газообразную соляную кислоту получают путем обработки хлорида натрия 94% серной кислотой. Обработку гидроксида алюминия ведут при температуре окружающей среды до достижения молярного отношения Al:Cl, равного 4:1. Получают 22,8 г основного хлорида алюминия в виде порошка, отвечающего химической формуле Al4(ОН)11Cl. Полученный продукт полностью растворяется в воде.
Пример 3. Берут 20 г порошкообразного активного гидроксида алюминия с удельным объемом пор 0,44 см3/г и средним диаметром пор 4,5 нм и помещают в лабораторный реактор кипящего слоя. В нижнюю часть реактора через газораспределительную решетку подают под давлением газообразную соляную кислоту при массовом соотношении HCl:H2O в газовой фазе 3:1. Газообразную соляную кислоту получают согласно Примеру 1. Обработку гидроксида алюминия ведут при температуре окружающей среды до достижения молярного отношения Al:Cl, равного 2:1. Получают 27,0 г основного хлорида алюминия в виде порошка, отвечающего химической формуле Al2(OH)5Cl. Полученный продукт полностью растворяется в воде.
Пример 4. Берут 20 г порошкообразного активного гидроксида алюминия с удельным объемом пор 0,52 см3/г и средним диаметром пор 5,5 нм и помещают в лабораторный реактор кипящего слоя. В нижнюю часть реактора через газораспределительную решетку подают под давлением газообразную соляную кислоту при массовом соотношении HCl:H2O в газовой фазе 4:1. Газообразную соляную кислоту получают путем продувки воздухом раствора 30% соляной кислоты. Обработку гидроксида алюминия ведут при температуре окружающей среды до достижения молярного отношения Al:Cl, равного 3:1. Получают 24 г основного хлорида алюминия в виде порошка, отвечающего химической формуле Al3(OH)8Cl. Полученный продукт полностью растворяется в воде.
Пример 5. Берут 20 г порошкообразного активного гидроксида алюминия с удельным объемом пор 0,62 см3/г и средним диаметром пор 6,5 нм и помещают в лабораторный реактор кипящего слоя. В нижнюю часть реактора через газораспределительную решетку подают под давлением газообразную соляную кислоту при массовом соотношении HCl:H2O в газовой фазе 15:1. Газообразную соляную кислоту получают путем продувки воздухом раствора 37% соляной кислоты. Обработку гидроксида алюминия ведут при температуре окружающей среды до достижения молярного отношения Al:Cl, равного 4,5:1. Получают 22,3 г основного хлорида алюминия в виде порошка, отвечающего химической формуле Al9(OH)25Cl2. Полученный продукт полностью растворяется в воде.
Из приведенных Примеров видно, что заявляемый способ позволяет получить в условиях твердофазного процесса основный хлорид алюминия с молярным отношением Al:Cl, равным 1-4,5:1, что соответствует более широкому диапазону основности по сравнению с прототипом (Al:Cl равно 1-2:1). При этом диапазон основности расширяется в сторону более высоких ее значений. Способ по изобретению является менее энергоемким, так как осуществляется без подогрева реагентов при температуре окружающей среды, и реализуется в одну стадию. Все это повышает эффективность получения основного хлорида алюминия. Кроме того, способ является более экологичным ввиду отсутствия жидких и твердых отходов, он относительно прост и может быть реализован с привлечением стандартного технологического оборудования.
edrid.ru
Как из хлорида Алюминия получить гидроксид алюминия
Вопрос задан 11.05.2018 в 22:16. Предмет Химия. Спрашивает Юркина Дарья.Ответы на вопрос
Отвечает Павлова Кира.
На вопрос «Как из хлорида Алюминия получить гидроксид алюминия» ответ был предоставлен пользователем Гость по предмету «Химия». Чтобы ознакомиться с ответом нажмите кнопку «Показать ответ»
Показать ответ
Последние заданные вопросы в категории Химия
Химия 18.11.2018 13:28 0 Крестинин Олег.Ответов: 1
Химия 18.11.2018 13:30 0 Хмарская Вика.Ответов: 1
Химия 18.11.2018 13:23 0 Лазерко Диана.Ответов: 1
Химия 18.11.2018 12:23 0 Кочнева Оксана.Ответов: 1
Химия 18.11.2018 12:29 0 Черникова Юля.Ответов: 1
Химия 18.11.2018 12:28 0 Казанцев Денис.Ответов: 1
Химия 18.11.2018 12:29 0 Васильев Никита.Ответов: 1
Химия 18.11.2018 12:29 0 Семенова Дарья.Ответов: 1
Химия 18.11.2018 12:29 0 Михайлова Милана.Ответов: 1
Химия 18.11.2018 12:30 0 Чертков Миша.Ответов: 1
uznavalka.pro
Способ получения гидроксида алюминия
Изобретение относится к способам получения активного гидроксида алюминия, пригодного для получения эффективного коагулянта — гидроксохлорида алюминия, а также катализаторов, осушителей и сорбентов. Способ включает смешение кристаллических солей алюминия и карбоната натрия в твердом виде при расходе карбоната натрия 4-6 моль на 1 моль Al2O3. В качестве соли алюминия берут его нитрат Al(NO3)3·9H2O или хлорид AlCl3·6H2O. Полученную реакционную массу выщелачивают водой при температуре не выше 50°C с образованием суспензии, из которой выделяют алюминийсодержащий осадок. Осадок промывают водой при температуре 60-80°C до величины pH промывной воды не более 7,5 и сушат. Технический результат — получение химически активного по отношению к соляной кислоте гидроксида алюминия, снижение количества жидких отходов, повышение экологичности способа. 3 з.п. ф-лы, 3 пр.
Изобретение относится к способам получения активного гидроксида алюминия, пригодного для получения эффективного коагулянта — гидроксохлорида алюминия, а также катализаторов, осушителей и сорбентов.
Большинство существующих способов получения активного гидроксида алюминия заключается в его осаждении из растворов алюмината натрия или из растворов кислых солей алюминия под действием кислотных (HCl, HNO3, CO2) или основных реагентов (NH3, NH4OH, NaOH, Na2CO3, (NH4)2CO3) соответственно. Главным недостатком этих способов является недостаточно высокая химическая активность получаемого гидроксида алюминия по отношению к соляной кислоте. Кроме того, эти способы характеризуются значительными материальными потоками, многооперационностью, трудностью отделения осадка гидроксида алюминия от раствора, а также связаны с образованием больших объемов сточных вод, что снижает их экологичность.
Известен способ получения гидроксида алюминия (см. пат. 2258035 РФ, МПК C01F 7/02, 2003), включающий обработку раствора основного сульфата алюминия AlOHSO4, содержащего 75 г/л Al2O3, в непрерывном режиме путем смешения с 25%-ным водным раствором аммиака NH4OH при pH 9,5-10,5 в течение 30-45 минут. Полученную суспензию фильтруют с отделением гидроксида алюминия, который подвергают автоклавной обработке в 5-7,5%-ном растворе аммиака при pH 10-11 и температуре 135-145°C в течение 1-2 часов. Полученный осадок гидроксида алюминия псевдобемитной структуры отфильтровывают, промывают химически обессоленной водой и сушат.
Основным недостатком данного способа является то, что получаемый гидроксид алюминия химически неактивней по отношению к соляной кислоте. Способ также характеризуется высокой энергоемкостью по причине повышенной влажности гидроксида алюминия и необходимостью использования автоклава. Кроме того, вследствие образования большого количества трудноутилизируемых разбавленных растворов сульфата аммония, способ является недостаточно экологичным.
Известен также принятый в качестве прототипа способ получения гидроксида алюминия (см. а.с. 852798 СССР, МПК3 C01F 7/34, 1977), включающий смешение в водном растворе кристаллических солей алюминия и бикарбоната аммония при их молярном соотношении 1:(3-7), перемешивание полученной смеси в течение 2 часов, выдерживание образовавшегося осадка под маточником 5-24 часа, отделение осадка фильтрацией со скоростью 100-102 л/(м2·ч), промывку его водой при 70-90°C и сушку.
Основным недостатком известного способа является недостаточно высокая химическая активность получаемого гидроксида алюминия по отношению к соляной кислоте. Кроме того, способ характеризуется длительностью выдерживания осадка под маточным раствором и низкой скоростью фильтрации вследствие образования сильнообводненного гидроксида алюминия. Следствием этого является наличие значительных объемов разбавленных растворов аммонийных солей, что снижает экологичность способа.
Настоящее изобретение направлено на достижение технического результата, заключающегося в получении химически активного по отношению к соляной кислоте гидроксида алюминия и в интенсификации способа. Кроме того, техническим результатом является снижение количества жидких отходов, что повышает экологичность способа.
Технический результат достигается тем, что в способе получения гидроксида алюминия, включающем смешение кристаллических солей алюминия и угольной кислоты, выделение алюминийсодержащего осадка, его промывку водой при повышенной температуре и сушку, согласно изобретению в качестве соли угольной кислоты используют карбонат натрия, смешение солей ведут в твердом виде при расходе карбоната натрия 4-6 моль на 1 моль Al2O3, полученную реакционную массу выщелачивают водой с образованием суспензии, из которой выделяют алюминийсодержащий осадок, а промывку осадка водой ведут до величины pH промывной воды не более 7,5.
Технический результат достигается также тем, что в качестве соли алюминия берут его нитрат Al(NO3)3·9H2O или хлорид AlCl3·6H2O.
Технический результат достигается также и тем, что выщелачивание реакционной массы ведут при температуре не выше 50°C.
На достижение технического результата направлено то, что промывку осадка ведут при температуре 60-80°C.
При смешении кристаллических солей алюминия и карбоната натрия согласно изобретению, протекают следующие химические реакции:
Возможность протекания этих реакций при смешении солей в твердом виде обусловлена наличием слабосвязанной воды в составе кристаллогидратов солей алюминия. Образующийся при этом гидроалюмокарбонат натрия NaAl(OH)2CO3 имеет специфическую волокнистую структуру в результате преимущественного роста кристаллов вдоль одного направления. В процессе водного выщелачивания реакционной массы, полученной при расходе карбоната натрия 4-6 моль на 1 моль Al2O3, гидролитического разложения гидроалюмокарбоната натрия не происходит вследствие наличия в растворе достаточного количества ионов натрия. При смешении твердых солей в отсутствие жидкой фазы гидроалюмокарбонат натрия формируется в малогидратированной форме и поэтому легко выделяется из суспензии фильтрованием. При промывке осадка водой происходит постепенное разложение гидроалюмокарбоната натрия с получением гидроксида алюминия в форме псевдобемита, который наследует структуру гидроалюмокарбоната натрия, что и предопределяет его высокую химическую активность по отношению к соляной кислоте. При величине pH промывной воды не более 7,5 достигается полное разложение гидроалюмокарбоната натрия до гидроксида алюминия.
Использование карбоната натрия в качестве соли угольной кислоты позволяет при условии смешения солей в твердом виде получить алюминийсодержащий осадок в виде гидроалюмокарбоната натрия, обладающего специфической волокнистой структурой, которую наследует гидроксид алюминия, что и обусловливает его высокую химическую активность по отношению к соляной кислоте. Кроме того, смешение солей в твердом виде позволяет интенсифицировать способ, так как в этом случае гидроалюмокарбонат натрия формируется в малогидратированной хорошо фильтруемой форме и дополнительной выдержки осадка под маточным раствором не требуется.
Расход карбоната натрия 4-6 моль на 1 моль Al2O3 позволяет обеспечить величину pH образующейся суспензии, наиболее благоприятную для формирования волокнистой структуры гидроалюмокарбоната натрия. При расходе карбоната натрия менее 4 моль на 1 моль Al2O3 часть алюминия при смешении реагентов превращается в аморфный гидроксид алюминия, что приводит к резкому снижению химической активности получаемого гидроксида алюминия по отношению к соляной кислоте. Увеличение расхода карбоната натрия более 6 моль на 1 моль Al2O3 является избыточным и приводит к неоправданному увеличению количества промывной воды.
Выщелачивание реакционной массы водой позволяет получить суспензию, твердая фаза которой представляет собой нерастворимый алюминийсодержащий осадок в виде гидроалюмокарбоната натрия, а жидкая фаза — раствор солей натрия.
Промывка алюминийсодержащего осадка водой до величины pH промывной воды не более 7,5 обусловлена тем, что при этом происходит полное разложение гидроалюмокарбоната натрия с образованием гидроксида алюминия, который также обладает хорошей фильтруемостью, что способствует снижению количества промывных вод. Величина pH промывной воды более 7,5 свидетельствует о неполноте разложения гидроалюмокарбоната натрия, что приводит к существенному снижению химической активности получаемого гидроксида алюминия по отношению к соляной кислоте.
Совокупность вышеуказанных признаков необходима и достаточна для достижения технического результата изобретения, заключающегося в получении химически активного по отношению к соляной кислоте гидроксида алюминия и в интенсификации способа за счет сокращения продолжительности операций при одновременном снижении количества жидких отходов.
В частных случаях осуществления изобретения предпочтительны следующие режимные параметры.
Использование в качестве соли алюминия нитрата алюминия Al(NO3)3·9H2O или хлорида алюминия AlCl3·6H2O обусловлено наличием в них кристаллизационной воды в количестве, необходимом для протекания реакции в соответствии с уравнениями (1) и (2) при условии смешения солей в твердом виде.
Проведение выщелачивания реакционной массы при температуре не выше 50°C гарантирует, наряду с наличием в растворе достаточного количества ионов натрия, предотвращение гидролитического разложения гидроалюмокарбоната натрия до гидроксида алюминия в процессе выщелачивания.
Промывка осадка при температуре 60-80°C способствует ускорению процесса разложения гидроалюмокарбоната натрия и минимизации количества промывной воды.
Вышеуказанные частные признаки изобретения позволяют осуществить способ в оптимальном режиме с точки зрения получения химически активного по отношению к соляной кислоте гидроксида алюминия, интенсификации способа и снижения количества жидких отходов.
Сущность предлагаемого способа и достигаемые результаты более наглядно могут быть проиллюстрированы следующими примерами.
Пример 1. 500 г Al(NO3)3·9H2O и 282,7 г кристаллического карбоната натрия Na2CO3 (расход карбоната натрия 4 моль на 1 моль Al2O3) смешивают в твердом виде в лопастном смесителе в течение 20 минут. Полученную реакционную массу весом 714,4 г выщелачивают 1500 мл воды при температуре 40°C в течение 15 минут. Образовавшуюся суспензию фильтруют на нутч-фильтре с выделением алюминийсодержащего осадка. Скорость фильтрации составляет 1340 л/(м2·ч). Из полученного осадка отбирают пробу массой 5 г, высушивают при 105°C до постоянной массы и анализируют методом рентгенофазового анализа РФА. По данным РФА основной фазой алюминийсодержащего осадка является гидроалюмокарбонат натрия NaAl(OH)2CO3. Алюминийсодержащий осадок промывают 5 раз порциями воды по 250 мл с температурой 60°C до величины pH 5-й порции промывной воды 7,1. Промытый алюминийсодержащий осадок сушат при 105°C до постоянной массы. Получают 88,7 г сухого осадка с содержанием Al2O3 74,1%. Влажность осадка составляет 77,6%. По данным РФА осадок представляет собой гидроксид алюминия в форме псевдобемита.
Для оценки химической активности по отношению к соляной кислоте берут навеску полученного гидроксида алюминия массой 5 г, помещают в эксикатор над 37% соляной кислотой и выдерживают в течение 30 минут. После этого навеску помещают в 100 мл воды с температурой 25°C, в которой она полностью растворяется, что свидетельствует о высокой химической активности полученного гидроксида алюминия по отношению к соляной кислоте.
Пример 2. 500 г Al(NO3)3·9H2O и 424,1 г кристаллического карбоната натрия Na2CO3 (расход карбоната натрия 6 моль на 1 моль Al2O3) смешивают в твердом виде в лопастном смесителе в течение 30 минут. Полученную реакционную массу весом 855,6 г выщелачивают 2200 мл воды при температуре 50°C в течение 30 минут. Образовавшуюся суспензию фильтруют на нутч-фильтре с выделением алюминийсодержащего осадка. Скорость фильтрации составляет 1280 л/(м2·ч). Из полученного осадка отбирают пробу массой 5 г, высушивают при 105°C до постоянной массы и анализируют методом рентгенофазового анализа РФА. По данным РФА основной фазой алюминийсодержащего осадка является гидроалюмокарбонат натрия NaAl(OH)2CO3. Алюминийсодержащий осадок промывают 7 раз порциями воды по 250 мл с температурой 80°C до величины pH 7-й порции промывной воды 7,5. Промытый алюминийсодержащий осадок сушат при 105°C до постоянной массы. Получают 83,1 г сухого осадка с содержанием Al2O3 79,2%. Влажность осадка составляет 72,8%. По данным РФА осадок представляет собой гидроксид алюминия в форме псевдобемита.
Для оценки химической активности по отношению к соляной кислоте берут навеску полученного гидроксида алюминия массой 5 г, помещают в эксикатор над 37% соляной кислотой и выдерживают в течение 30 минут. После этого навеску помещают в 100 мл воды с температурой 25°C, в которой она полностью растворяется, что свидетельствует о высокой химической активности полученного гидроксида алюминия по отношению к соляной кислоте.
Пример 3. 322 г AlO3-6H2O и 353,3 г кристаллического карбоната натрия Na2CO3 (расход карбоната натрия 5 моль на 1 моль Al2O3) смешивают в лопастном смесителе в течение 25 минут. Полученную реакционную массу весом 539,7 г выщелачивают 2000 мл воды при температуре 45°C в течение 20 минут. Образовавшуюся суспензию фильтруют на нутч-фильтре с выделением алюминийсодержащего осадка. Скорость фильтрации составляет 1310 л/(м2·ч). Из полученного осадка отбирают пробу массой 5 г, высушивают при 105°C до постоянной массы и анализируют методом рентгенофазового анализа РФА. По данным РФА основной фазой алюминийсодержащего осадка является гидроалюмокарбонат натрия NaAl(OH)2CO3. Алюминийсодержащий осадок промывают 6 раз порциями воды по 250 мл с температурой 70°C до величины pH 6-й порции промывной воды 7,3. Промытый алюминийсодержащий осадок сушат при 105°C до постоянной массы. Получают 86,3 г сухого осадка с содержанием Al2O3 76,4%. Влажность осадка составляет 74,1%. По данным РФА осадок представляет собой гидроксид алюминия в форме псевдобемита.
Для оценки химической активности по отношению к соляной кислоте берут навеску полученного гидроксида алюминия массой 5 г, помещают в эксикатор над 37% соляной кислотой и выдерживают в течение 30 минут. После этого навеску помещают в 100 мл воды с температурой 25°C, в которой она полностью растворяется, что свидетельствует о высокой химической активности полученного гидроксида алюминия по отношению к соляной кислоте.
Из приведенных Примеров видно, что заявляемый способ по сравнению с прототипом позволяет получить в условиях твердофазного процесса гидроксид алюминия, химически активный по отношению к соляной кислоте. Способ является менее длительным, так как скорость фильтрации возрастает в 12,5-13,4 раз при меньшей продолжительности предшествующих операций. Соответственно снижается количество жидких отходов, что повышает экологичность способа. Предлагаемый способ относительно прост и может быть реализован с привлечением стандартного технологического оборудования.
1. Способ получения гидроксида алюминия, включающий смешение кристаллических солей алюминия и угольной кислоты, выделение алюминийсодержащего осадка, его промывку водой при повышенной температуре и сушку, отличающийся тем, что в качестве соли угольной кислоты используют карбонат натрия, смешение солей ведут в твердом виде при расходе карбоната натрия 4-6 моль на 1 моль Al2O3, полученную реакционную массу выщелачивают водой с образованием суспензии, из которой выделяют алюминийсодержащий осадок, а промывку осадка водой ведут до величины pH промывной воды не более 7,5.
2. Способ по п. 1, отличающийся тем, что в качестве соли алюминия берут его нитрат Al(NO3)3·9H2O или хлорид AlCl3·6H2O.
3. Способ по п. 1, отличающийся тем, что выщелачивание реакционной массы ведут при температуре не выше 50°C.
4. Способ по п. 1, отличающийся тем, что промывку осадка ведут при температуре 60-80°C.
www.findpatent.ru
Химик.ПРО — Хлорид алюминия | Решение задач по химии бесплатно
Написать ступенчатые уравнения реакций гидролиза соли хлорида алюминия (AlCl3).
Решение задачи
Напомню, что гидролиз солей – это реакция обменного взаимодействия соли с водой.
Соль хлорид алюминия (AlCl3)образована сильной кислотой – соляной кислотой (HCl) и слабым основанием – гидроксидом алюминия (Al(OH)3) , следовательно, гидролиз идет по катиону и преимущественно протекает по первой ступени.
Так, как катион трехзаряден, гидролиз протекает в три стадии (ступени).
Первая ступень гидролиза хлорида алюминия:
Вторая ступень гидролиза хлорида алюминия (гидролиз протекает в меньшей степени):
Третья ступень гидролиза хлорида алюминия (гидролиз практически не протекает):
Похожие задачи по химии
himik.pro